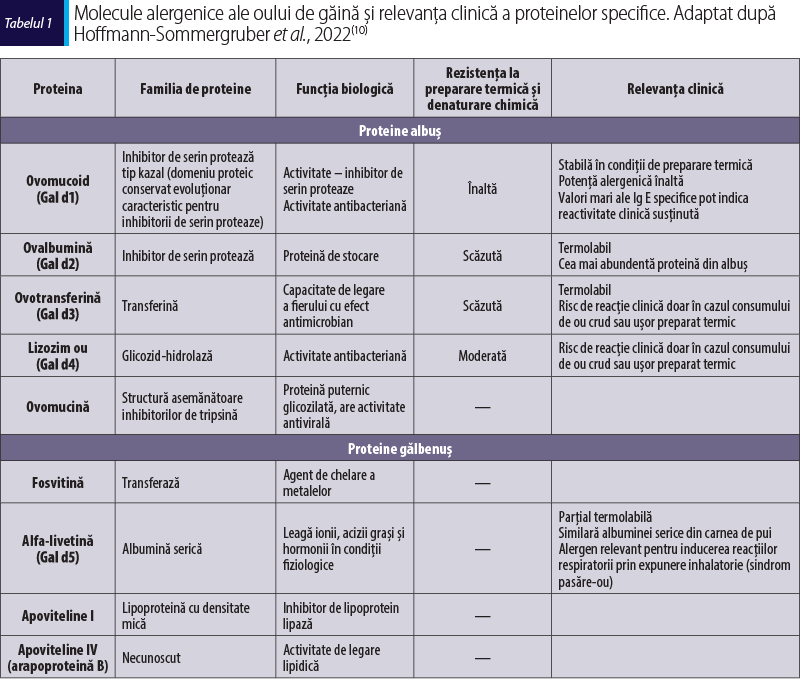
Egg allergy is one of the most common food allergies in children. Common symptoms of egg protein-induced allergy frequently involve the skin as well as the gut, and in more severe cases lead to anaphylaxis. Non-IgE-mediated symptoms such as eosinophilic diseases of the digestive tract or egg-induced enterocolitis may also be encountered. Sensitization to egg white proteins can be encountered in young children in the absence of clinical symptoms. The egg allergy diagnosis is based on the suggestive clinical history, positive skin and/or serological tests and possibly the egg protein challenge test, the gold standard for confirming the diagnosis. Ovomucoid is identified as a major allergen contained in the egg white, and its identification allows to improve the diagnosis, to identify the patient who can tolerate the highly prepared thermally prepared egg, the patient with the risk of persistent egg allergy and with the risk of a severe reaction. Spontaneous remission and development of egg tolerance are common and occur in 60-75% of children before adolescence; however, the burden of disease is significant during childhood, making the early and accurate diagnosis a necessity.
Alergia la ou. Diagnostic în alergia de tip imediat şi tardiv
Egg allergy. Diagnosis in immediate and delayed type allergy
First published: 19 decembrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.6.4.2022.7402
Abstract
Rezumat
Alergia la ouă este una dintre cele mai frecvente alergii alimentare la copii. Simptomele comune ale alergiei induse de proteinele din oul de găină implică frecvent pielea, precum şi intestinul şi, în cazuri mai severe, duc la anafilaxie. Simptomele non-IgE-mediate, cum ar fi bolile eozinofilice de tract digestiv sau enterocolita indusă de ouă, pot fi de asemenea întâlnite. Sensibilizarea la proteinele albuşului poate fi întâlnită la copiii mici în absenţa simptomelor clinice. Diagnosticul alergiei la ou are la bază istoricul clinic sugestiv, testele cutanate şi/sau serologice pozitive şi, eventual, testul de provocare la proteinele oului, standardul de aur pentru confirmarea diagnosticului. Ovomucoidul este identificat drept alergen major conţinut în albuş, iar identificarea lui permite îmbunătăţirea diagnosticului, identificarea pacientului care poate tolera oul înalt preparat termic, a pacientului cu risc de persistenţă a alergiei la ou şi cu risc de reacţie severă. Remisiunea spontană şi dezvoltarea toleranţei la ou sunt frecvente şi apar la 60-75% dintre copii înainte de adolescenţă; cu toate acestea, povara bolii este importantă în timpul copilăriei, ceea ce face ca diagnosticul precoce şi precis să fie o necesitate.
Introducere
Conform definiţiei EAACI, alergia la alimente este o reacţie adversă cu mecanisme imunologice mediate de anticorpi specifici de tip imunoglobulină E (reacţii IgE-mediate), mediate celular (reacţii non-IgE-mediate) sau mixte, mediate celular şi umoral (reacţii IgE-mediate şi non-IgE-mediate)(1).
Alergia la oul de găină este o reacţie adversă cu un mecanism imunologic subiacent indusă de ingestia sau contactul cu oul şi proteinele acestuia, cel mai frecvent induse de proteine din albuş, respectiv ovalbumină (Gal d2) şi/sau ovomucoid (Gal d1)(2). Prin conţinutul mare de proteine, oul de găină reprezintă unul dintre alimentele de bază care intră în dietă încă din primul an de viaţă, ceea ce face ca hipersensibilitatea la proteinele oului de găină să fie o tulburare larg răspândită, afectând 1-2% dintre copiii din întreaga lume. Este a doua cea mai frecventă alergie alimentară la copii, după alergia la laptele de vacă(3).
Identificarea sensibilizării la proteinele de ou poate avea semnificaţii clinice şi prognostice importante(4).
Manifestările clinice ale unui pacient sensibilizat la proteinele oului de găină pot îmbrăca tablou imediat sau tardiv, de severitate variabilă, până la anafilaxie sau forme severe tardive de tipul sindromului de enterocolită indus de proteine alimentare.
Sensibilizarea la albuş, adesea identificată la copiii cu dermatită atopică, este considerată factor de risc pentru dezvoltarea sensibilizării la arahide. De asemenea, sensibilizarea la ou în primii ani de viaţă, în special în asociere cu dermatita atopică, este puternic corelată cu dezvoltarea mai târziu a sensibilizării la alergene aeropurtate (Benhamou). Prezenţa alergiei la proteinele din oul de găină a ridicat semne de întrebare legate de siguranţa administrării vaccinurilor care conţin proteine de ou (de exemplu, vaccinul antigripal, vaccinul ROR). Recomandările EAACI actuale subliniază lipsa riscurilor pentru copilul alergic la ou şi posibilitatea de vaccinare în condiţii standard pentru vaccinul ROR care conţine urme de ovalbumină, propunând utilizarea de primă intenţie a formelor de vaccin antigripal cu doză mică de proteine de ou în componenţă şi administrare în condiţii standard pentru pacientul cu istoric de reacţie alergică nonanafilactică şi administrarea în doză unică a aceleiaşi forme de vaccin antigripal, dar sub supraveghere medicală, cu posibilitate de intervenţie rapidă şi supraveghere minimum o oră pentru pacientul cu istoric de anafilaxie ameninţătoare de viaţă indusă de proteinele oului de găină(5).
Aşadar, mai multe argumente clinice şi de prognostic fac necesară evaluarea pacientului alergic la proteinele oului de găină. Ne propunem o trecere în revistă a recomandărilor actuale de diagnostic al alergiei IgE-mediate şi non-IgE mediate la proteinele oului de găină.
Hipersensibilitatea IgE-mediată
Majoritatea reacţiilor induse de proteinele din ou sunt reacţii de hipersensibilitate de tip I (reacţii IgE-mediate), acestea numărându-se printre cele mai întâlnite alergii alimentare în populaţia pediatrică(2,6,7).
Este unanim acceptat că sensibilizarea la alimente poate apărea prin expunerea la proteine alimentare pe cale digestivă sau cutanată, iar pentru cazurile în care o reacţie alergică este manifestă chiar după prima ingestie a unui aliment, se presupune că sensibilizarea apare prin expunere la proteine alimentare pe calea laptelui matern sau chiar transplacentar(4). În plus, astmul profesional indus de proteinele oului inhalate, urmat de pierderea toleranţei imunologice la oul anterior consumat, sugerează şi calea inhalatorie drept cale de sensibilizare primară la proteinele oului de pasăre(4).
Organismul uman beneficiază de o serie de bariere fiziologice care asigură răspunsul optim la întâlnirea cu un antigen. La nivelul tubului digestiv există două bariere:
Bariera nonimunologică – acidul gastric, enzime pancreatice şi intestinale, mucusul, membrana de microvili, peristaltismul intestinal – condiţionează cantitatea şi calitatea antigenelor care ajung la nivelul lumenului intestinal. Majoritatea proteinelor alimentare sunt enzimatic modificate în tubul digestiv până la nivel de aminoacizi, 2% din proteinele ingerate ajungând sub formă de peptide sau alergene alimentare stabile faţă de digestie, în contact cu componentele sistemului imunitar digestiv.
Bariera imunologică – imunoglobuline, limfocite, macrofage, plăci Peyer, IgA secretor intestinal (gut-associated lymphoid tissues – GALT) şi din laptele matern – răspunsul imun la nivelul mucoasei gastrointestinale este caracterizat de echilibrul dintre mecanismele de apărare induse de recunoaşterea antigenelor alimentare non-self şi răspunsul imun reglator care ajută la instalarea răspunsului imun de tip tolerant(2).
Alterarea mecanismelor reglatoare alterează inducerea toleranţei şi duce la instalarea alergiei la alimente.
Etapa de sensibilizare implică preluarea antigenelor alimentare de către celule specializate ale tractului digestiv şi transferul lor către celulele prezentatoare de antigen (în special celule dendritice), care, prin dialogul cu limfocitele T helper şi limfocitele B, în contextul unui dezechilibru al răspunsului imun, vor induce polarizarea către populaţie de limfocite de tip T helper 2 care secretă citokine de tip interleukina 5 (IL-5) cu rol major în activarea, maturarea şi migrarea eozinofilelor, IL-4, IL-13 – citokine care facilitează sinteza de IgE specifice pentru alergenul alimentar prelucrat. Anticorpii de tip IgE specifici se vor lega atât de receptorii cu mare afinitate FcεRI (de la nivelul mastocitelor şi bazofilelor), cât şi de cei cu afinitate mică FcεRII (localizaţi pe macrofage, monocite, limfocite şi trombocite).
În etapa efectoare, proteinele alergenice din structura oului care străbat bariera mucoasă se vor lega la IgE specifice de pe suprafaţa mastocitelor şi bazofilelor, inducând degranularea celulelor, cu eliberarea mediatorilor proinflamatori (histamină, chemokine, citokine). Aceştia sunt responsabili de apariţia manifestărilor clinice imediate caracteristice: strănut, prurit, rash cutanat, bronhoconstricţie şi chiar anafilaxie. O etapă întârziată a reacţiei poate apărea în decurs de 10 ore de la expunerea la alergen şi este datorată chemokinelor şi leucotrienelor eliberate în etapa anterioară care recrutează în continuare limfocite Th2, bazofile şi eozinofile şi perpetuează răspunsul inflamator de tip alergic(2,8).
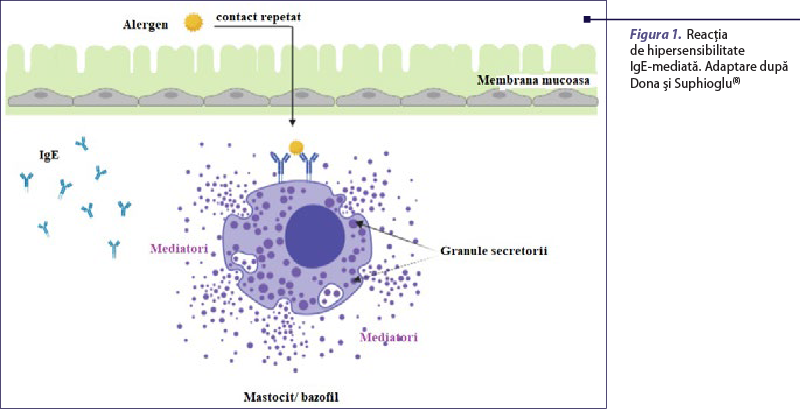
Manifestări clinice
În reacţiile IgE-mediate, simptomele apar în decurs de două ore de la expunerea alergenică, cel mai adesea în primele 30 de minute. De regulă, rezoluţia simptomatologiei (spontană sau prin tratament medicamentos) se face în mai puţin de 12 ore(7). Sensibilizarea la alimente la sugar este frecvent tranzitorie, nivelurile reduse de IgE specifice pentru proteine de ou putând să apară fără să fie însoţite de simptome clinice(4). Studiile efectuate la loturi de pacienţi cu reacţie de hipersensibilitate imediată au demonstrat că cele mai frecvente simptome întâlnite sunt cele cutanate (până la 90%), fiind urmate de cele gastrointestinale (până la 60%) şi respiratorii (până la 40%)(2,7). Reacţiile cutanate sunt reprezentate de eritem, prurit, urticarie, angioedem sau o combinaţie a celor enumerate anterior. De asemenea, în anumite cazuri poate fi prezentă hiperemia conjunctivală. Manifestările digestive includ greaţa, vărsăturile, durerile abdominale colicative şi refluxul apărut la o oră după masă.
Refuzul alimentar este un simptom particular, întâlnit în tabloul clinic al copilului mic cu alergii alimentare şi poate să fie manifestare izolată generată de expunerea copilului la o cantitate insuficientă de alergeni pentru a declanşa o reacţie clinică evidentă, contribuind la amânarea diagnosticului.
Afectarea respiratorie (disfonia, dispneea, tusea, stridorul, wheezingul) este rar întâlnită, dar, când este prezentă, indică o reacţie severă. Cu toate că, de cele mai multe ori, tabloul clinic este reprezentat strict de o reacţie cutanată, reacţiile de hipersensibilitate induse de proteinele din ou pot duce la apariţia anafilaxiei în 7% din cazuri(2,9).
Reacţiile alergice induse de proteinele din ou sunt asociate cu introducerea lui în dieta copilului, de cele mai multe ori acestea apărând după consumul oului întreg, deşi în prealabil copilul a tolerat consumul de gălbenuş(2). Severitatea reacţiei este direct proporţională cu doza de proteine ingerată şi cu gradul de preparare termică, astfel că oul din componenţa prăjiturilor poate induce cel mult o reacţie cutanată, pe când ingestia de ou crud sau insuficient preparat termic determină reacţii mai severe(9). Copiii cu dermatită atopică necesită o atenţie deosebită, având în vedere că de multe ori aceştia au teste cutanate prick sau IgE specifice pozitive pentru proteinele din ou, cu toate că nu au avut o reacţie în antecedente. În aceste cazuri, cel mai adesea oul nu a fost introdus în dieta copilului, testele pozitive demonstrând doar sensibilizarea la proteinele din ou. Dacă oul este prezent în dieta copilului, fiind identificat ca posibil inductor al unei reacţii alergice, primul pas diagnostic este o dietă de excludere care poate să ducă la ameliorarea leziunilor cutanate(2,9).
Diagnosticul reacţiilor IgE-mediate induse de proteinele oului de găină
Un istoric clinic sugestiv pentru o reacţie alergică poate include o paletă largă de simptome cutanate (urticarie, angioedem, eczeme), gastrointestinale (vărsături, dureri abdominale, diaree, constipaţie), respiratorii (rinoree, tuse, wheezing, dispnee), cardiovasculare (colaps în cazul şocului anafilactic) sau falimentul creşterii la copil. O atenţie particulară trebuie acordată posibilităţii de sensibilizare şi inducere a simptomelor prin expunere pe cale inhalatorie, de sensibilizare la ou secundară sensibilizării la alergene de pasăre (bird-egg syndrome) prin reactivitate încrucişată cu albumina din gălbenuş, dar şi cazurilor de anafilaxie indusă alimentar, dependentă de efort, care pot avea ca factor declanşator proteinele din ou. Un istoric detaliat va ajuta la stabilirea probabilităţii ca mecanismul implicat să fie unul IgE-mediat sau non-IgE-mediat. Evaluarea clinică include la copil examinarea cu atenţie a statusului nutriţional şi de creştere staturo-ponderală, precum şi asocierea cu alte comorbidităţi alergice: dermatita atopică, rinita alergică, astmul(1). Adăugarea testelor in vivo şi in vitro creşte sensibilitatea diagnosticului, iar testele de provocare sunt considerate standardul de aur(9). Recomandările EAACI pentru diagnosticul alergiilor la alimente ghidează paşii de evaluare indiferent de tipul de aliment incriminat în declanşarea unei alergii alimentare(1).
Istoricul clinic al pacientului
-
Istoricul detaliat este esenţial pentru diagnostic.
-
Date importante sunt: alergenul declanşator, simptomele, intervalul de timp pană la declanşarea simptomelor, cronicitatea, severitatea şi reproductibilitatea simptomelor, factorii de risc şi cofactorii asociaţi – istoricul familial, asocierea altor patologii.
Determinarea sensibilizării la alimente
-
Când sunt disponibile, se recomandă utilizarea testelor şi procedurilor standardizate.
-
Sensibilizarea IgE nu este întotdeauna corelată cu reactivitatea clinică, de aceea testarea pentru alergii alimentare trebuie să fie ghidată de istoricul clinic.
-
Testul de elecţie poate să fie testul cutanat prick sau determinarea IgE specifice, depinzând de disponibilitatea locală şi de contraindicaţiile relative şi absolute pentru testarea cutanată prick.
-
Testele negative în prezenţa unui istoric sugestiv de reacţie alergică trebuie interpretate cu precauţie, ţinând cont că în reacţiile non-IgE-mediate este de aşteptat să fie negative.
-
Când testele cutanate şi determinarea de IgE specifice sunt neconcludente, componentele moleculare pot aduce informaţie diagnostică suplimentară.
-
Dacă testele cutanate şi cele serologice nu sunt înalt predictive, atunci este necesar un test de provocare orală.
-
Determinarea IgE totale este de folos mai ales la pacientul cu dermatită atopică severă, caz în care identificarea IgE specifice pozitive pentru alimente în prezenţa unor titruri înalte ale IgE totale poate reprezenta sensibilizări asimptomatice.
Dieta de eliminare în scop diagnostic
-
Determinarea alimentului care trebuie exclus din dietă trebuie să se bazeze pe istoric de dietă, istoric clinic şi teste alergologice (teste cutanate şi/sau IgE specifice serice).
-
Pentru fiecare aliment exclus trebuie monitorizat cu atenţie rezultatul pentru 2-4 săptămâni de excludere.
-
Dacă dieta de eliminare conduce la ameliorarea semnificativă a simptomelor, aceasta trebuie continuată până când se efectuează un test de provocare.
-
Dacă dieta de eliminare nu conduce la ameliorarea semnificativă a simptomelor, alergia la alimentul eliminat este foarte improbabilă.
Testul de provocare orală (TPO)
-
TPO, în mod particular testul de provocare dublu-orb placebo-controlat (TPDOPC), este standardul de aur în investigarea alergiilor la alimente IgE-mediate şi non-IgE-mediate.
-
TPO trebuie folosit pentru a demonstra alergia sau toleranţa şi pentru a facilita astfel includerea în dietă sau evitarea corespunzătoare a unui alergen alimentar.
-
TPDOPC ar trebui efectuat când simptomele sunt subiective, atipice, întârziate, când pacienţii sau aparţinătorii sunt anxioşi, ori în scop de cercetare.
-
Un TPDOPC negativ trebuie să se încheie cu ingestia cunoscută într-o cantitate potrivită pentru vârstă a alimentului cercetat, pentru a confirma toleranţa orală.
-
TPO trebuie efectuate în unităţi de specialitate cu suport de urgenţă imediat disponibil; dacă există un risc moderat-înalt pentru o reacţie severă, suportul de tip terapie intensivă trebuie să fie imediat disponibil.
Diagnosticul esofagitei eozinofilice (EoE)
-
Fiecare pacient cu EoE trebuie să fie investigat din punct de vedere alergologic.
-
Diagnosticul EoE se stabileşte prin endoscopie digestivă superioară cu 2-4 biopsii din esofagul proximal şi distal: se recomandă ca biopsiile să fie efectuate când pacientul a fost tratat 4-6 săptămâni cu inhibitori de pompă de protoni pentru a exclude eozinofilia esofagiană cauzată de refluxul gastroesofagian.
-
Utilitatea clinică şi histologică a determinării IgE specifice şi a testelor cutanate prick şi pentru atopie (atopy patch test) necesită studii suplimentare.
Teste neconvenţionale, inclusiv determinarea de IgG specifice
Nu există teste neconvenţionale care pot fi recomandate ca metodă substitutivă sau complementară pentru diagnosticul alergiei la alimente, iar utilizarea lor trebuie descurajată.
Dacă ne raportăm la publicaţii dedicate alergiei la oul de găină, identificăm particularităţi de abordare diagnostică. Astfel, pentru evidenţierea istoricului sugestiv pentru o reacţie de hipersensibilitate este obligatorie o anamneză amănunţită. În primul rând, trebuie să se obţină detalii concise despre alimentaţia copilului:
-
Vârsta la care au fost introduse albuşul/gălbenuşul sau oul întreg.
-
Vârsta la care a avut prima reacţie (precizând ce componentă a oului a fost implicată în reacţie şi dacă era primul contact cu alimentul).
-
Dacă tolerează sau nu oul în diferite stadii de preparare termică (gătit, crud, omletă) şi toleranţa la acestea ulterior reacţiei descrise.
-
Cantitatea de proteine la care a fost expus, deoarece reprezintă un index al severităţii.
-
Calea de expunere – de regulă, simptomele apar după ingestia de ou sau preparate care conţin proteine din ou, dar pot apărea şi după contactul cutanat (direct sau indirect) cu proteinele alergenice (îmbrăţişări, joaca cu alţi copii, expunerea la particule volatile).
-
Ulterior, anamneza va fi îndreptată către procurarea informaţiilor cu privire la simptome:
-
Descrierea simptomelor şi a timpului de latenţă dintre expunerea la alergen şi debutul manifestărilor clinice.
-
Tratamentul necesar şi timpul de remitere a simptomatologiei, caracteristici care arată în mod indirect severitatea reacţiei. Persistenţa simptomelor mai mult de 12 ore sau agravarea lor ulterioară impun probleme de diagnostic diferenţial.
-
Numărul de reacţii şi descrierea lor – mai multe episoade care sunt corelate în mod clar cu consumul de ou reprezintă cea mai puternică atestare diagnostică.
-
Diagnosticul de alergie la ou ar trebui reevaluat periodic, întrucât sensibilizarea este de cele mai multe ori temporară(2,7).
Următoarea etapă în evaluarea reacţiilor imediate este testarea cutanată prick. Aceasta se poate realiza cu ajutorul extractelor standardizate de ou întreg, de albuş sau de gălbenuş. Extractele care conţin doar alergenele majore (ovomucoid, ovalbumină) nu sunt disponibile şi nu sunt utilizate în evaluarea de rutină(9). Suspiciunea clinică este un criteriu obligatoriu, deoarece testul are o valoare predictivă pozitivă scăzută când este folosit pentru screening. Valoarea predictivă negativă este înaltă (86-91%), astfel încât un test cutanat negativ exclude o posibilă alergie la proteinele din ou(2,7,9). Testul este considerat pozitiv când papula este ≥3 mm, diametrul acesteia nefiind corelat cu severitatea clinică(2,10). Un studiu sistematic a demonstrat că alergia la oul gătit este foarte probabilă când în urma testării cutanate prick se obţine un diametru mai mare de 5 mm la copiii sub 2 ani şi de peste 11 mm la copiii de cel puţin 2 ani. În privinţa alergiei la oul crud valorile sunt uşor modificate: diametrul papulei să fie mai mare de 4 mm la cei sub 2 ani şi în cazul celor de cel puţin 2 ani diametrul să fie de cel puţin 10 mm(10). Utilizarea oului crud pentru testarea cutanată prick în prick nu oferă informaţii suplimentare, având în vedere sensibilitatea mare a extractelor comerciale (73-100%; cu o specificitate de 53-71%), deşi poate fi luată în considerare când suspiciunea clinică este mare, în ciuda rezultatelor negative la testarea cu extracte(2,7).
Referitor la testele in vitro, determinarea nivelului de IgE specifice, precum şi testul de activare a bazofilelor (BAT) sunt două instrumente utile pentru susţinerea diagnosticului, mai ales când testarea cutanată nu este disponibilă(11). Determinare IgE specifice la albuş este cea mai precisă, deoarece atestă sensibilizarea la doi dintre alergenii majori: ovomucoidul şi ovalbumina(10). Un rezultat negativ are o valoare predictivă negativă mare, dar nu exclude în totalitate posibilitatea unei reacţii alergice(12,7). În schimb, valoarea predictivă pozitivă diferă în funcţie de o serie de factori, cum ar fi prevalenţa bolii în populaţia studiată şi coexistenţa altor patologii atopice (în special dermatita atopică)(2,7). Diferenţele dintre centre nu au permis stabilirea unor valori‑prag universal acceptate, cu toate că există o relaţie dovedită între nivelul IgE specifice şi rezultatul testului de provocare. Calvani et al. sugerează că alergia la oul crud este foarte probabilă când IgE specifice sunt ≥1,7 kU/l pentru copiii sub 2 ani şi ≥7,3 kU/l pentru cei de 2 ani şi peste(13). Pentru copiii cu reacţie moderat-severă la ou este utilă dozarea IgE specifice la arahide, pentru a oferi sfaturile optime de profilaxie a alergiei la arahide în special în zonele geografice unde acestea reprezintă o problemă(9).
Principalul avantaj al testului de activare a bazofilelor (BAT) faţă de cele anterior prezentate este specificitatea mare, un BAT pozitiv susţinând diagnosticul. Prin intermediul acestei determinări se pot nuanţa diferite fenotipuri, observându-se că pacienţii cu reacţie la oul gătit prezintă un procentaj mai mare de bazofile activate după stimularea cu proteinele din ou (la concentraţii de 10 şi 100 ng/ml) faţă de cei care tolerează oul gătit. Conform Santos et al., valorile prag ale BAT sunt de 5% CD63; >1,6 CD203c (alergia la ou crud) şi >1,7 CD203c (alergia la ou preparat termic)(11,14).
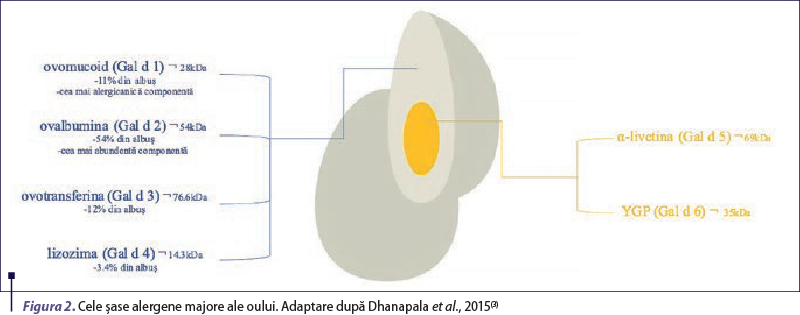
Diagnosticul molecular este utilizat din ce în ce mai des, are o specificitate mare (aprox. 95%) şi permite diferenţierea concretă dintre sensibilizarea şi alergia la proteinele din ou(10,12). Componentele moleculare ale albuşului sunt ovomucoidul (Gal d1), ovalbumina (Gal d2), ovotransferina (Gal d3), lizozimul (Gal d4) şi livetina (Gal d5). Rolul definitoriu al acestei investigaţii este de a distinge alergiile tranzitorii de cele permanente, permiţând totodată un management mai precis. O valoare pozitivă a IgE specifice la ovomucoid este marker al alergiei persistente, iar un nivel de ≥11 kU/L se corelează cu un risc înalt de a reacţiona la oul crud, dar şi la cel preparat termic. Pentru identificarea pacienţilor cu risc crescut de anafilaxie este esenţial să nu se omită nivelul Gal d1, deoarece acesta are o valoare predictivă pozitivă şi o specificitate mult mai mari faţă de determinarea IgE specifice la albuş. Dovezile actuale sugerează că alergenele moleculare nu sunt utilizate de rutină în diagnosticul alergiei la copii, dar pot reprezenta un instrument util în stabilirea dobândirii toleranţei la vârsta adultă (instalarea toleranţei fiind corelată cu scăderea nivelului IgE specifice la albuş şi la Gal d1)(9,10).
Reactivitatea cutanată la proteine din ouă de păsări diferite de oul de găină (în special de prepeliţă şi de raţă) este frecventă la copiii cu alergie la ouă de găină şi de aceea, este în general acceptat că aceia care evită oul de găină ar trebui să evite şi ouăle de la alte specii de păsări, precum raţa, gâsca şi prepeliţa. Există cazuri de reacţii la ouă de prepeliţă, raţă şi gâscă la cei care nu sunt alergici la ouăle de găină(9).
Testul de provocare orală dublu‑orb placebo‑controlat rămâne „standardul de aur” în managementul reacţiilor de hipersensibilitate, fiind recomandabil în cazul celor cu suspiciune de alergie la care este necesară confirmarea alergiei sau validarea dobândirii toleranţei imunologice. În vederea evaluării toleranţei, provocarea poate fi realizată dacă au trecut cel puţin şase luni de la ultimul episod clinic (pentru copiii sub 2 ani) sau cel puţin un an pentru cei de peste 2 ani. În cazul copiilor sensibilizaţi la proteinele din ou, fără expunere la aliment, se recomandă un test de provocare anterior introducerii oului în dietă. Existenţa unei reacţii recente (în ultimele 3-6 luni) corelată cu teste cutanate/serologice pozitive reprezintă o contraindicaţie(2,7). Anafilaxia severă nu este o contraindicaţie absolută a testului de provocare, dar necesită o supraveghere riguroasă mai ales în intervalul de timp în care s-a produs reacţia iniţială. În anumite cazuri selecţionate, se poate opta pentru iniţierea testului în mediu spitalicesc sau pentru introducerea oului la domiciliu (tabelul 2). Creşterea dozei se face într-un interval de timp mai scurt (câteva minute), dacă testul are loc într-un spital versus la domiciliu, unde creşterea este progresivă de la o zi la alta. De asemenea, doza iniţială din cursul provocării efectuate în spital este considerabil mai mare faţă de cea propusă pentru introducerea la domiciliu. Astfel, în cazul în care apar manifestări clinice, acestea sunt cel mai probabil uşoare, fiind induse de o cantitate mică de proteine. Pentru copiii cu sensibilizare la proteinele din ou care nu au atestată o reacţie alergică în antecedente, ghidul britanic de diagnostic şi management al alergiei la ou recomandă introducerea oului gătit în dietă la domiciliu. Dacă ulterior introducerii copilul dezvoltă simptome, atunci cazul ar trebui abordat ca o alergie la proteinele din ou(9).
De regulă, pentru testul de provocare se utilizează albuş, cu excepţia situaţiei în care se suspectează o reacţie la gălbenuş, caz în care se testează componentele în zile separate, începându-se cu gălbenuşul. Albuşul va fi consumat iniţial sub forma înalt preparată termic şi, dacă va fi tolerat, se va trece la etapa de albuş pasteurizat sau crud (tabelul 3). Doza de la care se începe va fi particularizată, putându-se ajunge până la o doză iniţială de maximum 100 mg. Dozele se administrează fracţionat, la un interval de 30-60 de minute, cu posibile variaţii în funcţie de timpul de latenţă cunoscut din istoricul pacientului. Se recomandă ca, după ultima doză, supravegherea să fie de minimum două ore. Pentru a certifica toleranţa, doza totală administrată trebuie să fie echivalentă cu un ou întreg (crud sau gătit).
La sugari şi la pacienţii cu manifestări obiective se poate opta, din motive practice, pentru un test de provocare deschis. Pentru cei cu simptome ambigue sau dificil de evaluat (de exemplu, durerea abdominală) este folosit testul simplu sau dublu-orb(2,7).
Nu există o abordare unică a dozelor şi intervalului de administrare pentru TPO la alimente. Cantităţile administrate şi intervalul dintre doze trebuie ajustate pentru a se potrivi cu istoricul pacientului (de exemplu, dacă sunt necesare zile de administrare pentru a provoca simptome) sau cu îngrijorările cu privire la sensibilitatea crescută (de exemplu, începând cu dozele minime distanţate pe perioade mai lungi de observaţie). De exemplu, un copil cu antecedente de dermatită atopică care se exacerbează de-a lungul zilelor în care a consumat ou, care are teste IgE specifice pozitive pentru ou şi care a evitat proteinele de ou timp de un an, poate avea o reacţie alergică imediată în ziua efectuării TPO.
Abordarea general recomandată este de a selecta un regim care este puţin probabil să aibă ca rezultat o reacţie imediată severă, prin creşterea precaută şi treptată a cantităţii ingerate (cu doza cumulativă ţintă a unei porţii de dimensiunea unei mese), luând în considerare şi constrângerile de timp.
Pentru pacienţii cu reacţii alimentare anterioare care au apărut imediat după ingerare, dozele sunt, în general, administrate la intervale de 15 până la 30 de minute, timp de aproximativ 90 până la 120 de minute, urmate de o porţie mai mare de alimente, de dimensiunea unei mese, câteva ore mai târziu.
Academia Europeană de Alergologie şi Imunologie Clinică a propus doze iniţiale după cum urmează (indicate ca greutatea proteinei sau volumul lichidului): arahide 0,1 mg, lapte 0,1 ml, ou 1 mg, cod 5 mg, grâu 100 mg, soia 1 mg, creveţi 5 mg, alun 0,1 mg. Un alt raport de consens a sugerat să se înceapă cu 3 mg de proteine alimentare(15).

Hipersensibilitatea non-IgE-mediată
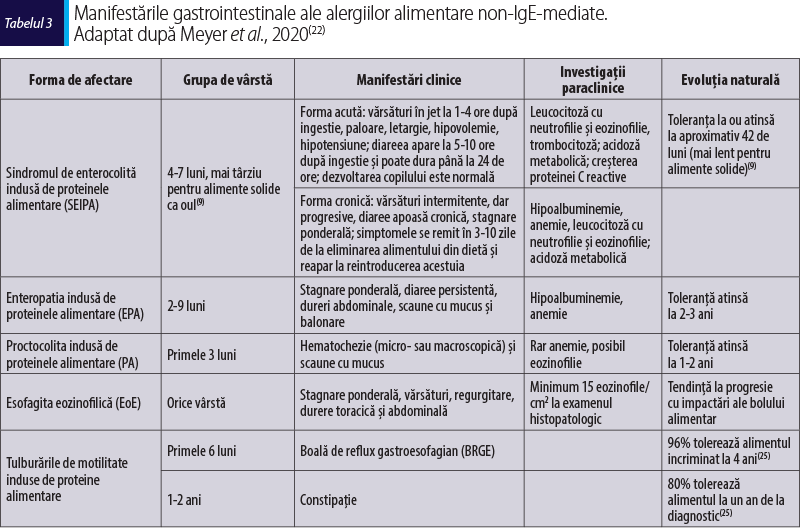
Alergiile alimentare non-IgE-mediate sunt manifestări tardive, apărute la distanţă de ore sau chiar zile de la consum, caracterizate prin afectare digestivă sau cutanată (dermatită atopică – DA). Principalele forme gastrointestinale şi caracteristicile lor sunt prezentate în tabelul 3.
Patogeneza alergiilor alimentare non-IgE-mediate este mult mai puţin cunoscută comparativ cu cea a celor IgE-mediate sau a dermatitei atopice. Sindromul enterocolitei induse de proteinele alimentare (SEIPA) este cel mai bine studiat dintre acestea, fiind observată creşterea permeabilităţii peretelui intestinal pentru antigene şi inflamaţie eozinofilică şi neutrofilică. De asemenea, au fost descrise implicarea limfocitelor Th2 şi Th17, expresia crescută a TNF-alfa la nivelul celulelor epiteliale intestinale şi scăderea producţiei de citokine protectoare precum TGF-beta. Aşadar, imaturitatea anatomică şi imunologică predispune sugarii la SEIPA. Totodată, eficienţa ondansetronului (antagonist al receptorului serotoninergic 5-HT3) în managementul formelor acute stă la baza teoriilor privind implicarea unor căi neuroendocrine(16,17). În ceea ce priveşte dermatita atopică, mecanismul imunologic de producere este unul mixt, implicând atât imunoglobuline E, cât şi limfocitele T.
Deşi cel mai adesea alergiile non-IgE-mediate sunt provocate de laptele de vacă, alergenele din ou sunt considerate triggeri frecvenţi ai acestor reacţii(18). Astfel, 12% din sindroamele de enterocolită indusă de proteine alimentare sunt provocate de ou. Atât albuşul, cât şi gălbenuşul pot fi factori declanşatori(19-21).
Prevalenţa alergiilor alimentare non-IgE-mediate este probabil subapreciată, întrucât manifestările clinice sunt diverse şi nespecifice. În lipsa unor teste cutanate sau de laborator sensibile, diagnosticul este dificil. Debutul este, în medie, la vârsta de 3-5 luni, însă simptomatologia poate apărea la scurt timp după naştere, contactul cu proteinele din ou fiind realizat prin intermediul laptelui matern. În mod particular, SEIPA provocat de ou este observat odată cu introducerea alimentelor solide, cazurile de apariţie a sindromului după expunerea la proteine prin intermediul laptelui matern fiind rare(22). De asemenea, au fost descrise manifestări digestive non-IgE-mediate la reintroducerea oului după remisiunea alergiei IgE-mediate(9).
În absenţa unor teste serologice de confirmare ca în cazul hipersensibilităţii IgE-mediate, diagnosticul alergiilor non-IgE-mediate la ou este unul dificil, bazat pe anamneză, examen clinic, dietă de excludere şi teste de provocare orală special concepute. În continuare există o întârziere medie de 4-7 luni între debutul simptomatologiei şi stabilirea diagnosticului de SEIPA, în ciuda stabilirii unor criterii în acest sens(23,24). Diagnosticul diferenţial include numeroase patologii nonalergice, printre care gastroenteritele virale sau bacteriene, sepsisul, boala celiacă, boala de reflux gastroesofagian, boala Hirschsprung, enteropatiile autoimune, afecţiunile neurologice sau bolile metabolice(1).
Hipoalbuminemia serică, deşi nespecifică, poate fi un argument în favoarea enteropatiei induse de proteinele alimentare (EPA) sau SEIPA. Dozarea calprotectinei din materiile fecale contribuie la excluderea unei boli inflamatorii intestinale cu debut precoce. Testele care detectează hemoragiile din materiile fecale sunt utile atât în stabilirea diagnosticului, cât şi în urmărirea evoluţiei proctocolitei induse de proteinele alimentare (PA)(22).
IgE specifice pentru alergenele din ou sunt, în general, absente, iar testele cutanate prick sunt negative la pacienţii cu alergii alimentare non-IgE-mediate. Cu toate acestea, sensibilizarea IgE a fost descrisă la 10-30% dintre aceştia, procentaj care poate ajunge la 75% în cazul celor cu EoE. Între 2% şi 20% dintre copiii cu SEIPA au IgE specifice pentru alergenele alimentare la momentul diagnosticului, acest fenotip fiind denumit SEIPA atipic(24). Aşadar determinarea IgE specifice nu are un rol în demersul diagnostic, însă este utilă în identificarea subpopulaţiei de pacienţi cu SEIPA atipic şi a celor care devin sensibilizaţi pe parcursul bolii (până la 30% dintre cazuri)(22,25).
Nivelul IgG4 specific pentru ou nu este corelat cu simptomatologia pacientului, fiind mai degrabă un răspuns fiziologic al organismului la expunerea repetată la proteine străine. De aceea, Societatea Europeană de Alergologie şi Imunologie clinică (EAACI) nu recomandă folosirea testelor IgG în evaluarea alergiilor alimentare. De asemenea, endoscopiile digestive şi examenul histopatologic nu sunt recomandate de rutină, dar pot fi utile în EPA când se suspectează un diagnostic alternativ(1). În cazul suspiciunii de esofagită eozinofilică, este necesar un tratament de minimum şase săptămâni cu inhibitori de pompă de protoni (IPP), în vederea excluderii BRGE şi a esofagitei eozinofilice responsive la IPP, anterior efectuării endoscopiei digestive superioare, cu prelevarea de biopsii pentru diagnosticul histopatologic(16).
Testele patch au fost propuse pentru evaluarea alergiilor alimentare tardive, însă nu sunt în prezent validate şi recomandate în acest scop. Există date contradictorii în literatură cu privire la utilitatea lor. Conform unei metaanalize, pentru alergia non-IgE-mediată la proteinele din ou, s-au identificat o specificate de 84,5% şi o sensibilitate de 54,5% ale acestor teste. Astfel, un rezultat negativ nu poate exclude cu certitudine o reacţie non-IgE-mediată, fiind în continuare necesar testul de provocare orală(26). S-a observat o acurateţe şi o sensibilitate mai mari, precum şi o specificate mai mică a acestor teste în cazul pacienţilor cu dermatită atopică comparativ cu cei cu simptome gastrointestinale. Deşi specificitatea lor este bună în diagnosticul reacţiilor non-IgE-mediate, lipsa de standardizare şi de reproductibilitate şi sensibilitatea slabă reprezintă argumente importante în defavoarea utilizării acestora(26,27).
Aşadar, când o alergie non-IgE-mediată la proteinele din ou este suspectată pe baza istoricului, a tabloului clinic şi a investigaţiilor paraclinice, diagnosticul de certitudine necesită eliminarea din dietă a alimentului, cu rezoluţia simptomelor în 2-4 săptămâni şi reapariţia lor la reintroducere(22). În cazul unui sugar alăptat exclusiv, cu simptomatologie sugestivă pentru o alergie non-IgE-mediată, este necesară eliminarea oului din dieta mamei. Totuşi, aproximativ 20% dintre sugarii cu proctocolită alergică alăptaţi prezintă remisiunea spontană a sângerării, fără modificări în alimentaţia mamei. Astfel, după excluderea altor cauze de sângerare, o perioadă de „watch and wait” poate fi încercată în acest caz(22).
SEIPA prezintă o caracteristică particulară, şi anume apariţia simptomelor acute după reexpunerea la aliment. În acest caz, TPO poate fi util în evaluarea iniţială a unui istoric neclar, însă este o procedură cu risc – 50% dintre pacienţii cu test pozitiv au reacţii severe care necesită tratament de reechilibrare hidroelectrolitică. Nu se va efectua TPO în cazul pacienţilor cu istoric convingător de implicare a oului sau în cazul unor reacţii severe în antecedente(23).
Protocolul de TPO propus de ghidurile internaţionale indică administrarea unei doze de 0,06‑0,6 g (de obicei 0,3 g) de proteină per kilogram corp în trei doze egale, la intervale de 30 de minute (maximum 3 g de proteină sau 10 g de aliment), urmată de o perioadă de supraveghere de 4-6 ore(23). Au fost formulate şi alte protocoale, însă fără a fi comparate în studii sistematice, astfel încât alegerea se bazează pe judecata medicului şi pe caracteristicile pacientului. Administrarea întregii doze într-o singură priză, urmată de supraveghere, nu s-a dovedit că are un risc mai mare comparativ cu administrarea fracţionată, dar poate economisi timp. Altă opţiune este administrarea într-o primă etapă a unei cantităţi mici de aliment, însă această modificare nu reduce semnificativ severitatea unei posibile reacţii pozitive(28).
De asemenea, înaintea efectuării unei provocări orale este necesară verificarea prezenţei IgE specifice pentru proteinele din ou, deoarece pacienţii sensibilizaţi au un risc de patru ori mai mare de a dezvolta reacţii severe la reexpunere. În astfel de situaţii, protocolul TPO va fi adaptat, fiind indicate utilizarea unei doze iniţiale mai mici, administrarea graduală, similară cu cea din alergiile IgE-mediate, şi supravegherea prelungită(23).
Un TPO efectuat în cazul suspiciunii de SEIPA este considerat pozitiv când pacientul prezintă vărsături la 1-4 ore după ingestia alimentului, în absenţa simptomelor unei alergii IgE-mediate şi două dintre următoarele: letargie, paloare, diaree la 5-10 ore după ingestie, hipotensiune, hipotermie, neutrofilie (≥1500/mm3). Totuşi, aceste criterii necesită validare în studii mari, multicentrice. În cazul în care vărsăturile necesită administrarea timpurie de ondansetron, testul va fi considerat pozitiv, deoarece medicamentul poate masca simptomele ulterioare(24).
Excluderea oului din dietă reprezintă pasul cel mai important, atât în diagnosticul, cât şi în managementul alergiilor non-IgE-mediate. Această excludere se va realiza pe o perioadă limitată, deoarece 56% dintre copiii cu hipersensibilitate non-IgE-mediată vor tolera acest aliment la vârsta de 18 luni(29). De obicei nu este necesară evitarea produselor cu „urme” de alergen. Majoritatea copiilor prezintă îmbunătăţirea semnificativă a simptomelor după patru săptămâni de excludere(22). Toate ghidurile recomandă reintroducerea acasă sau efectuarea unui TPO pentru confirmarea diagnosticului sau pentru verificarea necesităţii continuării dietei de excludere, prevenind astfel restricţiile alimentare nejustificate(16). În cazul copiilor alăptaţi, reintroducerea ar trebui să se realizeze în dieta mamei sau direct în cea a copilului, în funcţie de modul de hrănire al acestuia – dacă este alăptat exclusiv sau s-a început diversificarea(22).
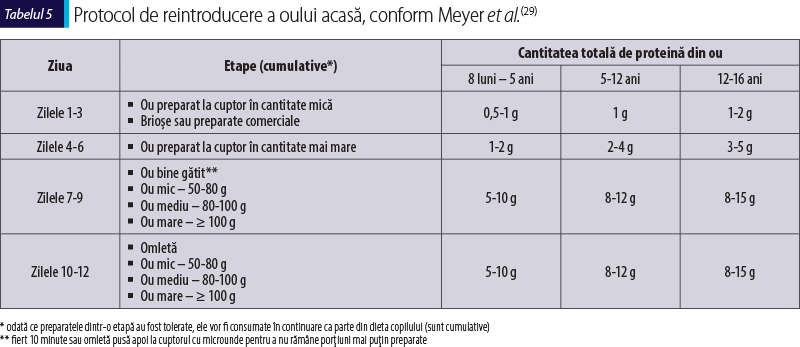
Cu excepţia SEIPA, restul alergiilor alimentare non-IgE-mediate nu necesită un test de provocare orală sub supraveghere medicală, manifestările clinice apărând după un interval mai mare de timp şi nepunând viaţa în pericol. Astfel, în aceste cazuri oul poate fi introdus treptat în alimentaţia copilului pentru a verifica toleranţa. Protocolul de introducere a oului la domiciliu propus de Meyer et al. şi prezentat în tabelele 4 şi 5 este unul sigur şi presupune administrarea în cantităţi crescătoare a alimentului bine preparat termic, în produse la cuptor, urmând apoi trecerea la produse mai puţin preparate, precum omleta. Autorii acestui protocol atrag atenţia asupra posibilităţii de sensibilizare IgE, care trebuie identificată înainte de începerea reintroducerii. Infecţiile respiratorii virale şi erupţiile dentare pot fi factori de exacerbare a simptomatologiei gastrointestinale, însă amânarea procedurii până când copilul nu este răcit sau nu are erupţii dentare este inutilă. Specialiştii recomandă în astfel de situaţii ambigue repetarea etapelor din protocol(29).
În ceea ce priveşte SEIPA, reintroducerea acasă a oului nu este recomandată. Aceasta trebuie efectuată sub supraveghere medicală, sub forma unui test de provocare, utilizând protocolul amintit anterior. Pentru verificarea toleranţei, majoritatea studiilor sugerează efectuarea unui TPO la 12-18 luni de la diagnostic, însă această perioadă nu a fost verificată în studii sistematice(23). Similar alergiilor IgE-mediate, s-a observat că proteinele din ou prelucrate prin coacere sunt tolerate mai devreme decât cele neprelucrate (la 30,2 versus 43,9 luni). Totuşi, reintroducerea lor trebuie realizată sub supraveghere medicală, deoarece în unele studii prelucrarea termică nu a influenţat apariţia reacţiilor severe(28,30).

Particularităţi ale alergiei la proteinele oului de pasăre la adulţi
Spre deosebire de alergia la copii, alergia la proteinele oului de găină la adulţi are probabilitate mai mare să fie severă şi de lungă durată. Se datorează fie unei alergii persistente la ouă din copilărie, fie unei adevărate alergii la ouă la adulţi, ceea ce este rar.
Formele clinice descrise la adult sunt(21):
debut nou de alergie la proteine din ou, anterior tolerate
sindromul pasăre-ou – sensibilizare la proteine din ou la pacientul sensibilizat la alergene de pasăre
sensibilizare la proteine din ou prin inhalare, în urma expunerii profesionale.
Concluzii
Alergia la ouă este frecventă la copiii care suferă de alergii alimentare, dar sensibilizarea la proteinele din ou este un fenomen complex, doar parţial caracterizat, întâlnit la persoanele predispuse la alergii. Aspectele încă insuficient cunoscute şi care necesită studii suplimentare sunt(21): prevalenţa alergiei la ou la adulţi, prevalenţa alergiei la ouă, altele decât oul de găină, alergia la gălbenuş, stabilirea mai clară a valorilor cut-off pentru diagnosticul de certitudine, definirea unor markeri clinici şi de laborator predictivi pentru remisiunea sau persistenţa alergiei la proteinele din ou, investigaţii suplimentare pentru imunoterapia orală pentru tratamentul alergiei la proteinele din ou. n
Bibliografie
-
Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, Cardona V, Dubois A, duToit G, Eigenmann P, Fernandez Rivas M, Halken S, Hickstein L, Høst A, Knol E, Lack G, Marchisotto MJ, Niggemann B, Nwaru BI, Papadopoulos NG, Poulsen LK, Santos AF, Skypala I, Schoepfer A, Van Ree R, Venter C, Worm M, Vlieg-Boerstra B, Panesar S, de Silva D, Soares-Weiser K, Sheikh A, Ballmer-Weber BK, Nilsson C, de Jong NW, Akdis CA; EAACI Food Allergy and Anaphylaxis Guidelines Group. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014 Aug;69(8):1008-25. doi: 10.1111/all.12429.
-
Martorell A, Alonso E, Boné J, Echeverría L, López MC, Martín F, Nevot S, Plaza AM; Food Allergy Committee of SEICAP. Position document: IgE-mediated allergy to egg protein. Allergol Immunopathol (Madr). 2013 Sep-Oct;41(5):320-36. doi: 10.1016/j.aller.2013.03.005.
-
Dhanapala P, De Silva C, Doran T, Suphioglu C. Cracking the egg: An insight into egg hypersensitivity. Mol Immunol. 2015 Aug;66(2):375-83. doi: 10.1016/j.molimm.2015.04.016.
-
Benhamou AH, Caubet JC, Eigenmann PA, Nowak-Wegrzyn A, Marcos CP, Reche M, Urisu A. State of the art and new horizons in the diagnosis and management of egg allergy. Allergy. 2010 Mar;65(3):283-9. doi: 10.1111/j.1398-9995.2009.02251.x.
-
Nilsson L, Brockow K, Alm J, Cardona V, Caubet JC, Gomes E, Jenmalm MC, Lau S, Netterlid E, Schwarze J, Sheikh A, Storsaeter J, Skevaki C, Terreehorst I, Zanoni G. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017 Nov;28(7):628-640. doi: 10.1111/pai.12762.
-
Caffarelli C, Ricò S, Varini M, Povesi-Dascola C, Mastrorilli C. Skin prick test and development of tolerance in egg allergy. Pediatr Allergy Immunol. 2016 Dec;27(8):881-884. doi: 10.1111/pai.12625.
-
Zudaire L, Carlos G, Magán, et al. Alergia a Huevo de Gallina. 2019. https://www.aeped.es/sites/default/files/documentos/16_alergia_huevo.pdf
-
Dona DW, Suphioglu C. Egg Allergy: Diagnosis and Immunotherapy. Int J Mol Sci. 2020 Jul 16;21(14):5010. doi: 10.3390/ijms21145010.
-
Leech SC, Ewan PW, Skypala IJ, Brathwaite N, Erlewyn-Lajeunesse M, Heath S, Ball H, James P, Murphy K, Clark AT. BSACI 2021 guideline for the management of egg allergy. Clin Exp Allergy. 2021 Oct;51(10):1262-1278. doi: 10.1111/cea.14009.
-
Hoffmann-Sommergruber K, Hilger C, Santos A, de las Vecillas L, Dramburg S. Molecular Allergology User’s Guide 2.0. EAACI Knowledge Hub. Published 2022. Accessed November 29, 2022. https://hub.eaaci.org/resources_guidelines/molecular-allergology-users-guide-2-0/
-
Foong RX, Dantzer JA, Wood RA, Santos AF. Improving Diagnostic Accuracy in Food Allergy. J Allergy Clin Immunol Pract. 2021 Jan;9(1):71-80. doi: 10.1016/j.jaip.2020.09.037.
-
Anagnostou A. Optimizing Patient Care in Egg Allergy Diagnosis and Treatment.
-
J Asthma Allergy. 2021 Jun 8;14:621-628. doi: 10.2147/JAA.S283307.
-
Calvani M, Arasi S, Bianchi A, Caimmi D, Cuomo B, Dondi A, Indirli GC, La Grutta S, Panetta V, Verga MC. Is it possible to make a diagnosis of raw, heated, and baked egg allergy in children using cutoffs? A systematic review. Pediatr Allergy Immunol. 2015 Sep;26(6):509-21. doi: 10.1111/pai.12432.
-
Santos AF. Clinical Applications of the Basophil Activation Test in Food Allergy. Buhlmann Diagnostics Corp. Published January 23, 2018. Accessed November 29, 2022. https://buhlmannlabs.com/clinical-applications-of-the-basophil-activation-test-in-food-allergy/
-
Sampson HA, Gerth van Wijk R, Bindslev-Jensen C, Sicherer S, Teuber SS, Burks AW, Dubois AE, Beyer K, Eigenmann PA, Spergel JM, Werfel T, Chinchilli VM. Standardizing double-blind, placebo-controlled oral food challenges: American Academy of Allergy, Asthma & Immunology-European Academy of Allergy and Clinical Immunology PRACTALL consensus report. J Allergy Clin Immunol. 2012 Dec;130(6):1260-74. doi: 10.1016/j.jaci.2012.10.017.
-
Caubet JC, Szajewska H, Shamir R, Nowak-Węgrzyn A. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol. 2017 Feb;28(1):6-17. doi: 10.1111/pai.12659.
-
Guibas GV, Tsabouri S, Makris M, Priftis KN. Food protein-induced enterocolitis syndrome: pitfalls in the diagnosis. Pediatr Allergy Immunol. 2014 Nov;25(7):622-9. doi: 10.1111/pai.12237.
-
Hsu P, Mehr S. Egg: a frequent trigger of food protein-induced enterocolitis syndrome. J Allergy Clin Immunol. 2013 Jan;131(1):241-2. doi: 10.1016/j.jaci.2012.08.045.
-
Lee E, Barnes EH, Mehr S, Campbell DE. An exploration of factors associated with food protein-induced enterocolitis syndrome: Birth, infant feeding and food triggers. Pediatr Allergy Immunol. 2021 May;32(4):742-749. doi: 10.1111/pai.13448.
-
Arik Yilmaz E, Cavkaytar O, Uysal Soyer O, Sackesen C. Egg yolk: an unusual trigger of food protein-induced enterocolitis syndrome. Pediatr Allergy Immunol. 2014 May;25(3):296-7. doi: 10.1111/pai.12173.
-
Nishino M, Sato S, Nagakura KI, Takahashi K, Asaumi T, Ogura K, Ebisawa M, Yanagida N. Food protein-induced enterocolitis syndrome triggered by egg yolk and egg white. Pediatr Allergy Immunol. 2021 Apr;32(3):618-621. doi: 10.1111/pai.13406.
-
Meyer R, Chebar Lozinsky A, Fleischer DM, Vieira MC, Du Toit G, Vandenplas Y, Dupont C, Knibb R, Uysal P, Cavkaytar O, Nowak-Wegrzyn A, Shah N, Venter C. Diagnosis and management of Non-IgE gastrointestinal allergies in breastfed infants-An EAACI Position Paper. Allergy. 2020 Jan;75(1):14-32. doi: 10.1111/all.13947.
-
Nowak-Węgrzyn A, Jarocka-Cyrta E, Moschione Castro A. Food Protein-Induced Enterocolitis Syndrome. J Investig Allergol Clin Immunol. 2017;27(1):1-18. doi: 10.18176/jiaci.0135.
-
Barni S, Vazquez-Ortiz M, Giovannini M, Liccioli G, Sarti L, Cianferoni A, Mori F. Diagnosing food protein-induced enterocolitis syndrome. Clin Exp Allergy. 2021 Jan;51(1):14-28. doi: 10.1111/cea.13767.
-
Meyer R, Fox AT, Chebar Lozinsky A, Michaelis LJ, Shah N. Non-IgE-mediated gastrointestinal allergies-Do they have a place in a new model of the Allergic March. Pediatr Allergy Immunol. 2019 Mar;30(2):149-158. doi: 10.1111/pai.13000.
-
Luo Y, Zhang GQ, Li ZY. The diagnostic value of APT for food allergy in children: a systematic review and meta-analysis. Pediatr Allergy Immunol. 2019 Jun;30(4):451-461. doi: 10.1111/pai.13031.
-
Sirin Kose S, Asilsoy S, Tezcan D, Atakul G, Al S, Atay O, Kangalli Boyacioglu O, Uzuner N, Anal O, Karaman O. Atopy patch test in children with cow’s milk and hen’s egg allergy: Do clinical symptoms matter? Allergol Immunopathol (Madr). 2020 Jul-Aug;48(4):323-331. doi: 10.1016/j.aller.2020.03.002.
-
Miceli Sopo S, Sinatti D, Gelsomino M. Retrospective analysis of 222 oral food challenges with a single dose in acute food protein-induced enterocolitis syndrome. Pediatr Allergy Immunol. 2021 Jul;32(5):1066-1072. doi: 10.1111/pai.13489.
-
Meyer R, De Koker C, Dziubak R, Godwin H, Reeve K, Chebar-Lozinsky A, Foong RX, Skrapac AK, Ellmer M, Shah N. The Challenge of Home Allergen Re-introductions Using the Ladder Approach in Children With Non-IgE Mediated Gastrointestinal Food Allergy. Front Allergy. 2021 Sep 10;2:721686. doi: 10.3389/falgy.2021.721686.
-
Miceli Sopo S, Romano A, Bersani G, Fantacci C, Badina L, Longo G, Monti G, Viola S, Tripodi S, Barilaro G, Iacono ID, Caffarelli C, Mastrorilli C, Barni S, Mori F, Liotti L, Cuomo B, Franceschini F, Viggiano D, Monaco S. Cooking influence in tolerance acquisition in egg-induced acute food protein enterocolitis syndrome. Allergol Immunopathol (Madr). 2019 May-Jun;47(3):221-226. doi: 10.1016/j.aller.2018.07.006.
Articole din ediţiile anterioare
Diagnosticul molecular în bolile alergice respiratorii induse de polenuri
Alergologia se află într-o perioadă de tranziţie în care diagnosticul bazat pe componente alergenice moleculare este integrat tot mai mult în pract...
Diagnosticul molecular în alergia la grâu
Alergia la grâu este o patologie frecventă în rândul pacienţilor pediatrici, dar poate fi întâlnită şi la adulţi, având potenţialul de a genera div...
Diagnosticul molecular al alergiilor în practica clinică
Prevalenţa bolilor alergice este în creştere, atât în ţările dezvoltate, cât şi în cele în curs de dezvoltare (Pawankar et al., 2013).
Alergenele recombinate – metode de producere şi utilitatea în diagnosticul molecular şi în imunoterapia alergenică
Extractele alergenice sunt folosite pe scară largă atât în diagnosticul in vivo, cât şi în terapia bolilor alergice, deşi prezintă multiple dezavan...