Atopic diseases are chronic multifactorial conditions that can evolve in the presence of one another, with overlapping pathogenetic mechanisms and with constantly increasing incidence. Previous studies have shown that there is a series of atopic manifestations that occur in a chronological order: the development of atopic dermatitis and food allergy as an initiating mechanism in the first year of life to the gradual development of allergic asthma and allergic rhinitis in childhood. This phenomenon is defined as atopic march, although its full progression following a temporal pattern with genetic and environmental factors is not yet proven and the underlying mechanisms are not completely clarified. The first clinical manifestation of atopy is generally considered to be atopic dermatitis and the beginning of the atopic march. The hypothetical mechanism initiated at the cutaneous level acts as a site of primary sensitisation through possible defects in the epidermal barrier, with the subsequent sensitisation at the airway level. To prevent the development of atopic march, the interrelationship between these conditions must be clearly understood. The identification of patients’ groups according to the clinical phenotype of the condition and specific measurable values (biomarkers) may help to establish the main etiopathogenetic mechanisms in these patients’ groups. This adds predictive value in disease progression and allows the use and research of targeted therapy to limit its progression and the association of comorbidities. The objectives of this review are to underline the main links between atopic dermatitis and asthma and to identify the possible underlying mechanisms involved in the pathogenesis of atopic dermatitis, which is characterized by disruption of the integrity of immunological function and skin barrier, supporting the idea that this condition is a systemic one.
Dermatita atopică şi astmul – interrelaţii clinice
Atopic dermatitis and asthma – clinical interrelationships
First published: 29 martie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.7.1.2023.7863
Abstract
Rezumat
Bolile atopice sunt afecţiuni cronice multifactoriale care pot evolua una în prezenţa alteia, cu mecanisme patogenetice suprapuse şi a căror incidenţă este într-o continuă creştere. Studiile anterioare au arătat faptul că există o serie de manifestări atopice care apar într-o ordine cronologică: dezvoltarea dermatitei atopice şi a alergiei alimentare, ca un mecanism de iniţiere în primul an de viaţă, până la dezvoltarea treptată spre astm alergic şi rinită alergică în perioada copilăriei. Acest fenomen este definit drept marş atopic, deşi nu este dovedit progresul complet după un tipar temporal cu factori genetici şi de mediu, iar mecanismele care stau la baza acestuia sunt incomplet clarificate. Prima manifestare clinică a atopiei este în general considerată a fi dermatita atopică şi începutul marşului atopic. Mecanismul ipotetic iniţiat la nivel cutanat acţionează ca loc de sensibilizare primară prin posibile defecte ale barierei epidermice, cu sensibilizarea ulterioară la nivelul căilor respiratorii. Pentru a preveni dezvoltarea marşului atopic, interrelaţia dintre aceste afecţiuni trebuie clar înţeleasă. Identificarea grupurilor de pacienţi în funcţie de fenotipul clinic al afecţiunii şi de valorile specifice măsurabile (biomarkeri) poate contribui la stabilirea principalelor mecanisme etiopatogenetice în aceste grupuri de pacienţi. Acest aspect adaugă o valoare predictivă în evoluţia bolii şi permite utilizarea şi cercetarea unei terapii mai ţintite pentru a limita această evoluţie şi asocierea de comorbidităţi. Printre obiectivele acestei revizuiri se află caracterizarea principalelor legături dintre dermatita atopică şi astm, alături de identificarea posibilelor mecanisme de bază implicate în patogeneza dermatitei atopice, care se caracterizează prin perturbarea integrităţii funcţiei imunologice şi a barierei cutanate, susţinând ideea că această afecţiune este una sistemică.
Introducere
În ultimele decenii s-a înregistrat o creştere semnificativă a incidenţei bolilor alergice, afectând 20% din populaţia mondială, în special copiii (Yang et al., 2020). Diferenţele de prevalenţă între populaţiile urbane şi cele rurale au fost atribuite riscului de atopie, inclusiv dieta, igiena, infecţiile, alergenele şi poluarea aerului, în combinaţie cu factorii genetici. Expunerea la animale de companie, la lapte nepasteurizat şi la endotoxine în timpul copilăriei este asociată cu o incidenţă redusă a manifestărilor alergice, deşi datele sunt raportate în mod inconsecvent, în general (Nicolaou et al., 2005; Tse and Horner, 2008). De asemenea, există o corelaţie strânsă între creşterea expunerii microbiene sau virale şi reducerea riscului de sensibilizare alergică (Spergel, 2010). Progresele actuale în ceea ce priveşte înţelegerea şi cunoaşterea bolilor alergice indică o ordine bazată pe timp: de la dermatita atopică (DA) şi alergia alimentară din primul an de viaţă până la dezvoltarea treptată în astm alergic şi rinită alergică în perioada copilăriei. Din punctul de vedere al structurii anatomice, aceste afecţiuni urmăresc evoluţia spaţială cutanată – tract gastrointestinal – tract respirator, fenomen definit drept marş atopic (Spergel şi Paller, 2003). O parte dintre aceste afecţiuni prezintă o evoluţie limitată, care se pot remite treptat până la dispariţia acestora odată cu vârsta, în timp ce altele persistă timp îndelungat, pe parcursul mai multor ani (Spergel, 2010). Totuşi, marşul atopic nu evoluează complet după un tipar temporal, care implică factori genetici şi de mediu, dar oferă o perspectivă în ceea ce priveşte cercetarea mecanismelor, predicţia, prevenţia şi tratamentul afecţiunilor alergice (Zheng et al., 2011; Yang et al., 2020).
Dermatita atopică, denumită şi eczemă atopică, este cea mai frecventă afecţiune inflamatorie cronică a pielii, care afectează peste 230 de milioane de persoane la nivel mondial şi reprezintă a patra cauză principală de invaliditate nonfatală (Weidinger şi Novak, 2016; Karimkhani et al., 2017). Această boală afectează între 15% şi 20% dintre copii şi între 1% şi 10% din populaţia adultă (Weidinger et al., 2018). Din punctul de vedere al fiziopatogeniei, dermatita atopică prezintă o interacţiune complexă între alterarea barierei cutanate şi tulburări ale sistemului imunitar, cu creşterea susceptibilităţii de a dezvolta complicaţii. Printre factorii implicaţi în patogeneză se numără mutaţii ale filagrinei, bariera fizică şi antimicrobiană. Există dovezi solide care implică un defect primar congenital al barierei epiteliale, rezultat din mutaţiile genei filagrinei, ca factor major de predispoziţie la un subset de pacienţi cu dermatită atopică şi, în mod secundar, la dezvoltarea astmului. În ceea ce priveşte bariera fizică, stratul cornos şi joncţiunile strânse joacă cele mai importante roluri. Bariera de joncţiune strânsă este implicată în patogeneza acestei afecţiuni, deoarece defectele structurale şi funcţionale ale acestor joncţiuni nu numai că perturbă bariera fizică, ci contribuie şi la deficienţe imune. În plus, peptidele antimicrobiene (AMP), cum ar fi catelicidina LL-37 (LL-37), psoriazina (S100A7) şi defensinele umane 2 şi 3 (HBD2, HBD3), îmbunătăţesc funcţia de barieră a joncţiunilor strânse. Asemănător dermatitei atopice, astmul, rinita alergică şi alergiile alimentare sunt frecvente în populaţia pediatrică, iar prevalenţa lor este într-o continuă schimbare. Alergia alimentară în copilărie este asociată cu afectarea calităţii vieţii, limitarea interacţiunilor sociale, afecţiuni comorbide şi cu costuri economice semnificative (Hill et al., 2016). O reacţie alergică severă care duce la anafilaxie poate pune în pericol viaţa, alergenele alimentare fiind cele mai frecvente cauze de anafilaxie şi de mortalitate asociate acestei afecţiuni la copii şi adolescenţi (de Silva et al., 2008). Pe de altă parte, astmul este o afecţiune de lungă durată, care afectează şi populaţia pediatrică, şi adulţii. Aproximativ 300 de milioane de persoane din întreaga lume suferă de astm şi se estimează că, până în 2025, alte 100 de milioane vor fi afectate. Astmul atopic este cea mai frecventă formă de astm, afectând 70-90% din populaţia pediatrică şi 50% dintre pacienţii adulţi (Yaneva şi Darlenski, 2021).
Distrugerea integrităţii barierei cutanate, factorii genetici, sensibilizarea alergică, nivelurile crescute de imunoglobuline E (IgE), microbiomul, imunitatea de tip T 2 (Th2) şi factorii declanşatori din mediul înconjurător sunt concepte binec unoscute, toate acestea fiind într-o măsură sau alta conectate, iar asocierea lor conturează conceptul de atopie şi dezvoltarea marşului atopic (Yaneva şi Darlenski, 2021).
Marşul atopic
Numeroase studii transversale şi longitudinale au indicat faptul că bolile alergice apar din momentul în care organismul începe să ia contact cu alergenele alimentare. Iniţial se dezvoltă dermatita atopică şi alergia alimentară în perioada de alăptare sau în prima parte a copilăriei. Ulterior, în a doua parte a copilăriei sau în adolescenţă, se dezvoltă rinita alergică şi astmul alergic. Această trecere graduală de la o boală atopică la alta, în etape specifice ale vieţii, este cunoscută sub denumirea de marş atopic. Dermatita atopică este considerată prima etapă de perturbare a barierei cutanate, de declanşare a inflamaţiei şi de apariţie a disbiozei bacteriene, care duce la sensibilizarea necesară dezvoltării ulterioare a altor boli atopice. Alergia alimentară poate preceda sau urma dermatita atopică, iar în unele cazuri este primul semn al declanşării marşului atopic. Perturbarea barierei cutanate poate duce la sensibilizare faţă de alergenele alimentare sau alergia alimentară poate însoţi dermatita atopică. Sensibilizarea la alimente ar putea fi un marker pentru severitatea dermatitei atopice, un endotip care ar putea sugera o mai mare probabilitate de tranziţie spre alte comorbidităţi atopice, precum astmul sau rinita alergică. Hiperreactivitatea bronşică este o reacţie imunologică care face parte din această cascadă de evenimente care au început precoce în timpul vieţii, când organismul a fost iniţial sensibilizat prin contact cutanat cu alergene. În modelul clasic de evoluţie a marşului atopic, astmul este rezultatul hiperreactivităţii bronşice. Date recente susţin faptul că prevalenţa astmului la pacienţii cu dermatită atopică este de 27,5% (Yaneva şi Darlenski, 2021). Atât dermatita atopică, cât şi astmul alergic sunt boli asociate cu o inflamaţie cronică, fiind IgE-mediate. Dezechilibrul dintre raportul Th1/Th2 este asociat cu o producţie mai mare de IgE la pacienţii atopici. Prin producţia de interleukine 2 şi 3 (IL-2, IL-13), celulele Th2 promovează producţia de IgE de către celulele B, ca răspuns la intrarea în contact cu alergene. Aceste modificări ale răspunsului imun duc la apariţia hiperreactivităţii bronşice la pacienţii cu astm sau la o reacţie cutanată inflamatorie la pacienţii cu dermatită atopică. Aceste similarităţi observate în patogeneza şi dezechilibrul imunologic pun cele două patologii una în contextul celeilalte (Yaneva şi Darlenski, 2021).
Bariera cutanată
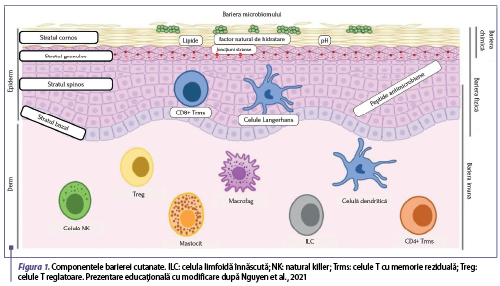
Pielea reprezintă o interfaţă între organism şi mediul exterior, acţionând astfel ca o barieră eficientă între cele două. Din punct de vedere funcţional, bariera cutanată este împărţită în patru niveluri diferite: bariera microbiomului, bariera chimică, bariera fizică şi bariera imună (figura 1). Pielea are mai multe mecanisme de apărare pentru a funcţiona ca barieră microbiană, chimică, fizică şi imună, care se coordonează între ele pentru a rezista stimulilor externi şi a menţine homeostazia acesteia (Yang et al., 2020). Epidermul îşi exercită rolul de barieră prin procesul de keratinizare. Proliferarea celulelor epidermice are loc în stratul bazal, trecând apoi prin procesul de diferenţiere şi migrare spre stratul cornos. Procesul de diferenţiere formează astfel, dinspre derm spre suprafaţa pielii, mai multe straturi ale epidermului: stratul bazal, stratul spinos, stratul granulos şi stratul cornos (Yang et al., 2020). Bariera chimică este realizată de peptidele antimicrobiene, factorul natural de hidratare (FNH) (care împreună contribuie la menţinerea unui pH cutanat adecvat) şi lipidele epidermului. Menţinerea unor niveluri necorespunzătoare ale FNH se asociază cu alterarea pH-ului şi a lipidelor din stratul cornos. Lactatul şi potasiul sunt constituenţi ai FNH, cu rol important în hidratarea pielii şi menţinerea caracteristicilor fizice ale stratului cornos. Lipidele localizate în acest strat sunt reprezentate de acizi graşi liberi, ceramide şi colesterol. Celulele derivate prin diferenţiere epidermică şi migrate până în stratul cornos sunt keratinocite mature, anucleate, aplatizate, a căror membrană este înlocuită de un înveliş cornificat care formează o reţea chimică cu un monostrat de lipide nepolare. S-a dovedit că peptidele antimicrobiene joacă un rol important în activitatea antimicrobiană şi imunomodulatoare. Proteinele stratului cornos şi structurile proteice care formează joncţiunile strânse dintre celulele stratului granulos sunt componente importante ale barierei fizice. Stratul granulos este compus din granule care conţin filagrină, loricrină, filamente de keratină, corpi lamelari cu lipide, corneodesmozină şi kalikreină. Keratinocitele din stratul granulos produc în principal trigliceride şi colesterol, indicând o legătură încrucişată între bariera fizică şi cea chimică. Majoritatea proteinelor care formează joncţiunile strânse sunt proteine transmembranare care conectează keratinocitele adiacente şi formează astfel o barieră care reglează transportul de apă şi de substanţe. Bariera imună este dinamică şi cuprinde mai multe populaţii de celule rezidente ale epidermului şi dermului. Pe lângă recrutarea celulelor imune, keratinocitele promovează atât viabilitatea, cât şi persistenţa acestora la nivel cutanat. Celulele T de memorie rezidente (Trm) sunt celule cu viaţă lungă, produse după eliminarea unei infecţii şi rămân în piele pentru a exercita efecte imune protectoare. Aceste celule nu numai că se acumulează în zona infectată, dar sunt alocate pe scară largă şi în zonele sănătoase ale pielii pentru a facilita protecţia împotriva contaminării microbiene secundare. După perturbarea barierei fizice, agenţii patogeni ar putea activa celulele imune rezidente, în special celulele Langerhans, care iniţiază ulterior răspunsul imun al celulelor T. Pe lângă aceasta, celulele imune rezidente promovează repararea barierei şi menţinerea homeostaziei pielii (Nguyen et al., 2020).
Etiopatogeneza dermatitei atopice
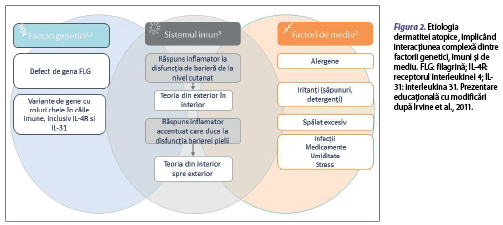
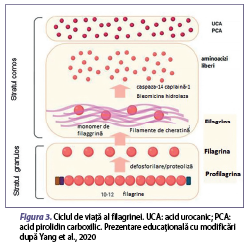
Etiologia dermatitei atopice implică interacţiunea complexă între factori de mediu, cei genetici şi cei imuni. Cei mai comuni factori de mediu asociaţi acestei afecţiuni sunt reprezentaţi de alimente, acarieni din praful de casă, animale de companie, polenuri, factori climatici, poluanţi atmosferici, agenţi iritanţi, tutun, agenţi infecţioşi, stres şi medicamente. Aceşti factori distrug bariera cutanată, astfel fiind facilitată pătrunderea alergenelor în organism, cu activarea mecanismelor imune de apărare (figura 2) (Howell et al., 2007). Printre factorii genetici, mutaţia genei filagrinei joacă un rol semnificativ în defectele barierei epidermice şi în sensibilizarea cutanată întâlnită în dermatita atopică. Filagrina este o proteină structurală importantă, care este responsabilă pentru diferenţierea keratinocitelor, pentru hidratarea cutanată şi pentru funcţia peptidelor antimicrobiene (Malik et al., 2017). Anomaliile genetice legate de gena filagrinei sunt puternic asociate cu dermatita atopică, iar debutul bolii la o vârstă mai mică de 5 ani, în 80% din cazuri, duce la creşterea sensibilităţii şi a severităţii alergiilor, existând un risc semnificativ de suprainfecţie (Palmer et al., 2006; Szegedi et al., 2015). Filagrina se găseşte ca profilagrină în granulele de kertohialină localizate în stratul granular. Profilagrina este degradată pentru a forma filagrină, ca mai apoi în stratul cornos să fie degradată în aminoacizi liberi şi convertită în acid urocanic, care menţine nivelul de aciditate al pielii (pH), şi, respectiv, acid pirolidin carboxilic, responsabil de menţinerea hidratării pielii, acţionând ca un hidratant natural (figura 3). Aşadar, aceste anomalii ale genei de filagrină sunt strâns legate de pierderea transepidermică de apă şi de deshidratarea la nivel cutanat în rândul populaţiei cu această afecţiune. Totodată, au loc modificări asupra unor cascade de evenimente, unde consecinţa majoră este dereglarea integrităţii barierei cutanate (figura 3). Atât pielea cu zone active de DA, cât şi cea nonlezională sunt caracterizate de o permeabilitate crescută, atribuită unor anomalii de arhitectură şi de compoziţie ale lipidelor epidermice. Defectul de barieră face ca ţesutul cutanat al pacienţilor să fie mai permisiv la pătrunderea iritanţilor, alergenelor şi agenţilor patogeni (Pellerin et al., 2013). Dintre grupurile de pacienţi cu dermatită atopică, doar 15-50% sunt purtători de mutaţii ale genei de filagrină (Yang et al., 2020).
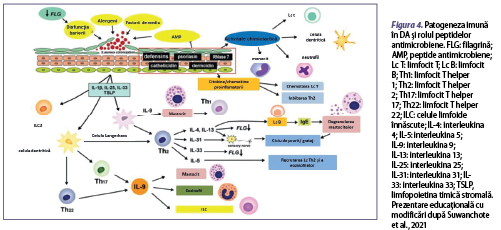
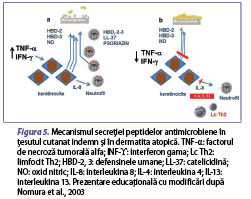
Un alt factor important este dereglarea funcţiei imunomodulatoare. Cel mai important factor imunologic implicat în patogeneza dezvoltării acestei afecţiuni este dereglarea funcţiei limfocitelor T helper 2 (Lc Th2), care secretă citokine proinflamatorii precum interleukina (IL) 5, IL-4, IL-13 şi IL-31 (Neis et al., 2006; Weidinger et al., 2016). Când pielea este traumatizată (de exemplu, prin grataj), keratinocitele eliberează limfopoietină timică stromală (TSLP) şi IL-33, care induc dezvoltarea inflamaţiei asociate Lc Th2-mediate şi creşterea expresiei IL-31 pe suprafaţa keratinocitelor (figura 4) (Murdaca et al., 2019). De asemenea, keratinocitele care eliberează TSLP, IL-25 şi IL-33 pot activa celulele efectoare înnăscute, cum ar fi celulele dendritice, mastocitele, bazofilele şi celulele limfoide înnăscute de tip 2 (ILC2), ceea ce duce la întreţinerea inflamaţiei cutanate în DA (Roan et al., 2019). Celulele efectoare înnăscute împreună cu citokinele secretate de Lc Th2 inhibă expresia peptidelor antimicrobiene (de exemplu, catelicidina, defensinele umane, psoriazina şi ribonucleaza din keratinocite) (figura 5). Inflamaţia T2-mediată (IL-4 şi IL-13) din dermatita atopică şi nivelurile scăzute al factorului de necroză tumorală alfa (TNF-α) şi interferonului gama (IFN-ϒ) suprimă expresia sau secreţia peptidelor antimicrobiene secretate de keratinocite (HBD-2, HBD-3, NO) şi inhibă secreţia de IL-8, care este cel mai puternic factor chemotactic pentru neutrofile, fiind astfel suprimate migrarea neutrofilelor şi secreţia de peptide antimicrobiene (HBD-2, HBD-3, LL-37, psoriazină), care joacă un rol important în protecţia barierei cutanate împotriva agenţilor patogeni (figura 5) (Nomura et al., 2003).
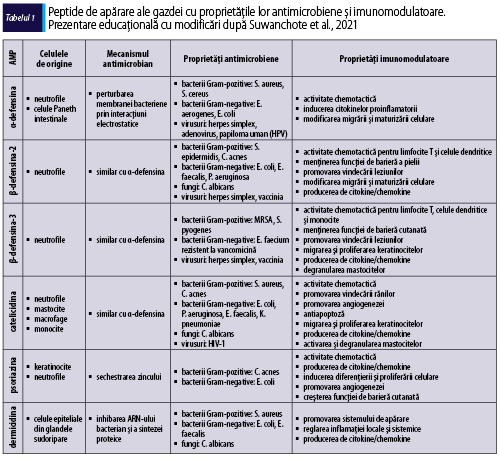
În sistemului imunitar înnăscut, în prima linie de apărare a tegumentului, împotriva agenţilor patogeni, sunt implicate peptidele antimicrobiene, produse de keratinocite, celulele epiteliale ale glandelor sudoripare, neutrofile şi mastocite. Peptidele antimicrobiene joacă un rol esenţial în formarea barierei imune cutanate, având capacitatea de a recunoaşte microorganismele patogene şi prin proprietăţile lor antimicrobiene şi imunomodulatoare având o importanţă majoră în apărarea înnăscută a gazdei. Un răspuns inflamator accentuat va distruge bariera cutanată şi va permite pătrunderea agenţilor patogeni, cu creşterea riscului de suprainfecţii bacteriene (impetigo, foliculită, abces), virale (eczeme herpetice, molluscum contagiosum) şi fungice (candidoză, dermatofitoză) la pacienţii cu dermatită atopică. Principalele familii de peptide antimicrobiene includ β-defensina umană 2 (HBD-2), LL-37, dermicidina şi psoriazina (tabelul 1). Astfel, s-a observat o reducere a sintezei acestora în dermatita atopică, comparativ cu alte afecţiuni ale pielii. HBD-2 este capabilă să distrugă Staphylococcus aureus (S. aureus) în prezenţa LL-37, dar nu şi de una singură. LL-37 poate suprima pruritul la pacienţii cu DA, deoarece induce expresia semaforinei 3A, un factor de chemorepulsie a nervilor epidermici, care este în general cu valori modificate în această afecţiune. Totodată, reduce inflamaţia virală prin suprimarea producţiei de TSLP, implicată în producţia de citokine inflamatorii de tip Th2. O nouă peptidă antimicrobiană este HBD-3, cu o capacitate puternică de distrugere a unui spectru larg de microbi (Suwanchote et al., 2021). Deficitul de HBD-3 contribuie la sensibilitatea crescută a tegumentului la infecţii, aceşti pacienţi fiind mai susceptibili la infecţii bacteriene ale pielii, prin distrugerea integrităţii barierei cutanate, astfel procesul inflamator alterând răspunsul imun local, în comparaţie cu tegumentul indemn (Yaneva şi Darlenski, 2021).
Peptidele derivate din dermicidină reprezintă prima linie de apărare, prin formarea unei bariere constante care acoperă epidermul. Dermicidina este secretată de glandele sudoripare; astfel, în transpiraţie se găsesc mai multe peptide antimicrobiene derivate din dermicidină, prelucrate proteolitic, care diferă ca încărcătură şi lungime (Palmer et al., 2006). Suprimarea dermicidinei va spori apariţia complicaţiilor în dermatita atopică. Psoriazina este prezentă în tegumentul indemn, dar, pe de altă parte, HBD-2 şi LL-37 se găsesc numai în pielea inflamată (Schittek, 2011).
Microbiomul
Ca interfaţă cu mediul înconjurător, pielea este un ecosistem complex colonizat de microorganisme comensale care coexistă într-un echilibru stabil. Pielea găzduieşte cea mai mare diversitate de comunităţi comensale (peste 1000 de specii de bacterii diferite). Date anterioare au arătat faptul că microbiomul pielii este stabil în timp (luni sau ani) şi că fiecare persoană posedă un microbiom cutanat personalizat. În cazul copiilor, care sunt mai puţin maturi din punct de vedere sexual, speciile de Corynebacterium şi Cutibacterium sunt mai puţin abundente, dar copiii au o diversitate mai mare de micoze cutanate în comparaţie cu subiecţii maturi sexual. Microbiomul cutanat este o componentă importantă pentru funcţionarea barierei epidermice, având rolul de a inhiba colonizarea cu agenţi patogeni precum S. aureus. Interacţiunea gazdei cu microorganismele comensale are efect asupra dezvoltării sistemului imunitar la sugar. Ulterior, contribuie la dezvoltarea şi evoluţia unor boli precum astmul şi dermatita atopică. În consecinţă, la pacienţii cu dermatită atopică, scăderea diversităţii microbiomului se corelează cu severitatea bolii şi cu creşterea riscului de colonizare cu bacterii patogene. Date anterioare au evidenţiat că aplicarea locală de microorganisme comensale (Staphylococcus hominis sau Roseomonas mucosa) reduce severitatea dermatitei atopice, sugerând astfel un rol important al microorganismelor comensale în scăderea colonizării cu agenţi patogeni (Paller et al., 2019).
Analiza microbiotei cutanate prin utilizarea secvenţierii metagenomice profunde şi a secvenţierii genelor 16S ARNr a arătat o reducere a diversităţii microbiotei în timpul episoadelor de dermatită atopică. S-au observat scăderi ale bacteriilor comensale din genurile Streptococcus, Corynebacterium şi Cutibacterium, în favoarea genului Staphylococcus, în general, şi S. aureus, în special. Colonizarea cu S. aureus este asociată cu niveluri crescute de IgE, alergie alimentară şi cu o formă mai severă de dermatită atopică. S. aureus produce factori de virulenţă care acţionează ca superantigene ce induc răspunsul imun de tip 2 şi suprimă celulele T reglatoare, mecanisme legate atât de astm, cât şi de dermatita atopică. Mai mult, însăşi colonizarea cu S. aureus este rezultatul unei bariere cutanate afectate, de exemplu când expresia filagrinei este scăzută şi expresia IL-4, IL-13 este crescută (Yaneva şi Darlenski, 2021).
Comorbidităţi în dermatită atopică şi astm
Unele comorbidităţi sunt consecinţe ale dermatitei atopice, în timp ce altele relevă diferite mecanisme patologice comune cu sau declanşate de această afecţiune. Dermatita atopică creşte riscul apariţiei de infecţii cutanate şi extracutanate, afecţiuni neuropsihiatrice, obezitate, boli cardiovasculare şi al unor tipuri de neoplasme. Date anterioare arată faptul că utilizarea unor măsuri de reducere a severităţii bolii în copilărie ar putea avea un efect protectiv împotriva dezvoltării acestor comorbidităţi, iar suferinţa cronică poate să reducă semnificativ calitatea vieţii pacientului (Paller et al., 2018). Lipsa unei remisiuni pe termen lung a bolii, la unii pacienţi, poate fi o cauză pentru afectarea statusului psihic şi un factor de predispoziţie pentru apariţia bolilor organice.
Riscul crescut de infecţii bacteriene, fungice şi virale la pacienţii cu dermatită atopică se datorează atât alterării barierei cutanate care permite agenţilor patogeni, cum ar fi S. aureus, să pătrundă în organism, cât şi inflamaţiei cutanate care alterează răspunsul imun local (Yaneva şi Darlenski, 2021). De asemenea, acest grup de pacienţi prezintă o susceptibilitate crescută la dezvoltarea infecţiilor virale. Infecţiile cutanate virale includ infecţia cu Coxsackie, eczema coxsackium, molluscum contagiosum, neoplasmul de col uterin legat de virusul papilomatozei umane (HPV) şi varicela (Suwanchote et al., 2021). Deşi nu există un risc aparent crescut pentru infecţia comună cu virusul herpes simplex, pacienţii cu această afecţiune prezintă un risc mai mare de a dezvolta eczema herpeticum (o infecţie diseminată a virusului herpes simplex, potenţial ameninţătoare de viaţă), în special în cazurile cu DA severă, istoric de alergie alimentară, debut precoce de boală, astm sau infecţie cutanată cu S. aureus (Park et al., 2015).
Afecţiunile extracutanate includ infecţiile respiratorii, gastrointestinale şi ale tractului urinar, boli metabolice, autoimune, cardiovasculare şi tulburări psihiatrice, având un risc semnificativ de declanşare odată cu creşterea numărului de afecţiuni alergice (Chen et al., 2001). Obezitatea reduce funcţia de barieră epidermică ca urmare a hiperactivităţii glandelor sudoripare, care reduce secreţia de peptide antimicrobiene, cum ar fi defensinele (tabelul 2) (Nino et al., 2012). Asemănător, afecţiunile alergice cresc riscul de apariţie a bolilor autoimune precum boala Crohn, colita ulcerativă şi alopecia areata (Augustin et al., 2015). Formele severe de alopecie areată sunt asociate în mod specific cu DA şi au un risc mai mare de apariţie când sunt prezente mutaţii ale filagrinei (Betz et al., 2007). Deşi unele date sugerează un risc redus de dezvoltare a unor afecţiuni maligne în cazul bolilor alergice, DA este asociată cu un risc crescut de limfom. Obezitatea şi tulburările psihiatrice cauzate de povara emoţională a suferinţei cronice sunt, de asemenea, trăsături comune ale ambelor afecţiuni şi ar trebui considerate ca fiind tulburări sistemice. Pacienţii cu cele două afecţiuni comorbide prezintă o creştere a excitabilităţii sistemului nervos simpatic ca răspuns la stres (frecvenţă cardiacă crescută, anxietate şi depresie). Chiar şi în timpul unor intervale fără stres, pacienţii au o frecvenţă cardiacă crescută şi o hiperactivitate a sistemului nervos simpatic care pot contribui la perturbarea somnului, fiind, de asemenea, un factor de risc pentru exacerbarea bolilor neuropsihiatrice. În ceea ce priveşte afecţiunile neuropsihiatrice, pacienţii cu DA sunt mai predispuşi la a dezvolta probleme de conduită, tulburări de hiperactivitate şi deficit de atenţie (ADHD), stres emoţional, anxietate şi depresie. Bolile cronice din copilărie sunt în general asociate cu un risc crescut de tulburări ale statusului mintal, iar afecţiunile alergice sunt legate de tulburarea de spectru autist, sindromul Tourette şi retardul mintal (Yaneva şi Darlenski, 2021).
Tratament
Recunoaşterea faptului că dermatita atopică poate preceda dezvoltarea ulterioară a altor boli atopice a determinat creşterea interesului, în eforturile de prevenire a întreruperii marşului atopic. Dovezile epidemiologice care arată o corelaţie între contactul ambiental cu animale, lapte nepasteurizat, endotoxine şi enterovirusuri în timpul copilăriei şi o incidenţă redusă a manifestărilor alergice nu sunt pe deplin clare – cu toate acestea, ele sugerează o paradigmă pentru expunerea imunostimulatoare în promovarea toleranţei la alergene în perioada primei copilării (Spergel, 2010).
Tratamentul simptomatic
Mai mulţi agenţi farmacologici, inclusiv antihistaminicele, corticosteroizii şi inhibitorii de calcineurină, au fost cercetaţi pentru capacitatea lor de a întrerupe marşul atopic. Antihistaminicele sunt utilizate pentru ameliorarea pruritului la pacienţii cu dermatită atopică şi pentru a preveni deteriorarea leziunilor cutanate agravate de grataj. S-a dovedit faptul că antihistaminicele reduc semnificativ riscul de astm alergic la sugarii cu dermatită atopică sensibilizaţi la polenul de ierburi sau la acarienii din praful de casă. Cu toate acestea, având în vedere efectele secundare ale antihistaminicelor, este necesar un număr mare de studii clinice pentru a evalua siguranţa şi eficacitatea acestora în evoluţia naturală a bolilor alergice (Yang et al., 2020). Glucocorticoizii sunt, de asemenea, un tratament antiinflamator eficient în bolile alergice, iar corticosteroizii inhalatori reprezintă tratamentul de bază în astmul alergic (Barnes, 2014).

Imunoterapia alergen-specifică
Imunoterapia alergen-specifică (AIT), cunoscută şi sub numele de „terapie de desensibilizare”, poate atenua simptomele alergice pentru o lungă perioadă şi poate schimba cursul natural al bolilor alergice. Există mai multe căi în ceea ce priveşte AIT, incluzând imunoterapia subcutanată (SCIT), imunoterapia sublinguală (SLIT), imunoterapia epicutanată şi imunoterapia orală (ITO). Mecanismele imunoterapiei alergen-specifice sunt reprezentate de stimularea secreţiei de IL-10 şi a factorului de creştere transformantbeta (TGF-β) de către limfocitul T reglator, promovarea echilibrului dintre celulele Th1 şi Th2 şi transformarea IgE în IgG pentru a bloca cascada IgE-mediată şi de a dobândi astfel toleranţa faţă de alergenele incriminate.
Terapia ţintită
Terapia care vizează inflamaţia Th2 previne dezvoltarea astmului bronşic şi a dermatitei atopice, deoarece este orientată asupra componentelor imunologice comune din marşul atopic, precum IL-4, IL-13, TSLP şi altele. Timp de mulţi ani, tratamentul dermatitei atopice a constat în utilizarea de emolienţi, fototerapie, inhibitori de caucineurină, corticosteroizi şi de alte terapii imunosupresoare. Ca urmare a numeroaselor cercetări privind patogeneza bolilor atopice, au fost dezvoltate noi terapii, iar multe sunt în curs de dezvoltare, cu mai puţine efecte secundare şi cu un răspuns terapeutic mai bun, care vizează mecanismul patogenic specific bolii (Yaneva şi Darlenski, 2021; Bieber, 2021). Dupilumab, un anticorp monoclonal pentru receptorul alfa al IL-4, blochează legarea IL-4 şi a IL-13 de receptorii săi şi a fost primul agent biologic aprobat pentru dermatita atopică moderată până la severă. Pe lângă blocarea căilor IL-4 şi IL-13, acesta creşte expresia filagrinei, a loricrinei şi a claudinelor (Guttman-Yassky et al., 2019). Omalizumb, anticorp monoclonal anti-IgE, a fost primul agent biologic aprobat pentru tratamentul astmului alergic sever la adolescenţi şi adulţi (Hansbro et al., 2011; Yaneva şi Darlenski, 2021). Direcţionarea căii de semnalizare JAK-STAT poate reduce inflamaţia Th2, implicată atât în astm, cât şi în dermatita atopică. Astfel, preparate precum baricitinib, upadacitinib, PF-04965842, ASN002 sau tofacitinib cresc expresia filagrinei, reduc inflamaţia, iar prin urmare refac bariera cutanată (Amano et al., 2015; Yaneva şi Darlenski, 2021). Lebrikizumab şi tralokinumab, inhibitori de IL-4/IL-13, prezintă eficienţă clinică în ambele afecţiuni, ceea ce consolidează mecanismele inflamatorii comune în patogeneza bolilor atopice (Wollenberg et al., 2019; Guttman-Yassky et al., 2020). De remarcat este faptul că aceste medicamente de terapie ţintită sunt autorizate numai pentru utilizare în anumite boli alergice. Deşi utilizările off-label sau adjuvante la tratament pentru numeroase afecţiuni alergice au obţinut rezultate încurajatoare, eficacitatea lor potenţială trebuie încă evaluată prin studii clinice.
Concluzii
Creşterea globală pronunţată a prevalenţei afecţiunilor atopice în ultimii ani este o problemă critică de sănătate publică, despre care se crede că este rezultatul schimbărilor din mediu, inclusiv al unei expuneri reduse la boli infecţioase şi al modificărilor ulterioare ale interacţiunilor dintre gene şi mediu. De asemenea, această creştere la nivel mondial a acestor afecţiuni scade considerabil calitatea vieţii. Teoria marşului atopic facilitează înţelegerea fiziopatogeniei afecţiunilor atopice şi promovează în continuare depistarea precoce, prevenirea şi tratamentul copiilor cu risc de boli alergice. Mecanismele prin care expunerea la alergene prin epiderm poate iniţia sensibilizarea sistemică şi predispune indivizii la o boală atopică au devenit mai bine înţelese în ultimii ani. Istoria naturală a simptomelor alergice poate urma o secvenţă care începe cu dermatita atopică în copilărie, urmată de rinită alergică şi astm în etapele următoare. Factorii sistemici implicaţi, cum sunt susceptibilitatea genetică şi perturbarea imunităţii de tip Th2, precum şi factorii tisulari specifici, cum ar fi răspunsul imun local, disfuncţia barierei sau disbioza cutanată, alături de factorii declanşatori de mediu, contribuie la creşterea riscului de comorbidităţi atopice (Paller et al., 2019). În general, pacienţii cu dermatită atopică cu debut precoce, severă şi persistentă, cu antecedente familiale pentru această afecţiune, au un risc mai mare de a dezvolta astm. Răspunsul imun de tip Th2, căile şi mediatorii săi sunt, fără îndoială, principalul mecanism determinant atât în DA, cât şi în astm. Cu toate acestea, nu toţi pacienţii cu DA dezvoltă astm şi nu toţi pacienţii cu astm sunt atopici. Legătura dintre aceste două afecţiuni există în contextul marşului atopic, în care anumite mecanisme patogenetice se suprapun într-o măsură mai mare. Iniţierea precoce a unei terapii ţintite către un mecanism patogenetic comun specific ar putea avea beneficii considerabile pentru pacienţii cu risc ridicat, deoarece dezvoltarea comorbidităţilor alergice este o condiţie prealabilă pentru dezvoltarea altora nonalergice. Cu toate acestea, identificarea şi stratificarea grupurilor de risc pot fi partea cea mai dificilă, deoarece definirea biomarkerilor semnificativi şi a valorilor lor prognostice în conformitate cu expresia fenotipică sunt încă provocări care trebuie depăşite. Studii ulterioare asupra marşului atopic ar trebui să vizeze mecanismele logice, precum aspectele genetice şi de mediu, pentru a explica modelul temporal, care ar deschide calea pentru abordări noi în prevenirea şi tratamentul precoce şi în timp util al manifestărilor clinice, iar în cele din urmă, pentru reducerea poverii alergiilor.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Amano W, Nakajima S, Kunugi H, Numata Y, Kitoh A, Egawa G, et al. The Janus kinase inhibitor JTE-052 improves skin barrier function through suppressing signal transducer and activator of transcription 3 signaling. J Allergy Clin Immunol. 2015 Sep;136(3):667-677.e7. doi: 10.1016/j.jaci.2015.03.051.2015.03.051. PubMed PMID: 26115905.
- Augustin M, Radtke MA, et al. Epidemiology and comorbidity in children with psoriasis and atopic eczema. Dermatology. 2015 May 8; 231(1):35-40. doi: 10.1159/000381913. PubMed PMID: 25966818.
- Barnes PJ. Glucocorticoids. Chem Immunol Allergy. 2014;100:311-6. doi: 10.1159/000359984. Epub 2014 May 22. PubMed PMID: 24925411.
- Betz RC, Pforr J, et al. Lossof-function mutations in the flaggrin gene and alopecia areata: strong risk factor for a severe course of disease in patients comorbid for atopic disease. J Invest Dermatol. 2007 Nov;127(11):2539-43. doi: 10.1038/sj.jid.5700915. PubMed PMID: 17581619.
- Bieber T. Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov. 2022 Jan;21(1):21-40. doi: 10.1038/s41573-021-00266-6. PubMed PMID: 34417579 PubMed Central PMCID: PMC8377708.
- de Silva IL, Mehr SS, Tey D, Tang ML. Paediatric anaphylaxis: a 5 year retrospective review. Allergy. 2008 Aug;63(8):1071-6. doi: 10.1111/j.1398-9995.2008.01719.x. PubMed PMID: 18691309.
- Guttman-Yassky E, Blauvelt A, Eichenfield L, Paller A, Armstrong A, et al. Efficacy and Safety of Lebrikizumab, a High-Affinity Interleukin 13 Inhibitor, in Adults With Moderate to Severe Atopic Dermatitis: A Phase 2b Randomized Clinical Trial. JAMA Dermatol. 2020 Apr 1;156(4):411-420. doi: 10.1001/jamadermatol.2020.0079. PubMed PMID: 32101256 PubMed Central PMCID: PMC7142380.
- Guttman-Yassky E, Bissonnette R, Ungar B, Suarez-Farinas M, Ardeleanu M, et al. Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis. J Allergy Clin Immunol. 2019 Jan;143(1):155-172. doi: 10.1016/j.jaci.2018.08.022. PubMed PMID: 30194992.
- Hansbro PM, Kaiko GE, Foster PS. Cytokine/anti-cytokine therapy- novel treatments for asthma? Br J Parmacol. 2011 May;163(1):81-95. doi: 10.1111/j.1476-5381.2011.01219.x.PubMed PMID: 21232048 PubMed Central PMCID: PMC308587.0
- Hill DA, Grundmeier RW, et al. The epidemiologic characteristics of healthcare provider-diagnosed eczema, asthma, allergic rhinitis, and food allergy in children: a retrospective cohort study. BMC Pediatr. 2016 Aug 20;16:133. doi: 10.1186/s12887-016-0673-z. PubMed PMID: 27542726 PMCID: PMC4992234.
- Howell MD, Boguniewicz M, et al. The constitutive capacity of human keratinocytes to kill Staphylococcus aureus is dependent on beta-defensin 3. J Invest Dermatol. 2007 Oct; 127(10):2368-80. doi: 10.1038/sj.jid.5700861. PubMed PMID: 17460726.
- Karimkhani C, Dellavalle RP, Coffeng LE, Flohr C, Hay R, Langan S, et al. Global skin disease morbidity and mortality: an update from the Global Burden of Disease study 2013. JAMA Dermatol. 2017;153(5):406–12. https://doi.org/10.1001/jamadermatol.2016.5538. PubMed PMID: 28249066 PubMed Central PMCID: PMC5817488.
- Malik K, Heitmiller K.D, et al. An Update on the Pathophysiology of Atopic Dermatitis. Dermatol. Clin Dermatol Clin. 2017 Jul; 35(3):317-326. doi: 10.1016/j.det.2017.02.006. PubMed PMID: 2857780.1
- Murdaca G, Greco M, et al. IL-33/IL-31 axis in immune-mediated and allergic diseases. Int J Mol Sci. 2019 Nov 22;20(23):5856. doi: 10.3390/ijms20235856. PubMed PMID: 31766607 Pub Med Center PMCID: PMC692919.1
- Neis M, Peters B, et al. Enhanced expression levels of IL-31 correlate with IL-4 and IL-13 in atopic and allergic contact dermatitis. J Allergy Clin Immunol. 2006 Oct; 118(4):930-7. doi: 10.1016/j.jaci.2006.07.015. PubMed PMID: 17030248.
- Nicolaou N, Siddique N, Custovic A. Allergic disease in urban and rural populations: increasing prevalence with increasing urbanization. Allergy. 2005 Nov;60(11):1357-60. doi: 10.1111/j.1398-9995.2005.00961.x. PubMed PMID: 16197466.
- Nino M, Franzese A, et al. The Effect of Obesity on Skin Disease and Epidermal Permeability Barrier Status in Children. Pediatr Dermatol. 2012 Sep-Oct; 29(5):567-70. doi: 10.1111/j.1525-1470.2012.01738.x. PubMed PMID: 2247193.8
- Nomura I, Goleva E, Howell MD, et al. Cytokine milieu of atopic dermatitis, as compared to psoriasis, skin prevents induction of innate immune response genes. J Immunol. 2003 Sep 15;171(6):3262-9. doi: 10.4049/jimmunol.171.6.3262. PubMed.
- Paller A, Spergel J, Mina-Osorio P, Irvine A. The atopic march and atopic multimorbidity: Many trajectories, many pathways. J Allergy Clin Immunol. 2019;143(1):46–55. https://doi.org/10.1016/j.jaci.2018.11.006. PubMed PMID: 30458183.
- Paller A, Jaworski J, et al. Major Comorbidities of Atopic Dermatitis: Beyond Allergic Disorders. Am J Clin Dermatol. 2018 Dec; 19(6):821-838. doi: 10.1007/s40257-018-0383-4. PubMed PMID: 30168085.
- Palmer CN, Irvine A, et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat Genet. 2006 Apr;38(4):441-6. doi: 10.1038/ng1767. PubMed PMID: 16550169.
- Pellerin L, Henry J, et al. Defects of filaggrin-like proteins in both lesional and nonlesional atopic skin. J Allergy Clin Immunol. 2013 Apr;131(4):1094-102. doi: 10.1016/j.jaci.2012.12.1566. PubMed PMID: 23403047.
- Roan F, Obata-Ninomiya K, et al. Epithelial cell-derived cytokines: more than just signaling the alarm. J Clin Invest. 2019 Apr 1;129(4):1441-1451. doi: 10.1172/JCI124606. PubMed PMID: 30932910 Pub Med Center PMCID: PMC6436879.
- Schittek B. The Antimicrobial Skin Barrier in Patients with Atopic Dermatitis. Curr Probl Dermatol. 2011;41:54-67. doi: 10.1159/000323296.
- Spergel JM. Epidemiology of atopic dermatitis and atopic march in children. Immunol Allergy Clin North Am. 2010 Aug;30(3):269-80. doi: 10.1016/j.iac.2010.06.003. PubMed PMID: 2067081.2
- Spergel JM, Paller AS. Atopic dermatitis and the atopic march. J Allergy Clin Immunol. 2003 Dec;112(6 Suppl):S118-27. doi: 10.1016/j.jaci.2003.09.033. PubMed PMID: 1465784.2
- Suwanchote S, Waitayangkoon P, et al. Role of antimicrobial peptides in atopic dermatitis. Int J Dermatol. 2022 May;61(5):532-540. doi: 10.1111/ijd.15814. PubMed PMID: 34432296.
- Szegedi A. Filaggrin mutations in early- and late-onset atopic dermatitis. Br J Dermatol. 2015 Feb; 172(2):320-1. doi: 10.1111/bjd.13534. PubMed PMID: 25660681.
- Tse K, Horner AA. Allergen tolerance versus the allergic march: the hygiene hypothesis revisited. Curr Allergy Asthma Rep. 2008 Nov;8(6):475-83. doi: 10.1007/s11882-008-0088-5. PubMed PMID: 18940137 PubMed Central PMCID: PMC2869282.
- Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine A. Atopic dermatitis. Nat Rev Dis Primers. 2018 Jun 21;4(1):1. doi: 10.1038/s41572-018-0001-z. Pubmed PMID: 29930242.
- Weidinger S, Novak N. Atopic dermatitis. Lancet. 2016 Mar 12;387(10023):1109-1122. doi: 10.1016/S0140-6736(15)00149-X. PubMed PMID: 2637714.2
- Wollenberg A, Howell M, Guttman-Yassky E, Silverberg J, Kell C, Ranade K, et al. Treatment of atopic dermatitis with tralokinumab, an anti–IL 13 mAb. J Allergy Clin Immunol. 2019;143(1):135–41. https://doi. org/10.1016/j.jaci.2018.05.029. PubMed PMID: 29906525.
- Yaneva M, Darlenski R. The link between atopic dermatitis and asthma‑ immunological imbalance and beyond. Asthma Res Pract. 2021 Dec 15;7(1):16. doi: 10.1186/s40733-021-00082-0. PubMed PMID: 34911576 PubMed Central PMCID: PMC8672460.
- Yang L, Fu J, Zhou Y. Research Progress in Atopic March. Front Immunol. 2020 Aug 27;11:1907. doi: 10.3389/fimmu.2020.01907. eCollection 2020. PubMed PMID: 32973790 PubMed Central PMCID: PMC7482645
- Yang G, Seok JK, et al. Skin Barrier Abnormalities and Immune Dysfunction in Atopic Dermatitis. Int J Mol Sci. 2020 Apr 20;21(8):2867. doi: 10.3390/ijms21082867. PubMed PMID: 32326002 PubMed Center PMCID: PMC7215310.
- Zheng T, Yu J, Oh MH, Zhu Z. The atopic march: progression from atopic dermatitis to allergic rhinitis and asthma. Allergy Asthma Immunol Res. 2011 Apr;3(2):67-73. doi: 10.4168/aair.2011.3.2.67. PubMed PMID: 21461244 PubMed Central PMCID: PMC3062798.
Articole din ediţiile anterioare
Corelaţia dintre rinita alergică şi astm
Conceptul de „o singură boală a căilor respiratorii” subliniază legătura strânsă dintre căile respiratorii superioare şi inferioare în bolile alerg...
Impactul clinic şi managementul comorbidităţilor în astmul sever
Pacienţii cu astm sever reprezintă o minoritate din populaţia totală cu astm (3-10% dintre aceştia), afecţiunea fiind responsabilă pentru 60% din c...
Terapiile biologice în astmul sever – o perspectivă moleculară
Astmul este o boală heterogenă definită printr‑un istoric de simptome respiratorii care variază în timp şi în intensitate, precum şi prin limitarea...
Utilitatea probelor funcţionale în diagnosticul astmului alergic
Astmul este o afecțiune eterogenă, caracterizată prin inflamația cronică a căilor respiratorii şi prin hiperreactivitate bronşică la stimuli dire...