As a result of immunomodulatory therapy, the last decade was marked by spectacular results in the targeted treatment of inflammatory, autoimmune, neoplastic, and other diseases. The widespread use of biological agents is affected by the increased number of drug and immunologically mediated adverse reactions, which justifies the need to explore the subject. The present paper is a presentation of adverse reactions to biological agents.
Reacţiile de hipersensibilitate la agenţi biologici
Hypersensitivity reactions to biological agents
First published: 16 noiembrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.1.1.2017.1238
Abstract
Rezumat
Ultimul deceniu aduce, grație terapiei imunomodulatoare, rezultate spectaculoase în tratamentul țintit al unor afecțiuni inflamatorii, autoimune, neoplazice și nu numai. Utilizarea pe scară tot mai largă a agenților biologici este grefată însă de creșterea numărului de reacții adverse medicamentoase și implicit a celor mediate imunologic, ceea ce justifică necesitatea cunoașterii acestui subiect. Lucrarea de față reprezintă o punere la punct în tema reacțiilor adverse la agenți biologici.
Scopul lucrării
Lucrarea de față pornește de la date generale privind reacțiile adverse medicamentoase și reprezintă o punere la punct în tema reacțiilor adverse la agenți biologici.
Alergia medicamentoasă reprezintă reacția adversă imprevizibilă care survine ca urmare a administrării unui medicament într-o anumită doză, tolerată de pacienții sănătoși și care are la bază un mecanism imunologic, IgE sau non-IgE mediat (prin IgG sau limfocite)(1). Unul sau mai multe mecanisme imune pot concura la dezvoltarea reacțiilor alergice la medicamente(1).
Clasificarea după Rawlins și Thompson (tabelul 1) a reacțiilor adverse medicamentoase include reacțiile de tipul A, previzibile, legate de doză și de acțiunea farmacologică a medicamentului, și reacțiile de tipul B, imprevizibile, nelegate de doza administrată sau de acțiunea medicamentului. Acestea din urmă reprezintă până la 15% din totalul reacțiilor adverse medicamentoase(2).
World Allergy Organization (WAO) recomandă clasificarea reacțiilor de hipersensibilitate la medicamente în raport cu perioada de la expunere până la debutul simptomelor, în reacții imediate și reacții întârziate. Acest mod de clasificare este util, în linii mari, în diferențierea reacțiilor IgE mediate, de hipersensibilitate de tipul I, care în mod obișnuit debutează în prima oră de la expunere, cu anumite excepții (absorbția lentă, ca urmare a administrării per os a unui medicament sau concomitent cu alimente), de cele tardive, mediate prin reacții de hipersensibilitate de tipurile II, III sau IV și în care manifestările survin de obicei după șase ore de la expunere și, tipic, la zile de la inițierea tratamentului(3).
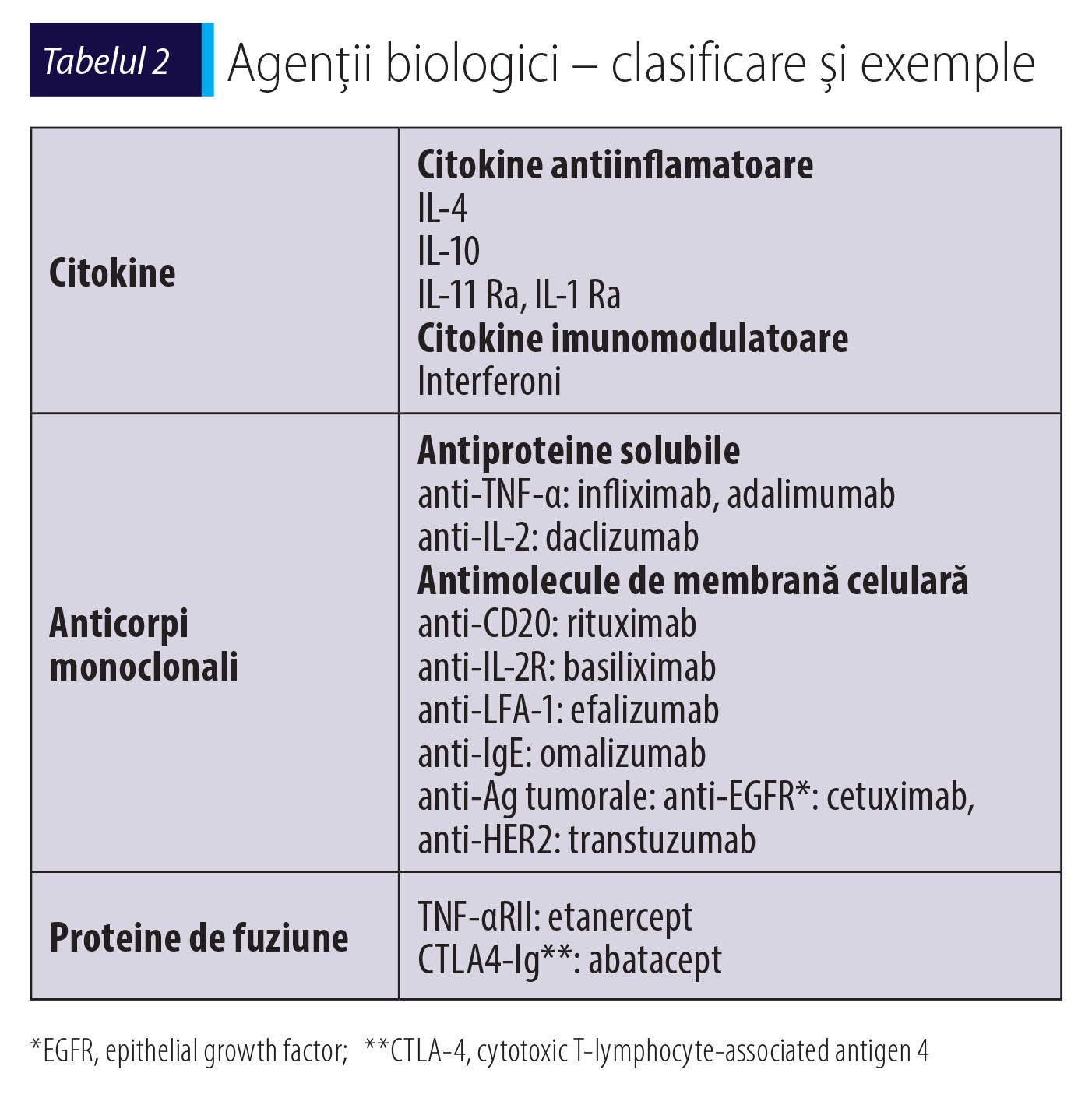
Ultimul deceniu aduce, grație terapiei imunomodulatoare (citokine, anticorpi monoclonali – MoAb monoclonal antibodies, vaccinuri, terapie genică), rezultate spectaculoase în tratamentul țintit al unor afecțiuni inflamatorii, autoimune, neoplazice și nu numai. Agenții biologici sunt medicamente în care substanța activă este produsă sau extrasă dintr-o sursă biologică, incluzând mai multe categorii de substanțe (tabelul 2).
Utilizarea pe scară tot mai largă a agenților biologici este grevată însă de creșterea numărului de reacții adverse medicamentoase și implicit a celor mediate imunologic, ceea ce justifică necesitatea cunoașterii acestui subiect.
Reacțiile adverse asociate terapiei cu agenți biologici variază în limite largi și includ reacții locale, la locul administrării, reacții legate de infuzie, reacții de hipersensibilitate de tipul I, discrazii sangvine, boala serului, vasculite, boli demielinizante, reactivarea unor infecții (tuberculoză, infecții fungice, virale), neoplazii sau afecțiuni autoimune. Efectele adverse asociate terapiei imunomodulatoare sunt potențial severe și, uneori, amenințătoare de viață. Terapia convențională (corticoterapie sistemică sau alte imunosupresoare, agenți citotoxici) poate asocia, de asemenea, reacții adverse severe, superioare terapiei biologice. Astfel, optarea pentru agenți biologici se face după evaluarea atentă a raportului risc/beneficiu pentru fiecare individ în parte.
Reacțiile locale, la sediul injectării, sunt frecvente, caracterizate sub aspect clinic prin eritem, edem, prurit, echimoze, durere, care survin în mod obișnuit în prima lună de tratament și se remit în decursul a câteva zile (3-5 zile) de la administrarea subcutanată. În cazuri excepționale, reacțiile locale sunt severe și impun sistarea terapiei. Arareori, reacțiile pot să apară la distanță de sediul administrării(4-9).

Reacțiile legate de infuzie pot fi imediate (90% dintre cazuri), debutează tipic în primele 10 minute – 4 ore de la administrare (arareori în decursul a 24 de ore), și întârziate, care se dezvoltă la una până la 14 zile (de obicei la 5-7 zile) de la tratament. Reacțiile legate de infuzie îmbracă diferite forme de severitate – ușoare, moderate sau severe – și variate forme clinice, de hipersensibilitate de tipul I, IgE mediată (urticarie, angioedem, mergând până la anafilaxie) sau non-IgE mediate, pseudoalergice, care pot mima anafilaxia(10-14).
Toți agenții biologici, inclusiv anticorpii monoclonali complet umani, au potențial imunogen. Formarea de anticorpi antimedicament – antiproteine murinice, denumiți și anticorpi antihimerici (HACA; human antichimeric antibodies), precum și antiproteine umane (HAHA; human anti-human antibodies) –, documentată uneori în cursul terapiei cu MoAb, asociază risc de reacții de hipersensibilitate, răspuns insuficient/eșec al terapiei, creșterea necesarului de tratament. Regiunile variabile murinice din componența MoAb (murini, himerici sau umanizați) reprezintă antigene complete, xenoantigene, capabile să inducă reacții de hipersensibilitate de tipul I, IgE mediate(15-20).
De asemenea, componentele proteice din structura MoAb pot induce sinteza unor imunoglobuline relevante clinic, izotipurile IgG sau IgM, responsabile pentru formarea de complexe imune, activarea cascadei complementului, sinteza de anafilatoxine și eliberarea sistemică a mediatorilor mastocitari, fiind asociate cu fenotipul clinic al reacțiilor de hipersensibilitate de tipul III sau cu reacții imediate, care mimează manifestările clinice ale hipersensibilității de tipul I(21,22).
Reacțiile acute non-IgE mediate sunt nediferențiabile clinic de reacțiile de hipersensibilitate de tipul I, dar sunt diferite sub aspectul mecanismului patologic incriminat. O altă explicație pentru reacțiile acute este cea a interacțiunii directe dintre anticorpii monoclonali și receptorii specifici (FcgR), exprimați de celulele imune efectoare (monocite, macrofage, limfocite T și B, celule NK). Consecutiv acestei interacțiuni, sunt activate celulele FcgR pozitive, ceea ce conduce la eliberarea sistemică și susținută a unor mediatori proinflamatori – sindromul eliberării citokinelor (cytokine release syndrome; CRS)(23). Studii in vivo și in vitro au confirmat că TNF-a, IFN-g, IL-6 și IL-8 sunt principalii mediatori ai „furtunii citokinice“ produse prin degranularea celulelor imune(24). Date publicate în literatură corelează majoritatea reacțiilor acute legate de infuzie cu un nivel al triptazei serice în limite normale. De obicei, aceste reacții legate de infuzie pot fi prevenite prin intermediul premedicației (acetaminofen, corticosteroizi, antihistaminice) și se remit la reducerea ritmului de administrare sau la sistarea temporară a administrării medicamentului. Reluarea terapiei biologice la o rată mai scăzută de infuzie și/sau cu premedicație este în general tolerată de către pacienți. Toate acestea constituie argumente în favoarea unui mecanism non-IgE mediat în majoritatea cazurilor de reacții acute legate de infuzie(25-28).
Reacțiile întârziate legate de infuzie pot fi similare reacțiilor de hipersensibilitate de tipul III, prin momentul debutului și prin manifestările clinice (erupții cutanate, artralgii, mialgii, astenie și fatigabilitate, sindrom febril). Astfel, reacțiile întârziate la agenți biologici ar putea fi mediate de reacții ușoare de hipersensibilitate de tipul III, mediate prin complexe imune antigen-anticorp.
Neutropenia este o altă reacție adversă asociată terapiei biologice, întâlnită de obicei la pacienții sub tratament anti-TNF-alpha sau anti-CD20 (rituximab)(29-31). Complicațiile infecțioase pot fi severe, așa încât se impune monitorizarea activă a hemoleucogramei la o lună de la inițierea tratamentului și apoi la fiecare 3-6 luni. Neutropenia cu debut tardiv, la 4-5 luni de la ultima administrare a rituximabului, este o potențială complicație care trebuie avută în vedere. Terapia cu rituximab crește, de asemenea, riscul de hipogammaglobulinemie, mai cu seamă la pacienții care urmează cure repetate de tratament(32,33).
Infecțiile severe pot limita utilitatea clinică a agenților biologici. Terapia anti-TNF-alpha asociază un risc crescut de infecții bacteriene, îndeosebi de pneumonie, reactivări TB, ale virusului varicelo-zoosterian sau ale virusului hepatitic B, infecții cu germeni oportuniști, ca urmare a blocării factorului de necroză tumorală alpha, care este o componentă esențială a răspunsului imun antiinfecțios. În acest context, screeningul pentru infecție TB latentă este imperativ în cazurile la care se optează pentru inhibitori TNF-alpha(34). Răspunsul la vaccinare poate fi alterat în cursul terapiei imunologice cu rituximab, prin efectul acestuia asupra limfocitelor B. Astfel, în cazurile în care se recomandă vaccinarea (antipneumococică, antivirală, antihepatita B), aceasta se efectuează cu cel puțin patru săptămâni înainte de inițierea rituximabului sau la 6 luni – 1 an de la sistarea terapiei imunomodulatoare(35,36).
Alte complicații posibile ale terapiei cu agenți biologici sunt insuficiență cardiacă, toxicitate pulmonară (fibroza pulmonară, boli granulomatoase, exacerbarea astmului preexistent, epanșamente pleurale), hepatotoxicitate, manifestări cutanate (psoriazis, eczeme cronice, vasculită leucocitoclastică, lichen plan sau lichenoid, alopecie)(37-40).
Autoimunitatea și neoplaziile sunt, de asemenea, asociate terapiei cu modificatori ai răspunsului biologic. Terapia biologică poate asocia, cu o incidență imprecisă, sinteza de autoanticorpi, îndeosebi a autoanticorpilor antinucleari (ANA), dar și a altor autoanticorpi (anti-ADN dublu catenar, antifosfolipidici, anticardiolipină, autoanticorpi antitiroidieni), care, în general, nu au impact clinic. Fenomenele de autoimunitate care survin în cadrul terapiei imunomodulatoare ar putea fi atribuite sintezei de autoanticorpi(41,42).
Diferite afecțiuni autoimune sistemice (lupus eritematos sistemic, vasculite sistemice, sarcoidoză, sindrom antifosfolipidic, dermatomiozită/polimiozită) și de organ (vasculite cutanate, psoriazis, uveită, nevrită optică, afecțiuni demielinizante, hepatite autoimune) pot surveni în contextul terapiei biologice. Bolile demielinizante au fost, de asemenea, raportate în contextul terapiei imunomodulatoare. Tabloul clinic variază în limite largi și cuprinde semne și simptome ale demielinizării, precum confuzie, ataxie, parestezii, diverse manifestări neurologice, nevrită optică, hemipareză, mielită transversă, sindrom Guillain-Barré, modificări imagistice compatibile demielinizării(43). Relația temporală directă dintre expunere la agenții biologici și debutul fenomenelor de autoimunitate, alături de rezoluția manifestărilor după sistarea acestora, sunt argumente în favoarea relației cauză-efect dintre terapia imunomodulatoare și autoimunitate.
Terapia imunomodulatoare cu interferoni (IFN) de tipul 1 are un potențial ridicat de inducere a autoimunității. Tratamentul cu IFN poate exacerba ori demasca afecțiuni autoimune preexistente sau inaparente clinic și poate induce boli autoimune de novo. Mecanismele patologice prin care terapia cu IFN induce fenomene de autoimunitate sunt imprecis definite. O serie de mecanisme au fost propuse, respectiv: efectul direct al IFN asupra sintezei de anticorpi, inhibarea celulelor T reglatoare, reglarea pozitivă a exprimării moleculelor complexului major de histocompatibilitate (CMH) de tipul I, exprimarea anormală a antigenelor CMH de clasa a II-a și activarea consecutivă a limfocitelor T helper de către autoantigene, dezechilibrul balanței T helper1/T helper2 și inducerea unui microclimat biologic citokinic proinflamator (interleukina-6, factorul de necroză tumorală)(44,45). Riscul de diabet zaharat de tipul I la pacienții cu infecție virală C sub terapie cu IFN este de 18 ori mai crescut, iar acesta poate debuta nu numai în cursul terapiei, ci și tardiv, după sistarea acesteia(46,47).
Complicarea terapiei biologice cu afecțiuni neoplazice rămâne în prezent subiect de studiu și interpretare. Inhibarea țintită a unor molecule cu rol activ antitumoral, precum factorul de necroză tumorală, ar putea, ipotetic, augmenta riscul de malignitate, însă legătura dintre acestea este dificil de susținut. Studiile privind dezvoltarea de afecțiuni neoplazice în cursul terapiei anti-TNF-alpha au demonstrat absența unui risc crescut pe termen lung, cu excepția cancerelor cutanate(48-51). De asemenea, există semne de întrebare privind asocierea pe termen lung a limfoamelor(52,53).
Întrucât reacțiile adverse produse de agenții biologici diferă de reacțiile adverse produse de alte medicamente, Pichler W.J. propune în 2006(54) o nouă clasificare a reacțiilor adverse produse de agenții biologici, care cuprinde:
- reacțiile de tipul alpha – cauzate prin excesul de citokine (ca urmare a administrării a unor doze mari de citokine, în scop terapeutic, fie prin sindromul eliberării sistemice de citokine). Exemple: manifestările pseudogripale, mialgiile, artralgiile, sindromul febril, care apar frecvent în contextul administrării de interferon alpha;
- reacțiile de tipul beta – includ reacțiile de hipersensibilitate mediate prin IgE, IgG sau limfocite T;
- reacțiile de tipul gamma – se referă la alterarea echilibrului imunologic și sunt subdivizate în funcție imună deficitară sau imunodeficiențe (de exemplu, reactivarea TB în contextul administrării de agenți anti-TNF-alpha), demascarea sau generarea unor afecțiuni mediate imunologic, precum autoimunitatea, bolile autoinflamatoare sau alergiile.
- reacțiile de tipul delta – reactivitatea încrucișată mediată de anticorpi direcționați împotriva unor ținte moleculare specifice (de exemplu, antigene tumorale) față de proteine self similare acestora sub aspect molecular;
- reacțiile de tipul epsilon – reacții adverse neimunologice, care relevă uneori efecte necunoscute ale agenților biologici administrați sau ale țintelor acestora (de exemplu, insuficiența cardiacă secundară administrării terapiei anti-TNF-alpha).
Precizarea mecanismului incriminat în reacțiile adverse la agenții biologici reprezintă adesea o adevărată provocare pentru clinician. Utile în identificarea reacțiilor de hipersensibilitate de tipul I sunt testele in vivo (test cutanat prick și intradermic) și in vitro (test de activare a bazofilelor), alături de investigarea toleranței imunologice față de acestea (testul de provocare). Confirmarea sensibilizării relevante clinic la un agent biologic impune, după caz, evitarea strictă a acestuia, optarea pentru preparate alternative sau desensibilizare(55). Hipersensibilitatea de tipul IV poate fi investigată in vivo (test cutanat patch, pozitivare tardivă a unui test intradermic) și in vitro (test de transformare limfoblastică la medicament). Interpretarea altor manifestări, precum fenomenele de autoimunitate sau asocierea unor boli neoplazice în contextul terapiei imunomodulatoare, este dificil de susținut.
Concluzii
Utilizarea agenților biologici a inaugurat o nouă eră în terapia afecțiunilor autoimune, alergice, neoplazice și numai. Utilitatea clinică a acestora este limitată uneori de apariția reacțiilor adverse. Terapia imunomodulatoare influențează răspunsul imun, precum și alte funcții biologice, ceea ce explică deopotrivă beneficiile clinice și reacțiile adverse imune și neimune ale acesteia. Succesul tratamentului imunomodulator este condiționat de selectarea eficientă a pacienților, așa încât cunoașterea potențialelor reacții adverse constituie un criteriu esențial în abordarea corectă a pacientului cu indicație de terapie biologică.
Bibliografie
- Demoly P, Adkinson NF, Brockow K, et al. International Consensus on drug allergy. Allergy.2014;69(4):420-37.
- Rawlins MD and Thompson JW (1977). Pathogenesis of adverse drug reactions. In Textbook of Adverse Reactions, Davies DM (ed.). 44.
- Johansson SG, Bieber T, Dahl R, et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 2004; 113:832.
- Weinblatt ME, Schiff M, Valente R, et al. Head-to-head comparison of subcutaneous abatacept versus adalimumab for rheumatoid arthritis: findings of a phase IIIb, multinational, prospective, randomized study. Arthritis Rheum 2013; 65:28.
- Moreland LW, Baumgartner SW, Schiff MH, et al. Treatment of rheumatoid arthritis with a recombinant human tumor necrosis factor receptor (p75)-Fc fusion protein. N Engl J Med 1997; 337:141.
- Emery P, Vencovský J, Sylwestrzak A, et al. A phase III randomised, double-blind, parallel-group study comparing SB4 with etanercept reference product in patients with active rheumatoid arthritis despite methotrexate therapy. Ann Rheum Dis 2017; 76:51.
- Smolen J, Landewé RB, Mease P, et al. Efficacy and safety of certolizumab pegol plus methotrexate in active rheumatoid arthritis: the RAPID 2 study. A randomised controlled trial. Ann Rheum Dis 2009; 68:797.
- Weinblatt ME, Fleischmann R, Huizinga TW, et al. Efficacy and safety of certolizumab pegol in a broad population of patients with active rheumatoid arthritis: results from the REALISTIC phase IIIb study. Rheumatology (Oxford) 2012; 51:2204.
- Keystone EC, Genovese MC, Klareskog L, et al. Golimumab, a human antibody to tumour necrosis factor {alpha} given by monthly subcutaneous injections, in active rheumatoid arthritis despite methotrexate therapy: the GO-FORWARD Study. Ann Rheum Dis 2009; 68:789.
- Cheifetz A, Smedley M, Martin S, et al. The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol 2003; 98:1315.
- Cheifetz A, Mayer L. Monoclonal antibodies, immunogenicity, and associated infusion reactions. Mt Sinai J Med 2005; 72:250.
- Vultaggio A, Matucci A, Nencini F, et al. Anti-infliximab IgE and non-IgE antibodies and induction of infusion-related severe anaphylactic reactions. Allergy 2010; 65:657.
- Banerji.A, Brennan P, Hesterberg P, et al. Drug desensitization in the management of allergy and anaphylaxis to chemotherapeutic agents and monoclonal antibodies. Chapter 19 in: Anaphylaxis and hypersensitivity reactions, Castells Mced, Humana Press. Springer Science-Bussines Media, LLC 2011, 297-311.
- Bendtzen K, Geborek P, Svenson M, et al. Individualized monitoring of drug bioavailability and immunogenicity in rheumatoid arthritis patients treated with the tumor necrosis factor alpha inhibitor infliximab. Arthritis Rheum 2006; 54:3782.
- Wolbink GJ, Vis M, Lems W, et al. Development of antiinfliximab antibodies and relationship to clinical response in patients with rheumatoid arthritis. Arthritis Rheum 2006; 54:711.
- Baert F, Noman M, Vermeire S, et al. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn’s disease. N Engl J Med 2003; 348:601.
- Haraoui B, Cameron L, Ouellet M, White B. Anti-infliximab antibodies in patients with rheumatoid arthritis who require higher doses of infliximab to achieve or maintain a clinical response. J Rheumatol 2006; 33:31.
- Vincent FB, Morand EF, Murphy K, et al. Antidrug antibodies (ADAb) to tumour necrosis factor (TNF)-specific neutralising agents in chronic inflammatory diseases: a real issue, a clinical perspective. Ann Rheum Dis 2013; 72:165.
- Radstake TR, Svenson M, Eijsbouts AM, et al. Formation of antibodies against infliximab and adalimumab strongly correlates with functional drug levels and clinical responses in rheumatoid arthritis. Ann Rheum Dis 2009; 68:1739.
- Bartelds GM, Krieckaert CL, Nurmohamed MT, et al. Development of antidrug antibodies against adalimumab and association with disease activity and treatment failure during long-term follow-up. JAMA 2011; 305:1460.
- Zhou H, Jang H, Fleischmann RM, et al. Pharmacokinetics and safety of golimumab, a fully human anti-TNF-alpha monoclonal antibody, in subjects with rheumatoid arthritis. J Clin Pharmacol 2007; 47:383.
- Bugelski PJ, Achuthanandam R, Capocasale RJ, et al. Monoclonal antibody-induced cytokine-release syndrome. Exp Rev Clin Immunol, 2009; 5:499-521.
- Vogel WH. Infusion reactions: diagnosis, assessment, and management. Clin J Oncol Nursing, 2010; 14:E10–E21.
- Wing M. Monoclonal antibody first dose cytokine release syndrome: mechanisms and prediction. J Immunotoxicol, 2008; 5:11-15.
- Cheifetz A, Smedley M, Martin S, et al. The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol 2003; 98:1315.
- Lecluse LLA, Piskin G, Mekkes JR, et al. Review and expert opinion on prevention and treatment of infliximab-related infusion reactions. Br J Dermatol, 2008; 159:527-536.
- Colombel JF, Loftus EV Jr, Treimane WJ, et al. The safety profile of infliximab inpatients with Crohn’s disease: the Mayo clinic experience in 500 patients. Gastroenterology, 2004; 126:19- 31.
- Sany J, Kaiser MJ, Jorgensen C, et al. Study of the tolerance of infliximab infusions with or without betamethasone premedication in patients with active rheumatoid arthritis. Ann Rheum Dis, 2005; 1647-1649.
- Hastings R, Ding T, Butt S, et al. Neutropenia in patients receiving anti-tumor necrosis factor therapy. Arthritis Care Res (Hoboken) 2010; 62:764.
- Tesfa D, Ajeganova S, Hägglund H, et al. Late-onset neutropenia following rituximab therapy in rheumatic diseases: association with B lymphocyte depletion and infections. Arthritis Rheum 2011; 63:2209.
- Salmon JH, Cacoub P, Combe B, et al. Late-onset neutropenia after treatment with rituximab for rheumatoid arthritis and other autoimmune diseases: data from the AutoImmunity and Rituximab registry. RMD Open 2015; 1:e000034.
- Popa C, Leandro MJ, Cambridge G, Edwards JC. Repeated B lymphocyte depletion with rituximab in rheumatoid arthritis over 7 years. Rheumatology (Oxford) 2007; 46:626.
- Cohen SB, Emery P, Greenwald MW, et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum 2006; 54:2793.
- Koo S, Marty FM, Baden LR. Infectious complications associated with immunomodulating biologic agents. Infect Dis Clin North Am 2010; 24:285.
- Smolen JS, Keystone EC, Emery P, et al. Consensus statement on the use of rituximab in patients with rheumatoid arthritis. Ann Rheum Dis 2007; 66:143.
- Gelinck LB, Teng YK, Rimmelzwaan GF, et al. Poor serological responses upon influenza vaccination in patients with rheumatoid arthritis treated with rituximab. Ann Rheum Dis 2007; 66:1402.
- Kwon HJ, Coté TR, Cuffe MS, et al. Case reports of heart failure after therapy with a tumor necrosis factor antagonist. Ann Intern Med 2003; 138:807.
- Khasnis AA, Calabrese LH. Tumor necrosis factor inhibitors and lung disease: a paradox of efficacy and risk. Semin Arthritis Rheum 2010; 40:147.
- Dixon WG, Hyrich KL, Watson KD, et al. Influence of anti-TNF therapy on mortality in patients with rheumatoid arthritis-associated interstitial lung disease: results from the British Society for Rheumatology Biologics Register. Ann Rheum Dis 2010; 69:1086.
- Collamer AN, Battafarano DF. Psoriatic skin lesions induced by tumor necrosis factor antagonist therapy: clinical features and possible immunopathogenesis. Semin Arthritis Rheum 2010; 40:233.
- Atzeni F, Talotta R, Salaffi F, et al. Immunogenicity and autoimmunity during anti-TNF therapy. Autoimmun Rev 2013; 12:703.
- Ramos-Casals M, Roberto-Perez-Alvarez, Diaz-Lagares C, et al. Autoimmune diseases induced by biological agents: a double-edged sword? Autoimmun Rev 2010; 9:188.
- Perez-Alvarez R, Pérez-de-Lis M, Ramos-Casals M, BIOGEAS study group. Biologics-induced autoimmune diseases. Curr Opin Rheumatol 2013; 25:56.
- Scully LJ, Brown D, Lloyd C, et al. Immunological studies before and during interferon therapy in chronic HBV infection: identification of factors predicting response. Hepatology 1990; 12:1111.
- Itoh Y, Okanoue T, Enjyo F, et al. Elevated interleukin-6 and gamma-globulin during interferon therapy of hepatitis B. Am J Gastroenterol 1992; 87:1485.
- Nakamura K, Kawasaki E, Imagawa A, et al. Type 1 diabetes and interferon therapy: a nationwide survey in Japan. Diabetes Care 2011; 34:2084.
- Zornitzki T, Malnick S, Lysyy L, Knobler H. Interferon therapy in hepatitis C leading to chronic type 1 diabetes. World J Gastroenterol 2015; 21:233.
- Mariette X, Matucci-Cerinic M, Pavelka K, et al. Malignancies associated with tumour necrosis factor inhibitors in registries and prospective observational studies: a systematic review and meta-analysis. Ann Rheum Dis 2011; 70:1895.
- Askling J, Fahrbach K, Nordstrom B, et al. Cancer risk with tumor necrosis factor alpha (TNF) inhibitors: meta-analysis of randomized controlled trials of adalimumab, etanercept, and infliximab using patient level data. Pharmacoepidemiol Drug Saf 2011; 20:119.
- Dommasch ED, Abuabara K, Shin DB, et al. The risk of infection and malignancy with tumor necrosis factor antagonists in adults with psoriatic disease: a systematic review and meta-analysis of randomized controlled trials. J Am Acad Dermatol 2011; 64:1035.
- Thompson AE, Rieder SW, Pope JE. Tumor necrosis factor therapy and the risk of serious infection and malignancy in patients with early rheumatoid arthritis: a meta-analysis of randomized controlled trials. Arthritis Rheum 2011; 63:1479.
- Parakkal D, Sifuentes H, Semer R, Ehrenpreis ED. Hepatosplenic T-cell lymphoma in patients receiving TNF-α inhibitor therapy: expanding the groups at risk. Eur J Gastroenterol Hepatol 2011; 23:1150.
- Mercer LK, Regierer AC, Mariette X, et al. Spectrum of lymphomas across different drug treatment groups in rheumatoid arthritis: a European registries collaborative project. Ann Rheum Dis 2017.
- Pichler WJ. Adverse side-effects to biological agents. Allergy 2006; 61(8):912–920
- Demirel F, Kartal O, Gulec M et al. Desensitization to Adalimumab: An Example of Repeated Desensitization to a Biological Agent. Drug Saf Case Rep. 2015; 2(1): 7.