Chronic pancreatitis is a major health problem of the population, which is often neglected due to poor symptoms, diagnostic methods with moderate specificity and, especially, the need for long-term administration of the treatment. For the proper selection of the treatment, it is necessary to take into account the particularities of the drug forms, the significance of the origin of pancreatin and the doses of pancreatic enzymes, the appropriate selection of doses, drug forms and the principles of administration of substitution drugs. The practitioner must carefully analyze the particularities of the evolution of chronic pancreatitis and the concomitant diseases in order to properly select the drug, doses and the dosing regimen for a specific patient.
Preparatele cu enzime de substituţie pancreatică – observaţii şi recomandări
Preparations of pancreatic substitution enzymes – considerations and recommendations
First published: 06 mai 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.194.3.2020.3533
Abstract
Rezumat
Pancreatita cronică reprezintă o problemă majoră de sănătate a populaţiei, care deseori este neglijată din cauza simptomatologiei sărace, a metodelor de diagnosticare cu o specificitate moderată şi, îndeosebi, a necesităţii utilizării de durată a tratamentului. Pentru selectarea adecvată a tratamentului este necesar să fie luate în considerare particularităţile formelor medicamentoase, semnificaţia provenienţei pancreatinei şi a dozelor enzimelor pancreatice, alături de selectarea adecvată a dozelor şi formelor medicamentoase şi a principiilor de administrare a preparatelor de substituţie. Medicul practician trebuie să analizeze minuţios particularităţile evoluţiei pancreatitei cronice şi maladiile concomitente, pentru a selecta adecvat preparatul, dozele şi regimul de dozare la fiecare pacientul.
Prevalenţa pancreatitei cronice la populaţia generală în contextul bolilor cronice este rar estimată în studiile epidemiologice. Într-o evaluare bazată pe interogarea populaţiei dintr-un stat din SUA, s-a raportat că prevalenţa pancreatitei cronice a fost de 42 la 100 000 de persoane. Prevalenţa a fost cea mai mare în grupa de vârstă 45-74 de ani, iar la bărbaţi, comparativ cu femeile, a fost de 52 faţă de 34 la 100 000 de persoane. Conform unui sondaj realizat la nivel naţional în Japonia, prevalenţa a fost similară – de 52 la 100 000 de persoane(3,9,7,11).
Beneficiile tratamentului insuficienţei exocrine a pancreasului au determinat revizuirea recomandărilor referitoare la utilizarea preparatelor de substituţie enzimatică la pacienţii cu pancreatită cronică, neoplasm pancreatic şi chirurgie postpancreatică. Cu toate acestea, majoritatea studiilor sugerează că o bună parte dintre pacienţi nu sunt trataţi sau administrează doze insuficiente. Într-un studiu european s-a raportat că circa 25% dintre pacienţii cu insuficienţă exocrină a pancreasului, cauzată de pancreatită cronică sau de cancer pancreatic, au administrat trei sau mai puţine capsule pe zi, iar la peste doua treimi dintre pacienţi s-au menţinut simptome de steatoree. Un alt sondaj a estimat că pacienţii cu pancreatită cronică şi insuficienţă exocrină a pancreasului au utilizat doze zilnice suboptimale de enzime pancreatice, iar majoritatea pacienţilor au raportat simptome gastrointestinale, inclusiv steatoree şi pierdere în greutate. O analiză a populaţiei cu pancreatită cronică a demonstrat că doar 6,5% dintre pacienţi au fost testaţi referitor la insuficienţa exocrină a pancreasului, la 30,4% li s-a prescris o reţetă pentru preparatele enzimatice şi doar 10% au primit o doză minimă eficientă. O analiză similară a pacienţilor cu cancer pancreatic a demonstrat că numai 1,9% dintre pacienţi au făcut teste pentru diagnosticarea insuficienţei exocrine a pancreasului şi la 22% li s-a eliberat o reţetă pentru preparatele enzimatice, dintre care 5,5% au folosit o doză adecvată. Aceste studii evidenţiază faptul că pacienţii cu insuficienţă exocrină a pancreasului sunt rar supuşi testelor de diagnosticare, iar tratamentul cu preparate de substituţie este prescris rar şi deseori este realizat cu doze inadecvate(6).
Diversitatea preparatelor de substituţie a sucului pancreatic este determinată de: principiile active (pancreatină, extract de bilă, hemicelulază, extract din plante, adsorbanţi, enzime vegetale sau fungice, lactază etc.), doza de pancreatină (lipază, amilază, proteaze) şi de formele medicamentoase (comprimate obişnuite, comprimate şi capsule gastrorezistente sau enterosolubile, capsule cu microsfere, minimicrosfere etc.). În funcţie de componenţă şi de doza de pancreatină, preparatele enzimatice de substituţie se subîmpart în:
A. Preparate monocomponente
(conţin doar pancreatină):
1) cu doze mici de pancreatină (<10 000 UL) – pancreatină, prodigestiv, pancitrat, prolipază, orază, creon, eurobiol, pancreon, pangrol, triferment, mezim-forte, licrează etc.;
2) cu doze majore de pancreatină (>25 000 UL) – pro-digestiv, pancreon, eurobiol, pancitrat, solizim, somilază, pancrelipază, creon 25;
B. Preparate combinate:
1) pancreatină + extract de bilă + hemicelulază (celulază) – digestal, festal, ferestal, forte enzim, panstal, pancral, cadistal, menzim, cotazim forte, rustal, tagestal, enzistal, panolaz, ipental etc.;
2) pancreatină + extract de bilă + extract din mucoasa gastrică – panzinorm forte;
3) pancreatină + extract de bilă + extract din plante – enzimtal, pepfiz, orază, solizim, pepzim, merchezim, nutrizim, pancurmen;
4) pancreatină + substanţe adsorbante – pancreoflet, pepfiz, enzimtal etc.;
5) preparate pe bază de enzime vegetale sau fungice: enzimtal, orază, louizim, solizim, elzim, milază-100, pepfiz sau asocierea acestora cu pancreatină – combizim forte, digolază, rosim etc.;
6) preparate pe bază de lactază – lactază, tilactază sau combinate (digest 365 etc.)(15,27)
Analiza componenţei preparatelor enzimatice de substituţie este importantă pentru selectare acestora în funcţie de prezenţa insuficienţei pancreatice şi a maladiilor concomitente (gastrită hipoacidă, colecistită cronică, meteorism etc.). În acest context este important să menţionăm efectele farmacologice ale componentelor.
Astfel, pancreatina prin lipază exercită acţiune lipolitică, amilaza – amilolitică, proteazele – proteolitice, ceea ce duce la ameliorarea digestiei şi asimilării, înlăturarea flatulenţei, stabilizarea masei corporale, ameliorarea diareei şi steatoreei. Extractul de bilă este responsabil de realizarea efectului coleretic, de emulsionarea lipidelor, de creşterea activităţii şi secreţiei lipazei pancreatice şi de absorbţia vitaminelor liposolubile. Extractele din plante vor manifesta activitate proteolitică la valori largi ale pH-ului (proteaze), vor stimula formarea şi secreţia bilei şi vor creşte activitatea lipazei. Hemicelulaza sau celulaza vor contribui la scindarea glucidelor, fibrelor nedigerabile, micşorarea proceselor de fermentaţie şi a meteorismului şi la normalizarea scaunului. Adsorbanţii (dimetilpolisiloxanul, cărbunii activi, simeticona etc.) vor manifesta acţiune adsorbantă, cu efect antispumant şi vor reduce meteorismul(27).
Preparatele enzimatice microbiene şi fungice sunt obţinute prin fermentaţie, care este un proces natural şi este realizat de microorganismele prezente în alimente. Enzimele de origine vegetală, bacteriană şi fungică, spre deosebire de cele animaliere, îşi păstrează activitatea la un pH larg, de la 3 la 9, şi cu o biodisponibilitate bună, respectiv nu au nevoie de o acoperire fiabilă rezistentă la acid şi/sau de administrare de antisecretorii. Hidrolazele microbiene sunt eliberate în stomac, ceea ce asigură o hidroliză anterioară şi mai uniformă a substraturilor alimentare. Stabilitatea într-un mediu acid al lipazei de origine microbiană, fungică şi vegetală este deosebit de importantă, deoarece conservarea activităţii sale este crucială pentru a asigura eficacitatea terapiei de substituţie. Este importantă păstrarea activităţii lipazei şi în caz de acidifiere a conţinutului duodenal, cu o scădere a producţiei de bicarbonat pancreatic în cazul insuficienţei pancreatice exocrine severe. La pacienţii cu pancreatită cronică şi hipoaciditate gastrică sau rezecţie gastrică, prezenţa unui mediu neutru sau alcalin este defavorabilă pentru preparatele enzimatice de origine animalieră care conţin microsfere. În acest caz, dizolvarea capsulei este mai lentă şi se reţine eliberarea enzimelor şi amestecarea acestora cu alimentele, în timp ce evacuarea bolului alimentar din stomac este accelerată. Enzimele de origine microbiană şi fungică nu trebuie să fie încapsulate, deoarece sunt active într-o gamă largă a nivelului de pH(15,21).
Un alt avantaj al lipazei de origine microbiană este absenţa necesităţii activării ei de către acizii biliari. Lipaza de origine animală, pentru a asigura lipoliza, necesită activare prin prezenţa acizilor biliari, situaţie dificilă în caz de deficienţă de bilă în duoden patologia hepatică şi/sau biliară. Suplimentarea cu componente biliare sau coleretice a preparatelor de origine animalieră poate cauza efecte nedorite (creşte presiunea osmotică, se dezvoltă diaree osmotică şi secretorie, creşte sarcina funcţională asupra ficatului, este afectată mucoasa tubului digestiv). Lipaza bacteriană (dar nu fungică) nu este inactivată de acizii biliari la concentraţii obişnuite, fapt important la pacienţii cu insuficienţa sfincterului Oddi şi după colecistectomie, când este posibil un exces de acizi biliari în lumenul duodenului(15,21).
Enzimele de origine microbiană, fungică şi vegetală au o specificitate mai largă a substratului decât în enzimele animale, din aceste considerente nu necesită introducerea obligatorie a unor componente suplimentare de hidrolizare (celulază/hemicelulază). Suplimentarea acestora în unele preparate (Digest 365®) este argumentată pentru ameliorarea flatulenţei. Preparatele de origine microbiană, vegetală şi fungică sunt rezistente la proteazele care reduc activitatea lipazei şi la inhibitorii enzimei pancreatice, care determină menţinerea activităţii şi au un efect terapeutic mai adecvat. Enzimele de origine microbiană, fungică şi vegetală nu suprimă secreţia pancreatică sau chiar pot să o stimuleze, datorită faptului că mecanismele de feedback, care sunt incluse în duoden ca răspuns la aportul de enzime de origine extrinsecă, nu au loc ca urmare a diferenţelor de structură. Preparatele respective pot fi utilizate la pacienţii cu hipersensibilitate la pancreatină(15).
Preparatele pe bază de lactază (Digest 365®) sunt utilizate în caz de deficienţă de lactoză (cu o frecvenţă de 12‑93%), manifestată prin dispepsie intestinală (flatulenţă, diaree) la utilizarea produselor care conţin lactoză (produsele lactate). Preparatul Digest 365® are o activitate lipolitică mai mică faţă de preparatele pancreatinei, dar datorită priorităţilor enumerate mai sus, patogenetic asigură un efect terapeutic în cazul dispepsiei de diferite origini (aport excesiv, schimbul naturii hranei în timpul călătoriilor etc.). Medicamentul poate fi prescris ca parte a terapiei complexe pentru pacienţii cu pancreatită cronică uşoară, cu rezultate normale ale testului de elastază fecală, dar cu dispepsie, la pacienţii cu diabet zaharat, în pregătirea pentru investigaţii radiologice sau pentru examenul ultrasonografic(15).
Insuficienţa exocrină a pancreasului poate fi determinată de patologia pancreatică [pancreatita cronică (30-90%), pancreatita acută (15-40%), pancreatita autoimună (30-60%), cancerul pancreatic (20‑60%), tumora benignă a pancreasului (30-60%), fibroza chistică (80-90%), pancreatoduodenoectomia (20‑90%)] şi extrapancreatică: diabet zaharat tip 1 (30-50%) şi tip 2 (20-30%), colita ulceroasă (10%), boala Crohn (4%), celiachia (5-80%), gastrectomia (40‑80%), sindromul Sjögren (10‑30%), fumatul (10‑24%), alcoolul (20-70%), infecţia cu HIV (10‑50%), sindromul Zollinger-Ellison etc.(2,4,5,10,11,12,14,17,23).
Insuficienţa exocrină a pancreasului se poate manifesta în diferite maladii şi stări patologice, de aceea indicaţiile preparatelor de substituţie enzimatică pot fi destul de variate, precum:
I. Tratamentul complex:
-
pancreatită cronică (jugularea sindromului algic, terapia de substituţie a hipofuncţiei exocrine cu malabsorbţie şi maldigestie);
-
gastrite hipoacide fără leziuni ale mucoasei;
-
dischinezia căilor biliare;
-
hepatite cronice, ciroze hepatice;
-
colecistite cronice, hepatocolecistite;
-
mucoviscidoză;
-
celiachie;
-
cancer pancreatic;
-
gastroduodenoectomie;
-
maladii inflamatorii ale intestinului (colita ulcerativă, boala Crohn).
II. Monoterapia sau terapia combinată a dereglărilor funcţionale ale tubului digestiv:
-
sindromul dispepsiei funcţionale neulcerogene;
-
dereglări disfuncţionale ale tractului biliar;
-
meteorism;
-
sindromul colonului iritabil cu predominanţa diareei.
III. Tratamentul complex al infecţiilor intestinale.
IV. Cu scop profilactic la pacienţii cu pancreatită cronică, colecistită, în perioada de remisiune a maladiei (lichidarea duodenostazei).
V. După necesitate, în caz de abuzuri alimentare, trecerea la un regim alimentar impus.
VI. Alte indicaţii:
-
micşorarea funcţională a funcţiei stomacului şi pancreasului;
-
dereglările postrezecţionale, sindromul intestinului scurt(12,13,17).
Pancreasul de porcine este cea mai comună sursă de enzime pancreatice şi toate produsele disponibile conţin un amestec de amilază, lipază şi proteaze derivate din porcine. Lipaza este principala enzimă pancreatică, a cărei funcţie este abia compensată prin mecanisme extrapancreatice şi este enzima cu cea mai scăzută rezistenţă la acid şi proteoliză. În funcţie de aceasta, preparatele enzimatice pot fi livrate sub formă de comprimate obişnuite, comprimate sau capsule gastrorezistente şi capsule care conţin microsfere şi minimicrosfere.
Forma medicamentoasă va determina unele avantaje şi dezavantaje pentru prescrierea şi utilizarea raţională a preparatelor enzimatice de substituţie (tabelul 1).
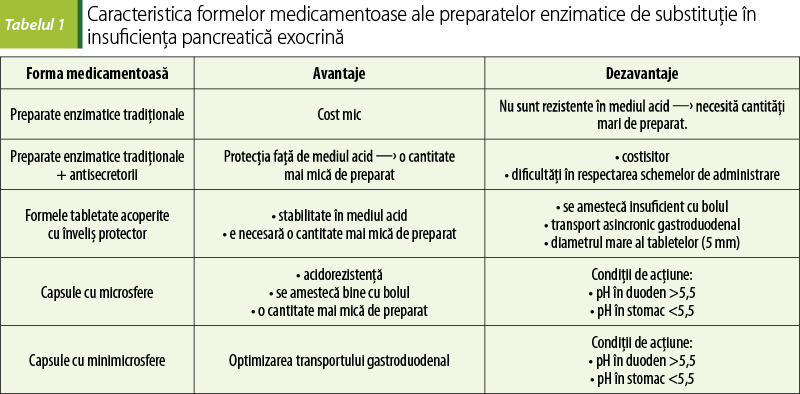
Faptul că predomină medicamentele sub formă de comprimate sau capsule gastrorezistente este explicabil datorită intenţiei de a proteja enzimele pancreatice de inactivarea în stomac de către pepsină şi acidul clorhidric (mediul acid).
Medicamentele gastrorezistente, deşi protejează enzimele de inactivarea de acidul clorhidric şi de pepsină, nu asigură o amestecare eficientă cu bolul alimentar, ceea ce determină o eliberare discordantă cu alimentele şi începutul mai tardiv al acţiunii în lumenul duodenului şi intestinului subţire, neasigurând astfel un contact suficient pentru digestia şi asimilarea produselor alimentare.
Preparatele moderne sunt administrate sub formă de capsule cu minimicrosfere, acoperite cu un înveliş solubil la pH-ul gastric, cu eliberarea minimicrosferelor rezistente la mediu acid, care se amestecă cu bolul alimentar, având dimensiuni sub 2 mm, ulterior complexul bol alimentar – minimicrosfere fiind eliberat în duoden. Aici, la un pH de peste 5,5, învelişul se dizolvă cu eliberarea enzimelor care interacţionează cu componentele bolului alimentar, le scindează şi apoi are loc absorbţia substanţelor nutritive. Din acest motiv, preparatele enzimatice trebuie administrate odată cu mesele şi gustările, pentru a imita producţia de enzime postprandiale la indivizii sănătoşi(1,2,5,13,17,23,25).
Preparatele enzimatice obişnuite, neprotejate de acţiunea pepsinei şi acidului clorhidric, au o eliberare imediată a enzimelor pancreatice, acestea fiind inactivate de sucul gastric, iar pentru protejarea lor ar fi necesar de utilizat concomitent antiacide sau antisecretorii (IPP, H2-HB etc.), pentru a asigura activitatea maximă în duoden(2,5,13,17,23,25).
Discuţiile, în acest context, sunt axate pe dezavantajele multiple care fac ca preparatele obişnuite să nu fie recomandate, iar pe de altă parte, se aduc argumente pentru posibilitatea utilizării lor în tratamentul insuficienţei exocrine a pancreasului, cu condiţia respectării unor reguli stricte, reieşind din particularităţile anatomofiziologice ale tubului digestiv şi din principiile de acţiune a enzimelor pancreatice. Se estimează că pepsina, care prezintă cel mai mare pericol pentru enzimele pancreatice, este puţin probabil să se cupleze mai ales cu lipaza, proteină cu masă moleculară mică, deoarece ţinta principală sunt moleculele alimentare mai mari. Enzimele pancreatice se eliberează şi în stomac, unde încep să digere alimentele cu mult înainte de a ajunge la locul lor fiziologic în duoden şi în intestinul subţire. Procesul de digestie începe în partea superioară a stomacului, unde mâncarea poate rămâne până la o oră înainte de a se amesteca cu sucul gastric, iar enzimele pancreatice sunt protejate de efectele pepsinei şi ale pH-ului. De asemenea, s-a estimat că amilaza din salivă ajunge în stomac, unde digeră circa 40% din amidonul consumat cu alimentele până acesta ajunge în intestinul subţire. Această legitate poate fi valabilă şi pentru enzimele pancreatice sub formă de medicamente. O protecţie naturală a preparatelor enzimatice de pH-ul acid al stomacului este asigurată de unele alimente care servesc ca un sistem-tampon care face mediul mai puţin acid. Această stare poate fi asigurată prin utilizarea antiacidelor (preponderent hidrocarbonatul de sodiu) şi a preparatelor antisecretorii (IPP, H2-HB etc.) cu deplasarea pH-ului stomacului până la un nivel >4. În acest context apar recomandările de a folosi un comprimat (650 mg) de hidrocarbonat de sodiu odată cu preparate enzimatice şi câte un comprimat la una şi la două ore după fiecare masă. Dintre preparatele antisecretorii, mai eficiente s-au dovedit a fi IPP – omeprazolul de câte 20 mg, ceea ce permite menţinerea pH-ului la nivelul de 3-4(1,24).
La evacuarea conţinutului gastric, enzimele, eliberate din comprimatele preparatelor neprotejate, încep să acţioneze în duoden şi partea proximală a intestinului subţire. Viabilitatea enzimelor va depinde de viteza de golire a stomacului – cu cât este mai mare, cu atât mai multe enzime active ajung în duoden. Enzimele din preparatele cu o membrană protectoare care se dizolvă în intestin sunt bine conservate în stomac şi sunt livrate integral în duoden şi în intestinul subţire. Este cunoscut faptul că acidul clorhidric acidifică pH-ul din duoden şi atunci membrana protectoare nu se poate dizolva aici. Ca rezultat, enzimele sunt eliberate mai distal – în jejunul distal, în ileon sau chiar în intestinul gros. Pentru a creşte eficacitatea acestui regim de tratament, acesta poate fi suplimentat cu IPP (omeprazol 40 mg/zi) şi/sau antiacide (bicarbonat de sodiu 650 mg, un comprimat în timpul fiecărei mese şi la 1 şi 2 ore după aceasta)(24).
Determinarea dozei ideale de preparate de substituţie pentru pacient poate fi dificilă, deoarece răspunsul la tratament este foarte variabil. Aceasta poate fi determinată de forma medicamentoasă (preparate obişnuite, forme gastrorezistente sau enterosolubile, medicamente sub formă de microsfere, minimicrosfere etc.), de gradul şi evoluţia insuficienţei pancreatice, respectarea dietei (conţinutul de lipide etc.), costul medicamentului şi asigurarea medicală(1,5,16,17,25).
Recomandările privind dozele preparatelor de substituţie enzimatică în pancreatita cronică depind de particularităţile fiecărui pacient în parte. Scopul terapiei este normalizarea stării nutriţionale şi ameliorarea simptomelor. În acest context, dozarea corectă ar putea începe cu 25 000‑50 000 UI de lipază la masa principală la adulţi şi 20 000 UI la gustare. Terapia optimă cu preparatele de substituţie se bazează pe eficacitatea clinică. Din aceste considerente, doza iniţială poate fi dublată sau triplată în funcţie de necesitatea clinică şi de rezultate(2,8,12,13,18,20).
Studii multiple au estimat că, pentru combaterea steatoreei, la fiecare masă ar fi necesare cel puţin 30 000 UI de lipază, care reprezintă aproximativ 10% din secreţia normală pancreatică. Scopul nu este înlocuirea a 100% din funcţia estimată a pancreasului, deoarece steatoreea se dezvoltă doar în bolile severe. Prin urmare, dozele iniţiale ar trebui să fie cuprinse între 30 000 şi 40 000 UI de lipază la fiecare masă şi 15 000‑20 000 UI cu gustări. Pacienţii trebuie instruiţi să ia jumătate din doza totală la începutul mesei şi cealaltă jumătate fie în timpul mesei, fie la sfârşitul mesei. În necesitatea administrării de doze mai mari, se vor prescrie capsule cu o doză mai mare de lipază sau sub formă de minimicrosfere, ceea ce va reduce numărul de capsule necesare şi va îmbunătăţi respectarea regimului prescris(1,8,16,22,27).
Preparatele enzimatice de substituţie trebuie să fie repartizate la mese în funcţie de durata acestora şi de cantitatea alimentelor (lipidelor). Astfel, dacă durata consumului unei mese este mai mică de 15 minute, toate enzimele pot fi luate la începutul mesei; pentru o masă de 15-30 de minute se recomandă administrarea a jumătate din capsulele enzimatice la început şi cealaltă jumătate la mijlocul mesei; pentru o masă de peste 30 de minute se recomandă folosirea a o treime din preparate la început, o treime la mijloc şi o treime la sfârşit. Scopul modalităţii respective de administrare a enzimelor pancreatice pe parcursul mesei este de a imita secreţia de enzime pancreatice endogene, pe parcursul unei mese. În acelaşi timp, cu cât este mai mare volumul de alimente ingerate şi/sau conţinutul de grăsimi din dietă, cu atât este mai mare cantitatea de enzime pancreatice endogene secretate şi, respectiv, numărul de capsule medicamentoase consumate (doza de lipază) ar trebui să fie adecvat. În acest context s-a făcut o estimare aproximativă a cantităţii de enzime pancreatice necesare (exprimate prin doza de lipază) pentru diferite grupe de vârstă: sugar – 2 000–4 000 UI/120 ml lapte matern; copii până la 4 ani – 1 000 UI/kg/masa de bază şi 500 UI/kg/gustare; copii peste 4 ani – 500 UI/kg/masa de bază şi 250 UI/kg/gustare; pentru adulţi – iniţial 50 000 UI/masa de bază şi 25 000 UI/gustare; pentru adulţi – maximum 150 000 UI/masa de bază şi 70 000 UI/gustare(12).
În alte cazuri de insuficienţă exocrină a pancreasului (fibroză chistică, cancer pancreatic, intervenţii gastrointestinale etc.), dozele standard ale preparatelor de substituţie ar putea fi insuficiente pentru a îmbunătăţi starea nutriţională, de aceea acestea pot fi crescute. În aceste situaţii, dacă nu se obţine un răspuns adecvat la dozele selectate, este necesară verificarea respectării regimului prescris. Dacă respectarea este adecvată, se recomandă o creştere a dozei preparatelor de substituţie pas cu pas. Se poate ajunge la o doză de 80 000 UI de lipază la o masă, iar în cazul răspunsului insuficient, tratamentul se poate suplimenta cu un antisecretor sau antiacid, pentru a reduce inactivarea lipazei(2,12,18).
Răspunsul la tratamentul de substituţie cu enzime pancreatice trebuie evaluat prin ameliorarea simptomelor (consistenţa scaunelor, prezenţa lipidelor în scaun) şi creşterea în greutate, iar monitorizarea acestora poate ajuta la controlul răspunsului la tratament. Determinarea elastazei în masele fecale nu va fi afectată de tratamentul de substituţie şi nu trebuie utilizată pentru ajustarea dozei. Vitaminele liposolubile trebuie verificate periodic, pentru a asigura suplimentarea adecvată. Concomitent, pacienţii trebuie instruiţi şi reevaluaţi, îndeosebi cei care nu răspund adecvat la terapia de substituţie, în vederea respectării tratamentului şi momentului corect de administrare a dozelor în raport cu mesele(1,16).
Cel mai frecvent motiv al eşecului terapeutic în cazul insuficienţei pancreatice exocrine este dozarea inadecvată. La pacienţii care administrează preparatele de substituţie corect, primul pas ar fi dublarea dozei. În cazul răspunsului inferior s-ar putea recurge la utilizarea de inhibitori ai pompei de protoni (IPP) sau H2-histaminoblocantelor (H2-HB) pentru suprimarea acidităţii sucului gastric şi creşterea disponibilului de enzime. O altă modalitate de abordare a eşecului terapeutic se va reduce la evaluarea formelor medicamentoase utilizate de pacient, care vor asigura amestecarea corespunzătoare a enzimelor cu alimentele şi evacuarea împreună în duoden. Limitarea drastică a aportului de lipide trebuie evitată, deoarece este necesară o absorbţie adecvată a vitaminelor liposolubile, cu scopul prevenirii hipovitaminozelor(1,5).
Pentru tratamentul durerii în pancreatita cronică se recomandă administrarea preparatelor enzimatice neprotejate cu o doză de minimum 400-800 UI de proteaze la fiecare masă, timp de 6-8 săptămâni. Dacă se obţine un efect pozitiv, se recomandă continuarea tratamentului până la 6 luni. După această perioadă, terapia poate fi întreruptă. În acest caz, aproximativ jumătate dintre pacienţi nu vor avea o recidivă a durerii, iar la cealaltă jumătate va apărea din nou. La acest subgrup va fi nevoie de un aport constant de preparate enzimatice(5,24).
În cazul preparatelor enzimatice gastrorezistente sau enterosolubile, îndeosebi cu doze mari de proteaze, pentru reducerea acidităţii în stomac şi, ulterior, pentru a obţine un pH favorabil în duoden şi în intestinul subţire (peste 5,5), se pot asocia antisecretoarele gastrice – H2-histaminoblocantele – şi, preferabil, inhibitorii pompei protonice. Odată cu micşorarea secreţiei sucului gastric se vor reduce eliberarea secretinei şi colecistochininei şi, respectiv, secreţia pancreatică şi sinteza enzimelor. Aceasta va determina micşorarea presiunii intrapancreatice şi în duct, iar distensia capsulei pancreatice se va diminua, respectiv durerea va fi anihilată. Concomitent cu efectul antisecretor, H2-histaminoblocantele pot reduce generarea radicalilor liberi, inclusiv a produselor de neutrofile, cu micşorarea stresului oxidativ şi a distrucţiei pancreocitelor. Inhibitorii pompei protonice pot produce o dinamică pozitivă a citochinelor pro- şi antiinflamatoare care se corelează cu diminuarea secreţiei pancreatice(9,4,2,5,3,24).
Concluzii
Creşterea incidenţei patologiilor caracterizate prin insuficienţă exocrină a pancreasului impune necesitatea intensificării şi modernizării diagnosticului şi tratamentului pacienţilor respectivi.
Diversitatea preparatelor enzimatice de substituţie după componenţă, dozele de enzime şi formele medicamentoase determină o abordare selectivă şi adecvată, în funcţie de particularităţile pacientului şi de evoluţia maladiei.
Analiza compoziţiei medicamentelor de substituţie enzimatică va permite prescrierea raţională în funcţie de asocierea insuficienţei exocrine a pancreasului cu patologiile concomitente.
Preparatele de origine microbiană, vegetală şi fungică sunt rezistente la factorii de inactivare (mediu acid al stomacului, deficienţa de acizi biliari în lumenul duodenal), nu necesită eliberarea în formele gastrorezistente şi enterosolubile, creşterea raportului lipază/protează şi inhibarea chimotripsinei.
Asigurarea eficacităţii terapeutice va fi determinată de: dozele enzimelor (lipazei, amilazei, proteazelor), selectarea adecvată a formelor medicamentoase şi regimul de dozare.
Bibliografie
-
Brennan GT, Saif MW. Pancreatic Enzyme Replacement Therapy: A Concise Review. JOP. 2019;20(5):121-125.
-
Capurso G, Traini M, Piciucchi M et al. Exocrine pancreatic insufficiency: prevalence, diagnosis, and management. Clin Exp Gastroenterol. 2019 Mar 21;12:129-139.
-
Hart PA, Conwell DL. Chronic Pancreatitis: Managing a Difficult Disease. Am J Gastroenterol. 2020 Jan;115(1):49-55.
-
Hobbs PM, Johnson WG, Graham DY. Management of pain in chronic pancreatitis with emphasis on exogenous pancreatic enzymes. World J Gastrointest Pharmacol Ther. 2016 Aug 6;7(3):370-86.
-
Ketwaroo GA, Graham DY. Rational Use of Pancreatic Enzymes for Pancreatic Insufficiency and Pancreatic Pain. Adv Exp Med Biol. 2019;1148:323-343.
-
Perbtani Y, Forsmark CE. Update on the diagnosis and management of exocrine pancreatic insufficiency. F1000Res. 2019 Nov 26;8. pii: F1000 Faculty Rev-1991.
-
Petrov MS, Yadav D. Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol. 2019 Mar;16(3):175-184.
-
Pham A, Forsmark C. Chronic pancreatitis: review and update of etiology, risk factors, and management. F1000Res. 2018 May 17;7. pii: F1000 Faculty Rev-607.
-
Olesen SS, Juel J, Graversen C et al. Pharmacological pain management in chronic pancreatitis. World J Gastroenterol. 2013 Nov 14;19(42):7292-301.
-
Othman MO, Harb D, Barkin JA. Introduction and practical approach to exocrine pancreatic insufficiency for the practicing clinician. Int J Clin Pract. 2018 Feb;72(2).
-
Singh VK, Yadav D, Garg PK. Diagnosis and Management of Chronic Pancreatitis: A Review. JAMA. 2019 Dec 24;322(24):2422-2434.
-
Struyvenberg MR, Martin CR, Freedman SD. Practical guide to exocrine pancreatic insufficiency – Breaking the myths. BMC Med. 2017 Feb 10;15(1):29.
-
Trang T, Chan J, Graham DY. Pancreatic enzyme replacement therapy for pancreatic exocrine insufficiency in the 21(st) century. World J Gastroenterol. 2014 Sep 7;20(33):11467-85.
-
Valente R, Waldthaler A, Scandavini CM. et al. Conservative Treatment of Chronic Pancreatitis: A Practical Approach. Scand J Surg. 2020 Mar;109(1):59-68.
-
Gubergrits NB, Belyaeva NV, Klochkov AE et al. Avantajele şi posibilităţile terapeutice ale preparatelor enzimelor digestive de origine non-animală. Buletinul Pancreatolog Club 2018, 1 ianuarie (38), 16-21.
-
Gubergrits NB, Belyaeva NV, Klochkov AE, Fomenko PG. Pancreatită cronică: lucrează asupra greşelilor. Gastroenterologia este frecventă. 2015, 3 (83), 97-104.
-
Ivashkin VT, Maev IV, Okhlobystin AV et al. Recomandări clinice ale Asociaţiei Gastroenterologice Ruse pentru diagnosticul şi tratamentul insuficienţei pancreatice exocrine. Revista rusă de gastroenterologie, hepatologie, coloproctologie. 2018; 28 (2): 72-100.
-
Mayev IV, Bideeva TV, Kucheryavy YA et al. Farmacoterapia pancreatitei cronice din perspectiva recomandărilor clinice actuale. Arhiva terapeutică. 2018, 8, 81-85.
-
Maslovsky LV. Utilizarea diferenţiată a preparatelor enzimatice în tratamentul pancreatitei cronice. Farmacoterapie eficace. Gastroenterologie 2014. 1 (13).
-
Maslovsky LV, Minushkin ON, Topchiy TB, Shaposhnikova OF, Evsikov AE. Prevalenţa sindromului de supraagregare bacteriană la intestinul subţire la pacienţii cu pancreatită cronică. Alfabet medical. 2017; 1 (9): 5-7.
-
Plotnikova EY. Rolul enzimelor de origine non-animală în tulburările digestive ale diverselor etiologii. Medicul curant. 2019, 1.
-
Polunina TE. Metode de corectare a sindromului diareic în pancreatita cronică. Revista medicală. 2018, 1, 6-16.
-
Polunina TE. Pancreatită cronică: insuficienţă exocrină şi corectarea acesteia. Medicul curant. 2018, 6, 71-77.
-
Savustyanenko AV. Preparatele enzimatice ale pancreasului fără acoperire enterică: sunt folosite astăzi? Gastroenterologie. – 2014. – Nr 3. – S. 89-96.
-
Senatorova AS. Omelchenko EV. Pancreasul şi enzimologia în pediatrie. Buletinul Clubului de Pancreatologi. 2014.1 (22), 18–23.
-
Simonova OI, Roslavtseva EA. Caracteristicile terapiei de înlocuire a enzimelor pentru fibroza chistică la copii: avantajele preparatelor de înaltă tehnologie enzimatică. Probleme în pediatria modernă. 2011, 10 (5), 152-156.
-
Sytov AV, Zuzov SA, Khoteev AZ. Recomandări practice pentru terapia de înlocuire a enzimelor pentru cancerul pancreatic. Tumori maligne: recomandări practice. 2019, 9, 652–654.