SARS-CoV-2 which initially causes an acute respiratory infection with primary damage to the lungs, has shown that it later causes multiple lesions, being considered a systemic disease. Pneumonia caused by the coronavirus is characterized by the development of a marked inflammatory process by direct damage to the pulmonary alveolocytes, as well as by an imbalance of the innate and adaptive immune status, pro-inflammatory and anti-inflammatory cytokines and chemokines, coagulation and fibrinolysis processes. The empirical use of antibacterial preparations has shown an evolution depending on the epidemiological situation, the data of experimental and clinical studies and the accumulated experience. The excessive prescription of antibiotics was determined by of subjective reasons, and with the accumulation of data confirming coinfections and/or secondary infections, the administration of antibacterial preparations was redirected. Beta-lactams, macrolides and fluoroquinolones were the most prescribed antibacterial drugs, for which possible antiviral effects were also estimated (azithromycin etc.). The use of antibiotics from the surveillance and reserve groups, according to WHO policy, was one of the major problems during the pandemic due to the aspect of dangerous microbial resistance. The elucidation of the microbial agents involved in the etiology of bacterial infections in COVID-19 has allowed for a more targeted selection of antibiotics, including regarding the danger of threatening microbial resistance.
Utilizarea preparatelor antibacteriene la pacienţii cu COVID-19
The use of antibacterial preparations in COVID-19 patients
First published: 24 martie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.210.1.2023.7758
Abstract
Rezumat
SARS-CoV-2 care provoacă iniţial o infecţie respiratorie acută cu afectarea primară a plămânilor, a demonstrat că ulterior provoacă leziuni multiple, fiind considerat o maladie sistemică. Pneumonia determinată de coronavirus se caracterizează prin dezvoltarea unui proces inflamator marcant cu afectarea directă a alveololelor pulmonare, precum şi de un dezechilibru al statusului imun înnăscut şi adaptiv, al citokinelor şi chemokinelor proinflamatorii şi antiinflamatorii, al proceselor de coagulare şi fibrinoliză. Utilizarea empirică a preparatelor antibacteriene a demonstrat o evoluţie în funcţie de situaţia epidemiologică, datele studiilor experimentale şi clinice şi experienţa acumulată. Prescrierea excesivă a antibioticelor a fost determinată de motive subiective, iar odată cu acumularea datelor de confirmare a coinfecţiilor şi/sau infecţiilor secundare, administrarea preparatelor antibacteriene a fost redirecţionată. Beta-lactaminele, macrolidele şi fluorochinolonele au fost cele mai prescrise preparate antibacteriene, la care s-au estimat şi posibilele efecte antivirale (azitromicina etc.). Utilizarea antibioticelor din grupele de supraveghere şi rezervă, conform politicii OMS, a constituit una dintre problemele majore pe parcursul pandemiei, prin aspectul rezistenţei microbiene periculoase. Elucidarea agenţilor microbieni implicaţi în etiologia infecţiilor bacteriene în COVID-19 a permis selectarea mai ţintită a antibioticelor, inclusiv prin prisma pericolului rezistenţei microbiene ameninţătoare.
Introducere
Strategiile de utilizare a preparatelor antimicrobiene în infecţia cu SARS-CoV-2 au evoluat odată cu pandemia, cunoscând controverse importante în funcţie de perioada COVID-19, de regiuni şi de experienţa acumulată. În prima fază a pandemiei provocate de coronavirus, majoritatea orientărilor naţionale şi internaţionale privind managementul COVID-19 au recomandat ca tratamentul empiric cu antibiotice să fie luat în considerare la toţi pacienţii cu pneumonie COVID-19 în stare gravă şi critică, în baza datelor anterioare ale infecţiei severe cu gripa A.
Organizaţia Mondială a Sănătăţii (OMS) a recomandat ca utilizarea antibioticelor pentru gestionarea COVID-19 să fie minuţios justificată în caz de tratament al coinfecţiilor bacteriene suspectate sau confirmate. Tot mai multe dovezi sugerează că un număr destul de mare de pacienţi cu COVID-19 sunt trataţi inutil cu antibiotice, care în circa 70-90% dintre cazuri au fost prescrise empiric, în pofida confirmării sub 10% a infecţiilor bacteriene secundare. Unele studii au raportat că antibioticele au fost iniţiate la aproximativ 59% dintre pacienţii cu COVID-19 la internare, deşi nu erau aduse dovezi prompte de coinfecţie bacteriană. În 98% dintre cazuri, preparatele antibacteriene au fost prescrise empiric, cu o utilizare a antibioticelor cu spectru larg sau ultralarg, destinate unei game largi de bacterii, îndeosebi cu un potenţial mare de rezistenţă. Acest moment poate accentua şi mai mult problema antibiorezistenţei în timpul pandemiei şi în perioada post-COVID (Usman et al., 2020).
Analiza comparativă a coinfecţiilor bacteriene în infecţiile virale a demonstrat o incidenţă relativ mai mică a acestora în cazul SARS-CoV, MERS-CoV şi SARS-CoV-2 faţă de gripa A H1N1 din 2009. Un sondaj internaţional cu participanţi din 23 de ţări şi 82 de spitale a raportat că terapia antibacteriană a fost prescrisă în 61,8% de cazuri, deşi ratele coinfecţiilor bacteriene şi ale infecţiilor bacteriene secundare raportate la pacienţii cu COVID-19 au fost estimate la 7% cu o creştere la 14% la pacienţii din terapie intensivă (Mussini et al., 2021).
Pandemia de COVID-19, în absenţa terapiei etiologice, a determinat o utilizare largă a preparatelor antibacteriene, în speranţa că acestea vor fi „eficiente” în infecţia cu coronavirus, ca urmare a experienţei în alte infecţii virale respiratorii acute, inclusiv gripă. Deşi conştienţi că antibioticele nu sunt preparate etiotrope, acestea erau prescrise empiric sub pretextul unor complicaţii bacteriene, care în gripă se asociau destul de precoce şi frecvent. Odată cu primele experienţe în tratamentul infecţiei cu SARS-CoV-2 şi cu primele studii, s-a constatat că incidenţa coinfecţiei sau infecţiei bacteriene este relativ rară, 3,5-14,3%, în timp ce preparatele antimicrobiene se prescriau în 70% până la 95% dintre cazuri. Discrepanţa dintre frecvenţa administrării antibioticelor şi incidenţa infecţiei bacteriene la pacienţii cu COVID-19 a determinat necesitatea analizei minuţioase şi multilaterale a acestei probleme(6,7,8,10,17,19).
La analiza pacienţilor cu COVID-19 în primele şase luni ale epidemiei, globale s-a constatat că aproape 75% au primit antibiotice, iar prescrierea a fost foarte variată în diferite regiuni ale lumii. Administrarea preparatelor antibacteriene a fost mai frecventă la persoanele de vârstă mai înaintată şi cu severitate mai mare, îndeosebi aflaţi sub ventilaţie asistată. În baza rezultatelor obţinute s-a estimat că ratele coinfecţiei bacteriene pentru SARS-CoV-2 au variat între 6,1% şi 8%. Din aceste considerente, prescrierea antibioticelor a fost semnificativ mai mare decât prevalenţa coinfecţiei bacteriene, ceea ce sugerează că o parte considerabilă de prescrieri ale antibioticelor sunt inutile, crescând riscul de reacţii adverse, de infecţie cu Clostridium difficile şi de rezistenţă antimicrobiană(9).
Utilizarea preparatelor antibacteriene în diferite perioade ale pandemiei a cunoscut incidenţe diferite. Astfel, în comparaţie cu decembrie 2019–iunie 2020 (cea mai controversată perioadă), administrarea antibioticelor în iunie 2020–martie 2021 s-a redus în general de la 82,3% până la 39,7%, inclusiv la bolnavii cu forme uşoare şi moderate, de la 75,1% până la 15,5%, iar la cei gravi şi critici, de la 75,3% până la 48,3%. Rata înaltă de prescriere a preparatelor antibacteriene în perioada decembrie 2019–iunie 2020 a fost determinată de: preocupările şi lipsa de cunoştinţele legate de COVID-19; dificultăţile în excluderea rapidă a infecţiilor bacteriene; absenţa unor strategii directoare de tratament. Astfel, administrarea direcţionată şi/sau empirică a antibioticelor în tratamentul pacienţilor cu COVID-19 a fost compromisă. Reducerea ponderii antibioterapiei în perioada iunie 2020–martie 2021, îndeosebi la pacienţii cu forme uşoare şi moderate, posibil, a fost determinată de: creşterea cunoştinţelor despre managementul clinic; perfectarea parametrilor şi metodelor de confirmare sau de suspectare a infecţiei bacteriene; recapitularea studiilor cu elaborarea politicilor şi ghidurilor clinice; schimbări în politicile guvernamentale şi internaţionale. Elucidarea şi înţelegerea fiziopatologiei, a particularităţilor de evoluţie şi diagnostic, aprecierea eficacităţii tratamentului şi prevenirii COVID-19 au determinat încrederea clinicienilor şi au contribuit la reducerea semnificativă a utilizării antibioticelor. Totuşi, în pofida acestor momente pozitive, se continuă încă utilizarea în exces a preparatelor antibacteriene(2).
Materiale şi metodă
Au fost analizate circa 80 de articole cu referire directă la utilizarea preparatelor antimicrobiene în tratamentul pneumoniilor comunitare la pacienţii cu COVID-19 în perioada ianuarie 2020–ianuarie 2023, prin folosirea cuvintelor-cheie „COVID-19”, „SARS-CoV-2”, „antibiotice”, „antimicrobiene”, „antibiotice în COVID” şi „coinfecţii COVID”.
Rezultate şi discuţie
Analiza agenţilor patogeni implicaţi în coinfecţiile şi infecţiile bacteriene secundare a demonstrat că Staphylococcus aureus, Streptococcus pneumoniae şi Streptococcus pyogenes par să aibă o pondere mai mică la pacienţii cu COVID-19, în timp ce cele mai frecvente bacterii izolate sunt Mycoplasma pneumoniae, Pseudomonas aeruginosa şi Haemophilus influenzae. Un studiu recent din Marea Britanie a arătat că incidenţa coinfecţiilor bacteriene confirmate în primele cinci zile după internare este mai mică decât incidenţa superinfecţiilor detectate în cursul spitalizării, iar majoritatea au fost provocate de bacili Gram-negativi, inclusiv Enterobacter spp., Pseudomonas spp. şi Serratia spp. E necesar de menţionat că o bună parte din aceşti microbi pot prezenta o rezistenţă semnificativă la antibioticele disponibile. În acest context sunt necesare studii diferenţiate referitoare la agenţii coinfecţiilor bacteriene, comparativ cu cei ai infecţiilor bacteriene secundare dezvoltate pe parcursul spitalizărilor, pentru a justifica timpul iniţierii antibioterapiei şi selectarea adecvată a preparatelor. Concomitent, fără o justificare argumentată, utilizarea nediscriminată a antibioticelor la pacienţii cu COVID-19 creşte riscul de reacţii adverse, de interacţiuni medicamentoase şi de selecţie a microorganismelor polirezistente(11).
Majoritatea participanţilor au estimat că pentru prescrierea antibioticelor cel mai puternic argument a fost necesitatea acoperirii agenţilor patogeni atipici, urmaţi de Staphylococcus aureus şi Pseudomonas aeruginosa, în timp ce stafilococii meticilino-rezistenţi (MRSA) şi fungii (Candida spp., Aspergillus spp.) nu au fost recunoscuţi ca agenţi patogeni critici, care ar trebui acoperiţi empiric. Antibioticele selectate empiric pentru pacienţii cu COVID-19 din secţie şi de la terapie intensivă demonstrează o gamă variată de preparate şi o incidenţă în funcţie de regiune. Durata medie a tratamentului cu antibiotice a fost de cinci zile în America de Nord, 5,44 zile în Marea Britanie, 6,59 zile în Spania, 6,87 zile în Portugalia, 7,2 zile în Italia, 7,35 zile în Slovenia, 7,63 zile în Turcia şi 8,47 zile în alte ţări, cu o medie de 7,12 pentru toate ţările(1).
Societatea de Boli Infecţioase şi Societatea Toracică din America au elaborat linii directoare referitoare la terapia empirică pentru pneumonia comunitară şi au recomandat ca, în funcţie de acestea, să se ia în considerare factorii de risc ai gazdei şi datele microbiologice anterioare. Investigaţiile microbiologice ar fi necesar să se efectueze în mod ideal înainte de prescrierea antibioticelor, inclusiv prin utilizarea testelor la antigenul urinar pentru Streptococcus, Legionella pneumophila şi anticorpii IgM şi IgG de Mycoplasma pneumoniae pe baza contextului clinic şi a epidemiologiei(21).
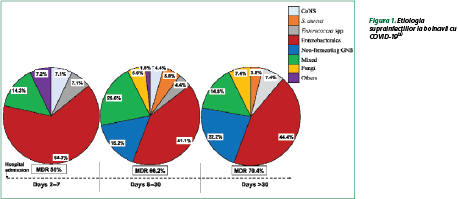
În cursul studiului s-au constatat suprainfecţii la 21,9% dintre pacienţii internaţi pentru COVID-19, majoritatea fiind diagnosticate la bolnavii aflaţi în unităţile de terapie intensivă (71,6%), îndeosebi la cei supuşi ventilaţiei mecanice invazive (62,4%). În baza investigaţiilor microbiologice, printre cele mai frecvente microorganisme au fost Enterobacterales (44,9%), bacili Gram-negativi nefermentaţi (15,6%), bacterii Gram-pozitive (15,6%) şi fungi (5,5%). Infecţia polimicrobiană a fost diagnosticată în 18,3% dintre cazuri. Printre cazurile de suprainfecţie s-au depistat şi germeni cu rezistenţă (65,1%), iar rata acestora a crescut în timpul spitalizării (figura 1). Printre agenţii cu rezistenţă microbiană s-au evidenţiat Klebsiella pneumoniae, Acinetobacter baumannii, Stenotrophomonas maltophilia, Pseudomonas aeruginosa, Enterococcus faecium, Staphylococcus aureus meticilino‑rezistent, Staphylococcus coagulazo‑negativ meticilino‑rezistent, inclusiv şi asocieri dintre Klebsiella pneumoniae + Pseudomonas aeruginosa, Klebsiella pneumoniae + Acinetobacter baumannii, Klebsiella pneumoniae + Staphylococcus aureus meticilino‑rezistent. Pacienţii care au dezvoltat suprainfecţia au prezentat un tablou clinic mai grav, limfopenie, creşterea nivelului PCR şi al procalcitoninei(3).
În cursul unui studiu comparativ referitor la prezenţa coinfecţiilor la pacienţii spitalizaţi cu SARS-CoV-2 (februarie 2020 – aprilie 2020) şi gripă (septembrie 2019 – aprilie 2020) nu s-a identificat o diferenţă semnificativă a incidenţei coinfecţiilor după ratele de investigaţii microbiologice efectuate (73% versus 80%) şi ratele de rezultate pozitive (7,5% versus 5,1%). Din numărul de hemoculturi efectuate pentru pacienţii cu pneumonită virală s-a constatat o incidenţă scăzută a coinfecţiei atât în rândul pacienţilor cu SARS-CoV-2 (9,3%), cât şi al gripei (6%). La bolnavii cu COVID-19 s-au identificat stafilococi coagulazo-negativi, Acinetobacter spp., Streptococcus oralis, Klebsiella pneumoniae, Enterobacter cloacae, Enterococcus spp. şi Pseudomonas aeruginosa(4).
Utilizarea unor preparate antibacteriene şi antiprotozoice a cunoscut o creştere semnificativă în perioada de pandemie, în urma situaţiei critice de sănătate publică, din nevoia de a utiliza medicamente capabile să aplaneze evoluţia COVID-19. Aceasta a determinat o discuţie între adepţii conservatori ai reţinerii utilizării preparatelor antimicrobiene pentru tratamentul COVID-19, dacă eficacitatea lor nu avea date ale medicinei bazate pe dovezi, cu adepţii unei abordări mai liberale. Acestea din urmă se bazau pe o selecţie intuitivă în baza datelor deja existente, dar care nu se refereau nemijlocit la infecţia cu SARS-CoV-2 sau în baza rezultatelor cercetărilor in vitro(6,7).
O analiză a utilizării preparatelor antibacteriene în baza dozei medii nictemirale pe zi (DDD/100 zile pat), în perioada aprilie-decembrie 2020 cu o perioadă similară din 2019, a demonstrat o creştere de circa şapte ori în timpul pandemiei, practic, a tuturor grupelor de antibiotice, cu excepţia aminoglicozidelor. Astfel, s-a constatat o creştere considerabilă a prescrierii macrolidelor (azitromicină), care au constituit circa 67% din volumul total de preparate antibacteriene. Folosirea tuturor grupelor de peniciline a crescut de aproximativ 6,5 ori, dar în principal pe baza amoxicilinei, preponderent amoxicilină+acid clavulanic, care a constituit peste 80% din toate penicilinele şi a ocupat locul al treilea printre toate antibioticele(7).
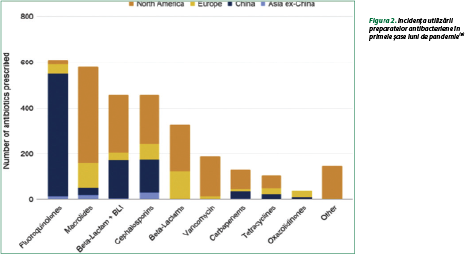
La analiza pacienţilor cu COVID-19 în primele şase luni ale epidemiei globale s-a constatat că prescrierea a fost foarte variată în diferite regiuni ale lumii (figura 2). Astfel, în China a predominat utilizarea fluorochinolonelor, asocierea beta-lactaminelor cu inhibitorii de beta-lactamaze, a cefalosporinelor şi o incidenţă mai mică a carbapenemelor, macrolidelor, tetraciclinelor şi oxazolidindionelor. În Europa s-a preferat prescrierea macrolidelor, beta-lactaminelor (cefalosporinelor, asocierea beta-lactaminelor cu inhibitorii de beta-lactamaze, carbapenemelor), cu o pondere mai mică a fluorochinolonelor, tetraciclinelor, vancomicinei şi oxazolidindionelor. În America de Nord s-a constatat o utilizare destul de largă a majorităţii grupelor de antibacteriene, cu predominanţa macrolidelor, beta-lactaminelor (cefalosporinelor, asocierea beta-lactaminelor cu inhibitorii de beta-lactamaze, carbapenemelor) şi chiar a unor preparate din diverse grupe(9).
Utilizarea cefalosporinelor a crescut de circa 1,7 ori în timpul pandemiei. Printre cefalosporine, cel mai frecvent au fost prescrise cefperazona/sulbactam (de şapte ori) şi cefotaxim/sulbactam (de opt ori). Administrarea ceftriaxonului şi ceftriaxon/sulbactamului s-a diminuat în perioada de pandemie în comparaţie cu perioada similară din 2019, care au constituit circa 62% din volumul cefalosporinelor(7).
Nivelul folosirii carbapenemelor în timpul pandemiei a crescut de circa trei ori faţă de perioada până la pandemie, printre care cea mai mare creştere a avut-o utilizarea ertapenemului şi meropenemului, iar utilizarea imipenemului a rămas la acelaşi nivel. Astfel, ertapenemul a fost prescris la 29,3% comparativ cu 5,5% până la pandemie, iar folosirea meropenemului a crescut de circa două ori şi a constituit 45% din toate carbapenemele(7).
Utilizarea fluorochinolonelor a crescut în perioada aprilie-decembrie 2020 de circa 2,5 ori, cu predominanţa levofloxacinei. Este necesar de menţionat că folosirea ciprofloxacinei s-a redus semnificativ comparativ cu perioada aprilie-decembrie 2019. Prescrierea levofloxacinei, fluorochinolonă respiratorie, a crescut de peste trei ori şi a ocupat locul al doilea dintre toate preparatele antibacteriene(7).
Administrarea frecventă a azitromicinei, îndeosebi la începutul pandemiei, se poate explica prin efectele pleiotrope ale macrolidului şi, în primul rând, prin acţiunile imunomodulatoare şi antivirale. Datele experimentale despre efectele imunomodulatoare au servit ca argument pentru utilizarea azitromicinei, îndeosebi după stabilirea rolului primordial al furtunii citokinice. În baza rezultatelor preclinice privind eficacitatea faţă de virusul Ebola şi rinovirusuri, s-a recomandat folosirea azitromicinei, ca agent presupus antiviral faţă de SARS-CoV-2. Aceste date au servit ca bază pentru a include azitromicina în tratamentul pacienţilor cu COVID-19, inclusiv în condiţii de ambulatoriu. Rezultatele unui prim studiu nerandomizat din martie 2020 a constatat că utilizarea azitromicinei sau asocierea cu hidroxiclorochina a determinat diminuarea sau dispariţia încărcăturii virale. Ulterior, rezultatele unui studiu mai amplu din mai 2020 nu au confirmat eficacitatea azitromicinei sau asocierea cu hidroxiclorochina. În baza acestor date, OMS nu a recomandat azitromicina în calitate de terapie empirică sau profilaxie a pacienţilor cu COVID-19. Astfel, azitromicina putea fi folosită la bolnavii cu COVID-19 doar în cazurile infecţiei bacteriene confirmate sau presupuse, în conformitate cu recomandările locale ale terapiei antibacteriene empirice, îndeosebi la depistarea agenţilor atipici(6,7,15).
Studiul realizat în septembrie-octombrie 2020 a demonstrat că, practic, la toţi pacienţii cu COVID-19 internaţi se prescriau preparate antibacteriene, iar la 54% – câte două preparate, la 21% – câte trei preparate, la 7% – patru şi uneori chiar cinci sau şase antibiotice. S-a relevat o corelaţie între numărul de antibiotice administrate şi gradul de afectare pulmonară după tomografia computerizată, durata spitalizării, nivelul neutrofilelor şi al proteinei C-reactive (PCR). Analiza a constatat o durată semnificativă a antibioterapiei fără a lua în considerare utilizarea antibioticelor la etapa de ambulatoriu. Astfel, macrolidele (azitromicina) s-au folosit maximal 16 zile, fluorochinolonele respiratorii – 22 de zile, cefalosporinele de a treia generaţie – 19 zile, cefalosporinele de a patra generaţie – 17 zile, carbapenemele – 34 de zile. Toţi pacienţii incluşi în studiu administrau antibioticele din prima zi până la externare. Durata antibioterapiei prezintă o dilemă importantă, îndeosebi în cazul absenţei unor date convingătoare despre infecţia bacteriană. Conform recomandărilor, tratamentul antibacterian empiric trebuie suspendat în absenţa datelor coinfecţiei bacteriene. Mai multe studii demonstrează că durata antibioterapiei la pacienţii spitalizaţi a fost de 1-2 zile, iar la majoritatea pacienţilor a fost de 5 zile(6).
Una dintre problemele antibioterapiei se reduce la apartenenţa preparatelor antibacteriene la clasa de medicamente conform clasificării AWA a OMS. Conform acestei clasificări, preparatele antibacteriene sunt subdivizate în trei clase. În conformitate cu aceasta, ghidurile OMS recomandau ca iniţial să se prescrie un antibiotic din clasa „Accesibile”, dacă este suspectată infecţia bacteriană, cu întreruperea precoce dacă aceasta nu este confirmată. Datele relatate în studii au demonstrat că doar 20% dintre antibioticele prescrise făceau parte din această clasă, iar 70% erau din clasa „Supraveghere” sau chiar „Rezervă”. În multe ţări, preparatele antibacteriene din clasa „Rezervă” după OMS nu sunt disponibile sau sunt limitate la nivel de spital. Totuşi, o parte din aceste medicamente (ceftazidim, cefotaxim, cefepim, meropenem, ertapenem, vancomicină, teicoplanină, amikacină, kevofloxacină, moxifloxacină, colistină, linezolid) au fost utilizate cu un risc crescut de dezvoltare a rezistenţei. Preparatele antibacteriene din clasa „Supraveghere” prezintă un risc mai mare de rezistenţă, ceea ce sugerează o necesitate urgentă de determinare a informaţiilor şi ghidurilor referitoare la selectarea raţională şi argumentată a antibioticelor la pacienţii cu COVID-19(2,15).
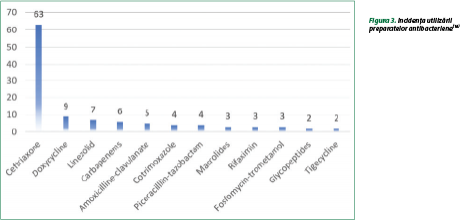
Sturza et al. (2023) au constatat că tratamentul antibacterian a fost iniţiat între a şasea şi a 13-a zi de la apariţia simptomelor, iar la 77,3% dintre pacienţii cărora li s-au prescris antibacteriene tratamentul a fost iniţiat în primele 48 de ore de la internare, cu o durată de 5-7 zile. Analiza grupelor şi a preparatelor utilizate a demonstrat că 75% au fost trataţi cu ceftriaxon, iar în celelalte cazuri s-au utilizat tetraciclinele (doxiciclina), carbapenemele, oxazolidindionele (linesolid), penicilinele asociate cu inhibitorii de beta-lactamaze (amoxicilină+acid clavulanic, piperacilină+tazobactam), sulfamidele combinate (co-tromoxazol), macrolidele, ansamicinele (rifaximina), fosofmicina, glicopeptidele şi tigeciclina (figura 3). Concomitent, autorii au constatat că, din cei 121 de bolnavi cărora li s-au prescris preparate antibacteriene, 18 pacienţi au primit antibiotice din grupul celor accesibile, 84 – din grupul de supraveghere, iar nouă – din grupul de rezervă(18).
Studiul clinic realizat în România a demonstrat o creştere a utilizării nejustificate a antibioticelor în comparaţie cu ţările Uniunii Europene, îndeosebi a celor cu spectru larg, inclusiv din grupurile de supraveghere şi de rezervă. În acest context se menţiona intensificarea administrării carbapenemelor, macrolidelor, glicopeptidelor şi penicilinelor protejate. S-a menţionat că, dintre pacienţii trataţi pentru pneumonia COVID-19, doar un număr mic au avut investigaţii microbiologice menite să depisteze agenţii cauzali ai afecţiunii pulmonare. Concomitent, în 2020 a crescut şi numărul cazurilor de depistare a bacteriilor Gram‑negative rezistente la carbapeneme(18).
Preparatele antimicrobiene sunt esenţiale în tratamentul infecţiilor bacteriene, inclusiv ale sistemului respirator, dar datele din primul val al pandemiei au demonstrat că majoritatea pacienţilor spitalizaţi (circa 70%) au primit tratament antimicrobian empiric. De asemenea, s-a constatat că rata utilizării antibioticelor în ţările cu venituri mici şi medii a constituit 89%, iar în cele cu venituri mari, 58%. Analiza preparatelor antibacteriene utilizate la pacienţii cu COVID-19 a demonstrat că preparate cel mai frecvent prescrise au fost ceftriaxonul (90,7%), vancomicina (86%), polimixina (74,4%), azitromicina (69,8%) şi meropenemul (67,4%). Aceste date sugerează o rată destul de mare de prescriere a antibioticelor din clasele de supraveghere şi de rezervă, conform clasificării AWA a OMS. Concomitent, s-a constatat că circa 77% dintre tulpinile de agenţi microbieni depistaţi au prezentat rezistenţă, chiar multiplă, inclusiv a florei Gram-pozitive la oxacilină şi a celei Gram-negative la cefalosporine şi carbapeneme(14).
În cursul studiului s-a evaluat utilizarea antibioticelor în perioada martie-noiembrie 2020 la pacienţii internaţi cu COVID-19. S-a constatat că 39,7% dintre pacienţii internaţi au urmat tratament antibacterian pentru infecţiile bacteriene suspectate sau confirmate. Incidenţa administrării preparatelor antibacteriene s‑a corelat cu gravitatea bolii, constituind 16,9% în formele uşoare, 29,8% în cele moderate şi 64,6% în cele grave. Este necesar de menţionat că, în 85,5% dintre cazuri, antibioticele erau prescrise empiric în primele 48 ore de la internare, iar incidenţa s‑a corelat cu gravitatea, variind de la 15,9%, 26,45% şi 52,9% în formele uşoare, moderate şi, respectiv, grave. Analiza utilizării lunare a antibioticelor a demonstrat că numărul prescripţiilor a scăzut cu 8,7% pe lună şi cu 9,9% indicate în primele 48 de ore de la internare. Aceste diminuări ale administrării preparatelor antibacteriene s-au constatat pe fundalul creşterii numărului de pacienţi internaţi. Concomitent, s-a estimat o reducere a consumului total al antibioticelor (de la 51,8% la 31,9% şi de la 45,7% la 26,7%). Această reducere poate fi explicată prin implementarea metodologiilor active şi pasive de diminuare a prescrierii neargumentate a antibioticelor(16).
O investigaţie comparativă a prevalenţei bacteriilor cu polirezistenţă şi a consumului de antibiotice faţă de aceste tulpini a fost realizată în timpul pandemiei de COVID-19 (martie 2020 – septembrie 2021) comparativ cu perioada prepandemică (martie 2018 – septembrie 2019). În acest context s-a analizat utilizarea antibioticelor în infecţiile cauzate de Staphylococcus aureus rezistent la meticilină (MRSA), Enterococcus rezistent la vancomicină (VRE), Enterobacteriaceae rezistente la carbapeneme (CRE), Acinetobacter baumannii rezistent la carbapeneme (CRAB) şi Pseudomonas aeruginosa rezistentă la carbapeneme (CRPA). Prevalenţa izolatelor în probele clinice din secţie a constituit pentru MRSA 4,7%, VRE – 49%, CRE – 22,4% şi 20,1%, iar în secţiile de terapie intensivă, pentru VRE – 26,7% şi CRE – 36,4%. Consumul de antibiotice a crescut în perioada pandemiei, inclusiv pentru peniciline asociate cu inhibitori de β-lactamaze constituind 3,4% în secţie şi 5,8% în secţia de terapie intensivă, iar de carbapeneme – 25,9% în secţie şi 12,1% în unităţile de terapie intensivă(5).
Factorii predispozanţi pentru utilizarea excesivă a antibioticelor sunt psihologici, sociali şi biologici. Dintre factorii psihologici, stresul determinat de pandemie a indus frica de infectare şi de moarte în rândul unei mari părţi a societăţii. Dezvoltarea anxietăţii, relevată prin spaima de a merge în societate, cu probabilitatea de a se infecta, a favorizat autotratamentul cu antibiotice. Acesta din urmă a determinat utilizarea preparatelor antibacteriene cu scop profilactic, pentru a evita necesitatea de spitalizare. Corelaţia dintre stresul psihoemoţional şi perceperea pericolului pentru sănătate a contribuit la autotratamentul cu antibiotice, în pofida informaţiilor prezentate de specialişti despre ineficacitatea acestora în infecţiile virale. În acest context, prescrierea şi eliberarea preparatelor antibacteriene de instituţiile medicale a fost determinată de dorinţa de a se conforma solicitărilor pacienţilor, pentru a evita situaţiile de conflict. În aceste situaţii, medicii recomandau preparatele antibacteriene, deşi nu aveau indicaţii clinice certe. Factorii sociali care au contribuit la utilizarea excesivă a antibioticelor pot fi: aglomeraţia şi întârzierile în primirea tratamentului în centrele medicale; rolul mass-media în promovarea utilizării antibioticelor la apariţia unor informaţii referitoare la probabilitatea eficacităţii unor preparate antibacteriene în infecţiile virale; inducerea stresului în societate de mass-media în asociere cu un deficit de medicamente; frica de contaminare a copiilor şi inducerea necesităţii de administrare a antibioticelor pentru a proteja copiii şi membrii familiei; corelaţia pozitivă dintre automedicaţie şi gen (femei), nivelul educaţiei şi al afilierii profesionale. Utilizarea abuzivă a antibioticelor trebuie interpretată prin următoarele aspecte: administrarea excesivă; dozarea neadecvată; combinaţiile incorecte; indicaţii neargumentate(12).
O analiză sistematică a estimat că factorii predispozanţi ai utilizării excesive a antibioticelor, îndeosebi în secţiile de terapie intensivă, pot fi: presiunea de timp; inerţia clinică; aşteptările percepute ale pacienţilor; incertitudinea diagnosticului; raportul risc/beneficiu; creşterea volumelor cauzate de COVID‑19; frica de COVID‑19; lipsa de înţelegere a pacientului cu privire la modul cum funcţionează antibioticele; lipsa accesului pe scară largă la diagnosticarea exactă şi rapidă a COVID-19; caracteristici clinice nespecifice (tuse, febră, dispnee etc.); dificultăţi în diagnosticul diferenţial al COVID-19 de alte afecţiuni respiratorii acute, care necesită prescrierea antibioticelor (pneumonie, exacerbări ale BPOC etc.); prevalenţă crescută a hipoxiei precoce şi a progresiei către insuficienţă respiratorie la pacienţii cu COVID-19(13).
O problemă importantă o constituie impactul COVID-19 asupra rezistenţei antimicrobiene. Pandemia, prin utilizarea excesivă a antibioticelor, a contribuit la dezvoltarea bacteriilor polirezistente, cu consecinţe devastatoare. Dezvoltarea rezistenţei antimicrobiene poate fi determinată de: utilizarea empirică a unor antibiotice la care deja persistă o rezistenţă (15-50% din izolatele bacteriene sunt rezistente cel puţin la un grup de antimicrobiene); efectul limitat al antimicrobienelor asupra infecţiilor dobândite în spital; utilizarea antibioticelor cu spectru larg cu efecte limitate; secţiile de reanimare şi de terapie intensivă sunt epicentre pentru dezvoltarea rezistenţei antimicrobiene odată cu continuarea pandemiei, infectarea în cadrul acestora şi persistenţa bacteriilor polirezistente cu eficacitate redusă a efectului antibioterapiei; dezvoltarea tulpinilor cu polirezistenţă în mediu, ca urmare a eliberării antimicrobienelor în apa potabilă a spitalelor, cu creşterea nivelului de rezistenţă la animale, precum şi în sistemele agricole şi naturale; estimarea neadecvată a eficacităţii antibioterapiei şi suspendarea ei dacă este necesar; utilizarea profilactică a antibioticelor; utilizarea exagerată a antisepticelor şi a săpunurilor antibacteriene, ca măsură de protecţie anti-COVID-19, care prin substanţe suplimentare nu cresc mult protecţia, dar pot fi responsabile de rezistenţa antimicrobienă, prin dezvoltarea pompelor de eflux(21).
Impactul COVID-19 asupra rezistenţei antimicrobiene globale este incert, iar utilizarea disproporţionată a antibioticelor la pacienţii cu COVID-19 are potenţialul de a exacerba această ameninţare pentru sănătatea publică, în special în zonele în care rezistenţa antimicrobiană este deja o problemă semnificativă. Indiferent de impactul net al COVID-19 asupra rezistenţei microbiene, principiile de administrare a preparatelor antibacteriene ar trebui să ghideze gestionarea antibioticelor la pacienţii cu COVID-19. Deciziile de prescriere empirică a preparatelor antibacteriene pot fi acceptate în situaţiile în care există o incertitudine în identificarea infecţiei bacteriene la pacienţii cu COVID-19. Totuşi, mai multe linii directoare pledează pentru utilizarea empirică a antibioticelor la pacienţii cu COVID-19 sever, iar în celelalte situaţii e necesară o administrare mai adaptată, pe baza prezentării pacientului. Concomitent, este necesar să se evalueze rolul iniţierii tratamentului cu antibiotice la pacienţii cu COVID-19 sever şi să se identifice parametrii adecvaţi pentru întreruperea administrării preparatelor antibacteriene pe baza datelor imagistice, semnelor şi simptomelor clinice şi a biomarkerilor. Este importantă evaluarea beneficiilor şi a riscurilor administrării antibioticelor, inclusiv la administrarea empirică(9).
Concluzii
În baza analizei literaturii în domeniul utilizării preparatelor antibacteriene în infecţiile respiratorii la pacienţii cu COVID-19, am concluzionat: incidenţa coinfecţiilor bacteriene şi a infecţiilor bacteriene secundare a variat de la 3,2% la 20% în secţiile de COVID şi de la 14% până la 41% în secţiile de terapie intensivă; tactica administrării preparatelor antibacteriene a variat de la o ţară la alta, în conformitate cu ghidurile şi protocoalele internaţionale, naţionale şi locale, precum şi cu recomandările Organizaţiei Mondiale a Sănătăţii; spectrul de agenţi etiologici ai infecţiilor respiratorii a fost determinat de speciile Gram-pozitive şi Gram-negative, cu predominanţa tulpinilor cu rezistenţă înaltă, care demonstrează dezvoltarea suprainfecţiilor în perioada de spitalizare; preparatele din grupa beta-lactaminelor (peniciline, cefalosporine, carbapeneme, asocieri ale beta-lactaminelor cu inhibitori de beta-lactamaze), a macrolidelor, a fluorochinolonelor, a glicopeptidelor şi a oxazolidindionelor au fost medicamentele cel mai frecvente utilizate la pacienţii cu SARS-CoV-2; preparatele antibacteriene au fost selectate empiric în majoritatea cazurilor, în baza datelor anterioare din pandemiile virale, a experienţei proprii sau în baza rezultatelor studiilor raportate pe parcursul pandemiei. În conformitate cu politica OMS în domeniul antibioterapiei (clasificarea AWA), s-a remarcat o utilizare frecventă a preparatelor din grupul de supraveghere şi chiar de rezervă, acest fapt implicând pericolul extinderii rezistenţei la aceste antibiotice. Utilizarea excesivă a preparatelor antibacteriene pe parcursul pandemiei a ridicat problema rezistenţei microbiene, dar care s-a estimat că va avea o relevanţă şi mai mare în perioada post-COVID-19. Experienţa acumulată pe parcursul pandemiei a contribuit la reducerea utilizării antibioticelor, cu un efect pozitiv asupra politicii de asigurare cu preparate antibacteriene şi cu reducerea poverii asupra sistemelor de sănătate.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Beovic B, Doušak M, Ferreira-Coimbra J, Nadrah K, Rubulotta F, Belliato M, Berger-Estilita J, Ayoade F, Rello J, Erdem H. Antibiotic use in patients with COVID-19: a ‘snapshot’ Infectious Diseases International Research Initiative (ID-IRI) survey. J Antimicrob Chemother. 2020 Nov 1;75(11):3386-3390. doi: 10.1093/jac/dkaa326.
-
Cong W, Stuart B, AIhusein N, Liu B, Tang Y, Wang H, Wang Y, Manchundiya A, Lambert H. Antibiotic Use and Bacterial Infection in COVID-19 Patients in the Second Phase of the SARS-CoV-2 Pandemic: A Scoping Review. Antibiotics (Basel). 2022 Jul 23;11(8):991. doi: 10.3390/antibiotics11080991.
-
Falcone M, Tiseo G, Giordano C, Leonildi A, Menichini M, Vecchione A, Pistello M, Guarracino F, Ghiadoni L, Forfori F, Barnini S, Menichetti F; Pisa COVID-19 Study Group. Predictors of hospital-acquired bacterial and fungal superinfections in COVID-19: a prospective observational study. J Antimicrob Chemother. 2021 Mar 12;76(4):1078-1084. doi: 10.1093/jac/dkaa530.
-
Hughes S, Troise O, Donaldson H, Mughal N, Moore LSP. Bacterial and fungal coinfection among hospitalized patients with COVID-19: a retrospective cohort study in a UK secondary-care setting. Clin Microbiol Infect. 2020 Oct;26(10):1395-1399. doi: 10.1016/j.cmi.2020.06.025.
-
Jeon K, Jeong S, Lee N, Park MJ, Song W, Kim HS, Kim HS, Kim JS. Impact of COVID-19 on Antimicrobial Consumption and Spread of Multidrug-Resistance in Bacterial Infections. Antibiotics (Basel). 2022 Apr 18;11(4):535. doi: 10.3390/antibiotics11040535.
-
Karoli NA, Kanaeva TV, Grashkina MV, Rebrov AP. Antibacterial therapy for patients with COVID-19 in outpatients care. South Russian Journal of Therapeutic Practice. 2022;3(2):80-85. doi.org/10.21886/2712-8156-2022-3-2-80-85.
-
Karnoukh KI, Lazareva NB. Analysis of the antibiotic consumption on the backdrop of the COVID-19 pandemic: hospital level. Meditsinskiy sovet Medical Council. 2021;(16):118–128. doi.org/10.21518/2079- 701X-2021-16-118-128.
-
Langford BJ, So M, Leung V, Raybardhan S, Lo J, Kan T, Leung F, Westwood D, Daneman N, MacFadden DR, Soucy JR. Predictors and microbiology of respiratory and bloodstream bacterial infection in patients with COVID-19: living rapid review update and meta-regression. Clin Microbiol Infect. 2022 Apr;28(4):491-501. doi: 10.1016/j.cmi.2021.11.008.
-
Langford BJ, So M, Raybardhan S, Leung V, Soucy JR, Westwood D, Daneman N, MacFadden DR. Antibiotic prescribing in patients with COVID-19: rapid review and meta-analysis. Clin Microbiol Infect. 2021 Apr;27(4):520-531. doi: 10.1016/j.cmi.2020.12.018.
-
Miranda C, Silva V, Capita R, Alonso-Calleja C, Igrejas G, Poeta P. Implications of antibiotics use during the COVID-19 pandemic: present and future. J Antimicrob Chemother. 2020 Dec 1;75(12):3413-3416. doi: 10.1093/jac/dkaa350.
-
Mussini C, Falcone M, Nozza S, Sagnelli C, Parrella R, Meschiari M, Petrosillo N, Mastroianni C, Cascio A, Iaria C, Galli M, Chirianni A, Sagnelli E, Iacobello C, Di Perri G, Mazzotta F, Carosi G, Tinelli M, Grossi P, Armignacco O, Portelli V, Andreoni M, Tavio M; Italian Society of Infectious and Tropical Diseases. Therapeutic strategies for severe COVID-19: a position paper from the Italian Society of Infectious and Tropical Diseases (SIMIT). Clin Microbiol Infect. 2021 Mar;27(3):389-395. doi: 10.1016/j.cmi.2020.12.011.
-
Nortey RA, Kretchy IA, Koduah A, Buabeng KO. Biopsychosocial analysis of antibiotic use for the prevention or management of COVID-19 infections: A scoping review. Res Social Adm Pharm. 2023 Apr;19(4):573-581. doi: 10.1016/j.sapharm.2022.11.011.
-
Pulia MS, Wolf I, Schulz LT, Pop-Vicas A, Schwei RJ, Lindenauer PK. COVID-19: An Emerging Threat to Antibiotic Stewardship in the Emergency Department. West J Emerg Med. 2020 Aug 7;21(5):1283-1286. doi: 10.5811/westjem.2020.7.48848.
-
Singulani JL, Silva DL, Lima CM, Magalhães VCR, Baltazar LM, Peres NTA, Caligiorne RB, Moura AS, Santos ARO, Fereguetti T, Martins JC, Rabelo LF, Lyon AC, Johann S, Falcão JP, Santos DA. The impact of COVID-19 on antimicrobial prescription and drug resistance in fungi and bacteria. Braz J Microbiol. 2022 Dec;53(4):1925-1935. doi: 10.1007/s42770-022-00818-x.
-
Sokolovic D, Drakul D, Joksimovic B, Lalovic N, Avram N, Milic M, Nogo-Živanovic D, Mijovic B. Consumption of Antibiotics in Primary Care Setting before and during COVID-19 Pandemic in Republic of Srpska, Bosnia and Herzegovina. Antibiotics (Basel). 2022 Sep 28;11(10):1319. doi: 10.3390/antibiotics11101319.
-
Stevens RW, Jensen K, Kooda K, Mara K, O’Horo JC, Shah A. A retrospective antibiotic prescribing assessment and examination of potential antibiotic stewardship targets in patients with COVID-19. JAC Antimicrob Resist. 2021 Nov 5;3(4):dlab170. doi: 10.1093/jacamr/dlab170.
-
Stoichitoiu LE, Pinte L, Ceasovschih A, Cernat RC, Vlad ND, Padureanu V, Sorodoc L, Hristea A, Purcarea A, Badea C, Baicus C. In-Hospital Antibiotic Use for COVID-19: Facts and Rationales Assessed through a Mixed-Methods Study.
-
J Clin Med. 2022 Jun 2;11(11):3194. doi: 10.3390/jcm11113194.
-
Sturza F, Guţă ŞD, Popescu GA. Antibiotics Used for COVID-19 In-Patients from an Infectious Disease Ward. Antibiotics (Basel). 2023 Jan 11;12(1):150. doi: 10.3390/antibiotics12010150.
-
Synopalnikov AI. COVID-19 pandemic is a «pandemic» of antimicrobial therapy. KMAX. 2021; 23(1): 5-15. DOI: 10.36488/cmac.2021.1.5-15
-
Usman M, Farooq M, Hanna K. Environmental side effects of the injudicious use of antimicrobials in the era of COVID-19. Sci Total Environ. 2020 Nov 25;745:141053. doi: 10.1016/j.scitotenv.2020.141053.
-
Wu CP, Adhi F, Highland K. Recognition and management of respiratory co-infection and secondary bacterial pneumonia in patients with COVID-19. Cleve Clin J Med. 2020 Nov 2;87(11):659-663. doi: 10.3949/ccjm.87a.ccc015.
Articole din ediţiile anterioare
Vaccinarea anti-COVID-19
Pandemia de COVID-19 este cea mai importantă provocare de sănătate publică cu care omenirea s-a confruntat în mileniul al treilea, până în prezent....
Metformina, diabetul zaharat de tip 2 şi COVID-19
Metformina, concomitent cu efectul antihiperglicemic, prin care reduce susceptibilitatea la diferite infecţii şi severitatea bolii, poate oferi pro...
Antibioticele. Mecanisme de acţiune, rezistenţa bacteriană la antibiotice şi riscul întoarcerii la era preantibiotică
Antibioticele sunt substanţe antimicrobiene utilizate pentru tratamentul bolilor bacteriene. La momentul descoperirii lor, au putut vindeca multe b...
Folosirea judicioasă a antibioticelor şi chimioterapicelor antibacteriene (III)
Antibioticele şi chimioterapicele antimicrobiene pot acţiona la nivelul peretelui celular, la nivelul membranei celulare, la nivelul ribozomilor cu...