Knowledge accumulation in genetics, culminating in deciphering the human genome, and better understanding of pathogenesis of cancers have led human being to the possibility of developing drugs that can attack cancer cells more selectively than classical chemotherapy. The advances in immunology have made it possible to know precisely the mechanisms involved in the immune response that allows the removal of precancerous cells. All of these make it possible at present to use targeted therapies that aim to destroy only cancer cells. We are entering the era of precision medicine, where the knowledge of genetic mutations responsible for the cancer of a particular patient makes it possible to treat this patient exactly with those drugs acting on the affected link.
Vechi şi nou în terapia antineoplazică
Old and new in cancer treatment
First published: 30 aprilie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.181.2.2018.1680
Abstract
Rezumat
Explozia de cunoaştere din domeniul geneticii, care a culminat cu descifrarea genomului uman, şi înţelegerea mai bună a patogenezei cancerelor au condus la posibilitatea dezvoltării unor medicamente care să atace mult mai selectiv celulele canceroase, comparativ cu chimioterapia clasică. Avansul din imunologie a permis cunoaşterea cu precizie a mecanismelor implicate în răspunsul imun care permite debarasarea de celulele precanceroase. Toate acestea fac posibile în prezent terapii ţintite, care urmăresc distrugerea doar a celulelor canceroase. Intrăm în epoca medicinei de precizie, în care cunoaşterea mutaţiilor genetice răspunzătoare de cancerul unui anumit pacient face posibilă tratarea acestui pacient exact cu acele medicamente care acţionează pe veriga afectată.
Introducere. Ce este cancerul?
În prezent, cancerul este considerat a fi o boală genetică, în care acumularea de alterări la nivelul genomului celulelor somatice stă la baza formării şi dezvoltării cancerului(1).
Decriptarea genomului uman şi progresul în tehnologiile de secvenţiere a ADN-ului au permis acumularea de noi cunoştinţe despre cancer şi despre tratamentul lui. În zilele noastre, asistăm la clasificarea tumorilor în funcţie de alterările genetice prezente în celulele canceroase şi la mutarea accentului de la un nivel histologic la nivel genetic. Aceasta determină şi schimbări de abordare terapeutică: modificările genetice somatice devin ţinte pentru terapie. Mai mult, asistăm la individualizarea tratamentului, prin genotiparea tumorilor şi alegerea pentru un anumit pacient a acelui tratament anticanceros potrivit pentru alterările genetice caracteristice tipului său de cancer(1).
Cancerul este o tumoră malignă. Tumorile sunt alcătuite din celule care proliferează necontrolat, şi pot fi benigne sau maligne. Spre deosebire de tumorile benigne, tumorile maligne au capacitatea de a se dediferenţia (şi de a-şi pierde funcţionalitatea normală), de a invada ţesuturi învecinate şi de a metastaza, adică de a forma tumori secundare în alte părţi ale corpului faţă de locul de origine. Aceste proprietăţi ale neoplasmelor reflectă alterări ale expresiilor genice la nivelul celulelor canceroase, alterări care rezultă din mutaţii genetice moştenite sau dobândite(2).
Celulele canceroase sunt celule proprii ale organismului şi se diferenţiază de celulele sănătoase, dar nu atât de mult, de aceea scapă mecanismelor de apărare ale organismului. Terapia medicamentoasă a cancerului se confruntă cu marea provocare de a distruge selectiv doar aceste celule şi de a nu afecta celulele sănătoase ale organismului. Medicamentele citotoxice clasice acţionează asupra tuturor celulelor organismului. Ceea ce le face utile ca anticanceroase este rata mare de multiplicare a celulelor canceroase, mai mare decât a celulelor majorităţii ţesuturilor umane sănătoase – citostaticele sunt mai active asupra celulelor care au o rată de înnoire mai mare (turnover mai rapid). Totuşi, şi celulele sănătoase sunt afectate de medicamentele citotoxice, de unde rezultă toxicitatea mare a acestora(2).
Patogeneza cancerului
Semnele distinctive ale cancerului sunt acele capabilităţi funcţionale dobândite care permit celulelor canceroase să supravieţuiască, să prolifereze şi să disemineze. Achiziţia lor este posibilă prin două caracteristici:
- dezvoltarea instabilităţii genomice în celulele canceroase, care generează mutaţii aleatorii, inclusiv rearanjamente cromozomiale;
- starea inflamatorie a leziunilor premaligne şi a celor maligne; această stare inflamatorie cronică modifică micromediul celular, permiţând celulelor canceroase să se multiplice şi să se dezvolte(1).
Se poate vorbi despre mai multe caracteristici distinctive ale cancerului:
- intensificarea semnalelor proliferative;
- semnalele supresoare ale creşterii scad în intensitate sau nu sunt corect interpretate;
- celulele dezvoltă rezistenţă la procesele fiziologice care conduc spre apoptoză, permiţând celulelor canceroase să capete nemurirea replicativă;
- inducerea angiogenezei, cu asigurarea nutriţiei tumorii;
- capacitate de invazie în ţesuturile adiacente;
- apariţia metastazelor;
- reprogramarea metabolismului energetic;
- evitarea recunoaşterii celulelor canceroase de către sistemul imun, cu scăderea distrugerii acestora prin mecanisme imunitare(1).
Fazele carcinogenezei
Prima etapă a carcinogenezei este iniţierea. În această etapă, celulele normale sunt expuse unor factori cancerigeni, care produc alterări genetice care, dacă nu sunt reparate, conduc la mutaţii celulare ireversibile. Aceste celule cu mutaţii genetice au răspunsuri alterate la stimuli şi sunt avantajate în procesul de creştere în comparaţie cu celulele normale. A doua fază a carcinogenezei este promovarea (engl. promotion), în care mediul celular este alterat, astfel încât să promoveze dezvoltarea clonei celulare neoplazice. A treia fază este transformarea sau conversia celulelor mutante la celule canceroase. Este nevoie de intervale lungi de timp pentru ca aceste faze să se producă; în funcţie de tipul de cancer, între iniţierea cancerului şi apariţia unui cancer detectabil clinic trec între 5 şi 20 de ani. În a patra fază, progresia, alte modificări genetice conduc la proliferare celulară crescută, invazivitatea cancerului în ţesuturile învecinate şi metastazarea lui(3).
Ciclul celular
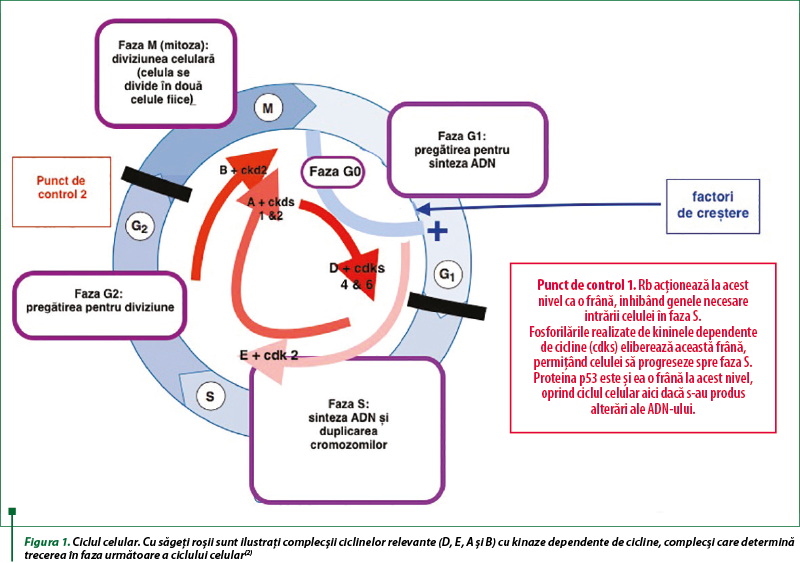
Toate celulele care se multiplică fac acest lucru prin ceea ce este cunoscut drept ciclul celular. Ciclul celular este o succesiune de faze, atent controlate, astfel încât, dacă lucrurile nu merg bine într-o anumită fază (de exemplu, apar alterări genetice), celula să nu poată progresa spre următoarele faze ale ciclului. În cancer, aceste mecanisme de control (checkpoints) sunt dereglate. Unele dintre medicamentele folosite în cancere restabilesc căile normale de semnalizare şi control sau perturbă activitatea căilor de semnalizare şi control care nu mai funcţionează normal.
Fazele ciclului celular sunt următoarele:
- G1 – faza de presinteză; are loc sinteza enzimelor necesare formării ADN-ului;
- S – faza de sinteză a ADN-ului; are loc replicarea ADN-ului;
- G2 – faza postsintetică; are loc sinteza componentelor necesare mitozei (proteine etc);
-
M – faza de mitoză; are loc diviziunea celulei, cu formarea a două celule-fiice. Subfazele mitozei sunt:
- profaza (dezorganizarea nucleului, cu evidenţierea cromozomilor şi diviziunea centrozomului, care se deplasează la polii opuşi ai celulei);
- metafaza (formarea fusului de diviziune, condensarea cromozomilor şi ataşarea lor pe fibrele fusului de diviziune);
- anafaza (clivarea cromozomilor şi migrarea fiecărei cromatide la unul dintre polii fusului de diviziune);
- telofaza (gruparea seturilor de cromozomi la polii opuşi ai celulei, dezorganizarea fusului de diviziune, decondensarea cromatidelor, reorganizarea membranei nucleare în jurul cromozomilor);
- G0 – faza nonproliferativă (repaus). Celulele care intră în faza 0 se diferenţiază şi pot rămâne în această fază în care nu se multiplică mult timp, până când primesc semnale stimulatoare de la factori de creştere.
Avansarea în ciclul celular are loc în felul următor(2):
- O celulă aflată în fază neproliferativă (G0) poate fi stimulată să se dividă de către diferiţi factori de creştere; ea intră astfel în faza G1 şi se pregăteşte pentru sinteza ADN-ului.
- Progresul prin ciclul celular este determinat de acţiunea secvenţială a complecşilor cicline/kinaze dependente de cicline (cdks). Aceşti complecşi determină trecerea în faza următoare a ciclului celular. Activitatea cdk-urilor este controlată de inhibitorii cdk.
- Dacă există vătămări la nivelul ADN-ului, produsele genei supresoare tumorale p53 opresc ciclul la punctul de control 1, permiţând repararea. Dacă repararea eşuează, este iniţiată apoptoza.
- După divizarea mitotică, celulele‑fiice pot intra în G1 şi pot continua să se multiplice sau pot intra pentru o perioadă lungă în faza neproliferativă G0.
- Carcinogeneza este un proces complex, cu mai multe stadii, care presupune multiple alterări genetice. Aceste alterări sunt de regulă favorizate de prezenţa unor factori epigenetici (mediu, cocarcinogene, factori hormonali), care nu produc cancer prin ei înşişi, dar care cresc probabilitatea ca mutaţiile genetice să conducă în final la apariţia cancerului(2).
Una sau mai multe mutaţii la nivelul ADN-ului unei celule pot transforma o celulă normală într-una canceroasă. Aceste mutaţii genetice pot fi moştenite sau dobândite în urma infectării cu virusuri sau a expunerii la factori fizici (radiaţii ionizante sau ultraviolete) ori la substanţe cancerigene, precum fumul de ţigară sau azbestul. Alterările genetice care conduc la apariţia cancerelor pot fi de două tipuri:
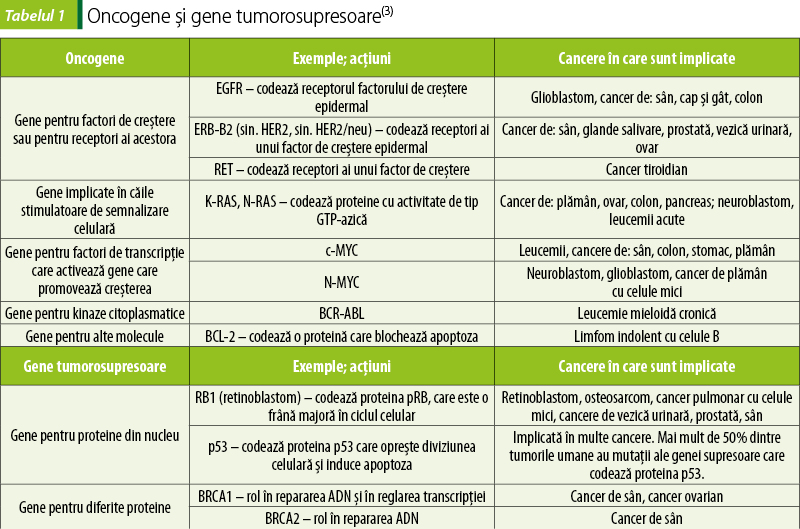
- Formarea oncogenelor (tabelul 1). Oncogenele, împreună cu alţi factori, determină proliferare necontrolată şi dediferenţierea celulelor.
- Scăderea exprimării genelor tumorosupresoare (tabelul 1); împreună cu alţi factori, aceasta conduce la scăderea apoptozei (morţii) celulelor canceroase şi la alterări ale telomerazelor. Inactivarea genelor tumorosupresoare poate fi evenimentul critic care conduce la apariţia cancerului(2).
Împreună, aceste evenimente conduc la dezvoltarea tumorii primare. Aceasta sintetizează metaloproteinaze, care distrug matricea celulară din vecinătatea tumorii, ceea ce favorizează invadarea ţesuturilor adiacente. Simultan, are loc procesul de angiogeneză, prin care se formează vase noi de sânge, care permit hrănirea tumorii. Celulele canceroase se pot desprinde din tumora primară şi pot circula pe cale limfatică sau sangvină, ajungând la alte organe, unde pot da naştere tumorilor secundare (metastaze)(2).
Oncogene şi gene supresoare ale tumorilor
Protooncogenele sunt gene care controlează procesele normale, fiziologice, de diviziune celulară, diferenţiere şi apoptoză. Anumite mutaţii genetice pot transforma protooncogenele în oncogene, care vor promova procese patologice de creştere celulară(2).
Genele tumorosupresoare sunt gene existente în celulele normale, având rolul de a suprima transformările maligne. De exemplu, proteina p53, care se formează sub acţiunea genei tumorosupresoare p53, este responsabilă de reglarea negativă a ciclului celular, permiţând ciclului celular să se întrerupă pentru a permite reparaţii şi corecţii asupra anumitor procese care se pot deteriora pe parcursul ciclului celular. În figura 1, locul de acţiune al proteinei p53 este punctul de control 1 (checkpoint 1), care controlează intrarea celulelor în faza de sinteză a acizilor nucleici. Inactivarea genei p53 face acest moment de control nefuncţional, permiţând mutaţiilor să se producă. Alte gene tumorosupresoare importante sunt genele care controlează reparaţiile la nivelul ADN-ului. Rolul acestor gene este să corecteze erorile care apar la nivelul ADN-ului în procesul de replicare sau sub acţiunea unor factori de mediu(2,3).
Proliferarea necontrolată
Celulele canceroase nu mai sunt sub controlul mecanismelor responsabile cu diviziunea celulară şi creşterea tisulară. Astfel, proliferarea celulelor canceroase devine autonomă.
Mai multe mecanisme induse de oncogene contribuie la această proliferare necontrolată:
- apar modificări la nivelul factorilor de creştere celulară, al receptorilor lor şi la nivelul căilor de semnalizare ale acestor receptori;
- apar modificări la nivelul reglatorilor ciclului celular: ciclinele, kinazele dependente de cicline (cdk) sau inhibitorii cdk;
- aparatul apoptotic care în mod fiziologic distruge celulele anormale nu mai funcţionează adecvat;
- apar modificări la nivelul telomerazelor;
- prin procesul de angiogeneză, se formează noi vase de sânge(2).
Factori de creştere
Factorii de creştere sunt eliberaţi în timpul proliferării celulare din matricea extracelulară, unde se află sechestraţi prin interacţiuni cu diferite componente ale acesteia. Eliberarea factorilor de creştere este realizată de enzimele matrix metaloproteinaze. Factorii de creştere determină ulterior semnale care stimulează multiplicarea şi proliferarea celulară.
Mai mulţi factori de creştere importanţi sunt în prezent ţinte pentru medicamentele folosite în cancere. Printre aceştia sunt:
- factorul de creştere derivat din plachete (PDGF);
- factorul de creştere fibroblastică (FGF);
- factorul uman de creştere epidermică;
- factorul vascular de creştere endotelială (VEGF).
Anumite medicamente pot bloca direct acţiunea acestor factori de creştere. Alte medicamente blochează receptorii acestor factorilor de creştere. Alte medicamente inhibă tirozinkinaza asociată receptorilor factorilor de creştere(2,4).
Reglatori şi căi de semnalizare
La nivelul celulelor există şi multe alte sisteme de semnalizare stimulatoare sau inhibitoare. În cancere se produc dereglări ale acestora; aceste dereglări pot fi ţinte ale acţiunii unor medicamente. Iată câteva exemple:
- Calea kinazelor Ras/Raf/MAP (unde MAP se referă la o mitogen-activated protein) este importantă în diviziunea, creşterea şi diferenţierea celulară(2).
- Calea Jak/Stat activată de mai multe citokine, care controlează sinteza şi eliberarea multor mediatori inflamatorii(2).
- JAK kinazele (JAK1 şi JAK2) sunt implicate în semnalizarea prin citokine şi factori de creştere, afectând hematopoieza şi funcţia sistemului imun. Dereglarea semnalizării mediate de JAK kinaze se întâlneşte în neoplazii mieloproliferative precum policitemia vera şi mielofibroza.
Telomeraze şi „imortalitatea“ celulelor canceroase
Telomerii sunt structuri aflate la capetele cromozomilor, care îi protejează de degradare, de rearanjare şi de fuziune cu alţi cromozomi. La fiecare diviziune celulară, o mică parte din aceşti telomeri se distruge, astfel că la un moment dat telomerii devin nefuncţionali. În acest moment, replicarea ADN-ului nu se mai produce, celula nu se mai divide şi se pregăteşte de apoptoză.
Telomerazele sunt enzime prezente în celulele cu diviziune rapidă, unde stabilizează telomerii. Telomerazele sunt absente din majoritatea celulelor somatice bine diferenţiate, dar aproape toate celulele cancerelor aflate în stadii avansate exprimă această enzimă. Acest lucru face ca celulele canceroase să fie mult mai puţin sensibile la procesele care conduc la distrugerea celulară fiziologică(2).
Angiogeneza
Tumorile mici, cu diametrul de 1-2 mm, pot obţine nutrienţi din micromediul imediat înconjurător, prin difuziune, dar orice creştere suplimentară necesită dezvoltarea de noi vase de sânge. Angiogeneza apare ca răspuns la factorii de creştere produşi de tumora în creştere(2).
Nediferenţierea şi pierderea funcţiilor celulare
În mod normal, celulele somatice apărute în urma multiplicării celulare capătă aceleaşi funcţii ca celula-mamă. Celulele canceroase nu se mai diferenţiază, iar celulele slab diferenţiate se multiplică mai repede şi sunt însoţite de un prognostic mai prost(2).
Invazivitatea
Celulele normale dezvoltă în timpul diferenţierii şi al creşterii ţesuturilor sau organelor anumite relaţii spaţiale unele în raport cu altele. Aceste relaţii ţin celulele asemănătoare unele lângă altele, le permit funcţionarea unitară şi le protejează.
Celulele canceroase se desprind de ţesutul unde s-au format şi se pot desprinde şi de tumoră, putând invada ţesuturile învecinate. Eliberarea de către celulele canceroase de metaloproteinaze şi alte enzime care distrug matricea celulară favorizează invadarea ţesuturilor adiacente cu celule canceroase(2).
Metastazarea
Metastazele sunt tumori secundare, formate din celule eliberate din tumora primară şi care au atins alte locuri, în principal prin vasele sangvine sau limfatice(2).
Metastazele sunt cauza principală a mortalităţii şi morbidităţii în majoritatea cancerelor.
Nedetectarea de către sistemul imun
Fiziologic, limfocitele T, care recunosc antigenul provenit din celulele canceroase, antigen prezentat de către moleculele de clasă I ale complexului major de histocompatibilitate de la suprafaţa celulelor prezentatoare de antigen, se activează şi atacă celula canceroasă care exprimă antigenul, distrugând-o(7).
Celulele canceroase dezvoltă mecanisme care le fac să nu mai fie recunoscute de sistemul imun; în acest fel, acesta nu le mai distruge, iar ele pot prolifera.
Terapia antineoplazică
Cancerele pot fi tratate prin mai multe modalităţi(3).
Chirurgia. Îndepărtarea fizică a tumorilor solide este cea mai veche modalitate de tratament al cancerelor şi rămâne cea mai bună metodă terapeutică pentru cancere detectate în stadii incipiente.
Radioterapia. Aceasta – tot un tratament local, ca şi chirurgia – determină micşorarea tumorilor. Radioterapia şi chirurgia nu sunt însă eficiente împotriva neoplaziilor sistemice, cum sunt cancerele hematologice, şi nici nu pot fi folosite împotriva micrometastazelor, care sunt neidentificabile clinic. Pentru aceste situaţii se folosesc terapiile antineoplazice sistemice.
Chimioterapia presupune administrarea medicamentelor de sinteză care, prin diverse mecanisme, împiedică diferite etape din multiplicarea celulelor canceroase sau interferează cu procese care dau celulelor canceroase acele caracteristici despre care am vorbit la începutul lucrării şi care le fac diferite de celulele sănătoase. Dintre chimioterapice, citotoxicele sunt medicamente care omoară celulele neoplazice.
Medicamentele biologice provin din surse biologice şi interferează şi ele cu procesele şi caracteristicile specifice cancerului. Multe dintre aceste medicamente biologice sunt mult mai specifice faţă de chimioterapicele clasice citotoxice şi acţionează ţintit asupra componentei dereglate prin diferite mutaţii care stă la baza cancerului.
Imunoterapia foloseşte diferite medicamente pentru a stimula sistemul imun al organismului să lupte cu cancerul. Anumite medicamente fac aceasta ridicând anumite frâne care apar la nivelul sistemului imun.
Terapia genică este ultima apariţie în arsenalul terapeutic antineoplazic. În august 2017, în SUA a fost aprobat pentru punerea pe piaţă primul astfel de dispozitiv terapeutic, Kymriah® (tisagenlecleucel), pentru tratamentul leucemiei limfoblastice acute cu celule B. Tisagenlecleucel este un tip de terapie numită terapie CAR-T (CAR sunt iniţialele de la Chimeric Antigen Receptor). Această terapie a fost aprobată pentru că într‑un studiu efectuat pe 31 de pacienţi cu leucemie limfoblastică acută a produs o remisiune completă şi fără precedent într-un număr record de cazuri(5).
Clasificarea terapiei după scop
Terapie curativă
Tratamentul medicamentos administrat pentru a vindeca pacientul cu cancere locale sau regionale poartă numele de terapie curativă(4).
Chimioterapia este curativă pentru câteva tipuri de cancere: leucemii, limfoame, choriocarcinoame şi cancer testicular(3).
Atunci când cancerul a metastazat la locuri îndepărtate, tratamentul curativ nu este de obicei posibil. Medicamentele anticanceroase pot fi administrate pacienţilor cu boală metastatică pentru a încetini progresia cancerului şi pentru a prelungi supravieţuirea, precum şi pentru a reduce dimensiunile tumorii şi, prin aceasta, a reduce simptomele neplăcute asociate(3).
Terapie adjuvantă
Terapia adjuvantă este administrarea sistemică de medicamente anticanceroase pentru a eradica boala micrometastatică după intervenţii terapeutice localizate, precum chirurgia sau radioterapia. Scopul terapiei adjuvante este de a reduce ratele de recurenţă şi de a prelungi supravieţuirea pe termen lung. Terapia adjuvantă este administrată pacienţilor cu afecţiuni maligne potenţial curative şi care nu au boală detectabilă clinic după operaţie sau radioterapie. Eficacitatea acestei terapii este evaluată prin ratele de recurenţă şi de supravieţuire(3).
Terapie neoadjuvantă
Terapia neoadjuvantă reprezintă folosirea antineoplazicelor preoperator, în scopul reducerii masei tumorale şi al distrugerii micrometastazelor. Astfel, reducerea dimensiunii tumorii primare permite o procedură chirurgicală mai puţin invazivă(3).
Terapie paliativă
Administrarea medicamentelor anticanceroase pacienţilor cu cancere terminale are ca scop reducerea simptomelor produse de tumori. Acest tip de terapie se numeşte terapie paliativă(3,6).
Rezistenţa la terapia anticanceroasă
Rezistenţa pe care celulele neoplazice o manifestă faţă de medicamentele anticanceroase poate fi primară (tumora nu e afectată de medicamentul administrat) sau dobândită (la începutul tratamentului, cancerul răspunde la terapie, dar pe parcurs tumora devine neresponsivă)(2).
Multe dintre medicamentele anticanceroase sunt acompaniate de teste genetice de diagnostic, care arată dacă tumora poartă sau nu mutaţia care o face să răspundă la medicamentul respectiv. Astfel, se poate testa rezistenţa primară la antineoplazice(3).
Rezistenţa dobândită apare pentru că celulele tumorale acumulează noi mutaţii genetice pe măsură ce se dezvoltă, majoritatea tumorilor fiind eterogene din punct de vedere genetic.
Rezistenţa poate apărea prin următoarele mecanisme(2):
- scăderea concentraţiei de medicamente citotoxice în celule, ca urmare a creşterii expresiei proteinelor de eflux al medicamentelor, aflate pe membrana celulară a celulelor (de exemplu, glicoproteina P/MDR1) – aşa apare rezistenţa la doxorubicină şi vinblastină;
- scăderea concentraţiei de medicamente citotoxice în celule, ca urmare a scăderii penetrării intracelulare – aşa apare rezistenţa la metotrexat;
- activarea insuficientă a medicamentului – aşa apare rezistenţa la fluorouracil, citarabină sau mercaptopurină;
- creşterea inactivării – aşa apare rezistenţa la citarabină şi mercaptopurină;
- utilizarea sporită de către celulele canceroase a căilor metabolice alternative – aşa apare rezistenţa la antimetaboliţi;
- repararea rapidă a leziunilor induse de medicamente – alterările produse de medicamentele alchilante sunt uneori corectate de celula canceroasă;
- modificarea enzimei la nivelul căreia acţionează medicamentul – la doxorubicină dezvoltă rezistenţă celulele care prezintă o topoizomerază II modificată;
- mutaţii genetice (de exemplu, la nivelul genei p53 sau supraexprimarea familiei de gene Bcl-2), cu apariţia unor molecule-ţintă rezistente.
Pentru a minimiza efectele rezistenţei dobândite ale tumorilor la medicaţia antineoplazică, se folosesc schemele combinate de chimioterapie.
Reacţii adverse, contraindicaţii, precauţii în folosirea antineoplazicelor
Mielosupresia
Mielosupresia este una dintre cele mai frecvente toxicităţi ale terapiei anticanceroase citotoxice. Apare prin afectarea măduvei hematoformatoare, care conţine celule cu o rată de reînnoire rapidă (turnover rapid), ceea ce le face foarte susceptibile la acţiunea citotoxică a citostaticelor(4,7).
Medicamentele citotoxice pot afecta eritrocitele, neutrofilele şi trombocitele. Pot apărea deci anemie, neutropenie şi trombocitopenie, ale căror complicaţii (fatigabilitate, infecţii, sângerări) sunt generatoare de morbiditate şi mortalitate semnificative(4).
Administrarea profilactică a factorilor de creştere hematopoietici poate proteja împotriva efectelor mielosupresive ale chimioterapiei(8).
Unul dintre motivele pauzelor dintre seriile de chimioterapie este acela de a permite măduvei hematoformatoare să se refacă. Toxicitatea hematologică este unul dintre factorii limitativi ai chimioterapiei; afectarea hematologică severă poate determina amânarea unei serii de tratament, poate impune folosirea unor doze mai mici sau poate necesita renunţare la tratament.
Toxicitatea gastrointestinală
Greaţa şi vărsăturile, mucozita, xerostomia, constipaţia şi diareea sunt reacţii adverse foarte frecvente ale medicamentelor antineoplazice. Tractul gastrointestinal este foarte susceptibil la chimioterapia citotoxică, deoarece şi la acest nivel celulele au un turnover rapid.
Aceste reacţii adverse scad mult calitatea vieţii şi pot fi atât de deranjante, încât determină pacientul să renunţe la tratament. Deshidratarea este o complicaţie serioasă a vărsăturilor şi diareii, care trebuie abordată corespunzător(3).
Strategia optimă de gestionare a acestor reacţii adverse este prevenirea lor. Din păcate, de multe ori prevenţia nu este suficientă. Tratamentul acestor reacţii adverse este simptomatic şi suportiv.
Toxicitatea dermatologică
Celulele epiteliale şi foliculii piloşi sunt extrem de sensibili la acţiunea citotoxică a chimioterapicelor. Pot apărea: alopecia, modificările unghiilor, hiperpigmentarea pielii, fotosensibilizarea, sindromul mână-picior (eritrodisestezie palmo-plantară), pielea uscată (xerostomie), erupţii papulo-pustulare (acneiforme), rash etc. Uneori, reacţiile cutanate sunt severe, până la sindrom Stevens-Johnson, celulită, sepsis şi fasciită necrozantă(3).
Neurotoxicitate
Metotrexatul, ifosfamida şi asparaginaza determină encefalopatie. Citarabina, fluorouracilul şi capecitabina sunt asociate cu toxicitatea cerebeloasă. Multe chimioterapice (vincristina, cisplatina, oxaliplatina, paclitaxelul, docetaxelul, cabazitaxelul, ixabepilona, bortezomibul, talidomida şi lenalidomida) pot determina simptome de neuropatie periferică(4).
Toxicitatea cardiacă
Antineoplazicele pot produce cardiomiopatie, aritmii şi hipertensiune arterială. Cardiomiopatia indusă de antracicline este dependentă de doza cumulată a pacientului. Multe terapii ţintite prezintă cardiotoxicitate.
Toxicitate la nivelul aparatului renal
Compuşii cu platină şi metotrexatul sunt nefrotoxice. Pentru prevenirea nefrotoxicităţii este necesară hidratarea corespunzătoare a pacientului înaintea administrării citostaticului. Nefrotoxicitatea indusă de metotrexat poate fi prevenită prin alcalinizarea urinei şi prin folosirea antidotului Leucovorin® (folinat de calciu).
Cistita hemoragică indusă de ifosfamidă poate fi prevenită prin utilizarea concomitentă de mesna(6).
Reacţii de hipersensibilitate
Multe anticanceroase sunt asociate cu reacţii de hipersensibilitate mediate de imunoglobulina-E. Anticorpii monoclonali sunt frecvent asociaţi cu reacţiile alergice. Pacientului trebuie să i se aplice premedicaţie cu antihistaminice H1 şi corticosteroizi şi să fie monitorizat după administrare, mai ales la începutul tratamentului(4).
Toxicitate specifică de organ
Numeroase substanţe pot avea diferite reacţii adverse specifice la nivelul anumitor organe. Câteva dintre ele sunt enumerate mai jos.
Osteonecroza maxilarului
Tratamentul cu bevacizumab şi sunitinib poate fi un factor de risc pentru osteonecroza maxilarului(9).
Toxicitate oftalmologică
Antineoplazicele care acţionează inhibitor la nivelul receptorului factorului de creştere epidermal (EGFR) (cetuximab, erlotinib, gefitinib şi panitumumab) pot produce keratită şi keratită ulcerativă, care pot duce la perforarea corneei şi la orbire(9).
Toxicitate pulmonară
Bleomicina, clorambucilul şi alte medicamente pot produce fibroză pulmonară(4). Multe antineoplazice determină boală pulmonară interstiţială(10).
Malignitatea secundară
Riscurile apariţiei unor afecţiuni maligne secundare (leucemie mieloidă acută, limfoame, cancer al vezicii urinare, sarcom osos) trebuie luate în considerare la folosirea unor antineoplazice în tratamentul cancerelor hematologice sau al tumorilor solide(4).
Reacţii la locul administrării
Extravazarea este infiltrarea neintenţionată a unui medicament în ţesutul care înconjoară vena, în timpul administrării unei perfuzii. Medicamentele cu acţiune vezicantă (alcaloizii din Vinca, antraciclinele) produc la extravazare necroză tisulară, uneori ireversibilă(6).
Extravazarea necesită tratament de urgenţă nespecific (ridicarea membrului în care s-a făcut administrarea, extracţia agentului, aplicarea de cald sau rece), dar şi specific medicamentului extravazat (folosirea de antidoturi, de exemplu dexrazoxan, în cazul extravazării doxorubicinei)(8).
Reacţii severe la perfuzie
Medicamentele biologice au un tip specific de reacţii adverse care pot apărea în timpul perfuziei sau la scurt timp după administrare şi care se datorează în general mecanismelor imunologice.
Astfel de reacţii pot apărea la până la jumătate dintre pacienţii trataţi cu anticorpi monoclonali.
Manifestările severe includ bronhospasm, hipoxie, edem pulmonar şi hipertensiune arterială. Alte simptome pot fi tuse, respiraţie şuierătoare, edem laringian, dispnee, congestie nazală şi rinită alergică.
Pacienţii trebuie premedicaţi cu antihistaminice, antipiretice şi corticosteroizi şi monitorizaţi frecvent în timpul întregii perfuzii. Pacienţii cu tulburări respiratorii obstructive pot avea nevoie de bronhodilatatoare şi corticosteroizi inhalatori(11).
Antineoplazicele şi capacitatea reproductivă
Chimioterapia citotoxică este potenţial gonadotoxică la om. Pacienţii care doresc să aibă copii trebuie să discute cu medicul potenţialul de revenire la starea fertilă şi oportunitatea prelevării şi conservării de ovule, respectiv de spermă, înainte de începerea terapiei(4).
Antineoplazicele şi sarcina
Multe dintre antineoplazice sunt şi teratogene, de aceea sarcina este contraindicată pe parcursul administrării majorităţii antineoplazicelor, ba chiar şi o perioadă după întreruperea administrării(6).
De exemplu, în timpul tratamentului cu anticorpul monoclonal obinutuzumab şi încă 18 luni după terminarea tratamentului, sarcina trebuie evitată prin folosirea metodelor contraceptive eficace(9).
Antineoplazicele şi alăptarea
Antineoplazicele, utilizate în monoterapie sau în diferite scheme terapeutice combinate, sunt contraindicate pe perioada alăptării. Alăptarea trebuie întreruptă pe perioada tratamentelor anticanceroase şi reluată la un interval variabil de timp după terminarea tratamentului, care este mai mare atunci când se folosesc asocieri de anticanceroase(3).
Evaluarea răspunsului la terapia anticanceroasă
Criteriile RECIST pentru evaluarea chimioterapiei ţin seama de evoluţia tumorii ţintite, după aplicarea tratamentului antineoplazic. Astfel, sunt definiţi următorii termeni:
- răspuns complet – dispariţia tuturor leziunilor; reducerea dimensiunilor nodulilor limfatici patologici la mai puţin de 1 mm;
- răspuns parţial – o reducere cu cel puţin 30% a sumei diametrelor leziunilor, comparativ cu dimensiunile iniţiale;
- afecţiune progresivă – o creştere cu cel puţin 20% a sumei diametrelor leziunilor, comparativ cu valoarea minimă a acesteia (care poate fi cea iniţială sau orice altă valoare care pe parcursul terapiei a fost cea mai mică); pentru a fi luată în calcul, creşterea trebuie să fie de cel puţin 5 mm; orice apariţie a unei leziuni noi este considerată progresie a bolii;
- afecţiune stabilă – evoluţie care pe baza sumei diametrelor leziunilor nu poate fi considerată nici răspuns parţial, nici progres al bolii;
- supravieţuire lipsită de boală – intervalul de timp scurs de la apariţia răspunsului complet până la reapariţia bolii sau până la deces;
- supravieţuire generală totală – timpul de la începutul tratamentului până la deces.
Chimioterapice citotoxice
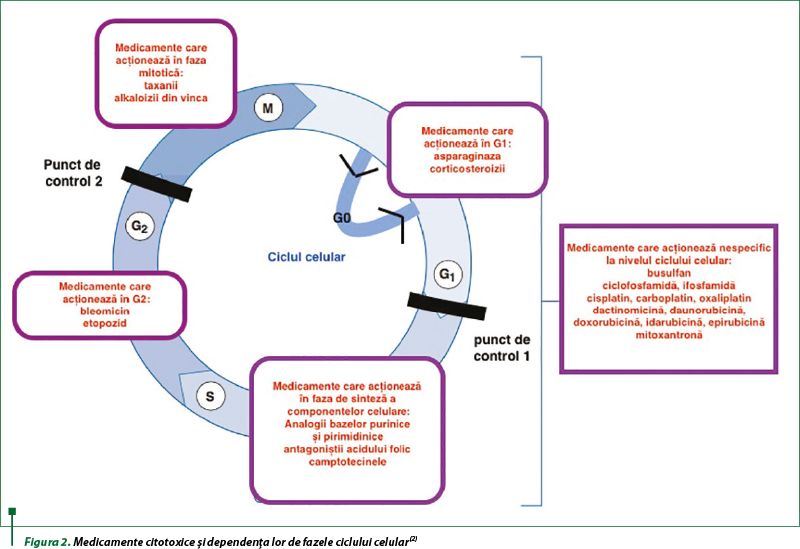
Chimioterapicele citotoxice afectează celulele canceroase prin distrugerea ADN-ului, interferarea cu sinteza ADN-ului sau inhibarea diviziunii celulare.
Unele citotoxice acţionează specific în anumite etape ale ciclului celular, altele sunt nespecifice faţă de fazele acestuia (figura 2).
Agenţi alchilanţi (tabelul 2)
Medicamentele alchilante conţin în moleculă grupări alchil foarte reactive, capabile să realizeze legături covalente cu sedii nucleofile de la nivelul ADN-ului, formând punţi („cross-links“) între catene ADN, cu împiedicarea replicării(7,2).
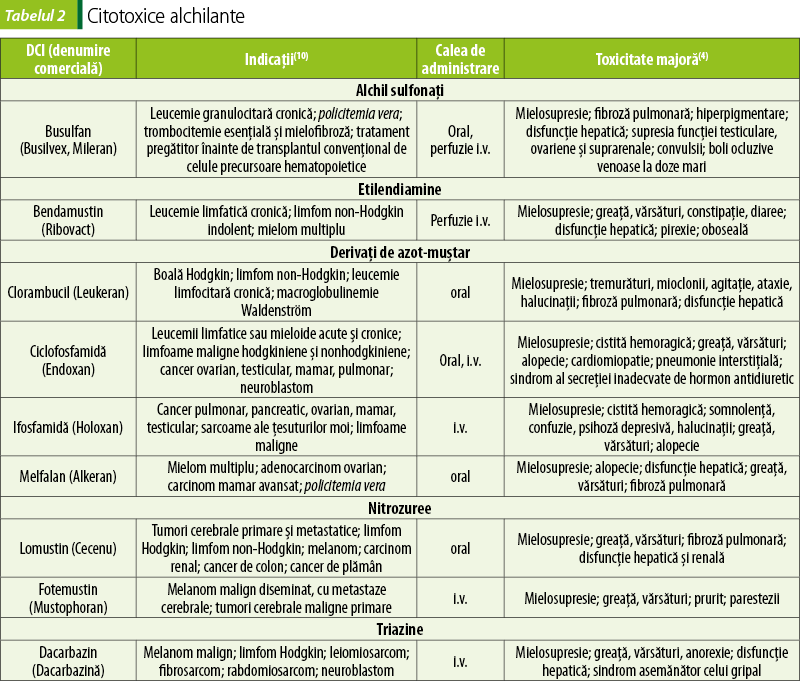
Pentru limitarea toxicităţii oxazafosforinelor (ciclofosfamidă, ifosfamidă), administrarea acestora se face împreună cu mesna (Uromitexan®, sol. inj.), care leagă şi detoxifică metaboliţii urotoxici ai acestora în vezica urinară şi în rinichi(10).
Antimetaboliţi (tabelul 3)
Antimetaboliţii blochează sau perturbă major căi metabolice implicate în sinteza ADN-ului(2).
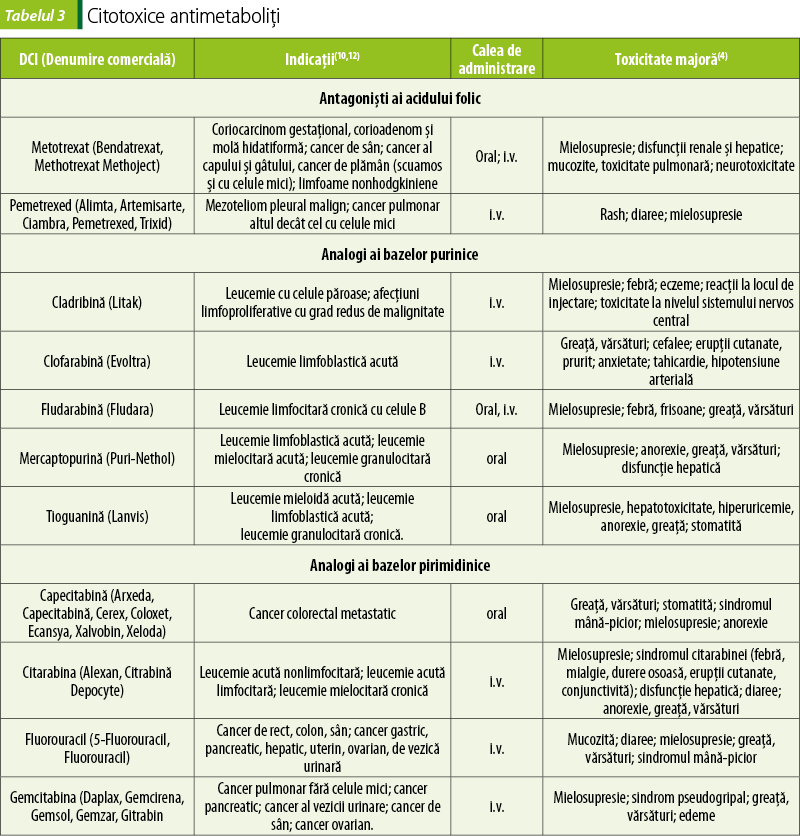
Pentru limitarea toxicităţii metotrexatului, se administrează folinat de calciu (Folinat de calciu®, Folcasin®, Leucovorin®)(9).
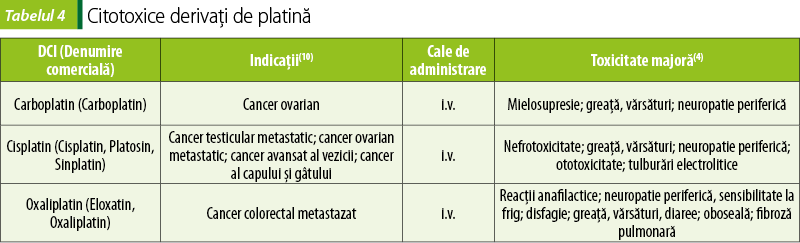
Compuşi cu platină (tabelul 4)
Compuşii cu platină acţionează similar citotoxicelor alchilante. Determină punţi intracatenare şi intercatenare la nivelul ADN-ului, care conduc la denaturarea acidului nucleic(2). Acţionează în toate fazele ciclului celular.
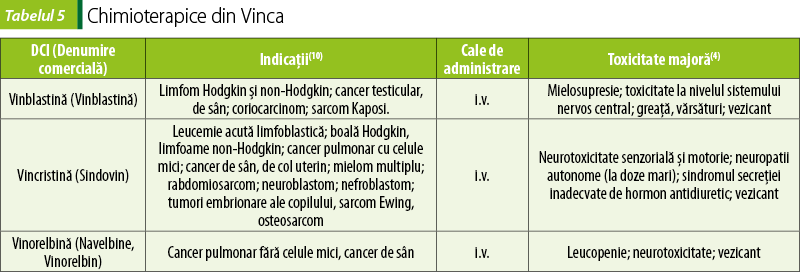
Derivaţi din plante
Alcaloizi din Vinca (tabelul 5)
Vincristina, vinblastina şi analogul semisintetic vinorelbină se leagă de tubulină şi inhibă polimerizarea sa în microtubuli, împiedicând formarea fusurilor de diviziune. Opresc astfel multiplicarea celulară în metafază. Efectele lor se manifestă numai în timpul mitozei(2).
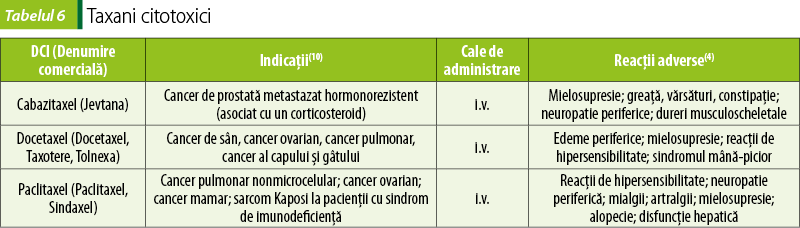
Taxani (tabelul 6)
Docetaxel, paclitaxel şi cabazitaxel împiedică activitatea microtubulilor(2,4). Taxanii inhibă funcţiile mitotice şi interfaza celulară, prin perturbarea reţelei microtubulare a celulelor. Se leagă de tubulină şi facilitează asamblarea tubulinei în microtubuli, simultan inhibând dezasamblarea lor, astfel stabilizându-i(10).
Alte medicamente care perturbă polimerizarea microtubulilor
Eribulin (Halaven®) se foloseşte în tratamentul anumitor cazuri de cancer de sân. Se administrează i.v. Reacţiile adverse includ mielosupresie, alopecie, greaţă, constipaţie, stomatită, neuropatie periferică(4,10).
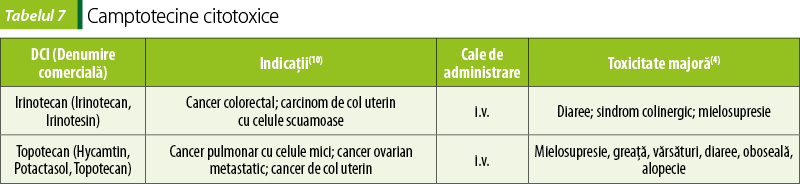
Camptotecine (tabelul 7)
Irinotecan şi topotecan sunt inhibitori de topoizomerază I. Topoizomerazele sunt proteine nucleare esenţiale pentru menţinerea configuraţiei spaţiale helicoidală a ADN-ului. Topoizomeraza I clivează un singur lanţ al ADN-ului, cu supercompactarea lui(8).
Etopozid
Etopozida (Etoposide®, Sintopozid®) inhibă topoizomeraza II. Este indicat în tumori testiculare, cancere pulmonare, limfoame maligne hodgkiniene şi nonhodgkiniene, leucemie acută nonlimfocitară, cancer de sân, coriocarcinom placentar şi sarcom Kaposi(10).
Reacţiile adverse importante sunt: mielosupresie, greaţă, vărsături, alopecie, mucozită, hipotensiune arterială (la perfuzare rapidă), reacţii de hipersensibilitate, febră, bronhospasm(4).
Antibiotice citotoxice
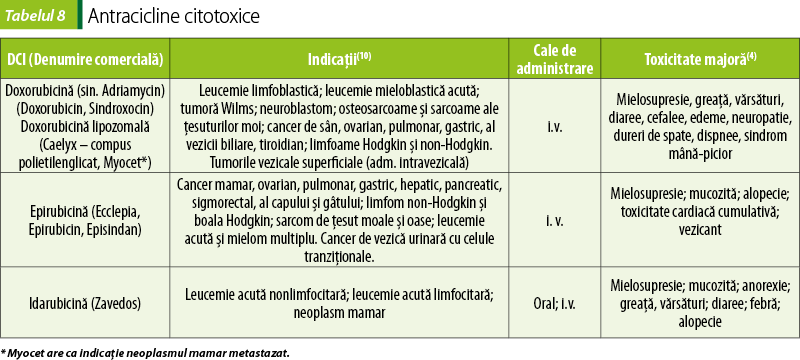
Antracicline (tabelul 8)
Antraciclinele se intercalează între perechile de baze adiacente ale ADN-ului dublu catenar, cu inhibarea ADN-ului, ARN-ului şi sintezei proteice(10).
Medicamente care hipometilează ADN-ul (tabelul 9)
Prin inhibarea ADN-metiltransferazei se produce hipometilarea promotorului unei gene, care poate conduce la reactivarea genelor de supresie tumorală. Consecutiv, se induce diferenţierea celulară sau îmbătrânirea celulară, urmate de moarte celulară programată(10).

Alte chimioterapice (tabelul 10)
Crisantaspaza este o enzimă care transformă asparagina în acid aspartic şi amoniac. Se foloseşte în leucemie limfoblastică acută, deoarece celulele canceroase din acest tip de leucemie au pierdut capacitatea de a sintetiza asparagina şi depind deci de o sursă exogenă(2).
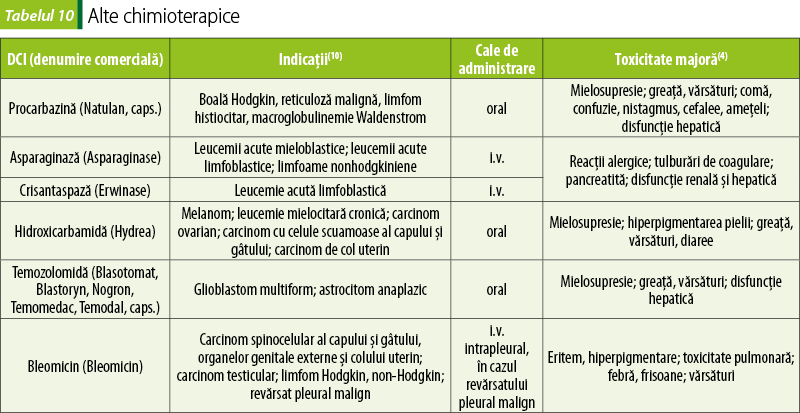
Hidroxicarbamida inhibă ribonucleotid-reductaza şi opreşte ciclul celular în faza G1 sau anterior sintezei ADN‑ului(4).
Temozolomida este un agent alchilant. Metabolitul său activ metilează guanina din structura ADN‑ului, cu inhibarea transcripţiei genice(10).
Bleomicina se leagă de ADN şi determină scindarea acestuia(10).
Terapia fotodinamică
Padeliporfin (Tookad®) este folosit în tratarea adenocarcinomului de prostată. Prin activare cu lumină laser cu lungimea de undă de 753 nm, declanşează o serie de reacţii fiziologice care duc la ocluzia vascularizării tumorii, la necroza autopropagată a celulelor tumorale datorate peroxidării membranelor celulare.
Chimioterapice ţintite
Anticorpi monoclonali (tabelul 11)
Anticorpii monoclonali sunt o posibilitate ţintită de a ataca celulele neoplazice. Anticorpii sunt proteine sintetizate de sistemul imun, care recunosc şi se leagă specific de antigen. Antigenul este reprezentat de o anumită moleculă expusă la suprafaţa unei celule. Anticorpii monoclonali sunt obţinuţi pe cale industrială prin diferite tipuri de biotehnologii.
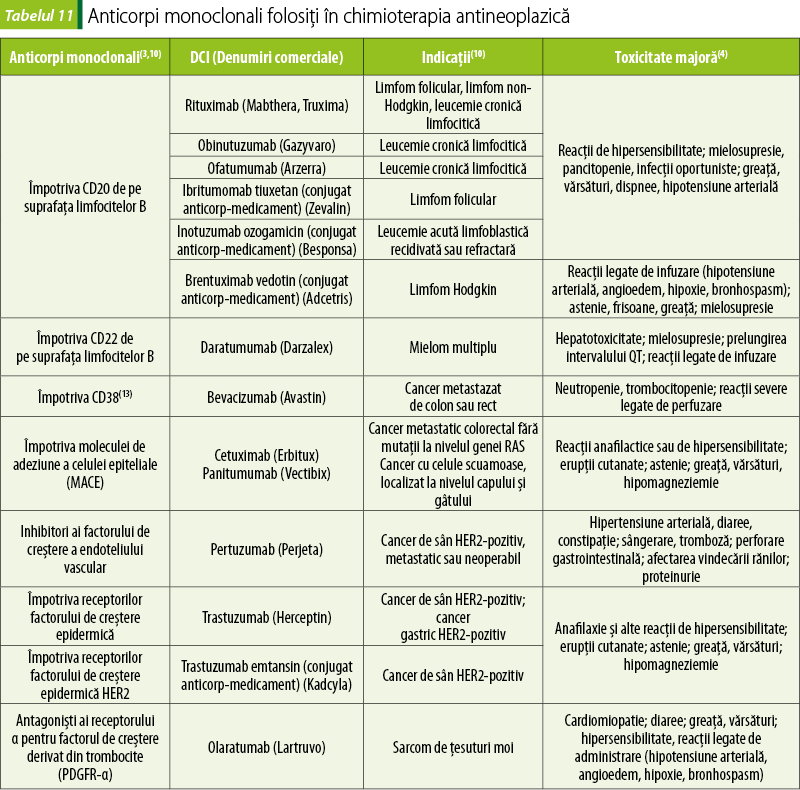
Celulele canceroase exprimă antigene specifice, pe care celulele sănătoase nu le prezintă. Anticorpii monoclonali identifică aceste antigene prezente pe celulele canceroase şi acţionează mult mai selectiv asupra acestor celule, fiind mult mai specifice decât vechile chimioterapice(6).
Anticorpii monoclonali acţionează la exteriorul celulei canceroase, spre deosebire de alte molecule mai mici, care pătrund în celulă şi acţionează la nivelul unor căi de semnalizare intracelulară importante în multiplicarea celulară (inhibitorii de tirozin kinază, inhibitorii de cicline etc.). Aceste medicamente se administrează în perfuzie intravenoasă.
Limfocitele au exprimate pe suprafaţa lor proteine, numite clusteri de diferenţiere (cluster of differentiation; CD), care funcţionează ca receptori sau ca liganzi pentru alţi receptori. Aceşti clusteri de diferenţiere sunt ţinte pe care anumiţi anticorpi monoclonali au fost sintetizaţi să-i recunoască şi să se lege de celulele tumorale care exprimă aceste molecule de recunoaştere.
Anticorpii monoclonali antineoplazici acţionează fie la nivelul unor celule canceroase care exprimă anumiţi CD, fie la nivelul unor factori de creştere şi ai receptorilor lor.
Daratumumab induce liza celulelor tumorale prin citotoxicitate dependentă de complement, citotoxicitate mediată celular dependentă de anticorpi, şi fagocitoză celulară dependentă de anticorpi în tumorile care exprimă CD38(13).
Conjugaţi anticorp-medicament citotoxic
Un conjugat anticorp-medicament este alcătuit din trei părţi:
- un anticorp care identifică şi se leagă de antigenul exprimat la suprafaţa celulei-ţintă;
- un medicament care produce moartea celulei-ţintă;
- un sistem de cuplare care ataşează medicamentul de molecula anticorpului şi care apoi eliberează medicamentul în interiorul celulei-ţintă.
De exemplu, brentuximab vedotin este un conjugat anticorp-medicament alcătuit dintr-un anticorp monoclonal care se ataşează la CD30 exprimat pe celulele canceroase, cuplat cu molecula citotoxică monometil auristatin E. Brentuximab este un anticorp recombinant himeric din clasa imunoglobulinei G1, produs prin tehnologia ADN-ului recombinant în celule ovariene de hamster chinezesc. Anticorpul monoclonal eliberează monometil auristatin E în celulele canceroase CD30 pozitive şi, odată aflat în interiorul celulelor canceroase, acesta opreşte diviziunea celulară, acţionând la nivelul microtubulilor, ceea ce duce în final la moartea celulelor canceroase. Se foloseşte în limfom Hodgkin, cu celule tumorale CD30 pozitive, recidivant sau nonrespondent la alte intervenţii terapeutice(10,14).
Inhibitori de tirozinkinaze (tabelul 12)
Aceste medicamente sunt molecule mici care pătrund în interiorul celulei canceroase şi inhibă domeniile tirozinkinazice intracelulare ale receptorilor unor factori de creştere sau alte proteine cu funcţie tirozinkinazică implicate în semnalizarea celulară. Induc astfel oprirea ciclului celular şi apoptoza celulelor canceroase(1).
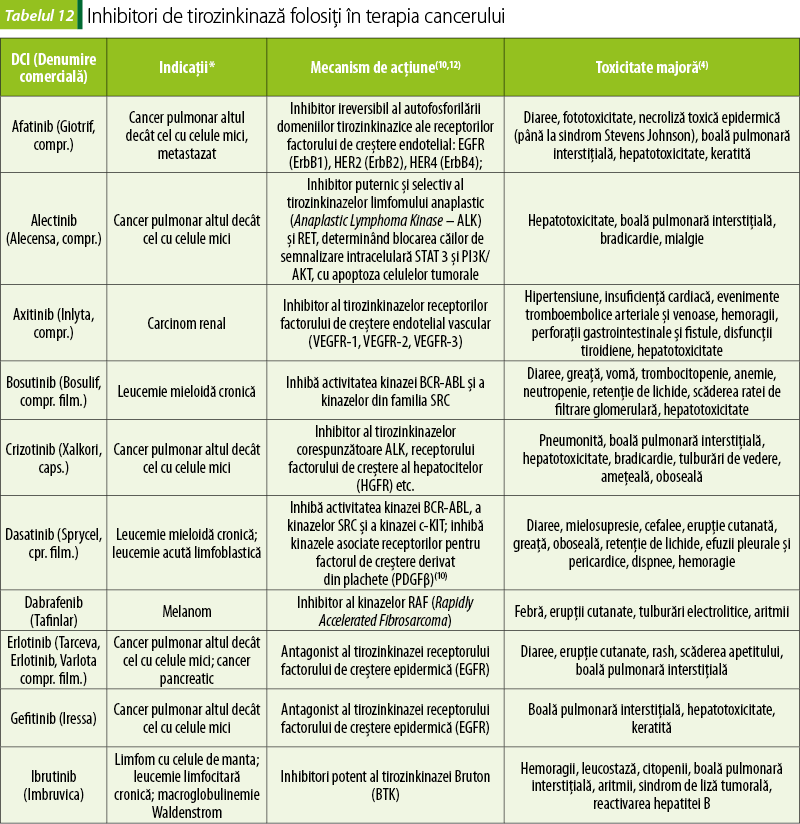
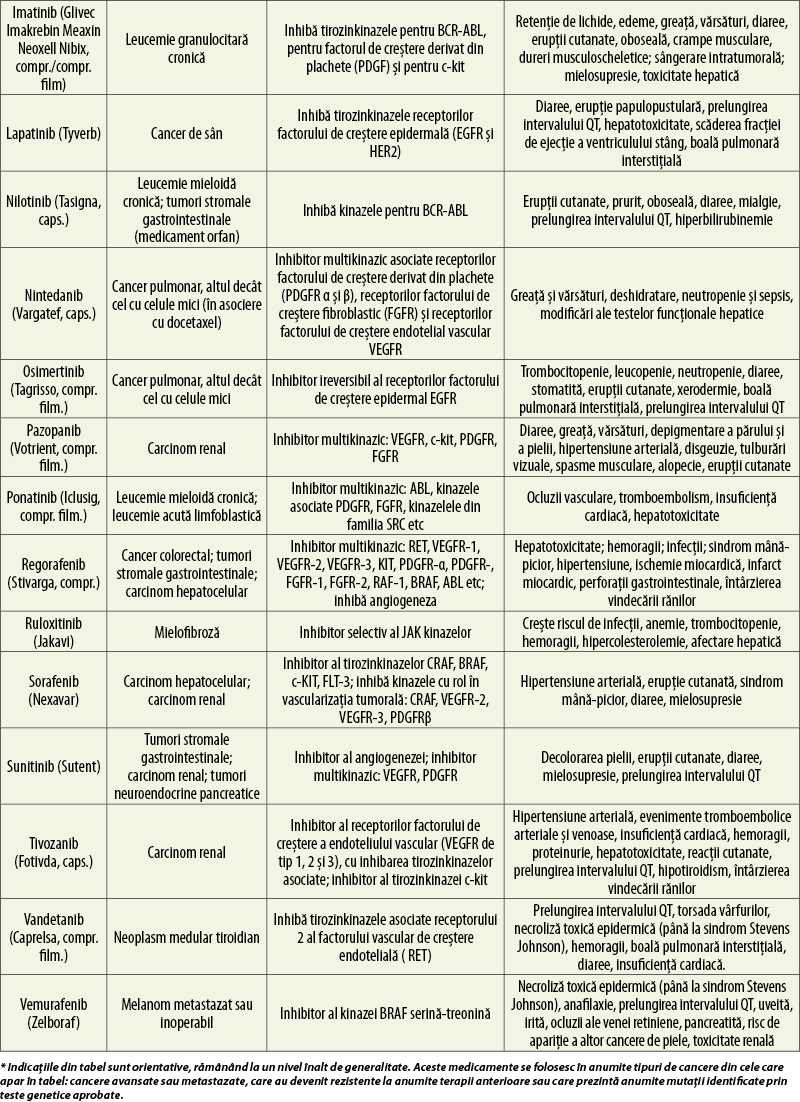
Un avantaj important al acestor medicamente este că se administrează oral, în una sau două prize zilnice, putând fi folosite în tratamentul în ambulatoriu al pacienţilor ale căror tumori exprimă mutaţii ale tirozinkinazelor pe care medicamentele respective le inhibă.
Inhibitori ai ciclinelor (tabelul 13)
Kinazele dependente de cicline sunt activate de legarea la cicline şi joacă un rol crucial în căile de semnalizare care duc la progresia şi proliferarea celulară. Complexul ciclinei D-CDK4&6 reglează progresia ciclului celular prin fosforilarea proteinei retinoblastom (pRb); formarea acest complex permite celulei să intre în faza S a ciclului celular, când ADN-ul se replică.

Studii clinice demonstrează că asocierea terapiei endocrine cu un inhibitor al CDK4 &6 este mai bună decât terapia endocrină în monoterapie în tratamentul tumorilor de sân dependente de hormoni sexuali(15).
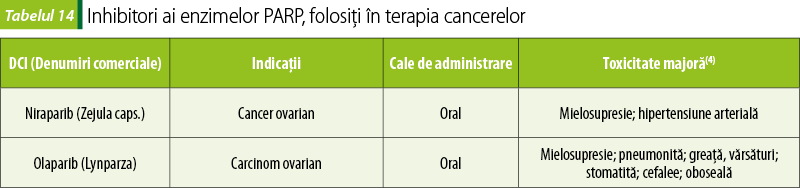
Inhibitori ai enzimelor care intervin în repararea ADN‑ului (tabelul 14)
Blocarea enzimelor poli(ADP-riboză) polimerază (PARP; PARP1 şi PARP2) face ca ADN-ul deteriorat al celulelor canceroase să nu poată fi reparat şi, ca urmare, celulele canceroase să moară. Medicamentele care blochează PARP sunt folosite în tratamentul cancerului.
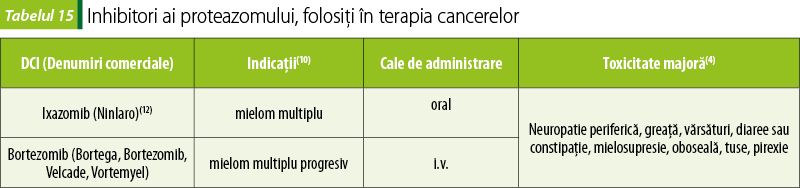
Inhibitori ai proteazomului (tabelul 15)
Proteazomii sunt complexe proteice care degradează proteinele nefolositoare sau deteriorate prin proteoliză.
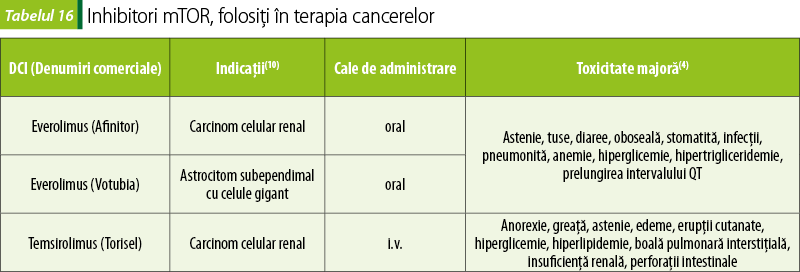
Inhibitori ai mTOR (tabelul 16)
Inhibarea mTOR suprimă producţia de proteine care reglează progresia prin ciclul celular şi angiogeneză. Everolimus este un imunosupresor şi antineoplazic derivat de sirolimus (rapamicină). Everolimus reduce activarea şi proliferarea limfocitelor B şi T. Temsirolimus reduce activitatea unor factori de creştere şi a unor kinaze(10).
Medicamente care inhibă BCL-2
Venetoclax (Venclyxto®) este un medicament folosit în anumite tipuri de leucemie limfocitară, care acţionează promovând apoptoza celulelor canceroase. Este un inhibitor puternic şi selectiv al proteinei BCL-2, o proteină antiapoptotică, prezentă în exces la nivelul celulelor B din LLC. BLC-2 favorizează supravieţuirea celulelor tumorale şi a fost asociat cu rezistenţa la chimioterapie(16).
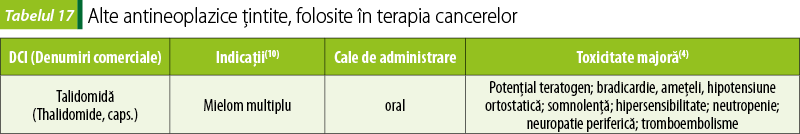
Antineoplazice hormonale
Glucocorticoizi
Datorită efectelor asupra limfocitelor, corticosteroizii sunt folosiţi în tratamentul afecţiunilor maligne hematologice: limfoame, leucemii limfocitare şi mielom multiplu(8). Utilizaţi îndelungat, în doze mari, efectele lor adverse sunt importante: hipercorticism iatrogen, atrofie musculară, osteoporoză, hiperglicemie, retenţie hidrosalină, hipokaliemie etc.(8)
Hormoni sexuali şi antagonişti ai acestora
Megestrol (Megesint®, comprimate) este un derivat de progesteron cu proprietăţi antiestrogenice, care îl fac util, în tratamentul paliativ, pentru stabilizarea simptomelor şi întârzierea progresiei cancerului de sân sau a cancerului de endometru(10).
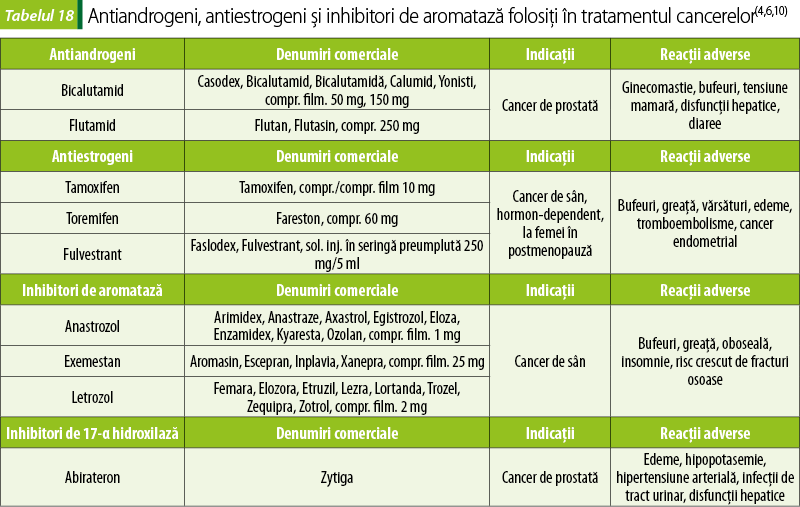
În cancerele hormon‑dependente se folosesc frecvent antagonişti hormonali sau medicamente care scad sinteza hormonilor sexuali (tabelul 18).
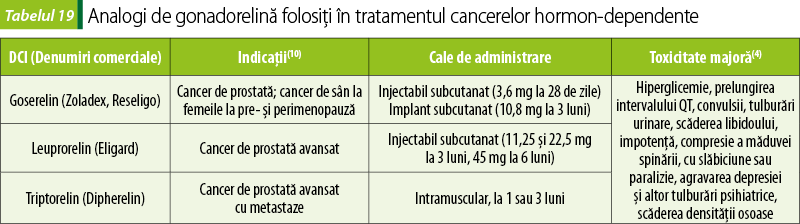
Analogi ai hormonilor de eliberare a gonadotropinelor (GnRH)
Aceste peptide de sinteză sunt analogi ai hormonului de eliberare a gonadotropinelor (tabelul 19). Iniţial, stimulează secreţia de gonadotropine hipofizare. Ulterior, administrarea prelungită inhibă secreţia de gonadotropine, prin feedback negativ, cu supresia producerii de hormoni sexuali de către gonade. Se folosesc în cancerele hormon‑dependente. La bărbaţi, folosirea analogilor GnRH duce la deprivare androgenică(8).
Degarelix (Firmagon® pulbere pentru soluţie injectabilă 120 mg) este folosit în cancerul de prostată. Este un peptid sintetic analog decapeptidului natural GnRH (hormonul gonadotropin-releasing) hipotalamic. Blochează receptorii hipofizari ai GnRH, reducând astfel sinteza de hormon luteotrop (LH) şi hormon foliculo-stimulant (FSH). Astfel, scade secreţia testiculară de testosteron.
Imunoterapia
Recrutarea sistemului imun pentru a lupta împotriva tumorilor este o strategie terapeutică excelentă.
Dacă sistemul imunitar poate fi determinat să recunoască şi să distrugă celulele canceroase, şi numai pe acestea, rezultatele în terapia cancerului sunt spectaculoase. Terapiile imunologice pot determina regresia metastazelor tumorale mari, în anumite cazuri. Medicamentele care determină inhibarea căilor de reglare mediate de CTLA-4(17) sau PD-1(18) pot duce la regresia tumorii la pacienţii cu melanom metastatic şi cancer pulmonar.
Provocarea la care are de răspuns imunoterapia este aceea de a nu stimula prea mult sistemul imun, fapt care poate da naştere unor efecte adverse mediate imunologic, unele foarte grave.
Modificatori ai răspunsului biologic
Stimularea imună nespecifică prin administrarea interleukinei-2 (IL-2) poate duce la răspunsuri clinice obiective la pacienţii cu melanom şi cancer renal(12).
Interferon alfa
Interferonul alfa afectează celulele tumorale prin mai multe mecanisme:
- efect antiproliferativ direct;
- efect imunomodulator asupra celulelor killer naturale, celulelor T, celulelor B şi macrofagelor;
- expunerea antigenelor celulelor tumorale la suprafaţa celulelor care le prezintă sistemului imun pentru recunoaştere;
- stimularea diferenţierii celulelor tumorale;
- efecte antiangiogenice(4).
Interleukina 2 (aldesleukină)
Aldesleukina este o citokină produsă prin tehnologia ADN‑ului recombinant. Determină proliferarea şi diferenţierea celulelor B şi T şi eliberarea de citokine, cu efecte imunologice complexe. Se poate folosi în tratamentul cancerului renal şi al melanomului(3).
Medicamente care acţionează la nivelul checkpointurilor sistemului imun (tabelul 20)
Ipilimumab® este un inhibitor al CTLA‑4 de pe suprafaţa limfocitelor T. CTLA-4 (Cytotoxic T Lymphocyte Antigen 4 – antigenul 4 al limfocitelor T citotoxice) este un receptor imunosupresiv aflat pe suprafaţa limfocitelor T, care atunci când este activat de alţi liganzi costimulatori determină inhibiţia celulelor T. Se consideră că acest mecanism este implicat în prevenirea autoimunităţii. Depăşirea acestui punct de control cu ajutorul unor medicamente este un mecanism de acţiune antitumorală, deoarece permite limfocitelor T să distrugă celulele canceroase(1).
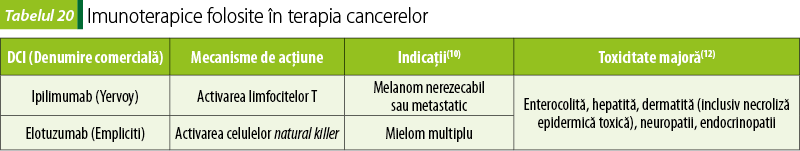
Elotuzumab activează celulele natural killer direct prin legarea specifică de proteina membrul 7 al familiei de molecule de semnalizare a activării limfocitare (SLAMF7 – signaling lymphocyte activation molecule family member 7). Expresia acestei proteine este semnificativ crescută în celulele tumorale, dar este absentă în celulele normale(19).
Problemele speciale de toxicitate ridicate de aceste medicamente pot fi severe sau fatale şi se datorează activării şi proliferării celulelor T(12).
Medicamente care acţionează la nivelul sistemului PD1/PDL1
Acest tip de anticorpi monoclonali sunt capabili să recunoască şi să se lege de o proteină numită „ligandul 1 al morţii programate“ (PD-L1), care este prezentă pe suprafaţa multor celule canceroase.
PD-L1 acţionează oprind activitatea celulelor sistemului imunitar, care altfel ar ataca celulele canceroase. Activarea PD-L1 suprimă activitatea citotoxică a limfocitelor T, proliferarea limfocitelor T şi producţia de citokine.
Medicamentele antineoplazice care blochează PD-L1 diminuează efectele acestora, mărind capacitatea sistemului imunitar de a ataca celulele canceroase, cu încetinirea progresiei bolii (tabelul 21).
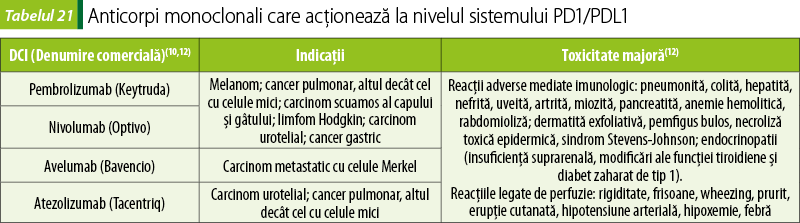
Avelumab poate acţiona şi inducând liza directă a celulelor tumorale, distrugere mediată de celulele natural killer(20).
Alte medicamente anticanceroase care acţionează la nivelul sistemului imunitar
Dinutuximab beta (Qarziba®) este un anticorp monoclonal folosit în tratamentul neuroblastomului, care recunoaşte şi se leagă de o fracţiune de carbohidrat a gangliozidului 2 (GD2), prezentă în cantităţi mari pe suprafaţa celulelor de neuroblastom, dar nu şi pe cea a celulelor normale. Astfel, celulele neuroblastomului devin o ţintă mult mai evidentă pentru sistemul imunitar al organismului, care le distruge(21).
Terapia genică
CAR-T
Terapiile CAR-T folosesc produse obţinute prin combinarea prin inginerie genetică a genei pentru un anticorp care recunoaşte un antigen tumoral cu o genă pentru un receptor care se află pe suprafaţa celulelor T. Astfel, celulele T devin precis orientate spre celulele tumorale.
Manipularea medicamentelor anticanceroase
Farmacistul şi cei care manipulează medicamentele citotoxice trebuie să respecte reguli speciale.
Reconstituirea citostaticelor trebuie făcută de personal instruit. Reconstituirea ar trebui să se efectueze în arii special amenajate ale farmaciei. Personalul trebuie să poarte îmbrăcăminte de protecţie (inclusiv mănuşi, halate, măşti şi ochelari de protecţie).
Gravidele trebuie să evite expunerea la medicamente citotoxice; toate femeile aflate la vârsta fertilă trebuie să fie informate cu privire la riscul asupra procesului de reproducere.
Trebuie să existe proceduri pentru gestionarea scurgerilor accidentale ale medicamentelor citotoxice (de exemplu, prin spargerea unui flacon) şi pentru eliminarea în siguranţă a citotoxicelor rămase nefolosite (fracţii de flacoane, medicamente expirate), inclusiv a dispozitivelor care au intrat în contact cu anticanceroasele (seringile, liniile de perfuzare, recipientele, materialul absorbant etc.).
Expunerea personalului la medicamentele citotoxice trebuie monitorizată(9).
Încheiere
Ultimii ani se remarcă prin apariţia a numeroase medicamente antineoplazice. Efectele unora sunt spectaculoase, dar trebuie să se acumuleze experienţă în folosirea lor şi să se strângă date privind siguranţa lor.
Cercetarea asupra acestei patologii devastatoare dă rezultate. Acest lucru este important, pentru că neoplaziile sunt foarte frecvente şi vor fi din ce în ce mai frecvente, pe măsură ce speranţa de viaţă creşte.
Dar şi alte intervenţii pot fi la fel de salutare în lupta cu cancerul. Stilul de viaţă sănătos poate să protejeze într-o oarecare măsură de cancer. Vaccinarea cu anumite vaccinuri scade riscul de infectare cu virusuri implicate în patogeneza cancerului. Screeningul şi detectarea precoce a cancerelor cresc mult şansele de vindecare sau cel puţin de supravieţuire după un cancer.
Bibliografie
- DeVita V, Lawrence T, Rosenberg S, editors. In DeVita, Hellman and Rosenberg’s Cancer. Principles & Practice of Oncology, 10th Edition. Wolters Kluwer. 2011.
- Rang H. Anticancer Drugs. In Rang & Dale’s Pharmacology 8th Edition. Elsevier. 2015.
- Shord S, Medina P. Cancer Treatment and Chemotherapy. In DiPiro JT, editor. Pharmacotherapy: A Pathophysiologic Approach, 9th Edition. McGraw Hill. 2014.
- Pace MB, Patel K. Neoplastic Disorders and Their Treatment: General Principles. In Alldredge BK, editor. Koda-Kimble and Young’s Applied Therapeutics: The Clinical Use of Drugs, 10th Edition. Lippincott Williams&Wilkins. 2012.
- Novartis. CTL019 (tisagenlecleucel) In pediatric and young adult patients with relapsed/Refractory B-cell acute lymphoblastic leukemia U.S. Food & Drug Administration Oncologic Drugs Advisory Committee. July 12, 2017.
- Chu E, Sartorelli A. Cancer Chemotherapy. In Katzung B, Trevor A, editors. Basic & Clinical Pharmacology, 13th Edition. Mc Graw Hill Lange. 2014.
- Chamber B. General Principles of Cancer Chemotherapy. In Brunton L, editor. Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 12th Edition. Mc Graw Hill Medical. 2011.
- Turculeţ L, Brezina A. Chimioterapia antineoplazică. In Cristea A. Tratat de farmacologie, Ediţia I. Bucureşti. Editura Medicală. 2005.
- Royal Pharmaceutical Society. British National Formulary 71: BMJ Group & Pharmaceutical Press. 2016.
- Chiriţă C, Marineci C. Agenda Medicală 2018. Ediţia de buzunar. Editura Medicală. 2018.
- Dillman R, Hendrix C. Unique aspects of supportive care using monoclonal antibodies in cancer treatment. Support Cancer Ther. 2003;1(1):38-48.
- Medscape. Monografiile medicamentelor. Ultima accesare 22 aprilie 2018 [Online].
- EMA. Darzalex. Rezumatul caractteristicilor produsului. Ultima actualizare august 2017.
- EMA. Adcetris. Rezumatul caracteristicilor produsului. Ultima actualizare februarie 2018.
- Barroso-Sousa R, Tolaney S. CDK4/6 inhibitors in advanced hormone receptor-positive breast cancer. Translational Cancer Research. 2017;6:S205-S209.
- EMA. Venclyxto. Rezumatul caracteristicilor produsului. Ultima actualizare ianuarie 2018.
- Topalian S, Hodi F, Brahmer J, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. New England Journal of Medicine. 2012;366.
- Attia P, Phan G, Maker A. Autoimmunity correlates with tumor regression in patients with metastatic melanoma treated with anti-cytotoxic T-lymphocyte antigen-4. Journal of Clinical Oncology. 2005;23:6043-6053.
- EMA. Empliciti. Rezumatul caracteristicilor produsului. Ultima actualizare iulie 2017.
- EMA. Bavencio. Rezumatul caracteristicilor produsului. Ultima actualizare ianuarie 2018.
- EMA. Qarziba. Rezumatul caracteristicilor produsului. Ultima actualizare martie 2018.
- Dobrescu D, Negreş S. Memomed. 23rd Edition. Editura Universitară. 2018.
- Gaffen S, Liu K. Overview of interleukin-2 function, production and clinical applications. Cytokine. 2004;28:109–123.
- Waller D, Sampson A, Renwick A, Hillier K. The immune response and immunosuppressant drugs. In Medical Pharmacology&Therapeutics. Fourth Edition. Saunders Elsevier. 2014.
Articole din ediţiile anterioare
Tratamentul bolilor alergice în timpul sarcinii
Bolile alergice, incluzând rinita/rinoconjunctivita alergică, astmul și urticaria, sunt afecţiuni frecvente care apar la adulţii tineri, prin urmar...
Agenţi de imunizare. Vaccinuri
Vaccinarea este o metodă de imunizare activă artificială, care constă în introducerea în organism a unor antigene, cu scopul de a stimula sistemul ...
Fumatul şi adicţia de nicotină
Fumatul este unul dintre cele mai vechi obiceiuri de pe glob, cu consecinţe extrem de grave privind starea de sănătate a populaţiei (cauzează anual...
Complianţa şi tolerabilitatea pacientelor cu cancer de sân la administrarea inhibitorilor de aromatază
Inhibitorii de aromatază (IA) reprezintă o clasă de medicamente oncologice utilizate în tratamentul pacientelor cu cancer mamar hormono-pozitiv.