Pelvic inflamatory disease represents a group of polymicrobial infection of the female upper genital tract, affecting sexually active young women (under 25 years old). Usually, the contamination occurs during the intercourse, and the pathogens are N. gonorrhoeae and C. trachomatis. PID is one of the most frequent conditions affecting fertile women. If left untreated, it can lead to serious complication, increasing long term morbidity (infertility, ectopic pregnancy, pelvic pain syndrome). The diagnostic process is often imprecise, with no historical or physical finding being specific enough. The therapy must be initiated as soon as possible in order to avoid complication.
Infecţiile genitale înalte
First published: 15 martie 2013
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.1.1.2013.5109
Abstract
Rezumat
Boala inflamatorie pelvină cuprinde un grup de infecţii polimicrobiene ale tractului genital înalt care afectează mai ales femeile tinere (vârsta mai mică de 25 de ani) cu viaţă sexuală activă. Cel mai frecvent contaminarea se face prin contact sexual, iar agenţii patogeni implicaţi sunt N. gonorrhoeae şi C. trachomatis. Infecţiile genitale înalte reprezintă o importantă problemă de sănătate deoarece este una din cele mai frecvente patologii care afectează femeile la vârsta fertilităţii, iar în lipsa tratamentului adecvat se soldează cu o serie de complicaţii care cresc morbiditatea pe termen lung (infertilitate, sarcină ectopică, sindrom algic pelvin). Diagnosticul este frecvent dificil, neexistând un semn sau simptom destul de sensibil sau specific pentru a stabili cu certitudine diagnosticul pozitiv. Tratamentul trebuie iniţiat cât mai precoce pentru a evita dezvoltarea sechelelor.
Infecţiile genitale înalte cuprind diferite forme de infecţii utero-anexiale, complicate sau nu: endometrite, salpingite, abcese tubo-ovariene, pelviperitonite cu origine genitală. Cei mai frecvenţi agenţi patogeni implicaţi sunt cei cu transmitere sexuală, în special Chlamydia trachomatis şi Neisseria gonorrhoeae, dar mai pot fi implicaţi şi alţi germeni precum cei ai florei vaginale aerobe (Streptococ de grup B, Stafilococ aerob, E. coli) sau anaerobe (Bacteroides Prevotella, Gardnerella vaginalis).
Contaminarea poate avea loc prin contact sexual, manevre ginecologice (inserţia de dispozitive intrauterine, histerosalpingografii, curetaj biopsic), post-partum, manevre abortive sau intervenţii chirurgicale în sfera genitală.
Afectarea tractului genital înalt se produce prin ascensionarea microorganismului de la nivelul vaginului sau al endocolului, şi mai rar pe cale hematogenă sau limfatică.
Cel mai frecvent, pacientele afectate sunt tinere (vârsta sub 25 de ani), cu viaţă sexuală activă, cu multipli parteneri sexuali, care nu folosesc metode contraceptive şi provin dintr-o zonă cu prevalenţă crescută a bolilor cu transmitere sexuală. Boala inflamatorie pelvină reprezintă o importantă problemă de sănătate, având în vedere că este una dintre cele mai comune cauze de infertilitate la nivel mondial. De asemenea, evoluţia bolii inflamatorii pelvine, mai ales în absenţa tratamentului adecvat, se soldează cu complicaţii şi sechele care determină morbiditate crescută pe termen lung (sindromul algic pelvin, hemoragii, sarcină ectopică, abces tubo-ovarian). Rata recurenţei infecţiilor genitale înalte este ridicată, ajungând până la 25-40%.
Etiologie
Principalii agenţi implicaţi în etiologia bolii inflamatorii pelvine sunt Chlamydia trachomatis şi Neisseria gonorrhoeae în până la 55% din cazuri şi în aproximativ 10% din cazuri este vorba de o coinfecţie. În etiologia afecţiunii mai sunt implicaţi agenţi patogeni ai florei vaginale aerobe (Streptococcus agalactiae, Streptococul de grup B, Peptostreptococi, E. coli, Stafilococul auriu, Enterococul) şi anaerobe (Bacteroides, Gardnerella vaginalis, Prevotella), precum şi micoplasme (Mycoplasma genitalium, Mycoplasma hominis). Asocierea mai multor germeni în etiologia bolii inflamatorii pelvine este frecvenţa.
Cu excepţia Chlamydia trachomatis şi Neisseria gonorrhoeae, microorganismele implicate în etiologia bolii inflamatorii pelvine sunt similare cu cele asociate vaginozei bacteriene, afecţiune de altfel frecvent întâlnită în istoricul pacientelor cu infecţii genitale înalte.
Factorii de risc pentru apariţia bolii inflamatorii pelvine includ: vârsta sub 25 de ani; debutul vieţii sexuale la o vârstă mai mică de 15 ani; parteneri sexuali multipli; inserţia recentă a dispozitivelor intrauterine (riscul relativ este de 2-3 ori mai mare în primele 4 luni după inserţia dispozitivului, apoi scade rapid); antecedente de infecţii genitale înalte sau boli cu transmitere sexuală; curetajul uterin, histeroscopia, histerosalpingografia sau alte manevre care întrerup bariera protectoare a mucusului cervical; status post-partum sau post-abortum.
Diagnostic
Diagnosticul clinic în boala inflamatorie pelvină se bazează pe existenţa următoarelor semne şi simptome: durere în etajul abdominal inferior (are caracter difuz, este localizată bilateral, debutează de obicei la câteva zile după prima zi de menstră şi este exacerbată de mişcare, exerciţii fizice şi contactul sexual); sensibilitatea zonelor anexiale la palpare şi durere la mobilizarea colului uterin la tactul vaginal; leucoree (prezenţa în 75% din cazuri). În funcţie de severitatea infecţiei, mai pot apărea febră (peste 38 de grade Celsius), greaţă şi vărsături, stare toxică.
Simptomatologia variază de la forme silenţioase (mai ales în infecţiile cu Chlamydia trachomatis sau Mycoplasma genitalium) la forme grave, cu un tablou clinic bogat (în special în infecţiile cu Neisseria gonorrhoeae), din acest motiv, diagnosticul clinic al bolii inflamatorii pelvine fiind dificil de stabilit. Nici un simptom, semn sau examen paraclinic nu este destul de sensibil sau specific pentru a putea stabili diagnosticul cu certitudine.
Diagnosticul clinic are o sensibilitate de 87% şi o specificitate de 50%, iar valoarea predictivă pozitivă a acestuia comparată cu cea a diagnosticului laparoscopic este de 65-90%. Cel mai sensibil semn este durerea anexială la tactul vaginal, ajungând până la o sensibilitate de 95%. Palparea fundurilor de sac vaginale, mobilizarea colului şi tentativa de delimitare a uterului sunt manevre dureroase. În cazul prezenţei unei complicaţii, cum ar fi piosalpinxul sau abcesul tubo-ovarian, se poate decela la palparea zonelor anexiale prezenţa unei mase dificil de delimitat sau impastarea ţesuturilor periuterine.
Alte simptome întâlnite frecvent în boala inflamatorie pelvină sunt: dispareunie, disurie, polakiurie, greaţă şi vărsături, durere la nivelul hipocondrului drept, asociată sau nu cu icter (în cazul sindromului Fitz-Hugh-Curtis - inflamaţia capsulei hepatice şi a ţesuturilor perihepatice).
Având în vedere polimorfismul clinic al bolii inflamatorii pelvine şi riscul crescut de dezvoltare a sechelelor în lipsa tratamentului specific, CDC (Center for Disease Control and Prevention) a emis în “Ghidul pentru tratamentul bolilor cu transmitere sexuală 2010” o listă de criterii pentru a îmbunătăţi diagnosticul clinic. Conform ghidului, tratamentul empiric ar trebui iniţiat la pacientele tinere cu viaţă sexuală activă (sau la risc pentru dezvoltarea bolilor cu transmitere sexuală) care prezintă durere abdominală inferioară sau pelvină (în cazul în care nu a fost decelată o altă cauză a durerii) şi cel puţin unul din următoarele criterii: sensibilitate la mobilizarea colului; sensibilitate la mobilizarea uterului; sensibilitate la palparea zonelor anexiale.
Criterii adiţionale pentru diagnosticarea bolii inflamatorii pelvine sunt: febră; leucoreea mucopurulentă, prezenţa de numeroase leucocite în secreţia vaginală; VSH crescut; proteina C reactivă crescută; dovada microbiologică a infecţiei cu Neisseria gonorrhoeae sau Chlamydia trachomatis.
Conform Ghidului elaborat de CDC, cele mai specifice criterii de diagnostic pentru infecţiile genitale înalte sunt:
-
curetaj uterin biopsic cu dovada histopatologică a endometritei;
-
ecografie transvaginală sau imagistică prin rezonanţă magnetică a pelvisului, care să evidenţieze colecţii salpingiene, pereţi tubari îngroşaţi, cu sau fără lichid liber în cavitatea peritoneală, sau dovezi Doppler ale infecţiei pelvine (hiperemie tubară);
-
anomalii compatibile cu boala inflamatorie pelvină la examinarea laparoscopică.
Investigaţii paraclinice
Analiza citologică şi microbiologică a secreţiei vaginale sau endocervicale este importantă în evaluarea unei paciente cu suspiciune clinică de boală inflamatorie pelvină, aceasta decelând de obicei un număr crescut de leucocite (mai ales polimorfonucleare). O secreţie clară, fără leucocite la examenul citologic, face diagnosticul improbabil, având o valoare predictivă negativă de 95%. De asemenea, în urma analizei microbiologice se poate identifica agentul etiologic.
Analizele uzuale de laborator în boala inflamatorie pelvină pot demasca un sindrom inflamator care nu este totdeauna prezent: leucocitoză, VSH crescut, nivel PCR crescut.
Examinarea ecografică are un rol important atât în diagnosticul pozitiv, cât şi în cel diferenţial al bolii inflamatorii pelvine, deşi are o sensibilitate de 81% şi o specificitate de 78% în cazurile atipice. La ecografia transvaginală în fază acută se pot observa: trompe uterine dilatate, cu pereţi groşi (peste 5 mm) şi neregulaţi, colecţii lichidiene salpingiene, endometru hiperecogen şi îngroşat, ovare cu margini greu de evidenţiat, uneori mărite şi având aspect polichistic, colecţii lichidiene la nivelul fundului de sac Douglas. Abcesul tubo-ovarian se prezintă ca masă anexială complexă, cu îngroşarea capsulei ovariene şi prezenţa de lichid încapsulat la acest nivel. În faza cronică a bolii inflamatorii pelvine, hidrosalpinxul se prezintă ca masă omogenă, trans-sonică, localizată adiacent şi medial faţă de ovar, la nivelul unei trompe uterine dilatate şi cu pereţi subţiri. Examinarea Doppler color aduce informaţii legate de vascularizaţia structurilor tractului genital înalt, ajutând în plus la diagnosticul diferenţial al bolii inflamatorii pelvine. În faza acută, se decelează un indice de rezistenţă scăzut al fluxului sangvin la nivelul arterelor tubare, care poate reveni la valoarea iniţială după tratament în aproximativ 50% din cazuri. În faza cronică, examinarea Doppler evidenţiază absenţa fluxului sangvin, ajutând la efectuarea diagnosticului diferenţial cu alte formaţiuni tumorale pelvine. Ecografia 3D aduce informaţii în plus legate de poziţionarea în spaţiu şi a raporturilor anatomice ale structurilor afectate.
Laparoscopia este considerată “standardul de aur” în diagnosticul bolii inflamatorii pelvine, însă din cauza costurilor şi a caracterului invaziv nu este o procedură recomandată uzual. Criteriile minime pentru diagnosticul laparoscopic includ: edem parietal al tubei uterine, hiperemia suprafeţei tubare şi prezenţa de exsudat peritubar. De asemenea se pot vizualiza direct eventualele complicaţii date de boala inflamatorie pelvină (abcesul tubo-ovarian, hidrosalpinxul, sindromul Fitz-Hugh-Curtis) şi se pot preleva probe pentru examinarea microbiologică şi histopatologică.
Imagistica prin rezonanţă magnetică (IRM) are o specificitate şi sensibilitate în diagnosticarea bolii inflamatorii pelvine apropiată de cea a laparoscopiei (89% şi respectiv 95%), ceea ce ar permite înlocuirea laparoscopiei cu IRM în cazuri selecţionate. Imaginile sugestive pentru boala inflamatorie pelvină obţinute prin IRM sunt: trompe uterine dilatate cu pereţi îngroşaţi, colecţii lichidiene salpingiene, ovare mărite cu aspect pseudopolichistic şi margini slab definite, lichid liber la nivel pelvin, abces tubo-ovarian (masă pelvină cu pereţi îngroşaţi, cu hiposemnal T1 şi hipersemnal T2) sau hidrosalpinxul.
Culdocenteza este o procedură efectuată rar, mai ales în cazul absenţei mijloacelor imagistice de investigare, având o acurateţe diagnostică scăzută.
Curetajul uterin biopsic este util pentru diagnosticul histopatologic al endometritei întâlnite în cadrul bolii inflamatorii pelvine, fiind considerat de CDC unul dintre cele mai specifice criterii de diagnostic. Această investigaţie se efectuează atunci când nu se decelează semne de salpingită, iar endometrita este singura manifestare a bolii.
Tratament
Tratamentul în boala inflamatorie pelvină are ca scop eradicarea infecţiei, a simptomatologiei şi prevenirea sechelelor pe termen lung. Terapia cu antibiotice trebuie iniţiată cât mai precoce după stabilirea diagnosticului şi trebuie să aibă un spectru cât mai larg pentru a acoperi majoritatea agenţilor patogeni implicaţi. În mod obligatoriu, tratamentul trebuie să fie eficient împotriva N. gonorrhoeae şi C. trachomatis şi pe cât posibil pe germenii anaerobi, gram-negativi şi diverse specii de streptococ.
Formele uşoare sau moderate pot fi tratate în ambulator, spitalizarea fiind necesară doar în cazuri speciale, cum ar fi: lipsa de răspuns clinic după 72 de ore de la iniţierea tratamentului antibiotic per os, lipsa de complianţă sau de toleranţă la tratamentul per os, pacienta însărcinată, cazuri cu simptomatologie severă (febră înaltă, greaţă, vărsături), evidenţierea abcesului tubo-ovarian la investigaţiile imagistice. În majoritatea cazurilor, răspunsul clinic apare la 48-72 de ore de la iniţierea tratamentului antibiotic. Persistenţa simptomelor (febră, sensibilitatea uterină, anexială şi cervicală, persistenţa leucoreei) trebuie să ridice suspiciunea unei complicaţii (abces tubo-ovarian) sau a unui alt diagnostic, iar pacienta trebuie spitalizată în vederea reevaluării, efectuării unor investigaţii suplimentare şi administrării parenterale a tratamentului.
Durata tratamentului antibiotic este cuprinsă între 10 şi 14 zile. În cazul formelor uşoare sau moderate, atât tratamentul parenteral, cât şi cel per os au aceeaşi eficienţă. Schimbarea tratamentului parenteral cu cel per os poate fi iniţiată după minimum 24 de ore de la ameliorarea simptomatologiei şi continuată până la un total de 14 zile de terapie antibiotică. Se preferă administrarea de Doxiciclină 100 mg de două ori pe zi sau Clindamicină 450 mg de patru ori pe zi. În cazul prezenţei unui abces tubo-ovarian, este recomandată spitalizarea pentru minimum 24 de ore, cu administrarea tratamentului parenteral, după care se poate continua per os cu Doxiciclină, asociată cu Metronidazol sau Clindamicină.
Schemele de tratament recomandate de CDC sunt redate în tabelele 1 şi 2.
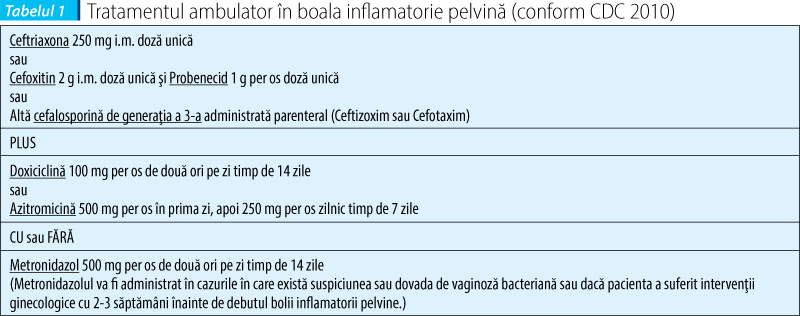
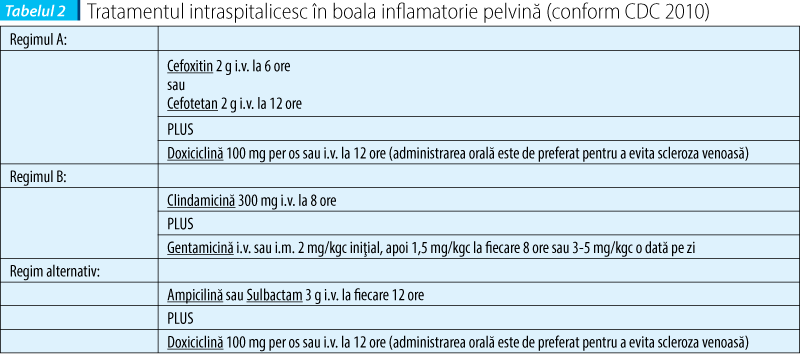
Regimurile de tratament care includ quinolone nu mai sunt recomandate în boala inflamatorie pelvină din cauza frecvenţei crescute a tulpinilor rezistente de Neisseria gonorrhoeae. În cazul în care nu se pot folosi cefalosporinele, terapia cu fluoroquinolone (Levofloxacin 500 mg per os o dată pe zi sau Ofloxacin 400 mg de două ori pe zi, timp de 14 zile) asociate sau nu cu Metronidazol (500 mg per os de două ori pe zi, 14 zile) poate fi luată în considerare dacă riscul infecţiei cu Neisseria gonorrhoeae este scăzut. În cazul izolării acestui agent patogen, se recomandă administrarea de cefalosporine, iar dacă acestea nu sunt disponibile, se va iniţia regimul terapeutic cu fluoroquinolone, adăugând şi Azitromicină 2 g per os în doză unică.
Tratamentul chirurgical este indicat în cazul apariţiei complicaţiilor precum: piosalpinxul, abces tubo-ovarian, abces al Douglas-ului sau peritonită.
Partenerul pacientei cu boală inflamatorie pelvină trebuie evaluat şi tratat pentru uretrită infecţioasă cu Chlamydia trachomatis sau Neisseria gonorrhoeae (deseori asimptomatică), mai ales dacă a existat contact sexual cu până la 60 de zile anterior debutului bolii. Contactul sexual neprotejat trebuie descurajat până la finalizarea tratamentului antibiotic.
Bibliografie
Workowski K.A., Berman S. Sexually transmitted diseases treatment guidelines, 2010. MMWR Recomm Rep. Dec 17 2010;59:1-110.
Patton D.L., Wolner-Hanssen P., Zeng W., Lampe M., Wong K., Stamm W.E., et al. The role of spermatozoa in the pathogenesis of Chlamydia trachomatis salpingitis in a primate model. Sex Transm Dis. Jul-Aug 1993;20(4):214-9.
Paavonen J. Chlamydia trachomatis infections of the female genital tract: state of the art. Ann Med. Feb 2012;44(1):18-28.
Taylor B.D., Darville T., Ferrell R.E., Kammerer C.M., Ness R.B., Haggerty C.L. Variants in toll-like receptor 1 and 4 genes are associated with Chlamydia trachomatis among women with pelvic inflammatory disease. J Infect Dis. Feb 15 2012;205(4):603-9.
den Hartog J.E., Ouburg S., Land J.A., et al. Do host genetic traits in the bacterial sensing system play a role in the development of Chlamydia trachomatis-associated tubal pathology in subfertile women?. BMC Infect Dis. Jul 21 2006;6:122.
Royal College of Obstetricians and Gynaecologists (RCOG). Management of acute pelvic inflammatory disease. London (UK): Royal College of Obstetricians and Gynaecologists (RCOG).; Nov 2008.
Herzog S.A., Althaus C.L., Heijne J.C., Oakeshott P., Kerry S., Hay P., et al. Timing of progression from Chlamydia trachomatis infection to pelvic inflammatory disease: a mathematical modelling study. BMC Infect Dis. Aug 11 2012;12:187.
Hillis S.D., Wasserheit J.N. Screening for chlamydia--a key to the prevention of pelvic inflammatory disease. N Engl J Med. May 23 1996;334(21):1399-401.
Hook E.W., Handsfield H.H. Gonococcal infections in the adult. In: Holmes KK, Sparling PF, Stamm WE, et al. eds. Sexually Transmitted Diseases. 4th edition. New York: McGraw Hill, Inc; 2008:627-645.
Mylonas I. Female genital Chlamydia trachomatis infection: where are we heading?. Arch Gynecol Obstet. May 2012;285(5):1271-85.
Ross J.D. Is Mycoplasma genitalium a cause of pelvic inflammatory disease?. Infect Dis Clin North Am. Jun 2005;19(2):407-13.
Bjartling C., Osser S., Persson K. Mycoplasma genitalium in cervicitis and pelvic inflammatory disease among women at a gynecologic outpatient service. Am J Obstet Gynecol. Jun 2012;206(6):476.e1-8.
Bravender T., Matson S.C. Adolescents, IUDs, PID, and Enterococcus: a report of two cases. J Pediatr Adolesc Gynecol. Jun 2012;25(3):e73-4.
Avan B.I., Fatmi Z., Rashid S. Comparison of clinical and laparascopic features of infertile women suffering from genital tuberculosis (TB) or pelvic inflammatory disease (PID) or endometriosis. J Pak Med Assoc. Nov 2001;51(11):393-9.
Cherpes T.L., Wiesenfeld H.C., Melan M.A., Kent J.A., et al. The associations between pelvic inflammatory disease, Trichomonas vaginalis infection, and positive herpes simplex virus type 2 serology. Sex Transm Dis. 2006;33:747-52.
Jarvis G.A., Chang T.L. Modulation of HIV transmission by Neisseria gonorrhoeae: molecular and immunological aspects. Curr HIV Res. Apr 2012;10(3):211-7.
Brunham R.C., Kimani J., Bwayo J., Maitha G., Maclean I., Yang C., et al. The epidemiology of Chlamydia trachomatis within a sexually transmitted diseases core group. J Infect Dis. Apr 1996;173(4):950-6.
Bjartling C., Osser S., Johnsson A., Persson K. Clinical manifestations and epidemiology of the new genetic variant of Chlamydia trachomatis. Sex Transm Dis. Sep 2009;36(9):529-35.
Kinnunen A., Molander P., Morrison R., Lehtinen M., Karttunen R., Tiitinen A., et al. Chlamydial heat shock protein 60--specific T cells in inflamed salpingeal tissue. Fertil Steril. Jan 2002;77(1):162-6.
Makepeace B.L., Watt P.J., Heckels J.E., Christodoulides M. Interactions of Neisseria gonorrhoeae with mature human macrophage opacity proteins influence production of proinflammatory cytokines. Infect Immun. Mar 2001;69(3):1909-13.
Champion J.D., Piper J., Shain R.N., Perdue S.T., Newton E.R. Minority women with sexually transmitted diseases: sexual abuse and risk for pelvic inflammatory disease. Res Nurs Health. Feb 2001;24(1):38-43.
Ness R.B., Soper D.E., Holley R.L., Peipert J., Randall H., Sweet R.L., et al. Douching and endometritis: results from the PID evaluation and clinical health (PEACH) study. Sex Transm Dis. Apr 2001;28(4):240-5.
Ness R.B., Hillier S.L., Kip K.E., Richter H.E., Soper D.E., Stamm C.A., et al. Douching, pelvic inflammatory disease, and incident gonococcal and chlamydial genital infection in a cohort of high-risk women. Am J Epidemiol. Jan 15 2005;161(2):186-95.
Koumans E.H., Kendrick J.S. Preventing adverse sequelae of bacterial vaginosis: a public health program and research agenda. Sex Transm Dis. May 2001;28(5):292-7.
Ness R.B., Hillier S.L., Kip K.E., Soper D.E., Stamm C.A., McGregor J.A., et al. Bacterial vaginosis and risk of pelvic inflammatory disease. Obstet Gynecol. Oct 2004;104(4):761-9.
Ness R.B., Soper D.E., Holley R.L., Peipert J., Randall H., Sweet R.L., et al. Hormonal and barrier contraception and risk of upper genital tract disease in the PID Evaluation and Clinical Health (PEACH) study. Am J Obstet Gynecol. Jul 2001;185(1):121-7.
Shelton J.D. Risk of clinical pelvic inflammatory disease attributable to an intrauterine device. Lancet. Feb 10 2001;357(9254):443.
[Guideline] C.D.C., Workowski K.A., Berman S.M. Sexually transmitted diseases treatment guidelines, 2006. MMWR Recomm Rep. Aug 4 2006;55(RR-11):1-94.
Kelly E.K., Rudinsky S.W. Intrauterine contraception: current evidence-based recommendations. J Midwifery Womens Health. Sep-Oct 2007;52(5):505-7.
Meirik O. Intrauterine devices - upper and lower genital tract infections. Contraception. 2007;06;75(6 Suppl/):S41-7.
Centers for Disease Control and Prevention. Pelvic Inflammatory Disease – PID. CDC Fact Sheet. Available at http://www.cdc.gov/std/pid/stdfact-pid.htm. Accessed December 9, 2012.
Sufrin C.B., Postlethwaite D., Armstrong M.A., Merchant M., Wendt J.M., Steinauer J.E. Neisseria gonorrhea and Chlamydia trachomatis screening at intrauterine device insertion and pelvic inflammatory disease. Obstet Gynecol. Dec 2012;120(6):1314-21.
Viberga I., Odlind V., Lazdane G., Kroica J., Berglund L., Olofsson S. Microbiology profile in women with pelvic inflammatory disease in relation to IUD use. Infect Dis Obstet Gynecol. Dec 2005;13(4):183-90.
Levgur M., Duvivier R. Pelvic inflammatory disease after tubal sterilization: a review. Obstet Gynecol Surv. Jan 2000;55(1):41-50. Sutton MY, Sternberg M, Zaidi A, St Louis ME, Markowitz LE. Trends in pelvic inflammatory disease hospital discharges and ambulatory visits, United States, 1985-2001. Sex Transm Dis. Dec 2005;32(12):778-84.
Ness R.B., Smith K.J., Chang C.C., Schisterman E.F., Bass DC. Prediction of pelvic inflammatory disease among young, single, sexually active women. Sex Transm Dis. Mar 2006;33(3):137-42.
Berek and Novak’s Gynecology 15th Edition.
World Health Organization - Sexually transmitted infections.
Pelvic Inflamatory Disease – CDC Treatment Guidelines 2010.www.cdc.gov/std/treatment/2010/pid.htm
Articole din ediţiile anterioare
Leziuni cervicale HPV induse la femeia HIV pozitivă
Confecţia HPV-HIV reprezintă o circumstanţă agravantă pentru dezvoltarea neoplaziei de col uterin. În cazurile de coinfecţie, axioma conform căreia...
Sindromul ovarelor polichistice. Fertilitatea ca dovadă a echilibrului energetic
În prezent, sindromul ovarelor polichistice (SOP) este cea mai frecventă endocrinopatie ginecologică din cadrul categoriei femeilor de vârstă ...
Tendinţe de evoluţie a numărului de născuţi vii în România: alternative de proiecţie 2007-2025
Ţinta acestui studiu este de a descrie tendinţa demografică a numarului de naşteri cu feţi vii în perioada 2007-2025 prin raportarea la rata fertil...
Infertilitatea de cauză necunoscută: inseminare artificială sau fertilizare in vitro?
Introducere. În practica medicală în domeniul infertilităţii cuplului, sterilitatea de cauză necunoscută ocupă, din păcate, aproape 20% şi pune pro...