Sjögren’s syndrome, a chronic disease which affects particularly the female gender, represents one of the most common autoimmune diseases and does not affect women of childbearing age, but is especially prevalent during perimenopause. It may be primary when only exocrine glandular dysfunctin occurs (xerophthalmia, xerostomia) or it may be secondary, when is most often associated with rheumatoid arthritis or systemic lupus erythematosus and affects the whole body. Pregnancy cases in the context of this disease are relatively rare, precisely by their incidence in women for whom fertility is not a priority anymore, at the age of 40 or 50 years old, but observing the trend of the last decades, through the implications offered by the modern society, with the increasing age when the first baby is conceived, the number of cases and associated outcome increase. The pregnancy outcome in the context of this disease is insufficiently known comparing to the one appearing in women affected by other autoimmune disorders. The most fearfull complication is represented by the fetal risk of congenital heart block. We report the case of a 29-year-old patient diagnosed with primary Sjögren’s syndrome, consistent with AECG criteria (American-European Consensus Group, 2002) prior to pregnancy, which required a multidisciplinary approach and a close cooperation between the obstetrician, rheumatologist, ophthalmologist and internal medicine physicians. During the 36th week of pregnancy she delivered by caesarean section. Both the patient and the newborn postoperative evolutions were favorable, with no evidence of fetal heart complications. Taking into account the potential maternal and fetal complications, the management of pregnant women diagnosed with Sjögren’s syndrome represents a real challenge for the obstetrician and requires an interdisciplinary approach in order to decrease the morbidity and mortality, both of the mother, as well as the fetus.
Managementul gravidei cu sindrom Sjögren. Prezentare de caz şi review al literaturii
Management of pregnant patient with Sjögren syndrome. Case report and literature review
First published: 20 mai 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.20.2.2018.1707
Abstract
Rezumat
Sindromul Sjögren, o afecţiune cronică ce afectează predominant sexul feminin, este una dintre cele mai frecvente boli autoimune, care însă nu caracterizează femeia de vârstă fertilă, ci apare cu predilecţie în perioada de perimenopauză. Sindromul Sjögren poate fi de tip primar, atunci când apare doar o afectare glandulară exocrină (xeroftalmie, xerostomie), sau poate fi de tip secundar, atunci când acestora li se alătură, cel mai adesea, artrita reumatoidă sau lupusul eritematos sistemic, cu răsunet la nivelul întregului organism. Cazurile de sarcină în contextul acestei afecţiuni sunt relativ rare, tocmai prin incidenţa lor la femeile pentru care fertilitatea nu reprezintă o prioritate, la vârste de peste 40 sau 50 de ani, însă urmărind tendinţa ultimelor decenii, de creştere a vârstei la care este conceput pimul copil, numărul acestora şi impactul asociat cresc. Prognosticul sarcinii în contextul acestei boli este unul insuficient cunoscut comparativ cu sarcina, în contextul altor afecţiuni autoimune. Cea mai de temut complicaţie este reprezentată de riscul fetal de bloc atrioventricular congenital. Raportăm cazul unei paciente în vârstă de 29 de ani, diagnosticată cu sindrom Sjögren primar, conform criteriilor AECG (American-European Consensus Group, 2002), anterior obţinerii sarcinii, care a necesitat pe parcursul acesteia o abordare multidisciplinară şi o strânsă colaborare între medicul obstetrician, reumatolog, oftalmolog şi cel de medicină internă. În săptămâna a 36-a de sarcină s-a decis extragerea fătului prin operaţie cezariană. Atât evoluţia pacientei, cât şi cea a nou-născutului au fost favorabile, nefiind decelate complicaţii cardiace fetale. Având în vedere potenţialele complicaţii materne, dar şi fetale, managementul gravidei diagnosticate cu sindrom Sjögren reprezintă o reală provocare pentru obstetrician, necesitând o abordare interdisciplinară pentru a diminua morbiditatea şi mortalitatea mamei şi fătului.
Introducere
Sindromul Sjögren (SS) reprezintă una dintre cele mai frecvente boli autoimune, cu o prevalenţă ce variază între 0,1% şi 4,8%(1). Afectează în principal sexul feminin, cu un raport femei:bărbaţi de 9:1, şi apare în principal după vârsta de 40 de ani(2). Este o boală cronică inflamatorie, cu implicaţii asupra glandelor exocrine, ceea ce va duce la insuficienta lor funcţionare, prezentându-se sub două forme – primară sau secundară(3). Lucrarea de faţă îşi propune să analizeze prognosticul sarcinii în prezenţa acestei afecţiuni, dar în acelaşi timp şi un review al literaturii asupra datelor disponibile până în prezent.
SS poate fi de tip primar, când tabloul clinic din boala inflamatorie cronică autoimună este dominat de afectarea glandulară (xeroftalmie, xerostomie etc.), sau secundar (extraglandular), când tabloului clinic i se alătură şi afectarea ţesutului conjunctiv, cel mai adesea fiind vorba de artrită reumatoidă sau lupus eritematos sistemic ori sclerodermie; spre deosebire de cel primar, care apare de obicei în perioada de perimenopauză, tipul secundar apare în proporţie mai mare la femeia de vârstă fertilă(4).
Etiologia acestei afecţiuni este necunoscută, însă apare la persoanele cu predispoziţie genetică, la care se suprapun factorii de mediu şi hormonali. Patogenia autoimună este susţinută de prezenţa anticorpilor anti-Ro/SS-A sau anti-La/SS-B. Aceştia sunt prezenţi în 40-60% din cazuri(5,6). Serologic, uneori pot fi detectaţi în sângele pacientelor şi FR (factorul reumatoid) sau ANA (anticorpii antinucleari)(4). Nivelul circulant de anticorpi nu se asociază cu gradul de activitate al bolii(7). Până la 30% din pacienţii cu SS prezintă în antecedentele heredo-colaterale o rudă cu alte afecţiuni autoimune(3).
În urma unei metaanalize în care au fost incluse 23 de studii cu peste 1.100 de cazuri cu SS, haplotipurile DQA1*05:01, DQB1*02:01 şi DRB1*03:01 din sistemul major de histocompatibilitate au fost incriminate ca factori de risc, pe când DQA1*02:01, DQA1*03:01 şi DQB1*05:01 au fost identificate ca factori cu rol de protecţie (date valabile pentru SS primar)(8).
Din perspectiva examenului clinic, SS are ca manifestări frecvente ochi uscaţi şi gură uscată (xeroftalmie – o senzaţie adesea descrisă de pacient ca de nisip în ochi, şi xerostomie)(9). Pe lângă acestea, pacienta poate să resimtă şi o uscăciune generalizată a nasului, gâtului, a pielii, dar şi la nivel vaginal(4). Uscăciunea vaginală şi dispareunia afectează mai mult de jumătate din paciente, cu implicaţii asupra vieţii de cuplu şi implicit asupra procreării(10). Toate aceste modificări duc la adaptarea stilului de viaţă al pacientei, de la nevoia de a ingera frecvent mici cantităţi de apă, atât pe timpul zilei, cât şi pe timpul nopţii, de a folosi picături la nivelul ochilor, cu predispoziţie către afecţiuni dentare, cum sunt cariile şi parodontoza, şi candidoză orală sau vaginală. Estrogenii s-au dovedit a avea un rol protectiv în această afecţiune, cu influenţă pozitivă asupra glandelor secretorii, justificând apariţia bolii la vârsta de 40-50 de ani, când scăderea nivelurilor serice ale hormonilor estrogeni duce la creşterea procesului de apoptoză de la nivelul glandelor exocrine(11).
Prezentare de caz
Raportăm cazul unei paciente în vârstă de 29 de ani, diagnosticată la vârsta de 21 de ani cu SS primar, care se prezintă în Clinica de Obstetrică-Ginecologie a Spitalului Universitar de Urgenţă Bucureşti pentru amenoree, greaţă şi vărsături, cu istoric personal de alergie la gentamicină şi ciprofloxacină, în vederea efectuării investigaţiilor de specialitate, în urma cărora se stabileşte diagnosticul de sarcină unică de 9 săptămâni în evoluţie. Au fost obţinute informaţii legate de stilul de viaţă, antecedentele heredo-colaterale, antecedentele personale fiziologice şi patologice.
Pacienta nu prezintă istoric de avorturi/sarcini oprite în evoluţie. Neagă consumul de alcool şi tutun. Dintre antecedentele personale patologice anterioare sarcinii, menţionăm SS, tiroidită autoimună – status hipotiroidian în tratament de substituţie, hernie de disc L4-L5 şi miopie la ambii ochi (-3,75/-3,75). Boala autoimună a debutat în anul 2009 printr-un episod de keratoconjunctivită, pentru care a început tratamentul cu hidroxiclorochină (antimalarice de sinteză) şi tratament corticosteroid, cu evoluţie favorabilă; anticorpii Anti-Ro şi Anti-La prezenţi. Pacienta a fost, de asemenea, diagnosticată şi cu tiroidită autoimună – status hipotiroidian, cu anticorpi anti-TPO şi Trab negativi, în tratament de substituţie cu Novothyral® (levotiroxină/liotironină). Evoluţia bolii este descrisă prin episoade repetate de xeroftalmie şi xerostomie, însoţite ocazional de parestezii şi fenomene de cianozare la nivelul extremităţilor. Investigaţiile paraclinice arată un titru crescut de anticorpi Anti-Ro=138,98 U/ml şi Anti-La=113,60 U/ml, absenţa factorului reumatoid şi absenţa anticorpilor anticardiolipină şi anti-b2glicoproteină. În urma examenului oftalmologic se stabileşte diagnosticul de conjunctivită Sicca, cu testul Schiermer pozitiv. Fracţiunile serice ale complementului C3 şi C4 erau în limite normale (evaluându-se astfel prognosticul, acestea fiind principalele elemente de predicţie a evoluţiei bolii). Având în vedere diagnosticul de sarcină în evoluţie, la indicaţia medicului reumatolog se decide continuarea tratamentului cu hidroxiclorochină şi corticosteroid, însă în doze minime, boala fiind inactivă la momentul evaluării; de asemenea, pacienta prezenta modificări hematologice minore: valorile hemoglobinei şi ale vitezei de sedimentare a hematiilor erau în limite normale, cu o uşoară leucopenie (WBC=3,85*1000/µl).
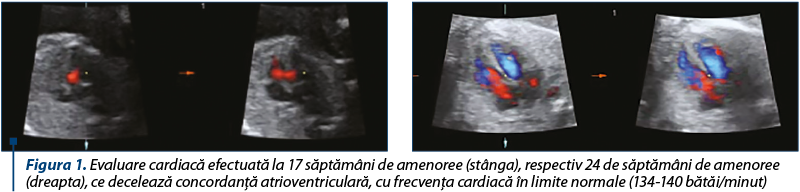
Pe parcursul sarcinii, pacienta a efectuat vizite obstetricale regulate, în cadrul cărora au fost efectuate investigaţii clinice, paraclinice şi ecografice, în concordanţă cu vârsta gestaţională. De-a lungul sarcinii, în culturi recoltate din colul uterin s-au decelat: colonizare vaginală cu streptococ de grup B şi infecţie cu Ureaplasma urealyticum, Klebsiella spp. şi Escherichia coli, tratate conform antibiogramei şi negativate. Nu au fost decelate episoade de reactivare a bolii de bază pe parcursul sarcinii. Pacienta a efectuat evaluările necesare fetale în cadrul ecografiilor de morfologie fetală, cu evaluare cardiacă în special în săptămânile 16 şi 24 de sarcină, unde nu s-au decelat anomalii cardiace, cu concordanţă atrioventriculară (figura 1).
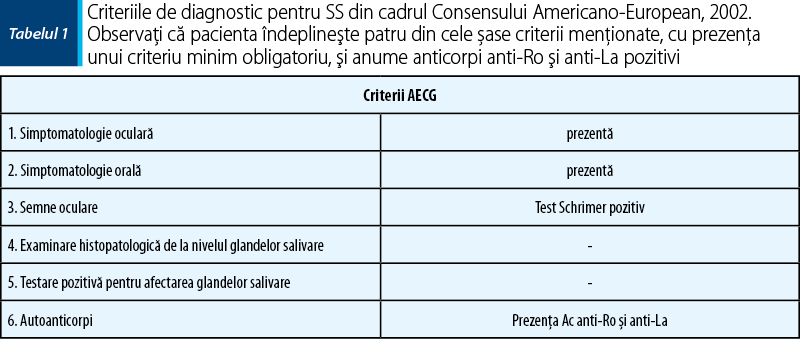
Conform AECG (American-European Consensus Group), pacienta îndeplineşte criteriile stabilite în 2002, şi anume simptomatologia oculară (disconfort zilnic pentru cel puţin trei luni sau senzaţie de nisip în ochi), orală (consum frecvent de lichide şi în timpul mesei pentru facilitarea ingestiei de alimente), semne oculare (test Schrimer pozitiv), prezenţa de autoanticorpi (Ac anti-Ro şi Ac anti-La), cu prezenţa a cel puţin patru criterii ncesare din cele şase menţionate în cadrul consensului.
Pacienta a primit tratament antiagregant până în săptămâna a 30-a de sarcină şi, ulterior, de comun acord cu medicul reumatolog, cardiolog şi hematolog, a primit tratament anticoagulant cu enoxaparin în doză profilactică.
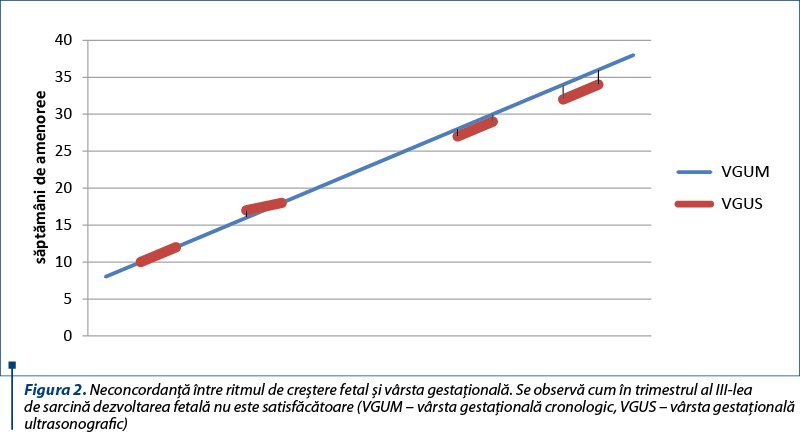
Din săptămâna a 30-a de sarcină s-a decelat hidramnios şi întârziere de creştere intrauterină simetrică (două săptămâni), care a persistat până la naştere (figura 2).
La 36 de săptămâni de sarcină, pacienta se prezintă la Camera de Gardă a Spitalului Universitar de Urgenţă Bucureşti pentru membrane rupte spontan şi contracţii uterine dureroase. Se decide extragerea de urgenţă a fătului prin operaţie cezariană pentru suferinţă fetală cronică acutizată – făt viu, de sex masculin, G=2.000 g, L=45 cm, APGAR 8. Atât pe parcursul sarcinii, cât şi după naştere, nu a fost decelată nicio anomalie fetală cardiacă de transmitere a conducerii atrioventriculare. Evoluţia postoperatorie a fost favorabilă, la patru zile postoperatorii atât mama, cât şi fătul fiind externaţi.
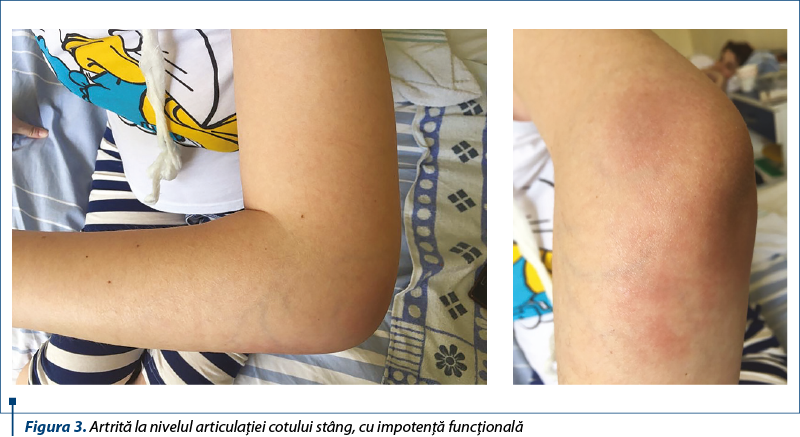
La 3 luni postoperatoriu apare însă nu doar o recădere, ci şi o exacerbare a bolii de fond, în urma consultului efectuat de către medicul reumatolog stabilindu-se diagnosticul de artrită la nivelul articulaţiei cotului stâng, zona de inflamaţie fiind roşie, caldă, dureroasă, cu impotenţă funcţională (figura 3).
Discuţii
Încă din definiţie, SS, fiind o boală autoimună, se caracterizează prin producerea de autoanticorpi, reacţii imune împotriva unor structuri proprii, în cazul de faţă împotriva structurilor glandelor exocrine, şi din punct de vedere histopatologic prin infiltrate celulare mononucleare, persistente şi cu evoluţie progresivă, ce determină hipofuncţia structurilor glandulare. La nivel glandular apar apoptoza, fibroza şi atrofia structurilor glandulare. Până în prezent, nu există niciun tratament ţintit cu scopul vindecării acestei afecţiuni, ci doar în scopul ameliorării simptomatologiei. Similar altor afecţiuni autoimune, SS nu poate fi diagnosticat pe baza unui singur test diagnostic sau a unui singur simptom(12).
Pe baza criteriilor americano-europene, prevalenţa SS este de aproximativ 0,1% la nivel mondial, cu o incidenţă anuală de 3-6/100.000 de locuitori(13,14). SS poate fi consecinţa unei infecţii virale, care mai apoi declanşează boala, ce apare pe un teren cu predispoziţie genetică şi modificări hormonale. Deficitul de estrogen pare să contribuie la apariţia bolii, teorie susţinută şi de studiile clinice pe animale de laborator, care au demonstrat că deficitul de estrogen a dus la uscăciune la nivelul ochilor, gurii, infiltrat limfocitic glandular şi producere de Ac anti-Ro şi Ac anti-La(15).
Ca factori de risc adiţional sexului feminin, pacientele cu rude de gradul I cu o boală autoimună prezintă un risc de până la 7 ori mai mare, acesta crescând în funcţie de numărul de rude afectate. Există însă un singur studiu care susţine că prezenţa unei sarcini în antecedente reprezintă un factor de risc. Astfel, este posibil ca modificările imunologice care apar în timpul sarcinii să joace un rol decisiv în patogeneza SS, o ipoteză fiind cea a traversării barierei placentare de către celulele fetale în circulaţia maternă, unde rămân chiar şi mai mulţi ani(16).
Pacientele cu SS nu se prezintă cu infertilitate, având în vedere debutul tardiv al acestei afecţiuni, în perimenopauză. Sarcina poate fi dusă de obicei la termen, atunci când nu se asociază cu alte afecţiuni autoimune (lupus eritematos sistemic sau sindrom antifosfolipidic). Cu toate acestea, o problemă pentru aceste paciente constă în apariţia lupusului neonatal, considerat a fi o consecinţă a transferului transplacentar de anticorpi anti-Ro, uneori şi anti-La(17). Aproximativ 2% din mamele cu anticorpi anti-Ro pozitivi vor naşte un copil cu afectare cardiacă în cadrul sindromului de lupus neonatal(18). Interesant este de menţionat că mamele cu Ac anti-Ro pozitivi pot alăpta, neobservându-se un pasaj al acestora prin laptele matern şi nefiind dăunător pentru copil(19). SS nu se rezumă la simpla simptomatologie de mucoase uscate. Există date care sugerează că apariţia unor complicaţii materne, cum sunt limfoamele şi neuropatia periferică, se află în strânsă legătură cu nivelul scăzut de vitamină D. S-a observat că blocul atrioventricular congenital este mai frecvent în anotimpurile reci, cu mai puţin soare, creând astfel premisa unei cercetări suplimentare între hipovitaminoza D şi afectarea cardiacă(20).
Stabilirea diagnosticului de SS nu este facilă, punând de multe ori medicul în dificultate, prin simptomatologia nespecifică, aceasta fiind mai frecvent întâlnită la pacienţii de vârstă înaintată, din cauza atrofiei ţesutului glandular. Nu există un parametru paraclinic specific care să stabilească cu certitudine diagnosticul de SS, însă există multiple modificări paraclinice, cum ar fi VSH-ul (viteza de sedimentare a hematiilor) crescut, anemie uşoară normocromă normocitară, modificare care însă apare frecvent şi în sarcină, leucopenie (în contradicţie cu leucocitoza specifică gravidelor) şi hipergamaglobulinemie policlonală(4). Hipocoplementemia reprezintă principalul factor prognostic(21). Prezenţa în sânge a anticorpilor anti-Ro/anti-LA precede apariţia manifestărilor clinice chiar şi cu zeci de ani, însă această observaţie are doar un scop informativ, şi nu terapeutic, neexistând până în prezent un tratament care să prevină apariţia manifestărilor bolii(22).
Criteriile de diagnostic utilizate în prezent sunt cele din 2002 (conform American-European Consensus Group)(5), revizuite în 2012(23), şi cuprind şase criterii, şi anume: semne şi simptome oculare, simptomatologie orală prezentă, implicarea glandelor salivare, biopsie cu examinare histopatologică pozitivă a glandelor salivare şi prezenţa anticorpilor anti-Ro/anti-La sau a ambilor. Pentru stabilirea diagnosticului de SS primar sunt necesare patru criterii şi cel puţin serologie sau examinare histopatologică pozitivă. Diagnosticul de SS secundar necesită prezenţa unei alte afecţiuni autoimmune, însoţite de simptomatologie oculară sau orală, şi oricare două criterii din cele rămase, exceptând anticorpii SSA/SSB. Sunt menţionate şi criterii de excludere: istoric de iradiere la nivelul capului şi gâtului, infecţie VHC, SIDA, limfom, sarcoidoză, medicaţie anticolinergică, boală grefă contra gazdă(5).
Complicaţii materne şi fetale
Principala complicaţie maternă a acestei afecţiuni este reprezentată de neoplazia de origine hematogenă. Pacientele prezintă un risc de 10 până la 50 de ori mai mare de limfom şi până la 9% dintre ele sunt diagnosticate cu această afecţiune(9). Complicaţiile fetale constau în lupusul neonatal şi blocul cardiac congenital, cea din urmă fiind şi cea mai de temut complicaţie, rezultând în urma unui transfer pasiv de anticorpi materni către produsul de concepţie(24), care apare prin afectarea nodului atrioventricular de către Ac anti-Ro şi anti-La(21). Însă doar simpla prezenţă a anticorpilor în serul matern nu pare să afecteze prognosticul sarcinii. În urma unui studiu în care au fost investigate 100 de paciente cu anticorpi anti-Ro prezenţi, din care au rezultat 122 de sarcini, au fost raportate două cazuri de bloc atrioventricular(4), în concordanţă cu datele cunoscute anterior, respectiv o prevalenţă de 1-2%(25). Prognosticul acestor sarcini poate fi unul bun atunci când cazul este coordonat de o echipă multidisciplinară, în care să existe o colaborare între medicul obstetrician, reumatolog, oftalmolog, de medicină internă şi neonatolog/pediatru, cu experienţă în domeniu pentru astfel de cazuri, care să stabilească o conduită optimă şi tratamentul necesar nou-născutului care necesită implantare de pacemaker. Studiul nu a demonstrat o afectare a sarcinii în ceea ce priveşte riscul de naştere prematură, greutate mică la naştere pentru vârsta gestaţională, restricţie de creştere intrauterină, ruperea prematură de membrane sau preeclampsie, riscul fiind similar pentru cele două grupuri studiate: cel cu anticorpi prezenţi (anti-Ro), respectiv cu anticorpi absenţi(26). Comparativ însă cu pacientele sănătoase, fără afecţiuni autoimune, greutatea feţilor la naştere a fost mai mică, naşterea prin operaţie cezariană a fost mai frecventă(4), la fel şi naşterea prematură(27). În ciuda acestor observaţii, pacientele cu SS pot duce cu succes o sarcină la termen.
Există date care arată o rată mai ridicată de avort spontan la pacientele diagnosticate cu SS, cu observaţia că acest lucu poate fi datorat tocmai vârstei înaintate a acestora(28).
Apariţia blocului atrioventricular la nou-născuţii din mame cu anticorpi anti-Ro prezenţi este estimată la aproximativ 2%(29,30) şi la 3% la cei născuţi din mame cu anticorpi anti-La prezenţi(31). Rata de recurenţă a unui astfel de eveniment la pacientele care au avut deja un copil cu afectare cardiacă şi anticorpi prezenţi este de aproximativ 16-18%(32). În ceea ce priveşte sexul feţilor afectaţi, nu există o predispoziţie clară feminin/masculin (procentul pentru sexul feminin variază de la 50% la 83%(33,34)). Atunci când apare afecţiunea cardiacă, cel mai frecvent în trimestrul al doilea de sarcină, este posibilă o abordare terapeutică intrauterină care să crească viteza de conducere atrioventriculară, îmbunătăţind astfel prognosticul fetal atunci când se adaugă şi tratament corticosteroid matern (dexametazonă sau betametazonă, atunci când este disponibilă, care să reducă gradul de afectare de la nivelul nodului atrioventricular(35)).
În literatura de specialitate disponibilă până în prezent nu este precizat dacă sarcina atenuează sau exacerbează simptomatologia SS sau boala în sine. Statusul şi predicţia bolii după naştere nu pot fi anticipate(36). Conform unui caz comunicat în anul 2016, simptomatologia SS a fost ameliorată pe parcursul sarcinii, evidenţiindu-se chiar o completă remisiune din punct de vedere serologic şi ecografic, însă, la trei luni post-partum, simptomatologia a revenit şi chiar s-a exacerbat, pacienta dezvoltând hipotiroidism, artrită reumatoidă, neuropatie periferică şi fatigabilitate(36). Alte date susţin contrariul, şi anume agravarea bolii de bază pe parcursul sarcinii(21). Statusul de imunosupresie din timpul sarcinii poate duce la remisiunea bolii, chiar totală, însă nu şi permanentă.
Tratament
Opţiunile de tratament sunt două, şi anume simptomatic şi medicaţie care să modifice cursul afecţiunii (disease-modifying drugs), imunomodulatoare şi imunosupresoare(37). Tratamentul simptomatic are efect asupra uscăciunii oculare şi orale şi, cel mai important, previne apariţia complicaţiilor – ulceraţii sau perforaţii corneene, carii dentare, candidoză orală etc. Antimalaricele de sinteză atenuează simptomatologia specifică bolii. Hidroxiclorochina creşte fluxul salivar şi a fost demonstrată şi o scădere a factorului de activare a celulelor B (BAFF) în lacrimile pacienţilor ce urmează tratamentul(38). Un alt rezultat notabil, având în vedere riscul de limfom al acestor pacienţi, constă în proprietăţile antineoplazice ale acesteia şi creşterea mecanismelor celulare de reparare(39). Hidroxiclorochina reprezintă medicaţia de prima linie. Adesea, SS duce la afectarea calităţii vieţii nu doar prin simptomatologia specifică tabloului clinic, ci şi prin asocierea anxietăţii, depresiei sau a fibromialgiei. Nu există un tratament-ţintă, acesta se rezumă la ameliorarea simptomatologiei şi prevenţia complicaţiilor(40).
Concluzii
Este crucial ca pacientele diagnosticate cu această afecţiune să obţină consiliere medicală de specialitate înaintea obţinerii unei sarcini, pentru un management corect şi complet, esenţial pentru un prognostic favorabil, având în vedere importanţa controlului bolii anterior obţinerii sarcinii şi a prezentării riscurilor în mod obiectiv. Pacientele diagnosticate cu SS prezintă o sarcină cu risc, ce necesită o abordare multidisciplinară.
Dacă pentru alte boli autoimune care afectează femeile însărcinate prognosticul sarcinii este mai bine cunoscut şi diferă în funcţie de gradul de activitate şi de statusul bolii, de gradul afectării de organ, de nivelul de anticorpi circulanţi sau în funcţie de tratamentul disponibil, pentru SS, toate aceste elemente nu sunt încă bine stabilite.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- De Carolis S, Salvi S, Botta A, Garofalo S, Garufi C, Ferrazzani S, De Carolis MP. The impact of primary Sjögren’s syndrome on pregnancy outcome: our series and review of the literature. Autoimmun Rev. 2014;13(2):103-7.
- Mavragani CP, Moutsopoulos HM. The geoepidemiology of Sjögren’s syndrome. Autoimmun Rev. 2010;9(5):A305-310.
- Peri Y, Agmon-Levin N, Theodor E, Shoenfeld Y. Sjögren’s syndrome, the old and the new. Best Pract Res Clin Rheumatol. 2012;26(1):105-17.
- Tincani A, Andreoli L, Cavazzana I, Doria A, Favero M, Fenini MG, Semeraro F. Novel aspects of Sjögren’s syndrome in 2012. BMC medicine. 2013;11(1):93.
- Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, Talal N. European Study Group on Classification Criteria for Sjögren’s Syndrome. Classification criteria for Sjögren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheumc Dis. 2002;61(6):554-8.
- Shiboski SC, Shiboski CH, Criswell LA, Baer AN, Challacombe S, Lanfranchi H, Dong Y. American College of Rheumatology classification criteria for Sjögren’s syndrome: A data‐driven, expert consensus approach in the Sjögren’s International Collaborative Clinical Alliance Cohort. Arthritis Care Res. 2012;64(4):475-87.
- Barcellos KS, Nonogaki S, Enokihara MM, Teixeira MS, Andrade LE. Differential expression of Ro/SSA 60 kDa and La/SSB, but not Ro/SSA 52 kDa, mRNA and protein in minor salivary glands from patients with primary Sjögren’s syndrome. J Rheumatol. 2007;34(6):1283-92.
- Cruz-Tapias P, Rojas-Villarraga A, Maier-Moore S, Anaya JM. HLA and Sjögren’s syndrome susceptibility. A meta-analysis of worldwide studies. Autoimmun Rev. 2012;11(4):281-7.
- Ramos-Casals M, Brito-Zero P, Siso-Almirall A, Bosch X. Primary Sjögren syndrome. BMJ. 2012;344:e3821.
- Tristano AG. The impact of rheumatic diseases on sexual function. Rheumatol Int. 2009;29(8):853-60.
- Konttinen YT, Fuellen G, Bing Y, Porola P, Stegaev V, Trokovic N, Takakubo Y. Sex steroids in Sjögren’s syndrome. J Autoimmun. 2012;39(1-2):49-56.
- Jonsson R, Vogelsang P, Volchenkov R, Espinosa A, Wahren-Herlenius M, Appel S. The complexity of Sjögren’s syndrome: novel aspects on pathogenesis. Immunol Lett. 2011;141(1):1-9.
- Bowman SJ, Ibrahim GH, Holmes G, Hamburger J, Ainsworth JR. Estimating the prevalence among Caucasian women of primary Sjögren’s syndrome in two general practices in Birmingham, UK. Scand J Rheumat. 2004;33(1):39-43.
- Gøransson LG, Haldorsen K, Brun JG, Harboe E, Jonsson MV, Skarstein K, Omdal R. The point prevalence of clinically relevant primary Sjögren’s syndrome in two Norwegian counties. Scand J Rheumatol. 2011;40(3):221-4.
- Sato EH, Sullivan DA. Comparative influence of steroid hormones and immunosuppressive agents on autoimmune expression in lacrimal glands of a female mouse model of Sjögren’s syndrome. Invest Ophthalmol Vis Sci. 1994;35(5):2632-42.
- Priori R, Medda E, Conti F, Cassara EAM, Sabbadini MG, Antonioli CM, Valesini G. Risk factors for Sjögren's syndrome: a case-control study. Clin Exp Rheumatol. 2007;25:378-84.
- Izmirly PM, Rivera TL, Buyon JP. Neonatal lupus syndromes. Rheum Dis Clin. 2007;33(2):267-85.
- Brucato A, Frassi M, Franceschini F, Cimaz R, Faden D, Pisoni MP, Lojacono A. Risk of congenital complete heart block in newborns of mothers with anti‐Ro/SSA antibodies detected by counterimmunoelectrophoresis: a prospective study of 100 women. Arthritis Rheum. 2001;44(8):1832-5.
- Askanase AD, Miranda‐Carus ME, Tang X, Katholi M, Buyon JP. The presence of IgG antibodies reactive with components of the SSA/Ro‐SSB/La complex in human breast milk: Implications in neonatal lupus. Arthritis Rheum. 2002;46(1):269-71.
- Garcia-Carrasco M, Jiménez-Herrera E A, Gálvez-Romero JL, de Lara LV, Mendoza-Pinto C, Etchegaray-Morales I, Cervera R. Vitamin D and Sjögren syndrome. Autoimmunity Rev. 2017;16(6):587-93.
- Gupta S, Gupta N. Sjögren Syndrome and Pregnancy: A Literature Review. Perm J. 2017;21:16-047.
- Fayyaz A, Kurien BT, Scofield RH. Autoantibodies in Sjögren’s syndrome. Rheum Dis Clin. 2016;42(3):419-34.
- Baldini C, Talarico R, Tzioufas AG, Bombardieri S. Classification criteria for Sjögren’s syndrome: a critical review. J Autoimmun. 2012;39(1-2):9-14.
- Andreoli L, Fredi M, Nalli C, Reggia R, Lojacono A, Motta M, Tincani A. Pregnancy implications for systemic lupus erythematosus and the antiphospholipid syndrome. J Autoimmun. 2012;38(2-3):J197-208.
- Frassi M, Brucato A, Cavazzana I, Franceschini F, Faden D, Motta M, Doria A, Cimaz R, Pisoni MP, Muscarà M, Castellino G, Brambilla G, Meroni PL, Cattaneo R, Biasini Rebaioli C, Antonioli C, Balestrieri G, Tincani A. Neonatal lupus: clinical features and risk of congenital cardiac heart block in newborns from mothers with anti Ro/SSA antibodies. Reumatismo. 2001;53(4):298-304.
- Brucato A, Doria A, Frassi M, Castellino G, Franceschini F, Faden D, Pisoni MP, Solerte L, Muscarà M, Lojacono A, Motta M, Cavazzana I, Ghirardello A, Vescovi F, Tombini V, Cimaz R, Gambari PF, Meroni PL, Canesi B, Tincani A. Pregnancy outcome in 100 women with autoimmune diseases and anti-Ro/SSA antibodies: a prospective controlled study. Lupus. 2002;11(11):716-21.
- Priori R, Gattamelata A, Modesti M, Colafrancesco S, Frisenda S, Minniti A, Bartoloni E. Outcome of pregnancy in italian patients with primary Sjögren syndrome. J Rheumat. 2013;40(7):1143-7.
- Julkunen H, Kaaja R, Kurki P, Palosuo T, Friman C. Fetal outcome in women with primary Sjögren’s syndrome. A retrospective case-control study. Clin Exp Rheum. 1995;13(1):65-71.
- Buyon JP, Clancy RM. Maternal autoantibodies and congenital heart block: mediators, markers, and therapeutic approach. Semin Arthritis Rheum. 2003;33(3):140-54.
- Costedoat-Chalumeau N, Georgin-Lavialle S, Amoura Z, Piette JC. Anti-SSA/Ro and anti-SSB/La antibody-mediated congenital heart block. Lupus. 2005;14(9):660-4.
- Miranda-Carús ME, Askanase AD, Clancy RM, Di Donato F, Chou TM, Libera MR, Buyon JP. Anti-SSA/Ro and anti-SSB/La autoantibodies band the surface of apoptotic fetal cardiocytes and promote secretion of TNF-α by macrophages. J Immunol. 2000;165(9):5345-51.
- Julkunen H, Kurki P, Kaaja R, Heikkila R, Immonen I, Chan EK, Wallgren E, Friman C. Isolated congenital heart block. long‐term outcome of mothers and characterization of the immune response to ss‐a/ro and to ss‐b/la. Arthritis Rheumat. 1993;36(11):1588-98.
- Chameides L, Truex RC, Vetter V, Rashkind WJ, Galioto Jr FM, Noonan JA. Association of maternal systemic lupus erythematosus with congenital complete heart block. N Engl J Med. 1977;297(22):1204-7.
- Buyon JP, Hiebert R, Copel J, Craft J, Friedman D, Katholi M, Rupel A. Autoimmune-associated congenital heart block: demographics, mortality, morbidity and recurrence rates obtained from a national neonatal lupus registry. J Am Coll Cardiol. 1998;31(7):1658-66.
- Ruffatti A, Marson P, Svaluto-Moreolo G, Marozio L, Tibaldi M, Favaro M, Punzi L. A combination therapy protocol of plasmapheresis, intravenous immunoglobulins and betamethasone to treat anti-Ro/La-related congenital atrioventricular block. A case series and review of the literature. Autoimmun rev. 2013;12(7):768-73.
- Khalele BA. Sjögren’s syndrome in a 25-year-old female: A case study. Future Dental J. 2016;2(2):94-8.
- Ramos-Casals M, Brito-Zerón P, Sisó-Almirall A, Bosch X, Tzioufas AG. Topical and systemic medications for the treatment of primary Sjögren’s syndrome. Nat Rev Rheumatol. 2012;8(7):399-411.
- Yavuz S, Asfuroğlu E, Bicakcigil M, Toker E. Hydroxychloroquine improves dry eye symptoms of patients with primary Sjögren’s syndrome. Rheumatol Int. 2011;31(8):1045-9.
- Doria A, Arienti S, Rampudda M, Canova M, Tonon M, Sarzi-Puttini P. Preventive strategies in systemic lupus erythematosus. Autoimmun Rev. 2008;7(3):192-7.
- Vivino FB, Carsons SE, Foulks G, Daniels TE, Parke A, Brennan MT, Hammitt KM. New Treatment Guidelines for Sjögren’s Disease. Rheum Dis Clin. 2016;42(3):531-51.
Articole din ediţiile anterioare
Managementul gravidei cu hepatită virală B cronică - review de literatură şi prezentarea experienţei Spitalului Clinic de Obstetrică-Ginecologie „Prof. Dr. Panait Sîrbu”, Bucureşti
Managementul hepatitei virale B cronice în timpul sarcinii rămâne o provocare și implică numeroase aspecte de îngrijire materno-fetale. Obiectivu...
Infecţia cu Virusul Herpes Simplex în sarcină
Infecţia cu virusurile Herpes Simplex (VHS) reprezintă un grup complex de infecţii, care pot avea drept gazdă organismul uman. Există două tipuri d...
Complicaţiile hipertensiunii arteriale induse de sarcină – management terapeutic şi prognostic
Managementul sarcinii asociate cu hipertensiune gestaţională se realizează în funcţie de severitatea hipertensiunii arteriale, de vârsta ges...
Diagnosticul precoce al sarcinii ovariene – prezentare de caz
Sarcina ovariană este o varietate foarte rară de sarcină ectopică şi reprezintă o provocare medicală în ceea ce priveşte managementul acesteia...