Study objective. Testing the hypothesis that statins improve androgen status in patients with polycystic ovary syndrome. Design. In the study entered 54 women with PCOS who received either statin or oral contraceptive for 12 weeks. Results. We observed a decrease in both total cholesterol and the free cholesterol in the group treated with statin. Although there were no changes to FSH or prolactin obtained, good results were obtained on LH achieving a significant reduction by statin administration. As expected, cholesterol decreased in the first group than the second, without affecting other parameters of the lipidic profile. The inflammatory profile assessed by C-reactive protein was significantly improved by taking statin compared to the group receiving oral contraceptive. Conclusions. Statin therapy improved clinical and endocrinological aspects of patients with polycystic ovary syndrome, also were observed improved effects on lipid profile and inflammatory markers.
Statina, o nouă perspectivă în tratamentul sindromului ovarelor polichistice
Statin, a new perspective in the treatment of polycystic ovarian syndrome
First published: 15 octombrie 2014
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.3.3.2014.4960
Abstract
Rezumat
Obiectivul studiului. Testarea ipotezei că statinele ameliorează statusul androgenic la paciente cu sindrom de ovar polichistic. Design. Au intrat în studiu 54 de femei cu SOPC, care au primit fie statină, fie contraceptiv oral timp de 12 săptămâni. Rezultate. S-a observat o scădere atât a colesterolului total, cât şi a celui liber în grupul tratat cu statină. Deşi nu s-au obţinut modificări asupra FSH sau prolactinei, rezultate bune s-au realizat asupra LH-ului, obţinându-se o scădere semnificativă prin administrarea de statină.
Aşa cum era de aşteptat, colesterolul a scăzut în primul grup comparativ cu al doilea, fără a fi influenţaţi ceilalţi parametri ai profilului lipidic. Statusul inflamator evaluat prin proteina C reactivă a fost mult îmbunătăţit prin administrarea de statină faţă de grupul care a primit contraceptiv oral. Concluzii. Terapia cu statină a îmbunătăţit aspectele clinice şi endocrinologice ale pacientelor cu sindrom al ovarelor polichistice, de asemenea, s-au observat efecte benefice pe profilul lipidic şi pe markerii de inflamaţie.
Sindromul ovarelor polichistice - SOPC - (sindromul Stein-Leventhal, hipertecoza ovariană) reprezintă o afecţiune endocrină ce afectează în medie 6% dintre femei şi reprezintă cea mai frecventă tulburare endocrină în rândul femeilor de vârstă fertilă. Debutul lui este în perioada peripubertară şi se caracterizează în principal prin anovulaţie cronică şi hiperandrogenism, ce pot merge până la infertilitate, fapt care explică şi importanţa deosebită a acestuia în practica medicală.
La ora actuală există mai multe seturi de criterii de diagnostic pentru SOPC. Astfel, după ce au fost excluse alte cauze de hiperandrogenism sau de infertilitate (sindrom Cushing, hiperplazie congenitală adrenaliană, tumori androgen secretante, hiperprolactinemie), principalele criterii utilizate sunt:
1. Criteriile NIH - 1990 (National Institutes of Health)/NICHD(National Institute of Child Health and Human Development). Este necesară prezenţa simultană a următoarelor criterii:
-
Semne de hiperandrogenism clinic (hirsutism, acnee, alopecie de tip masculin) sau biochimic (concentraţii serice crescute de hormoni androgeni).
-
Prezenţa de oligomenoree/amenoree.

2. Criteriile Rotterdam - 2003 emise de către European Society of Human Reproduction and Embryology (ESHRE) în asociere cu American Society of Reproductive Medicine (ASRM). Sunt suficiente pentru diagnosticul de SOPC existenţa a două din următoarele trei:
-
Tulburări de menstruaţie-oligomenoree şi/sau anovulaţie.
-
Prezenţa semnelor clinice şi/sau biochimice de hiperandrogenism.
-
Prezenţa ovarelor polichistice confirmată ecografic.
3. Criteriile AES-2006 (Androgen Excess Society):
-
Prezenţa hiperandrogenismului (clinic şi/sau biochimic) asociat obligatoriu cu:
-
Prezenţa disfuncţiei ovariene (oligo-anovulaţie şi/sau ovare polichistice diagnosticate ecografic.
Inexistenţa unui consens între aceste criterii (de exemplu, conform AES, nu este considerată necesară prezenţa ovarelor polichistice pentru diagnosticul de SOPC) duce practic la subdiagnosticarea acestei patologii cu important risc metabolic şi cardiovascular.
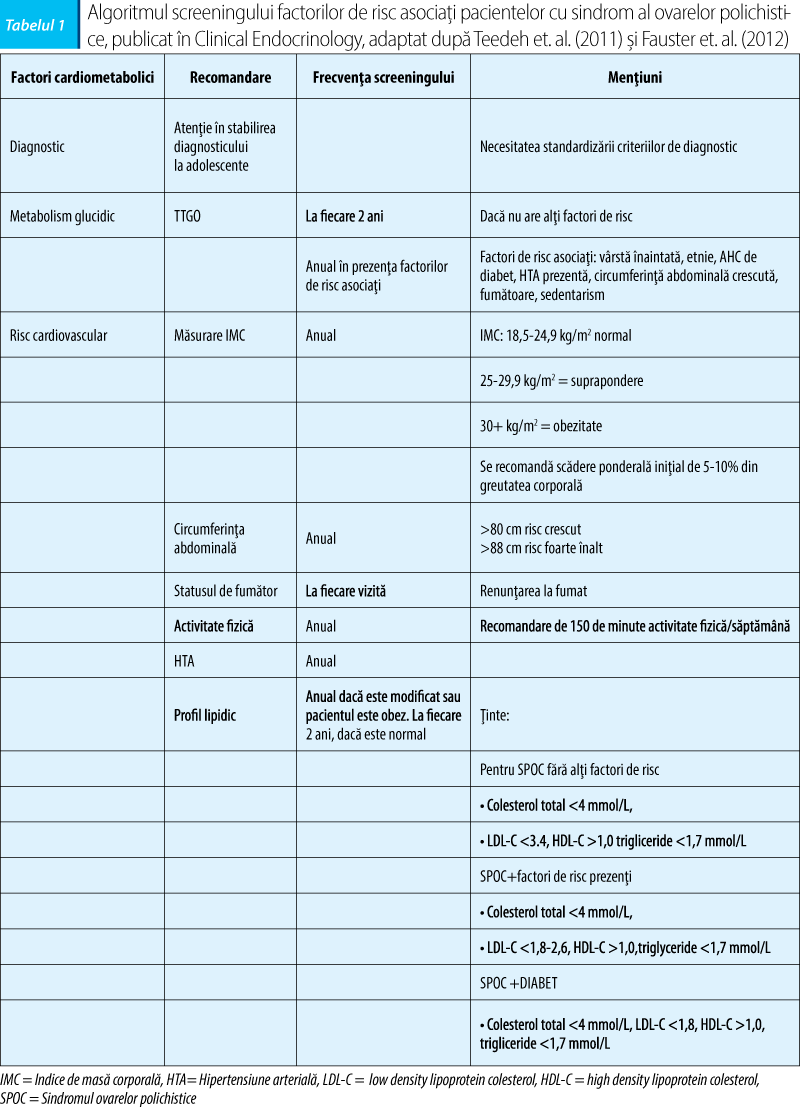
SOPC se asociază cu o creştere a factorilor de risc cardiovasculari, prevenţia primară fiind extrem de importantă la acest grup de pacienţi. Astfel, insulinorezistenţa şi obezitatea (în special tronco-abdominală), alterarea profilului lipidic, precum şi alterarea metabolismului glucidic (manifestat atât prin creşterea prevalenţei IGT, dar şi a diabetului zaharat cu 25-30% faţă de femeile de aceeaşi vârstă, fără SOPC) sunt aspecte metabolice frecvent întâlnite, putând vorbi în cadrul SOPC de un aisberg, în care ceea ce se observă este hiperandrogenismul (necesar diagnosticului), iar baza lui este reprezentată de toţi factorii de risc cardiometabolici, pentru care trebuie să existe screening intensiv.
Există diverse recomandări de screening al factorilor de risc asociaţi pacientelor cu sindrom de ovare polichistice, cel mai complet se pare că este cel publicat în 2013 în Clinical Endocrinology (adaptat după TeedeH et al (2011) şi Fauster et al. (2012)):
Statinele, Atorvastatin, Fluvastatin, Lovastatin, Pravastatin, Simvastatin sunt o clasă de medicamente intens prescrise şi utilizate la nivel mondial datorită rolului lor în îmbunătăţirea profilului lipidic, prin inhibarea sintezei colesterolului şi catabolizarea LDL-ului, prin creşterea numărului de receptori pentru LDL. Simvastatina este o lactonă inactivă, rapid hidrolizată in vivo la beta-hidroxiacidul corespunzător ce acţionează direct asupra enzimei limitante de viteză în calea de formare a colesterolului prin inhibiţia selectivă a 3-hidroxi-metilglutaril-coenzima A(HMG-CoA) reductază. Această enzimă este catalizator în conversia HMG-CoA la mevalonat, o reacţie precoce a colesterologenezei, limitând astfel producerea sa. Hidroliza la forma activă a simvastatinei are loc în principal în ficat, iar în plasma umană viteza acesteia este foarte lentă. Simvastatina este bine absorbită şi suferă metabolizare marcată la primul pasaj hepatic în funcţie de fluxul sangvin hepatic, astfel ficatul devenind primul loc de acţiune al metabolitului activ.
Efectele statinelor asupra funcţiei ovariene, în particular la femeile cu ovare polichistice, pot acţiona pe multiple căi, prima variantă fiind inhibiţia directă a producţiei de colesterol, substratul testosteronului, ameliorând astfel hiperandrogenemia. O a doua cale este limitarea acţiunii insulinei şi a IGF-1 asupra ovarului prin limitarea glicozilării N-linkate şi astfel a maturării insulinei şi receptorilor tip I pentru IGF-I.
Scopul lucrării
În urma unor studii efectuate in vitro, s-a descoperit că statinele reduc producţia androgenică ovariană prin inhibarea proliferării şi producţiei de androgeni la nivelul celulelor interstiţiale theca. Plecând de la acest fapt s-a emis ideea că administrarea acestei clase de medicamente ar putea avea un beneficiu în SOPC, nu doar în contextul dislipidemiei, ci şi în ameliorarea statusului androgenic (Banaszewska, 2007). Pornind de la aceste ipoteze privind rolul statinelor în ameliorarea aspectelor endocrinologice, în special a statusului androgenic, scopul acestei cercetări este acela de a scoate în evidenţă rolul benefic al statinei ca tratament administrat femeilor diagnosticate cu sindromul ovarelor polichistice comparativ cu alte metode terapeutice.
Material şi metodă
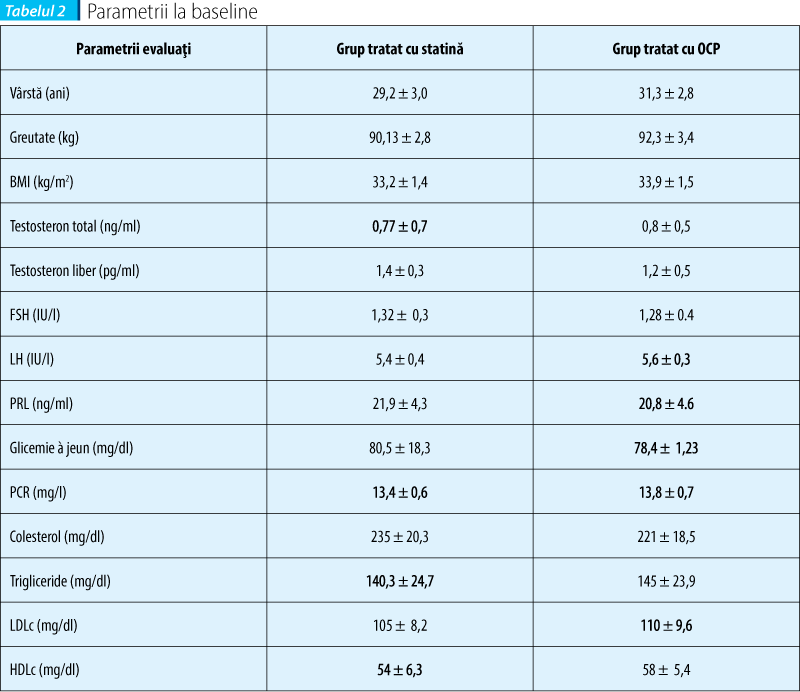
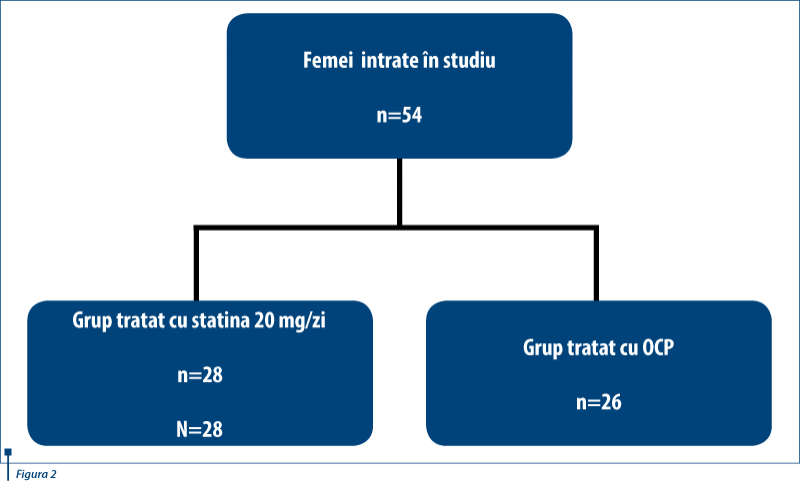
Premisa studiului nostru constă în posibilitatea aprecierii performanţei terapeutice a statinelor în tratamentul de elecţie al femeilor diagnosticate cu SOPC. Diagnosticul de sindrom al ovarelor polichistice a fost pus pe baza criteriilor Rotterdam, incluzând în studiu un număr de 54 de femei, studiu efectuat în Clinica de Obstetrică-Ginecologie a Spitalului Universitar de Urgenţă Elias în perioada 1 ianuarie 2010 - 30 mai 2010. În lot au fost incluse femei de vârstă reproductivă de la 25 la 35 de ani, 10 dintre paciente cu obezitate gradul I şi restul cu un IMC în limite normale.
Lotul de studiu a fost împărţit în 2 grupuri: primul grup format din 28 de paciente care au primit tratament cu simvastatină, 20 mg/zi, şi un grup de 26 paciente la care s-a administrat contraceptiv oral combinat. Ca urmare a acestei terapii diferenţiate s-au urmărit comparativ nivelul de:
-
testosteron (total şi liber);
-
LH, FSH;
-
prolactină;
-
colesterol total (pentru definirea profilului lipidic: LDLc, HDLc, trigliceride);
-
proteina C reactivă;
-
glicemia.
Concomitent cu urmărirea acestor parametri de laborator au fost de asemenea urmărite:
-
indicele de masă corporală;
-
circumferinţa abdominală.
Pornind de la valorile normale ale elementelor de laborator amintite ale unei femei de vârstă reproductivă, studiul nostru a urmărit comparativ revenirea la normal a acestor valori post-terapii administrate diferenţiat celor 2 loturi de paciente. Pacientele au fost evaluate la 12 săptămâni de la iniţierea terapiei.
Având în vedere că simvastatina, ca şi alţi inhibitori ai HMG-CoA reductază, poate produce ocazional miopatie, uneori chiar rabdomioliză, au fost excluse din studiu pacientele care prezentau:
1. Insuficienţă renală.
2. Hipotiroidism.
3. Antecedente personale sau familiale de tulburări musculare ereditare.
4. Antecedente de toxicitate musculară la administrarea unei statine sau fibrat.
5. Consum cronic de alcool etilic.
Rezultate
Pacientele înrolate în studiu care au fost supuse tratamentului cu statină au avut o medie de vârstă de 29,2 ani comparativ cu cele din grupul cu administrare de contraceptiv oral combinat care au avut o vârstă medie de 31,5 ani.
Din punctul de vedere al indicelui de masă corporală, pacientele din grupul cu administrare de statină au avut un IMC mediu de 33,2 comparativ cu lotul de femei tratate cu contraceptiv oral combinat care au avut un IMC mediu de 33,9.
În grupul de femei tratate cu statină s-a constatat o scădere a testosteronului total într-un procent de 45% comparativ cu 18% în grupul femeilor tratate cu COC (p <0,005), astfel încât nivelul de testosteron liber a scăzut cu 40% în grupul tratat cu statină faţă de 35% în grupul supus terapiei cu COC (dar p nu a avut semnificaţie statistică).
Terapia cu statină a fost asociată cu o scădere importantă a LH cu 38%, comparativ cu scăderea de numai 6% în grupul tratat cu COC, fără modificări semnificative asupra FSH şi prolactinei. Pe profilul lipidic, în grupul supus terapiei cu statină s-a obţinut o scădere a colesterolului total cu 12% şi a LDLc cu 17%, în timp ce în grupul pacientelor tratate cu COC s-a observat o creştere cu 6% a colesterolului total. În ambele grupuri s-a observat o creştere a HDLc, fără semnificaţie statistică între cele două. Trigliceridele nu au fost influenţate, la fel nici metabolismul glucozei.
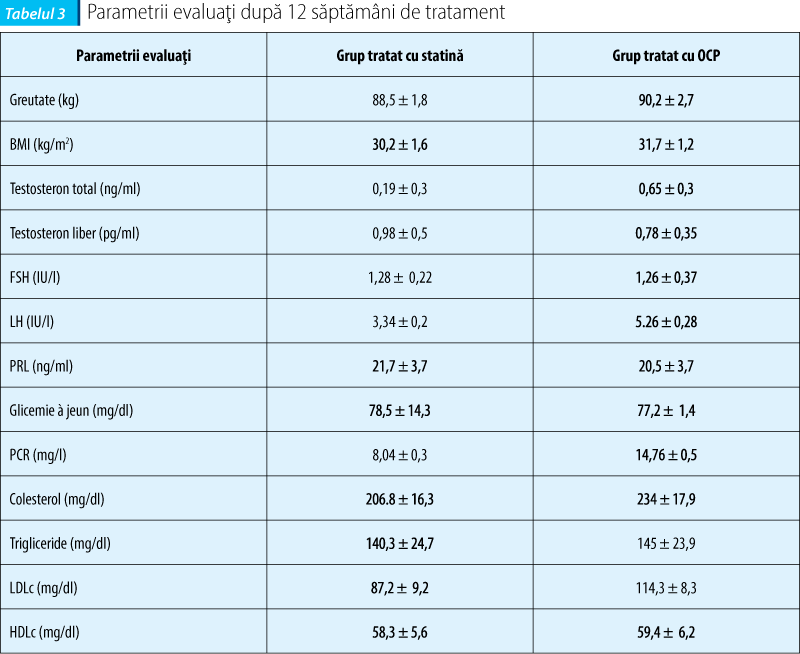
Proteina C reactivă a scăzut cu 40% în grupul cu statină, în timp ce în grupul cu OCP s-a observat o creştere cu 7% a valorii acesteia.
Cu privire la statusul ponderal al pacientelor s-a observat un trend descrescător al BMI-ului în ambele loturi, fără semnificaţie statistică, scăderea ponderală fiind mai importantă la pacientele care au respectat un regim alimentar hipocaloric, neputându-se atribui acest efect terapiei administrate.
Concluzii
Terapia cu statină a îmbunătăţit aspectele clinice şi endocrinologice ale pacientelor cu sindrom al ovarelor polichistice din lotul studiat, de asemenea observându-se efecte benefice pe profilul lipidic şi pe markerii de inflamaţie.
Statinele par să fie o terapie medicamentoasă promiţătoare în managementul sindromului ovarelor polichistice prin acţiunea lor nu numai asupra dislipidemiei frecvent asociate acestei endocrinopatii, cât şi asupra stimulării proliferării tecale şi steroidogenezei.
Mecanismele de acţiune ale statinelor sunt variate şi direcţionate împotriva stresului oxidativ, inflamaţiei sistemice şi rezistenţei insulinice/hiperinsulinemiei asociate cu fiziopatologia sindromului ovarelor polichistice, demonstrând rolul statinelor ca terapie de viitor în tratamentul sindromului ovarelor polichistice.
Dat fiind că studiul de faţă este în fază incipientă şi pe un număr limitat de cazuri, se pot ridica numeroase întrebări precum:
-
Care sunt efectele pe termen lung ale administrării statinelor la femeile de vârstă reproductivă?
-
Este important fenotipul sindromului ovarelor polichistice în alegerea acestei terapii (hiperinsulinemie faţă de normoinsulinemie)?
-
Ar trebui folosite statinele la femeile cu sindromul ovarelor polichistice cu profil lipidic normal?
-
Au acţiune favorabilă asupra pacientelor fără hiperandrogenemie?
-
Pot fi folosite eficient statinele la femeile cu sindromul ovarelor polichistice din grupuri etnice diferite (caucaziene, afro-americane, asiatice)?
-
Pot acţiona favorabil statinele asupra ovulaţiei?
-
Care este momentul optim de iniţiere a terapiei cu statine?
Ţinând cont de posibilul risc teratogenic al statinelor, cât şi de avantaje, administrarea lor necesită criterii individualizate pentru fiecare pacientă.
Un avantaj important al administrării simvastatinei la femeile cu sindromul ovarelor polichistice este că oferă faţă de tratamentul cu anticoncepţionale orale, pe lângă ameliorarea hiperandrogenemiei şi a dereglărilor de secreţie a hormonilor gonadotropi, şi o protecţie cardiovasculară pe termen lung.
Limitarea studiului prezent este dată de numărul mic de paciente incluse, fiind necesare studii ulterioare pentru dovedirea aplicabilităţii rezultatelor.
Bibliografie
Wassmann S, Laufs U, Muller K, Konkol C, Ahlbory K, Baumer AT, Linz W, Bohm M, Nickenig G 2002 Cellular antioxidant effects of atorvastatin in vitro and in vivo. Arterioscler Thromb Vasc Biol 22:300–305.
Engelhardt H, Gore-Langton RE, Armstrong DT 1989 Mevinolin (lovastatin)inhibits androstenedione production by porcine ovarian theca cells at the level of the 17 _-hydroxylase:C-17,20-lyase complex. Endocrinology 124:2297–2304.
Azziz R, Woods KS, Reyna R, Key TJ, Knochenhauer ES, Yildiz BO 2004 The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol Metab 89:2745–2749.
Diamanti-Kandarakis E, Kouli CR, Bergiele AT, Filandra FA, Tsianateli TC, Spina GG, Zapanti ED, Bartzis MI 1999 A survey of the polycystic ovary syndrome in the Greek island of Lesbos: hormonal and metabolic profile. J Clin Endocrinol Metab 84:4006–4011.
Asuncion M, Calvo RM, San Millan JL, Sancho J, Avila S, Escobar-Morreale HF 2000 A prospective study of the prevalence of the polycystic ovary syndrome in unselected Caucasian women from Spain. J Clin Endocrinol Metab 85:2434–2438.
Simvastatin and Oral Contraceptive Agent on Ovary Syndrome: Prospective, Randomized, Beata Banaszewska, Leszek Pawelczyk, Robert Z. Spaczynski, James Dziura, and Antoni J. Duleba.
Wild R 2002 Long-term health consequences of PCOS. Hum Reprod Update 8:231–241.
Tarkun I, Arslan BC, Canturk Z, Turemen E, Sahin T, Duman C 2004 Endothelial dysfunction in young women with polycystic ovary syndrome: relationship with insulin resistance and low-grade chronic inflammation. J Clin Endocrinol Metab 89:5592–5596.
Ando H, Takamura T, Ota T, Nagai Y, Kobayashi K 2000 Cerivastatin improves survival of mice with lipopolysaccharide-induced sepsis. J Pharmacol Exp Ther 294:1043–1046.
Rebar R, Judd HL, Yen SS, Rakoff J, Vandenberg G, Naftolin F 1976 Characterization of the inappropriate gonadotropin secretion in polycystic ovary syndrome. J Clin Invest 57:1320–1329.
Balen AH, Laven JS, Tan SL, Dewailly D 2003 Ultrasound assessment of the polycystic ovary: international consensus definitions. Hum Reprod Update 9:505–514.
Duleba AJ, Banaszewska B, Spaczynski RZ, Pawelczyk L 2006 Simvastatin improves biochemical parameters in women with polycystic ovary syndrome: results of a prospective, randomized trial. Fertil Steril 85:996–1001.
Mahabeer S, Naidoo C, Norman RJ, Jialal I, Reddi K, Joubert SM 1990 Metabolic profiles and lipoprotein lipid concentrations in non-obese and obese patients with polycystic ovarian disease. Horm Metab Res 22:537–540.
Dahlgren E, Janson PO, Johansson S, Lapidus L, Oden A 1992 Polycystic ovary syndrome and risk for myocardial infarction. Acta Obstet Gynecol Scand 71:599–604.
Izquierdo D, Foyouzi N, Kwintkiewicz J, Duleba AJ 2004 Mevastatin inhibits ovarian theca-interstitial cell proliferation and steroidogenesis. Fertil Steril 82(Suppl 3):1193–1197.
Spicer LJ, Hamilton TD, Keefer BE 1996 Insulin-like growth factor I enhancement of steroidogenesis by bovine granulosa cells and thecal cells.
Julie A Tomlinson, Jonathan H Pinkney, Phil Evans, Ann Millward, Elizabeth Stenhouse, British Journal of Diabetes and Vascular. Disease. 2013;13(3):115-123. Screening for Diabetes and Cardiometabolic Disease in Women With Polycystic Ovary Syndrome.
Hamidreza Mani, Miles J. Levy, Melanie J. Davies, Danielle H. Morris, Laura J. Gray, John Bankart, Hannah Blackledge, Kamlesh Khunti, Trevor A. HowlettClin Endocrinol. 2013;78(6):926-934. Diabetes and Cardiovascular Events in Women With Polycystic Ovary Syndrom.A 20-Year Retrospective Cohort Study.
Articole din ediţiile anterioare
Tratamentul medical al endometriozei: este opţiunea medicului?
Introducere. Endometrioza este o patologie cronică benignă, iar managementul ei implică adoptarea unei strategii pe termen lung care include tr...
Sindromul ovarelor polichistice. Fertilitatea ca dovadă a echilibrului energetic
În prezent, sindromul ovarelor polichistice (SOP) este cea mai frecventă endocrinopatie ginecologică din cadrul categoriei femeilor de vârstă ...
Sindromul de hiperstimulare ovariană
Sindromul de hiperstimulare ovariană reprezintă cea mai gravă complicaţie a stimulării ovariene şi a procedurilor de fertilizare in vitro, putând ...
Răspunsul ţesuturilor periodontale la contraceptivele orale
La menopauză, osteoporoza afectează implantarea dinţilor. Graţie existenţei în ţesuturile parodontale a doi receptori estrogeni, ERα şi ERβ, trat...