Pregnancy is a procoagulant state, at risk of developing a pulmonary thromboembolism, due to the physiological increase in coagulant factors and the decreasing of the coagulation inhibitors. These changes have the purpose to protect pregnant women from emergence bleeding in period IV. In order to prevent thrombotic events, it is important to understand the changes to set up a proper prophylactic treatment for pregnant women with an increased risk of thrombosis. It also should be understood that procoagulant status does not disappear at birth and that it remains up to 6 weeks post-partum. This article is set to present the physiological changes that occur during pregnancy at coagulation level.
Trombembolismul pulmonar asociat sarcinii - status fiziologic procoagulant
Pulmonary thromboembolism associated with pregnancy - physiological procoagulant status
First published: 22 mai 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.16.2.2017.761
Abstract
Rezumat
Sarcina reprezintă o stare procoagulantă cu risc de dezvoltare a trombembolismului pulmonar, prin creşterea fiziologică a factorilor procoagulanţi şi prin scăderea factorilor inhibitori ai coagulării. Aceste modificări au rolul de a proteja gravida de apariţia hemoragiei în periodul IV. Pentru a putea preveni evenimentele trombotice, este important să fie înţelese modificările apărute, astfel încât să se instituie un tratament profilactic adecvat gravidelor cu risc crescut de tromboză. De asemenea, trebuie înţeles faptul că statusul procoagulant nu dispare odată cu naşterea şi că acesta se menţine până la şase săptămâni post-partum. Articolul prezent îşi propune să prezinte modificările fiziologice apărute în sarcină la nivelul coagulării.
Introducere
Trombembolismul pulmonar (TEP) reprezintă o cauză majoră de deces matern în ţările dezvoltate, cu o incidenţă calculată de aproximativ 317000 de decese, în pofida măsurilor de profilaxie antitrombotică.
Riscul de dezvoltare a trombembolismului pulmonar la gravide este de 10 ori mai mare decât la femeile din populaţia generală, fiind de asemenea şi cea mai comună cauză de mortalitate maternă, cu o incidenţă de 1,08 din 100000(1).
Sarcina este o stare procoagulantă, ca urmare a modificărilor fiziologice care influenţează atât coagularea, cât şi fibrinoliza.
Aceste modificări au rolul de a preveni hemoragiile în timpul naşterii şi în periodul IV, cât şi să asigure o bună funcţionare a sistemului placentar, dar au şi dezavantajul de a creşte riscul de apariţie a TEP atât pe parcursul sarcinii, cât şi post-partum.
Diagnosticul clinic al TEP în sarcină este încă dificil de pus, mai ales din cauza tuturor modificărilor survenite în timpul sarcinii, care pot simula simptomele TEP.
Ghidurile actuale sugerează că, în momentul suspiciunii unui TEP, trebuie început imediat tratamentul, până la diagnosticul de certitudine, din cauza riscului crescut de deces matern(2).
Modificări fiziologice ale coagulării determinate de sarcină
În sarcină, hemostaza se modifică în mod fiziologic prin creşterea concentraţiei factorilor de coagulare concomitent cu scăderea concentraţiei factorilor anticoagulanţi şi cu procesul de fibrinoliză, astfel încât acesta devine o stare procoagulantă care previne hemoragiile din periodul IV.
În timpul sarcinii, riscul de tromboză creşte cu 0,5-3%, în comparaţie cu femeile din populaţia generală, această creştere fiind determinată de modificările fiziologice ale factorilor de coagulare-hipercoagulabilitate, de staza sangvină care afectează structura endoteliului vascular şi de concentraţia mare de oxid nitric ce determină vasodilataţia(3). Triada lui Virchow (hipercoagulabilitate, leziuni endoteliale, stază vasculară) este prezentă în sarcină, determinând riscul crescut de dezvoltare a trombembolismului pulmonar la femeile gravide. De asemenea, în timpul unei sarcini normale, se poate observa o creştere fiziologică a activităţii unor diferiţi factori implicaţi în coagulare (de exemplu, factorul VII şi factorul VIII). Pe lângă această creştere, apare o scădere a factorilor antitrombotici, precum proteina S şi creşterea nivelului seric al inhibitorul activatorului de plasminogen (PAI), având ca efect apariţia unui status procoagulant în sarcină.
Trombocitopenia este cea mai frecventă modificare hemostatică observată în timpul sarcinii(4). S-a observat că, la aproximativ 10% din gravide, ultimul trimestru de sarcină asociază o trombocitopenie determinată de apariţia fiziologică a hemodiluţiei. Creşterea volumului mediu trombocitar sugerează o stare compensatorie determinată de distrugerea progresivă a trombocitelor(5). Concentraţia serică crescută a derivaţilor de tromboxan A2 şi a b-tromboglobulinei (este crescută în peretele arterelor spiralate şi în spaţiul intervilos al placentei) în trimestrul al III-lea de sarcină reprezintă o dovadă suplimentară a activării plachetare in vivo(6).
Fibrinogenul creşte semnificativ în sarcină, ajungând la valori mai mari de 600 mg/dl spre sfârşitul trimestrului al III-lea de sarcină(7). Având în vedere hemodiluţia fiziologică, se poate afirma că fibrinogenul la sfârşitul sarcinii poate ajunge la o valoare dublă faţă de negravide. Imediat post-partum, nivelul seric al fibrinogenului creşte, ajungând la o valoare normală la 3-4 săptămâni de la naştere.
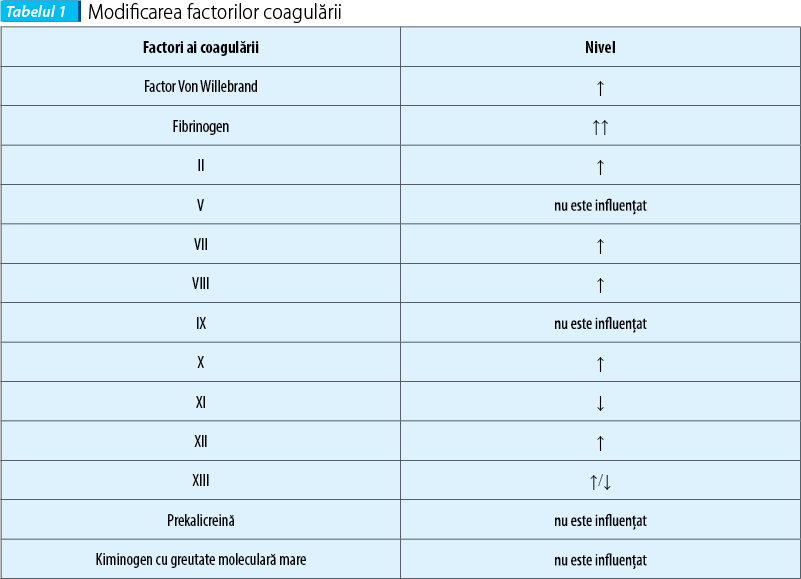
Factorii coagulării suferă modificări atât în timpul sarcinii, cât şi post-partum(8) (tabelul 1).
Factorii implicaţi în inhibarea fibrinolizei sunt modificaţi în sarcină(8) (tabelul 2).
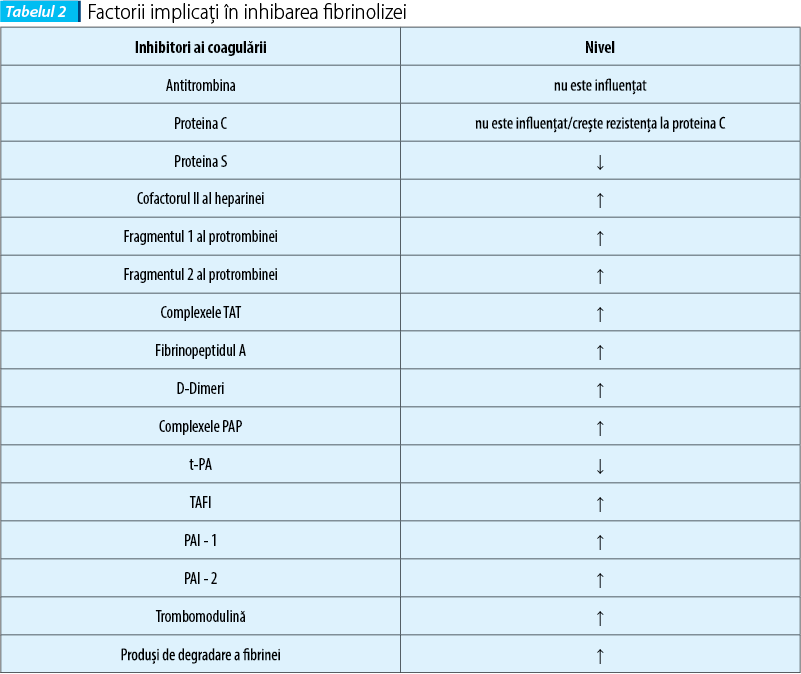
Fibrinoliza în sarcină este redusă în mod fiziologic prin modificări apărute în nivelul seric al factorilor inhibitori ai fibrinolizei, aceasta începând să revină la normal după delivrenţă.
Activatorul tisular al plasminogenului (t-PA) scade în sarcină. Activitatea t-PA este influenţată de nivelul seric crescut al inhibitorului activatorului plasminogenului PAI-1 (eliberat de celulele endoteliale) şi al inhibitorului activatorului plasminogenului PAI-2 (este produs doar de placentă).
Nivelul seric al PAI-2 la termen este de 25 de ori mai mare faţă de negravide(9). Post-partum, t-PA şi PAI-1 încep să revină la valori normale la cinci săptămâni post-partum; PAI-2, fiind produs exclusiv de placentă, se regăseşte doar la femeile gravide(10). Placenta, fiind unica sursă de PAI-2, determină apariţia unei relaţii direct proporţionale între nivelul seric al PAI-2 şi greutatea fătului la naştere(11,12). Proteina C şi Proteina S sunt factori dependenţi de vitamina K, ambele fiind sintetizate în ficat. Proteina S circulă 40% sub formă liberă şi 60% legată de o proteină, acesta fiind cofactorul Proteinei C, amplificându-i rolul anticoagulant, şi anume creşte efectul proteolitic asupra factorului V activat şi asupra factorului X activat(13). Nivelul seric al Proteinei C nu este modificat în sarcină, în schimb rezistenţa faţă de Proteina C activată este crescută, motiv pentru care apare o creştere compensatorie a factorului Von Willebrand. Activarea Proteinei C este realizată de factorul X activat şi de complexul trombomodulină-trombină (trombomodulina reprezintă receptorul trombinei de la nivelul celulelor endoteliale). Trombina legată de trombomodulină (nivel seric crescut în sarcină) nu are efect procoagulant(14).
D-Dimerii cresc semnificativ în sarcină, motiv pentru care nu se pot utiliza în excluderea apariţiei trombembolismului pulmonar la gravidele/lehuzele care au simptomatologie sugestivă de embolie pulmonară.
Inhibitorul fibrinolizei activabil de către trombină (TAFI), creşte în sarcină, cu un nivel maxim în săptămânile 35-39 şi scade rapid la 24 de ore după naştere(8). S-a constatat că nivelul seric de TAFI se corelează cu vârsta maternă(15).
Modificări fiziologice procoagulante post-partum
Activitatea procoagulantă creşte semnificativ în momentul delivrenţei, prin eliberarea de factori tromboplasmatici de la nivelul unităţii utero-placentare. De asemenea, s-a observat că statusul procoagulant în perioada puerperală este asemănător cu statusul indus de intervenţiile chirurgicale majore.
În timpul delivrenţei, nivelul seric de trombocite scade uşor, urmând ca la 2-5 zile post-partum să apară o trombocitopoeză compensatorie(16).
Antitrombina (AT) creşte după delivrenţă, rămânând crescută pentru cel puţin două săptămâni post-partum. De asemenea, apare o creştere a nivelului seric al Proteinei C în primele trei zile post-partum(17). Proteina S totală şi Proteina S liberă cresc. Proteina S totală revine la valori normale la o săptămână post-partum, iar nivelul seric de Proteină S liberă poate fi crescut până la opt săptămâni post-partum(18). Complexele TAT şi fragmentele 1 şi 2 ale protrombinei au niveluri serice crescute în periodul IV.
Vârful de activitate trombocitară şi de coagulare apare imediat în periodul IV, pe când vârful de fibrinoliză apare în primele trei ore de la delivrenţă, fiind demonstrat de creşterea D-Dimerilor(19). Fibrinoliza şi coagularea revin la parametri normali la trei săptămâni post-partum, când riscul de trombembolism pulmonar determinat de hipercoagulabilitatea indusă de sarcină este mult redus.
Concluzii
Trombembolismul pulmonar reprezintă o cauză majoră de deces matern, dat fiind statusul fiziologic procoagulant determinat de sarcină. Statusul procoagulant din sarcină se datorează creşterii nivelului seric al factorilor procoagulanţi şi scăderii fibrinolizei, precum şi factorilor cu rol în inhibarea coagulării. Din cauza riscului crescut de deces matern, înţelegerea modificărilor procoagulante fiziologice apărute în sarcină, alegerea corectă a metodelor de diagnostic al trombembolismului pulmonar, tromboprofilaxia şi managementul terapeutic au un rol vital. Discrepanţa dintre ghidurile internaţionale în ceea ce priveşte managementului TEP în sarcină subliniază necesitatea studierii în profunzime a modificărilor procoagulante apărute în sarcină, a factorilor de risc, a metodelor de diagnostic şi a managementului abordat.
Bibliografie
2. Ramsay R, Byrd L, Tower C, James J, Prescott M, Thachil J. The problem of pulmonary embolism diagnosis in pregnancy. Br J Haematol, 2015;170:727–8.
3. Carol JJ. Role of endothelial cell in coagulation. Adv Med Lab Prof, 1996;8(1):10-8.
4. Bonnar J. „Haemostasis and coagulation disorders in pregnancy”. In: Bloom AL, Thomas DP, edit. Haemostasis and Thrombosis, Churchill Livingstone, Edinburgh, 1987:570-84.
5. Douglas JT, Shah M, Lowe GD, Belch JJ, Forbes CD, Prentice CR. Plasma fibrinopeptide A and β-thromboglobulin in pre-eclampsia and pregnancy hypertension. Thromb Haemost, 1982;47:54-5.
6. Fitzgerald DJ, Mayo G, Catella F, Entman SS, FitzGerald GA. Increased thromboxane biosynthesis in normal pregnancy is mainly derived from platelets. Am J Obstet Gynecol, 1987;157:325-30.
7. Francalanci I, Comeglio P, Liotta AA, Cellai AP, Fedi S, Parretti E, et al. D-dimer concentrations during normal pregnancy, as measured by ELISA. Thromb Res 1995;78:399-405.
8. Mitran M, Georgescu C, Vlădăreanu S. Hipercoagulabilitatea în sarcină. Modificări adaptative şi patologice. Ginecologia.ro, 2015;7(1):20-5.
9. Kruithof EK, Tran-Thang C, Gudinchet A et al. Fibrinolysis in pregnancy: a study of plasminogen activator inhibitors. Blood 1987;69:460–6.
10. Bremme K, Ostlund E, Almqvist I, Heinonen K, Blomback M. Enhanced thrombin generation and fibrinolytic activity in the normal pregnancy and the puerperium. Obstet Gynecol, 1992;80:132–7.
11. De Boer K, ten-Cate JW, Sturk A, Borm JJ, Treffers PE. Enhanced thrombin generation in normal and hypertensive pregnancy. Am J Obstet Gynecol 1989;160:95-100.
12. Comeglio P, Fedi S, Liotta AA, Cellai AP, Chiarantini E, Prisco D, et al. Blood clotting activation during normal pregnancy. Thromb Res, 1996;84:199–202.
13. Nanu D. Tratamentul anticoagulant în sarcină, Obst-Ginec LIV, 2009:129-36.
14. Chetaille P, Alessi MC, Kouassi D, Morange PE, Juhan-Vague I. Plasma TAFI antigen variations in healthy subjects. Thromb Haemost, 2000;83:902-5.
15. Bouma BN. Thrombin-activable fibrinolysis inhibitor. J Tromb Haemost, 2003;1:1566.
16. Dahlstrom BL, Nesheim BI. Post-partum platelet count in maternal blood. Acta Obstet Gynecol Scand, 1994;73:695-7.
17. Gonzales R, Alberca J, VicenteV. Protein C levels in late pregnancy, post-partum and in women on oral contraceptives. Thromb Res, 1985;39:637–40.
18. Kjellberg U, Andersson NE, Rosen S, Tengborn L, Hellgren M. APC resistance and other haemostatic variables during pregnancy and puerperium. Thromb Haemost, 1999;81:527-31).
19. Gerbasi FR, Bottoms S, Farag A, Mammen E. Increased intravascular coagulation associated with pregnancy. Obstet Gynecol, 1990;75:385–9.
20. Gerbasi FR, Bottoms S, Farag A, Mammen E. Increased intravascular coagulation associated with pregnancy. Obstet Gynecol, 1990;75:385–9.
Articole din ediţiile anterioare
Sarcina ectopică cu evoluţie atipică
Prezentăm cazul unei paciente în vârstă de 32 de ani, cu istoric de infertilitate de cauză neexplicată (2 inseminări şi 2 fertilizări in vitro pe c...
Contracepţia la adolescente - o provocare
Odată cu debutul vieţii sexuale la vârste din ce în ce mai fragede, centrele de planificare familială joacă un rol important prin consilierea adole...
Transmiterea materno-fetală a infecţiei HPV
Mai multe studii au analizat transmiterea materno-fetală a infecţiei cu virusul papiloma uman (HPV). Aceasta se poate realiza în perioada periconce...
Actualizare despre utilizarea investigaţiilor radiologice cu raze ionizante în timpul sarcinii: care sunt riscurile fetale?
Investigaţiile imagistice pot ajuta la diagnosticarea unui spectru larg de boli acute sau cronice. Practicianul se poate confrunta cu incertitud...