Introduction. Nephrotic syndrome is among the most common kidney disorders in children, known to be associated with thromboembolic complications, but rarely the localization of thrombus is cerebral.
Case presentation. A female child aged 5 years old is hospitalized for palpebral edema, fever and cough – occurring in an epidemiological context, during flu season, her mother beeing diagnosed with the influenza season type A(H1N1). The child was diagnosed with nephrotic syndrome and influenza based on clinical and epidemiological criteria. She developed headache and photophobia, signs of cerebral venous thrombosis that was subsequently imagistically diagnosed. We identified a range of pro-thrombotic genetic mutations that contributed to thrombosis.
Discussions and conclusions. An infectious trigger started a cascade that could have had fatal consequences. Influenza‑induced renal complication was followed by a new complication – cerebral venous thrombosis, favored by nephrotic syndrome; this appeared on an undiagnosed pro-thrombotic genetic background.
The authors have not identified any similar case with influenza‑induced nephrotic syndrome complicated with cerebral venous thrombosis in a child.
Sindrom nefrotic complicat cu tromboză venoasă cerebrală, având ca trigger gripa de tip A(H1N1)
Nephrotic syndrome complicated with cerebral venous thrombosis having as trigger influenza A(H1N1)
First published: 06 noiembrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Inf.51.3.2017.1199
Abstract
Rezumat
Introducere. Sindromul nefrotic este printre cele mai frecvente afecțiuni renale la copii, cunoscută fiind asocierea cu complicații tromboembolice, însă extrem de rar localizarea trombului este cerebrală.
Prezentarea cazului. Un copil în vârstă de 5 ani se internează pentru edeme palpebrale, febră și tuse, apărute în context epidemiologic, în plin sezon gripal, mama având gripă de tip A(H1N1). Copilul a fost diagnosticat cu sindrom nefrotic și gripă pe baza criteriilor clinice și epidemiologice. În evoluție au apărut cefaleea și fotofobia, specifice trombozei venoase cerebrale, care a fost diagnosticată imagistic ulterior. Continuând investigațiile, am identificat o paletă de mutații genetice protrombotice, care au contribuit la tromboză.
Discuții și concluzii. Un trigger infecțios a declanșat o cascadă care putea avea urmări fatale. Complicația renală indusă de gripă a fost urmată de o nouă complicație – tromboza venoasă cerebrală, fiind favorizată de sindromul nefrotic, însă apărută pe un fond genetic protrombotic necunoscut de pacientă. Autorii nu au identificat în literatură vreun caz de sindrom nefrotic indus de gripă, complicat cu tromboză venoasă cerebrală la copil.
Introducere
Anual, gripa afectează 5-10% din populație la nivel mondial, cauzând 250 000–500 000 decese. Sezonul gripal 2015-2016, în Europa, a înregistrat o activitate mai severă comparativ cu sezoanele precedente, raportându-se o creștere rapidă a numărului cazurilor grave în Europa de Est, majoritatea fiind la adolescenți și adulți cu vârste între 15 și 64 ani(1). În aproximativ toate țările europene, sezonul gripal a fost dominat de gripa de tip A(H1N1)pdm09m(2).În România, la nivel național, până în februarie 2016 – săptămâna 06/2016, s-au înregistrat 91244 de cazuri de infecții respiratorii acute. În luna februarie s-au înregistrat 1479 de cazuri de gripă/Influenza-like illness(3).
Deși, în majoritatea cazurilor, gripa este autolimitantă, la sugari și copii mici poate avea evoluție nefavorabilă, uneori complicațiile fiind fatale. Simptomele cauzate de A(H1N1)pdm09 sunt ușoare, cu o rată a fatalității ≤0,5%(4,5).
Sindromul nefrotic (SN) în patologia pediatrică are o incidență de 2-7 cazuri la 100000 de copii, fiind una dintre cele mai frecvente afecțiuni renale la copii. La circa 3% dintre copiii cu SN, tromboembolismul venos (TEV) poate apărea ca o complicație a SN, în timp ce în grupurile cu risc înalt acesta atinge o incidență de circa 25%(6). Această complicație este cunoscută încă din secolul al XIX-lea, iar etiologia este multifactorială, fiind favorizată de tulburările de coagulare apărute în cadrul sindromului nefrotic.
Cea mai frecventă localizare a trombozei este vena renală, tromboza venoasă cerebrală (TVC) fiind extrem de rară, însă asociată cu mare morbiditate. În literatură sunt raportate foarte puține cazuri, incidența trombozei cerebrale asociate SN nefiind cunoscută. Însă, luând în considerare toate etiologiile posibile, TVC are o incidență de 0,67 cazuri la 100 000 copii/an, deși foarte probabil este subestimată(7).
Prezentarea cazului
Un copil de sex feminin, în vârstă de 5 ani și 9 luni, se prezintă în Spitalul Clinic de Urgență pentru copii „Grigore Alexandrescu“ în februarie 2016 pentru edeme palpebrale debutate cu 3 zile anterior internării, apărute dimineața, cu remisiune pe parcursul zilei. Edemele palpebrale au persistat, iar copilul a asociat febră, tuse seacă și un scaun semilegat cu 24 de ore anterior internării. Din antecedentele heredocolaterale amintim: ambii părinți, în vârstă de 39 de ani, afirmativ fără boli cronice, un frate în vârstă de 20 de ani fără boli cronice.
De menționat existența contextului epidemiologic: ambii părinți cu simptomatologie respiratorie – tuse, rinoree, febră, frison.
Din antecedentele personale fiziologice menționăm: născută la termen prin operație cezariană (cauze materne), rang II, scor Apgar 9, greutate la naștere de 3200 g, talie de 53 cm, externată din Maternitatea Spitalului CF 2 după patru zile, adaptare postnatală bună, icter fiziologic, alimentată artificial, diversificată la vârsta de 4 luni, dezvoltare psihomotorie pe vârste și etape bună, vaccinată conform schemei Ministerului Sănătății până la vârsta de 2 ani.
Menționăm că până la internarea actuală nu a mai fost spitalizată.
La internare era febrilă (38,8 ºC), greutate – 21 kg, stare generală mediocră, tegumente palide fără elemente eruptive, edeme palpebrale, edeme retromaleolare și pretibiale bilaterale albe, moi, pufoase, rinoree seromucoasă, tuse seacă, murmur vezicular prezent bilateral simetric, fără raluri, faringe intens hiperemic, alura ventriculară: 110 bătăi pe minut, zgomote cardiace ritmice, fără sufluri; tensiunea arterială 100/71 mmHg, apetit diminuat, abdomen suplu, depresibil, dureros spontan și la palpare difuz, un scaun semilegat; diureză prezentă, urină tulbure, spumoasă; faringe intens hiperemic; fără semne de iritație meningiană.
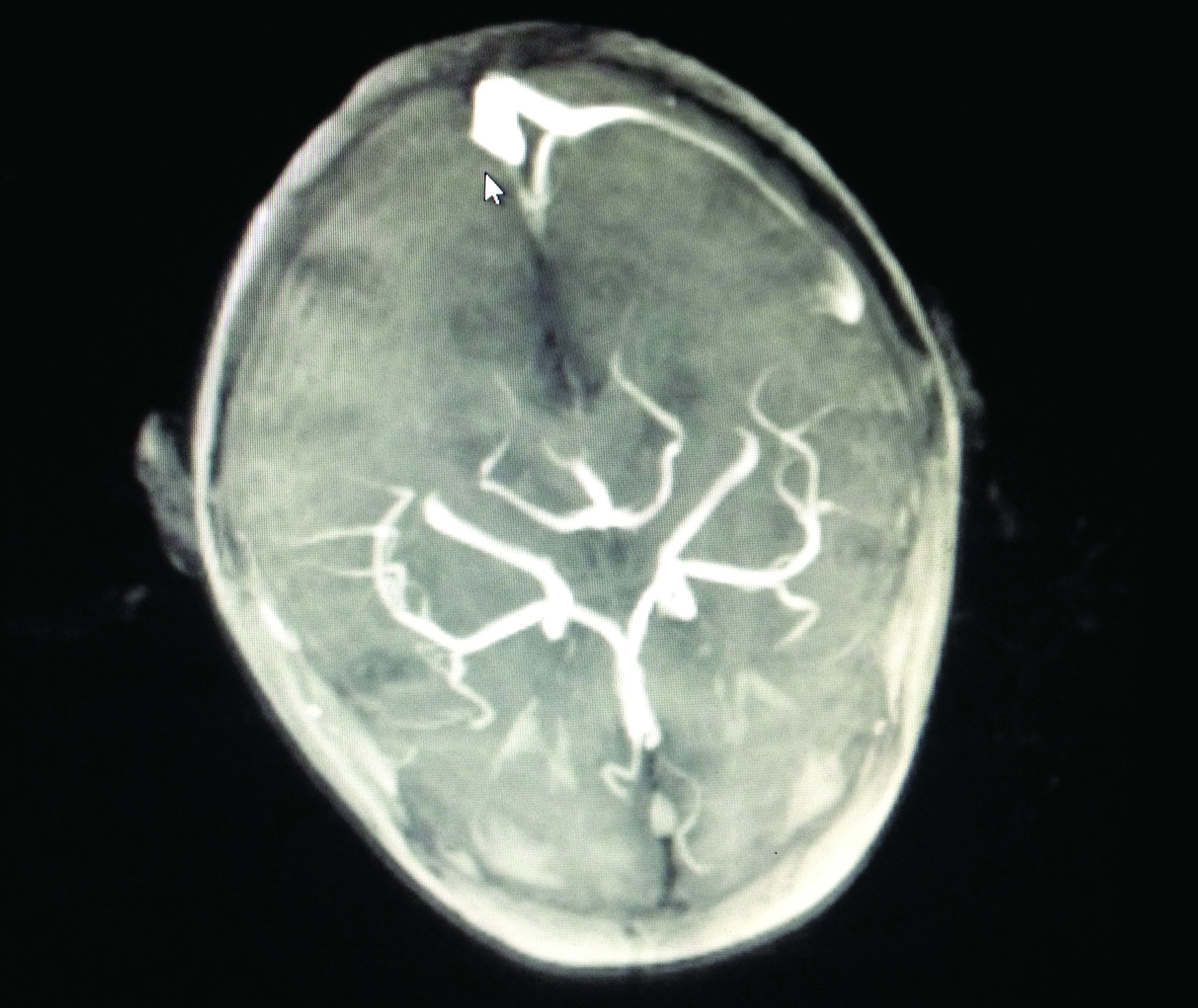
Investigații paraclinice pe parcursul spitalizării, tratament și evoluție
Ziua I: hemograma cu valori normale – 5900 leucocite/mm3, 1000 limfocite/mm3, 4400 granulocite. Biochimie: hipercolesterolemie (481 mg/dl), hiperlipidemie (1290 mg/dl), hipoproteinemie (4 g/dl), hipoalbuminemie 46,83% (VN: 50-66%), hiperalpha‑2‑globuline 20,53% (VN: 5-13%), hipocalcemie (7,4 mg/dl), markeri inflamatori crescuți: VSH (78 mm/h), fibrinogen (760 mg/dl), proteina C reactivă 1,14 mg/dl (VN: 0-1), markeri imunologici: C3, AAN, C4 ușor crescuți (0,09-0,36 g/l). S-a efectuat screening de boli infecțioase – negativ: Ac anti HIV, AgHbs, Ac anti HCV. Analiza urinei/24 de ore a evidențiat proteinurie 294,4 mg/dl. La internare s-a instituit tratament cu ceftriaxonă, care după trei zile a fost suprimat. În primele zile de internare a prezentat refuzul alimentației și lichidelor, necesitând perfuzie endovenoasă de aport și reechilibrare hidroelectrolitică.
În primele două zile de internare s-a menținut febrilă (39 °C), deși se afla sub antitermice, însă ulterior febra s-a remis.
Din ziua a patra de internare s-a introdus în tratament spironolactona în doze progresiv descrescătoare, pornind de la 3,5 mg/kgc/zi, în total șapte zile. Din ziua a cincea de internare s-a început terapia cortizonică, inițial intravenos – metilprednisolon 5 mg/kgc/zi, ulterior primind prednison per os în doză echivalentă până la externare.
Ecografia abdominală efectuată la 48 de ore de la internare a arătat la nivelul rinichiului drept creșterea ecogenității corticalei și atenuarea diferențierii corticomedulare, lamă fină de lichid intersplenorenal și în fundul de sac Douglas. Urmărirea ultrasonografică în dinamică a permis observarea evoluției cantității lichidului intraabdominal care a ascensionat în următoarele zile, dar s-a remis lent.
Ziua a VI-a: hemograma a evidențiat leucopenie – 2200 leucocite/mm3, cu predominanța limfocitelor în formula leucocitară – 1 100/mm3 (50%).
La acel moment, luând în considerare simptomatologia – febră, tuse, rinoree și contextul epidemiologic (ambii părinți cu aceleași simptome) – s-a ridicat suspiciunea unei infecții respiratorii virale, motiv pentru care i s-a recoltat mamei exsudat nazal, s-a efectuat RT-PCR, care a identificat prezența virusului gripal de tip A(H1N1).
Clinic, din ziua a patra de internare, respectiv la trei zile de la inițierea terapiei cortizonice, s-a constatat remiterea progresivă a edemelor.
Ziua a IX-a: hemograma evidențiază normalizarea numărului (5800 leucocite/mm3) și a formulei leucocitare. S-au menținut hipoproteinemia (3,8 g/dl) și hipoalbuminemia – 39,56% (VN: 50-66%).
Ziua a XI-a: hemograma a evidențiat leucocitoză (14 400 leucocite/mm3) și trombocitoză 548 000/mm. S-au menținut hipoproteinemia (4,8 g/dl), dar cu valori în creștere comparativ cu evaluările precedente, hipercolesterolemia (458 mg/dl) și hiperlipidemia (1 422 mg/dl.)
Menționăm că proteinuria a fost în scădere pe parcursul tratamentului și s-a normalizat la o săptămână de la introducerea corticosteroizilor (ziua a XI-a).
Din ziua a X-a de internare a acuzat cefalee frontală intensă, paroxistică, episoade cu durată scurtă și remitere la administrarea de paracetamol per os. Cefaleea s-a însoțit de fotofobie intensă, cu persistența ambelor simptome pe parcursul următoarelor patru zile. Nu a existat altă simptomatologie asociată.
În ziua a XIII-a s-a decis efectuarea de IRM (imagistică prin rezonanță magnetică) cerebral nativ – care a evidențiat flux foarte lent de-a lungul sinusului venos sigmoid și transvers de partea dreaptă sau tromobză – semnal intermediar T1, T2 și FLAIR cu zone centrale de asemnal T2*EG și cu absența fluxului decelabil în secvența TOF. IRM-ul cerebral cu substanță de contrast efectuat după două zile a confirmat existența trombului semnalat pe imaginile native.
Evaluarea hemostazei și a coagulării a arătat un nivel crescut de până la cinci ori al D-dimerilor (2,61 ug/ml, VN<0,5) și modificarea coagulogramei: INR 0,81 (VN: 0,88-1,2), PT 11,33 secunde (VN: 12,1-16,4), AP 63,10 (VN: 81-138%).
Echipa multidisciplinară formată din medici pediatri, medicul neurolog și medicul cardiolog a decis introducerea terapiei anticoagulante cu heparină cu greutate moleculară mică și acenocumarol, continuată până la obținerea unui INR cu valori între 2 și 3, rămânând apoi în tratament numai cu anticoagulantul oral, cu ajustarea dozelor în funcție de INR.
În acel moment s-a impus un bilanț complet de depistare a unei eventuale tulburări de coagulare de fond, pentru stabilirea conduitei terapeutice ulterioare.
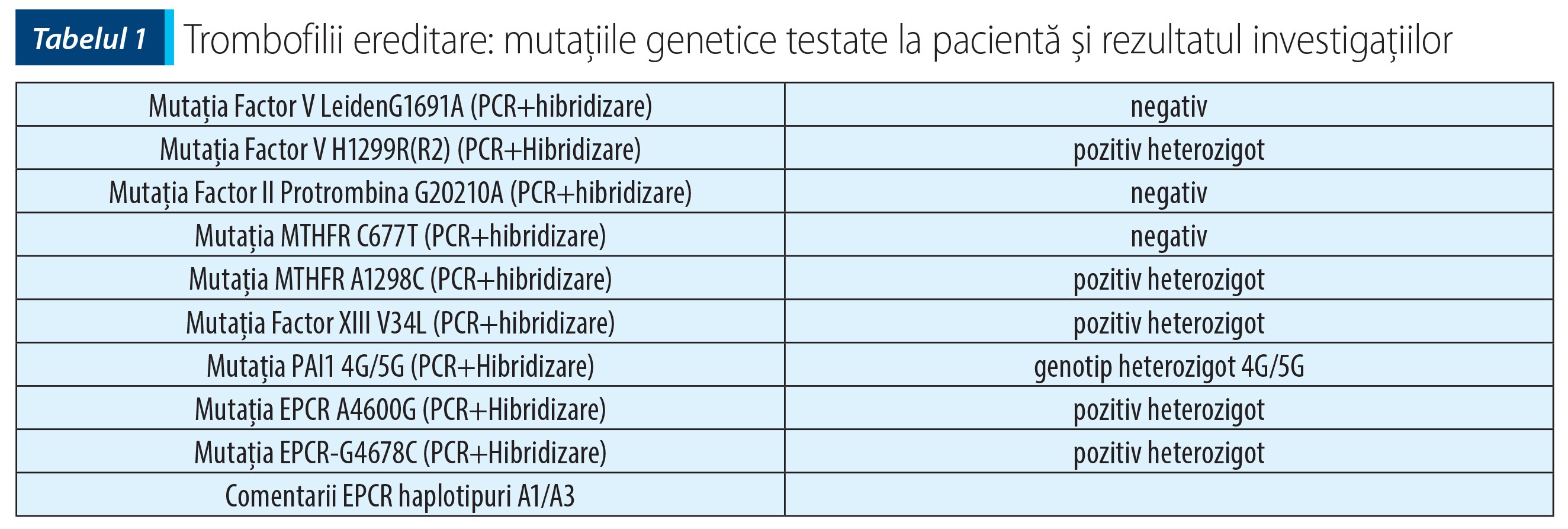
Analiza genetică (PCR și hibridizare) pentru trombofilii ereditare a identificat șase mutații de genotip heterozigot: Factor V H1299R(R2), MTHFR A1298C, Factor XIII V34L, PAI1 4G/5G, EPCR A4600G, EPCR-G4678C – EPCR haplotipuri A1/A3.
Investigații paraclinice ziua a XIX-a – bilanț la externare: hemograma a evidențiat leucocitoză – 24200 celule/mm3 și trombocitoză – 571000 celule/mm3. S-au menținut hipercolesterolemia, dar cu valori în scădere (401 mg/dl) și hiperlipidemia (1126 mg/dl). Proteinele totale s-au normalizat (6,5 g/dl). Evaluarea funcției renale a evidențiat absența proteinuriei.
Pacienta a primit la externare recomandarea de a continua tratamentul cu corticosteroizi per os și anticoagulante per os (acenocumarol), cu monitorizarea INR la 3 zile.
Discuții
Sindromul nefrotic este o glomerulopatie al cărei mecanism etiopatogenic nu este încă deslușit, însă există argumente clinice pentru implicarea limfocitelor T, întrucât SN poate surveni în contextul activării sistemului imun având ca trigger o infecție virală. Virusurile asociate cu dezvoltarea SN sunt: HIV, virusul hepatitei B și virusul hepatitei C. Virusul gripal a fost până în prezent etichetat ca potențial trigger al sindromului Goodpasture, cu recăderi ale SN, insuficiență renală acută, rabdomioliză, sindrom hemolitic uremic, glomerulonefrită acută postinfecțioasă, coagulare intravasculară diseminată, nefrită tubulointerstițială(8).Având în vedere simptomatologia respiratorie prezentată la debut, precum și contextul epidemiologic – ambii părinți cu infecție acută a căilor respiratorii superioare, mama fiind confirmată cu gripă de tip A(H1N1) –, considerăm că SN (grad de suspiciune ridicat) a apărut în cadrul infecției gripale.
Anual, epidemiile de gripă afectează populația pediatrică într-o proporție semnificativă, însă complicațiile gripei sunt frecvent respiratorii. Complicațiile renale ale gripei sezoniere cu influenza de tip A sunt rare și au fost raportate ca serii de câteva cazuri sau cazuri izolate(8).
Sindromul nefrotic indus în acest caz de infecția gripală a predispus la un status procoagulant, conducând astfel la apariția trombozei venoase cerebrale (TVC). Totul s-a dezvoltat pe un fond trombofilic al pacientei, însă necunoscut acesteia sau medicilor la momentul producerii TVC.
TVC este o afecțiune cerebrală vasculară extrem de rară (responsabilă de <1% din accidentele vasculare), fiind denumită foarte plastic drept „marele imitator neurologic“, pentru că tabloul clinic este foarte variabil.
TVC a survenit în cadrul hipercoagulabilității. Starea de hipercoagulabilitate a apărut ca urmare a pierderii urinare de factori anticoagulanți, a alterării sistemului fibronolitic, a trombocitozei și a anomaliilor de activare și agregare plachetară; totodată, o contribuție importantă au avut hipoalbuminemia, hipercolesterolemia și depleția volemică intravasculară iatrogenă cauzată de imobilizare și puncții venoase repetate – acestea fiind relatate în literatură ca factori favorizanți.
În plus, la starea dobândită de hipercoagulabilitate, la cazul prezentat au avut o contribuție majoră defectele genetice cu efect protrombotic, nou diagnosticate în cursul internării: Factor V H1299R(R2), MTHFR A1298C, Factor XIII V34L, PAI1 4G/5G, EPCR A4600G, EPCR-G4678C – EPCR haplotipuri A1/A3.
Factorul V funcționează ca un cofactor în cascada coagulării. Mutațiile genetice îl fac pe acesta rezistent la clivare de către proteina C activată, rămânând astfel activ și crescând rata formării de trombină. Factorul V Leiden este cea mai frecventă tulburare de hipercoagulabilitate. Totuși, pacienta din cazul prezentat nu are mutația pentru factorul V Leiden, ci o altă mutație – haplotip HR2.
Mutația H1299R(R2) în gena factorului V, numită și haplotip HR2, afectează semnificativ riscul de TEV la pacienții cu factor V normal = cei cu absența mutației Arg506Gn, cunoscut ca Factor V Leiden(9). Factorul V HR2 conferă rezistență la Proteina C activată, deși în literatură diferite studii oferă ipoteze discutabile, unii observând efectul HR2 numai în coexistență cu Factorul V Leiden(10,11).
MTHFR are ca rol convertirea homocisteinei la metionină. Mutația A1298C în gena MTHFR reduce activitatea enzimei de convertire, iar în consecință în plasmă se acumulează homocisteina – cunoscută ca factor de risc pentru tromboză și ateroscleroză(12).
Factorul XIII stabilizează cheagul format, catalizând formarea de legături intermoleculare în rețeaua de fibrină. Mutația V34L în gena factorului XIII conferă acestuia un rol protectiv împotriva trombozei venoase, fiind asociată cu un risc scăzut de accident vascular cerebral sau infarct miocardic(13).
PAI-1 este principalul inhibitor al activatorului plasminogenului tisular (tPA) și al urokinazei – ambii fiind activatorii plasminogenului și deci ai fibrinolizei. PAI-1 este produs în mare parte de endoteliu, dar este secretat și de alte țesuturi, precum cel adipos. Polimorfismul 4G/5G al genei PAI-1 poate fi considerat un factor de risc pentru dezvoltarea trombozei venoase, fiind implicat în special în trombozele organelor interne(14). Această variantă genetică conduce la creșterea nivelului de PAI-1, deci la inhibiția fibrinolizei, favorizând construcția rețelei de fibrină.
Polimorfismul genetic al factorilor implicați în căile anticoagulante poate modifica riscul de TEV. Receptorul endotelial al Proteinei C stimulează activarea proteinei C. Forma solubilă a acestui receptor (EPCRs) circulă în plasmă și inhibă atât activarea proteinei C, cât și activitatea anticoagulantă a proteinei C activate (APC) (Haplotypes of EPCR 2004). Purtătorii mutației genetice pentru proteina C, respectiv EPCR 4600G = Haplotip A3, au un risc mai mare de evenimente tromboembolice. Prezența alelei 4600G este asociată cu niveluri crescute ale EPCRs, care leagă atât proteina C, cât și (APC) și blochează astfel activitatea anticoagulantă a APC. Mai mult, Espana et al.(15) au arătat că prezența EPCR Haplotip A3 reduce semnificativ vârsta primului eveniment trombotic și crește probabilitatea de a nu suferi TEV la vârsta de 40 ani. Pe de altă parte, Haplotipul A1 = alela 4678G/C pentru EPCR este asociat cu un nivel moderat crescut de APC, având astfel un efect protectiv în ceea ce privește riscul de TEV.
În cazul prezentat, tromboza venoasă de sinus transvers a apărut pe fondul procoagulant indus de SN, cunoscută ca posibilă asocierea dintre cele două afecțiuni, însă o contribuție majoră au avut-o mutațiile protrombotice ale factorilor implicați în coagulare.
Pacienta a fost diagnosticată cu trombofilie congenitală, având șase mutații genetice în gene care codifică factori participanți la cascada coagulării și, respectiv, la activarea/inhibarea fibrinolizei. Dintre cele șase mutații genetice, două sunt considerate cu efect protectiv și patru sunt protrombotice. Evenimentele trombotice sunt recunoscute drept o sursă majoră de mortalitate și morbiditate.
Deoarece prezentarea clinică are mare variabilitate, iar incidența în populația pediatrică este extrem de mică, diagnosticul de TVC este dificil, iar uneori întârziat sau ratat, crescând astfel și mai mult morbiditatea și mortalitatea.
Privind cazul în ansamblu, deși exista deja un factor favorizant al trombozei venoase, respectiv starea de hipercoagulabilitate indusă de sindromul nefrotic, investigațiile au fost continuate și astfel a fost diagnosticată trombofilia – multiple mutații genetice. Stabilind corect diagnosticul, am reușit să oferim o abordare terapeutică adecvată, evaluând necesarul de anticoagulare și monitorizare pe termen lung.
Concluzii
În plin sezon gripal, infecția gripală cu virusul A(H1N1) a fost asociată cu sindrom nefrotic la un copil nevaccinat.Dincolo de complicația renală indusă de gripă, copilul a suferit o nouă complicație – tromboza venoasă cerebrală, care a fost favorizată de sindromul nefrotic. Iată cum un trigger infecțios a declanșat o cascadă greu de oprit, care putea avea urmări fatale.
Continuarea investigațiilor etiologiei TVC au făcut posibile diagnosticarea pacientei cu trombofilie congenitală, stabilirea conduitei terapeutice și monitorizarea pe termen lung.
Bibliografie
- European Centre for Disease Prevention and Control. Seasonal influenza surveillance report for 2015-2016, October 2016. Stockholm: ECDC; 2016, disponibil la: https://ecdc.europa.eu/en/publications-data/seasonal-influenza-annual-epidemiological-report-2015-2016.
- European Centre for Disease Prevention and Control. Influenza virus characterisation, summary Europe, July 2016. Stockholm: ECDC; 2016; disponibil la: https://ecdc.europa.eu/en/publications-data/influenza-virus-characterisation-summary-europe-july-2016.
- Institutul Național de Sănătate Publică. Raport de monitorizare alerte internaționale Nr 72, săptămâna 06 (08 – 14.02.2016). București: http://www.insp.gov.ro/index.php/informatii-publice.
- Sullivan SJ, Jacobson RM, Dowdle WR, Poland GA. 2009 H1N1 influenza. Mayo Clin Proc 2009 85:64-67.
- Writing Committee of the WHO Consultation on Clinical Aspects of Pandemic (H1N1) 2009 Influenza, Bautista E, Chotpitayasunondh T, et al. Clinical aspects of pandemic 2009 influenza A (H1N1) virus infection. N Engl J Med. 2010;362:1708-1719
- Park SJ, Shin JI. Complications of nephrotic syndrome. Korean J Pediatr. 2011;54(8):322-328.
- Ghedira Besbes L, Haddad S, Gabsi A, et al. Cerebral Sinovenous Thrombosis in a Child with Idiopathic Nephrotic Syndrome. Case Reports in Nephrology. vol. 2011, Article ID 724950, 5 pages.
- Watanabe T. Renal complications of seasonal and pandemic influenza A virus infection. Eur J Pediatr. 2013;172:15.
- Otrock ZK, Taher AT, Shamseddeen WA et al. Factor V HR2 haplotype: a risk factor for venous thromboembolism in individuals with absence of Factor V Leiden. Ann Hematol. 2008;87:1013.
- Alhenc-Gelas M, Nicaud V, Gandrille S, et al. The factor V gene A4070G mutation and the risk of venous thrombosis. Thromb Haemost 1999; 81:193-197.
- Faioni EM, Franchi F, Bucciarelli P, et al. Coinheritance of the HR2 haplotype in the factor V gene confers an increased risk of venous thromboembolism to carriers of factor V R506Q (factor V Leiden). Blood 1999 94:3062–3066.
- Hanson NQ, Aras O, Yang F, Tsai MY. C677T and A1298C polymorphisms of the methylenetetrahydrofolate reductase gene: incidence and effect of combined genotypes on plasma fasting and post-methionine load homocysteine in vascular disease. Clin Chem. 2001;47:661-6.
- Trumbo TA, Maurer MC. Examining thrombin hydrolysis of the factor XIII activation peptide segment leads to a proposal for explaining the cardioprotective effects observed with the factor XIII V34L mutation. J Biol Chem. 2000 275(27):20627-20631.
- Balta G, Altay C, Gurgey A. PAI-1 gene 4G/5G genotype: a risk factor for thrombosis in vessels of internal organs. Am J Hematol. 2000ș71(2):89-93.
- Navarro S, Medina P, Mira Y, et al. Haplotypes of the EPCR gene, prothrombin levels, and the risk of venous thrombosis in carriers of the prothrombin G20210A mutation. Haematologica. 2008;93(6):885-891.
Articole din ediţiile anterioare
Date privind prevenirea și controlul gripei la debutul unui nou sezon
Infecțiile acute ale căilor respiratorii sunt cauzate, de obicei, de virusuri, mai rar de bacterii, fiind diagnosticate mai frecvent la copii(1). A...
Conştientizarea existenţei unei protecţii locale antigripale şi cunoaşterea conceptului de „imunizare în masă“ pot modifica dorinţa populaţiei de a se vaccina?
Vaccinarea îi protejează în mod direct pe cetăţeni prin inducerea unui răspuns imun, dar protejează şi comunităţile în mod indirect, prin reducerea...
Calea spre un vaccin antigripal universal
Modificări ale cerinţelor de vaccinare antigripală pentru personalul medical din SUA
Anual, gripa este responsabilă de o morbiditate şi mortalitate îngrijorătoare. Vaccinarea anuală este recomandată întregului personal medical, pent...