Implant rupture is a possible complication after breast augmentation with implants, but silicone lymphadenopathy is relatively rare presented in the literature. We present a case of painful left axillary silicone adenopathy following an implant rupture diagnosed 10 years after breast augmentation with silicone implants. A 41-year-old pacient had a breast augmentation performed in June 2008. She suffered a domestic trauma in late 2017 and was asymptomatic until September 2018, when she accused left axillary pain. A mammary echography revealed an implant rupture with suspicion of silicon extrusion because of axillary cellulitis. The intraoperative findings revealed a nodular-fibrotic capsule that was excised together with two axillary nodules and the ruptured implant. The postoperative evolution was uneventful.
Adenopatie axilară dureroasă după ruptura implantului mamar – studiu de caz şi al literaturii de specialitate
Painful axillary adenopathy after breast implant rupture – case presentation and literature review
First published: 16 octombrie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Med.137.5.2020.3869
Abstract
Rezumat
Ruptura implantului este o complicaţie posibilă după augmentarea mamară cu implanturi, dar adenopatia cu silicon este rar raportată în literatură. Prezentăm cazul unei adenopatii siliconice axilare stângi după ruptura implantului, diagnosticată la 10 ani după augmentarea mamară cu proteze siliconice. Pacienta, în vârstă de 41 de ani, a beneficiat de o augmentare mamară în iunie 2008. Ea a suferit un traumatism casnic în anul 2017, fiind asimptomatică până în septembrie 2018, când a început să acuze dureri la nivelul axilei stângi. Ecografia mamară a identificat ruptura implantului, cu suspiciunea de extravazare a siliconului din cauza prezenţei celulitei axilare. Intraoperatoriu a fost descoperită o capsulă fibronodulară, care a fost excizată împreună cu doi ganglioni axilari şi cu implantul rupt. Aspectul histologic a confirmat adenopatia siliconică, iar evoluţia postoperatorie a fost lipsită de complicaţii.
Introducere
În ultimii ani se observă şi la noi în ţară o cerere crescută pentru intervenţiile chirurgicale estetice, dintre care cel mai des solicitată este augmentarea mamară cu implanturi siliconice. Acestea oferă satisfacţii pacientelor, dar sunt şi sursa unor rare complicaţii locale şi generale, printre care infecţiile, ruptura implantului, contractura capsulară şi uneori neoplaziile (cele mai de temut). Prezentăm cazul unei femei tinere care a constatat prezenţa unei adenopatii axilare dureroase la 10 ani după o augmentare mamară.
Prezentarea cazului
Anamneza. O pacientă în vârstă de 41 de ani, fără antecedente personale patologice, se adresează Unităţii de chirurgie estetică în luna octombrie a anului 2018, acuzând dureri la nivelul axilei stângi. Din anamneză reţinem că pacienta a beneficiat de o augmentare mamară cu implanturi siliconice în urmă cu 10 ani (iunie 2008). În decursul anului 2017 a suferit un traumatism prin cădere de la acelaşi nivel, după care a acuzat timp de câteva zile dureri moderate la nivelul sânului stâng. Evoluţia ulterioară a fost asimptomatică, până în septembrie 2018, când se adresează iniţial unui serviciu de urgenţă, acuzând dureri la nivelul axilei stângi. Examinarea clinică şi ecografică evidenţiază prezenţa unei adenopatii axilare de 3,2/2,7 cm şi, în absenţa semnelor locale sau generale de infecţie (leucocite 4,54/103/mm3), se recomandă continuarea investigaţiilor.
Examenul clinic local (figura 1) – inspecţie: torace asimetric, cu scolioză dextroconvexă. Asimetrie mamară şi ptoză de gradul II, glandele având volume diferite, mai evident la nivelul polului superior stâng, al cărui volum este mai redus decât al sânului contralateral. Deviere spre stânga a sânului şi complexului areolo-mamelonar stâng; mamelonul stâng este situat cu aproximativ 2 cm inferior faţă de cel drept. Cicatrice chirurgicale inframamare bilaterale vindecate, de aspect normal.
Palpare. Fără modificări patologice evidenţiate la nivelul sânului şi axilei drepte; sânul stâng prezintă sensibilitate moderată şi o consistenţă crescută în cadranul supero-extern (CSE), în prelungirea axilară, precum şi în axila stângă. Consistenţa şi integritatea implantului par să fie compromise; acesta este palpabil într-o poziţie inferioară faţă de cel contralateral. Pe peretele lateral al axilei stângi sunt palpabile cel puţin două formaţiuni ovalare, de 3,5/2,5 cm şi 1/0,7 cm, de consistenţă elastică, moderat sensibile la palpare, mobile pe planul profund şi cel superficial.
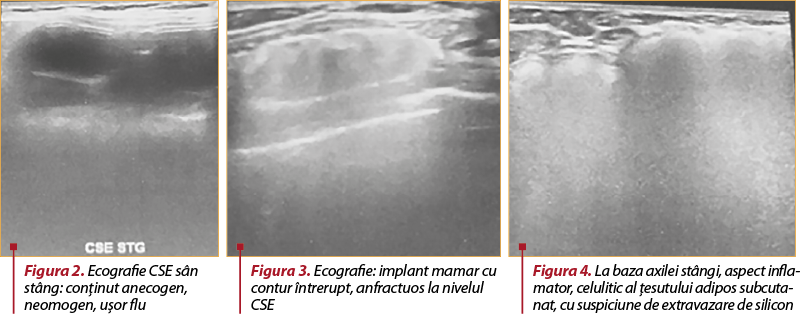
Examenul ecografic. Implant mamar cu contur întrerupt, anfractuos la nivelul CSE (figura 2); conţinut anecogen, neomogen, uşor flu în CSE (figura 3). Tegumente indemne, grosime normală; ţesut adipos subcutanat pre- şi retroglandular normal reprezentat. Ţesut fibroglandular cu mobilitate prezentă faţă de planurile tisulare adiacente. Fără formaţiuni înlocuitoare de spaţiu vizibile ecografic, fără ectazii ductale semnificative. La baza axilei stângi, aspect inflamator, celulitic, al ţesutului adipos subcutanat, cu suspiciune de extravazare de silicon (figura 4).
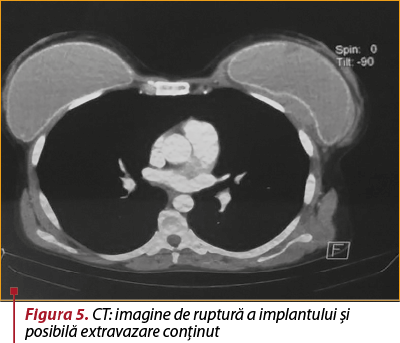
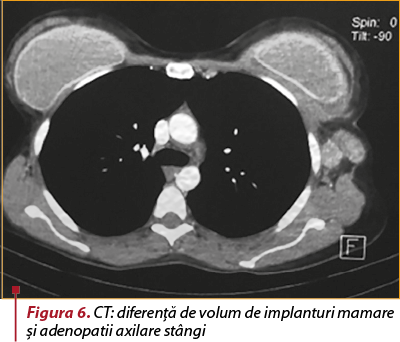
Examenul CT. Status postintervenţional cu proteze mamare prezente bilateral. Se remarcă un contur neregulat întrerupt al capsulei externe a implantului mamar stâng (figura 5), cu acumulare lichidiană periprotetică de maximum 9 mm, fără a se evidenţia iodofilii focale sau difuze suspecte în ţesutul mamar adiacent. Conglomerat de mase adenopatice voluminoase ovalare, omogene, net delimitate, cu dimensiuni cuprinse între 11/7 mm şi 36/25 mm, posibil substrat inflamator (figura 6). Fine benzi aderenţiale fibrotice în segmentul Foler, fără acumulări lichidiene pleurale sau pericardice, fără adenopatii mediastinale sau hilare, axe vasculare mediastinale permeabile, fără modificări de calibru, fără dilataţii ale arborelui bronşic. Densificarea grăsimii din loja timică. Fără leziuni osoase suspecte în segmentul scanat. Concluzii. Ruptură capsulară a implantului mamar stâng, cu acumulare lichidiană periprotetică şi conglomerate de mase adenopatice axilare stângi, probabil reactive.
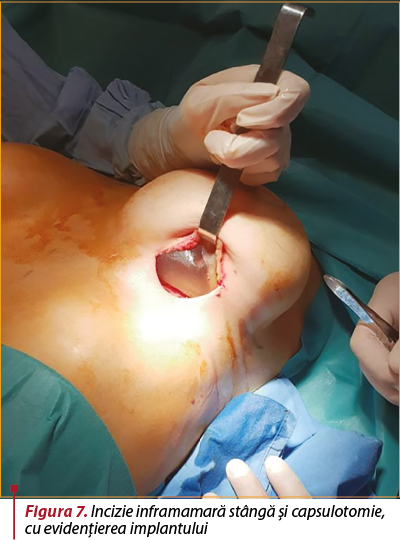
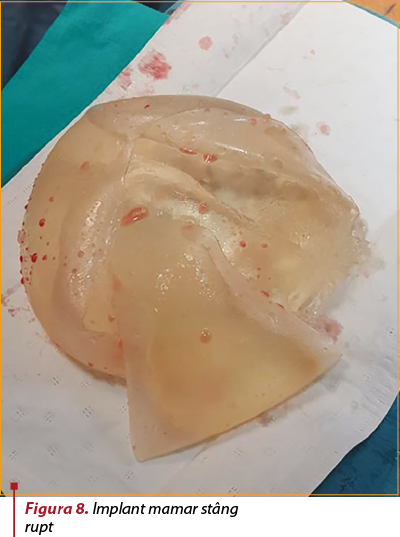
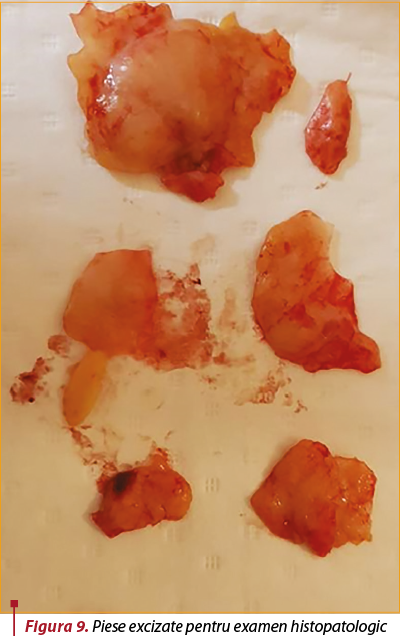
Intervenţie chirurgicală. Se intervine chirurgical, în anestezie generală cu IOT şi se practică incizie în şanţul inframamar stâng (figura 7). Disecţie, capsulotomie, extracţie de implant mamar, care prezintă două soluţii de continuare radiale (figura 8), cu extravazarea parţială a gelului siliconic. Capsulectomie parţială. Lavaj. Incizie axilară stângă de 5 cm, prin care sunt excizaţi doi ganglioni, trimişi pentru examen histopatologic, împreună cu fragmente din capsula excizată (figura 9). Lavaj abundent. Inserţie de implant mamar stâng, urmată de mastopexie periareolară. Închiderea plăgii în straturi anatomice. Aplicare de steristrip. Pansament.
N.B. La nivelul sânului drept se practică: incizie inframamară, capsulotomie, extracţie de implant şi înlocuirea acestuia, mastopexie periareolară, urmată de sutura în straturi anatomice.
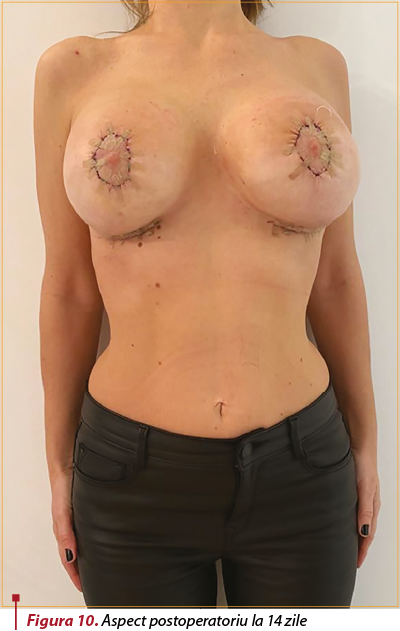
Evoluţie postoperatorie imediată favorabilă.
Examen histopatologic. Limfoganglion şi capsulă de implant cu numeroase macrofage cu citoplasma spumoasă, spaţii optic vide. Fără elemente neoplazice. Concluzie: aspecte histopatologice cu date clinice (ruptură de implant mamar) care susţin diagnosticul de reacţie granulomatoasă la silicon.
Discuţie
Drenajul limfatic al sânului către staţiile axilare şi extraaxilare. Din reţeaua dermică, pe căi paralele cu venele, limfa ajunge în ganglionii regionali: cei axilari (20-40 de noduli) primesc mai mult de 75% din limfa sânului; alte direcţii sunt direct la ganglionii pectorali, la nodulii subcaspulari sau către ganglionii interpectorali sau infraclaviculari (inconstant). Părţile mediale şi laterale ale sânului drenează către ganglionii parasternali. Căile limfatice de-a lungul liniei mediane pot drena limfa către axila contralaterală. Deoarece nu sunt prezente valve la nivelul limfaticelor, blocarea căilor prin celule tumorale sau inflamatorii poate duce la inversarea fluxului limfatic(1).
De la injectarea intramamară de silicon şi utilizarea protezelor umplute cu ser fiziologic, implanturile mamare au evoluat semnificativ. De la primele generaţii cu înveliş gros şi silicon vâscos, cu o rată mică de ruptură, dar cu contractură capsulară şi calcificări la aproape toate cazurile, generaţiile de azi au un înveliş texturat sau neted mai gros decăt generaţiile intermediare şi conţin gel siliconic coeziv, cu rate mici de difuziune(2). Se consideră că până la 50% dintre implanturile mai vechi de 10 ani prezintă extravazări de silicon, de obicei fără simptome, şi de aceea nu este necesar screeningul RMN(3).
În 2019, în Statele Unite ale Americii au fost efectuate 299.715 augmentări mamare (în scădere cu 4% faţă de 2018), implanturile fiind mai ales siliconice, 85% (15% saline). În acelaşi an, au trebuit îndepărtate 33.764 de implanturi (cu 15% mai mult decât în anul precedent)(4). Atât producătorii, cât şi medicii avertizează de obicei pacientele că implanturile mamare sunt semipermanente. Conform FDA (Food and Drug Administration – SUA), acestea au o durată de viaţă limitată. Implantul mamar îşi păstrează integritatea mecanică timp de decenii în interiorul organismului, deşi incidenţa rupturii creşte cu timpul(5).
Rupturile implantului. Implanturile pot fi sursa unor complicaţii, dintre care amintim: ruperea implantului, contractura capsulară şi dificultăţile în efectuarea screeningului pentru cancer. Mecanismele care pot explica ruptura implantului sunt: leziuni instrumentale intraoperatorii, cudarea sau tumefierea învelişului exterior, manevrele de tipul capsulotomiei închise, precum şi traumatismele la nivelul toracelui sau sânului. Însă ruperea implantului pare să fie mai ales un proces multifactorial(2).
Incidenţa rupturii implanturilor mamare în literatură variază semnificativ în funcţie de tipul de implant, producători şi de metoda de evaluare a pacientelor. Prevalenţa rupturii implanturilor siliconice poate fi de peste 55%, cu 22% din cazuri prezentând diseminarea extracapsulară a siliconului(6). Reacţia organismului la orice corp străin este reprezentată de formarea unei capsule fibroase în jurul acestuia, care păstrează de obicei siliconul din implanturile mamare pe loc, chiar după ruperea învelişului(3). Rupturile pot fi intra- sau extracapsulare. În ruptura intracapsulară, deşi învelişul este rupt, siliconul rămâne în interiorul capsulei; în cea extracapsulară, are loc extravazarea macroscopică a siliconului în afara acesteia. Siliconul poate ajunge în ganglionii regionali sau la distanţă, fiind descrise depozite siliconice în ganglionii axilari, ai arterei mamare interne, mediastinali, dar şi în ficat şi splină.
Diagnostic pozitiv şi diferenţial. Pentru detectarea complicaţiilor precoce după augmentarea mamară, examenul clinic periodic este indispensabil. Atunci când sunt prezente, simptomele rupturii implantului mamar includ dureri locale, asimetrie, aspect cudat, fibrozarea şi rareori infecţia. Multe rupturi sunt însă asimptomatice, iar examinarea clinică nu este suficient de sensibilă pentru a detecta ruptura implantului, mai ales dacă nu există contractură capsulară(7). Evaluarea postoperatorie a sânilor cu implanturi mamare necesită parcurgerea unor etape diagnostice, începând cu ecografia mamară, tomografia computerizată (cu variante) şi RMN-ul.
Examinarea ultrasonografică/ecografia. Este investigaţia iniţială preferată, fiind neinvazivă, repetabilă şi uşor de efectuat, dar este operator-dependentă. Permite evaluarea morfologiei, conturului, conţinutului sânului, ţesuturilor perimamare şi ale axilei. Pot fi vizualizate pliurile radiale ale învelişului, omogenitatea lumenului implantului şi semne ale prezenţei siliconului liber sau ale granuloamelor siliconice(8). Aspectul ecografic al implanturilor, atât saline, cât şi siliconice, este similar: acestea apar anecogene, înconjurate de un înveliş liniar ecogen. Semnul caracteristic al rupturii intracapsulare este „stepladder” = scara, cu multiple linii reflectorizante curbe în interiorul implantului, corespunzătoare învelişului turtit. Siliconul din ţesutul mamar şi nodulii axilari dau aspectul tipic de „snowstorm” = furtună de zăpadă, cu umbrire posterioară(6), care poate fi vizualizat, şi prezenţa siliconului la nivelul ficatului sau a splinei(9). De reţinut că ecografia singură nu este suficientă pentru screeningul cancerului de sân la femeile cu implanturi mamare(10).
Rezonanţa magnetică nucleară (RMN) reprezintă cea mai precisă metodă de evaluare în investigarea patologiei implantelor mamare, fiind modalitatea imagistică de elecţie pentru a descoperi şi evalua o ruptură nedepistată clinic(3,6,7,10). În absenţa simptomelor, RMN-ul nu trebuie efectuat pentru screeningul integrităţii implanturilor; dar în cazul suspiciunii de ruptură, reprezintă cea mai bună tehnică pentru a depista extravazarea siliconului(3). Food and Drug Administration, autoritatea competentă din Statele Unite, recomandă un screening primar RMN la 3 ani după inserţia implantului şi la fiecare 2 ani următori pentru a detecta ruptura protezei(11). În cadrul acestei examinări, menţionăm imposibilitatea de a caracteriza calcificările vizualizate, fapt ce poate necesita utilizarea unei metode suplimentare de evaluare, respectiv costurile ridicate şi unele contraindicaţii (prezenţa pacemakerului, metalelor sau claustrofobia)(10). Pe de altă parte, prezenţa implanturilor nu afectează sensibilitatea rezonanţei magnetice pentru detectarea cancerului mamar(3).
Tomografia computerizată (CT) poate identifica semnul „linguine” specific turtirii, respectiv ruperii învelişului implantului(6,12), dar are dezavantajul iradierii pacientei, având un număr limitat de utilizări anuale, spre deosebire de ecografie, care poate fi repetată de câte ori e nevoie. Persoanele care nu pot efectua RMN din diferite motive pot apela la examinări CT speciale. Dual-energy CT (DECT) poate oferi informaţii asupra compoziţiei materialelor, identificând ruptura intracapsulară şi seromul, precum şi siliconul extracapsular, având rezultate similare cu RMN-ul(6,12). Tomografia computerizată spirală a sânului cu detector de fotoni combină avantajele mamografiei (în detectarea calcificărilor) şi ale RMN-ului (pentru evaluarea integrităţii implantului) – fără nevoia de compresie sau substanţă de contrast, fiind preferată de unele paciente (84,7%) din motive personale sau din cauza mastodiniei(13). Tomografia computerizată cu emisie pozitronică (PET-CT) poate fi utilizată pentru a depista activitatea hipermetabolică multifocală din jurul sau asociată cu implanturile mamare (creşterea absorţiei de 18F-FDG – 18-fluorine fluoro-deoxy-glucose – în regiunile cu inflamaţie indusă de silicon). Interpretarea necesită precauţie, absorbţia crescută putând reprezenta atât o neoplazie, cât şi o inflamaţie granulomatoasă benignă. Odată ce sunt identificate focare de absorbţie crescută la PET-CT, trebuie efectuate biopsia şi analiza histopatologică pentru corelarea acestora cu aspectele imagistice şi pentru stabilirea diagnosticului de certitudine(7).
Mamografia în 4 incidenţe reprezintă standardul de referinţă pentru screeningul în cancerul mamar în conformitate cu recomandările Societăţii Americane pentru Cancer (American Cancer Society = ACS)(14). În prezenţa implanturilor mamare sunt necesare doze mai mari de radiaţii şi pacienta poate acuza disconfort cauzat de compresie. Mamografia nu poate detecta rupturile intracapsulare (cele mai frecvente), ruptura extracapsulară putând fi recunoscută ca o densitate crescută în ţesutul mamar. În cazuri foarte rare, presiunea mecanică din timpul mamografiei poate duce la ruperea implantului(10).
Adenopatiile siliconice. Majoritatea rupturilor de implant mamar nu se manifestă clinic şi sunt denumite „silenţioase”. Suspectarea lor se face pe baza simptomelor pacientei, cum ar fi: schimbările de formă, mărime sau consistenţă ale sânului, contractura capsulară, dureri locale sau formaţiuni palpabile la nivelul sânului sau în axilă. Reacţia inflamatorie produsă de extravazarea siliconului din rupturile extracapsulare se manifestă de obicei prin prezenţa de adenopatii. Adenopatia axilară este cea mai frecventă constatare, explicată prin specificitatea drenajului limfatic al sânului, dar au fost descrise şi adenopatii ale lanţului mamar intern(7), la nivel cervical(15,16), supraclavicular(17) sau mediastinal(18,19). Au fost descrise chiar şi aspecte sugestive ale prezenţei siliconului în ficat sau splină(9).
După identificarea unei adenopatii la palpare sau prin investigaţii imagistice, diagnosticul diferenţial include: granuloamele de silicon, metastazele, recidiva neoplaziei (mai ales atunci când implantul a fost folosit pentru reconstrucţia după mastectomie), cancerul de novo – inclusiv limfatic. Aspectul imagistic nu permite, de cele mai multe ori, diferenţierea caracterului benign de cel malign şi de aceea un diagnostic corect este cel realizat prin biopsie chirurgicală, urmată de examen histopatologic, prin colorare cu hematoxilină-eozină sau imunofluorescenţă.
Un alt aspect important la persoanele cu implant mamar (cu sau fără adenopatii asociate) este posibilitatea apariţiei limfomului cu celule anaplastice BIA-ALCL (breast implant associated-anaplastic large cell lymphoma), manifestat prin tumefiere persistentă şi prezenţa unei tumori sau a durerilor la nivelul implantului, apărute la ani de la realizarea augmentării mamare. La evaluarea clinică şi imagistică pot fi observate: colecţie lichidiană (serom), formaţiune tumorală sau indurarea (contractura capsulară) în jurul implantului. Evaluarea citologică a fluidului sau tumorii prin frotiu colorat cu Wright-Giemsa, imunohistochimie sau citometrie trebuie să urmărească CD30 şi markerii pentru ALK (anaplastic lymphoma kinase)(20).
Tratament
Deşi relativ rară, odată diagnosticată, ruptura implantului necesită tratament chirurgical cât mai rapid. Trebuie efectuată îndepărtarea implantului rupt pentru a preveni complicaţiile ulterioare ale migrării siliconului(7), care poate ajunge până în ficat şi splină(9) sau poate produce afectări pulmonare(21-24). Prezenţa unei adenopatii suspecte la o pacientă cu implanturi mamare, care nu se reduce în decurs de o lună, necesită investigaţii imagistice, începând cu ecografia – mamară şi axilară – în căutarea unei rupturi a implantului, şi continuând cu RMN-ul sau PET-CT („silicone sensitive MRI or PET-CT”) pentru a identifica sursa acesteia(9).
Concluzii
Medicul de familie, prin realizarea atentă a anamnezei, efectuarea examenului clinic local şi prin recomandarea investigaţiilor imagistice (ecografie, rezonanţă magnetică nucleară), are un rol deosebit de important în identificarea pacientelor cu suspiciune de ruptură a implantului sau cu alte patologii asociate acestuia.
Ecografia mamară şi axilară reprezintă primele metode paraclinice de diagnostic imagistic utilizate şi sunt coroborate, dacă este cazul, cu examinarea RMN, considerată în literatura de specialitate cea mai bună metodă de confirmare a rupturii implantului mamar.
După stabilirea diagnosticului de ruptură a implantului, pacienta va fi trimisă de medicul de familie către chirurgul specialist de chirurgie plastică, estetică şi microchirurgie reconstructivă, în vederea tratamentului de specialitate, şi anume îndepărtarea implantului, pentru a preveni complicaţiile migrării siliconului.
În prezenţa adenopatiilor sau a altor tumori în vecinătatea implantului, examinarea histopatologică este esenţială pentru un diagnostic definitiv şi pentru a exclude o neoplazie sau o adenopatie metastatică.
În cazul pacientelor care doresc sau necesită intervenţii chirurgicale de augmentare mamară cu implanturi siliconice, permanenta comunicare între medicul de familie şi chirurgul de chirurgie estetică şi plastică, atât înaintea intervenţiei chirurgicale, cât şi pentru dispensarizarea postoperatorie, este o necesitate şi reprezintă cheia pentru obţinerea unei evoluţii pozitive, respectiv pentru prevenirea şi tratamentul posibilelor complicaţii.
Bibliografie
-
Gatzoulis MA, Gui GPH, Johnson MR, Tsiridis E. Chest wall and breast. In: Grays Anatomy/The Anatomical Basis of Clinical Practice. Elsevier, 2008, pp. 915-939.
-
Hillard C, Fowler JD, Barta R, Cunningham B. Silicone breast implant rupture: a review. Gland Surg. 2017;6(2):163-168.
-
Mann RM, Balleyguier C, Baltzer PA, Bick U, Colin C, Cornford E, et al., European Society of Breast Imaging (EUSOBI). Breast MRI: EUSOBI recommendations for women’s information. Eur Radiol. 2015 Dec;25(12):3669–78.
-
ASPS Plastic Surgery Statistics Report 2019. Available at: https://www. plasticsurgery.org/documents/News/Statistics/2019/plastic-surgery-statistics-fullreport-2019.pdf. Accesed: 17/09/2020.
-
Zingaretti N, Rampino Cordaro E, Parodi PC, Marega G, Modolo F, Moreschi C, Da Broi U. Determinants of surgeon choice in cases of suspected implant rupture following mastectomy or aesthetic breast surgery. Clinical implications. Medicine. 2020 Jul 2; 99(27):e21134.
-
Glazebrook KN, Leng S, Jacobson SR, McCollough CM. Dual-Energy CT for Evaluation of Intra- and Extracapsular Silicone Implant Rupture. Case Reports in Radiology. 2016;2016:6323709.
-
Manzil FFP, Bhambhvani PG. 18F-FDG PET/CT Unveiling of Implant Rupture and Clinically Unsuspected Silicone Granuloma in Treated Breast Cancer. Journal of Nuclear Medicine Technology. 2018 Dec;46(4):394-5.
-
Shah AT, Jankharia BB. Imaging of common breast implants and implant-related complications: A pictorial essay. Indian J Radiol Imaging. 2016 Apr-Jun; 26(2):216-225.
-
Samreen N, Glazebrook KN, Bhatt A, Venkatesh SK, McMenomy BP, Chandra A, Leng S, Adler KE, McCollough CH. Imaging findings of mammary and systemic silicone deposition secondary to breast implants. Br J Radiol. 2018 Sep;91(1089):20180098.
-
Ruby L, Shim S, Berger N, Marcon M, Frauenfelder T, Boss A. Diagnostic value of a spiral breast computed tomography system equipped with photon counting detector technology in patients with implants: An observational study of our initial experiences. Medicine(Baltimore). 2020 Jul 24; 99 (30):e20797.
-
FDA. FDA update on the safety of silicone gel-filled breast implants. Disponibil pe https://www.fda.gov/medical-devices/breast-implants/update-safety-silicone-gel-filled-breast-implants-2011-executive-summary, content current as of 07/16/2018, accesat în 17/09/2020.
-
Glazebrook KN, Doerge S, Leng S, Drees TA, Hunt KN, Zingula SN, Pruthi S, Geske JR, Carter RE, McCollough CH, Fletcher JG. Ability of Dual-Energy CT to Detect Silicone Gel Breast Implant Rupture and Nodal Silicone Spread. AJR Am J Roentgenol. 2019 Apr;212(4):933-942.
-
Berger N, Marcon M, Frauenfelder T, Boss A. Dedicated spiral breast computed tomography with a single photon-counting detector: initial results of the first 300 women. Invest Radiol. 2020;55:68–72.
-
ACS. American Cancer Society Breast Cancer Screening Guideline Disponibil pe https://www.cancer.org/health-care-professionals/american-cancer-society-prevention-early-detection-guidelines/breast-cancer-screening-guidelines.html. Publicat 2019. Accesat 17/09/2020.
-
Gilbert LK, Thiruchelvam J. Cervical silicone lymphadenopathy. Br J Oral Maxillofac Surg. 2016 Jul;54(6):e52-4.
-
Borghol K, Gallagher G, Skelly BL. Silicone granuloma from ruptured breast implants as a cause of cervical lymphadenopathy. Ann R Coll Surg Engl. 2016 Sep;98(7):e118-20.
-
Shipchandler TZ, Lorenz RR, McMahon J, Tubbs R. Supraclavicular lymphadenopathy due to silicone breast implants. Arch Otolaryngol Head Neck Surg. 2007 Aug;133(8):830-2.
-
Maricevich M, Grams J, Aleff PA, Inwards C, Jacobson SR. Mediastinal silicone lymphadenopathy secondary to a ruptured breast implant. Breast J. 2011 Nov-Dec;17(6):674-5.
-
Moraitis SD, Agrafiotis AC, Kapranou A, Kanakakis K. Mediastinal silicone lymphadenopathy revealed after thymectomy for autoimmune myasthenia gravis. Monaldi Arch Chest Dis. 2018 May 28;88(1):912.
-
FDA, Questions and Answers about Breast Implant - Associated Anaplastic Large Cell Lymphoma (BIA-ALCL). https://www.fda.gov/medical-devices/breast-implants/questions-and-answers-about-breast-implant-associated-anaplastic-large-cell-lymphoma-bia-alcl accesat in 20/09/2020.
-
García Hernández MJ, López Milena G, Ruiz Carazo E. Subacute silicone pneumonitis after silent rupture of breast implant. Arch Bronconeumol. 2016 Jul;52(7):397-8. doi: 10.1016/j.arbres.2015.10.009. Epub 2015 Dec 23.PMID: 26706995.
-
Paredes Vila S, Gonzalez Barcala FJ, Suarez Antelo J, Moldes Rodriguez M, Abdulkader Nallib I, Valdes Cuadrado L. Pneumonitis caused by silicone gel following breast implant rupture. Ir J Med Sci. 2010 Mar;179(1):141-5.
-
Azeem A, Khuwaja S, Parthvi R, Persaud T. Pulmonary fibrosis and embolism secondary to silicon implant leak. BMJ Case Rep. 2019 Jun 14;12(6):e229470.
-
Karnatovskaia LV, Khoor A, Johnson MM, Kaplan J. A 60-year-old woman with PET scan-avid lung nodules and a history of a ruptured silicone breast implant. Chest. 2014 Oct;146(4):e138-e142.