Chronic obstructive pulmonary disease (COPD) is a significant cause of mortality and morbidity, whose economy and society effects are growing. WHO expected that by 2020 COPD will become the third cause of mortality overall, at present, being responsible for more than three million annual deaths and 40% of the addressability in pneumology(1). The natural evolution of COPD is highlighted by frequent exacerbations which causes significant implications on short and long terms in patients, as well as in the health system. Currently, COPD is detected in a satisfactory extent, and most cases are diagnosed in late stages, when treatment options are limited. A correct and early diagnosis of COPD, followed by appropriate treatment, together with the definitive renunciation of smoking is the ideal management of this pathology.
BPOC: 5 etape importante în diagnostic și tratament
COPD: 5 important steps in diagnosis and treatment
First published: 07 martie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Boala pulmonară cronică obstructivă (BPOC) este o cauză importantă de mortalitate și morbiditate, ale cărei efecte economice și sociale sunt în continuă creștere. OMS preconizează că, până în 2020, BPOC va deveni a treia cauză de mortalitate globală, în prezent aceasta fiind răspunzătoare de peste trei milioane de decese anuale și de 40% din adresabilitatea către pnemologie(1). Evoluția naturală a BPOC este punctată de exacerbări frecvente care determină implicații semnificative pe termen lung și scurt atât asupra pacientului, cât și a sistemului de sănătate. În prezent, BPOC nu este depistată într-o măsură satisfăcătoare, iar majoritatea cazurilor sunt diagnosticate în stadii tardive, când opțiunile terapeutice sunt limitate. Un diagnostic corect și precoce al BPOC, urmat de un tratament adecvat, împreună cu renunțarea definitivă la fumat reprezintă managementul ideal în această patologie.
Boala pulmonară obstructivă cronică (BPOC) se caracterizează prin limitarea persistentă și progresivă a fluxului de aer, printr-un răspuns inflamator cronic la particulele nocive sau gaze. Prevalența patologiei este în directă legătură cu fumatul și poluarea aerului, astfel că odată cu creșterea ratei fumătorilor se preconizează și o creștere a BPOC, în special la femei și în țările în curs de dezvoltare(16). BPOC este și va fi o provocare de sănătate la nivel mondial în următoarele decenii, pacienții având un risc crescut de moarte prematură(2) atât prin boala în sine, cât și din cauza comorbidităților, ca diabetul zaharat, bolile cardiovsaculare sau depresia, ce adaugă o încărcătură negativă patologiei(17).
Date recente care prezintă heterogenitatea în ceea ce privește rata de declin a funcției pulmonare ne arată că BPOC este o patologie deosebit de complexă, iar tratamentul bronhodilatator precoce, de lungă durată, are potențialul de a încetini rata declinului funcției pulmonare și de a scădea frecvența exacerbărilor. Astfel, țintele în BPOC nu sunt limitate doar la controlul simptomelor, al exacerbărilor și menținerea calității vieții, iar scăderea progresiei bolii a devenit o țintă viabilă(15).
Definiție
Limitarea cronică a fluxului respirator este o caracteristică a BPOC, fiind cauzată de o combinație de mici leziuni respiratorii (bronșiolită obstructivă) și distrucții parenchimatoase (emfizem), în combinație ce variază de la bolnav la bolnav. Inflamația cronică cauzează modificări structurale și îngustarea căilor respiratorii distale. Distrugerea parenchimului prin procese inflamatorii duce la pierderea simultană a alveolelor, astfel scăzând reculul elastic al plămânului; aceste modificări scad capacitatea căilor respiratorii de a rămâne deschise în timpul expirației. Exacerbările și comorbiditățile contribuie la severitatea generală a stării pacienților.
Limitarea fluxului aerian este cel mai bine măsurată prin spirometrie, fiind cel mai disponibil și reproductibil test la scară largă al funcției pulmonare(3). În etiopatogenia BPOC au fost identificați o serie de factori de risc, fumatul fiind cel mai important. Evaluarea diagnosticului se bazează pe simptomele prezente, riscul de exacerbări și rezultatele testelor funcției pulmonare.
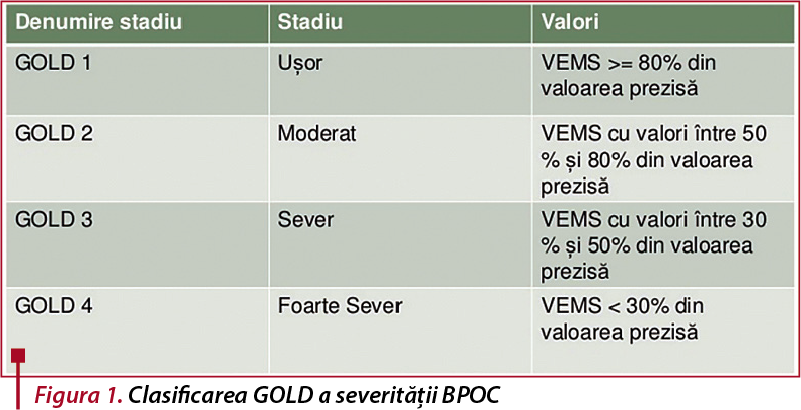
Pentru diagnosticul pozitiv avem nevoie ca raportul VEMS/CVF (volum expirator maxim în prima secundă/capacitate vitală forțată) să fie sub 0,7, raport menținut fix și post-bronhodilatare. Severitatea obstrucției se definește în conformitate cu GOLD (Global Strategy for the Diagnosis, Management, and Prevention of COPD). Aceasta face recomandări terapeutice, ținând seama de gradul BPOC, de evaluarea simptomatică și de riscul viitor al exacerbărilor(4).
Fiziopatologie
Prin intermediul particulelor rezultate în urma fumului de țigară inhalate are loc o inflamație cronică, ce poate induce (la indivizii care dezvoltă BPOC) distrucția țesutului parenchimatos (emfizem) și întrerupe mecanismele normale de reparare și apărare (fibroză). Aceste procese vor duce în timp la captarea aerului, cu limitarea progresivă a fluxului aerian.
La pacienții cu BPOC întâlnim modificări structurale cauzate de numeroase leziuni ce apar odată cu creșterea numărului de celule inflamatorii, modificări ce se găsesc atât în parenchimul pulmonar, cât și la nivel vascular. Aceste modificări se intensifică cu severitatea bolii și, din păcate, persistă și după încetarea fumatului. Deși nu sunt cunoscute pe deplin mecanismele ce determină inflamație și după încetarea fumatului, se presupune că un rol important îl au antigenii și microorganismele remanente la nivel pulmonar. Unii pacienți pot prezenta BPOC și în lipsa fumatului, dar natura răspunsului inflamator la acești pacienți este necunoscută(5).
Îngustarea căilor respiratorii periferice însoțite de inflamație determină scăderea VEMS, iar distrugerea parenchimului prin emfizem se supraadaugă, limitând și mai mult fluxul aerian. În evoluția tardivă a BPOC poate apărea hipertensiunea pulmonară, datorată vasoconstricției hipoxice a arterelor pulmonare mici, rezultând în hiperplaxia intimei și ulterior pierderea patului capilar pulmonar din cauza emfizemului(6).
Diagnostic și clasificare
Simptomele BPOC nu apar decât atunci când leziunile pulmonare sunt semnificative, iar acestea se înrăutățesc în timp, mai ales dacă expunerea la tutun continuă. Un diagnostic clinic de BPOC ar trebui avut în vedere la orice pacient cu dispnee, tuse cronică cu sau fără spută și cu un istoric de expunere la factori de risc. În bronșita cronică, simptomul predominant este tusea zilnică, de obicei productivă, cel puțin trei luni pe an, doi ani consecutiv. Printre alte simptome enumerăm:
- Dispnee, în special în timpul activității fizice.
- Wheezing.
- Constricție toracică.
- Cianoză periorală sau la nivelul patului unghinal.
- Astenie, fatigabilitate.
- Scădere ponderală (în stadii avansate).
- Istoric de expunere la factori de risc: fumat, prafuri, chimicale, însă și fumul rezultat din încălzirea cu lemne.
În diagnosticul pozitiv al BPOC, spirometria este esențială, iar obstrucția este definită ca:
- VEMS <80% din valoarea prezisă.
- VEMS/CVF <70% din valoarea prezisă
VEMS = volum expirator maxim în prima secundă.
CVF= capacitate vitală forțată.
Diagnosticul diferențial se realizează în principal cu astmul bronșic, unde observăm reversibilitatea obstrucției după administrarea tratamentului (răspuns >400 ml la administrarea bronhodilatatoarelor sau răspuns >400 ml la 30 mg prednisolon zilnic timp de două săptămâni).
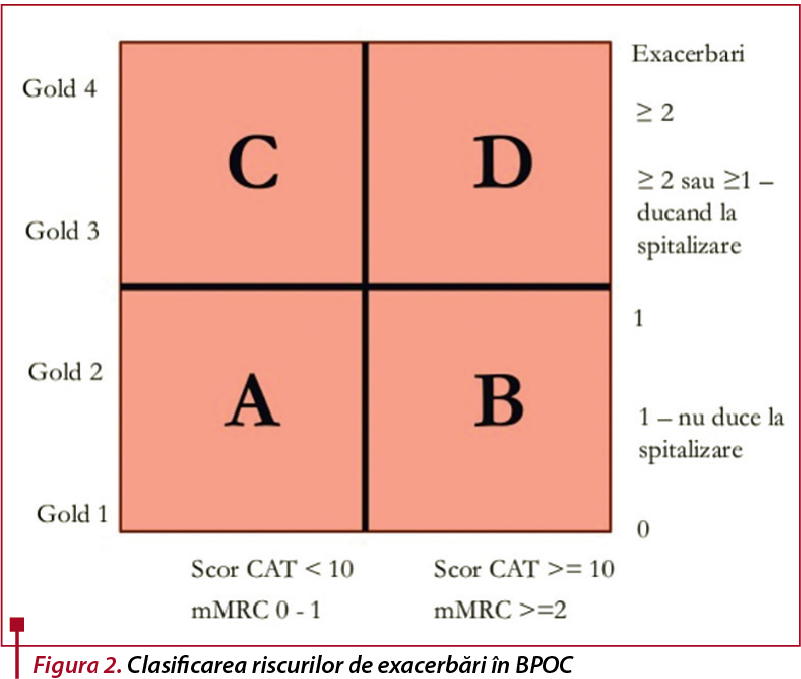
Severitatea BPOC este clasificată în patru stadii, în funcție de valoarea procentuală a VEMS, conform GOLD (Global Initiative for Chronic Obstructive Lung Disease), iar pacienții vor fi, de asemenea, încadrați într-o clasă de risc, în funcție de numărul de exacerbări sau spitalizări. Strategia GOLD recomandă folosirea chestionarelor mMRC (modified British Medical Research Council) sau testul CAT (COPD Assessment Test) pentru evaluarea simptomelor(7).
Managementul pacientului cu BPOC stabil
Evaluarea se realizează la intervale de 3-6-12 luni, în funcție de severitatea patologiei. La fiecare vizită se evaluează în primul rând statutul de fumător (nefumator, fost fumător sau fumător activ), precum și gradul de expunere, măsurat în pachete/an (numărul de pachete pe zi x numărul de ani ca fumător activ). De asemenea, se evaluează gradul de dispnee (test de mers de 6 minute), simptomele asociate și apariția complicațiilor (insuficiență respiratorie cronică, cord pulmonar cronic, poliglobulie). Este necesară notarea frecvenței exacerbărilor și a internărilor în spital, precum și funcția ventilatorie prin spirometrie. Aceasta se va realiza anual pentru pacienții cu BPOC ușor și moderat și la 3-6 luni pentru cei cu BPOC sever și foarte sever. Ca tratament medicamentos, la acești pacienți dispunem de următoarele medicamente:
a. Bronhodilatatoare cu durată scurtă de acțiune: beta 2-agonist (salbutamol, fenoterol) sau anticolinergic (bromură de ipratropium), administrate fie individual, fie în combinație; sunt administrate la nevoie pentru ameliorarea simptomelor;
b. Bronhodilatatoare cu durată lungă de acțiune: beta 2-agonist (salmeterol, ormoterol), anticolinergic (tiotropium) sau teofilina;
c. Glucocorticoizi inhalatori, rezervat pacienților cu VEMS <50% și exacerbări frecvente. Combinația cu un bronhodilatator cu acțiune lungă (salmeterol + fluticazona, formoterol + budesonide) reprezintă o opțiune la pacienții cu BPOC moderat/sever, cu răspuns slab la tratamentul standard;
d. Oxigenoterapia de lungă durată: se recomandă la pacienții cu SaO2 sub 88%, în stadiul IV de BPOC, la pacienții cu policitemie (Ht >55%) sau în caz de hipertensiune pulmonară, pentru o durată de minimum 15 h/zi;
e. Vaccinarea antigripală anuală este recomandată tuturor pacienților cu BPOC, iar vaccinarea antipneumococică se recomandă în cazurile severe cu VEMS <40% sau la pacienții vârstnici >65;
f. Antibioticele, mucoliticele, antitusivele sau stimulentele respiratorii nu sunt recomandate în tratamentul de fond al BPOC(3).
Tratamentul exacerbărilor
Spre deosebire de BPOC stabil, exacerbările acute prezintă o serie de dificultăți de management și pot crește riscul de morbiditate și mortalitate. Se estimează că 70-80% au un trigger viral sau bacterian care determină o infecție respiratorie, iar restul de 20-30% se datorează fie expunerii la un poluant sau au o etiologie necunoscută(8). Conform datelor prezente, detecția precoce și un tratament agresiv și prompt al exacerbărilor pot asigura un rezultat favorabil. Din păcate însă, mulți pacienți cu BPOC nu raportează exacerbările, astfel fiind necesară educarea pacienților cu privire la semnele și simptomele exacerbărilor, ca aceștia să primească ajutor în stadiile inițiale ale exacerbării. Ca opțiuni terapeutice, notăm:
a. Bronhodilatatoarele inhalatorii
Bronhodilatatoare cu durată scurtă de acțiune și anticolinergicele rămân tratamentul principal al simptomatologiei și obstrucției din timpul exacerbărilor. Nu există dovezi legate de îmbunătățirea funcției pulmonare la 90 de minute între clasele prezente(9). În inspir, efectele bronhodilatatoarelor încep în 5 minute, cu un maxim terapeutic la 30 de minute. În contrast, efectul bromurii de ipratropium începe după 10-15 minute, cu un vârf la 30-60 de minute.
b. Antibioterapie
Alegerea antibioticului pentru tratamentul exacerbării acute a fost recent contestată de creșterea prevalenței organismelor rezistente, mai ales la pacienții cu exacerbări severe și la cei cu un tratament anterior cu antibiotice și corticosteroizi pe cale orală. În această situație, se recomandă antibiotice cu spectru larg, cum ar fi fluorochinolone de generație nouă, care vor fi eficiente împotriva tulpinilor rezistente de H. influenzae și S. pneumoniae(10).
c. Glucocorticosteroizi
Rolul corticosteroizilor sistemici în tratamentul exacerbărilor rămâne controversat. Nu există nici o dovadă puternică pentru a realiza o selecție corespunzătoare a pacienților, calea de administrare sau durata tratamentului. Aceștia reduc timpul de recuperare și eșecuri de tratament atunci când sunt utilizați pentru tratarea episoadelor acute. Doza optimă și durata tratamentului cu corticosteroizi nu au fost bine stabilite, însă ghidurile GOLD recomandă o doză de 30-40 mg prednisolon pe zi, de preferință pe cale orală, timp de 10-14 zile(11).
d. Oxigenoterapie
Terapia cu oxigen este benefică în tratamentul exacerbărilor BPOC, pacienții fiind adesea hipoxici, obiectivul reprezentându-l tratarea hipoxemiei fără a modifica raportul ventilație/perfuzie.
e. Agenți mucolitici
Folosirea agenților mucolitici și antioxidanți (ambroxol, erdosteină, carbocisteină) a fost investigată în numeroase studii cu rezultate controversate. Cu toate acestea, pacienții cu spută vâscoasă pot beneficia de terapia mucolitică, dar beneficiile finale nu sunt semnificative(3).
f. Metilxantine
Metilxantinele utilizate i.v. (teofilină, aminofilină) sunt considerate ca terapie de linia a doua în cazul unui răspuns ineficient la terapia standard(12).
g. Ventilația non-invazivă
Un progres semnificativ în tratamentul exacerbărilor BPOC a fost implementarea tratamentului ventilației neinvazive cu presiune pozitivă (VNI). S-a demonstrat că VNI îmbunătățește acidoza respiratorie acută (crește pH-ul și scade presiunea parțială a dioxidului de carbon arterial), scade frecvența respiratorie, efortul respirator, severitatea dispneei, precum și complicațiile (ex.: pneumonia de ventilatație) și durata spitalizării. Astfel, se evită intubarea, iar mortalitatea datorată exacerbărilor BPOC este substanțial redusă(13).
În ciuda inițiativelor de a îmbunătăți detecția și tratamentul BPOC, ghidurile actuale sunt slab implementate atât în cadrul medicilor de familie, cât și al specialiștilor pneumologi și interniști. Diagnosticul se stabilește de cele mai multe ori fără utilizarea spirometriei, fie din cauza lipsei de disponibilitate sau timp, fie a costurilor implicate sau a lipsei personalului calificat(18). Un studiu realizat în 2010 în Suedia a arătat că doar un sfert din pacienți au fost diagnosticați cu BPOC cu ajutorul spirometriei. Datele au relevat că, de obicei, femeile fumătoare active și cu un Indice de Masă Corporală (IMC) crescut au fost cel mai des diagnosticate fără criteriul de spirometrie necesar bolii(19). Mai mult decât atât, dovezile sugerează că terapia farmacologică este des prescrisă neadecvat, în dezacord cu recomandările severității bolii(20). Provocarea actuală în tratamentul BPOC este aplicarea cunoștințelor legate de procesul patologic sub forma algoritmilor de tratament. În acest circuit, medicii de familie și medicii specialiști (pneumologie, medicină internă) au un rol vital în identificarea pacienților aflați la risc și oferirea tratamentului optim în stadii cât mai precoce.
Galerie
Bibliografie
2. Pena VS, Miravitlles M, Gabriel R, Jimenez-Ruiz CA, Villasante C, Masa JF, Viejo JL, Fernandez-Fau L. Geographic variations in prevalence and underdiagnosis of COPD: results of the IBERPOC multicentre epidemiological study. Chest 2000;118:981–989.
3. Vestbo J, Hurd SS, Agustí AG, et all. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med. 2013 Feb 15;187(4):347-65.
4. Osthoff M, Jenkins C, Leuppi J. Chronic obstructive pulmonary disease - a treatable disease. Swiss Med Wkly. 2013 Apr 11;143:w13777.
5. Cosio MG, Saetta M, Agusti A. Immunologic aspects of chronic obstructive pulmonary disease.N Engl J Med. 2009;360:2445–2454.
6. Peinado VI, Pizarro S, Barbera JA. Pulmonary vascular involvement in COPD. Chest 2008;134:808–814.
7. Mirjam Osthoff, Christine Jenkins, Jörg D. Leupp. Chronic obstructive pulmonary disease – a treatable disease. Swiss Med Wkly. 2013;143:w13777.
8. Sethi S, Murphy TF. Infection in the pathogenesis and course of chronic obstructive pulmonary disease. N Engl J Med. 2008 Nov 27; 359(22):2355-65.
9. Karpel JP, Pesin J, Greenberg D, Gentry E. A comparison of the effects of ipratropium bromide and metaproterenol sulfate in acute exacerbations of COPD. Chest. 1990 Oct; 98(4):835-9.
10. Celli BR, MacNee W, ATS/ERS Task Force. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J. 2004 Jun; 23(6):932-46.
11. Niewoehner DE, Erbland ML, Deupree RH, Collins D, Gross NJ, Light RW, Anderson P, Morgan NA. Effect of systemic glucocorticoids on exacerbations of chronic obstructive pulmonary disease. Department of Veterans Affairs Cooperative Study Group. N Engl J Med. 1999 Jun 24; 340(25):1941-7.
12. Mahon JL, Laupacis A, Hodder RV, McKim DA, Paterson NA, Wood TE, Donner A. Theophylline for irreversible chronic airflow limitation: a randomized study comparing n of 1 trials to standard practice. Chest. 1999 Jan; 115(1):38-48.
13. Maggiore SM, Richard JC, Abroug F, Diehl JL, Antonelli M, Sauder P, Mancebo J, Ferrer M, Lellouche F, Lecourt L, Beduneau G, Brochard L. A multicenter, randomized trial of noninvasive ventilation with helium-oxygen mixture in exacerbations of chronic obstructive lung disease. Crit Care Med. 2010 Jan; 38(1):145-51.
14. Abdool-Gaffar MS, Ambaram A, Ainslie GM, et all; COPD Working Group. Guideline for the management of chronic obstructive pulmonary disease--2011 update. S Afr Med J. 2011 Jan;101(1 Pt 2):63-73. Erratum in: S Afr Med J. 2011 May;101(5):288.
15. Russell R, Anzueto A, Weisman I. Optimizing management of chronic obstructive pulmonary disease in the upcoming decade. International Journal of Chronic Obstructive Pulmonary Disease. 2011;6:47-61.
16. Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med. 2006;3:e442.
17. Chatila WM, Thomashow BM, Minai OA, Criner GJ, Make BJ. Comorbidities in chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2008;5:549–555.
18. Derom E, van Weel C, Liistro G, Buffels J, Schermer T, Lammers E, Wouters E, Decramer M. Primary care spirometry. Eur Respir J. 2008 Jan; 31(1):197-203.
19. Arne M, Lisspers K, Ställberg B, Boman G, Hedenström H, Janson C, Emtner M.How often is diagnosis of COPD confirmed with spirometry? Respir Med. 2010Apr;104(4):550-6.
20. Jones RC, Dickson-Spillmann M, Mather MJ, Marks D, Shackell BS. Accuracy of diagnostic registers and management of chronic obstructive pulmonary disease: The Devon primary care audit. Respir Res. 2008;9:62.
Articole din ediţiile anterioare
COVID-19 – viroza care ne-a schimbat viaţa
Noul tip de coronavirus şi boala produsă de acesta (COVID-19) ne-au schimbat în mod radical viaţa în decurs de numai 6 luni. Este cea mai mare pand...
Rolul medicului de familie în diagnosticarea, tratamentul şi monitorizarea pacienţilor cu patologie psihiatrică
Patologia psihiatrică reprezintă una dintre problemele emergente ale medicinei contemporane. Într-o societate aflată în continuă dezvoltare, se ob...
Hipertensiunea arterială la vârstnic
Pacienţii vârstnici au numeroase particularităţi legate de patologia cardiovasculară. Majoritatea covârşitoare a acestora au un profil de risc în...
Demenţa: importanţa investigaţiilor neuroimagistice în stabilirea diagnosticului şi rolul medicului de familie în abordarea terapeutică şi evolutivă
Demenţa este una dintre cele mai întâlnite patologii în practica medicului psihiatru şi a medicului de familie, reprezentând o problemă de sănătate...