The acute cardiac allograft rejection (ACAR) is the leading cause of mortality in patients with heart transplant. Currently, the endomyocardial biopsy (EMB) is considered to be the gold standard in screening for ACAR, which is an invasive procedure with life-threatening complications; however, it does not provide information about the whole myocardium and may give a false negative result in up to 20% of the cases. At the moment, cardiac magnetic resonance imaging (CMR) has become a commonly used diagnostic method. It is known to be a noninvasive and reproducible method for determining cardiac ventricular volumes and muscle mass. It provides tissue-specific information (myocardial edema, necrosis/fibrosis) using different sequences and contrast agents. The purpose of this study is to evaluate the most promising techniques for characterizing myocardial tissue and detecting ACAR using CMR imaging.
Rolul imagisticii prin rezonanţă magnetică cardiacă în evaluarea pacienţilor cu transplant cardiac
Cardiac magnetic resonance for heart transplant patients
First published: 25 martie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Med.145.1.2022.6214
Abstract
Rezumat
Respingerea acută a alogrefei cardiace (ACAR – acute cardiac allograft rejection) reprezintă principala cauză de deces în cazul pacienţilor cu transplant cardiac. În prezent, standardul de aur în diagnosticul de ACAR este reprezentat de biopsia endomiocardică (EMB – endomyocardial biopsy), care este o procedură invazivă, cu complicaţii ameninţătoare de viaţă; totodată, nu oferă informaţii despre întregul miocard şi poate da un rezultat fals negativ la până la 20% din cazuri. Rezonanţa magnetică cardiacă (CMR – cardiac magnetic resonance) a devenit la momentul actual o metodă de diagnosticare utilizată tot mai frecvent. Este cunoscută a fi o metodă neinvazivă şi reproductibilă pentru determinarea volumelor ventriculare cardiace, respectiv a masei musculare. Oferă informaţii specifice ţesutului (edem miocardic, necroză/fibroză), folosind diferite secvenţe şi utilizând substanţă de contrast. Scopul lucrării este de a evalua cele mai promiţătoare metode pentru caracterizarea ţesutului miocardiac şi detectarea ACAR în cadrul imagisticii prin CMR.
Introducere
Transplantul cardiac este considerat o strategie terapeutică standard în cazul pacienţilor cu insuficienţă cardiacă în stadiu terminal. Odată cu dezvoltarea terapiei imunosupresoare, supravieţuirea pacienţilor cu transplant cardiac s-a îmbunătăţit semnificativ, însă, cu toate acestea, în ciuda terapiei moderne, respingerea acută a alogrefei cardiace (ACAR; acute cardiac allograft rejection) reprezintă principala cauză de deces la aceşti pacienţi. Se observă o incidenţă a ACAR ridicată în primul an după transplant: 20% în caz de respingere celulară mediată de celule T(1) şi 10% la respingerea mediată de anticorpi(2). Respingerea recurentă şi cronică este asociată cu o incidenţă crescută a vasculopatiei alogrefei cardiace (CAV; cardiac allograft vasculopathy) şi a disfuncţiei alogrefei, cea mai frecventă indicaţie pentru repetarea transplantului cardiac(3).
În prezent, standardul de aur în diagnosticul de ACAR este reprezentat de anomaliile observate în probele de biopsie endomiocardică (EMB). Nu există un consens internaţional cu privire la frecvenţa adecvată a eşantionării, cu o medie de 10-15 proceduri efectuate în primul an(4). EMB este o procedură invazivă asociată cu disconfortul pacientului, leziuni ale valvei tricuspide şi complicaţii rare, care pun viaţa în pericol (aritmie ventriculară, perforaţie miocardică etc.)(5). EMB nu oferă informaţii despre întregul miocard şi poate da un rezultat fals negativ la până la 20% din cazuri(6).
Ecocardiografia reprezintă o metodă rapidă şi facilă de evaluare a cordului, însă, în studiile care au evaluat performanţa diagnostică a ecocardiografiei, nu s-au găsit parametri care să fie uniform valabili în toate studiile destinate diagnosticului ACAR(7).
Rezonanţa magnetică cardiacă (CMR) a devenit la momentul actual o metodă de diagnosticare utilizată tot mai frecvent. Este cunoscută ca o metodă neinvazivă şi reproductibilă pentru determinarea volumelor ventriculare cardiace, respective a masei musculare. Oferă informaţii specifice ţesutului (edem miocardic, necroză/fibroză), folosind diferite secvenţe şi utilizând substanţă de contrast. Spre deosebire de EMB, aceasta permite evaluarea întregului miocard şi, deoarece nu implică radiaţii ionizante, poate fi repetată de mai multe ori.
Rezonanţa magnetică cardiacă
CMR este o metodă de screening utilă pentru examinarea ţesutului miocardic global şi regional. Cu ajutorul examenului CMR avem posibilitatea de a detecta inflamaţia şi necroza miocardului, care poate fi observată şi în cazul ACAR.
Ponderare T₂
Identificarea edemului miocardic prin calculul raportului dintre intensitatea semnalului miocardului şi muşchiul scheletic în imaginile ponderate T₂ este posibilă, dar nu este suficient de fiabilă în evaluarea respingerii acute(8).
Mai recent, Krieghoff şi colab. au constatat într-un studiu cu 73 de pacienţi transplantaţi că raportul intensităţii semnalului pentru cuantificarea edemului a avut o sensibilitate de 63%, o specificitate de 78% şi o valoare predictivă negativă de 93% pentru respingerea acută celulară de grad ≥1b (clasificarea ISHLT 1990)(9).
Cu toate acestea, imaginile ponderate T₂ sunt limitate de un raport semnal-zgomot scăzut, de artefacte de mişcare, de intensitatea variabilă a semnalului şi de posibilitatea prezenţei inflamaţiei muşchiului scheletic, care distorsionează rezultatele.
Ponderare T₁
După administrarea intravenoasă de substanţă de contrast, este posibilă obţinerea de imagini ponderate T₁ în fază timpurie pentru detectarea hiperemiei inflamatorii asociate cu respingerea acută. Această metodă, ca şi înregistrările tradiţionale cu ponderare T₂, permite o evaluare calitativă, însă e posibilă şi măsurarea acumulării relative globale (GRH; global relative enhancement), care reprezintă raportul dintre intensitatea semnalului miocardului şi a muşchiului scheletic. Rolul diagnostic al GRH, similar cu rata edemului, este însă controversat în detectarea ACAR.
Există mai puţine informaţii din literatură cu privire la relaţia dintre acumularea de contrast de tip tardiv (LGE; late gadolinium enhancement), ca indicator de necroză/fibroză miocardică, şi ACAR. Prevalenţa exactă a acumulării tardive la pacienţii cu transplant cardiac este necunoscută; cu toate acestea, unele studii mai mici au raportat o prevalenţă de 71%(10). Totuşi, pe lângă ACAR, CAV şi leziunile de reperfuzie pot fi responsabile pentru acumularea tardivă observată la pacienţii cu transplant cardiac(11).

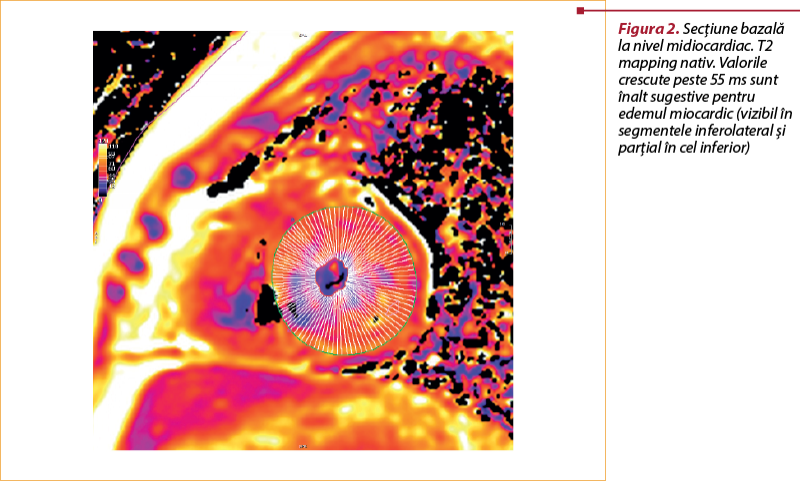
Tehnica T₂ mapping (hărţi T2)
Unul dintre cei mai studiaţi parametri CMR în diagnosticul ACAR este timpul de relaxare T₂, care este direct proporţional cu conţinutul de apă miocardică, astfel încât o prelungire a timpului T₂ este de aşteptat în ACAR. Tehnica T₂ mapping permite o evaluare cantitativă, în care poate fi determinat timpul de relaxare T₂ al fiecărui punct al miocardului.
Atunci când se utilizează tehnica T₂ mapping, trebuie remarcat faptul că valoarea acesteia este prelungită în perioada post-transplant indiferent de prezenţa ACAR, probabil explicată prin leziuni de ischemie-reperfuzie(12,13).
Într-un studiu publicat în 2019, timpul T₂ miocardic a fost semnificativ mai mare la pacienţii cu ACAR în antecedente, comparativ cu cei fără ACAR (51±3,8 ms versus 49,2±4 ms; p=0,02) şi la pacienţii fără ACAR, comparativ cu subiecţii de control de aceeaşi vârstă (49,2±4 ms versus 45,2±2,3 ms; p<0,01). Pacienţii cu ACAR activ au demonstrat un timp T₂ crescut comparativ cu grupul fără ACAR (52,4±4,7 ms versus 49,2±4 ms, p<0,01), dar nu în cazul grupului ACAR în antecedente(13).
Marie şi colab. au analizat tehnica T₂ mapping în respingerea acută a transplantului de inimă, folosind o secvenţă black blood la un câmp magnetic scăzut de 0,5 Tesla(14). Ei au constatat că o valoare T₂≥56 ms este în corelaţie cu respingerea cardiacă acută de grad ≥2 (sensibilitate 89%, specificitate 70%).
Bonnemains şi colab. au confirmat aceste rezultate pe un câmp magnetic mai mare (1,5 T) la 60 de pacienţi cu o valoare T₂>60 ms, asociate cu un risc de respingere mai mare decât gradul 2(15).
În prezent, există puţine date în literatură; totuşi, în cercetările precedente, tehnica T₂ mapping s-a dovedit a fi una dintre cele mai promiţătoare metode de detectare a ACAR, a cărei valoare se corelează cu severitatea ACAR. Astfel, poate fi utilă nu numai în diagnosticarea ACAR, ci şi în monitorizarea eficacităţii terapiei.
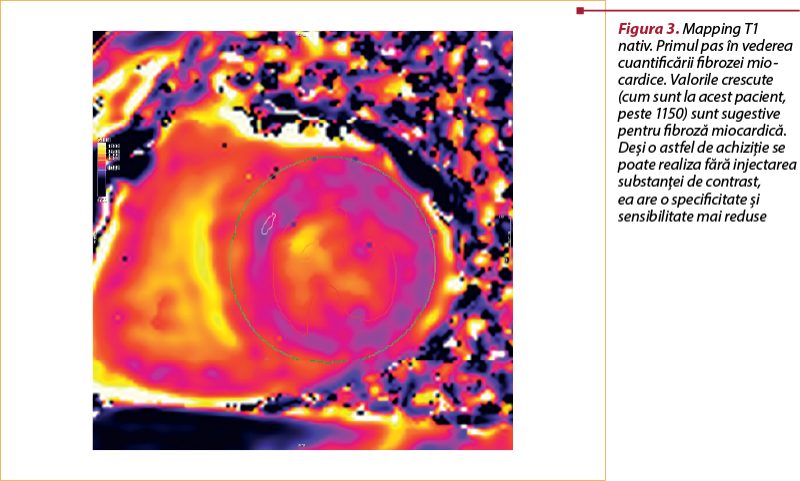
Tehnica T₁ mapping
Similar cu tehnica T₂ mapping, timpul T₁ din diferite puncte ale miocardului poate fi determinat atât nativ, cât şi după administrarea unui agent de contrast, care oferă informaţii detaliate despre procesele celulare din miocard. Timpul T₁ este sensibil la modificările conţinutului de apă din miocard, astfel încât timpul T₁ nativ creşte din cauza edemului în ACAR(16). Trebuie remarcat faptul că valoarea şi timpul T₁ se prelungesc după transplant, indiferent de prezenţa ACAR(13). Există puţine date disponibile cu privire la relaţia dintre timpul T₁ şi respingerea acută.
Într-un studiu publicat recent s-a dovedit că tehnica T₁ mapping este capabilă să urmărească recuperarea după terapia imunosupresoare; la pacienţii cu ACAR, valorile T₁ au scăzut semnificativ în urma tratamentului. Mulţi dintre pacienţi şi-au normalizat valorile T₁ după terapie, în ciuda unei biopsii seriale cu rezultat de grad 2 persistent. Acest fapt sugerează că recuperarea histopatologică poate întârzia faţă de recuperarea evidenţiată de rezonanţa magnetică cardiacă(17).
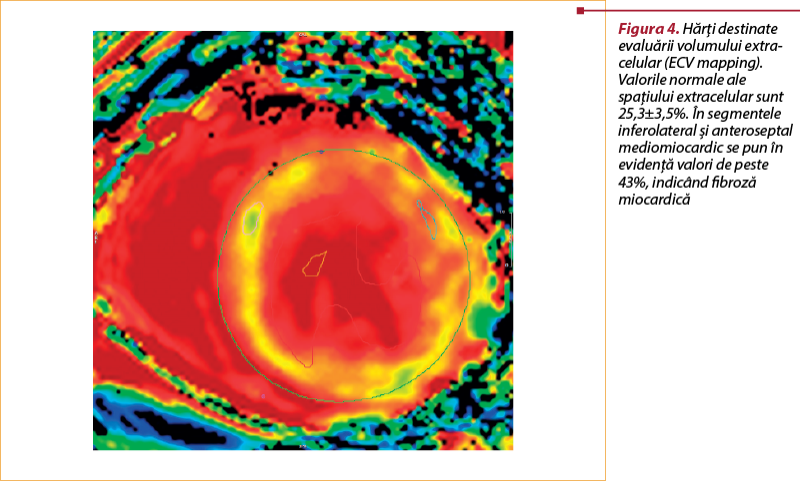
Tehnica T₁ mapping nativă şi postcontrast poate fi utilizată pentru a obţine informaţii despre volumul extracelular (ECV; extracellular volume fraction).
Valorile ECV miocardice normale sunt foarte asemănătoare în diferite studii, ele situându-se într-un interval de 24-28%(18.19). Într-o examinare recentă (2018), pacienţii cu respingere cardiacă acută au avut un ECV semnificativ mai mare la nivel bazal comparativ cu pacienţii fără respingere (34,2% versus 27,4%). Valorile ECV la nivel bazal au prezentat o acurateţe diagnostică ridicată pentru a identifica o respingere acută (sensibilitate de 89%, specificitate de 77%). Combinarea timpului T₂ şi ECV a crescut sensibilitatea, ducând la detectarea tuturor episoadelor de respingere cardiacă şi, potenţial, la scăderea cu 63% a numărului de EMB(20).
Rezonanţa magnetică cardiovasculară de stres
Este cea mai fidelă şi mai avansată metodă de vizualizare şi de evaluare a funcţiei inimii. Se efectuează cu agenţi farmacologici inotropi (ex.: dobutamină) sau vasodilatatori (ex.: adenozină, dipiridamol). În timpul administrării dobutaminei, cererea de oxigen a miocardului creşte odată cu creşterea contractilităţii miocardice, iar ischemia miocardică este detectată ca o tulburare de mişcare a peretelui. Adenozina poate fi utilizată pentru a analiza calitativ şi cantitativ fluxul sanguin miocardic, folosind diferite programe de evaluare(21). S-a constatat o scădere a fluxului sanguin miocardic la pacienţii transplantaţi care au suferit anterior respingere, dovedită prin măsurători angiografice invazive(22,23).
Discuţie
Standardul de aur pentru diagnosticul ACAR este reprezentat momentan de biopsia endomiocardică invazivă, pe baza criteriilor stabilite de ISHLT (International Society for Heart and Lung Transplantation). Cu toate acestea, EMB are şi unele limitări în diagnosticul ACAR, cel mai important dintre acestea fiind faptul că nu oferă informaţii despre întregul miocard. În prezent, există puţine date în literatură, iar tehnica T₂ mapping s-a dovedit a fi cea mai promiţătoare metodă în diagnosticarea şi monitorizarea respingerii acute a alogrefei cardiace. Există dovezi că tehnica T₁ mapping şi ECV pot fi utile în diagnosticarea ACAR şi în urmărirea evoluţiei posttransplant.
CMR oferă o acurateţe ridicată pentru diagnosticul de respingere acută şi ar putea fi un ajutor în detectarea ACAR în cazul pacienţilor cu rezultat fals negativ în probele de biopsie endomiocardică.
Concluzii
CMR este o metodă promiţătoare, neinvazivă pentru detectarea ACAR. Tehnica T₂ mapping a arătat cea mai ridicată corelaţie cu ACAR şi există dovezi că tehnica T₁ mapping şi ECV pot fi utile în diagnosticarea ACAR.
CMR oferă o acurateţe diagnostică ridicată pentru depistarea respingerii acute şi ar putea reduce numărul de biopsii endomiocardice efectuate de rutină.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
-
Stehlik J, Edwards LB, Kucheryavaya AY, et al. The Registry of the International Society for Heart and Lung Transplantation: 29th official adult heart transplant report–2012. J Heart Lung Transplant. 2012;31:1052-64.
-
Patel JK, Kobashigawa JA. Should we be doing routine biopsy after heart transplantation in a new era of anti-rejection? Curr Opin Cardiol. 2006;21:127-31.
-
Colvin-Adams M, Agnihotri A. Cardiac allograft vasculopathy: current knowledge and future direction. Clin Transplant. 2011;25:175-84.
-
Costanzo MR, Dipchand A, Starling R, Anderson A, Chan M, Desai S, et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2010;29:914-56.
-
Spiegelhalter DJ, Stovin PG. An analysis of repeated biopsies following cardiac transplantation. Stat Med. 1983;2:33-40.
-
Fishbein MC, Kobashigawa J. Biopsy-negative cardiac transplant rejection: etiology, diagnosis, and therapy. Curr Opin Cardiol. 2004;19:166-9.
-
Lu W, Zheng J, Pan X, Sun L. Diagnostic performance of echo-cardiography for the detection of acute cardiac allograft rejection: a systematic review and meta-analysis. PLoS One. 2015;10(3):e0121228.
-
Almenar L, Igual B, Martinez-Dolz L, et al. Utility of cardiac magnetic resonance imaging for the diagnosis of heart transplant rejection. Transplant Proc. 2003;35(5):1962-4. PubMed PMID:12962864.
-
Krieghoff C, Barten MJ, Hildebrand L, et al. Assessment of subclinical acute cellular rejection after heart transplantation: comparison of cardiac magnetic resonance imaging and endomyocardial biopsy. Eur Radiol. 2014;24(10):2360-71. doi:10.1007/s00330-014- 3246-2. PubMed PMID: 24895035; PubMed.
-
Braggion-Santos MF, Andre F, Lossnitzer D, et al. Prevalence of different forms of infarct-atypical late gadolinium enhancement in patients early and late after heart transplantation. Clin Res Cardiol. 2014;103(1):57-63. doi:10.1007/s00392-013-0623-9. PubMed PMID: 24122145.
-
Miller CA, Fildes JE, Ray SG, et al. Non-invasive approaches for the diagnosis of acute cardiac allograft rejection. Heart. 2013;99(7):445-53. doi:10.1136/heartjnl-2012-302759. PubMed PMID:23257172.
-
Wisenberg G, Pflugfelder PW, Kostuk WJ, et al. Diagnostic applicability of magnetic resonance imaging in assessing human cardiac allograft rejection. Am J Cardiol. 1987;60(1):130-6. PubMed PMID:3300244.
-
Dolan RS, Rahsepar AA, Blaisdell J, et al. Multiparametric Cardiac Magnetic Resonance Imaging Can Detect Acute Cardiac Allograft Rejection After Heart Transplantation. JACC Cardiovasc Imaging. 2019;12(8 Pt 2):1632-1641.
-
Marie PY, Angioi M, Carteaux JP, et al. Detection and prediction of acute heart transplant rejection with the myocardial T2 determination provided by a black-blood magnetic resonance imaging sequence. J Am Coll Cardiol. 2001;37(3):825-31. PubMed PMID:11693758.
-
Bonnemains L, Villemin T, Escanye J-M, Hossu G, Odille F, Vanhuyse F, et al. Diagnostic and prognostic value of MRI T2 quantification in heart transplant patients. Transpl Int. 2014;27:69-76.
-
Haaf P, Garg P, Messroghli DR, Broadbent DA, et al. T1 Mapping and Extracellular Volume (ECV) in clinical practice: a comprehensive review. J Cardiovasc Magn Reson. 2016;18(1):89. doi:10.1186/s12968-016-0308-4. PubMed PMID: 27899132; PubMed Central PMCID: PMCPMC5129251.
-
Imran M, Wang L, McCrohon J, et al. Native T1 Mapping in the Diagnosis of Cardiac Allograft Rejection: A Prospective Histologically Validated Study. JACC Cardiovasc Imaging. 2019;12(8 Pt 2):1618-1628.
-
Lee JJ, Liu S, Nacif MS, Ugander M, Han J, Kawel N, et al. Myocardial T1 and extracellular volume fraction mapping at 3 T. J Cardiovasc Magn Reson. 2011;13:75.
-
Rogers T, Dabir D, Mahmoud I, Voigt T, Schaeffter T, Nagel E, et al. Standardization of T1 measurements with MOLLI in differentiation between health and disease – the ConSept study. J Cardiovasc Magn Reson Off J Soc Cardiovasc Magn Reson. 2013;15:7.
-
Vermes E, Pantaléon C, Auvet A, et al. Cardiovascular magnetic resonance in heart transplant patients: diagnostic value of quantitative tissue markers: T2 mapping and extracellular volume fraction, for acute rejection diagnosis.
-
J Cardiovasc Magn Reson. 2018;20(1):59.
-
Hamirani YS, Kramer CM. Cardiac MRI assessment of myocardial perfusion. Future Cardiol. 2014;10(3):349–58. doi:10.2217/ fca.14.18. PubMed PMID: 24976472; PubMed Central PMCID: PM-CPMC4152773.
-
Muehling OM, Wilke NM, Panse P, et al. Reduced myocardial perfusion reserve and transmural perfusion gradient in heart transplant arteriopathy assessed by magnetic resonance imaging. J Am Coll Cardiol. 2003;42(6):1054-60. PubMed PMID:13678930.
-
Rivard AL, Swingen CM, Blake D, et al. A comparison of myocardial perfusion and rejection in cardiac transplant patients. Int J Cardiovasc Imaging. 2007 23(5):575–82. doi:10.1007/s10554-006- 9184-6. PubMed PMID:17206459.
-
Miller CA, Naish JH, Shaw SM, et al. Multiparametric cardiovascular magnetic resonance surveillance of acute cardiac allograft rejection and characterisation of transplantation-associated myocardial injury: a pilot study. J Cardiovasc Magn Reson. 2014;16:52. doi:10.1186/s12968-014-00.