The emergence in the world market of abundant types of drugs that can cause osteonecrosis of the jaws makes the daily practice of dentists and oral and maxillofacial surgeons extremely difficult. The adverse effects of antiresorptive, anti-angiogenic and biological drugs are further studied, but the dynamics of events lead to a continuous need to update information by studying the scientific literature. The collaboration of specialists in the field of dental medicine with the attending physicians is mandatory, both for the prevention and for the treatment of the medication-related osteonecrosis of the jaw.
Update privind managementul interdisciplinar al pacientului sub terapie antiresorbtivă/antiangiogenică/biologică, în contextul prevenirii osteonecrozei maxilarelor induse medicamentos
Update regarding the interdisciplinary management of the patient under antiresorptive/antiangiogenic/biological therapy in the context of prevention of medication-related osteonecrosis of the jaw
First published: 19 septembrie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Med.136.4.2020.3664
Abstract
Rezumat
Apariţia pe piaţa mondială a numeroaselor tipuri de medicamente ce pot determina osteonecroza maxilarelor face extrem de dificilă practica de zi cu zi a medicilor stomatologi şi a chirurgilor orali şi maxilo-faciali. Efectele adverse ale medicamentelor antiresorbtive, antiangiogenice şi biologice sunt în continuare studiate, dinamica evenimentelor determinând o necesitate continuă de actualizare a informaţiilor, prin studierea literaturii ştiinţifice de specialitate. Colaborarea specialiştilor din domeniul medicinei dentare cu medicii curanţi este obligatorie atât pentru prevenirea, cât şi pentru tratarea osteonecrozei maxilarelor induse medicamentos.
Osteonecroza este definită drept „necroza oaselor cauzată de obstrucţia alimentării cu sânge”. În ceea ce priveşte osteonecroza maxilarului, aceasta poate apărea spontan sau idiopatic, având ca factori declanşatori: radioterapia efectuată la nivelul capului şi gâtului, consumul cronic de corticosteroizi, medicamente antiangiogenice şi antiresorbtive sau infecţia cu virusul herpes zoster, infecţii necontrolate sau traume majore la pacienţii imunocompromişi(1). Această patologie poate varia de la o expunere osoasă minoră (în mare parte asimptomatică) până la cazuri mai severe, cu expunere osoasă extinsă, durere, infecţie, fractură de maxilar şi fistule(2).
În anul 2003, a fost pentru prima dată când s-a raportat o patologie nouă la nivelul oaselor maxilare, descrisă ca o necroză atipică, asociată cu administrarea bifosfonaţilor(3). Terminologia de „osteonecroza maxilarelor indusă de bifosfonaţi” a fost modificată de Asociaţia Americană a Chirurgilor Oro-Maxilo-Faciali (AAOMS) în „osteonecroza maxilarelor asociată terapiei antiresorbtive/antiangiogenice” în anul 2014(4). Această schimbare a fost justificată de apariţia unui număr crescut de cazuri de osteonecroză asociate cu alte clase de medicamente, în afara bifosfonaţilor(5). Osteonecroza maxilarelor asociată terapiei antiresorbtive/antiangiogenice este definită ca fiind „o complicaţie a utilizării medicamentelor antiresorbtive sau a unor agenţi antiangiogenici, caracterizată prin apariţia unei zone osoase expuse la nivelul cavităţii orale, ce persistă mai mult de 8 săptămâni la un pacient care nu a urmat radioterapie în regiunea oro-maxilo-facială şi nu prezintă leziuni metastatice la nivelul oaselor maxilare”(4).
Cu toate acestea, Grupul internaţional de lucru pentru osteonecroza maxilarelor (Kahn et al., 2015) a recomandat ca terminologia de osteonecroză a maxilarelor să fie utilizată doar ca afecţiune ce este asociată cu două clase de medicamente: bifosfonaţi şi denosumab, menţionând că poate exista şi o asociere cu agenţii antiangiogeni, însă aceasta necesită în continuare studii de specialitate(6).
Recent, în literatura de specialitate au fost descrise cazuri izolate de osteonecroză a maxilarelor asociate cu un nou tratament biologic (imunomodulatoare), cum ar fi infliximab (anti-TNFa), adalimumab (anti-TNFa) sau rituximab (anti-CD20)(5,7,8).
În tot acest context, medicul stomatolog/chirurg trebuie să aibă o colaborare foarte strânsă cu medicul curant (reumatolog, endocrinolog, dermatolog, gastroenterolog, oncolog) în cazul pacienţilor care sunt sub tratament cu medicamente antiresorbtive/antiangiogenice/imunomodulatoare sau care urmează să înceapă acest tratament, întrucât lucrează pe un teren tarat, existând riscul de a dezvolta osteonecroza maxilarelor, mai ales consecutiv manoperelor de chirurgie orală (extracţii dentare, rezecţii apicale, inserare de implanturi).
Specialiştii în chirurgie orală şi maxilo-facială sunt direct implicaţi în diagnosticul şi tratamentul complicaţiilor determinate de efectele adverse ale acestor grupe de medicamente. În plus, întrucât procedurile chirurgicale orale sunt un factor-cheie în dezvoltarea osteonecrozei, stomatologul/chirurgul trebuie să îşi asume un rol decisiv în prevenirea sa(9).
Pentru a putea preveni şi trata această boală, trebuie mai întâi să înţelegem mecanismul de acţiune al tuturor claselor de medicamente.
Bifosfonaţii
Bifosfonaţii inhibă resorbţia osoasă mediată de acţiunea osteoclastelor, făcând parte din clasa medicamentelor antiresorbtive. Pot fi administraţi (1) pe cale intravenoasă, în cazul pacienţilor cu mielom multiplu sau în cazul metastazelor osoase din cancerul de sân sau de prostată, ori (2) pe cale orală, ca tratament de primă intenţie pentru osteoporoză şi osteopenie, dar şi în displaziile osoase.
O altă clasificare a bifosfonaţilor este în funcţie de structura chimică şi mecanismul molecular de acţiune, fiind împărţiţi în bifosfonaţi simpli (fără azot) şi bifosfonaţi conţinând azot(10).
Bifosfonaţii „fără azot” cu administrare orală, cum ar fi studronatul şi clodronatul, au cea mai mică potenţă şi, prin urmare, cel mai mic risc de osteonecroză. Aceştia sunt utilizaţi în principal în displazii osoase rare şi în distrofii, cum ar fi boala Paget(5,10).
Bifosfonaţii conţinând azot, cum ar fi risedronatul, ibandronatul şi alendronatul, cu administrare orală, sunt utilizaţi în principal la pacienţii cu osteoporoză. Potenţa lor relativă este de 10 până la 100 de ori mai mare, iar prevalenţa osteonecrozei maxilarelor în rândul pacienţilor este estimată ca fiind între 0,1% şi 0,21%, riscul crescând semnificativ începând cu al patrulea an de tratament(5,10).
Tot din categoria bifosfonaţilor conţinând azot fac parte şi pamidronatul şi zoledronatul, având însă calea de administrare intravenoasă şi fiind recomandaţi în tratamentul bolnavilor de cancer. Potenţa lor este de 100 până la 1000 de ori mai mare decât cea a bifosfonaţilor neazotaţi, fapt ce le încadrează într-o clasă crescută de risc de osteonecroză, studiile arătând o prevalenţă de până la 23%(5).
Datorită capacităţi ridicate de legare de matricea osoasă, efectele bifosfonaţilor pot dura până la 10 ani după întreruperea tratamentului(5).
Riscul de osteonecroză a maxilarelor la pacienţii care primesc tratament cu bifosfonaţi depinde de o serie de factori, fiind semnificativ mai crescut în următoarele cazuri:
-
pacienţi la care administrarea se face pe cale intravenoasă;
-
pacienţi la care doza administrată este mai mare şi pentru o perioadă mai lungă;
-
pacienţi care primesc corticoterapie sau cei cu diabet sau cu patologii articulare inflamatorii.
Terapia antiresorbtivă biologică
În prezent, denosumab (Prolia®, Xgeva®) este principalul medicament antiresorbtiv biologic asociat cu ostenecroza maxilarelor indusă medicamentos. Denosumab este un anticorp monoclonal IgG2 uman, produs pe o linie celulară de mamifere (celule ovariene de hamster chinezesc) prin tehnologia ADN-ului recombinant. Spre deosebire de bifosfonaţi, denosumab nu se leagă permanent de matricea osoasă şi, prin urmare, efectul rezidual asupra osului remodelat ar putea fi minim după 12-24 de luni de la încetarea tratamentului. Cu toate acestea, numărul de studii asupra efectelor reziduale ale denosumabului în urma întreruperii sunt limitate şi cu un număr mic de pacienţi(5,11).
Denosumab are următoarele indicaţii terapeutice:
-
tratamentul osteoporozei;
-
tratamentul pierderii de masă osoasă asociată cu ablaţia hormonală la bărbaţii cu cancer de prostată cu risc crescut de fracturi;
-
tratamentul pierderii de masă osoasă asociată cu terapia sistemică pe termen lung cu glucocorticoizi la pacienţii adulţi cu risc crescut de fractură.
Riscul de osteonecroză a maxilarelor la pacienţii cu cancer sub tratament cu denosumab este estimat a fi comparabil cu riscul pacienţilor trataţi cu zoledronat, între 0,7% şi 1,9%. În ceea ce priveşte pacienţii trataţi pentru osteoporoză, riscul ar putea fi mult mai mic, estimându-se a fi în jur de 0,04%(5).
Terapia antiangiogenică:
anti-VEGF şi anti-TKIs
Medicamentele antiangiogenice sunt substanţe capabile să inhibe formarea de noi vase sanguine. Datorită acestei capacităţi, acestea sunt folosite în principal în oncologie, având în vedere că neoangiogeneza este un proces esenţial pentru creşterea tumorilor şi pentru dezvoltarea metastazelor în unele tumori solide. Dintre numeroasele grupe de medicamente antiangiogenice, cele anti-VEGF (inhibitorii factorilor de creştere endotelială vasculară) şi anti-TKI (inhibitori de tirozină kinază) par să aibă un risc mai mare de a provoca osteonecroza maxilarelor(5).
În 2008, primele cazuri publicate de osteonecroză a maxilarelor au fost ale unor pacienţi cu cancer sub tratament cu bevacizumab, în 2009, cu sunitinib şi, ulterior, în 2016, cu aflibercept. În ultimii 5 ani s-a observat publicarea de noi cazuri de osteonecroză a maxilarelor indusă medicamentos, asociate cu alte medicamente antiangiogenice, precum dasatinib, erlotinib, imatinib, axitinib, sorafenib şi cabozantinib(5,11).
Imunomodulatoarele biologice –
terapia biologică
Imunomodulatoarele biologice sunt medicamente – în general, anticorpi monoclonali umanizaţi – special concepute pentru a se lega selectiv la unul dintre mediatorii răspunsului inflamator. Includerea lor în rezervorul de produse terapeutice disponibile a dus la o creştere a calităţii vieţii şi la reducerea efectelor secundare severe ale altor alternative de tratament pentru pacienţii care suferă de boală Crohn, artrită reumatoidă, colită ulceroasă, spondilită anchilozantă sau artrită psoriazică(5,12).
Agenţii biologici pot fi clasificaţi în trei categorii:
1. Citokine
-
Sunt în mod normal proteine secretate cu funcţii de creştere, diferenţiere şi activare, care reglează şi direcţionează natura răspunsurilor imune.
-
Exemple de citokine utilizate sub formă de agenţi biologi: interferonul a (IFN-a), IFN-b şi interleukina-2 (IL-2).
2. Anticorpi monoclonali
-
Au fost dezvoltaţi pentru proteine solubile precum citokine, pentru molecule de suprafaţă celulară, imunoglobulină E (IgE) şi pentru antigene tumorale.
-
Odată cu dezvoltarea tehnicilor de biologie moleculară şi inginerie genetică, anticorpii monoclonali de origine animală (şoareci) au fost înlocuiţi cu anticorpi monoclonali himerici, umanizaţi sau complet umanizaţi.
3. Proteine de fuziune
-
Sunt forme esenţial solubile de receptori naturali sau liganzi care au o afinitate ridicată pentru liganzii sau anticorpii respectivi.
-
Sunt proiectate prin fuzionarea proteinelor cu porţiunea Fc a imunoglobulinei (IgG1).
În prezent, nu există dovezi solide care să considere imunomodulatoarele ca fiind medicamente de risc în raport cu osteonecroza maxilarelor, întrucât în literatura ştiinţifică sunt publicate doar prezentări de caz, neexistând studii clinice.
Alte imunomoduatoare
Corticoizi. Utilizarea pe termen lung a corticoizilor pe cale sistemică creşte riscul de a suferi osteonecroză sau necroză avasculară (AVN). Aceasta implică moartea ţesutului osos şi a măduvei sale din cauza afectării aportului de sânge la ţesutul osos. Cele mai comune situsuri sunt femurul, tibia, humerusul, calcaneul şi scafoida. La nivel oral, corticoizii nu par a fi capabili să provoace singuri osteonecroză a maxilarelor indusă medicamentos, deşi pacienţii cărora li se administrează concomitent bifosfonaţi sau denosumab ar putea avea un risc crescut de a o dezvolta(5).
Metotrexat. Metotrexatul (MTX) este unul dintre medicamentele-cheie utilizate în tratamentul artritei reumatoide (RA) şi al altor afecţiuni autoimune şi boli inflamatorii. Mai mult, este un medicament citotoxic care este indicat în tratamentul mai multor tumori solide şi maligne hematologice. Asocierea MTX cu osteonecroza maxilarelor are câteva aspecte controversate. Astfel, în multe cazuri descrise în literatura de specialitate, în plus faţă de MTX, pacienţii au fost trataţi anterior sau concomitent cu bifosfonaţi şi/sau corticoizi(5).
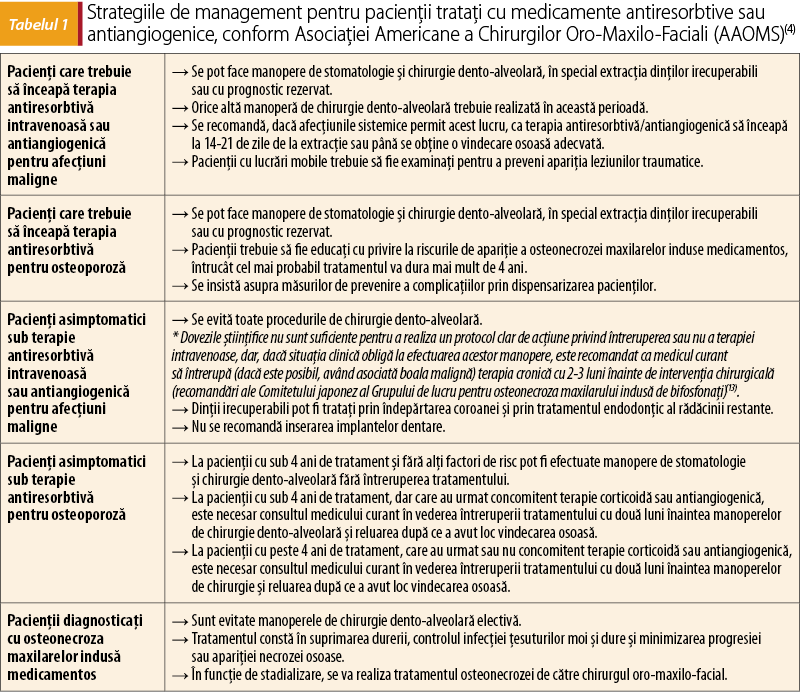
Pentru a preveni apariţia osteonecrozei maxilarelor indusă medicamentos, după intervenţiile de chirurgie orală şi maxilo-facială în cazul pacienţilor care urmează tratament cu medicaţie antiresorbtivă şi/sau antiangiogenică, AAOMS recomandă o abordare multidisciplinară şi strategii de management, conform studiului efectuat de S.L. Ruggiero et al., în 2014(4). Astfel, atât implementarea screeningului oral, cât şi măsurile terapeutice luate înaintea instituirii tratamentului antiresorbtiv pot conduce la o scădere a incidenţei osteonecrozei.
Strategiile de management pentru pacienţii sub terapie biologică
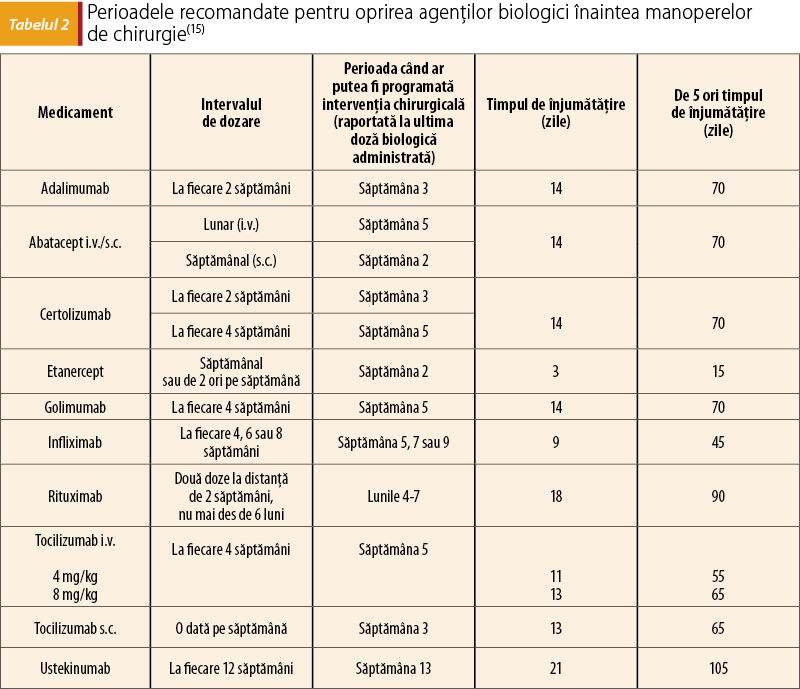
Dovezile ştiinţifice privind managementul pacienţilor sub terapie biologică în contextul manoperelor de chirurgie orală şi maxilo-facială sunt inexistente. Cele mai recente date sunt furnizate de Asociaţia Britanică de Dermatologie, care a recomandat în 2017 ca pacienţii cu psoriazis în tratament cu agenţi biologici să întrerupă medicaţia o perioadă egală cu de 3-5 ori timpul de înjumătăţire al medicamentului (conform tabelului 2) anterior oricăror intervenţii chirurgicale elective(14). În 2019, Asociaţia Britanică de Reumatologie a propus ca planificarea intervenţiei chirurgicale să se facă atunci când a trecut cel puţin un interval de dozare pentru medicamentul respectiv (exceptând rituximab şi tocilizumab – au nevoie de perioade lungi de restricţie), iar pentru manoperele chirurgicale cu risc crescut de infecţie, să se întrerupă conform formulei amintite anterior(15). Ambele asociaţii recomandă ca reluarea tratamentului să se facă după vindecarea completă a plăgii (la 14 zile de la intervenţie), după suprimarea firelor de sutură/capselor chirurgicale, atunci când este absent orice semn de infecţie(14,15).
Concluzii
1. Publicaţiile din literatura ştiinţifică recentă arată că nu doar bifosfonaţii determină apariţia osteonecrozei maxilarelor induse medicamentos.
2. Colaborarea interdisciplinară între medicul stomatolog/chirurg şi medicul curant poate determina prevenirea apariţiei osteonecrozei maxilarelor induse medicamentos.
3. Se recomandă ca pentru pacienţii sub terapie antiangiogenică să se respecte protocoale asemănătoare celor din cazul terapiei antiresorbtive.
4. Pentru pacienţii sub terapie biologică se recomandă să se aibă în vedere timpul de eliminare al medicamentelor înaintea programării oricărei intervenţii chirurgicale.
5. Implementarea screeningului oral, ca şi măsurile terapeutice luate înaintea instituirii tratamentului antiresorbtiv/antiangionenic/biologic pot conduce la o scădere a incidenţei osteonecrozei.
Bibliografie
- Hernandez M, Izarra A, Bronstein D, Suzuki J. Prevalence of Osteonecrosis of the Jaw Secondary to Antiresorptive Therapy in Patients Who have Undergone Dental Surgical Procedures: A Retrospective Study. Int J Dent Oral Sci. 2016;3:353–7.
- Aghaloo TL, Tetradis S. Osteonecrosis of the Jaw in the Absence of Antiresorptive or Antiangiogenic Exposure: A Series of 6 Cases. J Oral Maxillofac Surg. 2017;75(1):129–42.
- Marx RE. Letters to the editor. J Oral Maxillofac Surg. 2003;61:1115–8.
- Ruggiero SL, Dodson TB, Fantasia J, Goodday R, Aghaloo T, Mehrotra B, et al. American Association of Oral and Maxillofacial Surgeons position paper on medication-related osteonecrosis of the jaw - 2014 update. J Oral Maxillofac Surg [Internet]. 2014;72(10):1938–56. Available from: http://dx.doi.org/10.1016/j.joms.2014.04.031
- Eguia A, Bagan L, Cardona F. Review and update on drugs related to the development of osteonecrosis of the jaw. Med Oral Patol Oral y Cir Bucal. 2020;25(1):e71–83.
- Khan AA, Morrison A, Hanley DA, Felsenberg D, McCauley LK, O’Ryan F, et al. Diagnosis and management of osteonecrosis of the jaw: A systematic review and international consensus. J Bone Miner Res. 2015;30(1):3–23.
- Favia G, Tempesta A, Limongelli L, Crincoli V, Iannone F, Lapadula G, et al. A case of osteonecrosis of the Jaw in a patient with Crohn’s disease treated with infliximab. Am J Case Rep. 2017;18:1351–6.
- Preidl RHM, Ebker T, Raithel M, Wehrhan F, Neukam FW, Stockmann P. Osteonecrosis of the jaw in a Crohn’s disease patient following a course of Bisphosphonate and Adalimumab therapy: A case report. BMC Gastroenterol. 2014;14(1).
- Ponte FS De. Bisphosphonates and Osteonecrosis of the Jaw: A Multidisciplinary Approach. Springer; 2012. 186 p.
- Trandafir D, Trandafir V. Osteonecroza maxilarelor indusă de bifosfonaţi: Revista Literaturii. Jurnalul Chir. 2012;8(2):118–30.
- Sivolella S, De Biagi M, Brunello G, Berengo M, Pengo V. Managing dentoalveolar surgical procedures in patients taking new oral anticoagulants. Odontology. 2015;103(3):258–63.
- Patel SV, Khan DA. Adverse Reactions to Biologic Therapy. Immunol Allergy Clin North Am. 2017;37(2):397–412.
- Yoneda T, Hagino H, Sugimoto T, Ohta H, Takahashi S, Soen S, et al. Bisphosphonate-related osteonecrosis of the jaw: Position paper from the Allied task force committee of Japanese society for bone and mineral research, Japan Osteoporosis Society, Japanese Society of Periodontology, Japanese Society for Oral and Maxillofacial Radiology, and Japanese Society of Oral and Maxillofacial Surgeons. J Bone Miner Metab. 2010;28(4):365–83.
- Smith CH, Jabbar-Lopez ZK, Yiu ZZ, Bale T, Burden AD, Coates LC, et al. British Association of Dermatologists guidelines for biologic therapy for psoriasis 2017. Br J Dermatol. 2017;177(3):628–36.
- Holroyd CR, Seth R, Bukhari M, Malaviya A, Holmes C, Curtis E, et al. The British Society for Rheumatology biologic DMARD safety guidelines in inflammatory arthritis. Rheumatology (Oxford). 2019;58(2):e3–42.
Articole din ediţiile anterioare
Psoriazisul vulgar – o boală multisistemică
Psoriazisul este o afecţiune cronică inflamatorie, mediată imun, cu manifestări cutanate şi sistemice în evoluţie, având un impact negativ asupra c...
Efectele secundare posibile ale tratamentului cu bifosfonaţi la pacientele cu osteoporoză post-menopauză: dereglarea homeostaziei osoase şi osteonecroza de mandibulă
Odată cu creşterea speranţei de viaţă, patologia osteoporotică a devenit extrem de frecventă. Riscul crescut de fractură a determinat un interes ...
Monitorizarea interdisciplinară a pacientului cu astm bronşic
Astmul bronşic este caracterizat de inflamaţia cronică a căilor aeriene, asociată cu obstrucţie variabilă ce limitează fluxul de aer şi hiperreacti...
Efectele tratamentului cu bifosfonaţi asupra remodelării microarhitecturii corticale osoase la pacientele cu osteoporoză post-menopauză – cercetări morfologice, clinice şi experimentale
inamica remodelării microarhitecturii osoase corticale este evidenţiată cu acurateţe prin utilizarea spectrelor de absorbţie în infraroşu, oferind ...