The experiments were performed on five piglets of Vietnamese race, who have the ability to become mature at 4 months and grow up to a mass of 50-60 kg. The interventions were performed after the administration of narcotic drugs such as Calypsol® and Sedalgin®, and a local anesthesia with lidocaine. Testing the plastic material was performed by shaping bone defect on the parietal bone of the left. The right parietal bone remained intact in order to be used for comparison. The autopsy for morphological research was done one month after surgery in two pigs, after three months in two pigs, and after six months in one piggy. Conclusions. 1) Osteomatrix forte autogenous graft is a biocompatible material with osteoconductive and osteoinductive capacities, which is subject to moderate resorption that stimulates tissue regeneration up to full substitution with organospecific matured bone tissue. 2) The autogenous graft partially demineralized becomes elastic, and during reconstructive surgery is suitable for modeling according to the contour of the recipient cavity.
Argumentarea experimentală a posibilităţii utilizării grefelor osoase autogene cu proprietăţi osteoinductive în otochirurgia reconstructivă
Experimental argumentation of the possibility of using autogenous bone grafts with osteoinductive properties in reconstructive ear surgery
First published: 24 septembrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Orl.40.3.2018.1936
Abstract
Rezumat
Experimentele au fost efectuate pe cinci purcei de rasă vietnameză, care au capacitatea de a deveni maturi la 4 luni şi cresc până la o masă de 50-60 de kilograme. Intervenţiile s-au realizat după aplicarea narcoticelor Calypsol® şi Sedalgin®, efectuând şi o anestezie locală cu lidocaină. Testarea materialului plastic s-a efectuat prin modelarea defectului osos pe osul parietal din stânga. Din dreapta, osul parietal rămânea intact, cu scopul de a fi utilizat pentru comparare. Autopsia pentru cercetări morfologice s-a făcut după o lună de la operaţie la doi purceluşi, peste trei luni la doi purceluşi şi peste şase luni la un purceluş. Concluzii. 1) Grefa autogenă Osteomatrix forte este un material biocompatibil, care are capacităţi osteoconductive şi osteoinductive, se supune resorbţiei moderate prin care ghidează şi stimulează regenerarea ţesuturilor până la substituirea completă cu ţesut osos maturizat organospecific. 2) Grefa autogenă parţial demineralizată devine elastică şi, în timpul operaţiei reconstructive, este convenabilă pentru modelare în conformitate cu conturul lojei recipientului.
Experimentele chirurgicale au fost efectuate la Catedra Anatomie topografică şi chirurgie operatorie a Universităţii de Stat de Medicină şi Farmacie „Nicolae Testemiţanu” din Chişinău pe cinci purcei de rasă vietnameză, care au capacitatea de a deveni maturi la 4 luni şi cresc până la o masă de 50-60 de kilograme. Majoritatea comunităţilor universitare din lume consideră această specie de purcei drept animale de laborator relevante pentru cercetări în domeniul medicinei.
Intervenţiile s-au realizat după aplicarea narcoticelor Calypsol® şi Sedalgin®, efectuând şi o anestezie locală cu lidocaină, în conformitate cu regulile efectuării cercetărilor medico-biologice pe animale şi în concordanţă cu cerinţele Comitetului de etică (proces-verbal nr. 34 din 25.03.2009).
Testarea materialului plastic s-a efectuat prin modelarea defectului osos pe suprafaţa bolţii craniului, anume pe osul parietal din stânga. Din dreapta, osul parietal rămânea intact, cu scopul de a fi utilizat pentru comparare.
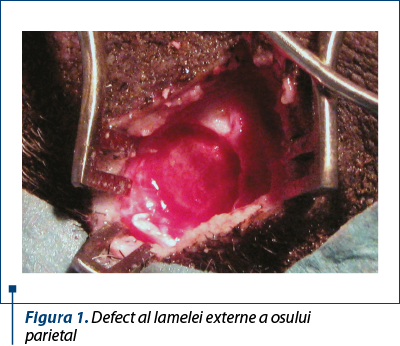
S-a efectuat stratificat incizia pielii, a ţesutului subcutanat adipos, a aponevrozei epicraniene şi a periostului, pentru denudarea osului. Pe suprafaţa osului parietal s-a efectuat osteotomie circulară cu o freză de 10 mm diametru, până la stratul diploic. Lamela externă a osului parietal, datorită formei tubulare a frezei, se extirpa în întregime ca un fragment osos rotund, cu diametru de 9 mm şi grosimea de 2 mm (figura 2). Plaga, după o hemostază minuţioasă, s-a suturat strat cu strat.
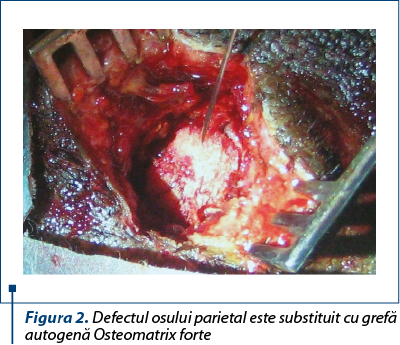
Grefa autogenă a fost expediată imediat după prelevare la Laboratorul de inginerie tisulară şi transplant celular al Universităţii de Stat de Medicină şi Farmacie „Nicolae Testemiţanu”, unde, în primul rând, a fost prelucrată cu formaldehidă de 0,5% pentru blocarea activităţii proteinelor. În al doilea rând, grefa a fost prelucrată cu acid clorhidric 0,6 n pentru a elibera parţial matricea osoasă de minerale şi a obţine un material elastic uşor modelabil în timpul operaţiei plastice-reconstructive. Totodată, procesul de demineralizare ameliorează capacităţile osteoinductive ale grefei, deoarece contribuie la contactul proteinelor lui cu celulele patului recipient. În final, pentru detoxificare de formol şi acid, grefa este prelucrată în soluţii de trisamină, etildeamintetraacetat, amoniac şi clorură de natriu de 0,9%.
După 48 de ore de la prelevare, grefa prelucrată a fost replantată în patul său iniţial, devenind după origine grefă autogenă ortotopică, dar prelucrată cu scop de a îmbunătăţi proprietăţile ei osteoconductive şi osteoinductive.
Având în vedere că matricea osoasă a autogrefei în rezultatul demineralizării şi blocajul autolizei obţine capacităţi fiziologice noi – anume, elimină mai uşor proteine morfoinductive şi este pătrunsă mai forţat de către regeneratul osos nou format –, grefa prelucrată este numită „Osteomatrix forte”.
După operaţia intramusculară, au fost administrate antibiotice (cefalosporină, tetraciclină). Postoperatoriu, animalele au fost îngrijite şi supravegheate în cadrul gospodăriei „Animale exotice” din satul Bardar, Hânceşti.
Autopsia pentru cercetări morfologice s-a făcut la o lună după operaţie la doi purceluşi, peste trei luni la doi purceluşi şi peste şase luni la un purceluş.
Rezultatul postoperatoriu a fost evaluat prin metode histologice. Osul parietal a fost rezecţionat din bolta craniului, eliberat de ţesuturi moi care nu prezentau interes şi despicat în două jumătăţi. Pentru cercetări histologice, piesele anatomice au fost fixate în soluţie de formol neutralizat de 10%. Din locul defectului au fost secţionate fragmente respective care, ulterior, au fost decalcifiate în soluţie de acid azotic de 15% şi au fost plasate în parafină. Cu microtomul au fost făcute secţiuni histologice de 7-10 microni în grosime şi au fost colorate cu hematoxilină-eozină şi picrofuxină, după procedeul Van-Ghizon. Secţiunile histologice au fost realizate în cadrul Departamentului de morfopatologie al Institutului Naţional de Medicină de Urgenţă. În total au fost analizate 35 de secţiuni histologice.
Descrierea rezultatelor
Rezultatele sunt redate în ansamblu, şi nu sub formă de procese-verbale, totodată menţionându-se abaterile observate.
La toate animalele, plaga s-a cicatrizat din prima încercare. Edemul postoperatoriu a dispărut la finele primei săptămâni după intervenţia de replantare.
Rezultate macro- şi microscopice
Macroscopic
La o lună după operaţie, locul plastiei poate fi observat ca fiind mai întunecat şi înălţat. Periostul este hipertrofiat şi puternic vascularizat din ţesuturile adiacente.
Peste 3 luni, locul plastiei rămâne întunecat şi hipertrofiat, dar mai mic în volum comparativ ca la o lună.
Peste 6 luni, osul compact pe suprafaţa osului parietal nu are niciun semn de intervenţie.
Microscopic
La o lună după operaţie, periostul deasupra grefei este îngroşat. Sub periost se determină ţesut conjunctiv lax, multe vase sangvine, focare de osteogeneză şi trabeculi osteoizi. Marginea grefei este înconjurată de ţesut conjunctiv lax, cu multe vase sangvine care pătrund în spaţiile intratrabeculare (figura 3).
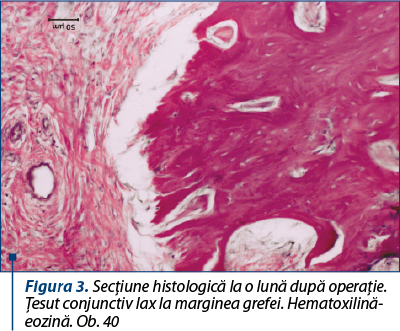
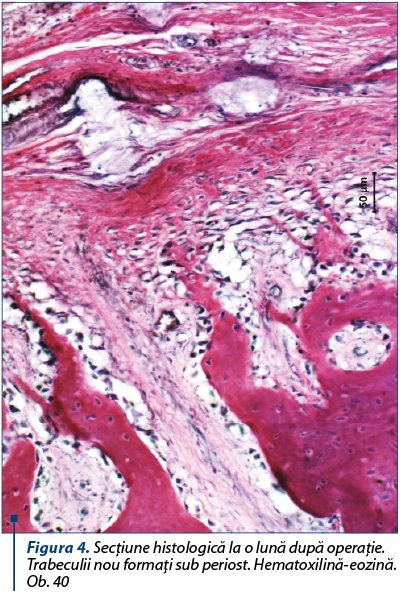
Osteoblastele cu activitate sporită, cu nuclee mari şi întunecate, aşezate în palisadă, se văd pe trabeculi la marginea defectului. Focare noi de osteogeneză se determină pe toată suprafaţa grefei. Grefa are o coloraţie palidă, căsuţele osteocitelor deşarte şi marginea dezmembrată. Suprafaţa inferioară a grefei repetă structura spongioasă a substanţei diploice, iar trabeculii nou formaţi pătrund între trabeculii neviabili ai grefei, care sunt înconjuraţi de limfocite, au o coloraţie mai palidă, dar nu sunt demarcaţi de ţesuturile recipientului. Sub periost creşte abundent ţesut osos neregulat, iar trabeculii şi osteocitele sunt gram colorate (figura 4).
Peste 3 luni, grefa este mult mai dezmembrată. În grefă pătrunde ţesut conjunctiv, cu fibre neregulat orientate, cu multe vase sangvine şi trabeculi osoşi tineri, aşezaţi mai compact la marginea defectului (figura 5).
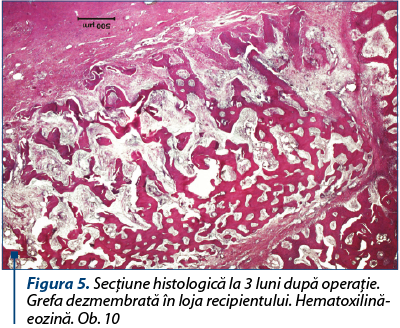
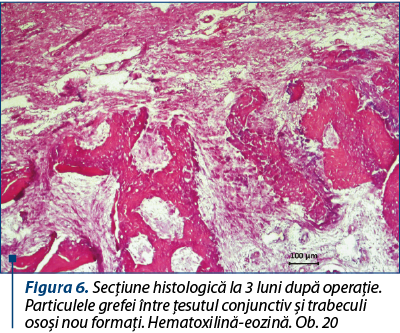
Grefa, în majoritatea sa, este substituită de ţesut osos reticulofibros în care se văd şi focare de formare a osteoanelor, cu lamele aşezate regulat circular. Dimpotrivă, ele constituie partea componentă a procesului de regenerare a ţesutului osos, fiind încadrate în ţesutul conjunctiv sau în travee osoase nou formate. În tot câmpul de vedere se găsesc osteoblaste mononucleare şi osteoclaste multinucleare cu citoplasma bazofilă intens colorată şi nucleele contrastate întunecate. Particulele de grefă sunt colorate mai palid, dar, în consecinţă, sunt puţin schimbate, comparativ cu termenul precedent, şi nu par a fi rejectate sau încapsulate (figura 6).
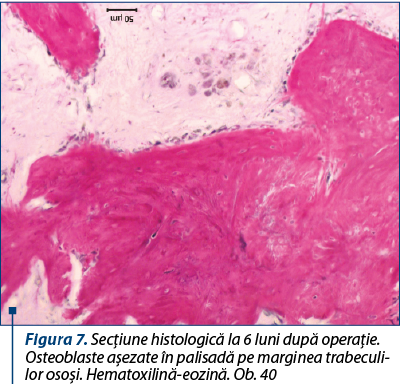
Peste 6 luni, limitele dintre grefă şi loja ei pot fi determinate doar aproximativ. Defectul este ocupat de ţesutul osos reticulofibros orientat neregulat, în care se găsesc unele fragmente ale grefei, osteoclaste singulare sau în grupuri de câte 3-5 la număr şi osteoblaste, de obicei aşezate în palisadă pe marginea trabeculilor osoşi în creştere (figura 7).
La acest termen este şi ţesut osos lamelar, cu tendinţă evidentă de formare a osteonelor noi. Ţesutul osos nou format se deosebeşte de cel bătrân prin coloraţie mai deschisă, osteocitele cu nuclee mari şi restructurarea osului reticulofibros în os lamelar (figura 8).

Discuţia rezultatelor obţinute
Dezvoltarea vertiginoasă a translantologiei clinice a scris adevărate pagini de succes în evoluţia şi progresul chirurgiei plastice. Cu toate acestea, în caz de necesitate se va efectua plastia defectelor osoase sau augmentarea ţesutului osos. Astfel, apare problema folosirii materialelor osteoplastice. Soluţionarea acestei probleme iese din limitele clinicii şi se referă la mecanismele morfogenezei, procesele de regenerare reparatorie şi, în fine, la rezolvarea problemelor aplicative ale chirurgiei plastice şi reconstructive(1,4,5).
Elaborarea şi crearea materialelor bioplastice noi, care au capacitatea de a stimula procesul de regenerare reparatorie şi, prin urmare, de a majora eficacitatea intervenţiilor chirurgicale reconstructive, constituie o direcţie de mare perspectivă în chirurgia contemporană.
În privinţa acestui aspect, cercetările orientate spre descoperirea mecanismelor morfogenezei şi regenerării se bucură de un real succes. Deja se ştie că în matricea intercelulară a ţesuturilor există proteine inductoare care iniţiază regenerarea reparatorie. Graţie efortului câtorva generaţii de cercetători, astăzi sunt studiate principiile de bază ale procesului de reparare a ţesuturilor afectate. Este elaborată legislaţia generală privind regenerarea, care afirmă că schimbarea capacităţilor reparatorii depinde de condiţiile mediului local în loja recipientului. Sunt formulate principiile de bază ale procesului de reparare: se desfăşoară în stadii, este organospecific şi depinde de ereditate. Sunt demonstrate metodele sau mecanismele de regenerare: morfolaxisul – reconstrucţia, dediferenţierea şi reorganizarea celulelor şi ţesuturilor; epimorfoza – proliferarea celulelor şi creşterea ţesutului din plagă; hipertrofia regenerativă – hiperplazia şi hipertrofia porţiunii restante a organului; regenerarea prin inducţie, la baza căreia stă mecanismul de stimulare a procesului de regenerare reparatorie cu factori specifici sau nespecifici(3,6,10).
În privinţa aspectului aplicativ, mecanismul de inducţie prezintă interes deoarece permite activarea regenerării reparatorii în cazul când ea este dereglată sau, în genere, stopată. În acest caz, atrag atenţia materialele plastice de origine biologică, şi anume din ţesut osos. Fiind de structură fibroasă colagenoasă, având o arhitectonică de carcasă naturală, aceste materiale sunt, în primul rând, conductoare ideale pentru pătrunderea regeneratului în direcţia programată, iar în al doilea rând, păstrează şi capacitatea nativă de osteoinducţie.
Referitor la ţesutul osos, se ştie că matricea osoasă conţine un set de proteine morfogenetice specific osteoinductive, care, la nevoie, se includ imediat în procesul de restabilire a osului prin iniţierea diferenţierii şi proliferării celulelor stem preosteogene. Totodată, rămâne nesoluţionată problema privind care materiale cunoscute sunt optime pentru utilizarea în repararea defectelor osoase şi augmentarea ţesutului osos(2,7,8,14,15).
Dispunând de multe tipuri de biomateriale plastice şi în pofida descrierii detaliate a diverselor forme ale procesului de regenerare şi identificare a factorilor de creştere, o teorie unică de reglare a restabilirii ţesuturilor afectate încă nu există.
Cercetătorii sunt permanent în impas din cauza întrebărilor: care substanţe sau care factori iniţiază procesul de regenerare? Ce semnalizează necesitatea finalizării acestui proces pentru a nu evolua în tumori? Care sunt relaţiile reciproce dintre substanţele de stimulare şi inhibiţie şi celulele lojei de reparaţie(9,18)? Un lucru este cert: descoperirea mecanismelor şi a surselor de regenerare reparatorie constituie o problemă nu numai a medicinei teoretice.
Astăzi, cercetările ştiinţifice fundamentale continuă cu investigaţii practice aplicative, inclusiv cu cele de testare directă, aşa-numite probe biologice pe animale de laborator, utilizând modele experimentale care permit extrapolarea rezultatelor la necesităţile clinicilor medicale.
Secvenţele relatate sunt şi o argumentare teoretică a experimentelor chirurgicale, care par a fi pur empirice. Experimentele efectuate constituie o probă biologică, nu mecanică, şi sunt bazate pe date fundamentale din domeniile medicinei şi biologiei.
În acest capitol este analizat un biomaterial plastic: grefa autogenă prelucrată, dar nu proaspătă şi nu păstrată congelată timp îndelungat.
Grefa autogenă se produce din os compact, a cărui matrice intercelulară este mult mai bogată în proteine osteoinductive, comparativ cu osul spongios. Procedeul principal de prelucrare este demineralizarea ţesutului osos cu acid clorhidric şi fixarea proteinelor cu formaldehidă. În rezultatul prelucrării, materialul devine steril şi obţine capacităţi osteoconductive, precum şi osteoinductive. Având în vedere că matricea osoasă conţine partea organică a osului, se presupune că poate provoca o reacţie antigenică de rejectare şi că pot fi transmise şi unele boli infecţioase, cauzate de virusuri sau bacterii. Dar este bine cunoscut faptul că prelucrarea cu acid clorhidric şi aldehide inactivează microorganismele. Totodată, experienţa Băncii de Ţesuturi şi Celule umane din Republica Moldova, pe parcursul a mai mult de 50 de ani, şi datele bibliografice confirmă că nu are loc infectarea recipientului din cauza biomaterialului plastic demineralizat sau formalinizat(17,19,20,21).
Secţiunile histologice confirmă că grefa autogenă este biocompatibilă şi are o citotoxicitate joasă. Grefa este integrată în ţesut conjunctiv sau în ţesut osos nou formate şi provoacă o cascadă de evenimente celulare din partea lojei recipientului.
După modelarea cheagului de sânge, grefa autogenă este înconjurată de ţesut conjunctiv lax bogat de capilare sangvine, care înaintează între fibrele colagene. Fibrocitele se înmulţesc şi se diferenţiază în osteoblaste şi osteoclaste. Limfocitele apar în toate câmpurile de vedere, dar nu se adună în mai multe rânduri, ceea ce ne permite să concluzionăm că nu este o reacţie patogenică. Putem considera că are loc osteogeneza desmală, trecând prin toate etapele de modificare a ţesuturilor pentru a obţine forma definitivă.
Pe parcursul modificărilor tisulare, grefa rămâne integrată în regeneratul nou format, dar se supune resorbţiei cu participarea osteoclastelor şi se substituie cu ţesut osteoid neordonat. Apoi, apar primele sisteme osteonice, care au o viaţă tranzitorie, fiind lizate de către osteoclaste şi înlocuite de sisteme osteonice maturizate, cu o arhitectonică de lamele osoase, aşezate deja nu haotic, dar paralel circular cu un canal haversian clasic în centru.
În ceea ce priveşte rezultatul restructurărilor respective de maturizare a regeneratului osos, pe suprafaţa osului parietal, în regiunea defectului, se formează o placă de os compact.
Capacităţile osteoinductive ale grefei autogene prelucrate pot fi explicate prin păstrarea în componenţa matricei osoase a unei familii întregi de proteine morfogenetice osteoinductive. Prima proteină osteoinductivă a fost descoperită de M. Urist în 1965(22,23). În ultimii ani s-a dovedit că există mai multe proteine cu astfel de proprietăţi. Unele dintre ele nu sunt morfogenetice, ci doar promovează activitatea proteinelor osteoinductive(24).
Toate aceste proteine, după componenţa lor chimică, sunt glicozaminoglicane sulfatate, produse de osteoblaste şi osteocite. De componenţa lor calitativă şi cantitativă depind direcţia diferenţierii celulelor preosteogene şi modificarea ţesutului osos nou format(9).
În încheiere, putem considera că osteogeneza reparatorie în teritoriul defectului produs experimental pe suprafaţa osului parietal este reglată de mecanismele genetice şi, totodată, este promovată de proteine osteoinductive care se eliberează din grefa autogenă pe parcursul absorbţiei. Fiind organică şi autogenă, de origine, grefa se prezintă, la fel, ca o carcasă osteoconductivă pentru formarea regeneratului osos, dar, totodată, se atestă şi capacităţi osteoinductive, stimulând mai activ procesul de osteogeneză.
Concluzii
1. Grefa autogenă Osteomatrix forte este un material biocompatibil, care manifestă capacităţi osteoconductive şi osteoinductive, se supune resorbţiei moderate prin care ghidează şi stimulează regenerarea ţesuturilor, până la substituirea completă cu ţesut osos maturizat organospecific.
2. Grefa autogenă parţial demineralizată devine elastică şi, în timpul operaţiei reconstructive, este convenabilă pentru modelare în conformitate cu conturul lojei recipientului.
Conflict of interests: The author declares no conflict of interests.
Bibliografie
- Araújo MG, Linder E, Lindhe J. Bio-Oss® Collagen in the buccal gap at immediate implants: a 6-month study in the dog. Clinical Oral Implants Research. 2011;22(1):1-8.
- Bernhardt A, Lode A, Peters F, et al. Novel ceramic bone replacement material Osbone® in a comparative in vitro study with osteoblasts. Clinical Oral Implants. Research. 2011;22(6):651-657.
- Busenlechner D, Tangl S, Arnhart C, et al. Resorption of deproteinized bovine bone mineral in a porcine calvaria augmentation model. Clinical Oral Implants Research. 2012;23(1):95-99.
- Caneva M, Botticelli D, Pantani F, et al. Deproteinized bovine bone mineral in marginal defects at implants installed immediately into extraction sockets: an experimental study in dogs. Clinical Oral Implants Research. 2012;23(1):106-112.
- Chackartchi T, Iezzi G, Goldstein M, et al. Sinus floor augmentation using large (1-2 mm) or small (0.25-1 mm) bovine bone mineral particles: a prospective, intraindividual controlled clinical, micro-computerized tomography and histomorphometric study. Clinical Oral Implants Research. 2011;22(5):473-480.
- Donos N, Graziani F, Mardas N, et al. The use of human hypertrophic chondrocytes-derived extracellular matrix for the treatment of critical-size calvarial defects. Clinical Oral Implants Research. 2011;22(12):1346-1353.
- Friedlaender GE, Perry CR, Cole JD, et al. Osteogenic protein-1 (bone morphogenetic protein-7) in the treatment of tibial nonunions. J Bone Joint Surg Am. 2001;83(suppl 1, pt 2:S151).
- Geesink RG, Hoefnagels NH, Bulstra SK. Osteogenic activity of OP-1 bone morphogenetic protein (BMP-7) in a human fibular defect. J Bone Joint Surg Br. 1999;81:710.
- Gerstenfeld LC, Cho TJ, Kon T, et al. Impaired intramembranous bone formation during bone repair in the absence of tumor necrosis factor-alpha signaling. Cells Tissues Organs. 2001;169:285.
- Govender S, Csimma C, Genant HK, et al. BMP-2 Evaluation in Surgery for Tibial Trauma (BESTT) Study Group. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures: a prospective, controlled, randomized study of four hundred and fifty patients. J Bone Joint Surg Am. 2002;84:2123.
- Jensen T, Schou S, Stavropoulos A, et al. Maxillary sinus floor augmentation with Bio-Oss or Bio-Oss mixed with autogenous bone as graft: a systematic review. Clinical Oral Implants Research. 2012;23(3):263-273.
- LeGeros RZ. Properties of osteoconductive biomaterials: calcium phosphates. Clin Orthop. 2002;395:81.
- Liu O, Douglas T, Zamponi C, et al. Comparison of in vitro biocompatibility of NanoBone® and BioOss® for human osteoblasts. Clinical Oral Implants Research. 2011;22(11):1259-1264.
- Ramazanoglu M, Lutz R, Ergun C, et al. The effect of combined delivery of recombinant human bone morphogenetic protein-2 and recombinant human vascular endothelial growth factor 165 from biomimetic calcium-phosphate-coated implants on osseointegration. Clinical Oral Implants Research. 2011;22(12):1433-1439.
- Ramírez-Fernández MP, Calvo-Guirado JL, Delgado-Ruiz RA, et al. Experimental model of bone response to xenografts of bovine origin (Endobon®): a radiological and histomorphometric study. Clinical Oral Implants Research. 2011;22(7):727-734.
- Ramírez-Fernández MP, Calvo-Guirado JL, Delgado-Ruiz RA, et al. Bone response to hydroxyapatites with open porosity of animal origin (porcine [OsteoBiol®mp3] and bovine [Endobon®]): a radiological and histomorphometric study. Clinical Oral Implants Research. 2011;22:767-773.
- Riecke B, Heiland M, Hothan A, et al. Primary implant stability after maxillary sinus augmentation with autogenous mesenchymal stem cells: a biomechanical evaluation in rabbits. Clinical Oral Implants Research. 2011;22(11):1242-1246.
- Riedel GE, Valentin-Opran A. Clinical evaluation of rhBMP-2/ACS in orthopedic trauma: a progress report. Orthopedics. 1999;22:663.
- Rosano G, Taschieri S, Gaudy J-F, et al. Maxillary sinus vascular anatomy and its relation to sinus lift surgery. Clinical Oral Implants Research. 2011;22(7):711-715.
- Topor B. Materiale plastice combinate din matrice osoasă şi ţesuturi embrionare (cercetare experimentală clinică în ortopedie, traumatologie şi chirurgie). Teza de doctor habilitat. Moscova. 1991;354.
- Trombelli L, Franceschetti G, Rizzi A, et al. Minimally invasive transcrestal sinus floor elevation with graft biomaterials. A randomized clinical trial. Clinical Oral Implants Research. 2012;23(4):424-432.
- Urist MR. Bone: formation by autoinduction. Science. 1965;150:893-899.
- Urist MR, Strates BS. Bone morphogenetic protein. J. Dent. Res. 1971;50(6):1392-1406.
- Yamada M, Kojima N, Att W, et al. Improvement in the osteoblastic cellular response to a commercial collagen membrane and demineralized freeze-dried bone by an amino acid derivative: an in vitro study. Clinical Oral Implants Research. 2011;22(2):165-172.