The cloacal – bladder extrophy – epispadias complex is the most severe form of all renal, urinary and genital abnormalities, affecting the abdominal wall, pelvis, all the urinary tract, genital organs, and sometimes the spine and anus. The etiopathogenesis of these malformations is not completely elucidated, the causes of their appearance being multifactorial. Although most cases of extrophy are isolated anomalies, there are certain gene mutations inherited from healthy parents that contribute as modifiers or promoters in the plurifactorial process of occurrence of this spectrum of abnormalities. The incidence of the classic bladder extrophy is 1/37,000, with a slight male predominance. These anomalies have a profound impact on continence, renal and sexual functions, on the cosmetic aspect and implicitly on the psychosocial and psychosexual development of the patient. Parents initially, but especially children and later adolescents with such malformations will need an individualized approach from a multidisciplinary team, throughout the course of such cases.
Extrofia de vezică, o malformaţie rară, cu implicaţii deosebite asupra pacientului pediatric şi a viitorului adult – aspecte clinico-epidemiologice
Bladder extrophy, a rare abnormality with a profound impact on the pediatric patient and the future adult – clinico-epidemiological aspects
First published: 18 decembrie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.56.4.2019.2794
Abstract
Rezumat
Complexul cloacă – extrofie de vezică – epispadias este cea mai severă formă dintre toate anomaliile renale şi ale tractului urogenital, interesând peretele abdominal, pelvisul, tot tractul urinar, organele genitale şi uneori coloana vertebrală şi anusul. Etiopatogeneza acestor malformaţii nu este complet elucidată, cauzele apariţiei fiind plurifactoriale. Deşi majoritatea cazurilor de extrofie sunt anomalii izolate, există anumite mutaţii genice moştenite de la părinţii sănătoşi care contribuie în calitate de modificatori sau promotori în procesul plurifactorial de apariţie a acestui spectru de anomalii. Incidenţa clasicei extrofii de vezică este de 1/37000, cu o uşoară preponderenţă masculină. Aceste anomalii au un impact profund asupra continenţei, a funcţiei renale şi sexuale, a aspectului cosmetic şi, implicit, asupra dezvoltării psihosociale şi psihosexuale a pacientului. Iniţial părinţii, dar mai ales copiii şi ulterior adolescenţii cu asemenea tip de malformaţii vor necesita o abordare individualizată din partea unei echipe pluridisciplinare de-a lungul evoluţiei unor asemenea cazuri.
Introducere
Malformaţiile congenitale reprezintă o cauză principală de morbiditate şi mortalitate neonatală în toate ţările lumii şi, în ciuda evoluţiei pe plan ştiinţific a ramurilor biomedicale, se pare că incidenţa lor este în creştere(1). Spectrul de anomalii ce includ clasica extrofie de vezică şi epispadias a fost unanim denumit complex extrofie de vezică – epispadias (CEE)(2). CEE poate apărea sub diverse forme, în funcţie de gravitate, de la epispadiasul simplu distal sau proximal şi până la clasica extrofie de vezică, anomalii cu impact profund asupra continenţei, a funcţiei renale şi sexuale, a aspectului cosmetic şi, implicit, a dezvoltării psihosociale şi psihosexuale a pacientului(3). Iniţial părinţii, dar mai ales copiii şi ulterior adolescenţii cu asemenea tip de malformaţii vor necesita o abordare individualizată din partea unei echipe pluridisciplinare de-a lungul întregii evoluţii a unor asemenea cazuri.
Istoric
Extrofia de vezică a fost descrisă pentru prima dată de medicul german Johann Schenck von Grafenberg, în anul 1595 (sau chiar mai devreme, în 1583), şi mai târziu de John Wood, în 1869(4). În cadrul Universităţii din Amsterdam (Olanda), există Muzeul Vrolich, fondat de către Gerardus Vrolich (1775-1859) şi de fiul său, Willem Vrolich (1801-1863), unde este păstrată o colecţie impresionantă de specimene reprezentând malformaţii congenitale ale peretelui abdominal anterior, printre care şi un pelvis mumificat al unui băieţel de aproximativ 6 ani cu diastazis important al oaselor pubiene şi cu extrofie de vezică(4,5). Termenul „extrofie” este derivat din cuvântul grecesc „ekstriphein”, care înseamnă „dinăuntru în afară”, şi a fost utilizat pentru prima dată de către Chaussier, în 1780(6).
Aspecte embriologice
Complexul cloacă – extrofie de vezică – epispadias (CCEE) este cea mai severă formă dintre toate anomaliile renale şi ale tractului urogenital, interesând peretele abdominal, pelvisul, tot tractul urinar, organele genitale şi uneori coloana vertebrală şi anusul. Din CCEE fac parte epispadiasul (forma cea mai uşoară), extrofia de vezică, forma clasică, cea mai frecventă (60%), şi extrofia cloacală – forma cea mai severă (10%). Etiopatogeneza acestor malformaţii nu este complet elucidată. Dezvoltarea precoce a membranei cloacale în săptămâna a patra de gestaţie inhibă migrarea celulelor mezodermale între straturile endodermice şi ectodermice şi rezultă în anomalii de dezvoltare a peretelui abdominal inferior şi a pelvisului. Migrarea anormală a stratului mezodermal în săptămânile 5-8 de gestaţie duce la ruptura prematură a membranei cloacale, o structură tranzitorie alcătuită din ectoderm şi endoderm, care acoperă cloaca în timpul vieţii intrauterine. Momentul exact al acestei rupturi determină spectrul malformativ ce va rezulta, respectiv extrofie cloacală, extrofie de vezică sau doar epispadias(1,7).
Aspecte histologice
Studii histologice au demonstrat că modificările existente la nivelul peretelui vezical nu sunt atât de grave încât să justifice îndepărtarea plăcii vezicale la pacienţii cu extrofie vezicală. În peretele vezicii urinare extrofice există un raport crescut al matricei extracelulare versus cantitate musculară şi în mod particular o cantitate crescută de colagen de tip III, dar normalizarea acestor rapoarte după închiderea plăcii vezicale demonstrează că acestea sunt modificări datorate imaturităţii(8). Aşadar, placa vezicală este imatură din punct de vedere histologic, cu mai puţine fibre nervoase mielinizate decât în mod normal. Totuşi, studii urodinamice efectuate pe vezici urinare extrofice reconstruite demonstrează capacitatea acestora de a se umple şi goli în mod regulat(9). Studii recente au evidenţiat o distribuţie anormală şi o densitate crescută a receptorilor muscarinici M3 în cadrul complexului extrofie-epispadias, explicând anomaliile de contractilitate precum spasmul vezical(10). Ureterele abordează vezica urinară dintr-un unghi anormal, rezultând reflux vezico-ureteral la toţi pacienţii cu extrofie vezicală sau cloacală după reconstrucţie, necesitând reimplantare uretero-vezicală la momentul închiderii primare a plăcii vezicale, al reconstrucţiei colului vezical sau al augmentării vezicale. În plus faţă de modificările produse de refluxul vezico-ureteral, tractul urinar superior este malformat la aproximativ o treime dintre pacienţii cu CCEE şi în special la cei cu extrofie cloacală, respectiv obstrucţie pieloureterală, rinichi în potcoavă, ectopie renală(11).
Incidenţă şi distribuţie pe sexe
Incidenţa globală la naştere în cazul CCEE în populaţia europeană este de 1/10000, iar calculată pe subtipuri, incidenţa la naştere (inclusiv cazurile avortate) este de 1/117000 pentru băieţi şi de 1/484000 pentru fete în cazul epispadiasului, 1/37000 pentru clasica extrofie de vezică (între 1/30000 şi 1/50000) şi de 1/200000-400000 de nou-născuţi în cazul extrofiilor cloacale(12,13). Datele din Registrul internaţional al malformaţiilor congenitale arată o incidenţă de 3,3/100000 de nou-născuţi în cazul extrofiei de vezică(14). Deşi o proporţie importantă a femeilor cu epispadias rămân nediagnosticate, totuşi o preponderenţă masculină în jur de 1,4/1 poate fi luată în considerare. Pentru extrofia de vezică, predominanţa masculină poate varia de la 1,5/1 până la 6/1, în funcţie de diverse raportări, cu o medie de 2,4/1(15,16). Pentru întreg spectrul CCEE, incidenţa variază în funcţie de etnie şi de expresia fenotipică, dar se pare totuşi că este de două ori mai mare la sexul masculin(17).
Etiologie
În apariţia CCEE nu a putut fi identificat un singur agent teratologic sau factor de mediu, dar studiul lui Reutter şi colab. asupra unei largi cohorte de pacienţi şi a familiilor acestora a relevat că fumatul şi radiaţiile medicale în primul trimestru de sarcină ar putea determina o expresie mai severă a CCEE(17). Sunt incriminate şi vârsta parentală avansată, multiparitatea şi fertilizarea in vitro(18). Raportări izolate incriminează alcoolul sau unele medicamente precum fenobarbitalul, acidul valproic, diazepamul, heparina sau misoprostolul ca fiind factori teratogenici cu rol în apariţia CCEE(11).
Rolul factorilor genetici în apariţia CCEE a putut fi rareori demonstrat, această ipoteză bazându-se pe existenţa unor cazuri familiale, pe asocierea anomaliilor cromozomiale, pe concordanţa incompletă, dar ridicată între gemenii monozigoţi şi riscul ridicat de recurenţă la urmaşi(19). Au fost raportate peste 30 de familii cu mai mulţi membri afectaţi(4,20). Riscul de apariţie a extrofiei de vezică la gemenii monozigoţi este de 5,6 ori mai mare decât la gemenii dizigoţi, iar prezenţa unei rude afectate creşte la 1/100 riscul de apariţie a malformaţiei(21). Posibilul rol al factorilor genetici implicaţi în expresia CCEE se bazează astfel pe riscul crescut de recurenţă la urmaşii persoanelor afectate. Conform altor studii, printre rude, riscul de recurenţă variază între 0,3% şi 2,3% la părinţii neafectaţi ai pacienţilor cu extrofie de vezică şi este de 400 de ori mai mare decât în populaţia afectată la urmaşii celor afectaţi, respectiv aceştia au un risc de 1,4%(22,23). Implicarea unor factori genetici este demonstrată şi de apariţia familială a câte două sau chiar trei cazuri de extrofie de vezică. Transmiterea pare să fie de tip autozomal dominant, cu penetranţă scăzută, autosomal recesivă sau X-linkată(17). Studii moleculare au evidenţiat existenţa unor microduplicaţii pe cromozomul 22q11.21 şi polimorfismul genei TP63 (tumor protein p63)(24). A fost, de asemenea, descrisă implicarea genei ISL1 în apariţia extrofiei de vezică la rasa umană(25).
Aceste observaţii sugerează că, deşi există o genă implicată cu un efect major asupra expresiei fenotipice, este nevoie şi de acţiunea unor factori de mediu pentru apariţia bolii. Deşi aproximativ 98,5% din cazurile de CCEE prezintă anomalii izolate, există anumite mutaţii genice moştenite de la părinţii sănătoşi, mutaţii care cel puţin contribuie ca modificatori sau promotori în modalitatea de apariţie plurifactorială a acestui spectru de anomalii(3). Eficacitatea acidului folic în prevenirea apariţiei omfalocelului şi defectelor de tub neural, ambele anomalii în cadrul CCEE, a fost demonstrată, dar efectul de prevenire este maxim dacă acidul folic este luat cu trei luni înainte de concepţie şi continuat pe durata primului trimestru de sarcină(26).
Aspecte clinice
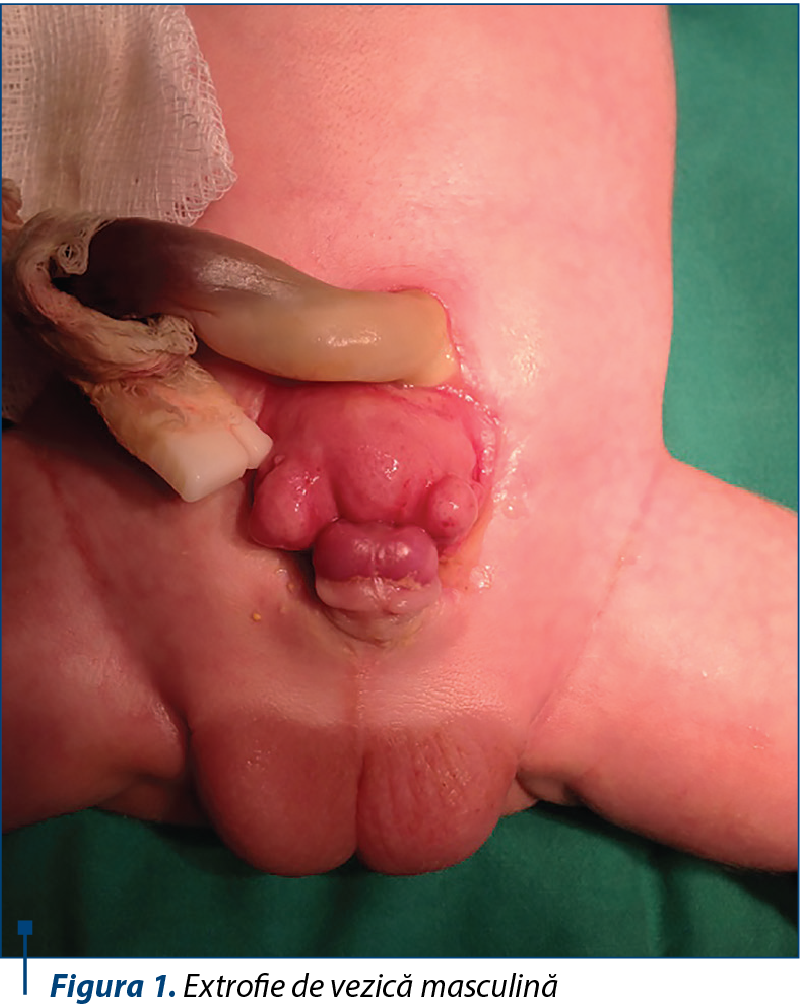
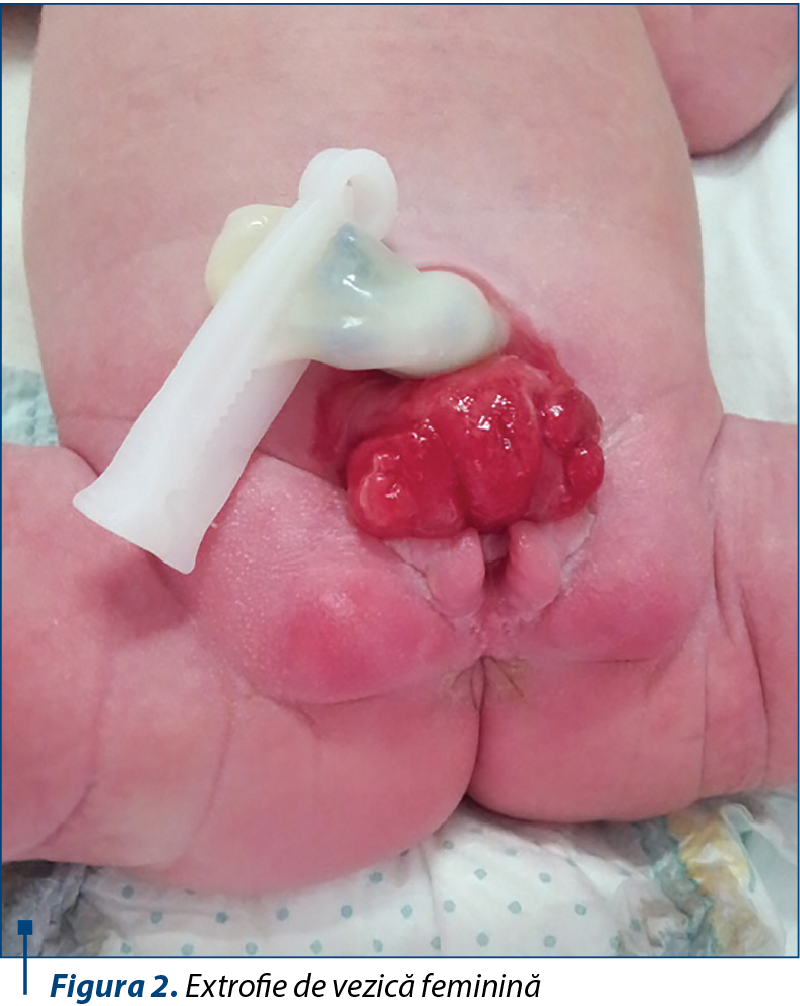
Extrofia de vezică se caracterizează prin absenţa peretelui anterior şi prezenţa la exterior a peretelui posterior al vezicii urinare eversate, astfel încât urina se scurge liber prin orificiile ureterale expuse. Mucoasa vezicală este iritată şi roşie la naştere, uneori are aspect polipoid, şi cu cât se întârzie închiderea plăcii vezicale, cu atât mucoasa se inflamează mai mult şi apar depozite purulente şi ulceraţii. Placa vezicală este delimitată de o zonă de tranziţie cu piele fină lucioasă, care face delimitarea între pielea normală şi zona de metaplazie scuamoasă. Ombilicul este situat jos, iar sub el se pot palpa muşchii drepţi abdominali, divizaţi de o hernie ombilicală. Majoritatea pacienţilor, indiferent de sex, se prezintă şi cu diastazis pubian şi hernie inghinală bilaterală (figura 1). La băieţei, placa uretrală epispadă acoperă faţa dorsală a penisului, ambii corpi cavernoşi fiind situaţi dedesubt, penisul fiind de dimensiuni reduse cu 60% comparativ cu populaţia normală şi curbat dorsal(21). Scurtarea este mai importantă pe seama porţiunii anterioare a penisului şi este cu atât mai mare, cu cât diastazisul pubian este mai mare. În acest sens, osteotomia de bazin efectuată la momentul închiderii plăcii vezicale poate ameliora şi aspectul ulterior al penisului. La examenul clinic atent poate fi vizualizată deschiderea coliculelor seminale şi a ductelor ejaculatorii în zona prostatei. Testiculele de dimensiuni normale pot fi palpate în scrot sau pe traiectul canalului inghinal(11). La fetiţe, clitorisul bifid poate fi observat de o parte şi de alta a plăcii uretrale (figura 2). Perineul este orientat anterior, deschiderea vaginului este îngustă şi anusul antepozat. Vaginul este de calibru normal, dar mai scurt, rar depăşind 5-6 cm lungime. În ciuda problemelor pe termen lung, un studiu retrospectiv a demonstrat că, dintre femeile cu extrofie de vezică care au rămas însărcinate, în condiţiile efectuării de cateterism urinar intermitent (92%) şi cu augmentare vezicală (75%), 78% au născut cu succes prin intervenţie cezariană şi rata avortului spontan a fost de 22%(27).
Anatomia CEE analizată prin studii RMN şi CT este caracterizată de un defect specific la nivelul pelvisului, cu o rotaţie externă anterioară de 18o, o rotaţie externă posterioară de 12o, o scurtare a ramurilor pubiene cu 30%, acetabulumul este retroversat, iar unghiurile sacroiliace sunt lărgite. Comparativ cu populaţia generală, diastazisul pubian are o medie de 4,8 cm, pelvisul este rotat inferior şi sacrumul este lărgit(28,29). Rotaţia externă a piciorului de aproximativ 30o şi mersul legănat, evidente în copilărie, se ameliorează cu vârsta.
La copiii cu extrofie de vezică, anusul este antepozat, situat imediat în spatele diafragmului urogenital, levatorul anal este deplasat posterior, cu un segment anterior slab reprezentat în plan coronal, ceea ce înseamnă un slab suport pentru organele urogenitale, acestea fiind predispuse la prolaps rectal, incontinenţă anală sau prolaps uterin; muşchii obturatori intern şi extern sunt, de asemenea, rotaţi spre exterior(29). Distanţa dintre ombilic şi orificiul anal este întotdeauna scurtată în cadrul acestor anomalii. Modificările anatomice la copiii cu reconstrucţie pelviană şi osteotomie de bazin includ o chingă a levatorilor anali aplatizată şi mai puţin conică decât normal, un diametru al hiatusului levatorilor lărgit în plan coronal şi un unghi al inserţiei levatorilor dublu faţă de normal. În afara anomaliilor sistemului genito-urinar prezente în cadrul extrofiei de vezică, pacienţii pot asocia şi alte anomalii, precum omfalocel, malformaţii anorectale, defecte de tub neural, anomalii scheletale, separate sau împreună în cadrul complexului OEIS (Omfalocel – Extrofie de vezică – anus Imperforat – anomalii Scheletale)(30,31). La copiii cu extrofie de vezică, malformaţiile coloanei vertebrale apar cu o frecvenţă de 7-18%, malformaţiile digestive, în special malformaţii anorectale, se pot regăsi în aproximativ 21% din cazuri, iar 34% dintre copii asociază şi omfalocel(30). Malformaţii cardiace apar la 15% dintre copiii cu extrofie de vezică. Aceste procente demonstrează o dată în plus faptul că, odată depistată o malformaţie congenitală, trebuie căutate şi alte malformaţii congenitale asociate(1).
Conflict of interests: The authors declare no conflict of intersts.
Bibliografie
- Ţarcă Elena, Malformaţii congenitale ale peretelui abdominal anterior. Editura „Gr. T. Popa”, U.M.F. Iaşi, 2016, ISBN 978-606-544-421-8.
- Hyun SJ. Cloacal exstrophy. Neonatal Netw. 2006; 25:101-115.
- von Lowtzow C, Hofmann A, Zhang R, Marsch F, Ebert AK, Rösch W, et al. CNV analysis in 169 patients with bladder exstrophy-epispadias complex. BMC Med Genet. 2016;17:35. Published online 2016 Apr 30. doi: 10.1186/s12881-016-0299-x.
- Ludwig M, Ching B, Reutter H, Boyadjiev SA. The bladder exstrophy-epispadias complex. Birth Defects Res Part A Clin Mol Teratol. 2009; 85(6):509-522.
- Oostra RJ, Baljet B, Verbeeten BW, Hennekam RC. Congenital anomalies in the teratological collection of Museum Vrolik in Amsterdam, The Netherlands. III: Primary field defects, sequences, and other complex anomalies. Am J Med Genet. 1998; 80(1):46-59.
- Gearhart LP, Mathews RI, “Exstrophy-epispadias complex,” in Campbell-Walsh Urology, AJ Wein, LR Kavoussi, AC Novick, AW Partin, and CA Peters, Eds., vol. 4, pp. 3325-3378, Elsevier, Philadelphia, Pa, USA, 10th edition, 2012.
- Muecke EC. The role of the cloacal membrane in exstrophy: the first successful experimental study. J Urol. 1964; 92:659-667.
- Mathews R, Gosling JA, Gearhart JP. Ultrastructure of the bladder in classic exstrophy: correlation with development of continence. J Urol. 2004; 172(4 Pt 1):1446-1449.
- Gearhart JP, Jeffs RD. Management of the failed exstrophy closure. J Urol. 1991;146:610.
- Rösch WH, Hanisch E, Hagemann M, Neuhuber WL. The characteristic innervation pattern of the urinary bladder in particular forms of exstrophy-epispadias-complex. BJU. 2001; 87(Suppl 1):30.
- Ebert AK, Reutter H, Ludwig M, Rosch WH. The exstrophy-epispadias complex. Orphanet J Rare Dis. 2009; 4:23.
- Wiesel A, Queisser-Luft A, Clementi M, Bianca S, Stoll C. Prenatal detection of congenital renal malformations by fetal ultrasonographic examination: an analysis of 709,030 births in 12 European countries. Eur J Med Genet. 2005;48:131-144.
- Pena A, Levitt MA, Hong A, Midulla P. Surgical management of cloacal malformations: a review of 339 patients. J Pediatr Surg. 2004; 39:470-479.
- Lancaster PAL. Epidemiology of bladder exstrophy: a communication from the International Clearinghouse for Birth Defects monitoring systems. Teratology. 1987; 36:221.
- Silver RI, Yang A, Ben-Chaim J et al. Penile length in adulthood after exstrophy reconstruction. J Urol. 1997; 158:999.
- Gambhir L, Höller T, Müller M, Schott G, Vogt H, Detlefsen B, et al. Epidemiological survey of 214 European families with Bladder Exstrophy-Epispadias Complex (BEEC). J Urol. 2008, 179(4):1539-1543.
- Reutter H, Boyadjiev SA, Gambhir L, Ebert AK, Rosch WH, Stein R, et al. Phenotype severity in the bladder exstrophy-epispadias complex: analysis of genetic and nongenetic contributing factors in 441 families from North America and Europe. J Pediatr. 2001; 159(5):825-831.
- Wood HM, Babineau D, Gearhart JP. In vitro fertilization and the cloacal/bladder exstrophy-epispadias complex: a continuing association. J Pediatr Urol. 2007; 3(4):305-310.
- Reutter H, Shapiro E, Gruen JR. Seven new cases of familial isolated bladder exstrophy and epispadias complex (BEEC) and review of the literature. Am J Med Genet A. 2003; 120A(2):215-221.
- Cuckow P. The bladder-exstrophy-epispadias-complex. In: Essentials of Pediatric Urology Volume Chapter 15. 2nd edition. Edited by: Thomas d, Duffy P. London: Informa healthcare; 2008:199-212.
- O’Kelly F, Keefe D, Herschorn S, Lorenzo AJ. Contemporary issues relating to transitional care in bladder exstrophy. Can Urol Assoc J. 2018 Apr; 12(4 Suppl 1):S15–S23. doi: 10.5489/cuaj.5313
- Messelink EJ, Aronson DC, Knuist M, Heij HA, Vos A. Four cases of bladder exstrophy in two families. J Med Genet. 1994; 31:490-492.
- Shapiro E, Lepor H, Jeffs RD: The inheritance of the exstrophy-epispadias complex. J Urol. 1984; 132:308-310.
- Draaken M, Baudisch F, Timmermann B, Kuhl H, Kerick M, et al. Classic bladder exstrophy: Frequent 22q11.21 duplications and definition of a 414 kb phenocritical region. Birth Defects Res Part A Clin Mol Teratol. 2014; 100:512-517.
- Draaken M, Knapp M, Pennimpede T, Schmidt JM, Ebert AK, Rösch W et al. Genome-wide association study and meta-analysis identify ISL1 as genome-wide significant susceptibility gene for bladder exstrophy. PLoS Genet. 2015 Mar 12;11(3):e1005024.
- Van Allen MI, McCourt C, Lee NS. Preconception health: folic acid for the primary prevention of neural tube defects. A resource document for health professionals, 2002. Ottawa, Ontario: Minister of Public Works and Government Services Canada; 2002. (Cat. Number H39-607/ 2002E).
- Dy GW, Willihnganz-Lawson KH, Shnorhavorian M, et al. Successful pregnancy in patients with exstrophy-epispadias complex: A University of Washington experience. J Pediatr Urol. 2015;11:213.e1-6.https://doi.org/10.1016/j.jpurol.2015.04.019.
- Sponseller PD, Bisson LJ, Gearhart JP, Jeffs RD, Magid D, Fishman E. The anatomy of the pelvis in the exstrophy complex. J Bone Joint Surg Am 1995 Feb;77(2):177-189.
- Stec AA, Pannu HK, Tadros YE, Sponseller PD, Fishman EK, Gearhart JP. Pelvic floor anatomy in classical bladder exstrophy by using 3D computerized tomography: initial insights. J Urol. 2001; 166:1444-1449.
- Siffel C, Correa A, Amar E, Bakker MK, Bermejo-Sánchez E, Bianca S et al. Bladder Exstrophy: An Epidemiologic Study From the International Clearinghouse for Birth Defects Surveillance and Research, and an Overview of the Literature. Am J Med Genet C Semin Med Genet. 2011 November 15; 0(4): 321–332. doi:10.1002/ajmg.c.30316.
- Mahfuz I, Darling T, Wilkins S, White S, Cheng W. New insights into the pathogenesis of bladder exstrophy-epispadias complex. J Pediatr Urol. 2013;9(6):996–1005. doi: 10.1016/j.jpurol.2013.05.001.