Renal vein thrombosis is the most frequent unrelated to vascular catheters thrombosis, with the highest incidence in the neonatal period. Risk factors include shock, dehydration, perinatal asphyxia, polycythemia, cyanotic heart disease, sepsis, maternal diabetes, traumatic births. There are few literature data regarding inherited prothrombotic anomalies. We report a premature newborn’s case, 36 weeks gestational age, of thrombophilic mother, who developed in the first 48 hours postnatally jaundice and thrombocytopenia, then hematuria and a mass in the left flank. Doppler ultrasound revealed left renal vein thrombosis. Despite heparin treatment, the thrombotic process extended. Factor V (Leiden) mutation was identified. Conclusions. Although infants with this presentation are typically treated with anticoagulants, there is a lack of evidence-based guidelines. A case-control study is required to investigate whether maternal prothrombotic disorders may be a risk factor for neonatal thrombotic processes.
Tromboză venoasă profundă la un prematur târziu - prezentare de caz
Deep vein thrombosis in a late premature - case presentation
First published: 30 octombrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Peri.1.3.2017.1173
Abstract
Rezumat
Tromboza de venă renală este cea mai frecventă tromboză venoasă nelegată de prezenţa cateterelor vasculare, cu incidenţă crescută în perioada neonatală. Factori de risc sunt şocul, deshidratarea, asfixia perinatală, cardiopatiile congenitale cianogene, sepsisul, policitemia, diabetul matern şi naşterea traumatică. Există puţine date în literatură asupra rolului afecţiunilor protrombotice înnăscute. Prezentăm cazul unui nou-născut prematur (36 de săptămâni de gestaţie), din mamă cu trombofilie, care prezintă la două zile postnatal icter şi trombocitopenie, ulterior hematurie şi masă tumorală la nivelul flancului stâng. Ecografia Doppler decelează tromboză de venă renală stângă. Deşi tratamentul iniţiat a fost cu heparină nefracţionată, procesul trombotic se extinde. Analiza mutaţiilor trombofilice la nou-născut relevă mutaţia factorului V (Leiden). Concluzii. Deşi nou-născuţii cu această afecţiune sunt trataţi cu medicaţie anticoagulantă, nu există recomandări bazate pe dovezi în această direcţie. Sunt necesare studii asupra rolului afecţiunilor protrombotice materne în apariţia proceselor trombotice la nou-născut.
Introducere
Complicaţiile trombotice în perioada neonatală sunt mai frecvente decât în orice altă perioadă a copilăriei; 80% dintre ele apar în prima lună de viaţă(1).Localizarea predilectă a acestora este la nivelul vaselor mari: aortă, venă cavă inferioară, venă portă, venă şi arteră renală, artere femurale, vase cerebrale.
Incidenţa evenimentelor trombotice în perioada neonatală este apreciată la 5 cazuri la 100000 de nou-născuţi vii şi peste 40% dintre acestea interesează venele renale(1).
Tromboza de venă renală este o afecţiune multifactorială, de departe cea mai frecventă formă de manifestare a complicaţiilor trombotice în perioada neonatală. Este cea mai comună formă de tromboză venoasă nelegată de prezenţa cateterelor vasculare.
Deşi cu mortalitate redusă, generează complicaţii severe, cu afectarea funcţiei renale şi uneori prognostic rezervat.
Incidenţa trombozei de venă renală este de 2,2-5 cazuri la 100000 de nou-născuţi vii(2).
Este bine cunoscut faptul că există o predispoziţie fiziologică la apariţia accidentelor trombotice în perioada neonatală, cu localizare la nivelul venelor renale, din cauza particularităţilor hemostazei la nou-născut: nivel scăzut al anticoagulanţilor naturali, antitrombinei III, proteinelor S şi C, dar şi din cauza perfuziei renale scăzute. Factorii de risc asociaţi sunt diabetul matern, hipoxia perinatală şi traumatismul obstetrical, deshidratarea, policitemia şi hipervâscozitatea sangvină, prematuritatea, infecţiile perinatale şi cardiopatiile congenitale cianogene(1). Anomaliile congenitale protrombotice reprezintă un factor de risc important(3). Totuşi, există puţine date în literatură cu privire la rolul acestora, deşi incidenţa trombozelor vasculare în familiile cu trombofilie este mare; trombofilia maternă şi anomaliile congenitale protrombotice au fost descrise la numeroase dintre cazurile raportate. Formarea trombului poate fi declanşată de hipervâscozitatea şi hiperosmolaritatea plasmatică, fluxul plasmatic renal scăzut sau trombofilie(4). Sunt mai frecvent afectaţi nou-născuţii de sex masculin, iar în 70-80% dintre cazuri localizarea este unilaterală, vena renală stângă fiind mai frecvent afectată(5,6). Debutul are loc în zilele a doua şi a treia de viaţă în majoritatea cazurilor, iar forma obişnuită de prezentare este triada clasică hematurie, masă tumorală renală, trombocitopenie.
Tratamentul anticoagulant şi fibrinolitic are ca scop mai degrabă stoparea progresiunii trombului, iar succesul raportat în unele cazuri pare să fie anecdotic(5,6). Chiar dacă în unele cazuri tratamentul a fost de succes, lipsesc studiile prospective şi recomandările bazate pe dovezi în tratamentul acestor pacienţi.
Prezentarea cazului
Prezentăm cazul unui nou-născut prematur, de sex feminin, cu vârsta de gestaţie 36 de săptămâni, născut în clinica noastră prin operaţie cezariană, G=3300 g, scorul Apgar 9/9. Din antecedentele heredocolaterale reţinem: mama de 36 de ani, grup de sânge AII, Rh negativ, fără anticorpi în sistemul Rh; IIG IP, cu un avort spontan în antecedente; este cunoscută cu trombofilie - mutaţia 1298A>C în formă homozigotă şi diabet gestaţional; sarcina este obţinută după tratament pentru sterilitate; a urmat tratament cu Aspenter® în primele 5 luni de sarcină şi Clexane® în lunile 7-8; tatăl - 35 de ani, BIII, Rh pozitiv, afirmativ sănătos, neinvestigat pentru mutaţii trombofilice.În evoluţia postnatală imediată, nou-născutul prezintă icter cu debut în primele 24 ore de viaţă; iniţial se ia în considerare o izoimunizare sangvină feto-maternă, dar grupul de sânge şi Rh-ul nou-născutului au fost BIII, pozitiv, iar mama nu a prezentat antenatal anticorpi în sistemul Rh. Nou-născutul este expus la fototerapie intermitentă 12 ore/zi, 4 zile. La 48 de ore postnatal apar urine hematurice şi la nivelul flancului stâng se palpează o formaţiune tumorală. Paraclinic, se constată trombocitopenie iniţial 80000, apoi 60000/mm³.
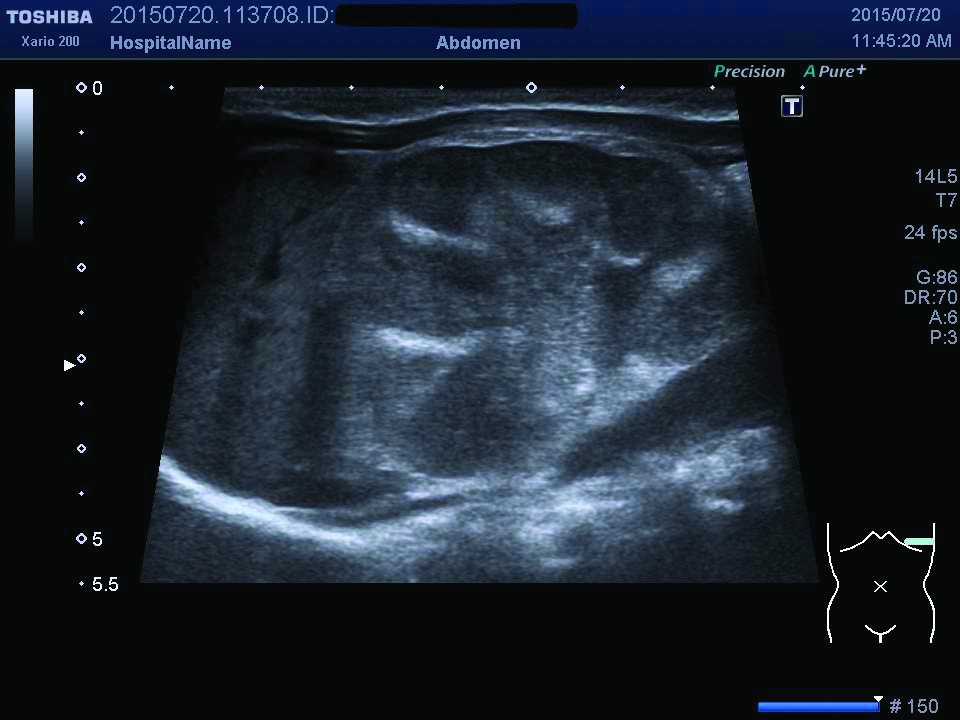
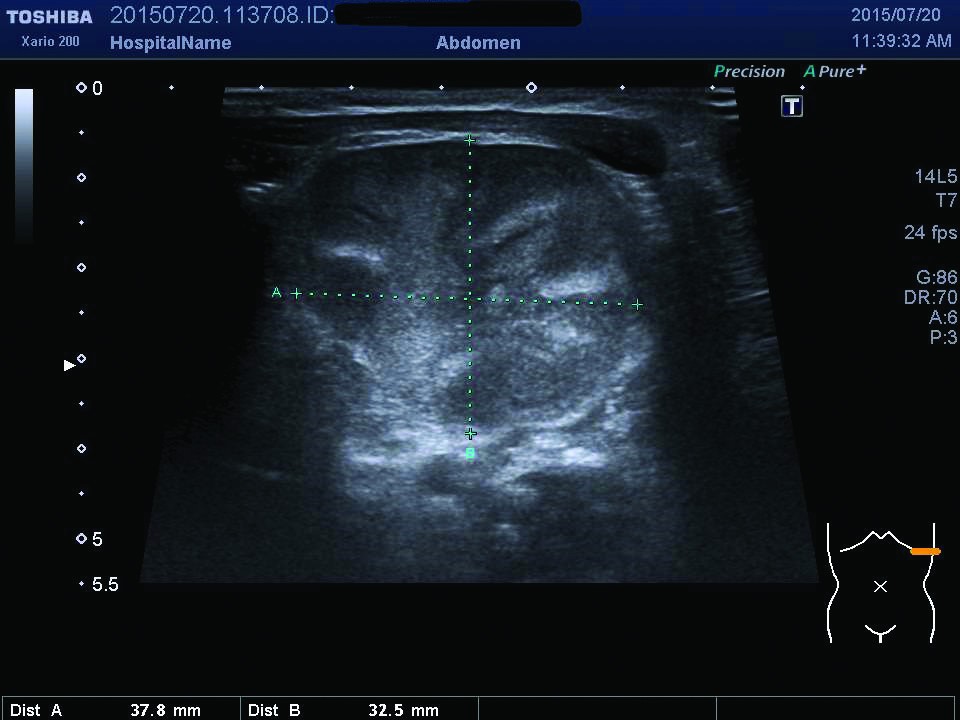
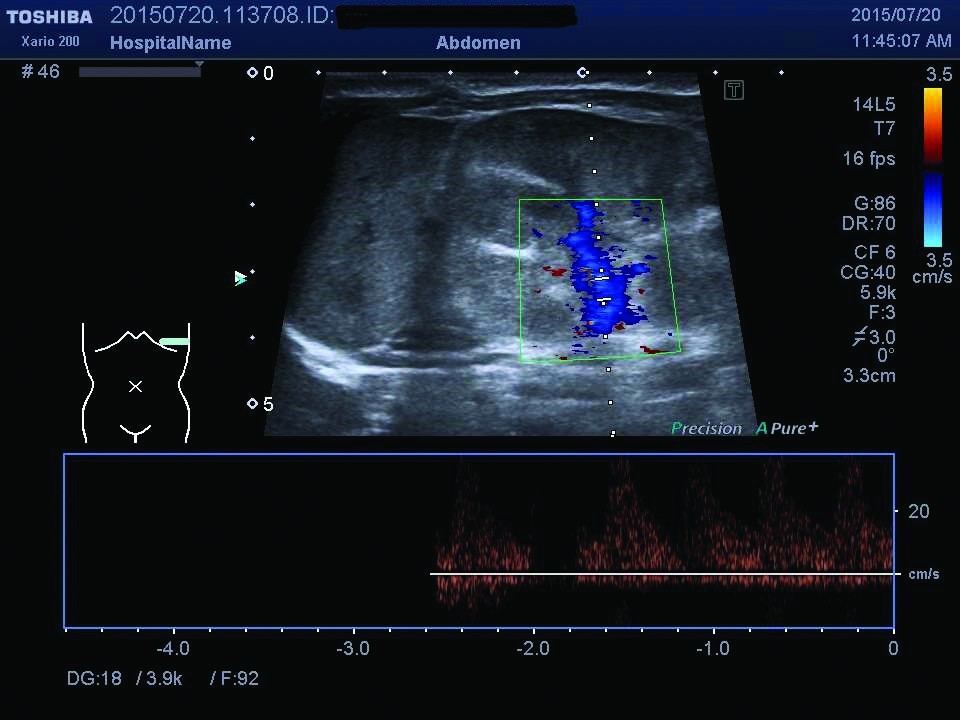
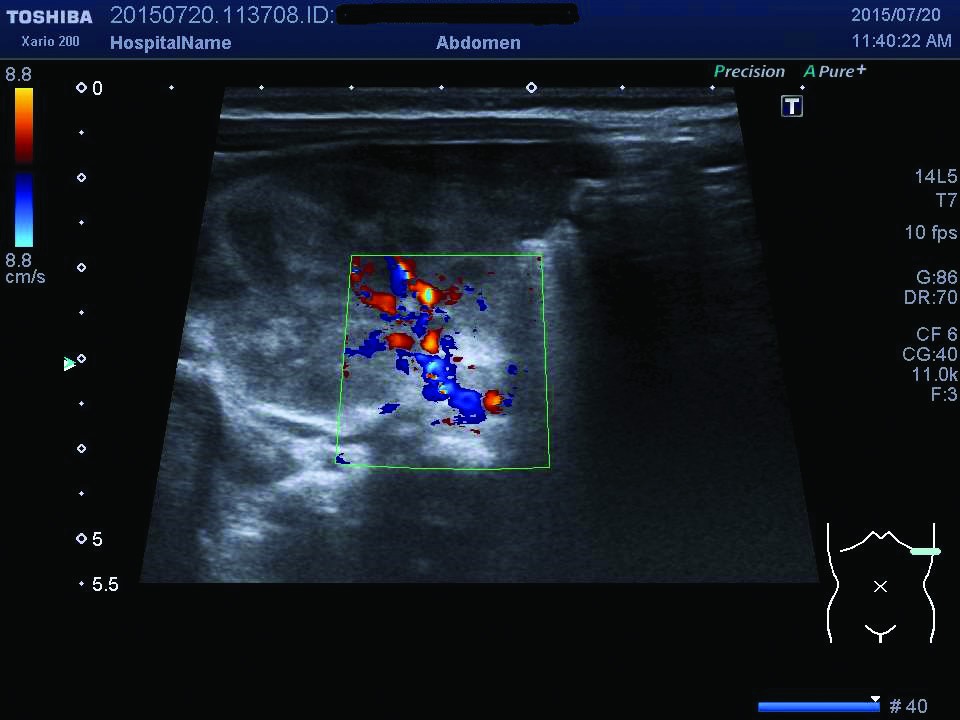
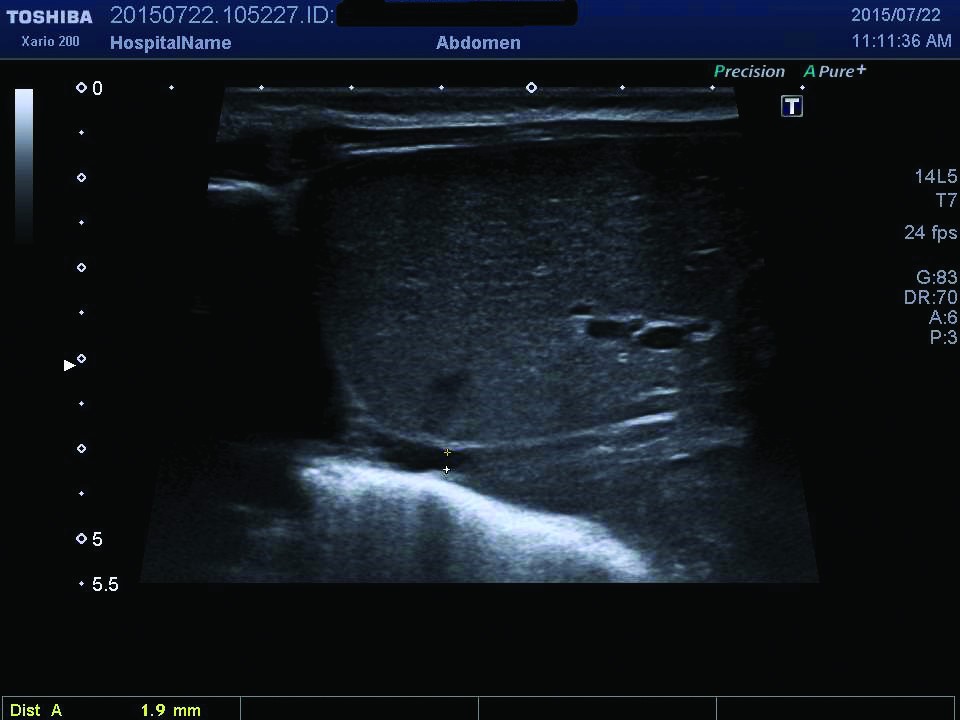
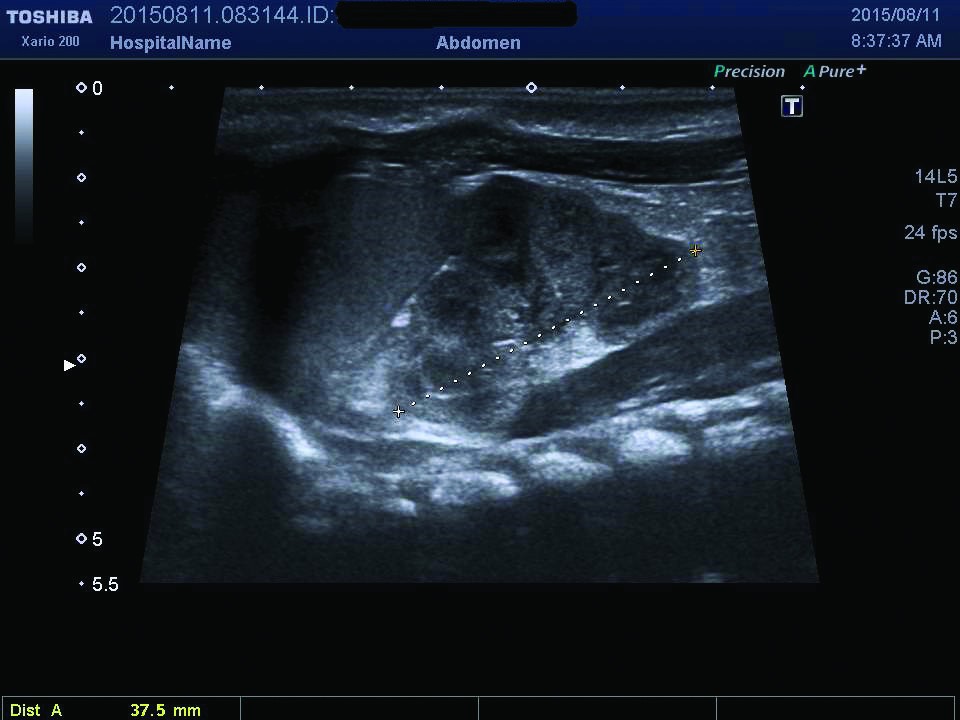
Ecografia abdominală relevă dimensiuni crescute ale rinichiului stâng, cu ştergerea diferenţierii cortico-medulare (figurile 1, 2), iar examinarea Doppler pune în evidenţă prezenţa unui tromb la nivelul venei renale stângi (figurile 3, 4). După încă 24 de ore apar modificări de culoare şi circumferinţă la nivelul membrului inferior stâng (tumefiat, cianotic), iar reevaluarea ecografică vizualizează extinderea trombului în vena cavă inferioară (figura 5), vena iliacă externă şi femurală stângă; există suspiciunea de extindere a trombului şi la nivelul venei renale drepte, fapt care se confirmă la ecografiile ulterioare.
Conduita terapeutică
Tratamentul administrat a constat din heparină cu doze între 20→70 UI/kg/zi, variabil în funcţie de valorile APTT la 4 ore; APTT oscilează între 23-70-120 sec.; s-a asociat plasmă AB IV, Rh neg, 10 ml/kg, pentru aport de antitrombină III. La 3 zile de la iniţierea heparinizării, se inserează cateter de venă jugulară externă (imposibilitate tehnică de recoltare de sânge pentru monitorizarea coagulogramei); se modifică tratamentul anticoagulant, optându-se pentru heparina cu greutate moleculară mică - Clexane® 1,6-1,7 mg/kg/zi. Monitorizarea tratamentului cu Clexane® s-a efectuat prin determinarea activităţii reziduale a factorului X (0,19 U/ml) şi a D-dimerilor (1,75 μg/ml). În tot acest timp probele funcţionale renale şi electroliţii s-au menţinut în limite normale. Analiza mutaţiilor trombofilice pune în evidenţă mutaţia factorului V Leiden, genotip heterozigot.
Ecografia de control efectuată la 21 de zile postnatal relevă aspect staţionar al trombului de la nivelul venei cave inferioare, fără semne de reperfuzie; venele paravertebrale uşor dilatate cu viteze de flux crescute, posibil prin devierea fluxului venos la acest nivel; vena renală dreaptă aparent este repermeabilizată, cu semnal Doppler la acest nivel, iar ecostructura rinichiului drept este păstrată. La nivelul venei renale stângi sunt prezente semne de reperfuzie.
Examinarea ecografică la 3 luni postnatal evidenţiază rinichiul stâng atrofic (figura 6), în timp ce rinichiul drept are ecostructură şi dimensiuni normale. Copilul este predat în urmărirea serviciului de Nefrologie pediatrică, sub tratament cu Clexane® 1,6 mg/kg/zi. Prognosticul pe termen lung este rezervat. La 6 luni, copilul dezvoltă convulsii, punând în discuţie posibilitatea unor microinfarcte cerebrale secundare migrării de microtrombi la nivelul vaselor cerebrale şi este preluat spre monitorizare şi în serviciul de Neurologie pediatrică.
Discuţii
Prezenţa triadei clasice masă tumorală renală, hematurie şi trombocitopenie a permis stabilirea precoce a diagnosticului de tromboză de venă renală. În literatură, hematuria asociată cu masa tumorală renală este semnalată la 50-60% dintre cazurile raportate, iar triada clasică a fost descrisă la 13% din cazuri(7). De asemenea, datele din literatură raportează afectarea copiilor de sex masculin cu o preponderenţă de 67,25%(5). În cazul nostru este vorba despre un nou-născut de sex feminin. Deşi informaţiile asupra rolului factorilor protrombotici ereditari în declanşarea bolii sunt puţine, datele din literatură arată că mutaţia factorului V Leiden este un factor determinant major în producerea accidentelor trombembolice la pacienţii pediatrici(5,8). Mai mult, există date care arată că mutaţia factorului Leiden este asociată cu debutul intrauterin al procesului trombotic, el devenind evident la scurt timp postnatal(7,9).Autorii englezi arată că, în 70% dintre cazuri, tromboza venei renale este unilaterală şi 63,6% dintre acestea interesează vena renală stângă(5,6). În cazul nostru, deşi localizarea primară a fost la nivelul venei renale stângi, procesul trombotic s-a extins rapid spre vena cavă inferioară, vena femurală stângă, dar şi la nivelul venei renale drepte.
Putem incrimina numeroşi factori de risc în declanşarea accidentului trombotic în cazul nostru: diabetul matern, mutaţia trombofilică a mamei, prematuritatea şi perfuzia renală scăzută, dar şi hipervâscozitatea sangvină secundară expunerii la fototerapie. De departe însă, mutaţia factorului V Leiden la nou-născut a fost determinantă.
Tratamentul în cazul nostru s-a iniţiat cu heparină nefracţionată, dar ca urmare a dificultăţilor tehnice întâmpinate în monitorizarea coagulogramei şi ajustarea tratamentului, aceasta a fost înlocuită cu heparină cu greutate moleculară mică. Concomitent, s-au asigurat aportul hidroelectrolitic adecvat şi administrarea de plasmă proaspătă congelată.
Datele din literatură referitoare la tratamentul acestor copii şi rezultatele imediate şi la distanţă ale acestuia sunt inconsecvente. În anii ’70-’80, tratamentul chirurgical era prima opţiune în tromboza de venă renală bilaterală(10,11). Terapia trombolitică şi anticoagulantă a fost raportată cu succes, îndeosebi la sugar şi copilul mic(10,11,12,13,14). În ce priveşte nou-născutul, scopul principal al acestei terapii pare să fie mai degrabă stoparea progresiunii trombului, iar unii autori consideră anecdotic succesul raportat(5,6,15). Totuşi, autorii canadieni raportează afectarea pe termen lung a funcţiei renale la pacienţii care nu au beneficiat de tratament anticoagulant. La cazul nostru, pe tot parcursul internării, funcţia renală s-a menţinut la parametri normali. Deşi nou-născutul a dezvoltat în următoarele luni atrofia rinichiului stâng, funcţia renală a fost compensată de rinichiul drept. Toţi autorii însă subliniază importanţa terapiei suportive la aceşti copii, corectarea deshidratării şi a tulburărilor de coagulare fiind de primă intenţie. Evoluţia spre atrofie renală este de altfel concordantă cu datele din literatură.
Concluzii
Deşi medicaţia anticoagulantă s-a iniţiat precoce, aceasta nu a putut stopa evoluţia spre atrofie renală şi nici extinderea procesului trombotic în afara teritoriului venei renale stângi. Totuşi, repermeabilizarea circulaţiei la nivelul venei renale contralaterale a permis salvarea funcţiei renale. De remarcat absenţa unor studii prospective şi recomandări bazate pe dovezi pentru tratamentul trombozelor de venă renală la nou-născut.Bibliografie
2. Agnieszka Szafranska, Agata Pajak, Katarzyna Kilis-Pstrusinka, Barbara Krolak-Olejnik. Renal vein thrombosis in a newborn with abnormal factor VIII level - clinical case report, Medicine (Baltimore), vol.94 (31), Aug 2015.
3. Heller C, Schobess R, Kurnik K, Yunker R, Gunther G, Kreuz W, Novak-Gotti U. Abdominal venous thrombosis in neonates and infants: role of prothrombotic risk factors – a multicentre case-control study. For the Childhood thrombophilia Study Group, Br. J Haematol, Nov. 2000; 111(2):534-9.
4. Moudqil A. Renal venous thrombosis in neonate, Curr. Pediatr., Rev. 2014;10(2); 101-6.
5. Keith K Lau, Jayson M Stoffman, Suzane Williams, Patricia Mc Cluster, L Brandao, S Patel, and AKC Chan. Neonatal renal vein thrombosis: Review of the English language literature between 1992-2006, Pediatrics, Nov. 2007, vol. 120, Issue 5.
6. Stefan Kuhle, Patti Massicote, Anthony Chan, Lesley Mitchell. A case series of 72 neonates with renal vein thrombosis. Data from I-800-NO_CLOTS Registry, Thromb Haemost, 2004.
7. Zigman A, Yazbeck S, Emil S, et al. Renal vein thrombosis: a 10-year review. J. Pediatr Surg. 2000; 35:1540-2.
8. Leonardo R Brandao, Ewurabena A Simpson, Keith K Lau. Neonatal renal vein thrombosis, Seminars in fetal and neonatal medicine, vol. 16, Issue 6, Dec. 2011, 323-8.
9. Ozyurek E, Besbas N, Aslan D, et al. Trauma as a risk factor for thrombosis in children: a report of three cases. Turk J Pediatr. 2003; 45:167-169.
10. Ifeoma C Anochie, Felicia Eke. Renal vein thrombosis in the neonate: a case report and review of the literature, Journal of the National Medical Association, vol. 96, No. 12, Dec. 2004.
11. Ricci MA, Lloyd DA. Renal venous thrombosis in infants and children. Arch surg. 1990; 125:1195-7.
12. Bromberg WD. Firth CF fibrinolytic therapy for renal vein thrombosis in the child, J. Urol. 1990; 143:86-8.
13. Bokenkamp A, von Kries R, Nowak-Gottl U et al. Neonatal renal venous thrombosis in Germany between 1992-1994: epidemiology, treatment and outcome. Eur J Pediatr. 2000; 159:44-8.
14. Bresolin NL, Essig LC, Kleis RL. Renal vein thrombosis in newborn infants, J. Pediatr. 1996; 72:44-8.
15. Weinschenk N, Pelidis M, Fiascone J. Combination thrombolytic and anticoagulant therapy for bilateral renal vein thrombosis in a premature infant. Am Perinatol. 2001, 18:293-7.