Borrelia burgdorferi sensu lato is a complex of spirochetes, the etiological agents of Lyme disease or Lyme borreliosis, an infectious disease of several domestic and wild animals, including humans, clinically expressed by dermatitis, arthritis, meningoencephalitis and general disorders. However, the infection is not necessarily associated with the clinical expression, and for diagnosis the clinical suspicion is should be correlated with the laboratory results. In this study, there are presented information on the history, etiology, epidemiology, clinical picture, diagnosis, prophylaxis and control of Borrelia burgdorferi sensu lato infections.
Infecţii cu Borrelia burgdorferi sensu lato
Infections with Borrelia burgdorferi sensu lato
First published: 18 decembrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.33.4.2018.2108
Abstract
Rezumat
Borrelia burgdorferi sensu lato este un complex de spirochete recunoscute ca agenţi etiologici ai bolii Lyme sau boreliozei Lyme, boală infecţioasă comună mai multor specii de animale domestice şi sălbatice, inclusiv omului, care se poate manifesta prin dermatită, artrită, meningoencefalită şi tulburări generale. Cu toate acestea, infecţia nu este neapărat asociată cu expresia clinică, iar în diagnosticul de confirmare suspiciunea clinică trebuie corelată cu rezultatele obţinute în laborator. În acest studiu sunt prezentate informaţii referitoare la istoricul, etiologia, epidemiologia, tabloul clinic, diagnosticul, profilaxia şi combaterea infecţiilor cu Borrelia burgdorferi sensu lato.
Borrelia burgdorferi sensu lato este un complex de genospecii potenţial patogene pentru om şi/sau animale, transmisibile prin căpuşe ixodide(1). Infecţiile produse de acestea sunt frecvent denumite boala Lyme sau borelioza Lyme(1,2,3), dar literatura de specialitate le mai prezintă şi sub denumiri ce reflectă forma de exprimare clinică a bolii, precum neuroborelioza Lyme(4).
Borelioza Lyme este una dintre cele mai prevalente zoonoze transmisibile prin vectori din zona temperată a emisferei nordice(1,3,5), cu circa 85.000 de cazuri pe an în Europa şi 20.000 de cazuri pe an în Statele Unite ale Americii(3). Atât la om, cât şi la animale, infecţiile evoluează frecvent asimptomatic sau ca infecţii autolimitante(3,6,7). Borelioza Lyme evoluează ca infecţie multiorgan, la om cu exprimare cutanată (eritem cronic migrator, limfocitom, acrodermatită cronică atrofică) sau extracutanată (cardită, neuroborelioză, artrită)(7), la câine, de obicei, cu poliartrită şi glomerulopatii, dar şi ca neuroborelioză şi cardită(6), la cai cu slăbire progresivă, şchiopături, laminită, artrită, uveită anterioară şi neuroborelioză(8), iar la bovine ca boală febrilă cu evoluţie acută, însoţită de laminită, artrită, scăderea producţiei de lapte şi chiar avorturi(8,9).
Istoric
Prima descriere clinică a bolii Lyme ca boală infecţioasă cu evoluţie epidemică (artrită oligoarticulară la copii şi adulţi) datează din 1977(10), dar studii recente sugerează o istorie mult mai veche. În 1883, medicul german Alfred Buchwald descrie o inflamaţie cronică a pielii asemănătoare celei din boala Lyme, care este posibil să fi avut aceeaşi etiologie cu boala a cărei recunoaştere oficială a avut loc abia în secolul XX(11).
Boala Lyme a fost denumită după oraşul Lyme, o comunitate mică, rurală, din statul Connecticut (Statele Unite ale Americii). Istoria bolii Lyme începe în 1975, când un grup de copii şi adulţi care locuiau în această comunitate au prezentat simptome artritice neobişnuite. Însemnările medicului Douglas S. Lloyd (State of Connecticut Department of Health’s Commissioner) ne dezvăluie dominantele clinice ale bolii, ce se caracteriza prin „episoade de durere şi tumefiere, de obicei scurte şi uşoare, dar adesea recurente, în câteva articulaţii mari, genunchi, cu perioade de remisiune mai lungi fără simptome. [...] Aproape jumătate dintre pacienţi au avut simptome numai la nivelul articulaţiilor, alţii au febră, dureri de cap, slăbiciune şi o erupţie cutanată. [...] Un sfert dintre pacienţi au suferit o leziune cutanată neobişnuită înainte de apariţia simptomelor articulare. [...] Distribuţia sezonieră şi geografică a cazurilor şi asocierea cu o leziune a pielii sugerează că un virus transmis de o insectă muşcătoare poate fi responsabil pentru această boală”(11).
Primele studii care susţin posibila implicare a unei spirochete transmisibile prin căpuşe în etiologia bolii Lyme sunt făcute de Burgdorfer şi col. (1982). Aceştia detectează şi reuşesc să izoleze o spirochetă treponema-like din căpuşe Ixodes dammini, incriminate ca vectori ai bolii Lyme(12). După demonstrarea etiologiei spirochetice şi denumirea agentului etiologic, în literatura ştiinţifică denumirea de borelioză Lyme devine din ce în ce mai populară.
Etiologie
B. burgdorferi sensu lato (s.l.) este încadrat taxonomic în încrengătura Spirochaetes, ordinul Spirochaetales, familia Spirochaetaceae, genul Borrelia. Complexul spirochetic B. burgdorferi (s.l.) reuneşte bacterii Gram-negative, din care cel puţin nouă sunt circulante în Europa: B. afzelii, B. bavariensis, B. bissetti, B. burgdorferi (sensu stricto), B. finlandensis, B. garinii, B. lusitaniae, B. spielmanii şi B. valaisiana(13).
Morfologia borreliilor este complexă, iar comportamentul bacteriilor în organismele infectate şi în diferite condiţii de cultivare este la fel de complex. Astfel, în condiţii culturale normale, B. burgdorferi (s.l.) prezintă pleomorfism ca răspuns la condiţiile de mediu, precum transformarea în particule sferice consecutivă expunerii la ser uman sau formarea de colonii „biofilm-like” în suspensie în mediile de cultură in vitro normale(14).
B. burgdorferi (s.l.) are în comun cu alte spirochete următoarele caracteristici structurale:
-
celulele au formă helicoidală şi sunt mobile, cu trei moduri de mişcare;
-
o membrană celulară externă înconjoară un cilindru protoplasmic complex, care este constituit din citoplasmă, membrană celulară internă şi peptidoglican;
-
flagelul, care este echivalent cu cel al altor bacterii, este localizat în spaţiul periplasmic, între membrana celulară externă şi cilindrul protoplasmic. Acest flagel periplasmic este inserat în extremităţile cilindrului protoplasmic(15).
Din cele prezentate anterior se poate concluziona că structura generală a B. burgdorferi are o serie de particularităţi ce-l fac să difere semnificativ faţă de alte bacterii Gram-negative: corpul bacterian este un cilindru protoplasmic acoperit de două membrane lipidice; între membrana externă (outer membrane) şi membrana internă (inner membrane) există un spaţiu periplasmic în care se află peptidoglicanul şi flagelul; în timp ce alte bacterii au organitele de mişcare în exteriorul celulei, B. burgdorferi (s.l.) are flagelul în spaţiul periplasmic(14,15). La B. burgdorferi (s.l.), flagelul furnizează bacteriei nu doar motilitate, ci şi forma spiralată specifică(14).
Epidemiologie
Peste 40 de specii de vertebrate (tabelul 1), în principal mamifere mici, sunt considerate gazde rezervor pentru B. burgdorferi (s.l.)(13,16,17).
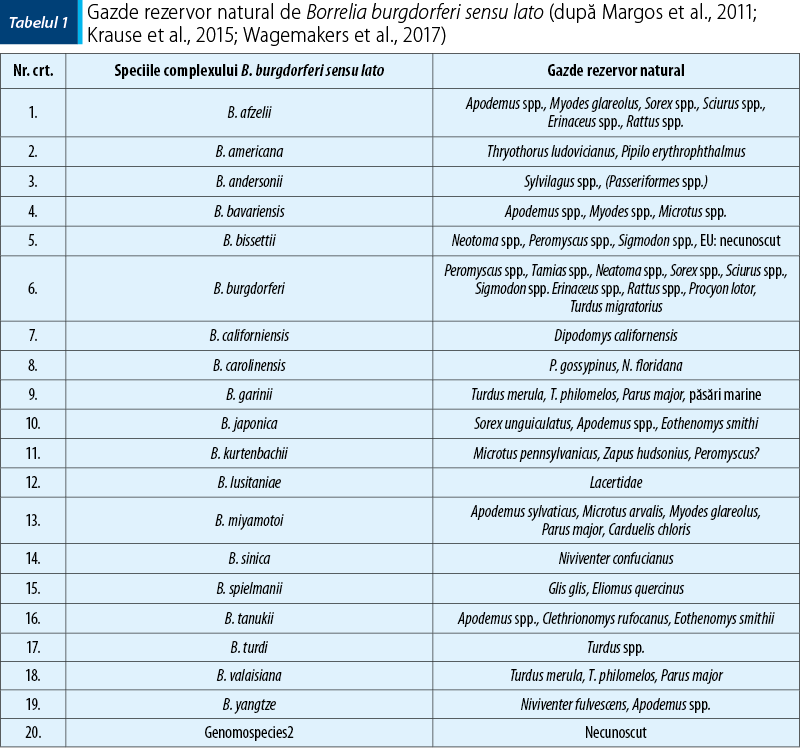
B. burgdorferi (s.l.) este transmisă în principal prin înţepătura căpuşelor infectate din genul Ixodes (tabelul 2). Transmiterea transovariană a fost înregistrată în cazul lui I. ricinus pentru B. miyamotoi, dar nu şi pentru genospeciile complexului B. burgdorferi (s.l.)(16).
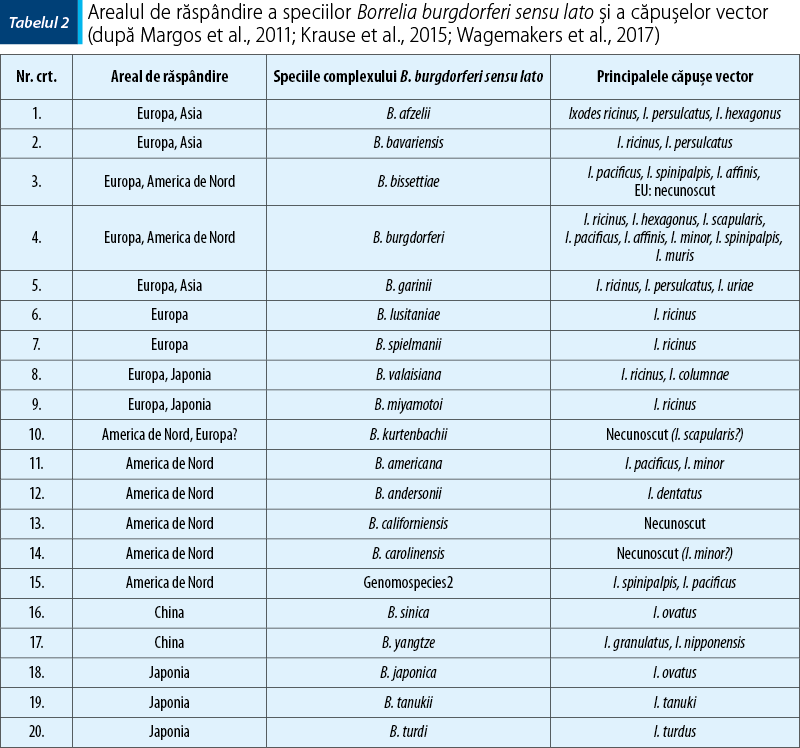
În Eurasia şi America de Nord, boala este transmisă cel mai frecvent de I. scapularis, I. pacificus, I. ricinus şi I. persulcatus, care sunt grupate în complexul speciilor Ixodes ricinus. Aceste patru specii servesc ca vectori de legătură a ciclurilor silvatic şi zoonotic/domestic la oameni şi animale domestice, gazde accidentale ale infecţiei. Aceste specii de căpuşe sunt considerate specii „generaliste”, care pe parcursul ciclului lor de viaţă multianual se hrănesc pe diverse gazde ce pot include specii de mamifere, păsări sau reptile. Importanţa lor ca vectori ai bolilor la om şi animalele domestice variază în funcţie de agentul etiologic transmis, specia de căpuşe, comunitatea de gazde vertebrate existente în areal, regiunea geografică şi factorii ecologici locali. Astfel, B. burgdorferi (s.l.) este transmisă în regiunile estice şi central-vestice ale SUA şi estice şi central-sudice ale Canadei de căpuşe I. scapularis, iar pe coasta pacifică a Americii de Nord de I. pacificus. Ixodes ricinus transmite boala Lyme în Europa şi vestul Asiei, iar I. persulcatus este vector în estul Europei şi Asia Centrală. Alte specii de căpuşe ixodide menţin B. burgdorferi (s.l.) în cicluri enzootice „silenţioase” şi nu sunt implicate în transmiterea bolii la om(18).
Manifestări clinice
Infecţiile cu B. burgdorferi (s.l.) pot îmbrăca cele mai variate forme de exprimare clinică.
La câini, infecţiile sunt asimptomatice în 95% din cazuri şi în numărul redus de cazuri clinic exprimate pot fi descrise forme renale, cardiace, neurologice, cutanate şi articulare, însoţite de şchiopătură şi sindrom febril(6). Infecţia experimentală se reproduce relativ greu la câine. Numai căţeii infectaţi experimental au manifestat un sindrom febril pasager, cu anorexie şi artrită. Examenul citologic al lichidului sinovial recoltat de la pacienţii cu artrită a arătat evoluţia unei inflamaţii neutrofilice. În infecţiile cronice, afecţiunile articulare pot evolua spre boală articulară degenerativă, deoarece căţeii purtători au dezvoltat ulterior infiltrate sinoviale nesupurative moderate şi asimptomatice(19).
La cai, semnele clinice asociate infecţiilor cu B. burgdorferi (s.l.) includ: slăbire cu evoluţie cronică, şchiopături sporadice, laminită, sindrom febril moderat (subfebrilitate), tumefierea articulaţiilor, sensibilitate musculară şi uveită anterioară. În formele cronice, pe lângă semnele amintite anterior, mai pot fi observate semne neurologice precum depresie, modificări de comportament, disfagie, înclinare a capului şi encefalită(8).
La bovine, infecţiile cu B. burgdorferi (s.l.) evoluează uzual ca o problemă de efectiv. Formele acute sunt adesea exprimate prin febră, rigiditate, tumefierea articulaţiilor şi scăderea producţiei de lapte şi, mai rar, prin slăbire progresivă cu evoluţie cronică, laminită şi avort(8).
La om sunt descrise manifestări clinice variate, specifice unei boli care afectează mai multe organe şi sisteme. Exprimarea clinică poate fi împărţită în trei stadii, fără ca toate acestea să fie obligatoriu exprimate la toţi pacienţii. Stadiul 1 este reprezentat de eritemul migrator ce apare la locul de inoculare al B. burgdorferi (s.l.) de către căpuşa-vector. Stadiul 2 este reprezentat de faza de diseminare a infecţiei, cu afectarea sistemului nervos, a articulaţiilor şi/sau a cordului. Stadiul 3 este relativ rar semnalat şi se asociază cu afecţiuni articulare sau cutanate cronice, precum acrodermatita cronică atrofică (frecvent raportată la femeile vârstnice în Europa)(3).
Diagnostic
În diagnosticul de laborator al boreliozei Lyme au fost descrise mai multe protocoale şi tehnici de diagnostic ce au ca obiective: cultivarea şi caracterizarea agentului etiologic, detecţia antigenelor specifice (immunoblotting), detecţia agentului etiologic prin tehnici de biologie moleculară (PCR, RT-PCR) şi/sau evidenţierea restructurărilor imunologice (ELISA). Aceste tehnici au valori diferite ale specificităţii şi sensibilităţii, influenţate atât de tipul probei biologice introduse în testare, cât şi de limitările intrinseci ale fiecărei tehnici în parte(7). Examinarea microscopică directă a probelor biologice, precum lichidul cefalorahidian, prin tehnica microscopiei în câmp întunecat poate permite observarea spirochetelor, dar sensibilitatea şi specificitatea sunt foarte slabe, această tehnică nefiind recomandată ca instrument de diagnostic de rutină.
Cultivarea B. burgdorferi (s.l.)
Izolarea B. burgdorferi (s.l.) se poate face din lichidul cefalorahidian, din piele sau sânge, folosindu-se medii de cultivare speciale (ex.: mediul Kelly modificat), incubate la 30-34ºC.
Deoarece creşterea in vitro a spirochetelor este lentă, culturile trebuie monitorizate până la 12 săptămâni. Citirea microscopică a culturilor poate furniza rezultate fals-pozitive şi ar trebui confirmată prin tehnici specifice precum PCR sau teste de imunodiagnostic cu anticorpi monoclonali. Sensibilitatea scăzută, creşterea lentă şi numărul redus de laboratoare de microbiologie specializate fac ca această metodă să fie mai rar utilizată în diagnosticul curent(4).
Diagnosticul prin tehnici imunologice
Evidenţierea anticorpilor specifici IgG şi IgM în ser sau lichidul cefalorahidian se poate face prin tehnici ELISA ce folosesc antigen din celule bacteriene inactivate prin sonicare, antigene recombinate sau extracte antigenice VlsE sau C6. Pentru creşterea siguranţei diagnosticării, în diagnosticul imunologic se recomandă retestarea probelor ELISA pozitive printr-o altă tehnică, cum ar fi immunoblottingul(4). Specificitatea testelor serologice în diagnosticul bolii Lyme este influenţată de seropozitivii clinic sănătoşi, a căror pondere este extrem de variabilă, precum şi de persistenţa timp de ani a anticorpilor specifici la pacienţii care au beneficiat de terapie.
Diagnosticul prin PCR
Protocoalele PCR destinate detecţiei de ADN B. burgdorferi (s.l.) direct din probe biologice sunt descrise în numeroase lucrări ştiinţifice de specialitate, iar avantajele şi dezavantajele fiecărui protocol fac dificilă recomandarea unui protocol standard sau de referinţă. Chiar dacă specificitatea analitică a acestor metode este foarte mare, specificitatea diagnosticului bolii Lyme prin tehnici PCR este influenţată major de incapacitatea actuală a tehnicii de a diferenţia un individ infectat asimptomatic sau cu boală cronică de unul cu infecţie clinic exprimată în formă acută. De asemenea, tehnica PCR are utilitate practică limitată în activitatea de evaluare a eficacităţii terapiei(4).
Profilaxie şi combatere
Cea mai eficientă metodă de prevenire a bolii Lyme s-a dovedit a fi educarea populaţiei prin campanii informative susţinute, mai ales în regiunile cu risc epidemiologic ridicat. Informarea comunităţilor locale cu privire la limitele zonelor cu risc epidemiologic, perioadele din an în care riscul contaminării este maxim şi care sunt măsurile de protecţie individuală ce trebuie aplicate la începutul activităţii căpuşelor în primăvara fiecărui an s-au dovedit extrem de eficiente în regiuni cunoscute ca endemice.
Măsurile generale de profilaxie a bolii Lyme au în vedere prevenirea expunerii la înţepătura căpuşelor vector prin:
-
purtarea de îmbrăcăminte adecvată pe timpul desfăşurării de activităţi în zonele cunoscute ca posibil contaminate cu căpuşe, precum cizme, pantaloni şi pulovere strânse sau închise la glezne, încheieturi şi talie;
-
aplicarea de repelente chimice pe haine (ex.: N-diethyl-toulamide s-a dovedit a fi eficient în prevenirea ataşării I. ricinus pe haine);
-
controlul de rutină al corpului şi hainelor după finalizarea activităţilor în zonele infestate cu căpuşe (inspecţia zilnică şi înlăturarea imediată a căpuşelor fixate);
-
inspectarea cu regularitate a blănii animalelor ce stau sau au fost în regiuni infestate cu căpuşe pentru detectarea prezenţei căpuşelor, în principal a căpuşelor femele adulte;
-
aprofundarea (intensificarea) programelor educative referitoare la simptomatologie, diagnostic, tratament, factori de risc, profilaxie, precum şi la alte informaţii specifice atât în regiunile cu istoric de boală, cât şi în regiunile în care riscul apariţiei bolii este real(3).
Vaccinarea – deşi posibilă la unele specii de animale – este complementară măsurilor de profilaxie generală şi, de obicei, utilizată la animale din regiunile endemice(20).
Majoritatea infecţiilor cu B. burgdorferi sunt asimptomatice şi autolimitante, iar aceasta face ca tratamentul să nu fie justificat la pacienţii serologic pozitivi asimptomatici. La pacienţii a căror simptomatologie este posibil asociată infecţiei cu B. burgdorferi şi la care rezultatele investigaţiilor de laborator susţin posibila evoluţie a bolii Lyme, se recomandă tratamentul specific (ex.: peniciline, cefalosporine sau tetracicline) care să prevină posibila progresie a bolii(3), alături de tratamentul simptomatic(20).
Conflict of interests: The author declares no conflict of interests.
Bibliografie
- Margos G, Vollmer SA, Ogden NH, Fish D. Population genetics, taxonomy, phylogeny and evolution of Borrelia burgdorferi sensu lato. Infect Genet Evol. 2011; 11(7):1545-63.
- Tilly K, Rosa PA, Stewart PE. Biology of infection with Borrelia burgdorferi. Infect Dis Clin North Am. 2008; 22(2):217-34.
- Lindgren E, Jaenson TGT. Lyme borreliosis in Europa: influences of climate and climate change, epidemiology, ecology and adaptation measures. WHO, Copenhagen, Denmark, 2006, pp. 1-34.
- Mygland A, Ljøstad U, Fingerle V, Rupprecht T, Schmutzhard E, Steiner I. EFNS guidelines on the diagnosis and management of Europaan Lyme neuroborreliosis. Eur J Neurol. 2010; 17(1):8-16.
- Radzijevskaja J, Rosef O, MatulaitytėV, Paulauskas A. Borrelia burgdorferi sensu lato genospecies in Ixodes ricinus ticks feeding on passerine birds in southern Norway. Biologija. 2016; 62(2):124-33.
- Ungureanu A, Bărăităreanu S, Danes D. Survey research concerning the main items of clinical suspicion in dog Lyme borreliosis and its options of confirmation. Bulletin of University of Agricultural Sciences and Veterinary Medicine Cluj-Napoca. Veterinary Medicine. 2013;70(2):339-40.
- Hengge UR, Tannapfel A, Tyring SK, Erbel R, Arendt G, Ruzicka T. Lyme borreliosis. Lancet Infect Dis. 2003;3:489-500.
- Parker JL, White KK. Lyme borreliosis in cattle and horses: a review of the literature. Cornell Vet. 1992;82(3):253-74.
- Danes D, Bărăităreanu S. Lyme borreliosis options of diagnostic by polymerase chain reaction in livestock. Journal of Biotechnology. 2015; 208(Supplement):S87.
- Steere AC, Malawista SE, Snydman DR, Shope RE, Andiman WA, Ross MR, Steele FM. Lyme arthritis: an epidemic of oligoarticular arthritis in children and adults in three Connecticut communities. Arthritis Rheum. 1977;20:7-17.
- Taylor PA. The hidden history of Lyme disease: links to biological warfare research. https://www.dr-rath-foundation.org/2018/08/the-hidden-history-of-lyme-disease-links-to-biological-warfare-research/ (Accesat 18.11.2018)
- Burgdorfer W, Barbour AG, Hayes SF, Benach JL, Grunwaldt E, Davis JP. Lyme disease - a tick-borne spirochetosis? Science. 1982;216:1317-9.
- Obiegala A, Król N, Oltersdorf C, Nader J, Pfeffer M. The enzootic life-cycle of Borrelia burgdorferi (sensu lato) and tick-borne rickettsiae: an epidemiological study on wild-living small mammals and their ticks from Saxony, Germany. Parasit Vectors. 2017;10(1):115.
- Merilainen L, Herranen A, Schwarzbach A, Gilbert L. Morphological and biochemical features of Borrelia burgdorferi pleomorphic forms. Microbiology. 2015;161(Pt 3):516-27.
- Barbour AG, Hayes SF. Biology of Borrelia species. Microbiol Rev. 1986; 50(4):381-400.
- Krause PJ, Fish D, Narasimhan S, Barbour AG. Borrelia miyamotoi infection in nature and humans. Clin Microbiol Infect. 2015;21:631-9.
- Wagemakers A, Jahfari S, de Wever B, Spanjaard L, Starink MV, de Vries HJC, Sprong H, Hovius JW. Borrelia miyamotoi in vectors and hosts in The Netherlands. Ticks Tick Borne Dis. 2017; 8(3):370-374.
- Smith RP. Ticks: The vectors of Lyme Disease. In Lyme disease: An evidence-based approach John J. Halperin (Ed.). 2nd Edition. CABI, Wallingford, UK, 2018;1-17.
- Littman MP, Goldstein RE, Labato MA, Lappin MR, Moore GE. ACVIM Small Animal Consensus Statement on Lyme Disease in Dogs: Diagnosis, Treatment, and Prevention. J Vet Intern Med. 2006;20:422-34.
- Littman MP, Gerber B, Goldstein RE, Labato MA, Lappin MR, Moore GE. ACVIM consensus update on Lyme borreliosis in dogs and cats. J Vet Intern Med. 2018;32(3):887-903.
Articole din ediţiile anterioare
Orientări clinice în patologia unor specii de şopârle de companie
Întreţinerea în captivitate a unor specii atât de diferite a însemnat implicit dezvoltarea de terarii sau acvaterarii care să ofere condiţii cât ma...