In recent years, there has been a higher interest to grow knowledge regarding gastrointestinal microbiota in canine and feline patients. Microbiota gathers more than 500 species of bacteria, viruses, fungus and archaea. This article intends to review and highlight recent research and discoveries regarding the digestive microbiota and its roles in several body functions, such as: metabolism homeostasis, defense against pathogens, education of immunity answer, synthesis or facilitation of a wide range of key nutrients essential for health from food, mental health maintenance, obesity, and dermatology. Through these essential roles, microbiota can directly or indirectly influence the majority of host’s physiological functions. Most studies highlight dysbiosis as a starting point or cofactor in leading to several pathologies, such as inflammatory bowel disease, chronic enteritis, atopy, deficient immunity answer, metabolic syndrome, obesity, depression in humans, or aggressivity in dogs. The preservation of a healthy microbiome proves to be an essential element for health maintenance and disease prevention, or for disease treatment in either humans or pets.
Microbiomul digestiv la animalele de companie
The digestive microbiome in small animals
First published: 22 noiembrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.38.4.2022.7278
Abstract
Rezumat
În ultimii ani există un interes tot mai crescut privitor la explorarea îndeaproape a microbiomului gastrointestinal al pacienţilor canini şi felini. Microbiomul este alcătuit din peste 500 de specii de bacterii, virusuri, miceţi şi archea. Acest articol are scopul de revizui şi prezenta cercetări recente şi descoperiri privind microbiomul digestiv şi rolurile sale într-o serie de funcţii ale organismului precum: homeostazia metabolismului, protecţia împotriva patogenilor, educarea răspunsului imunitar, sinteza şi/sau facilitarea sintezei unor nutrienţi-cheie pentru sănătate, menţinerea sănătăţii psihice, obezitatea, afecţiunile dermatologice, cardiologie, nefrologie. Prin aceste funcţii de bază microbiomul are capacitatea de a influenţa direct ori indirect majoritatea funcţiilor fiziologice ale gazdei.
Cel mai frecvent, studiile prezintă disbiozele ca punct de plecare ori cofactor pentru apariţia unor patologii precum: IBD, enterita cronică, atopia, răspunsul imunitar deficitar, sindromul metabolic, obezitatea, depresia la om sau agresivitatea la câine, pentru a menţiona doar câteva.
Menţinerea sănătăţii microbiomului s-a dovedit a fi un element esenţial în menţinerea sănătăţii şi prevenţia sau tratarea bolilor la om, dar şi la animalele de companie
Introducere
Dacă secolul trecut, în medicină, a fost secolul antibioticelor, secolul acesta este al microbiomului.
Microbiomul – definiţie
Microbiota digestivă este populaţia de microorganisme prezente la nivel digestiv.
Microbiomul este sistemul cu acţiune mutuală, alcătuit din genomul celulelor gazdei şi microbii rezistenţi prezenţi, fiind denumirea actuală a microbiomului intestinal. Adesea aceşti doi termeni au fost folosiţi în paralel pentru a exprima acelaşi lucru, însă recent există această distincţie clară a termenilor.
În tractul digestiv al mamiferelor, pe lângă bacterii, care constituie peste 90% din totalul microbiotei, în compoziţia acesteia intră şi alte specii de microorganisme, precum fungi, protozoare, virusuri, bacterii şi arheea. Studii moleculare de ultimă oră au furnizat date aprofundate privind diversitatea acestor microorganisme la animalele sănătoase, dar şi interacţiunile lor, precum şi influenţa lor asupra gazdei, însă rolul lor în bolile gastrointestinale rămâne neclar deocamdată.
Microbiota intestinală sănătoasă
Microbiota intestinală sănătoasă poate fi descrisă ca fiind complexul mixt alcătuit din grupuri de bacterii care colonizează o zonă definită a tubului digestiv la om sau la animale, care nu a fost afectată de boală sau de o intervenţie medicală. Asemănător oricărui alt organ, microbiomul are o fiziologie şi o patologie, iar sănătatea individuală (şi cea colectivă) ar putea fi afectată când componenţa populaţiei alcătuite din toate elementele sale este dezechilibrată. Diagnosticul afecţiunilor generate de microbiom implică studii metagenomice. Terapeutica patologiilor induse de microbiom sau mai bine zis cele induse de tulburările microbiomului, numite şi disbioze, includ transplantul de microbiotă sau bacterian, o tehnică disponibilă şi în creştere.
Studii filogenetice moleculare recente, având la bază în mod curent analize genetice comparative pe 16S rRNA, au relevat că tractul gastrointestinal al mamiferelor cantonează de la câteva sute până la mii de genuri de tipuri bacteriene. Se estimează că intestinul mamiferelor conţine aproximativ 1010 până la 1014 microorganisme, cam de zece ori mai mult decât numărul total de celule care alcătuiesc corpul gazdei lor. Microbii digestivi joacă un rol crucial în sănătatea gazdei.
Ei acţionează precum o barieră protectoare împotriva patogenilor care invadează, ajută major procesele digestive, furnizează energie din hrană, oferă suport nutriţional pentru enterocite şi stimulează dezvoltarea sistemului imunitar. Studiile moleculare ne-au ajutat să îmbunătăţim modalitatea de înţelegere privind compoziţia, dinamica şi modul de funcţionare a ecosistemului intestinal la pisici şi câini.
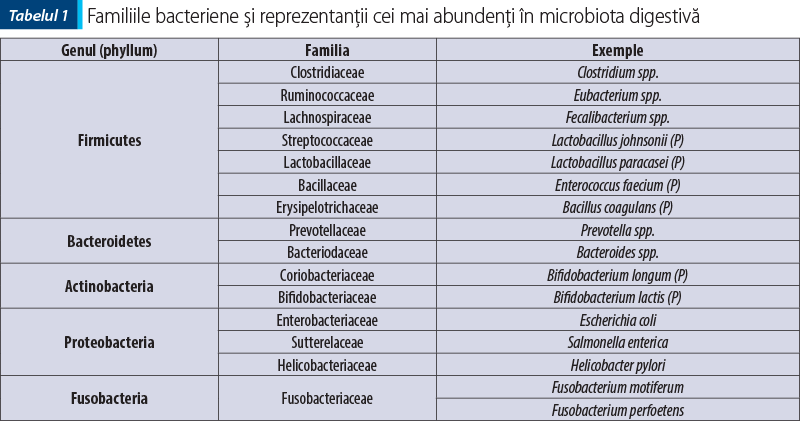
Există cinci genuri bacteriene, iar cele mai reprezentative sunt: Firmicutes, Bacteroides şi Fusobacteria, urmate de Proteobacteria şi Actinobacteria.
Tabelul 1 include familiile bacteriene şi reprezentanţii cel mai frecvent întâlniţi, conform bazei de date Greengenes (DeSantiz et al., 2006, Marchesi şi Ravel, 2015).
Rolurile microbiotei
Dezvoltarea intestinală
Microbiota intestinală joacă un prim rol major şi important în dezvoltarea intestinală. Patogenii, de asemenea, ar putea schimba morfologia intestinală într-un mod negativ. S-a demonstrat, de asemenea, că SCFAs (Short chain fatty acids – acizii graşi cu lanţ scurt), precum butiratul, propionatul şi acetatul, sunt produşi ai microbiotei intestinale care contribuie creşterea şi proliferarea enterocitelor. Microbiota intestinală influenţează morfologia intestinală atât la om, cât şi la toate speciile de mamifere, dar şi la păsări. Butiratul, sau acidul butric, este sursa de energie primară pentru epiteliul colonului şi i-a fost demonstrat şi rolul critic în menţinerea homeostaziei colonocitelor şi dezvoltarea morfologică a vililor intestinali.
Cu toate că există diferenţe marcante în compoziţia filogenetică a microbiotei intestinale între indivizi ai aceleiaşi specii de animale, iar produşii metabolici şi produsele finale sunt în mod curent similare între animale. Membrii similari ai comunităţii bacteriene sunt capabili să îndeplinească funcţii similare, iar dacă un grup microbian lipseşte ca urmare a unor perturbări (de exemplu, terapia cu antibiotice sau alte medicamente), alţi membri ai comunităţii sunt capabili să menţină stabile funcţiile sistemului. La această dată, microbiomul central stabil la pisici şi câini încă nu a fost definit complet.
Printre rolurile sale, microbiota a dovedit că produce enzime care facilitează descompunerea polizaharidelor din hrană. S-a stabilit, de asemenea, că microbiota prin SCFAs poate regla fluxul sangvin intestinal, stimulează creşterea şi proliferarea enterocitelor, precum şi producţia de mucină, alături de influenţarea răspunsurilor imune la nivel intestinal. De asemenea, contribuie la metabolizarea azotaţilor şi a proteinelor din hrană, ceea ce furnizează suplimentar aminoacizi necesari proceselor de menţinere a funcţiilor vitale, la reconstrucţie şi pot reprezenta şi o sursă de energie.
Flora digestivă comensală este compusă dintr-un strat dens şi complex de comunităţi distribuite în tractul digestiv, putând bloca ataşarea şi colonizarea majorităţii patogenilor enterici – aceasta este denumită excluderea competitivă. Unele bacterii comensale acţionează prin producţia de substanţe antibacteriene numite surfactanţi, compuşi care inhibă creşterea şi dezvoltarea patogenilor. La nivel digestiv sunt prezente şi virusuri, aşa-numite bacteriofage. O metoda promitatoare a inventarierii virusurilor digestive si gazda lor consta in terapia cu fagi sau bacteriofagi, prin care sunt ţintite selectiv bacterii patogene pentru a trata infecţiile.
Produce şi absoarbe nutrienţii din hrană
Marea majoritate a bacteriilor colonice sunt anaerobe şi principalele lor funcţii sunt de a produce energie din hrană şi să ajute la excluderea competitivă a potenţialelor bacterii patogene. Cu cât ingestia este mai lentă şi disponibilitatea nutrienţilor este mai mare în timp, cu atât favorizează diversitatea microbiană în colon.
Bacteriile dintr-un ecosistem au descoperit strategii de cooperare pentru a transforma complexitatea nutrienţilor pentru propriul beneficiu, precum şi pentru cel al gazdei. Bacteriile din colon furnizează enzime digestive care permit folosirea carbohidraţilor complecşi. Bacteriile metabolizează celulele epiteliale dehiscente, mucusul endogen şi substanţele nedigerate care au trecut prin intestinul subţire. În cele din urmă, bacteriile digestive acţionează prin folosirea nutrienţilor prezenţi în mod normal în alimentaţie, metabolizând predominant carbohidraţi complecşi, inclusiv amidon şi fibre alimentare, precum celuloza, pectina şi fructanţii. Fermentaţia acestor substanţe duce la producţia de SCFAs – acizi graşi cu catenă scurtă (acetat, propionat şi butirat) –, care vor furniza energie pentru metabolismul bacterian, dar şi pentru creşterea şi dezvoltarea celulelor epiteliale aşa cum am menţionat anterior.
Simpla mişcare de motilitate a intestinului este un mecanism major de apărare împotriva ataşării bacteriilor patogene de intestinul subţire, iar motilitatea intestinală sub limitele normale este adesea asociată cu disbioza. Concentraţia fiziologică de SCFAs stimulează motilitatea intestinală în ileonul canin, susţinând importanţa produşilor de fermentaţie a microbilor, influenţând sănătatea gazdei.
Menţine sănătatea digestiei
Este evidentă relaţia apropiată dintre microbiota intestinală şi celulele gazdei, care va avea un impact semnificativ asupra sănătăţii gastrointestinale. Cauzalitatea bolilor gastrointestinale ar putea fi determinată de patogenii tranzitorii la nivel digestiv, de suparapopularea cu bacterii oportuniste rezistente sau ca urmare a perturbărilor de comunicare între microbiota comensală şi sistemul imunitar înnăscut. Invadarea anumitor patogeni ar putea perturba profund epiteliul şi funcţiile intestinale prin deprecierea structurii mucoasei gastrointestinale.
Un număr uriaş de dovezi ştiinţifice au arătat că microbii joacă un rol important în mecanismele patogenetice ale apariţiei IBD (boala inflamatorie intestinală), atât la om, cât şi la câine şi la pisică, cu mecanisme de apariţie foarte asemănătoare.
Teoriile curente privind apariţia IBD sunt în favoarea asocierii dintre factorii de mediu, microbiota digestivă şi o susceptibilitate genetică a gazdei, aspect demonstrat la câinii din rasa Boxer care prezintă colită granulomatoasă, care joacă un rol important în promovarea sănătăţii intestinului.
Similar cu oamenii, studiile au relevat că IBD-ul la feline şi canide este asociat cu o dereglare a imunităţii, întrucât expresia diferenţiată a citokinelor s-a identificat la ambele specii de animale mici care prezintă enteropatii cronice. Microbiota este implicată în IBD-ul la om pe un fond inflamator prezent în segmentele digestive cu cel mai bogat număr de bacterii. Studiile pe modelele de animale cu susceptibilitate pentru inflamaţie indică faptul că apariţia IBD are loc doar dacă sunt prezente bacteriile. Relaţia cauză-efect între dezechilibrele microbiene şi inflamaţia intestinală nu este încă foarte bine determinată. Se suspectează că inflamaţia intestinală cauzează disbioza în favoarea dezvoltării Germenilor Gram-negativi (proteobacteriile) şi pierderea de grupuri bacteriene comensale, iar aceasta ar putea duce la limitarea capacităţii microbiomului intestinal de a regla un răspuns imun aberant, ceea ce duce la perturbarea florei intestinale.
Susţine funcţia imunitară
Tubul digestiv are două funcţii majore: absorbţia nutrienţilor şi apărarea faţă de patogeni, aşadar rol de suport imunitar. Funcţia imunitară a tractului digestiv este prioritară semnificativ, întrucât tubul digestiv este cea mai mare suprafaţă din corp care alocă spaţiu şi funcţii răspunsurilor imunitare şi este expusă continuu diverselor organisme.
Sistemul imunitar intestinal este compus din stratul de mucus (imunitate) în strânsă interconectare cu celulele epiteliale (integritatea intestinală), care secretă imunoglobulina A solubilă şi peptidele antimicrobiene. Joncţiunile strânse sunt părţi interconectate ale imunităţii.
Stratul de mucus este compus din stratul extern în care microorganismele pot coloniza şi un strat intern compact care respinge bacteriile. O comunitate microbiană benefică joacă un rol-cheie în menţinerea homeostaziei fiziologice normale, însă alterarea sistemului imunitar influenţează dezvoltarea organelor şi a metabolismului. Ca o componentă a sistemului imunitar intestinal, stratul de mucus previne penetrarea microorganismelor în epiteliul intestinal şi serveşte drept primă barieră de protecţie împotriva infecţiilor. Menţinerea integrităţii intestinale şi a joncţiunilor este următoarea linie de apărare a organismului împotriva patogenilor.
Relaţia digestie şi sănătatea cerebrală
(gut-brain axis)
Impactul microbiomului digestiv privind sănătatea cerebrală şi emoţională a fost şi este intens studiat atât la om, cât şi la câine.
Pentru a întrezări unele dintre conexiunile dintre microbiomul digestiv şi comportamentul gazdei, s-au făcut profilurile filogenetice ale compoziţiei şi structurii microbiomului digestiv la câine cu tendinţe agresive, fobice, comparativ cu un comportament normal.
În acord cu cele descoperite, tulburările comportamentale de agresivitate au fost caracterizate de o structură aberantă a microbiomului digestiv, cu o mare biodiversitate şi bogăţie de genuri cu genuri bacteriene subdominante în general (de exemplu, Catenibacterium şi Megamonas). Pe de altă parte, câinii care prezentau fobii aveau o floră mai bogată în Lactobacillus, gen bacterian cunoscut ca având proprietăţi probiotice şi psihobiotice.
Cu toate că este necesară evaluarea pe mai departe pentru a fi validate aceste studii, descoperirile actuale susţin oportunitatea surprinzătoare că unele fenotipuri comportamentale la câini pot fi asociate cu profiluri ale microbiomului digestiv aberant, sugerând posibile conexiuni între acest aspect al disbiozei şi sistemul nervos central, astfel indicând probabilitatea adoptării terapiilor probiotice şi cu fibre care ţintesc restaurarea echilibrului gazdă-microbiom pentru a atenua tulburările comportamentale.
Relaţia microbiomului cu apariţia obezităţii
În ultimii ani au fost efectuate studii multiple care au dovedit relaţia directă între scorul corporal – expresie a sănătăţii ponderale şi fizice, relevând diferenţa evidentă între profilurile metabolice, normoponderal, supraponderal şi obez.
Implicarea microbiomului în obezitate este corelată cu ceea ce s-a identificat la şoareci, lipsa expresiei genelor care codează leptina, ai cărei produşi promovează saţietatea.
Obezitatea şi chiar supraponderalitatea sunt caracterizate şi de perturbări ale compoziţiei microbiomului – disbioza.
În obezitate, disbioza este rezultantă fie a pierderii speciilor bacteriene cheie, fie a reducerii diversităţii microbiomului digestiv sau a suprapopulării cu specii bacteriene cu potenţial toxigen, precum Clostridium difficile sau Bacteroides fragilis.
Mai sus sunt menţionate doar o parte din rolurile microbiotei dovedite şi studiate privind menţinerea sănătăţii.
Disbioza
Dezechilibrul microbiomului digestiv este cunoscut ca disbioză. Aceasta apare secundar schimbărilor care au loc la nivel digestiv prin schimbările de mediu sau medicamente, precum terapia cu metronidazol sau tilozină.
Deoarece multe dintre bacterii nu pot fi cultivate în laborator, s-a identificat nevoia unui test standardizat şi accesibil pentru a identifica prezenţa disbiozei – aşa a apărut Indicele de disbioză.
Indicele disbiozei DI însă ar trebui evaluat în contextul pacientului şi al istoricului de tratamente şi afecţiuni, nu ca parametru singular.
Cercetări recente au stabilit indexul disbiozei ca cifră (-1, 0, 2) şi poate fi identificat prin folosirea testelor de disbioză disponibile în Europa şi în America de Nord, având la bază măsurarea PCR cantitativ.
Terapia
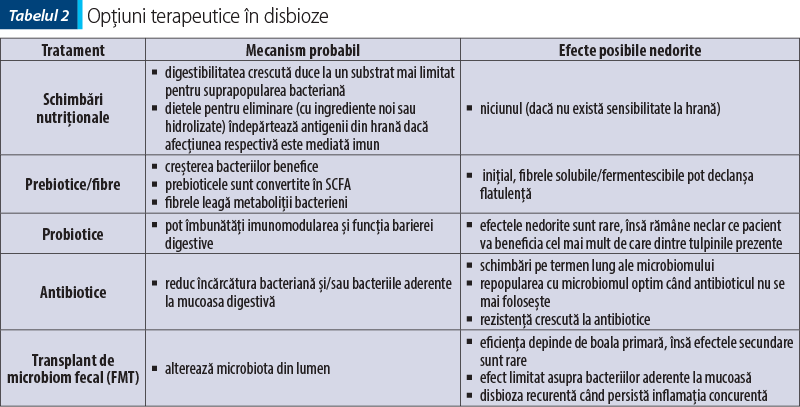
Cu toate că sunt intens explorate terapiile nutriţionale, probiotice, prebiotice, simbiotice, toate acestea vor fi efectuate adaptat fiecărui pacient.
În oricare dintre tulburările disbiotice se recomandă restaurarea sau reechilibrarea microbiomului, prin diverse intervenţii care, în funcţie de tipul de fibre folosit, va influenţa una sau mai multe genuri bacteriene prezente în lumen.
Opţiuni terapeutice în disbioze sunt rezumate în tabelul 2. Recent s-a demonstrat rolul crucial şi definitoriu mai eficient al terapiilor prin suplimentarea cu fibre alimentare şi/sau folosirea dietelor terapeutice bogate în fibre.
Doar în cazul în care aceste intervenţii nu sunt eficiente se recomandă transplant de microbiom fecal (FMT) ca terapie customizată în funcţie de nevoile pacientului.
Concluzii
Microbiomul digestiv ar trebui privit ca un organ metabolic cu rol major în menţinerea sănătăţii şi cu impact direct sau indirect în privinţa multiplelor funcţii imunitare şi metabolice, producând metaboliţi şi vitamine. Multiplele căi metabolice investigate şi monitorizate au fost relevante prin prisma prezenţei microbiotei intestinale. Astfel, bacteriile microbiotei şi celulele organismului trebuie văzute ca un tot unitar, mai curând, şi nu ca entităţi separate, ca „un organ ascuns”.
Cele mai recente studii au în vedere evaluarea nu doar a compuşilor microbiotei – cine este acolo? –, ci mai curând rolurile şi impactul lor la nivel digestiv şi asupra întreg organismului, evaluând modul de menţinere a sănătăţii: ce fac acolo?
Bibliografie
-
Arora T, Sharma R. Fermentation potential of the gut microbiome: implications for energy homeostasis and weight management. Nutr Rev. 2011 Feb;69(2):99-106.
-
Kates AE, Jarrett O, Skarlupka JH, Sethi A, Duster M, Watson L, Suen G, Poulsen K, Safdar N. Household Pet Ownership and the Microbial Diversity of the Human Gut Microbiota. Front Cell Infect Microbiol. 2020 Feb 28;10:73.
-
Carding S, Verbeke K, Vipond DT, Corfe BM, Owen LJ. Dysbiosis of the gut microbiota in disease. Microb Ecol Health Dis. 2015 Feb 2;26:26191.
-
Reddy KE, Kim HR, Jeong JY, So KM, Lee S, Ji SY, Kim M, Lee HJ, Lee S, Kim KH, Kim M. Impact of Breed on the Fecal Microbiome of Dogs under the Same Dietary Condition. J Microbiol Biotechnol. 2019 Dec 28;29(12):1947-1956.
-
Pilla R, Suchodolski JS. The Gut Microbiome of Dogs and Cats, and the Influence of Diet. Vet Clin North Am Small Anim Pract. 2021 May;51(3):605-621.
-
Ephraim E, Cochrane CY, Jewell DE. Varying Protein Levels Influence Metabolomics and the Gut Microbiome in Healthy Adult Dogs. Toxins (Basel). 2020 Aug 12;12(8):517.
-
Suchodolski JS. Intestinal microbiota of dogs and cats: a bigger world than we thought. Vet Clin North Am Small Anim Pract. 2011 Mar;41(2):261-72.
-
Forster GM, Stockman J, Noyes N, Heuberger AL, Broeckling CD, Bantle CM, Ryan EP. A Comparative Study of Serum Biochemistry, Metabolome and Microbiome Parameters of Clinically Healthy, Normal Weight, Overweight, and Obese Companion Dogs. Top Companion Anim Med. 2018 Dec;33(4):126-135.
-
Coelho LP, Kultima JR, Costea PI, Fournier C, Pan Y, Czarnecki-Maulden G, Hayward MR, Forslund SK, Schmidt TSB, Descombes P, Jackson JR, Li Q, Bork P. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 2018 Apr 19;6(1):72.
-
Carding S, Verbeke K, Vipond DT, Corfe BM, Owen LJ. Dysbiosis of the gut microbiota in disease. Microb Ecol Health Dis. 2015 Feb 2;26:26191.
-
Tseng CH, Wu CY. The gut microbiome in obesity. J Formos Med Assoc. 2019;118 Suppl 1:S3-S9.
-
Pilla R, Suchodolski JS. The Role of the Canine Gut Microbiome and Metabolome in Health and Gastrointestinal Disease. Front Vet Sci. 2020 Jan 14;6:498.
-
Blake AB, Guard BC, Honneffer JB, Lidbury JA, Steiner JM, Suchodolski JS. Altered microbiota, fecal lactate, and fecal bile acids in dogs with gastrointestinal disease. PLoS One. 2019 Oct 31;14(10):e0224454.
-
Kieler IN, Shamzir Kamal S, Vitger AD, Nielsen DS, Lauridsen C, Bjornvad CR. Gut microbiota composition may relate to weight loss rate in obese pet dogs. Vet Med Sci. 2017 Nov 3;3(4):252-262.
-
Chaitman J, Ziese AL, Pilla R, Minamoto Y, Blake AB, Guard BC, Isaiah A, Lidbury JA, Steiner JM, Unterer S, Suchodolski JS. Fecal Microbial and Metabolic Profiles in Dogs With Acute Diarrhea Receiving Either Fecal Microbiota Transplantation or Oral Metronidazole. Front Vet Sci. 2020 Apr 16;7:192.
-
Suchodolski JS. Companion animals symposium: microbes and gastrointestinal health of dogs and cats. J Anim Sci. 2011 May;89(5):1520-30.
-
Carding S, Verbeke K, Vipond DT, Corfe BM, Owen LJ. Dysbiosis of the gut microbiota in disease. Microb Ecol Health Dis. 2015 Feb 2;26:26191.
-
Canine Microbiota Dysbiosis Index, https://vetmed.tamu.edu/gilab/service/assays/canine-microbiota-dysbiosis-index/
-
Fitzgibbon G, Mills KHG. The microbiota and immune-mediated diseases: Opportunities for therapeutic intervention. Eur J Immunol. 2020 Mar;50(3):326-337.