It is an infectious disease caused by the bacterium Bartonella henselae. Most cats contract the disease from other felines and pass it on through fleas. The infection is transmitted to humans when the cat scratches its owner with dirty paws. Usually, animals that have this disease do not show clinical symptoms. This disease can affect any cat, regardless of breed, age or sex. However, the probability of contracting the disease is higher in the first year of life when cats have fleas, at those who tend to roam the streets or are homeless.
Prevalenţa infecţiei cu Bartonella spp. în populaţia de pisici
Prevalence of Bartonella spp. infection in cat’s population
First published: 01 august 2017
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Este o boală infecțioasă cauzată de bacteria Bartonella henselae. Majoritatea pisicilor contractează boala de la alte feline și o transmit mai departe, prin purici. Infecția se transmite și la om, atunci când pisica își zgârie stăpânul cu lăbuțele murdare. De obicei, animalele care au această maladie nu prezintă simptome clinice. Această boală poate afecta orice pisică, indiferent de rasă, vârstă sau sex. Totuși, probabilitatea de a contracta boala este mai mare în primul an de viață, la pisicile care au purici, la cele care obișnuiesc să hoinărească pe străzi sau la cele fără adăpost.
Introducere
Prezenta lucrare îşi propune prezentarea epidemiologiei infecţiilor produse de Bartonella spp., a impactului asupra statusului fiziologic drept consecinţă a expunerii la agentul cauzal, a patologiei determinate la pisică, precum şi asupra impactului zoonotic.
Biologia şi morfologia bartonelelor
Înainte de anul 1990 erau puse în evidenţă doar două specii de Bartonella, iar actualmente au fost descrise 22 de specii, necalculând şi speciile ce sunt încă în stadiu de cercetare.
În anul 1993, genul Rochalimaea a fuzionat cu genul Bartonella şi s-au redenumit 4 specii de Bartonella, şi anume: Bartonella quintana, B. vinsonii, B. henselae şi B. elizabethae. Această fuziune s-a soldat şi cu reclasificarea acestor bacterii din Familia Rickettsiaceae în Familia Bartonellaceae, care include şi Bartonella bacilliformis. De aseamenea, pentru a susţine aceste schimbări, familia Bartonellaceae a fost scoasă din Ordinul Rickettsiales(1).
În anul 1995 s-a propus unificarea genului Grahamella cu genul Bartonella, ceea ce a rezultat în adiţionarea a 5 noi specii, şi anume: Bartonella talpae, B. peromysci, B. grahamii, B. taylorii şi B. doshiae(2). În 1996 s-a izolat la câine şi s-a denumit ca fiind o nouă subspecie Bartonella vinsonii subsp. Berkhoffii(3).
Tot în acelaşi an s-a identificat la pisică o nouă specie ce a fost denumită Bartonella clarridgeiae(4), iar în anul 1998 s-a izolat Bartonella tribocorum la rozătoarele sălbatice(5).
În primele 11 luni ale anului 1999 au mai fost izolate şi identificate: Bartonella koehlerae la pisicile domestice(6), Bartonella alsatica la iepurii sălbatici(7), Bartonella vinsonii subsp. Arupensis la bovinele domestice(8) şi Bartonella weissi la pisici.
Bartonella face parte din genul bacteriilor gram-negative, parazit intracelular facultativ, extrem de adaptabil mamiferelor gazdă, cărora le induce o bacteriemie intraeritrocitară durabilă.
Aceste particularităţi ajută numeroasele specii de Bartonella să se adapteze la un număr mare de mamifere-gazdă - exemple: Bartonella henselae, B. koehlerae şi B. clarridgeiae evoluează în populaţia de pisici, Bartonella vinsonii subsp. berkhoffii la canidele domestice şi sălbatice şi Bartonella bovis, B. schoenbuchensis şi B. capreoli la rumegătoare(9).
Bartonella spp. s-a evidenţiat şi în sângele unor animale sălbatice precum: leu, coiot, linx, vulpe, elan şi căprioară.
Pe lângă aceste specii de mamifere identificate ca fiind purtătoare şi eliminatoare de Bartonella spp., mai nou se numără şi veveriţa, la care s-au identificat şi sunt supuse clasificării 3 specii noi de candidate la genul Bartonella: Bartonella washoensis la veveriţa comună, Bartonella durdenii la veveriţa gri şi Bartonella volans la veveriţa zburătoare.
Genul Bartonella este catalază, oxidază, urează şi nitrat-reductază negativ. Produce peptidază cu o variabilitate destul de accentuată între multiplele specii ale genului(5). Prin amprenta de ADN s-au putut izola şi diferenţia două tipuri (tipul 1 şi tipul 2), diferenţiere făcută pe baza deosebirilor de la nivelul secvenţei genei 165rRNA.
Epidemiologia infecţiei cu Bartonella spp. în populaţia de pisici (receptivitate, vectori, evoluţie)
Transmiterea bolii la pisică se face prin intermediul artropodelor hematofage (purici, ţânţari, păduchi), în acest sens Ctenocephalides felis jucând rolul determinant. Acum 10 ani, căpuşa era considerată ca fiind principalul vector, însă actualmente importanţa sa în transmiterea acestei boli este discutabilă.
Deşi s-a demonstrat existenţa bartonelelor la nivelul acestora, transmiterea propriu-zisă prin muşcătura căpuşelor nu a fost încă demonstrată(10). În ceea ce priveşte speciile de căpuşe demonstrate ca fiind purtătoare de bartonele s-au evidenţiat Ixodes scapularis în SUA şi Ixodes ricinus în Olanda(11).
Pentru a se evidenţia importanţa vectorilor în transmiterea bartonelozei s-a realizat un studiu ce a avut ca bază transmiterea B. henselae prin transferul de purici dintr-o felisă cu pisici cu bacteriemie într-una cu pisici SPF(12). Acest studiu însă nu a stabilit dacă Ctenocephalides felis a servit atât ca un vector mecanic, cât şi ca unul biologic.
Bartonelele sunt detectabile în organele abdominale ale puricilor şi pot fi puse în evidenţă până la 9 zile de la infecţie în fecalele acestora(13). În acelaşi studiu s-a încercat să se demonstreze, fără succes însă, o eventuală transmitere orală utilizând purici ca atare sau fecalele lor.
Transmiterea transplacentară şi perinatală nu a fost identificată în ceea ce priveşte infecţia experimentală(14).
Patogeneza
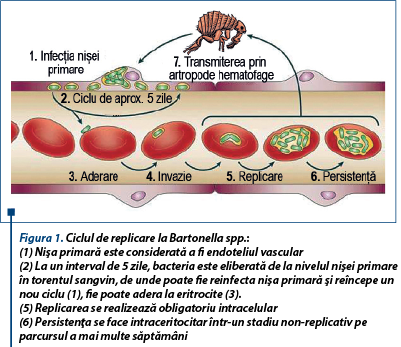
Imediat după infectare, bartonelele colonizează la nivelul celulelor endoteliale. Apoi, la fiecare 5 zile, o serie de celule endoteliale infectate sunt eliberate în circulaţie, unde infectează eritrocitele. După ce pătrund în eritrocite, se replică la nivelul membranei fagozomilor, multiplicându-se astfel până ating o densitate maximă a populaţiei. Colonizarea la nivelul celulelor endoteliale protejează bartonelele de răspunsul imun imediat al organismului-gazdă şi facilitează dispersia vasculară.
S-a demonstrat că unii lianţi bacterieni, precum pilii, sau unele categorii de proteine membranare (OMPs) pot involua în procesul de aderare. Din cele 9 proteine membranare, 5 sunt considerate a avea un rol important în aderarea endotelială. Dintre acestea se remarcă proteina 43-kDa (OMP43), cu o secvenţă similară de aminoacizi, cu proteina OMP2b caracteristică speciilor de Brucella. Această proteină posedă o afinitate deosebită pentru celulele endoteliale, sugerând un rol determinant în patogeneza bartonelozei(15).
Receptorii endoteliali implicaţi în adeziunea bartonelelor includ molecula ICAM-1 şi E-selectin(16).
Unele studii demonstrează că Bartonella spp. poate infecta macrofagele specializate, incluzând celule dendritice, microgliile şi chiar monocitele. Astfel, afectând macrofagele şi monocitele, bartonelele se pot localiza în ţesuturi şi organe pe care le lezionează, acest fapt contribuind la realizarea procesului inflamator specific determinat de acestea. În plus, infecţia cu Bartonella determină imunosupresie şi predispune astfel individul afectat la infecţii virale şi bacteriene oportuniste, precum şi la micoze.
Tabloul clinic şi anatomopatologic al infecţiei
Studii recente în ceea ce priveşte bartoneloza la pisici, cât şi la oameni subliniază conceptul conform căruia Bartonella spp. poate induce o infecţie persistentă, fără semne clinice, sau cu manifestare clinică minimală, nespecifică, fiind foarte greu de diagnosticat(17).
Semnele clinice uzuale, în cazul unei infecţii naturale, cuprind:
- La nivel bucal: gingivite, stomatite şi ulceraţii.
- La nivelul sistemului respirator: rinite, sinuzite, precum şi afectarea tractului respirator superior.
- La nivel ocular: conjunctivite, uveite, ulcere corneene, corioretinite şi cheratite.
- La nivel intestinal: inflamaţii intestinale, diaree cronică şi vomismente cronice.
- La nivel SNC - semne neurologice: letargie, dezorientare, lipsa de răspuns la stimuli ambientali.
- Diverse: limfadenopatie cu creşterea în volum a limfonodurilor reactive, sindrom febril, dermatite şi valvulopatii.
Experienţa clinică a demonstrat că febra, ca simptom, poate apărea şi la pisicile cu bacteriemie, dar fără manifestări clinice de boală, în urma unei intervenţii chirurgicale minore. Deşi nedemonstrată, se merge pe ipoteza conform căreia bartoneloza, precum alte infecţii intravasculare cronice, determină în caz de stres (precum intervenţii chirurgicale sau traume) apariţia unor manifestări clinice de tipul hipertermiei tranzitorii, anemiei moderate şi semnelor neurologice de mică intensitate şi limitate ca durată.
Atât imunitatea umorală, cât şi cea mediată celular joacă un rol foarte important în eliminarea, supresia şi controlul bartonelelor din genurile: B. henselae, B. clarridgeiae şi B. koehlerae.
Activarea răspunsului imun mediat celular, inclusiv a gamma-interferonului, joacă un rol esenţial în combaterea şi eliminarea B. henselae.
Imunosupresia asociată cu virusul leucemiei feline sau cu virusul imunodeficienţei feline măreşte patogenitatea în cazul B. henselae.
Metode de diagnostic
Ca diagnostic de certitudine se recomandă evidenţierea anticorpilor prin testul de imunoflurescenţă indirectă sau PCR (Polymerase Chain Reaction). Pentru testul serologic, proba de analizat se ia din sângele animalului testat (minimum 1-2 ml de sânge, fără anticoagulant, pentru a putea exprima ser), în timp ce pentru testul PCR proba de analizat poate fi din: sânge, limfonoduri, aspirate tisulare, salivă, lichid articular, exsudat ocular sau probă biopsică.
Deşi aceste două metode sunt metode de referinţă, uneori chiar şi aşa diagnosticul de bartoneloză ca boală primară la pisică se realizează cu mare dificultate. În America, spre exemplu, diagnosticul de certitudine se pune prin combinarea metodei de testare PCR cu testarea parametrilor clinici şi cu răspunsul la medicaţia specifică(18). Deşi diagnosticul serologic sau cel prin testare PCR poate fi folosit singular în confirmarea bartonelozei, diagnosticul clinic sau cel terapeutic poate fi folosit doar ca diagnostic de suspiciune. Semnele clinice specifice ce ajută la conturarea unui diagnostic de suspiciune şi impun testare serologică ulterioară sunt: leziuni de inflamaţie granulomatoasă, limfonoduri mărite în volum, reactive, endocardită, miocardită, poliartrită, anemie hemolitică mediată imun, trombocitopenie, eozinofilie, splenomegalie, epistaxis, efuziuni cavitare idiopatice, semne neurologice, hipertermie, hepatită cronică.
Administrarea de medicamente imunosupresoare sau de chimioterapice înaintea testării PCR creşte nivelul bartonelelor din organism, făcând boala mai uşor de confirmat, în timp ce administrarea de antibiotice are efect invers.
Tratamentul bartonelozei
Eficacitatea antibioticelor în eliminarea bartonelelor din organism nu a fost încă pe deplin stabilită.
Răspunsuri incomplete la tratament (fără eliminarea definitivă) au fost observate la pisicile infectate experimental şi tratate 2-4 săptămâni cu enrofloxacin, doxiciclină sau cu orbifloxacin.
Ampicilina şi doxiciclina s-au dovedit a fi foarte eficiente în tratarea pisicilor infectate experimental prin inoculare „per ac”.
În cazul infecţiei naturale cu Bartonella henselae, hipertermia a cedat uşor după administrarea pe cale orală a 5 mg/kg enrofloxacin.
Eficienţa doxiciclinei nu a fost dovedită pentru infecţia cu B. vinsonii subsp. berkhoffii, dar s-a demonstrat că în cazul infecţiei naturale cu B. henselae sau cu B. clarridgeiae o doză crescută, de 10 mg/kg, administrată la 12 ore, timp de 4-6 săptămâni, poate elimina infecţia din organism.
Indiferent ce antibiotic alegem să folosim, tratamentul trebuie efectuat pe o durată de 4-6 săptămâni pentru a avea eficienţa scontată.
Prevenire, combatere şi riscuri
Din cauza potenţialului zoonotic şi a modului extrem de facil de transmitere, pericolul de expunere pentru medicul veterinar este foarte mare.
Transmiterea realizată prin muşcătură de pisică, zgârietură, prin intermediul vectorilor (puricii) sau prin contact direct cu sângele sau alte secreţii de la animalul infectat este facilitată în camera de urgenţă când principala preocupare a medicului veterinar este stabilizarea animalului sever bolnav, traumatizat sau debilitat. De aceea se recomandă folosirea de către medicul veterinar a echipamentului de protecţie, spălarea frecventă pe mâini şi evitarea înţepăturilor şi tăieturilor la nivelul mâinilor.
Tot medicului veterinar îi revine şi sarcina de a informa populaţia (crescători sau iubitori de pisici) asupra epidemiologiei şi implicaţiilor zoonotice asociate cu patogeneza şi transmiterea prin vectori.
De asemenea, este de datoria medicilor veterinari şi a autorităţilor competente să stabilească şi să pună în practică un plan de combatere a vectorilor (purici, păduchi, căpuşe).
S-a demonstrat şi este indubitabil că, odată cu scăderea drastică a vectorilor din mediul înconjurător, prevalenţa bartonelozei în populaţia de pisici este net diminuată(19).
Bibliografie
2. Birtles R.J., Harrison T.G., Saunders N.A., Molyneux D.H. (1995) – “Proposals to unify the genera Grahamella and Bartonella, with descriptions of Bartonella talpae comb. nov., Bartonella peromysci comb. nov., and three new species, Bartonella grahamii sp. nov., Bartonella taylorii sp. nov., and Bartonella doshiae sp. nov.” Int J Syst Bacteriol.
3. Kordick D.L., Swaminathan B., Greene C.E., Wilson K.H., Whitney A.M., O’Connor S., Hollis D.G., Matar G.M., Steigerwalt A.G., Malcolm G.B., Hayes P.S., Hadfield T.L., Breitschwerdt E.B., Brenner D.J. (1996) – “Bartonella vinsonii subsp. berkhoffii subsp. nov., isolated from dogs: Bartonella vinsonii subsp. vinsonii; an emended description of Bartonella vinsonii” Int J Syst Bacteriol.
4. Lawson P. A., Collins M. D. (1996) – “Description of Bartonella clarridgeiae sp. nov. isolated from the cat of a patient with Bartonella henselae septicemia” pp. 64–73.
5. Heller R., Riegel P., Hansmann Y., Delacour G., Bermond D., Dehio C., Lamarque F., Monteil H., Chomel B., Piemont Y. (1998) – “Bartonella tribocorum sp. nov., a new Bartonella species isolated from the blood of wild rats” pp. 1333–1339.
6. Droz A., Chi B., Horn E., Steigerwalt A.G., Whitney A.M., Brenner D.J. (1999) – “Bartonella koehlerae sp. nov., isolated from cats” J Clin Microbiol. pp. 1117–1122.
7. Heller R., Kubina M., Mariet P., Riegel P., Delacour G., Dehio C., Lamarque F., Kasten R., Boulouis H-J, Monteil H., Chomel B., Piemont Y. (1999) – “Bartonella alsatica sp. nov., a new Bartonella species isolated from the blood of wild rabbits” Int J Syst Bacteriol. pp. 283–288.
8. Welch D.F., Carroll K.C., Hofmeister E.K., Persing D.H., Robison D.A., Steigerwalt A.G., Brenner D.J. (1999) – “Isolation of a new subspecies, Bartonella vinsonii subsp. arupensis, from a cattle rancher: identity with isolates found in conjunction with Borrelia burgdorferi and Babesia microti among naturally infected mice” J Clin Microbiol pp. 2598–2601.
9. Chomel B.B., Boulouis H.J., Maruyama S. (2006) - “Bartonella spp. in pets and effect on human health” pp. 389–394.
10. Telford S.R. III, Wormser G.P. (2010) - “Bartonella spp. transmission by ticks not established” Emerg Infect Dis. Vol. 16 (3), pp. 379–84.
11. Schouls L.M., Van De Pol I., Rijpkema S.G.T., Schot C.S. (1999) – “Detection and identification of Ehrlichia, Borrelia burgdorferi sensu lato, and Bartonella species in Dutch Ixodes ricinus ticks” J Clin Microbiol. pp. 2215–2222.
12. Chomel B., Kasten R.W., Floyd-Hawkins K., Chi B., Yamamoto K., Roberts-Wilson J., Gurfield A.N., Abbott R.C., Pedersen N.C. (1996) – “Experimental transmission of Bartonella henselae by the cat flea” J Clin Microbiol. pp. 1952–1956.
13. Higgins J.A., Radulovic S., Jaworski D.C., Azad A.F. (1996) – “Acquisition of the cat scratch disease agent Bartonella henselae by cat fleas” pp. 490–495.
14. Guptill L., Slater L.N., Wu C.C. (1998) - “ Evidence of reproductive failure and lack of perinatal transmission of Bartonella henselae in experimentally infected cats” pp. 177–189.
15. Burgess A.W.O., Paquet J-Y, Letesson J-J, Anderson B.E. (2000) - „Isolation, sequencing and expression of Bartonella henselae omp43 and predicted membrane topology of the deduced protein” pp. 73–80.
16. Dehio C., Meyer M., Berger J., Schwarz H., Lanz C. (1997) – “Interaction of Bartonella henselae with endothelial cells results inbacterial aggregation on the cell surface and the subsequentengulfment and internalisation of the bacterial aggregate by aunique structure, the invasome” – J. Cell. Sci. 110 pp. 2141–2154.
17. Merrell D.S., Falkow S. (2004) - “Frontal and stealth attack strategies in microbial pathogenesis” pp. 250–256.
18. Brunt J., Guptill L., Kordick D.L., American Association of Feline Practitioners (2006) - “Academy of Feline Medicine Advisory Panel. American Association of Feline Practitioners 2006 Panel report on diagnosis, treatment, and prevention of Bartonella spp. infections” J Feline Med Surg pp. 213–226.
19. Bradbury C.A., Lappin M.R. (2009) - “Prevention of Bartonella henselae transmission from cat fleas (Ctenocephalides felis) to cats by topical 10% imidacloprid 1% moxidectin application” J Am Vet Med Assoc.
20. Anderson B.E., Neuman M.A. (1997) – “Bartonella spp. as emerging human pathogens”, Clin Microbiol Rev. vol.10, pp. 203–219.
21. Breitschwerdt, E.B., Kordic D.L. (2000) - “Bartonella infection in animals: carriership, reservoir potential, pathogenicity and zoonotic potential for human infection” Clin. Microbiol. Rev. pp. 428-438.
22. Biswas S., Raoult D., Rolain J.M. (2007) - “Molecular mechanisms of resistance to antibiotics in Bartonella bacilliformis” J Antimicrob Chemother, pp. 1065–1070.
23. Billeter S.A., Levy M.G., Chomel B.B. (2008) - “Vector transmission of Bartonella species with emphasis on the potential for tick transmission” Med Vet Entomol, pp. 1–15.
24. Bergmans A.M.C., Hulskotte E.G.J., de Jong C.M.A., van Amerongen G., Osterhaus A. D.M.E., Schouls L.M. (1996) – “Experimental infection of cats and macaques with Bartonella henselae: kinetics of bacteremia and efficacy of antibiotic treatment in cats” Ph.D. thesis., Bilthoven, Olanda, Universitatea Utrecht, pp. 101–119.
25. Chomel B.B., Boulouis H.J., Maruyama S. (2006)– “Bartonella spp. in pets and effect on human health” Emerg. Infect. Dis., Vol. 12, pp. 389–394.
26. Chomel B.B., Boulouis H.J., Breitschwerdt E.B. (2009) - “Ecological fitness and strategies of adaptation of Bartonella species to their hosts and vectors” Vet. Res., Vol 40, p. 29.
27. Chomel B.B., Wey A.C., Kasten R.W. (2003) - “Fatal case of endocarditis associated with Bartonella henselae type I infection in a domestic cat” pp. 5337–5339.
28. Kordick D.L., Breitschwerdt E.B. (1997) – “Relapsing bacteremia following blood transmission of Bartonella henselae in cats” Am. J. Vet. Res., Vol. 58, pp. 492–497.
29. Dehio C. 2004 - “Molecular and cellular basis of bartonella pathogenesis” Annu. Rev. Microbiol., Vol. 58, pp. 365–390.
30. Dehio C., Meyer M., Berger J., Schwarz H., Lanz C. (1997) – “Interaction of Bartonella henselae with endothelial cells results in bacterial aggregation on the cell surface and the subsequent engulfment and internalisation of the bacterial aggregate by a unique structure, the invasome” J Cell Sci., Vol. 110, pp. 2141–2154.
31. Foley J.E., Chomel B., Kikuchi Y., Yamamoto K., Pedersen N.C. (1998) - “Seroprevalence of Bartonella henselae in cattery cats: association with cattery hygiene and flea infestation” Vet Q., Vol. 20, pp. 1–5.
32. Greene C.E., McDermott M., Jameson P.H. (1996) – “Bartonella henselae infection in cats: evaluation during primary infection, treatment, and rechallenge infection” J Clin Microbiol., Vol. 34, pp. 1682–1685.
33. Heller R., Artois M., Xemar V., DeBriel D., Gehin H., Jaulhac B., Monteil H., Piemont Y. (1997) – “Prevalence of Bartonella henselae and Bartonella clarridgeiae in stray cats” J Clin Microbiol., Vol. 35, pp. 1327–1331.
34. Guptill L., Slater L., Wu C., Lin T., Glickman L., Welch D., HogenEsch H. (1997) – “Experimental infection of young cats with the zoonotic organism Bartonella henselae” J Infect Dis. Vol. 176, pp. 206–216.
35. Heller R., Riegel P., Hansmann Y., Delacour G., Bermond D., Dehio C., Lamarque F., Monteil H., Chomel B., Piemont Y. (1998) – “Bartonella tribocorum sp. nov., a new Bartonella species isolated from the blood of wild rats”, pp. 1333–1339.
36. Kordick D.L., Breitschwerdt E.B. (1997) - “Relapsing bacteremia following blood transmission of Bartonella henselae in cats”, pp. 492–497.
37. Kordick D.L, Wilson K.H., Sexton D.J. (1995) – “Prolonged Bartonella bacteremia in cats associated with cat-scratch disease patients” J Clin Microbiol. Vol. 33, pp. 3245–3251.
38. Kordick D.L., Brown T.T., Shin K., Breitschwerdt E.B. (1999) - “Clinical and pathologic evaluation of chronic Bartonella henselae or Bartonella clarridgeiae infection in cats” J Clin Microbiol., Vol.37, pp. 1536–1547.
39. Kordick D.L., Breitschwerdt E.B. (1995) – “Intraerythrocytic presence of Bartonella henselae” J Clin Microbiol., Vol. 33, pp. 1655–1656.
40. Lappin M.R., Breitschwerdt E., Brewer M. (2009) - “Prevalence of Bartonella species antibodies and Bartonella species DNA in the blood of cats with and without fever” J Feline Med Surg., Vol. 11 (2), pp. 141–148.
41. Lappin M.R., Black J.C. (1999) – “Bartonella spp. infection as a possible cause of uveitis in a cat” J Am Vet Med Assoc., Vol. 214, pp. 1205–1207.
42. Eremeeva M.E., Gerns H.L., Lydy S.L. (2007) – “Bacteremia, fever, and splenomegaly caused by a newly recognized bartonella species” N Engl J Med., Vol. 356 (23), pp. 2381–2387.
43. Maurin M., Raoult D. (1998) – “Bartonella infections: diagnostic and management issues” Curr Opin Infect Dis., Vol. 11, pp. 189–193.
44. Mehock J.R., Greene C.E., Gherardini F.C., Hahn T-W, Krause D.C. (1998) - “Bartonella henselae invasion of feline erythrocytes in vitro” Infect Immun. Vol. 66, pp. 3462–3466.
45. O’Reilly K.L., Bauer R.W., Freeland R.L., Foil L.D., Huges K.J., Rohde K.R., Roy A.F., Stout R.W., Triche P. (1999) – “Acute clinical disease in cats following infection with a pathogenic strain of Bartonella henselae” (LSU 16) Infect Immun. Vol. 67, pp. 3066–3072.
46. Rolain J.M., Franc M., Davoust B. (2003) – “Molecular detection of Bartonella quintana, B. koehlerae, B. henselae, B. clarridgeiae, Rickettsia felis, and Wolbachia pipientis in cat fleas” Emerg Infect Dis. Vol. 9, pp. 338–342.
47. Chomel B.B., Kasten R.W., Floyd-Hawkins K.A. (1997) – “Experimental and natural infection with Bartonella henselae in domestic cats” Comp Immunol Microbiol Infect Dis. Vol. 20, pp. 41–51.
48. Quimby J.M., Elston T., Hawley J. (2008) - “Evaluation of the association of Bartonella species, feline herpesvirus 1, feline calicivirus, feline leukemia virus and feline immunodeficiency virus with chronic feline gingivostomatitis” J Feline Med Surg. Vol. 10(1), pp. 66–72.
49. Sander A., Ruess M., Bereswill S., Schuppler M., Steinbrueckner B. (1998) – “Comparison of different DNA fingerprinting techniques for molecular typing of Bartonella henselae isolates” J Clin Microbiol. Vol. 36, pp. 2973–2981.
50. Schulein R., Seubert A., Gille C. (2001) – “Invasion and persistent intracellular colonization of erythrocytes. A unique parasitic strategy of the emerging pathogen Bartonella” J Exp Med. Vol. 193, pp. 1077–1086.
51. Brunt J., Guptill L., Kordick D.L. (2006) – “American Association of Feline Practitioners, Academy of Feline Medicine Advisory Panel. American Association of Feline Practitioners 2006 Panel report on diagnosis, treatment, and prevention of Bartonella spp. infections” J Feline Med Surg. Vol. 8 (4), pp. 213–226.
52. Miller W., Morris A.K., Lappin M.R. (2009) – “Effect of orbifloxacin or doxycycline administration on Bartonella spp. and hemplasma test results from naturally exposed cats” Proceedings of the American College of Veterinary Internal Medicine Annual Forum, Montreal, Canada. p. 774.
53. Kordick D.L., Papich M.G., Breitschwerdt E.B. (1997) – “Efficacy of enrofloxacin or doxycycline for treatment of Bartonella henselae or Bartonella clarridgeiae infection in cats” Antimicrob Agents Chemother. Vol. 41, pp. 2448–2455.
54. Regnery R.L., Rooney J.A., Johnson A.M. (1997) – “Experimentally induced Bartonella henselae infections followed by challenge exposure and antimicrobial therapy in cats” Am J Vet Res. Vol. 58, p. 803.
55. Greene C.E., McDermott M., Jameson P.H. (1996) – “Bartonella henselae infection in cats: evaluation during primary infection, treatment, and rechallenge infection” J Clin Microbiol. Vol. 34 (7), pp. 1682–1685.
56. Zeaiter Z., Liang Z., Raoult D. (2002) - “Genetic classification and differentiation of Bartonella species based on comparison of partial ftsZ gene sequences” J. Clin. Microbiol., Vol. 40 (10), pp. 3641–7.
57. Jacomo V., Kelly P.J., Raoult D. (2002) - “Natural history of Bartonella infections (an exception to Koch’s postulate)” Clin. Diagn. Lab. Immunol. Vol. 9 (1), pp. 8–18.
Articole din ediţiile anterioare
Cercetări privind protocoalele de dializă peritoneală la felinele cu afectare renală în diferite stadii
Dializa peritoneală este considerată metodă de substituţie a funcţiei renale în medicina veterinară, cu rolul de suplinire continuă a funcţiei rena...
Aspecte generale privind impactul stresului asupra principalelor manifestări comportamentale la felinele domestice
Expunerea felinelor domestice la diverşi factori de stres s-a dovedit a avea un impact negativ asupra bunăstării generale a indivizilor, declanşând...
Reproducţia la feline – particularităţi şi modalităţi de control
Articolul trece în revistă principalele niveluri de reglare hormonală a activităţii sexuale la felinele domestice, accentuând particularităţile car...