Brain injury represents the disruption of physiological function and the alteration of the brain structure induced by an external force. Cranial trauma is not always accompanied by brain trauma. In order to diagnose a brain trauma, the patient must present: altered mental status, neurological deficits and/or intracranial lesions confirmed by advanced imaging. The therapeutic conduct for the treatment of dogs and cats with traumatic brain injury is extrapolated from human medicine, isolated clinical trials in animals, and from anecdotal experience.
Traumatismul craniocerebral
Traumatic brain injury
First published: 25 mai 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.36.2.2022.6432
Abstract
Rezumat
Traumatismul cerebral reprezintă întreruperea funcţiei fiziologice şi alterarea structurii encefalului, induse de o forţă externă. Traumatismele craniene nu sunt întotdeauna însoţite de traumatisme cerebrale. Pentru a avea un traumatism cerebral, pacientul trebuie să prezinte: alterarea statusului mental, deficite neurologice şi/sau leziuni intracraniene confirmate prin imagistică avansată. Conduita terapeutică pentru tratarea câinilor şi pisicilor care prezintă leziuni traumatice cerebrale este extrapolată din medicina umană, studii clinice izolate la animale şi din experienţă de cabinet.
Introducere
Traumatismul cerebral reprezintă întreruperea funcţiei fiziologice şi alterarea structurii encefalului, induse de o forţă externă. Traumatismele craniene nu sunt întotdeauna însoţite de traumatisme cerebrale. Pentru a avea un traumatism cerebral, pacientul trebuie să prezinte: alterarea statusului mental, deficite neurologice şi/sau leziuni intracraniene confirmate prin imagistică avansată.
Cel mai des întâlnite cauze ale traumatismului cerebral sunt reprezentate de accidentele rutiere, muşcături, căderi de la înălţime şi lovituri la nivelul capului. Leziunile cerebrale traumatice reprezintă una dintre cel mai des întâlnite urgenţe neurologice, fiind adesea însoţite de politraumatisme, fiind necesară o abordare multidisciplinară pentru diagnosticul şi stabilizarea pacientului.
Conduita terapeutică pentru tratarea câinilor şi pisicilor care prezintă leziuni traumatice cerebrale este extrapolată din medicina umană, studii clinice izolate la animale şi din experienţă de breaslă. De asemenea, leziunile apărute în urma politraumatismelor (hemoragii, leziuni la nivelul altor organe) pot complica luarea deciziilor şi pot influenţa rezultatele tratamentului. Pentru a afla cum putem trata leziunile traumatice cerebrale, este necesară înţelegerea:
Neuroanatomiei – ce structuri sunt implicate (prozencefalul/trunchiul cerebral/cerebelul) şi ce semne clinice sunt asociate cu afectarea lor.
Fiziologiei/fiziopatologiei – presiunea intracraniană, edemul cerebral, alterarea barierei hematoencefalice.
Aspecte fiziologice
Creierul primeşte 15-20% din debitul cardiac total cu fiecare ciclu cardiac. Rata metabolică ridicată şi dependenţa creierului de o circulaţie adecvată pentru nutrienţi demonstrează necesitatea unui flux sangvin adecvat.
Fluxul sangvin cerebral (FSC) este determinat de presiunea arterială sistemică, dar este dependent de mai mulţi factori. Frecvenţa cardiacă şi nivelul de oxigen şi de dioxid de carbon din sânge au un efect semnificativ asupra FSC. FSC normal are loc la o tensiune arterială între 50 mmHg şi 150 mmHg.
În momentul în care bariera hematoencefalică este afectată în urma traumatismelor cerebrale, scade presiunea de perfuzie cerebrală (PPC). PPC este definită ca fiind diferenţa dintre tensiunea arterială (TA) şi presiunea intracraniană (PIC) (figura 1).
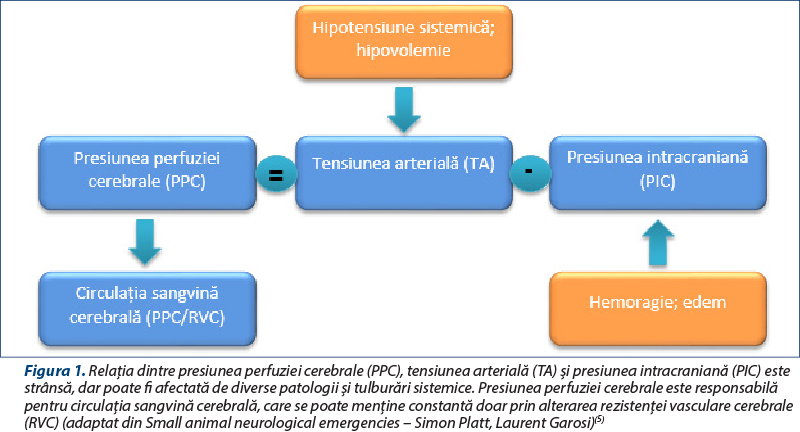
Aspecte fiziopatologice ale leziunilor cerebrale traumatice şi clasificarea lor
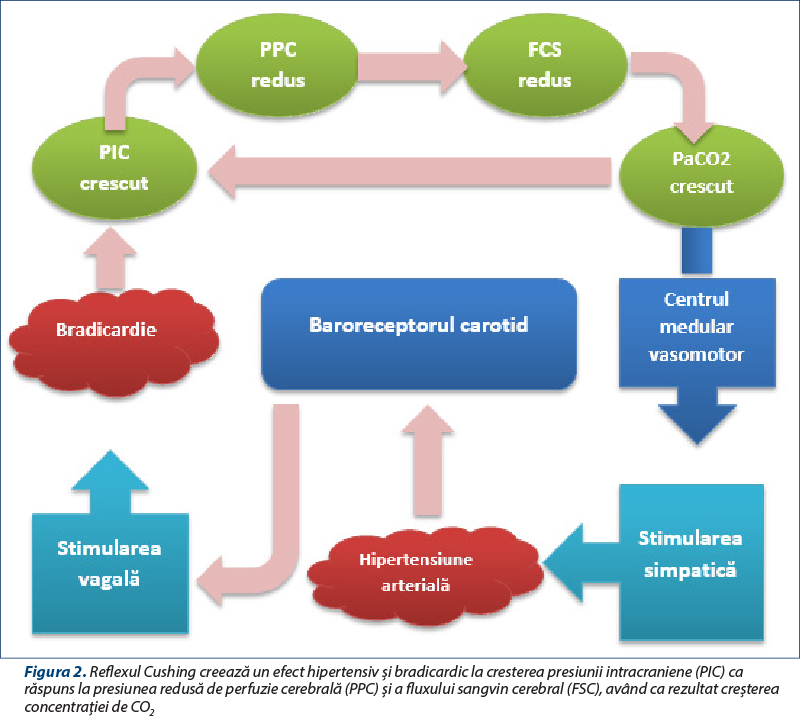
Reducerea PPC din cauza PIC crescute poate duce la fenomene ischemice la nivelul parenchimului cerebral. O serie de răspunsuri fiziologice apar când PPC este redus, pentru a putea preveni acest lucru:
-
Reducerea fluxului sangvin în centrii vasomotori din trunchiul cerebral va duce la eliminarea redusă a dioxidului de carbon.
-
Ulterior, creşterea concentraţiei de dioxid de carbon va stimula sistemul nervos simpatic să crească tensiunea arterială – va apărea hipertensiunea sistemică pentru a menţine fluxul sangvin la nivel cerebral.
-
Baroreceptorii situaţi la nivelul aortei şi al sinusurilor carotidiene vor detecta hipertensiunea sistemică şi vor transmite semnale către centrii vagali din trunchiul cerebral, iar drept consecinţă, va apărea bradicardia vagală reflexă.
Acest fenomen poartă denumirea de reflex Cushing şi este un răspuns fiziologic al sistemului nervos la creşterea presiunii intracraniene. Reflexul Cushing se prezintă în mod clasic ca o creştere a presiunii sistolice, reducere a frecvenţei cardiace (bradicardie) şi respiraţie neregulată. Pacienţii cu reflex Cushing reprezintă o urgenţă medicală, deoarece creşterea de presiune intracraniană acută poate duce la hernierea cerebrală şi, consecutiv, la decesul pacientului (figura 2).
Leziunile primare cerebrale
-
Fracturi ale craniului (închise/deschise; cominutivă/liniară/dehiscentă).
-
Hemoragii (extraaxiale – epidurale/subarahnoidiene/subdurale; intraaxiale – intraparenchimale). Scăderea fluxului sangvin cerebral secundară creşterii presiunii intracraniene cauzate de prezenţa hematoamelor şi a hemoragiilor va exacerba leziunile cerebrale secundare.
-
Contuzii cerebrale – pot apărea la locul traumei (leziune de tip „coup”) sau în emisfera cerebrală opusă (leziune de tip „countercoup”).
-
Comoţii cerebrale – paralizia traumatică reversibilă a funcţiei sistemului nervos (durată variabilă).
-
Laceraţii cerebrale.
Leziunile secundare cerebrale
-
Cascada de evenimente biomoleculare – eliberare masivă de neurotransmiţători excitatori (glutamat) (figura 3).
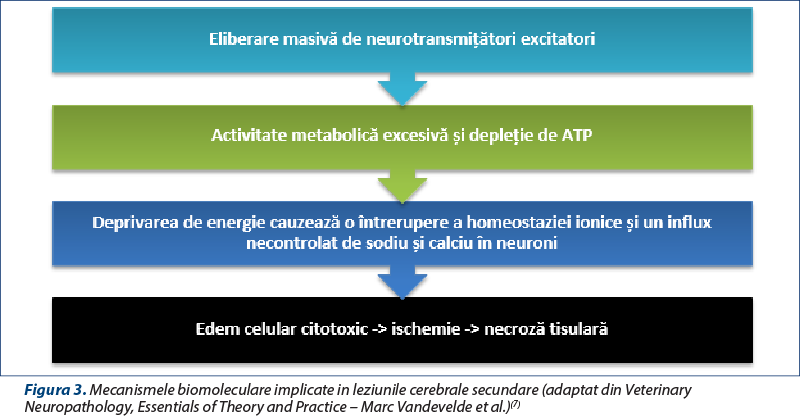
Figura 3. Mecanismele biomoleculare implicate in leziunile cerebrale secundare (adaptat din Veterinary Neuropathology, Essentials of Theory and Practice – Marc Vandevelde et al.)(7) -
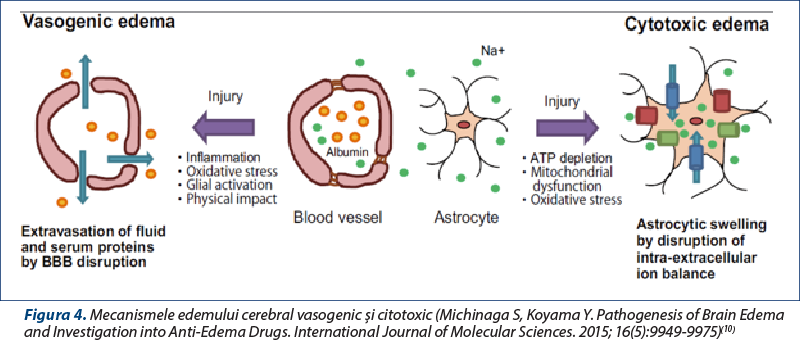
Edemul cerebral (figura 4):
-
citotoxic – apare secundar acumulării de calciu intracelular;
-
vasogenic – apare prin întreruperea barierei hematoencefalice şi a vasodilaţiei.
-
-
Ischemia cerebrală.
-
Creşterea de presiune intracraniană – hernii cerebrale/cerebelare.
Abordarea pacienţilor cu traumatism cranio-cerebral
1. Evaluarea sistemică
-
Evaluarea căilor respiratorii.
-
Evaluarea sistemului cardiovascular – monitorizarea frecvenţei cardiace (electrocardiogramă) şi măsurarea tensiunii arteriale.
-
Măsurarea temperaturii corporale.
-
Analize biochimice, hemoleucogramă, gaze, electroliti şi nivelul lactatului.
-
Radiografii toracice şi abdominale, ± radiografii cervicale (după stabilizarea pacientului). În urma politraumatismelor pot apărea contuzii pulmonare, pneumotorax, hemoragii, fracturi şi leziuni la nivelul altor organe.
-
Ecografie abdominală prin tehnica POCUS („point of care ultrasound”) – evaluarea integrităţii organelor interne, prezenţa hemoragiilor şi a lichidelor libere în abdomen.
2. Evaluarea neurologică
Evaluarea neurologică trebuie efectuată la toţi pacienţii care prezintă politraumatisme. La cei care prezintă traumatism cranio-cerebral, examenul neurologic trebuie efectuat la fiecare 30-60 de minute, deoarece acesta permite evaluarea eficacităţii tratamentului şi a recunoaşterii semnelor de deterioare a pacientului.
Scopul evaluării neurologice la pacienţii cu traumatism cranio-cerebral este de a determina:
-
Deficitele neurologice (neurolocalizare – emisfere cerebrale/trunchi cerebral/cerebel) şi severitatea leziunii.
-
Leziuni ale măduvei spinării şi ale sistemului nervos periferic – politraumatismele pot fi asociate cu fracturi ale coloanei vertebrale şi traumatisme ale plexurilor nervoase/nervilor periferici.
La pacienţii cu traumatism cranio-cerebral, evaluarea neurologică cuprinde trei mari categorii:
-
statusul mental – de obicei alterat (dezorientat/depresat/stupor/comă);
-
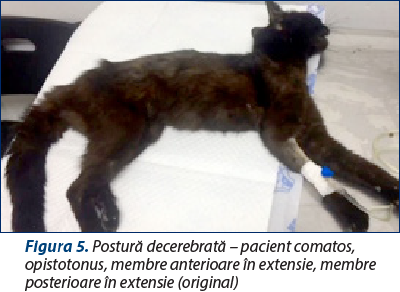
activitatea motorie – evaluarea mersului (hemipareză/tetrapareză) şi a posturii (decerebrată – figura 5/decerebelată – figura 6);
-
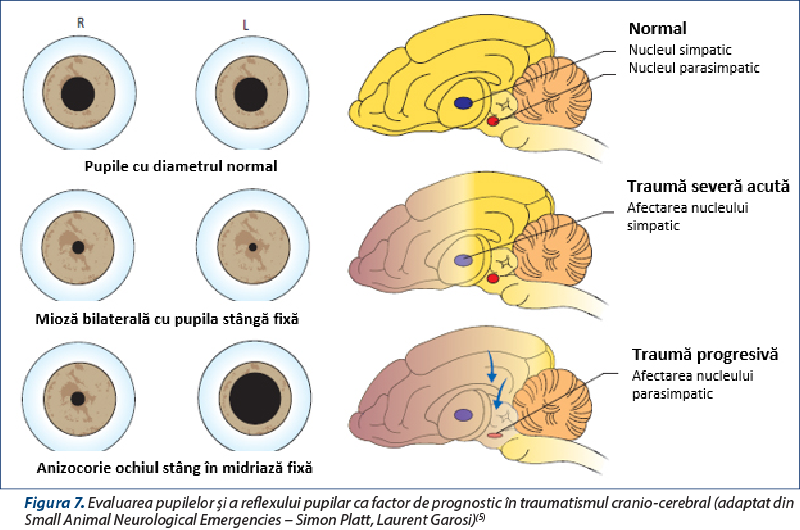
reflexele trunchiului cerebral (diametrul pupilelor şi reflexul pupilar (figura 7) – sistemul nervos simpatic şi parasimpatic/reflexul vestibulo-ocular).

Scorul Glasgow modificat
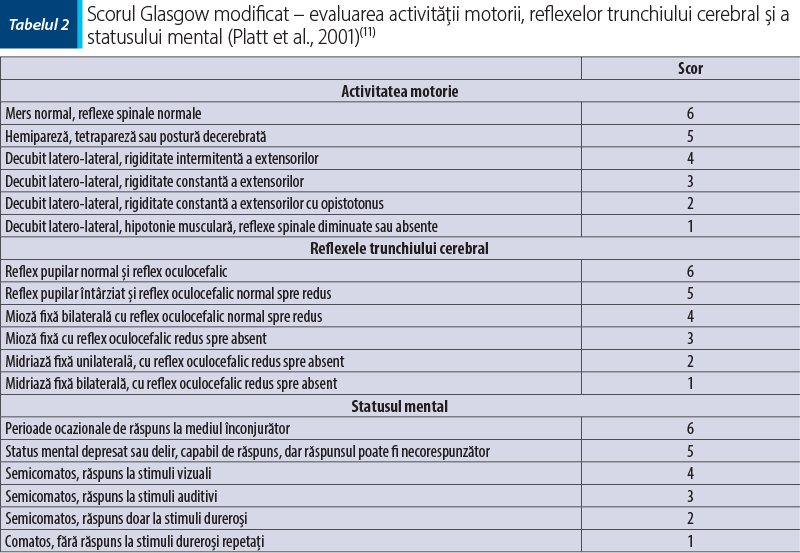
Un sistem de scor a fost dezvoltat în medicina veterinară pentru a putea evalua deficitele neurologice la pacienţii cu traumatism cranio-cerebral. În medicina umană, scorul Glasgow este folosit pentru evaluarea pacienţilor cu traumatism cranio-cerebral prin evaluarea răspunsurilor verbale, vizuale şi motorii.
Scorul Glasgow a fost adaptat în medicina veterinară şi este denumit scorul Glasgow modificat (MGCS – Modified Glasgow Coma Scale) (tabelul 2). Cu ajutorul acestui scor se evaluează trei categorii: statusul mental, activitatea motorie şi reflexele trunchiului cerebral. Fiecare categorie este notată de la 1 la 6 (1 reprezentând scorul minim, 6 scorul maxim). Scorurile de la cele trei categorii sunt adunate şi determină MGCS(3-18) (tabelul 1, figura 8).
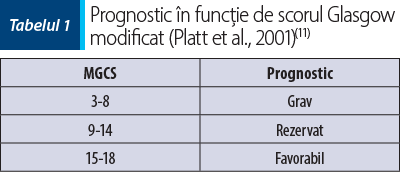
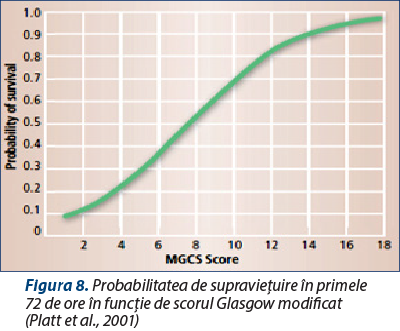
Probabilitatea de supravieţuriere creşte cu cât scorul este mai mare. Acest scor ne indică eficacitatea tratamentului, iar reevaluarea seriată ajută la formularea prognosticului şi la adaptarea conduitei terapeutice.
Metode de diagnostic
Se realizează pe baza istoricului şi a semnelor clinice (traumatismele cranio-cerebrale sunt asociate cu semne neurologice).
Imagistică
Radiografia
-
Tehnică rar folosită pentru diagnostic. Poate ajuta în identificarea anumitor tipuri de fracturi ale craniului, dar nu oferă detalii ale parenchimului cerebral. Poate fi folosită pentru evaluarea iniţială a toracelui, abdomenului şi a coloanei vertebrale.
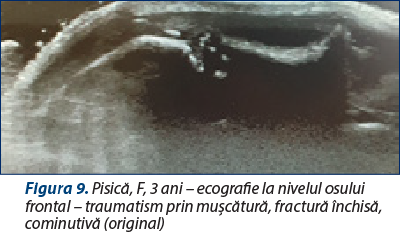
Ecografia (figura 9)
-
Parenchimul cerebral poate fi evaluat printr-un defect osos (în urma fracturilor de craniu).
-
Poate fi folosită pentru evaluarea diametrului tecii nervului optic (în suspiciune de creştere a presiunii intracraniene).
Ecografia Doppler poate ajuta la evaluare fluxului sangvin al arterelor bazilare care, indirect, poate indica creşterea presiunii intracraniene.
Tomografia computerizată (CT)
-
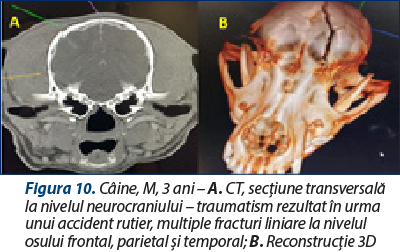
Avantaje – oferă detalii osoase superioare radiografiei/reconstrucţie 3D pentru planificarea intervenţiilor chirurgicale/poate detecta hemoragiile intracraniene şi efectele de masă (figura 10). De asemenea, are o durată scurtă de scanare.
-
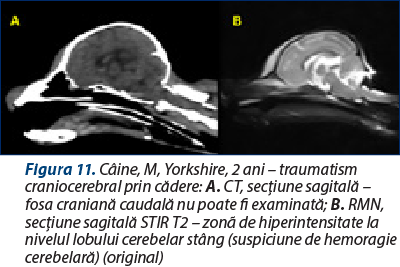
Dezavantaje – nu oferă detalii asupra parenchimului cerebral (figura 11); CT-ul trebuie folosit doar dacă pacientul este sever afectat sau dacă necesită intervenţie chirurgicală.
-
Poate oferi factori de prognostic prin măsurarea scorului Koret (Koret CT Score – KCTS).
Rezonanţa magnetică nucleară (RMN)
-
Avantaje – oferă detalii superioare asupra parenchimului cerebral (figura 11)/poate detecta modificările subtile ale fosei craniene caudale care nu sunt observate pe CT.
-
Dezvantaje – necesită anestezie/fracturile craniului pot fi evaluate, dar CT-ul oferă detalii superioare.
-
Rezonanţa magnetică nucleară poate oferi factori de prognostic (grad I-VI) la pacienţii cu leziuni cerebrale traumatice.
Management terapeutic
Stabilizarea sistemică
-
corectarea şocului hipovolemic prin fluidoterapie;
-
stabilizarea respiratorie prin oxigenoterapie;
-
stabilizarea cardiovasculară.
Stabilizarea neurologică
-
reducerea presiunii intracraniene;
-
managementul crizelor de tip epileptiform;
-
intervenţii neurochirurgicale pentru stabilizarea fracturilor de craniu, evacuarea hemoragiilor şi a hematoamelor, controlul presiunii intracraniene;
-
corticosteroizii sunt CONTRAINDICAŢI la pacienţii cu traumatisme cranio-cerebrale, deoarece produc efecte adverse: hiperglicemie, imunosupresie şi semne gastrointestinale (vomă/diaree).
Tratament de susţinere
-
montarea de cateter urinar şi monitorizarea frecvenţei urinare;
-
dietă nutriţională adecvată;
-
evitarea ulcerelor/escarelor decubitale.
În medicina veterinară a fost propus un sistem progresiv de terapie bazat pe niveluri (nivel 1-3), în funcţie de severitatea semnelor clinice. Nivelul 1 de terapie este administrat tuturor pacienţilor; nivelul 2 de terapie este administrat pacienţilor cu scor Glasgow modificat sub 8 sau care nu au răspuns la nivelul 1 de terapie; nivelul 3 de terapie este administrat pacienţilor cu scor Glasgow modificat sub 8 şi care nu au răspuns la nivelul 2 de terapie (figura 12).
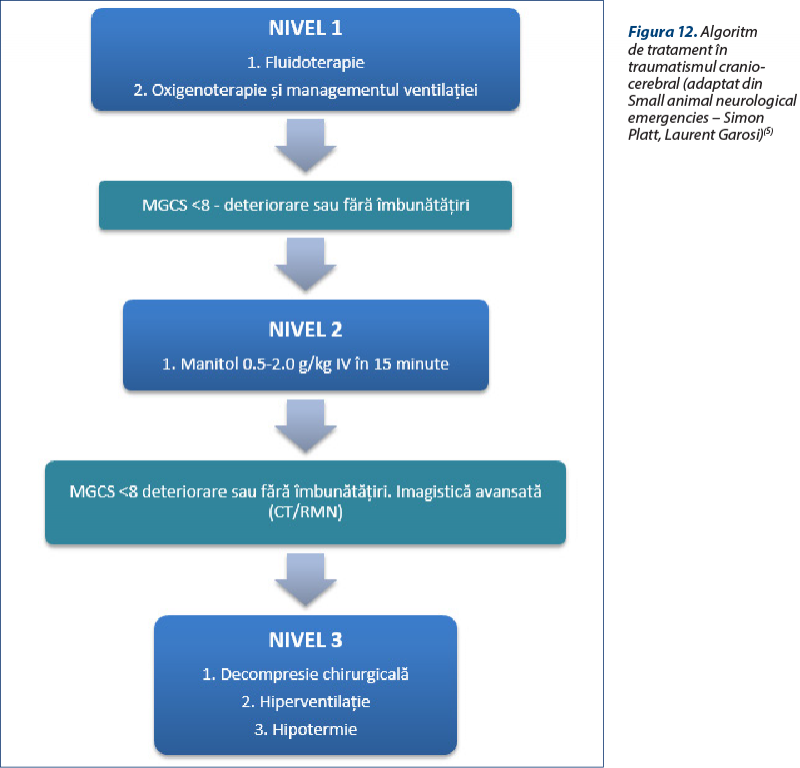
Nivelul 1
Fluidoterapia are ca scop reechilibrarea hidroelectrolitică şi stabilizarea şocului hipovolemic.
-
Terapia cu soluţii cristaloide (NaCl 0,9%/Ringer/Ringer lactat): doze de şoc (90 ml/kg la câine; 60 ml/kg la pisică); dozele trebuie administrate fracţionat, iar pacientul trebuie să fie reevaluat constant până la corectarea hipovolemiei.
-
Terapia cu soluţie hipertonă salină (NaCl 7,5%) şi soluţii coloide: ajută la restabilirea rapidă a volumului sangvin.
-
Avantaje: rămân în circulaţie o perioadă mai lungă; îmbunătăţesc debitul cardiac; corectează hipervolemia.
-
Dezavantaje: produc deshidratare (trebuie administrate întotdeauna concomitent cu soluţii cristaloide pentru evitarea deshidratării).
-
-
Soluţia hipertonă salină (NaCl 7,5%) – este preferată la pacienţii cu şoc hipovolemic, hipotensivi şi cu creştere de presiune intracraniană. Este contraindicată dacă pacienţii prezintă deshidratare şi hipernatremie. Doza recomandată este de 5-6 ml/kg (la câine) şi 2-4 ml/kg (la pisică), administrată în 5-10 minute. Pentru a putea maximiza efectul consecutiv trebuie administrate soluţii cristaloide.
Oxigenoterapia şi managementul ventilaţiei
Oxigenoterapia este recomandată la toţi pacienţii cu traumatism cranio-cerebral. Oxigenoterapia şi managementul ventilaţiei au ca scop menţinerea presiunii parţiale de oxigen (PaO2) mai mare sau egală cu 90 mmHg şi a presiunii parţiale a dioxidului de carbon (PaCO2) între 35 mmHg şi 40 mmHg.
Nivelul 2
Este folosit ca terapie la pacienţii care nu răspund la nivelul 1 de terapie şi este indicat la pacienţii care prezintă MGCS sub 8.
-
Diureticele osmotice – manitol se adminstrează în doză de 0,5-2 g/kg bolus în 15 minute. Manitolul reduce edemul cerebral în 15-30 de minute de la administrare, iar efectul poate dura aproximativ 2-5 ore.
-
Avantaje – îmbunătăţeşte fluxul sangvin cerebral şi scade presiunea intracraniană prin reducerea edemului cerebral, reduce vâscozitatea sângelui, expandează volumul de plasmă şi elimină radicalii liberi care contribuie la leziunile secundare.
-
Dezvantaje – este contraindicat la pacienţii care nu au fost resuscitaţi hidroelectrolic deoarece poate produce insuficienţă renală. Dozele administrate repetat produc diureză, care va duce la scăderea volumului plasmei, creşterea osmolarităţii, deshidratare intracelulară, hipotensiune şi ischemie tisulară.
-
-
Managementul crizelor de tip epileptiform – acestea trebuie tratate agresiv deoarece produc efecte secundare asupra parenchimului cerebral (hipoxie tisulară/edem cerebral).
-
Diazepam – în doză de 0,5-2 mg/kg i.v., folosit iniţial.
-
Fenobarbital – în doză de 2-3 mg/kg i.v. sau i.m. (dacă pacientul nu răspunde la diazepam); doza se poate ajusta până la doza de încărcare (18-24 mg/kg i.v. sau i.m., administrat fracţionat în 24-48 de ore). Poate depresa statusul mental.
-
Levetiracetam – în doză de 20-60 mg/kg i.v. – efectul durează până la 8 ore (avantajul este reprezentat de faptul că nu este metabolizat la nivel hepatic).
-
Terapie de menţinere după stabilizarea iniţială cu fenobarbital 2-3 mg/kg p.o.
-
În cazul crizelor de tip epileptiform refractare – propofol (4-8 mg/kg bolus urmat de 1-5 mg/kg/oră în rata de infuzie constantă).
-
Nivelul 3
Se foloseşte în cazul pacienţilor care nu răspund la nivelul 2 de terapie. În cazul pacienţilor cu scor Glasgow modificat sub 8, care nu răspund la primele două niveluri de terapie, este recomandată imagistica avansată (CT/RMN). Nu sunt suficiente studii în medicina veterinară care să confirme eficacitatea terapiei de nivel 3.
-
Hiperventilaţia – trebuie evitată pe o perioadă lungă deoarece poate produce vasoconstricţie, ce va duce la apariţia fenomenelor de ischemie tisulară şi perfuzie cerebrală scăzută.
-
Hipotermia controlată şi coma indusă – folosită experimental pentru a reduce rata metabolică cerebrală şi consumul de oxigen.
-
Terapia cu progesteron – folosită experimental în medicina umană pentru efectele neuroprotectoare ale progesteronului.
-
Intervenţiile chirurgicale (craniotomia/craniectomia): sunt indicate la pacienţii care nu răspund la primele niveluri de terapie. Acestea sunt indicate pentru evacuarea hematoamelor, scăderea presiunii intracraniene şi remedierea fracturilor oaselor craniului (recomandate în special la pacienţii care prezintă fracturi cominutive cu posibil risc de infecţie).
Bibliografie
-
De Lahunta A, Glass E, Kent M (2014), Veterinary Neuroanatomy and Clinical Neurology, Ediţia a IV-a, Editura Elsevier.
-
Dewey CW, Da Costa RC (2015), Practical Guide to Canine and Feline Neurology, Ediţia a III-a, Editura Wiley Blackwell.
-
Dojana N (2001), Fiziologia animalelor domestice, Ediţia a II-a, Editura Printech, Bucureşti.
-
Evans H, De Lahunta A (2013), Miller’s Anatomy of the Dog, Ediţia a IV-a, Editura Elsevier.
-
Platt S, Garosi L (2012), Small Animal Neurological Emergencies, Editura Manson Publishing Ltd.
-
Uemura EE (2015), Fundamentals of Canine Neuroanatomy and Neurophysiology, Ediţia I, Editura Wiley Blackwell.
-
Vandevelde M, et al. (2012), Veterinary Neuropathology, Essentials of Theory and Practice, Editura Wiley Blackwell.
-
William OR (editor), Howard HE (associate editor), Jesse PG (associate editor), Etsuro EU (associate editor) (2015), Dukes’ Physiology of Domestic Animals, Ediţia 13, Editura Wiley Blackwell, Ames, Iowa.
-
Beltran E, Platt SR, McConnell JF, Dennis R, Keys DA, De Risio L. Prognostic value of early magnetic resonance imaging in dogs after traumatic brain injury: 50 cases. J Vet Intern Med. 2014 Jul-Aug;28(4):1256-62. doi: 10.1111/jvim.12368.
-
Michinaga S, Koyama Y. Pathogenesis of Brain Edema and Investigation into Anti-Edema Drugs. International Journal of Molecular Sciences. 2015; 16(5):9949-9975. https://doi.org/10.3390/ijms16059949.
-
Platt SR, Radaelli ST, McDonnell JJ. The prognostic value of the modified Glasgow Coma Scale in head trauma in dogs. J Vet Intern Med. 2001 Nov-Dec;15(6):581-4.
-
Rapoport K, Mateo I, Peery D, Mazaki-Tovi M, Klainbart S, Kelmer E, Ruggeri M, Shamir MH, Chai O. The prognostic value of the Koret CT score in dogs following traumatic brain injury. Vet J. 2020 Dec;266:105563. doi: 10.1016/j.tvjl.2020.105563.
-
Rudloff E, Hopper K. Crystalloid and colloid compositions and their impact. Front Vet Sci. (2021). 8:639848. doi: 10.3389/fvets.2021.639848.
-
Sande A, West C. Traumatic brain injury: a review of pathophysiology and management. J Vet Emerg Crit Care (San Antonio). (2010) 20:177–90.
-
Simpson SA, Syring R, Otto CM. Severe blunt trauma in dogs: 235 cases (1997-2003). J Vet Emerg Crit Care (San Antonio). (2009) 19:588–602.
Articole din ediţiile anterioare
Recomandări terapeutice pentru traumatisme cerebrale
Primary or biomechanical injury is the injury to the brain tissue from direct trauma and the forces applied to the brain at impact.
Tulburări ale comportamentului agresional la animalele de companie - tulburarea distimică
O definiţie atotcuprinzătoare a acestei modificări comportamentale nu a fost încă realizată, totuşi poate fi prezentată ca totalitatea manifestăril...
Aplicaţiile testării potenţialelor auditive evocate de trunchi cerebral (BAER) în medicina veterinară
Patologia nervului statoacustic reprezintă una dintre cele mai frecvente afecţiuni ale nervilor cranieni întâlnite în practica veterinară. Ea se po...
Hidrocefalia la câine
Hidrocefalia reprezintă o acumulare excesivă de lichid cefalorahidian (LCR) la nivelul encefalului. Această afecţiune este mai des întâlnită la câi...