Binge eating disorder (BED) is a frequent diagnosis especially in adolescents, but it is also met as the main pathology or as a comorbidity in the adult population. The evolution of BED is influenced by the presence of associated psychiatric disorders (e.g., depressive disorders, anxiety disorders, substance‑related disorders), psychological factors (avoidant personality features, impulsivity, neuroticism etc.), and organic complications (obesity, overweight, dyslipidemia, type II diabetes). An efficient case management should involve both pharmacotherapy and psychotherapy, and also a careful monitoring of the BED core symptoms and associated features, at regular intervals during the treatment and periodically after its completeness. Cognitive-behavioral therapy and group interpersonal therapy are the most evidence-based psychosocial approaches for this indication, and their efficacy up to 4 years is supported by follow-up studies. From the psychopharmacological perspective, lisdexamfetamine is the only FDA-approved drug, but many other agents are under investigation for binge eating disorder, based on the BED complex pathophysiology- dopamine reward circuitry, endogenous opioids, endocannabinoids, serotonin, noradrenaline, and glutamate neurotransmission, but also endocrine and enzyme-related drugs – e.g., those involved in maintaining the insulin/glucagon equilibrium, or those with pancreatic lipases inhibition or acetaldehyde dehydrogenase inhibition properties. Although there is a long list of potential therapeutic agents for BED, their validation through extensive, well-designed trials, is still in an early phase.
Actualităţi în terapia tulburării de alimentaţie compulsivă
Modern approaches in the treatment of compulsive eating disorders
First published: 24 iunie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Psih.57.2.2019.2442
Abstract
Rezumat
Tulburarea de alimentaţie compulsivă reprezintă o patologie frecvent întâlnită atât la adolescenţi, cât şi la populaţia adultă, fie ca principal diagnostic, fie ca o comorbiditate. Evoluţia şi prognosticul acestor pacienţi sunt deseori marcate de prezenţa unor tulburări mintale asociate (depresive, anxioase, dependenţa de substanţe), aspecte psihologice (impulsivitate, neuroticism, personalitate de tip evitant) şi complicaţii organice (obezitate, supraponderalitate, dislipidemii, diabet zaharat de tip 2). Un management de caz eficient trebuie să reunească abordări farmacologice şi psihoterapeutice, însoţite de o atentă monitorizare a simptomatologiei pe durata tratamentului şi la intervale fixe după finalizarea acestuia. Terapia cognitiv-comportamentală şi terapia interpersonală de grup sunt intervenţiile psihosociale cele mai susţinute de dovezi, fiind eficiente şi conform unor studii de follow-up efectuate după patru ani, iar din punct de vedere psihofarmacologic, lisdexamfetamina este singurul medicament aprobat de FDA pentru această indicaţie. Mulţi alţi agenţi farmacologici sunt investigaţi pentru tulburarea de alimentaţie compulsivă, pornind de la substratul neurobiologic complex al acestei patologii, care antrenează circuitele dopaminergice ale recompensei, sistemele opioidelor endogene şi endocanabinoizilor, neurotransmisia serotoninergică, noradrenergică, glutamatergică, precum şi mecanismele hormonale şi enzimatice – echilibrul insulină-glucagon, inhibiţia lipazelor pancreatice, inhibiţia acetaldehid-dehidrogenazei etc. Deşi lista potenţialilor agenţi farmacologici în terapia acestei tulburări de comportament alimentar este vastă, validarea lor prin teste randomizate, pe populaţii largi de pacienţi, este încă într-un stadiu timpuriu.
Introducere
Tulburarea de alimentaţie compulsivă este definită prin episoade recurente de ingestie rapidă a unei cantităţi mari de alimente şi prin senzaţia resimţită de persoana în cauză de lipsă de control asupra acestei ingestii pe durata episodului(1,2). Această patologie este recunoscută de cea mai recentă ediţie a Manualului de Diagnostic şi Statistică a Tulburărilor Mintale (DSM‑5), după ce în ediţia anterioară fusese menţionată doar în anexa destinată „tulburărilor care necesită studii suplimentare”(1,2). În a 10-a ediţie a „Clasificării tulburărilor mintale şi de comportament” elaborată de experţii OMS, tulburarea de alimentaţie compulsivă este inclusă în categoria „Alte tulburări de comportament alimentar”(3). În proiectul pentru ediţia a 11-a a aceleiaşi clasificări internaţionale, tulburarea de alimentaţie compulsivă este caracterizată prin episoade frecvente, recurente, de mâncat compulsiv (de exemplu, o dată pe săptămână sau mai des, pe durata a cel puţin câteva luni), iar episoadele nu sunt urmate în mod regulat de comportamente compensatorii inadecvate destinate să prevină creşterea ponderală(4). Un episod de mâncat compulsiv este definit de ICD-11 ca „o perioadă bine definită în cursul căreia persoana simte că şi-a pierdut controlul asupra comportamentului alimentar, mâncând semnificativ mai mult sau în mod diferit faţă de nivelul său normal, simţindu-se incapabilă să se oprească sau să-şi limiteze aportul alimentar”(4). De asemenea, un astfel de episod este însoţit de emoţii negative, cum ar fi vinovăţia sau dezgustul(4).
Tulburarea de mâncat compulsiv este asociată frecvent cu obezitatea sau sindromul metabolic, dar se poate întâlni şi împreună cu tulburările afective, anxioase sau tulburările legate de consumul de substanţe(5). Aceste asocieri creează dificultăţi la nivel diagnostic şi terapeutic, clinicianul fiind nevoit să ia în calcul efectuarea unui screening diagnostic structurat la pacienţii cu tulburare de alimentaţie compulsivă aflaţi la prima evaluare, dar şi periodic, pe durata monitorizării evoluţiei acestora, precum şi să ţină cont de necesitatea tratării concomitente a tuturor entităţilor nosologice detectate.
Sindromul alimentaţiei nocturne reprezintă o altă entitate nosologică, definită prin episoade repetate de hiperfagie instalată nocturn, în cadrul cărora persoana este lucidă şi îşi aduce aminte ulterior de existenţa acestui comportament(2). Alimentaţia nocturnă este asociată în mod necesar cu disconfort semnificativ şi/sau afectare a funcţionării cotidiene(2). Această patologie nu este inclusă în ultimele două ediţii ale clasificării OMS şi este menţionată în DSM-5 doar în categoria „Alte tulburări de comportament alimentar specificate”(2-4). Din păcate, studiile destinate circumscrierii nosologice şi tratamentului acestei tulburări sunt de abia la început şi nu există date disponibile care să poată sta la baza unor recomandări clinice. Cercetările viitoare ar trebui să stabilească dacă ne aflăm în prezenţa unei variante ale tulburării de alimentaţie compulsivă ori dacă se poate vorbi despre o cu totul altă entitate diagnostică.
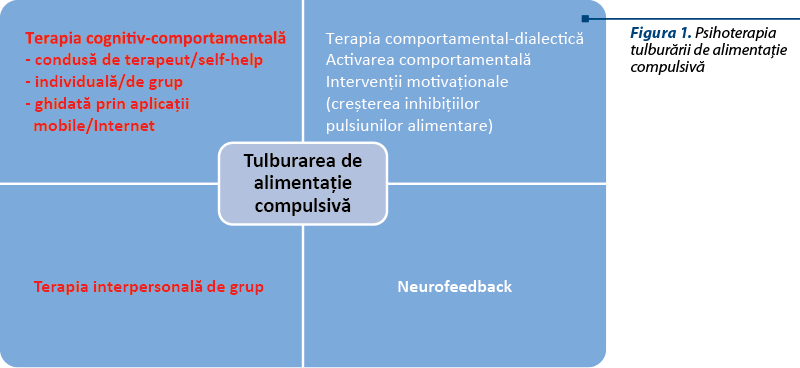
Psihoterapia tulburării de alimentaţie compulsivă
Terapia cognitiv-comportamentală condusă de terapeut a dus la reduceri ale numărului de episoade de mâncat compulsiv şi a crescut procentul de remisiune în această tulburare, prin comparaţie cu grupurile de control (în principal, acestea erau reprezentate de o listă de aşteptare)(6,7). Terapia cognitiv-comportamentală condusă de terapeut în cabinet a fost comparată cu terapia de tip self-help ghidată de un specialist prin intermediul internetului, iar rezultatele au fost uşor superioare pentru prima metodă din perspectiva eficienţei(8). Totuşi intervenţiile psihoterapeutice cognitiv-comportamentale minimale bazate pe utilizarea internetului pot reduce numărul de episoade de mâncat compulsiv şi alte simptome asociate, inclusiv pe termen lung(9). Eficacitatea terapiei cognitiv-comportamentale şi a terapiei comportamentale bazate pe scăderea în greutate a fost demonstrată pe termen lung (până la 12 luni), în cazul pacienţilor cu obezitate şi tulburare de mâncat compulsiv(10). Din punctul de vedere al factorilor de prognostic, pacienţii care nu au răspuns la primele patru şedinţe de psihoterapie ar putea beneficia de intervenţii individualizate iniţiate precoce în cadrul terapiei(10). Stima de sine redusă, afectul negativ, supraevaluarea formei corporale sau a greutăţii proprii s-au asociat cu un răspuns mai bun la terapia cognitiv-comportamentală(11).
Aplicaţiile instalate pe telefonul mobil pentru facilitarea intervenţiilor de tip self-help construite pe modelul cognitiv-comportamental pot creşte aderenţa terapeutică, un studiu arătând scăderea numărului de episoade de alimentaţie compulsivă şi a gradului de respectare a regimului alimentar, pe termen scurt (3 luni)(12).
Activarea comportamentală aplicată la pacienţii cu obezitate şi alimentaţie compulsivă a ameliorat anumite aspecte ale comportamentului alimentar şi a avut un efect pozitiv asupra simptomelor depresive, dar nu a indus schimbări semnificative comparativ cu lista de aşteptare în privinţa numărului de episoade de alimentaţie compulsivă şi nici în ceea ce priveşte alte simptome(13). Aceasta poate indica o menţinere a alimentaţiei compulsive prin alte mecanisme, în afara unui nivel redus de activitate şi a dispoziţiei depresive(13).
Terapia interpersonală de grup ar putea fi de ajutor pentru pacienţii supraponderali cu tulburări de alimentaţie compulsivă care prezintă un locus extern al controlului şi dificultăţi psihosociale semnificative, unul dintre obiectivele principale ale terapiei fiind reducerea emoţiilor negative care facilitează episoadele de mâncat compulsiv(14,15). Un studiu de follow-up a arătat că pacienţii care urmaseră terapie interpersonală de grup au avut recuperări pe termen lung şi ameliorări ale simptomelor centrale din tulburarea de alimentaţie compulsivă după patru ani de la finalizarea terapiei(16).
Variante ale terapiei comportamental-dialectice au fost aplicate pentru pacienţii cu această tulburare de comportament alimentar, dar rezultatele nu sunt concludente, necesitând studii cu loturi mai mari de pacienţi(17,18). Totuşi, unii mediatori ai prognosticului posttratament au fost identificaţi, cei mai importanţi fiind tulburarea de personalitate de tip evitant şi un debut mai precoce al supraponderalităţii (sub 15 ani), aceşti factori fiind asociaţi cu un prognostic mai bun când au primit terapie comportamental-dialectică, comparativ cu o altă metodă de tratament(19).
Tehnicile care se bazează pe creşterea inhibiţiei pulsiunilor alimentare au la bază intervenţii motivaţionale pentru schimbarea terapeutică, tehnici axate pe întărirea controlului emoţional şi a proceselor inhibitorii, precum şi metode de creştere a stabilităţii emoţionale şi de prevenire a recăderilor(20). Astfel de tehnici psihoterapeutice au condus la rezultate favorabile la 3 luni în cazul pacienţilor cu tulburare de alimentaţie compulsivă şi obezitate(20).
Neurofeedbackul bazat pe modificări la nivel electroencefalografic postexpunere la anumiţi stimuli alimentari a redus nevoia percepută de paciente de a se alimenta compulsiv, stresul perceput de acestea şi autoeficienţa în domeniul dietei(21). Deşi această tehnică implică un antrenament în mai multe etape şi o aparatură specifică, rezultatele ar putea fi satisfăcătoare pentru o anumită subpopulaţie diagnosticată cu tulburare de alimentaţie compulsivă.
Farmacoterapia tulburării de alimentaţie compulsivă
Lisdexamfetamina dimesilat este singurul agent farmacologic aprobat – din anul 2015 – de US Food and Drug Administration pentru tulburarea de mâncat compulsiv de intensitate moderat-severă(22). Această moleculă este un precursor al substanţei active, ea convertindu-se în dextroamfetamină şi l-lizină în mare parte la nivel sangvin prin acţiunea unor aminopeptidaze eritrocitare, produsul activ având capacitatea de blocare a recaptării norepinefrinei şi dopaminei la nivel presinaptic(22,23). Doza zilnică recomandată, conform rezumatului caracteristicilor produsului, pentru tulburarea de mâncat compulsiv este de 30 mg, cu posibilitatea de titrare cu 20 mg săptămânal până la atingerea dozei maxime de 70 mg/zi(22). În studiile clinice, lisdexamfetamina s-a dovedit superioară clinic placebo în privinţa reducerii numărului de zile de mâncat compulsiv pe săptămână la dozele cuprinse între 50 şi 70 mg/zi(24).
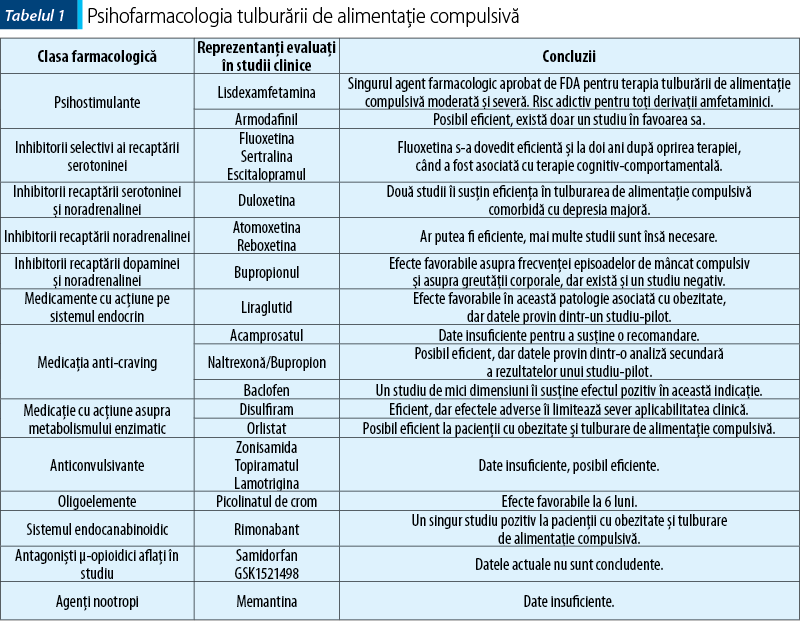
Întrucât amfetaminele şi derivaţii acestora prezintă potenţial adictiv, se recomandă evaluarea riscului de dependenţă înaintea prescrierii lisdexamfetaminei şi monitorizarea semnelor de abuz şi dependenţă pe durata terapiei(22). Avantajul lisdexamfetaminei faţă de produsul activ este creşterea timpului de înjumătăţire al d-amfetaminei, ceea ce permite administrarea unei singure doze de medicament pe zi(24).
Desigur, o limitare a utilităţii acestui medicament este prezenţa comorbidităţilor adictive sau a factorilor psihosociali care predispun la o tulburare legată de consumul de substanţă în cazul pacienţilor cu tulburare de alimentaţie compulsivă. Din acest motiv evaluarea comprehensivă a statusului mental iniţial şi periodic pe durata terapiei acestor pacienţi trebuie să ia în calcul şi riscul de apariţie sau recurenţă a unei patologii de tip adictiv.
Fluoxetina împreună cu terapia cognitiv-comportamentală administrate pacienţilor supraponderali cu tulburare de alimentaţie compulsivă au condus la rezultate favorabile în cadrul unui studiu randomizat, dublu orb, atât la 6, cât şi la 12 luni posttratament(25). Fluoxetina împreună cu psihoterapia au condus la rezultate superioare fiecărei metode terapeutice luate în parte în privinţa tuturor variabilelor urmărite, cu excepţia greutăţii corporale, care nu s-a menţinut la vizitele de follow-up(25). Efectele asocierii fluoxetinei la terapia cognitiv-comportamentală asupra reducerii frecvenţei episoadelor de alimentaţie compulsivă şi a inducerii abstinenţei la doi ani după finalizarea terapiei au fost conservate, neexistând schimbări semnificative ale principalelor variabile monitorizate, inclusiv ale greutăţii acestor pacienţi(26). O comparaţie a fluoxetinei (40-80 mg/zi) şi sertralinei (100-200 mg/zi) pe durata a 6 luni la pacienţii cu obezitate şi tulburare de alimentaţie compulsivă a demonstrat că ambele antidepresive au o eficacitate similară în privinţa reducerii frecvenţei episoadelor de alimentaţie compulsivă, scăderii ponderale şi a severităţii psihopatologiei(27). Acest ultim studiu a arătat ameliorări precoce, după 8 săptămâni, ale scorurilor de severitate pentru alimentaţie compulsivă şi ale greutăţii corporale(27).
Escitalopramul în doze mari (doza medie 26,5 mg/zi) s-a asociat cu reduceri semnificativ superioare placebo ale greutăţii corporale, indicelui de masă corporală şi severităţii globale a tulburării(28). Într-o analiză secundară, escitalopramul s-a dovedit eficient şi din perspectiva scăderii numărului de episoade de mâncat compulsiv, a numărului de zile de mâncat compulsiv, a greutăţii, a indicelui de masă corporală şi a severităţii tulburării, dar nu în privinţa simptomelor obsesiv-compulsive asociate(28).
Duloxetina (60-120 mg, 12 săptămâni, N=40 participanţi) a fost evaluată la pacienţii cu tulburare depresivă majoră şi tulburare de alimentaţie compulsivă, rezultatele unui studiu controlat placebo arătând că antidepresivul menţionat poate reduce frecvenţa săptămânală a episoadelor de alimentaţie compulsivă, numărul total al acestor episoade, severitatea globală a tulburării şi greutatea corporală(29). Duloxetina (60-120 mg/zi, 12 săptămâni, N=45 pacienţi) a fost asociată cu scăderea numărului de episoade de alimentaţie compulsivă/săptămână, reducerea severităţii depresiei, a greutăţii corporale şi a scorurilor impresiei clinice globale la pacienţii obezi cu tulburare de alimentaţie compulsivă trataţi în regim ambulatoriu(30).
Bupropionul este folosit ca antidepresiv, dar şi ca agent împotriva dependenţei de nicotină. Această substanţă are ca mecanism farmacodinamic principal inhibiţia recaptării de dopamină şi noradrenalină, fiind însă dovedit şi efectul său de atenuare a efectelor stimulante ale nicotinei asupra receptorilor acetilcolinici de tip nicotinic(31,32). În cadrul unui studiu randomizat, dublu-orb, bupropionul a avut efect modest asupra reducerii greutăţii corporale şi nu a ameliorat frecvenţa episoadelor de mâncat compulsiv, craving pentru alimente sau trăsături semiologice asociate, într-un grup de pacienţi supraponderali sau obezi cu tulburare de alimentaţie compulsivă(33). Bupropionul (150 mg/zi) şi sertralina (200 mg/zi) au fost comparate la pacienţii depresivi cu tulburare de alimentaţie compulsivă, rezultatele arătând o scădere a simptomelor anxios-depresive şi a frecvenţei episoadelor de alimentaţie compulsivă(34). Bupropionul s-a dovedit totuşi superior ca eficacitate în privinţa scăderii greutăţii corporale şi ameliorării funcţionării sexuale, fiind asociat şi cu o scădere ponderală mai mare comparativ cu sertralina(34).
Atomoxetina (40-120 mg/zi, 10 săptămâni) a condus la rezultate superioare placebo în privinţa reducerii frecvenţei episoadelor de alimentaţie compulsivă, a frecvenţei zilelor de binge-eating, a greutăţii corporale, a indicelui de masă corporală şi a scorurilor de severitate globală şi de obsesionalitate, la pacienţii trataţi în regim ambulatoriu pentru tulburare de alimentaţie compulsivă(35).
Reboxetina, un alt antidepresiv cu proprietăţi de inhibiţie a recaptării noradrenalinei, ar putea fi eficientă în terapia aceleiaşi tulburări de comportament alimentar, conform unui studiu de mici dimensiuni (N=9 pacienţi, 12 săptămâni)(36). Efectele favorabile ale reboxetinei au fost observate la nivelul calităţii vieţii, indicelui de masă corporală, numărului de zile cu binge-eating pe săptămână, precum şi al severităţii scorului scalelor specifice (Binge Eating Scale)(36).
Armodafinilul a fost evaluat ca monoterapie în tulburarea de alimentaţie compulsivă în cadrul unui studiu randomizat, dublu orb, la care au participat 60 de pacienţi(37). După 10 săptămâni de tratament, armodafinilul s-a asociat cu o rată mai mare de reducere a frecvenţei episoadelor de alimentaţie compulsivă faţă de placebo, dar şi cu scăderea trăsăturilor obsesiv-compulsive asociate alimentaţiei şi a indicelui de masă corporală(37).
Disulfiramul are ca mecanism principal de acţiune blocarea acetaldehid-dehidrogenazei şi oprirea metabolizării alcoolului etilic la nivel de acetil-coenzimă A. Pornind de la asemănările clinice dintre tulburarea alimentaţiei compulsive şi dependenţa de alcool, precum şi de la substratul neurobiologic presupus a fi comun (activarea de către stimulii adictivi a sistemului dopaminergic al recompensei), disulfiramul a fost evaluat într-un studiu deschis la care au participat 12 pacienţi diagnosticaţi cu tulburare de alimentaţie compulsivă(38,39). Disulfiramul a redus frecvenţa episoadelor de alimentaţie compulsivă, dar efecte adverse au fost observate în majoritatea cazurilor (11 din 12 participanţi, în special somnolenţă, cefalee, disgeuzie, tahicardie, vertij şi greaţă), ceea ce ar putea limita aplicabilitatea acestei metode de tratament(38).
Un alt agent folosit în terapia dependenţei de alcool, acamprosatul, nu a condus la rezultate superioare faţă de placebo în privinţa frecvenţei episoadelor de mâncat compulsiv în cadrul analizei longitudinale primare, dar a ameliorat aspecte precum simptomele obsesiv-compulsive legate de alimentaţie, cravingul alimentar şi calitatea vieţii într-o analiză secundară(40).
Naltrexona în combinaţie cu bupropionul a fost evaluată într-un studiu-pilot la pacienţii cu obezitate sau supraponderalitate şi tulburare depresivă majoră, fiind observat un efect favorabil al acestei asocieri farmacologice asupra scăderii simptomelor de tip mâncat compulsiv(41). Acest studiu a fost deschis, cu durata de 24 de săptămâni, şi a utilizat doze de 32 mg/zi de naltrexonă cu eliberare prelungită şi 360 mg/zi bupropion cu eliberare prelungită şi a inclus 25 de femei, evoluţia sub tratament arătând o scădere semnificativă a severităţii depresiei, a greutăţii corporale şi a simptomelor de binge-eating(41,42).
Baclofenul este studiat în terapia dependenţei de etanol, pornind de la proprietăţile sale anti-craving, acţiunea sa principală fiind aceea de agonist al receptorilor GABA-B(43). Aceleaşi proprietăţi sunt însă studiate şi pentru pacienţii cu tulburare de alimentaţie compulsivă, după cum o arată şi un studiu randomizat, controlat placebo, în cadrul căruia 12 pacienţi cu acest diagnostic au prezentat o reducere a frecvenţei episoadelor de mâncat compulsiv, dar şi a severităţii depresiei şi a cravingului pentru alimente(44).
Zonisamida s-a dovedit eficientă în bulimia nervosa prin reducerea frecvenţei episoadelor de alimentaţie compulsivă şi a numărului de zile cu astfel de episoade, precum şi prin scăderea simptomatologiei obsesiv-compulsive şi depresive asociate, ceea ce ar putea fi un indicator pentru necesitatea studierii acestui antiepileptic şi în tulburarea de mâncat compulsiv(45).
Topiramatul administrat la pacienţii obezi cu tulburare de alimentaţie compulsivă împreună cu terapie cognitiv-comportamentală a condus la scăderea semnificativă a greutăţii corporale după 21 de săptămâni (p<0,01) şi la atingerea unui număr mai mare de remisiuni ale tulburării de comportament alimentar(46).
Lamotrigina (236 +/-150 mg/zi, 16 săptămâni) administrată la pacienţii cu obezitate şi tulburare de alimentaţie compulsivă a condus la scăderi ale frecvenţei episoadelor de alimentaţie compulsivă şi ale numărului de zile de binge, ale greutăţii corporale şi indicelui de masă corporală, ale simptomelor obsesiv-compulsive, ale impulsivităţii şi severităţii globale a tulburării similare placebo, dar s-a dovedit superioară în domeniul scăderii glicemiei à jeun, a insulinemiei şi a nivelului plasmatic al trigliceridelor(47).
Samidorfanul este un antagonist opioidic cu acţiune de legare puternică de receptorii µ, evaluat în terapia depresiei majore(48). Acest agent a fost studiat şi în cazul terapiei tulburării de alimentaţie compulsivă, rezultatele unui studiu controlat arătând scăderea frecvenţei episoadelor de alimentaţie compulsivă la un nivel similar cu scăderea indusă de placebo, după 6 săptămâni(49). Un alt opioid antagonist aflat în studiu, GSK1521498, care posedă acţiuni potente asupra receptorilor µ, a fost evaluat la pacienţii obezi care prezentau tulburare de mâncat compulsiv de intensitate moderată(50). Acest agent farmacologic a produs o scădere a răspunsurilor la nivelul unor structuri din ganglionii bazali la imaginile alimentelor bogate în calorii şi o scădere a motivaţiei pentru a vedea acest tip de imagini(50). Aceste constatări arată că răspunsurile la stimuli specific dependente de ganglionii bazali (putamen/pallidum) la pacienţii obezi cu tulburare de alimentaţie compulsivă sunt sensibile la modificarea transmisiei opioidice pe calea receptorilor µ(50).
Picolinatul de crom a fost evaluat la pacienţii cu tulburare de alimentaţie compulsivă într-un studiu randomizat, dublu orb, conducând la scăderea glicemiei à jeun (semnificativ faţă de placebo) şi la diminuarea frecvenţei episoadelor de alimentaţie compulsivă, a greutăţii corporale şi a simptomelor de depresie (nesemnificativ faţă de placebo) după 6 luni de tratament(51).
Liraglutid este un analog al peptidei 1 asemănătoare glucagonului (GLP-1), care stimulează secreţia de insulină într-o manieră dependentă de glucoză, reduce secreţia excesivă de glucagon şi menţine în acest fel echilibrul glicemic(52). Liraglutidul reduce greutatea corporală şi masa de ţesut adipos prin diferite mecanisme aflate la baza apetitului alimentar şi a aportului energetic(52). Un studiu‑pilot cu durata de 3 luni efectuat la pacienţii obezi cu alimentaţie compulsivă, nediabetici, a susţinut o ameliorare semnificativă la cei care au primit liraglutid comparativ cu lotul-martor, atât la nivelul comportamentului alimentar compulsiv, cât şi la nivelul greutăţii corporale, al indicelui de masă corporală, al circumferinţei taliei, al tensiunii arteriale sistolice, al glicemiei à jeun şi al colesterolului total(53).
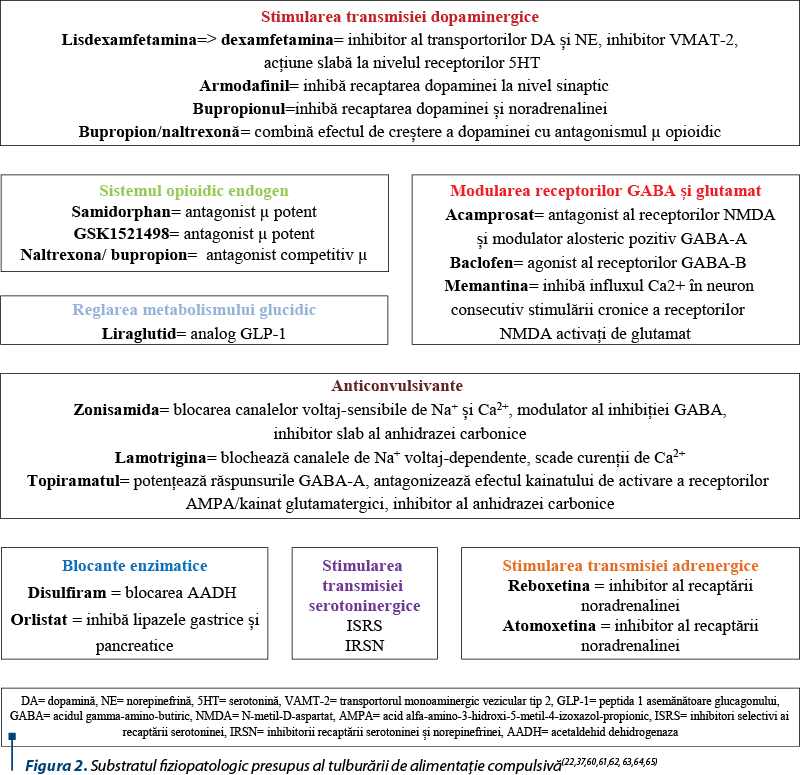
Orlistatul acţionează prin inhibiţia lipazelor gastrointestinale, de care se leagă covalent, astfel încât efectul său este de lungă durată(54). Acest agent farmacologic utilizat în combinaţie cu terapia comportamentală centrată pe scăderea ponderală la pacienţii cu obezitate cu şi fără tulburare de mâncat compulsiv a condus la rezultate favorabile(55). Astfel, scăderea în greutate a fost mai mare la pacienţii obezi fără tulburare de alimentaţie compulsivă care au primit şi orlistat faţă de cei care au primit placebo, în schimb cei care prezentau şi tulburare de alimentaţie compulsivă au răspuns la fel în prezenţa placebo şi a orlistatului(55). Totuşi, o rată de remisiune de 65% a fost observată la pacienţii obezi cu tulburare de alimentaţie compulsivă după tratament şi de 50% după un follow-up la 6 luni(55). Un alt studiu care a inclus pacienţi obezi cu tulburare de alimentaţie compulsivă a arătat după 24 de săptămâni o scădere semnificativă comparativ cu placebo a greutăţii corporale şi a scorurilor de severitate pe o scală specifică (Eating Disorder Inventory 2)(56).
Intervenţia transmisiei endocanabinoidice în patogeneza tulburării de alimentaţie compulsivă şi obezitate a fost evaluată la nivel farmaco‑clinic prin măsurarea eficienţei rimonabantului versus placebo pe o durată de 6 luni(57). Pacienţii care au primit substanţă activă au prezentat o scădere mai mare a scorurilor la scalele specifice pentru alimentaţia compulsivă, în condiţiile unei incidenţe similare a ratei de apariţie a efectelor adverse(57). De asemenea, pacienţii care au primit rimonabant au avut o scădere a greutăţii corporale semnificativ mai mare decât subiecţii care au primit placebo(57).
Memantina (5-20 mg/zi, 12 săptămâni) a fost eficientă şi bine tolerată în cazul pacienţilor cu tulburare de alimentaţie compulsivă, reducând frecvenţa numărului şi a zilelor de alimentaţie compulsivă, severitatea globală a tulburării, severitatea dezinhibiţiei (factor al Three Factor Eating Questionnaire) şi dizabilitatea (evaluată prin Sheehan Disability Scale)(58).
Managementul terapeutic – recomandările ghidurilor internaţionale
O analiză a ghidurilor terapeutice destinate tulburărilor de comportament alimentar arată că tratamentul efectuat în regim ambulatoriu este de primă intenţie pentru tulburarea de alimentaţie compulsivă, intervenţiile psihologice fiind recomandate de aproape toate sursele (terapia cognitiv-comportamentală fiind cea mai susţinută de dovezi, urmată de terapia cognitiv-comportamentală de tip self-help ghidată sau nu şi de psihoterapia interpersonală)(59).
Aceeaşi analiză a ghidurilor terapeutice a găsit recomandări pentru antidepresive, în special inhibitorii selectivi ai recaptării serotoninei pentru scăderea numărului de episoade de mâncat compulsiv, dar şi pentru anticonvulsivante (topiramat, în special)(59). Medicamentele care vizează scăderea în greutate au fost indicate de ghiduri terapeutice doar în cazul în care tulburarea de mâncat compulsiv a fost comorbidă cu obezitatea, iar orlistatul a fost cel mai frecvent recomandat agent farmacologic din această clasă(59).
Concluzii
Managementul de caz în tulburarea de alimentaţie compulsivă se bazează pe combinarea componentei farmacologice cu psihoterapia. Din prima categorie, lisdexamfetamina este alegerea cea mai susţinută de dovezi, dar trebuie analizate şi alte variante, în special din cauza riscului adictiv al derivaţilor amfetaminici şi al faptului că tulburarea de alimentaţie compulsivă şi dependenţa de substanţe împărtăşesc elemente fiziopatologice comune. Astfel de variante, corespunzătoare substratului patogenetic complex al acestei tulburări de comportament alimentar, sunt agenţi cu acţiune centrală – de exemplu, inhibitorii selectivi ai recaptării serotoninei, bupropionul, timostabilizatoarele, agenţii anti-craving, dar şi agenţi care acţionează periferic, endocrin – liraglutidul, ori enzimatic – disulfiramul, orlistatul. Psihoterapia cognitiv-comportamentală şi terapia interpersonală de grup sunt de asemenea bine susţinute de dovezi şi s-au dovedit eficiente pe termen lung, dar şi terapia dialectică comportamentală sau neurofeedbackul ar putea beneficia de studii viitoare care să le susţină eficienţa.
Monitorizarea simptomatologiei centrale (frecvenţa episoadelor de alimentaţie compulsivă, impactul funcţional al acestor episoade), dar şi a elementelor asociate (în special simptomele obsesiv-compulsive, depresive, anxioase sau adictive) este necesară pe durata tratamentului, dar şi ulterior, la intervale fixe, pe durata a minimum un an, din cauza riscului de recădere/recidivă.
Toate comorbidităţile psihiatrice şi somatice trebuie să beneficieze de tratament adecvat, riscul minimalizării importanţei unei tulburări depresive, dependenţe de substanţă sau a unui sindrom metabolic putând conduce la un prognostic negativ şi la o invalidare funcţională semnificativă.
Bibliografie
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4th Ed., revised, 2000, Washington DC.
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 5th Ed., 2013, Washington DC.
- WHO, ICD-10. Accesat la adresa https://www.icd10data.com/ICD10CM/Codes/F01-F99/F50-F59/F50- în data de 25 mai 2019.
- WHO, ICD-11. Accesat la adresa https://icd.who.int/browse11/l-m/en#/http://id.who.int/icd/entity/1673294767 în data de 25 mai 2019.
- Amodeo G, Cuomo A, Bolognesi S, et al. Pharmacotherapeutic strategies for treating binge eating disorder. Evidence from clinical trials and implications for clinical practice. Expert Opin Pharmacother. 2019, 20(6), 679-690.
- Hilbert A. Binge-eating disorder. Psychiatr Clin North Am. 2019, 42(1), 33-43.
- Brownley KA, Berkman ND, Peat CM, et al. Binge-eating disorder in adults: a systematic review and meta-analysis. Ann Intern Med. 2016, 165, 409-20.
- König HH, Bleiber F, Friederich HC, et al. Economic evaluation of cognitive behavioral therapy and Internet-based guided self-help for binge-eating disorder. Int J Eat Disord. 2018, 51(2), 155-164.
- Wagner B, Nagl M, Dölemever R, et al. Randomized controlled trial of an Internet-based cognitive-behavioral treatment program for binge-eating disorder. Behav Ther. 2016, 47(4), 500-14.
- Munsch S, Meyer AH, Biedert E. Efficacy and predictors of long-term treatment success for Cognitive-Behavioral treatment and Behavioral Weight-Loss-Treatment in overweight individuals with binge eating disorder. Behav Res Ther. 2012, 50(12), 775-85.
- Grilo CM, Masheb RM, Crosby RD. Predictors and moderators of response to cognitive behavioral therapy and medication for the treatment of binge eating disorder. J Consult Clin Psychol. 2012, 80(5), 897-906.
- Hildebrandt T, Michaelides A, Mackinnon D, et al. Randomized controlled trial comparing smartphone assisted versus traditional guided self-help for adults with binge eating. Int J Eat Disord. 2017, 50(11), 1313-1322.
- Alfonsson S, Parling T, Ghaderi A. Group behavioral activation for patients with severe obesity and binge eating disorder: a randomized controlled trial. Behav Modif. 2015, 39(2), 270-294.
- Tanofsky-Kraff M, Yanovski SZ, Schvey NA, et al. A prospective study of loss of control eating for body weight gain in children at high risk for adult obesity. International Journal of Eating Disorders. 2009, 42, 26-30.
- Tanofsky-Kraff M, Shomaker LB, Young JF, Wilfley DE. Interpersonal psychotherapy for the prevention of excess weight gain and eating disorders: a brief case study. Psychotherapy (Chic.) 2016, 53(2), 188-194.
- Hilbert A, Bishop ME, Stein RI, et al. Long-term efficacy of psychological treatments for binge eating disorder. Br J Psychiatry 2012, 200(3), 232-7.
- Klein AS, Skinner JB, Hawley KM. Targeting binge eating through components of dialectical behavior therapy: preliminary outcomes for individually supported diary card self-monitoring versus group-based DBT. Psychotherapy (Chic.) 2013, 50(4), 543-52.
- Masson PC, von Ranson KM, Wallace LM, Safer DL. A randomized wait-list controlled pilot study of dialectical behaviour therapy guided self-help for binge eating disorder. Behav Res Ther 2013, 51(11), 723-8.
- Robinson AH, Safer DL. Moderators of dialectical behavior therapy for binge eating disorder: results from a randomized controlled trial. Int J Eat Disord 2012, 45(4), 597-602.
- Preuss H, Pinnow M, Schnicker K, Legenbauer T. Improving inhibitory control abilities (ImpulsE)- a promising approach to treat impulsive eating? Eur Eat Disord Rev 2017, 25(6), 533-543.
- Schmidt J, Martin A. Neurofeedback against binge eating: a randomized controlled trial in a female subclinical threshold sample. Eur Eat Disord Rev 2016, 24(5), 406-16.
- Vyvanse. Highlights of prescribing information. Accesat la adresa https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/208510lbl.pdf în data de 25 aprilie 2019.
- Pennick M. Absorption of lisdexamfetamine dimesylate and its enzymatic conversion to d-amfetamine. Neuropsychiatr Dis Treat 2016, 6, 317-327.
- Ward K, Citrome L. Lisdexamfetamine: chemistry, pharmacodynamics, pharmacokinetics, and clinical efficacy, safety, and tolerability in the treatment of binge eating disorder. Expert Opin Drug Metab Toxicol 2018, 14(2), 229-238.
- Grilo CM, Crosby RD, Wilson GT, Masheb RM. 12-month follow-up of fluoxetine and cognitive behavioral therapy for binge eating disorder. J Consult Clin Psychol 2012, 80(6), 1108-13.
- Devlin MJ, Goldfein JA, Petkova E, Liu L, Walsh BT. Cognitive behavioral therapy and fluoxetine for binge eating disorder: two-year follow-up. Obesity (Silver Spring) 2007, 15(7), 1702-9.
- Leombruni P, Pierò A, Lavagnino L, et al. A randomized, double-blind trial comparing sertraline and fluoxetine 6-month treatment in obese patients with binge Eating Disorder. Prog Neuropsychopharmacol Biol Psychiatry 2008, 32(6), 1599-605.
- Guerdjikova AI, McElroy SL; Kotwal R, et al. Hig-dose escitalopram in the treatment of binge-eating disorder with obesity: a placebo-controlled monotherapy trial. Hum Psychopharmacol 2008, 23(1), 1-11.
- Guerdjikova AI, McElroy SL, Winstanley EL, et al. Duloxetine in the treatment of binge eating disorder with depressive diosrders: a placebo-controlled trial. Int J Eat Disord 2012, 45(2), 281-9.
- Leombruni P, Lavagnino L, Gastaldi F, Vasile A, Fassino S. Duloxetine in obese binge eater outpatients: preliminary results from a 12-week open trial. Hum Psychopharmacol 2009, 24(6), 483-8.
- Warner C, Soaib M, How does bupropion work as a smoking cessation aid? Addiction Biology 2005, 10, 219-31.
- Wikes S. The use of bupropion SR in cigarette smoking cessation. Int J Chron Obstr Pulmon Dis 2008, 3(1), 45-53.
- White MA, Grilo CM, Bupropion for overweight women with binge-eating disorder: a randomized, double-blind, placebo-controlled trial. J Clin Psychiatry 2013, 74(4), 400-6.
- Calandra C, Russo RG, Luca M. Bupropion versus sertraline in the treatment of depressive patients with binge eating disorder: retrospective cohort study. Psychiatry Q 2012, 83(2), 177-85.
- McElroy SL, Guerdjikova A, Kotwal R, et al. Atomoxetine in the treatment of binge-eating disorder: a randomized placebo-controlled trial. J Clin Psychiatry 2007, 68(3), 390-8.
- Silveira RO, Zanatto V, Appolinário JC, Kapczinski F. An open trial of reboxetine in obese patients with binge eating disorder. Eat Weight Disord 2005, 10(4), e93-6.
- McElroy SL, Guerdjikova AI, Mori N, et al. Armodafinil in binge eating disorder: a randomized, placebo-controlled trial. Int Clin Psychopharmacol 2015, 30(4), 209-15.
- Farci AM, Piras S, Murgia M, et al. Disulfiram for binge eating disorder: an open trial. Eat Behav 2015, 16, 84-7.
- Koob GF, Volkow ND. Neurocircuitry of addiction. Neuropsychopharmacology 2010, 35, 217-238.
- McElroy SL, Guerdjikova AI, Winstanley EL, et al. Acamprosate in the treatment of binge eating disorder: a placebo-controlled trial. Int J Eat Disorder 2011, 44(1), 81-90.
- Gurdjikova AI, Walsh B, Shan K, et al. Concurrent improvement in both binge eating and depressive symptoms with naltrexone/bupropion therapy in overweight or obese subjects with major depressive disorder in an open-label, uncontrolled study. Adv Ther 2017;34(10):2307-2315.
- McElroy SL, Guerdjikova AI, Kim DD, et al. Naltrexone/bupropion combination therapy in overweight or obese patients with major depressive disorder: results of a pilot study. Prim Care Companion CNS Disord 2013, 15(3), PCC.12m01494.
- Rozatkar AR, Kapoor A, Idana A, Chavan BS. Clinical experience of baclofen in alcohol dependence: a chart review. Ind Psychiatry J 2016, 25(1), 11-16.
- Corwin RL, Boan J, Peters KF, Ulbrecht JS. Baclofen reduces binge eating in a double-blind, placebo-controlled, crossover study. Behav Pharmacol 2012, 23(5-6), 616-25.
- Guerdjikova AI, Blom TJ, Martens BE, Keck PE Jr, McElroy SL. Zonisamide in the treatment of bulimia nervosa: an open-label, pilot, prospective study. Int J Eat Disord 2013, 46(7), 747-50.
- Claudino AM, de Oliveira IR, Appolinario JC, et al. Double-blind, randomized, placebo-controlled trial of topiramate plus cognitive-behavior therapy in binge-eating disorder. J Clin Psychiatry 2007, 68(9), 1324-32.
- Guerdjikova AI, McElroy SL, Welge JA, et al. Lamotrigine in the treatment of binge-eating disorder with obesity: a randomized, placebo-controlled monotherapy trial. Int Clin Psychopharmacol 2009, 24(3), 150-8.
- Ehrich E, Turncliff R, Du Y, et al. Evaluation of opioid modulation in major depresion disorder. Neuropsychopharmacology 2015, 40(6), 1448-1455.
- McElroy SL, Guerdjikova AI, Blom TJ, et al. A placebo-controlled pilot study of the novel opioid receptor antagonist ALKS-33 in binge eating disorder. Int J Eat Disord 2013, 46(3), 239-45.
- Cambridge VC, Ziaudden H, Nathan PJ, et al. Neural and behavioral effects of a novel mu opioid receptor anatagonist in binge-eating obese people. Biol Psychiatry 2013, 73(9), 887-94.
- Brownley KA, Von Holle A, Hamer RM, La Via M, Bulik CM. A double-blind, randomized pilot trial of chromium picolinate for binge eating disorder: results of the Binge Eating and Chromium (BEACh) study. J Psychosom Res 2013, 75(1), 36-42.
- Victoza. Rezumatul caracteristicuilor produsului. Accesat la adresa https://ec.europa.eu/health/documents/community-register/2009/2009063059548/anx_59548_ro. pdf în data de 30 aprilie 2019.
- Robert SA, Rohana AG, Shah SA, et al. Improvement in binge eating in non-diabetic obese individuals after 3 months of treatment with liraglutide- a pilot study. Obes Res Clin Pract 2015, 9(3), 301-4.
- Xenical. Rezumatul caracteristicilor produsului. Accesat la adresa https://www.ema.europa.eu/en/documents/product-information/xenical-epar-product-information_ro.pdf în data de 05 mai 2019.
- Grilo CM, White MA. Orlistat with behavioral weight loss for obesity with versus without binge eating disorder: randomized placebo-controlled trial at a acommunity mental health center serving educationally and economically disadvantaged Latino/as. Behav Res Ther 2013, 51(3), 167-75.
- Golay A, Laurent-Jaccard A, Habicht F, et al. Effect of orlistat in obese patients with binge eating disorder. Obes Res 2005, 13(10), 1701-8.
- Pataky Z, Gasteyger C, Ziegler O, et al. Efficacy of rimonabant in obese patients with binge eating disorder. Exp Clin Endocrinol Diabetes 2013, 121(1), 20-6.
- Brennan BP, Roberts JL, Fogarty KV, et al. Memantine in the treatment of binge eating disorder: an open-label, prospective trial. Int J Eat Disord 2008, 41(6), 520-6.
- Hilbert A, Hoek HW, Schmidt R. Evidence-based clinical guidelines for eating disorders: international comparison. Curr Opin Psychiatry 2017, 30(6), 423-437.
- Acamprosate. Accesat la adresa https://www.drugbank.ca/drugs/DB00659 în data de 05 mai 2019.
- Robinson DM, Keating GM. Memantine: a review of its use in Alzheimer’s disease. Drugs 2006, 66(11), 1515-34.
- Fong TM, Haymsfield SB. Cannabinoid-1 receptor inverse agonists: current understanding of mechanism of action and unanswered questions. Int J Obes (Lond) 2009, 33(9), 947-55.
- Zonegran. Summary of product characteristics. Accesat la adresa https://www.ema.europa.eu/en/documents/product-information/zonegran-epar-product-information_en.pdf în data 05 mai 2019.
- Schneiderman JH. Topiramate: pharmacokinetics and pharmacodynamics. Can J Neurol Sci 1998, 25(3), S3-5.
- Ghaffarpour M, Parkdaman H, Harirchian MH, et al. Pharmacokinetic and pharmacodynamic properties of the new AEDs: A review article. Iran J Neurol 2013, 12(4), 157-165.
Articole din ediţiile anterioare
Sinteze de recomandări și practici terapeutice în tulburările psihice: 1. Tulburarea afectivă bipolară
Tulburarea afectivă bipolară (TAB) reprezintă una dintre bolile psihiatrice majore şi cele mai severe, fiind caracterizată de un dezechilibru dispo...
Recomandări terapeutice nefarmacologice în tulburarea afectivă bipolară
În tulburarea afectivă bipolară (TAB), aplicarea simplă a farmacoterapiei se soldează cu recăderi, simptome reziduale și tulburări psihosociale. În...