Fish allergy is one of the most common food allergies and has become an important concern worldwide. Prevalence is variable (0-7%) and is influenced by regional dietary habits. Although fish is known to be an inducer of IgE-mediated reactions, other forms of clinical presentation, such as non-immediate reactions (predominantly food induced enterocolitis syndrome, FPIES)“, are also described. The diagnosis is established by correlating the anamnestic data with those obtained through in vivo/in vitro tests and confirmed by the oral food challenge. Parvalbumins are the major allergens detected in the serum of 75-95% of sensitized patients and are responsible for cross-reactivity between different fish species. Recent approaches target the concept of „monosensitization“, a situation in which minor allergens (enolase, aldolase) have a substantial role, making component-based diagnosis (CRD) indispensable. Even though the management is based on avoiding the offending allergen, current approaches based on immunomodulation are being developed and standardized, potentially leading to new therapeutic options soon.
Actualităţi în managementul alergiei la peşte
Updates in the management of fish allergy
First published: 31 mai 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.7.2.2023.8193
Abstract
Rezumat
Alergia la peşte este una dintre cele mai frecvente alergii alimentare şi a devenit o preocupare importantă la nivel mondial. Prevalenţa este variabilă (0-7%) şi este influenţată de obiceiurile alimentare regionale. Cu toate că peştele este cunoscut ca fiind un inductor al reacţiilor IgE-mediate, sunt descrise şi alte forme de prezentare clinică, precum reacţiile tardive (predominant, sindromul enterocolitei induse de proteine alimentare; SEIPA). Diagnosticul este stabilit prin corelarea datelor anamnestice cu cele obţinute prin testele in vivo/in vitro şi confirmat prin testul de provocare orală. Parvalbuminele sunt alergenele majore întâlnite la 75-95% dintre pacienţii sensibilizaţi şi sunt responsabile pentru reactivitatea încrucişată dintre diferitele specii de peşte. Abordări recente vizează conceptul de „monosensibilizare”, o situaţie în care alergenele minore (enolaza, aldolaza) au un rol substanţial, determinând ca diagnosticul bazat pe componente (CRD) să fie indispensabil. Chiar dacă managementul este centrat pe evitarea alergenului incriminat, abordările curente care au la bază imunomodularea sunt în curs de dezvoltare şi standardizare, putând conduce la noi opţiuni terapeutice în viitorul apropiat.
Generalităţi
Alergia la peşte face parte din grupul celor opt alergii alimentare principale, ocupând locul al treilea în Europa, după alergia la proteinele laptelui de vacă şi alergia la ou(1,2). Alături de alte alimente cu potenţial alergenic (lapte, ou, arahide, nucifere, soia, grâu, fructe de mare), peştele se numără printre cei mai frecvenţi factori declanşatori ai alergiilor IgE-mediate(3). Cu toate că se poate dezvolta atât în copilărie, cât şi la vârsta adultă, alergia la peşte apare cel mai adesea încă din copilăria precoce, în momentul introducerii alimentului în dieta copilului. Conform unui studiu spaniol efectuat la 355 de copii cu alergie IgE-mediată la peşte, debutul afecţiunii are loc în primii doi ani de viaţă(2). Actualmente, nu există date suficiente care să susţină corelaţia dintre introducerea precoce a peştelui în dieta copilului (până la vârsta de 12 luni) şi prevenirea dezvoltării alergiei(3). Totuşi, includerea alimentului în alimentaţie poate avea un rol în reducerea riscului de a dezvolta rinită alergică şi astm(3). Particularitatea acestui tip de alergie alimentară este reprezentată de caracterul persistent, afectând aproximativ 80% dintre pacienţi, chiar şi la zece ani de la diagnosticul iniţial(2).
Consumul de peşte a crescut la nivel mondial datorită valorii nutriţionale ridicate şi asocierii cu un stil de viaţă echilibrat, aceste aspecte explicând frecvenţa crescută a reacţiilor de hipersensibilitate induse de proteinele din peşte(2,4). Conştientizarea importanţei în dietă, dar şi a potenţialului de a induce o reacţie de hipersensibilitate, a dus la includerea peştelui în regulamentul Uniunii Europene (regulamentul U.E. nr 1169/2011) referitor la etichetarea produselor alimentare, cu scopul de a evita un potenţial eveniment nedorit(1).
Prevalenţa alergiei la peşte este variabilă şi poate fi dificil de determinat din cauza confuziei cu reacţiile adverse induse de diferite toxine şi paraziţi şi cu reacţiile induse de crustacee(4,5). Studii bazate pe chestionare au evidenţiat rate de prevalenţă diferite (0-7%), în funcţie de obiceiurile alimentare ale populaţiei studiate, criteriile de diagnostic folosite, calea de expunere şi vârstă(3). Prevalenţa cea mai mare este întâlnită în Australia, Asia şi anumite părţi din Europa (Spania, Portugalia, ţările scandinave). Prevalenţa astmului profesional indus de expunerea la proteinele din peşte este cuprinsă între 2% şi 8% din numărul total al cazurilor de astm profesional(4).
Diagnosticul alergiei la peşte se face cu ajutorul unui algoritm complex care cuprinde istoricul detaliat, testele in vitro şi in vivo, alături de testul de provocare orală. Rezultatele trebuie să fie interpretate ţinând cont de conţinutul variabil al anumitor alergene din extractele standard şi de reactivitatea încrucişată între diferite specii de peşte. Diagnosticul molecular (component-resolved diagnosis – CRD) este instrumentul-cheie care oferă informaţii despre tipul de sensibilizare individuală şi poate prezice riscul unei reacţii alergice severe. Testul de provocare orală le oferă un beneficiu major pacienţilor sensibilizaţi la un singur tip de peşte (monosensibilizare) prin certificarea toleranţei la alte specii de peşte şi evitarea restricţiilor alimentare inutile(4,5,7). Cu toate că recomandarea generală este de a evita toate speciile de peşte, s-a demonstrat prin intermediul testelor de provocare orală că până la 29% dintre cei diagnosticaţi cu alergie la peşte pot consuma în siguranţă anumite specii la care nu sunt sensibilizaţi(6).
Taxonomie
Speciile de peşte consumate frecvent fac parte din două mari clase: peşti osoşi (Osteichthyes) şi cei cartilaginoşi (Chondrichthyes).
Peştii cartilaginoşi prezintă un endoschelet cartilaginos, se găsesc preponderent în apele marine şi se împart în două subclase: Elasmobranchii (rechini, patine şi peştii-fierăstrău) şi Holocephali.
Peştii osoşi reprezintă cea mai extinsă clasă de vertebrate şi sunt divizaţi în peşti cu aripioare în formă de rază (Actinopterygii) sau lobate (Sarcopterygii), având un endoschelet alcătuit din oase craniene stabile. Se găsesc atât în apele dulci, cât şi în cele marine. Dintre aceştia, Actinopterygii este cea mai mare subclasă, incluzând toate speciile comestibile de peşti osoşi. Un rol important în declanşarea reacţiilor de hipersensibilitate este deţinut de peştii osoşi, parvalbumina din structura celor cartilaginoşi (α-parvalbumină) neavând potenţial alergenic(4,6,8).
Căi de expunere şi surse alergenice
Sensibilizarea pacienţilor la proteinele din peşte se poate produce prin mai multe căi. Cea mai frecventă modalitate este reprezentată de ingestia alimentului. Pacienţii se pot sensibiliza de asemenea prin contactul la nivel cutanat cu produse din peşte sau prin intermediul tractului respirator în momentul inhalării aburului rezultat în timpul procesului de gătire sau în cazul celor care lucrează frecvent cu produse de origine piscicolă.
Printre sursele care pot provoca reacţii de hipersensibilitate se numără carnea de peşte, sursa cea mai importantă din punctul de vedere al potenţialului alergenic, cu un conţinut bogat în parvalbumine, dar, de asemenea, şi enolaze, aldolaze, tropomiozină, colagen şi altele. Alergenele se pot regăsi şi în icre (vitelogenina fiind principalul reprezentant), în sânge sau în gelatină, aceasta din urmă putând fi prezentă în compoziţia diverselor produse, precum bomboane, cosmetice, medicamente sau vaccinuri(1).
Parvalbuminele reprezintă alergenele majore din peşte, 75-95% dintre pacienţii alergici prezentând niveluri crescute ale IgE specifice pentru parvalbumine(4). Din punct de vedere structural, parvalbuminele prezintă două izoforme:
-
α-parvalbumina (găsită în peştii cartilaginoşi, pui, crocodil şi broaşte), proteină care s-a dovedit a nu avea potenţial alergenic în cazul peştilor(10) şi
-
β-parvalbumina (găsită în peştii osoşi), cu potenţial alergenic crescut, fiind cel mai frecvent incriminată în reacţiile de hipersensibilitate de tip IgE-mediată(9).
Conţinutul de parvalbumine variază între diferitele specii de peşti, specii precum crapul, heringul, sebasta, somonul, păstrăvul şi codul având un conţinut mai ridicat de parvalbumină. Un alt factor care influenţează nivelul de parvalbumine este reprezentat de tipul de ţesut muscular. Parvalbuminele sunt prezente în cantităţi mai mari în carnea albă faţă de carnea roşie. Astfel, peştii care au preponderant carne albă, precum codul sau plătica, conţin un nivel de parvalbumină crescut faţă de peştii cu un procentaj mai mare de carne roşie, cum ar fi tonul, macroul sau peştele spadă.
Procesarea peştelui joacă şi ea un rol important în potenţialul alergenic. Deşi parvalbuminele sunt considerate a fi proteine termostabile, s-a dovedit că potenţialul lor alergenic poate fi modificat prin preparare termică. Studiile au arătat un nivel cu 20-60% mai scăzut al parvalbuminelor în carnea de peşte procesată în condiţii de temperatură sau presiune înaltă ori pH scăzut(12,13). Mediul de conservare s-a dovedit a fi, de asemenea, important în alterarea concentraţiei parvalbuminelor. De exemplu, într-un mediu cu pH mic, precum conservele cu oţet, potenţialul alergenic al peştelui scade ca urmare a degradării proteinelor.
Concentraţia de calciu din mediu este un alt factor care influenţează alergenicitatea parvalbuminelor, acestea fiind proteine care leagă ionii de calciu. Un studiu a raportat reducerea capacităţii de legare a IgE de parvalbumina de crap cu 57% după eliminarea calciului din mediul de reacţie(14). Astfel, conservarea peştelui în medii bogate în sare, precum saramura, sau conservarea în medii care conţin acid etilendiaminotetraacetic, un cunoscut chelator al calciului, scade potenţialul alergenic. Pe de altă parte, soluţiile care conţin sos de roşii şi cele bogate în lipide, precum conservele de peşte în ulei, cresc stabilitatea proteinelor. Produsele din peşte conservate în acest fel prezintă, în consecinţă, un potenţial alergenic crescut(12).
Un alt parametru care influenţează alergenicitatea parvalbuminei este reprezentat de nivelul pH-ului din mediu. Unele studii arată că un pH crescut poate stimula abilitatea parvalbuminelor de a provoca o reacţie de hipersensibilitate din cauza digestiei incomplete. Acest lucru ridică probleme în special la pacienţii sub tratament cu inhibitori de pompă de protoni sau la cei cu patologii ale mucoasei gastrice, precum gastrita atrofică(9,11).
În ceea ce priveşte prepararea peştelui pentru consum, un studiu a raportat un conţinut cu doar 25% mai mic în peştele gătit comparativ cu peştele crud(13). Acest efect depinde de modul şi timpul de preparare, precum şi de tipul de peşte. Toţi aceşti factori influenţează capacitatea de legare a IgE specifice de parvalbumină, aceasta putând fi crescută, nemodificată sau scăzută, explicând astfel toleranţa pacienţilor pentru anumite preparate pe bază de peşte(16).
O altă grupă de proteine care pot provoca reacţii de hipersensibilitate la produsele din peşte sunt enolazele şi aldolazele, considerate alergene minore. Deşi majoritatea pacienţilor sensibilizaţi la aceste proteine sunt sensibilizaţi şi la parvalbumină, există cazuri raportate de reacţii de hipersensibilitate apărute la pacienţi care nu prezentau IgE specifice pentru parvalbumine. Aceşti pacienţi par să fie monosensibilizaţi, cu reacţii declanşate de o singură specie de peşte. O altă grupă de proteine prezentă în preparatele pe bază de peşte o reprezintă tropomiozinele, deşi acestea sunt cunoscute mai ales pentru rolul lor de panalergen la crustacee. Vitelogenina este o proteină găsită în icrele de peşte de la diverse specii, fiind specifică anumitor tipuri de caviar, deşi a fost raportată reactivitate încrucişată cu alte ouă de peşte, în special între ouăle de hering şi ouăle de somon(10). Colagenul reprezintă o altă clasă de proteine capabilă să inducă producţia de IgE specifice, însă relevanţa clinică a acestei sensibilizări nu este clară(17).
Reacţii adverse
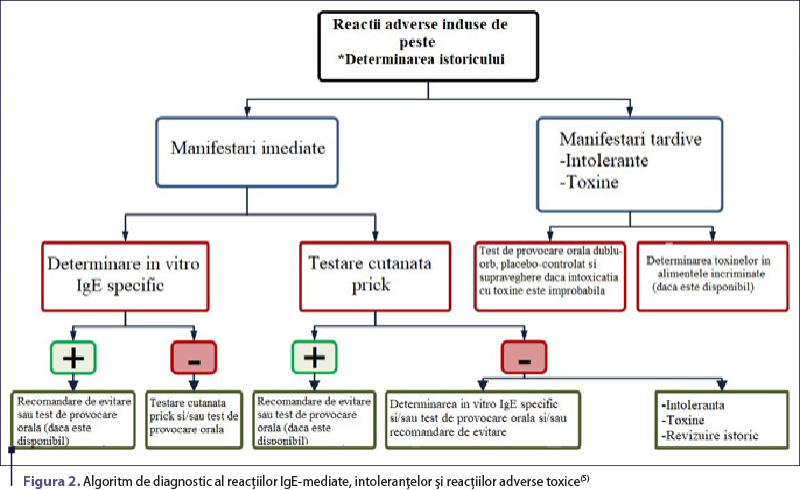
De-a lungul timpului au fost descrise diverse tipuri de reacţii adverse induse de peşte, similare cu reacţiile de hipersensibilitate (figura 1), astfel că un algoritm detaliat a fost propus pentru a diferenţia şi diagnostica reacţiile IgE-mediate, intoleranţele şi reacţiile adverse toxice (figura 2).
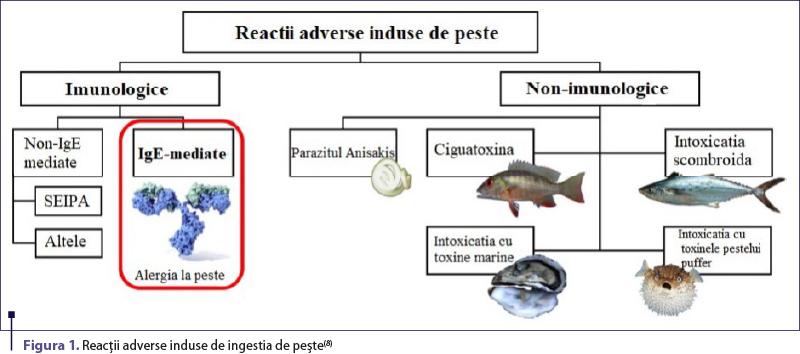
Dintre reacţiile adverse nonimunologice cele mai importante, amintim:
Simptome induse de Anisakis simplex – acest parazit al peştilor marini poate induce două tipuri de tablouri clinice:
Infecţia cu Anisakis (anisakiaza) apare ca urmare a ingestiei de paraziţi vii prin consumul de peşte crud, murat sau insuficient preparat termic. Infecţia poate duce la apariţia manifestărilor precum greaţă, vărsături, dureri abdominale, uneori apendicită sau ocluzie intestinală, febră.
Reacţia de hipersensibilitate indusă de Anisakis apare ca răspuns împotriva proteinelor cu potenţial alergenic din structura parazitului. Aceste molecule sunt termostabile, astfel că reacţia este declanşată de ingestia paraziţilor morţi. Testarea serologică poate confirma sensibilizarea, deşi nivelul de IgE specifice la Anisakis nu se corelează întotdeauna cu sensibilizarea simptomatică(1,8).
Intoxicaţia scombroidă (scombroidoza sau intoxicaţia cu histamină) este determinată de ingestia peştelui depozitat necorespunzător (cel mai adesea, peşte cu carne roşie: ton, macrou) ce favorizează multiplicarea bacteriilor care transformă histidina în histamină. Scombroidoza este similară unei reacţii alergice autentice, având un debut rapid (10-30 de minute după consum, cu rezoluţie spontană în 24 de ore) şi un spectru larg de manifestări clinice (urticarie, greaţă, vărsături şi, în cazuri rare, anafilaxie). Diagnosticul este sugestiv la un pacient fără istoric de reacţie alergică în antecedente, cu precădere dacă membrii familiei prezintă aceeaşi simptomatologie(4,8,9).
Intoxicaţia cu toxine marine (Ciguatera) este cauzată de alge producătoare de toxine care se acumulează în ţesutul nevertebratelor ingerate de peşti. Această intoxicaţie este caracterizată de spectrul extins al simptomelor: cutanate (urticarie), gastrointestinale (greaţă, vărsături), neurologice (vedere înceţoşată, parestezie, ataxie, convulsii) şi cardiovasculare (bradicardie/tahicardie, hipotensiune/hipertensiune arterială, bloc de conducere)(5,9).
Tipuri de reacţii de hipersensibilitate induse de produsele din peşte
Reacţiile de hipersensibilitate induse de consumul de peşte pot fi declanşate prin mecanisme atât imunologice (IgE-mediate sau non-IgE-mediate), cât şi nonimunologice. Reacţiile imunologice recunosc drept agent cauzator proteinele din carnea de peşte, cel mai frecvent incriminate fiind parvalbuminele, alergenele minore anterior menţionate având o pondere mai scăzută în inducerea reacţiilor.
Reacţiile IgE-mediate au debut rapid, pot varia ca tablou clinic şi severitate, prezentând un spectru larg de manifestări clinice: urticarie, angioedem, simptome rinoconjunctivale, sindromul alergiei orale şi chiar anafilaxie.
Pe lângă proteinele menţionate anterior, reacţiile IgE-mediate pot fi provocate şi de parazitul Anisakis simplex, în urma consumului de peşte crud sau insuficient preparat termic care conţine larve vii. Peştii cel mai frecvent incriminaţi sunt merluciul, stavridul, merlanul albastru şi hamsia.
Reacţiile de hipersensibilitate non-IgE-mediate cuprind sindromul enterocolitei induse de proteinele alimentare (SEIPA), proctocolita alergică indusă de proteinele alimentare (PAIPA) şi esofagita eozinofilică (EoE). Peştele se numără printre cei mai comuni factori declanşatori ai SEIPA la adulţi, ocupând primul loc în Europa de Sud(18,19).
SEIPA este o reacţie de hipersensibilitate de tip tardiv, non-IgE-mediată. Mecanismul suspicionat are la bază activarea celulelor T de la nivelul intestinului de către proteinele alergenice, urmată de eliberarea citokinelor proinflamatorii. Tabloul clinic sugestiv este reprezentat de simptomele gastrointestinale asociate cu paloare şi/sau letargie la 1-4 ore de la ingestia alimentului. Diagnosticul este susţinut de prezenţa unui criteriu major şi a minimum trei criterii minore (tabelul 1), conform ghidului internaţional publicat în 2017(20). Diagnosticul este unul clinic, iar testul de provocare orală (TPO) este standardul de aur pentru confirmare. Indicaţiile TPO sunt reprezentate de istoricul neclar al reacţiei, dar şi de testarea toleranţei după o dietă de excludere a alimentului incriminat. Potrivit unui studiu efectuat la 70 de copii cunoscuţi cu SEIPA la proteinele din peşte, 20% dintre copii nu dobândesc toleranţă până la vârsta adultă(21), dar 75% dintre copii depăşesc această patologie până la vârsta de 5 ani, după cum arată un alt studiu efectuat de Vazquez-Ortiz et al.(22)

Proctocolita alergică indusă de proteinele alimentare este o altă reacţie non-IgE-mediată, de obicei întâlnită la sugari, cel mai frecvent indusă de alimente precum laptele, soia şi oul, deşi există date care sugerează implicarea alergenelor din peşte într-o proporţie redusă în etiologia acestei reacţii. Un studiu efectuat de Vassilopoulou et al. a arătat că o dietă mediteraneeană bogată în peşte şi fructe de mare la mamele care alăptează poate avea un efect protector împotriva dezvoltării PAIPA(23).
O altă patologie de natură alergică datorată consumului de peşte este esofagita eozinofilică. Deşi studiile arată că printre cele mai frecvente alimente se numără laptele, oul şi grâul, peştele este responsabil pentru 2% dintre cazurile de esofagită eozinofilică(24).
Evaluarea alergologică
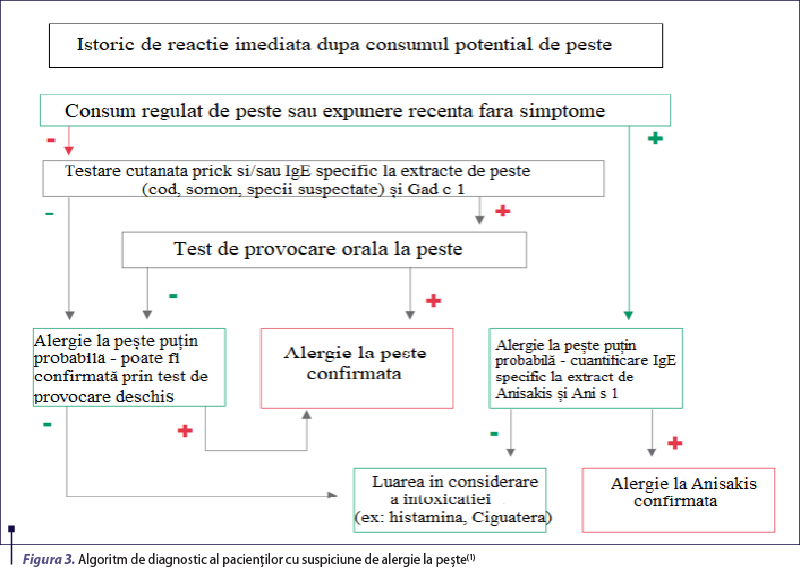
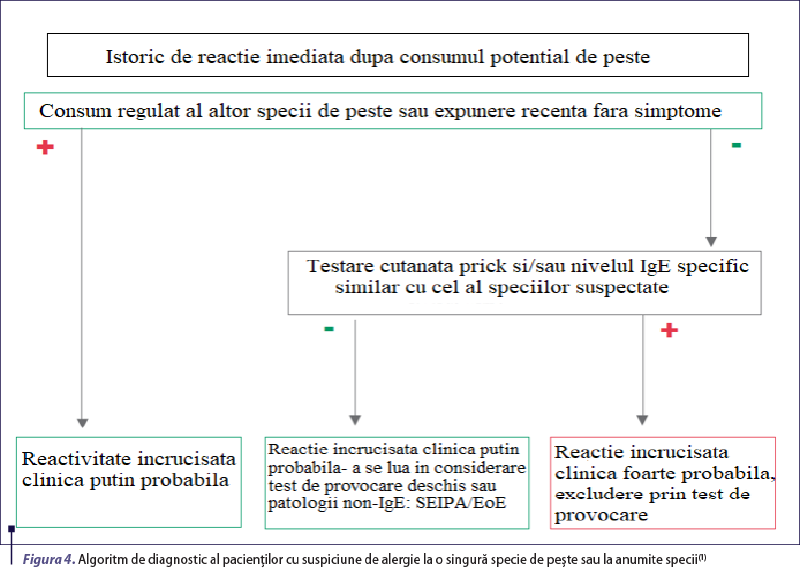
Primul pas în evaluarea alergologică a unui pacient cu istoric de reacţie de hipersensibilitate indusă de consumul de peşte este reprezentat de efectuarea unei anamneze cât mai amănunţite. Aceasta presupune obţinerea unui istoric cât mai complet al reacţiei (simptomatologie, cronologie), evaluarea corelaţiei dintre debutul simptomatologiei şi ingestia alergenului, specia de peşte incriminată, precum şi existenţa altor reacţii similare declanşate de expunerea la acelaşi tip de peşte sau unul diferit(9). De cele mai multe ori, anamneza pune anumite dificultăţi atât prin prisma etichetării greşite din punct de vedere taxonomic a multor produse disponibile comercial(25), cât şi din cauza reactivităţii încrucişate între diferitele specii de peşti (estimată la 29-67% în populaţia generală)(26-32). Este vital ca efectuarea ei să fie făcută de către un alergolog, deoarece acesta are capacitatea de a exclude alte patologii cu prezentare clinică similară (intoxicaţia scombroidă, alergia indusă de parazitul Anisakis), etichetate în mod eronat ca reacţii de hipersensibilitate (figurile 3 şi 4)(7,9).
Următoarea etapă este reprezentată de testarea cutanată prick clasică (SPT) sau prick-to-prick (PTP). Cu toate că testarea cutanată prick la extractul de peşte are o sensibilitate mai mare decât în cazul altor alergene (ou, lapte, arahide), extractele disponibile sunt limitate în comparaţie cu numărul de specii comestibile(7). Este important de menţionat că, deşi este uşor de efectuat, testarea cutanată prick prezintă dificultăţi în interpretarea rezultatelor. Acest lucru se datorează atât subiectivităţii persoanei care interpretează rezultatele, cât şi reactivilor prezenţi pe piaţă, aceştia nefiind standardizaţi din punctul de vedere al conţinutului sau al metodei de conservare(33-37). Deşi rezultatele testării pot ghida clinicianul către un diagnostic mai precis, trebuie ţinut cont de faptul că mărimea papulei nu se corelează direct cu reactivitatea clinică a pacientului. S-a demonstrat că anumite extracte disponibile sunt deficitare în ceea ce priveşte conţinutul anumitor alergene, putând duce la apariţia unor rezultate fals negative(5). Unele dintre inconvenientele prezentate anterior pot fi eliminate prin efectuarea testării prick-to-prick cu produse proaspete din peşte. Deşi nestandardizată, această abordare este uneori singura soluţie disponibilă pentru testarea cutanată. De cele mai multe ori, testele pot fi efectuate în siguranţă, deşi în literatură există cazuri de reacţii sistemice induse de testarea cutanată prick. Factori de risc propuşi în dezvoltarea unei reacţii sistemice sunt vârsta fragedă, leziunile active de dermatită, istoricul de anafilaxie şi testarea cutanată prick-to-prick cu produse proaspete(5).
Determinarea nivelului de IgE specifice este un instrument util în diagnosticul reacţiei de hipersensibilitate, dar şi în prezicerea dezvoltării toleranţei sau a persistenţei alergiei(7). Diferenţele dintre centre nu au permis stabilirea unor valori-prag universal acceptate, cu toate că există o relaţie dovedită între nivelul IgE specifice şi rezultatul testului de provocare. Sampson et al. sugerează că un nivel IgE specific la cod egal cu 20 kU/L se asociază cu o valoare predictivă pozitivă de 95% a testului de provocare în rândul populaţiei pediatrice. Nu există date care să confirme că acest nivel-prag poate fi aplicat pentru toate speciile de peşte(9). Un titru al IgE specifice la cod de peste 5 kU/L este un marker util, corelat cu o probabilitate mică de a depăşi în timp alergia(1). Demn de notat în privinţa acestei metode este că un nivel scăzut serologic nu exclude posibilitatea unei reacţii, deoarece au fost raportate reacţii la 10-20% dintre pacienţii cu valori serologice scăzute(9).
Specificitatea scăzută a testelor cutanate prick şi a nivelului IgE specific, împreună cu preocupările legate de siguranţă şi costurile asociate testului de provocare au permis dezvoltarea unei investigaţii mai fidele, şi anume diagnosticul molecular (diagnostic bazat pe componente – CRD). Informaţiile suplimentare aduse de această metodă se referă la reactivităţile încrucişate şi la riscul de a dezvolta o reacţie sistemică. Determinarea IgE specifice pe componente moleculare se poate face prin metoda ImmunoCAP (cod: rGad c 1 şi crap: rCyp c 1) şi prin metoda ISAC (panel de alergene care include şi rGad c 1). Un dezavantaj al testării prin ImmunoCAP este reprezentat de necesitatea unei cantităţi mai mari de ser pentru procesare (fiecare componentă se testează individual), acest lucru putând limita utilizarea metodei în rândul populaţiei pediatrice. Rezultatele celor două metode sunt similare, dar sensibilitatea este mai mică pentru determinarea de tip ISAC. Un studiu retrospectiv evidenţiază o asociere între scăderea dimensiunii papulei şi a nivelului IgE specific pentru parvalbumina din somon şi merluciu, cu dezvoltarea unei posibile toleranţe. Testarea IgE specifice la parvalbumina recombinată permite evaluarea cross-reactivităţilor din rândul speciilor de peşte. Totuşi, există amintite în literatură şi cazuri de monosensibilizare la preparatele din cod sau peşte spadă. Cu toate că parvalbumina este alergenul major, date recente au demonstrat o corelaţie fidelă între nivelul IgE specific la aldolază, respectiv enolază, la pacienţi alergici la cod, fără a fi sensibilizaţi la parvalbumină. Astfel, includerea alergenelor minore precum enolaza (Gad m 2), aldoza (Gad m3) şi probabil colagenul ar putea ajuta la caracterizarea mai fidelă a profilului de sensibilizare individuală(7,9).
Standardul de aur pentru identificarea alergiei la produsele din peşte rămâne testul de provocare orală (TPO), de preferat executat dublu-orb placebo-controlat, pentru a evita rezultatele fals pozitive, mai ales în cazul pacienţilor fără istoric de reacţie de hipersensibilitate, dar cu somatizare importantă. În cazul pacienţilor cu un istoric clar se utilizează testul de provocare orală deschis cu tipul de peşte incriminat în reacţia index(9). Din păcate, testul de provocare orală nu este utilizat frecvent din cauza cost-eficienţei reduse, fiind o procedură consumatoare de timp şi de resurse, care poate pune pacientul la risc pentru dezvoltarea unei reacţii sistemice(38). Nu există un protocol unanim acceptat în ceea ce priveşte forma de procesare a peştelui sau doza maximă zilnică, totuşi există studii efectuate la pacienţi pediatrici care ar putea ghida conduita în funcţie de particularităţile cazului. În cursul studiului Europrevall(39), care cuprinde date din 12 centre europene, s-a încercat standardizarea testului de provocare dublu-orb placebo-controlat. Doza maximă atinsă în timpul testului a fost de 1 g de proteină (echivalent a 5 g de peşte gătit), fragmentată în 3 mcg, 60 mcg, 600 mcg, 12 mg, 120 mg şi 1 g de proteină. Dacă dozele au fost tolerate fără dezvoltarea reacţiilor, s-a continuat cu un test de provocare deschis la cod atlantic gătit, administrat în trei doze: 2, 6 şi 12 grame de proteină(9). Studii recente au demonstrat că unii pacienţi pot tolera anumite specii de peşte(40-42), în ciuda sensibilizării dovedite la mai multe alergene(41). TPO poate demonstra în aceste cazuri selecţionate toleranţa pacientului la unele produse din peşte, evitându-se astfel excluderea absolută şi eronată din dietă(5).
Managementul pacientului
În prezent, principala opţiune terapeutică este reprezentată de excluderea din dietă a preparatelor pe bază de peşte, asociată cu tratamentul simptomatic în cazul expunerii accidentale(4,43). Datele din literatură susţin faptul că anumiţi pacienţi sensibilizaţi pot consuma unele specii de peşte fără declanşarea unor reacţii de hipersensibilitate. Astfel, pacienţii pot fi împărţiţi în trei categorii(6):
Pacienţi polisensibilizaţi, care reacţionează la mai multe specii de peşte – aceştia sunt sensibilizaţi la β-parvalbumină şi frecvent la enolază şi aldolază.
Pacienţi oligosensibilizaţi, care reacţionează la un număr de specii de peşte prin sensibilizare faţă de enolază sau aldolază, fără să prezinte însă IgE specifice pentru β-parvalbumină.
Pacienţi monosensibilizaţi, care reacţionează la o singură specie de peşte, cu IgE specifice anti-β-parvalbumină.
În funcţie de tipul de sensibilizare, se poate efectua un test de provocare la o specie de peşte sau la mai multe, cu scopul de a certifica şi de a oferi alternative sigure(6).
Legat de posibilitatea efectuării imunoterapiei orale pentru peşte, nu există date concrete care să susţină eficienţa pe termen lung a terapiei, nici protocoale standardizate în acest sens(44,45,46). Au fost încercate multiple abordări, precum administrarea codului în formă deshidratată (în perioada de iniţiere), continuându-se ulterior cu forma gătită în perioada de menţinere a dozei sau chiar administrarea codului exclusiv în forma gătită în ambele faze ale imunoterapiei(46,47). Au fost raportate şi reacţii de hipersensibilitate secundare imunoterapiei (adesea, reacţii uşoare), concluziile obţinute după perioada de urmărire arătând faptul că pacienţii (adulţi şi copii) nu au ajuns la o doză de menţinere similară unei porţii uzuale de peşte(9).
Au fost implementate recent protocoale asemănătoare de către D’Amelio (2017) şi Martore-Calatayud (2019) în care peştele administrat a fost merluciul. Rezultatele sunt promiţătoare, demonstrând eficienţa şi certificând toleranţa dobândită. Totuşi, sunt necesare studii pe eşantioane mai mari de pacienţi pentru a putea valida rezultatele(48,49).
Concluzii
Alergia la peşte este inclusă în grupul celor mai importante alergii cu trigger alimentar, fiind recunoscută pentru potenţialul de a induce adesea manifestări IgE-mediate. Actualmente, diagnosticul molecular este metoda centrală care permite încadrarea pacientului în cele trei grupuri de sensibilizare, aducând astfel un beneficiu major în vederea unui management mai precis. Deşi, de cele mai multe ori, pacienţii sunt sfătuiţi să excludă produsele din peşte din dietă, pe viitor imunoterapia ar putea fi conduita terapeutică de elecţie.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, Aalberse RC, Agache I, Asero R, Ballmer-Weber B, Barber D, Beyer K, Biedermann T, Bilò MB, Blank S, Bohle B, Bosshard PP, Breiteneder H, Brough HA, Caraballo L, Caubet JC, Crameri R, Davies JM, Douladiris N, Ebisawa M, EIgenmann PA, Fernandez-Rivas M, Ferreira F, Gadermaier G, Glatz M, Hamilton RG, Hawranek T, Hellings P, Hoffmann-Sommergruber K, Jakob T, Jappe U, Jutel M, Kamath SD, Knol EF, Korosec P, Kuehn A, Lack G, Lopata AL, Mäkelä M, Morisset M, Niederberger V, Nowak-Węgrzyn AH, Papadopoulos NG, Pastorello EA, Pauli G, Platts-Mills T, Posa D, Poulsen LK, Raulf M, Sastre J, Scala E, Schmid JM, Schmid-Grendelmeier P, van Hage M, van Ree R, Vieths S, Weber R, Wickman M, Muraro A, Ollert M. EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol. 2016 May;27 Suppl 23:1-250.
-
Carvalho S, Marcelino J, Cabral Duarte MF, Costa C, Barbosa MA, Pereira Dos Santos MC. Role of Recombinant Parvalbumin Gad c 1 in the Diagnosis and Prognosis of Fish Allergy. J Investig Allergol Clin Immunol. 2020;30(5):340-345.
-
Klueber J, Schrama D, Rodrigues P, et al. Fish Allergy Management: From Component-Resolved Diagnosis to Unmet Diagnostic Needs. Curr Treat Options Allergy. 2019;6:322–337.
-
Kourani E, Corazza F, Michel O, Doyen V. What Do We Know About Fish Allergy at the End of the Decade? J Investig Allergol Clin Immunol. 2019;29(6):414-421.
-
Davis CM, Gupta RS, Aktas ON, Diaz V, Kamath SD, Lopata AL. Clinical Management of Seafood Allergy. J Allergy Clin Immunol Pract. 2020 Jan;8(1):37-44.
-
Kalic T, Radauer C, Lopata AL, Breiteneder H, Hafner C. Fish Allergy Around the World-Precise Diagnosis to Facilitate Patient Management. Front Allergy. 2021 Oct 13;2:732178.
-
Tong WS, Yuen AW, Wai CY, Leung NY, Chu KH, Leung PS. Diagnosis of fish and shellfish allergies. J Asthma Allergy. 2018 Oct 8;11:247-260.
-
Ruethers T, Taki AC, Johnston EB, Nugraha R, Le TTK, Kalic T, McLean TR, Kamath SD, Lopata AL. Seafood allergy: A comprehensive review of fish and shellfish allergens. Mol Immunol. 2018 Aug;100:28-57.
-
Buyuktiryaki B, Masini M, Mori F, Barni S, Liccioli G, Sarti L, Lodi L, Giovannini M, du Toit G, Lopata AL, Marques-Mejias MA. IgE-Mediated Fish Allergy in Children. Medicina (Kaunas). 2021 Jan 18;57(1):76.
-
Mukherjee S, Horka P, Zdenkova K, Cermakova E. Parvalbumin: A Major Fish Allergen and a Forensically Relevant Marker. Genes (Basel). 2023 Jan 14;14(1):223.
-
Untersmayr E, Poulsen LK, Platzer MH, Pedersen MH, Boltz-Nitulescu G, Skov PS, Jensen-Jarolim E. The effects of gastric digestion on codfish allergenicity. J Allergy Clin Immunol. 2005 Feb;115(2):377-82.
-
Aksun Tümerkan ET. Detection of Parvalbumin Fish Allergen in Canned Tuna by Real-Time PCR Driven by Tuna Species and Can-Filling Medium. Molecules. 2022 Sep 2;27(17):5674.
-
Kuehn A, Scheuermann T, Hilger C, Hentges F. Important variations in parvalbumin content in common fish species: a factor possibly contributing to variable allergenicity. Int Arch Allergy Immunol. 2010;153(4):359-66.
-
Swoboda I, Bugajska-Schretter A, Verdino P, Keller W, Sperr WR, Valent P, Valenta R, Spitzauer S. Recombinant Carp Parvalbumin, the Major Cross-Reactive Fish Allergen: A Tool for Diagnosis and Therapy of Fish Allergy. J Immunol. 2002;168:4576–4584.
-
Dijkema D, Emons JAM, Van de Ven AAJM, Oude Elberink JNG. Fish Allergy: Fishing for Novel Diagnostic and Therapeutic Options. Clin Rev Allergy Immunol. 2022 Feb;62(1):64-71.
-
Jiang X, Rao Q. Effect of Processing on Fish Protein Antigenicity and Allergenicity. Foods. 2021 Apr 28;10(5):969.
-
Kalic T, Kamath SD, Ruethers T, Taki AC, Nugraha R, Le TTK, Humeniuk P, Williamson NA, Hira D, Rolland JM, O’Hehir RE, Dai D, Campbell DE, Breiteneder H, Lopata AL. Collagen- A n Important Fish Allergen for Improved Diagnosis. J Allergy Clin Immunol Pract. 2020 Oct;8(9):3084-3092.e10.
-
Infante S, Pérez-Pallisé E, Skrabski F, Cabrera-Freitag P, Morales-Cabeza C, Fuentes-Aparicio V, Alvarez-Perea A, Zubeldia JM. Poor prognosis of food protein-induced enterocolitis syndrome to fish. Pediatr Allergy Immunol. 2021 Apr;32(3):560-565.
-
Anvari S, Ruffner MA. Adult Food Protein-Induced Enterocolitis Syndrome. Front Allergy. 2022 May 26;3:889879.
-
Nowak-Węgrzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, Atkins D, Bahna S, Barad AV, Berin C, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive Summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin. Immunol. 2017;139:1111–1126.
-
Vazquez-Ortiz M, Machinena A, Dominguez O, Alvaro M, Calvo-Campoverde K, Giner MT, Jiménez-Feijoo R, Lozano J, Piquer M, Dias M, Folqué MDM, Plaza AM. Food protein-induced enterocolitis syndrome to fish and egg usually resolves by age 5 years in Spanish children. J Allergy Clin Immunol Pract. 2017 Mar-Apr;5(2):512-515.e1.
-
Mennini M, Fiocchi AG, Cafarotti A, Montesano M, Mauro A, Villa MP, Di Nardo G. Food protein-induced allergic proctocolitis in infants: Literature review and proposal of a management protocol. World Allergy Organ J. 2020 Oct 1;13(10):100471.
-
Vassilopoulou E, Feketea G, Konstantinou GN, Zekakos Xypolias D, Valianatou M, Petrodimopoulou M, Vourga V, Tasios I, Papadopoulos NG. Food Protein-Induced Allergic Proctocolitis: The Effect of Maternal Diet During Pregnancy and Breastfeeding in a Mediterranean Population. Front Nutr. 2022 Mar 30;9:843437.
-
Spergel J, Aceves SS. Allergic components of eosinophilic esophagitis. J Allergy Clin Immunol. 2018 Jul;142(1):1-8.
-
Willette DA, Simmonds SE, Cheng SH, Esteves S, Kane TL, Nuetzel H, et al. Using DNA barcoding to track seafood mislabeling in Los Angeles restaurants. Conserv Biol. (2017) 31:1076–85.
-
Khan F, Orson F, Ogawa Y, Parker C, Davis CM. Adult seafood allergy in the Texas Medical Center: a 13-year experience. Allergy Rhinol (Providence) 2011;2: e71-7.
-
Torres Borrego J, Martínez Cuevas JF, Tejero García J. Reactividad cruzada entre pescados y mariscos [Cross reactivity between fish and shellfish]. Allergol Immunopathol (Madr). 2003 May-Jun;31(3):146-51. Spanish.
-
Abramovitch JB, Kamath S, Varese N, Zubrinich C, Lopata AL, O’Hehir RE, Rolland JM. IgE Reactivity of Blue Swimmer Crab (Portunus pelagicus) Tropomyosin, Por p 1, and Other Allergens; Cross-Reactivity with Black Tiger Prawn and Effects of Heating. PLoS One. 2013 Jun 19;8(6):e67487.
-
Abramovitch JB, Lopata AL, O’Hehir RE, Rolland JM. Effect of thermal processing on T cell reactivity of shellfish allergens - Discordance with IgE reactivity. PLoS One. 2017 Mar 8;12(3):e0173549.
-
Rolland JM, Varese NP, Abramovitch JB, Anania J, Nugraha R, Kamath S, Hazard A, Lopata AL, O’Hehir RE. Effect of Heat Processing on IgE Reactivity and Cross-Reactivity of Tropomyosin and Other Allergens of Asia-Pacific Mollusc Species: Identification of Novel Sydney Rock Oyster Tropomyosin Sac g 1. Mol Nutr Food Res. 2018 Jul;62(14):e1800148.
-
Chapman JA, Bernstein IL, Lee RE, Oppenheimer J, Nicklas RA, Portnoy JM, et al. Food allergy: a practice parameter. Ann Allergy Asthma Immunol. 2006; 96:S1-68.
-
Sicherer SH, Muñoz-Furlong A, Sampson HA. Prevalence of seafood allergy in the United States determined by a random telephone survey. J Allergy Clin Immunol. 2004 Jul;114(1):159-65.
-
Rancé F, Juchet A, Brémont F, Dutau G. Correlations between skin prick tests using commercial extracts and fresh foods, specific IgE, and food challenges. Allergy Eur J Allergy Clin Immunol. 1997;52(10):1031–1035.
-
Zawodniak A, Kupczyk M, Górski P, Kuna P. Comparison of standard and modified SPT method. Allergy Eur J Allergy Clin Immunol. 2003;58(3):257–259.
-
Morell F, Codina R, Rodrigo MJ. Increased positivity of skin test and allergenic stability of glycerinated soybean hull extracts. Clin Exp Allergy. 1999;29(3):388–393.
-
Eigenmann PA, Sampson HA. Interpreting skin prick tests in the evaluation of food allergy in children. Pediatr Allergy Immunol. 1998;9(4):186–191.
-
Ruethers T, Taki AC, Nugraha R, Cao TT, Koeberl M, Kamath SD, et al. Variability of allergens in commercial fish extracts for skin prick testing. Allergy. 2019;74:1352-63.
-
Rubin ZE, Gu H, Polk BI. Seafood graded oral food challenge outcomes in a pediatric tertiary care center. World Allergy Organ J. 2020 May 13;13(5):100121.
-
Fernández-Rivas M, Barreales L, Mackie AR, Fritsche P, Vázquez-Cortés S, Jedrzejczak-Czechowicz M, Kowalski ML, Clausen M, Gislason D, Sinaniotis A, Kompoti E, Le TM, Knulst AC, Purohit A, de Blay F, Kralimarkova T, Popov T, Asero R, Belohlavkova S, Seneviratne SL, Dubakiene R, Lidholm J, Hoffmann-Sommergruber K, Burney P, Crevel R, Brill M, Fernández-Pérez C, Vieths S, Clare Mills EN, van Ree R, Ballmer-Weber BK. The EuroPrevall outpatient clinic study on food allergy: background and methodology. Allergy. 2015 May;70(5):576-84.
-
Kalic T, Morel-Codreanu F, Radauer C, Ruethers T, Taki AC, Swoboda I, et al. Patients allergic to fish tolerate ray based on the low allergenicity of its parvalbumin. J Allergy Clin Immunol Pract. 2019;7:500-508.e11.
-
Sørensen M, Kuehn A, Mills ENC, Costello CA, Ollert M, Småbrekke L, et al. Cross-reactivity in fish allergy: a double-blind, placebo-controlled foodchallenge trial. J Allergy Clin Immunol. 2017;140:1170-2.
-
Mourad AA, Bahna SL. Fish-allergic patients may be able to eat fish. Expert Rev Clin Immunol. 2015;11:419-30.
-
Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, Cardona V, Dubois A, duToit G, Eigenmann P, Fernandez Rivas M, Halken S, Hickstein L, Høst A, Knol E, Lack G, Marchisotto MJ, Niggemann B, Nwaru BI, Papadopoulos NG, Poulsen LK, Santos AF, Skypala I, Schoepfer A, Van Ree R, Venter C, Worm M, Vlieg-Boerstra B, Panesar S, de Silva D, Soares-Weiser K, Sheikh A, Ballmer-Weber BK, Nilsson C, de Jong NW, Akdis CA; EAACI Food Allergy and Anaphylaxis Guidelines Group. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014 Aug;69(8):1008-25.
-
Patriarca G, Nucera E, Pollastrini E, Roncallo C, De Pasquale T, Lombardo C, Pedone C, Gasbarrini G, Buonomo A, Schiavino D. Oral specific desensitization in food-allergic children. Dig Dis Sci. 2007 Jul;52(7):1662-72.
-
Patriarca G, Nucera E, Roncallo C, Pollastrini E, Bartolozzi F, De Pasquale T, Buonomo A, Gasbarrini G, Di Campli C, Schiavino D. Oral desensitizing treatment in food allergy: clinical and immunological results. Aliment Pharmacol Ther. 2003 Feb;17(3):459-65.
-
Porcaro F, Caminiti L, Crisafulli G, Arasi S, Chiera F, La Monica G, Pajno GB. Management of Food Allergy to Fish with Oral Immunotherapy: A Pediatric Case Report. Pediatr Allergy Immunol Pulmonol. 2016 Jun;29(2):104-107.
-
Patriarca G, Nucera E, Pollastrini E, Roncallo C, De Pasquale T, Lombardo C, Pedone C, Gasbarrini G, Buonomo A, Schiavino D. Oral specific desensitization in food-allergic children. Dig Dis Sci. 2007 Jul;52(7):1662-72.
-
D’Amelio C, Gastaminza G, Vega O, Bernad A, Madamba RC, Martínez-Aranguren R, Ferrer M, Goikoetxea MJ. Induction of tolerance to different types of fish through desensitization with hake. Pediatr Allergy Immunol. 2017 Feb;28(1):96-99.
-
Martorell-Calatayud C, Carnés J, Michavila Gómez A, Dopazo Fernández L, Echeverría Zudaire L, Santana Rodríguez C, Gómez Galán C, Toral Pérez T, Rodríguez Del Río P, Martorell Aragonés A. Oral Immunotherapy to Hake in 8 Pediatric Patients. J Investig Allergol Clin Immunol. 2019 Aug;29(4):294-296.