The analysis of the pathogenetic chains proved with certainty that COVID-19 is a systemic condition, which, although it causes a primary pulmonary damage, produces gastrointestinal, cardiovascular, neurological, endocrine, hepatic, renal etc. disorders. SARS-CoV-2 infection, known as a primary lung disease, through the marked inflammatory response and immune imbalance, causes a high prevalence of thromboembolic complications. The physiopathological mechanisms of SARS-CoV-2 infection can be determined by endothelial dysfunction, activating coagulation cascades and decreasing fibrinolytic activity, dysregulation of the innate and adaptive immune system or the alteration of the complement system.
Aspecte patogenetice ale infecţiei cu SARS-CoV-2
Pathogenetic aspects of infection with SARS-CoV-2
First published: 26 aprilie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.211.2.2023.7952
Abstract
Rezumat
Analiza verigilor patogenetice a demonstrat cu certitudine că boala COVID-19 este o afecţiune sistemică, care, deşi determină o afectare primară a plămânilor, produce dereglări gastrointestinale, cardiovasculare, neurologice, endocrine, hepatice, renale etc. Infecţia cu SARS-CoV-2, cunoscută ca o afecţiune pulmonară primară, prin răspuns inflamator marcant şi dezechilibru imun, determină o prevalenţă înaltă a complicaţiilor tromboembolice. Mecanismele fiziopatologice ale infecţiei cu SARS-CoV-2 pot fi determinate de disfuncţia endotelială, activarea cascadei de coagulare şi diminuarea activităţii fibrinolitice, dereglarea sistemului imunitar înnăscut şi adaptiv şi de alterarea sistemului complementului.
Introducere
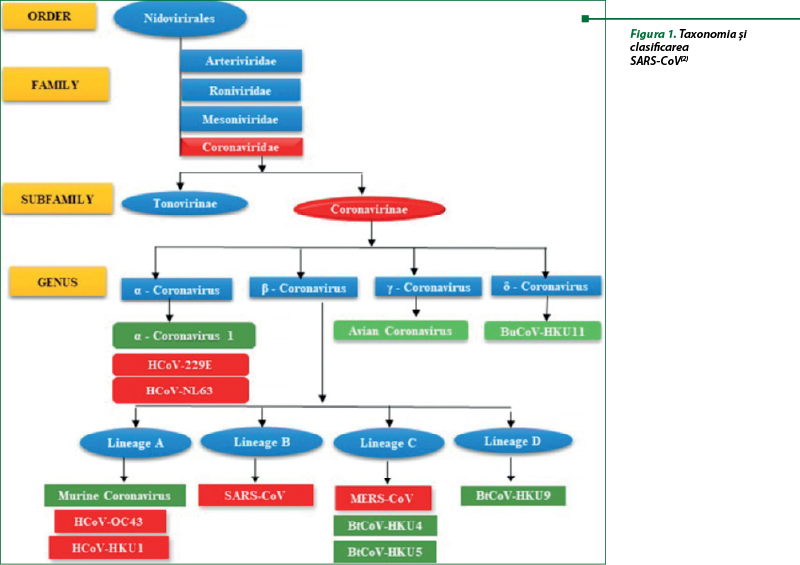
Termenul „coronavirus” a fost propus în 1968 în urma unor studii de microscopie electronică bazate pe morfologie, care, ulterior, în 1975, a fost caracterizat de un comitet internaţional pentru taxonomia virusului şi atribuit ordinului Nidovirales, familia Coronaviridae, subfamilia Coronavirinae. Coronavirusurile au fost clasificate în patru genuri: α-/β-/γ-/δ-CoV. Ornitologii au considerat α- şi β-CoV agenţi infecţioşi pentru mamifere, inclusiv pentru om, iar γ- şi δ-CoV, agenţi patogeni pentru păsări (figura 1). Investigaţiile anterioare arătaseră că omul este susceptibil la α-CoV (HCoV-229E şi HCoV-NL63), β-CoV (HCoV-HKU1 şi HCoV-OC43) şi SARS-CoV-2, care iniţial au fost consideraţi că sunt responsabili de forme uşoare de infecţii respiratorii acute cu simptome precum tusea şi răceala. La începutul secolului XXI, beta-coronavirusurile, precum SARS-CoV şi MERS-CoV, au determinat apariţia în 2002-2003 (SARS-CoV) şi 2012-2013 (MERS-CoV) unor infecţii grave ale tractului respirator, cu o rată crescută de letalitate. În decembrie 2019, în Wuhan, China, a fost raportată o boală necunoscută, asemănătoare pneumoniei. În ianuarie 2020, de la persoanele infectate a fost identificat agentul cauzal denumit „noul coronavirus” (nCoV) 2019-nCoV (Virus Corona), care mai târziu şi-a schimbat nomenclatura în „sindromul respirator acut sever coronavirus-2” (SARS-CoV-2), iar boala cauzată a fost denumită Corona Virus Disease-19 (COVID-19) în februarie 2020. La 11 martie 2020, Organizaţia Mondială a Sănătăţii (OMS) a definit COVID-19 ca pandemie, menţionând că aceasta este a cincea pandemie din ultimele zece decenii. Rezultatele experimentelor au arătat că SARS-CoV, MERS-CoV şi SARS-CoV-2 au o asemănare structurală de cel puţin 75% şi ar putea folosi aceiaşi receptori pentru a infecta celulele gazdei(2,21).
SARS-CoV-2 aparţine grupului de virusuri învelite care conţin ca material genetic ARN liniar, nesegmentat, monocatenar. Structural, SARS-CoV-2 este compus din două clase de proteine, proteine structurale şi nonstructurale (nsp) (figura 2). Proteinele structurale includ proteina S (proteina spike, sau de vârf), proteina de membrană a învelişului (E), proteina membranară (M) şi proteina nucleocapsidei (N). Proteinele nonstructurale includ metaloproteaza (Mpro), o protează asemănătoare papainei (PLpro), nsp13 (helicază), nsp12 (ARN-polimeraza ARN-dependentă sau RdRp), nsp14 (exoribonuclează N-terminală şi guanină-N7 metiltransferază C-terminală), nsp15 (endoribonuclează specifică uridilatului), nsp16 (2’-O-metiltransferază) şi nsp10. Proteina spike (proteina S) a coronavirusului este compusă din glicoproteina transmembranară, care este de natură trimetrică şi iese de pe suprafaţa virusului. Proteina S virală are o afinitate mare pentru receptorii ECA2, în principal în celulele alveolare de tip II. Virusul este apoi internalizat prin fuziunea membranei sau endocitoză. Metaloproteaza principală (Mpro) este o protează virală care activează o serie de evenimente cu ARN polimeraza ARN-dependentă (RdRp), care ajută la replicarea materialului genetic viral şi produce multiple copii ale virusului. Prin urmare, proteina S, ACE2, Mpro şi RdRp sunt ţinte importante în descoperirea medicamentelor pentru COVID-19(21).
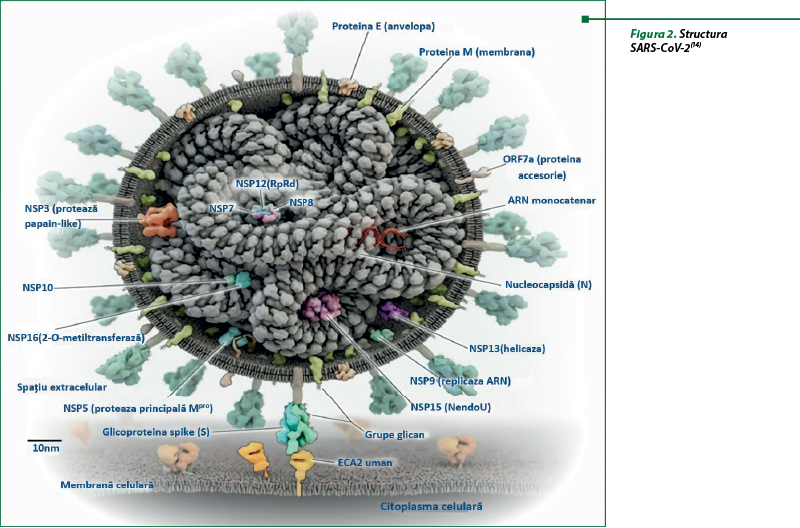
Proteinele structurale ale coronavirusului care formează particula virală sunt glicoproteina de suprafaţă (S), proteina de înveliş (E), proteina membrană (M) şi proteina nucleocapsidă (N). Aceste proteine sunt mai puţin conservate decât nsp-urile, jucând funcţii importante în ciclul de viaţă viral. Proteina (S) are un rol important în patogeneza virusului şi în tropismul de organe, fiind responsabilă de intrarea virală prin recunoaşterea receptorilor şi fuziunea membranelor. Proteina (E), cea mai mică dintre proteinele structurale, are un rol crucial în asamblare, înmugurire, formarea învelişului şi virulenţă. Proteina (M) are funcţia principală de a promova asamblarea virală, datorită proprietăţilor sale de îndoire a membranei care împachetează genomul ARN viral într-un complex ribonucleoproteic numit nucleocapsidă, pentru a proteja genomul. Proteina (N) este o proteină multifuncţională de legare a ARNului, transcriere şi replicare a ARN-ului viral şi conţine domeniul de legare ARN-N-terminal şi domeniul de dimerizare C-terminal, împreună cu un linker central bogat în Ser/Arg. Domeniul N-terminal este responsabil pentru legarea ARN, domeniul C-terminal este responsabil pentru oligomerizare şi linkerul bogat în Ser/Arg ajută la fosforilarea primară. Glicoproteina S a SARS-CoV-2 are două subunităţi: S1 şi S2. S1 se leagă de receptorii de suprafaţă celulară, în timp ce S2 fuzionează cu membrana celulară. Serin proteaza transmembranară 2 (TMPRSS2) a gazdei ajută virusul să adere la celule prin două mecanisme: legarea subunităţii spike S1 de receptorul enzimei de conversie a angiotensinei 2 (ACE-2) cu scindarea ulterioară a acestuia de către TMPRSS2; TMPRSS2, prin acţiunea sa asupra subunităţii S2, provoacă o schimbare conformaţională ireversibilă, cu fuziunea virusului cu membranele celulare(9,11,16,20).
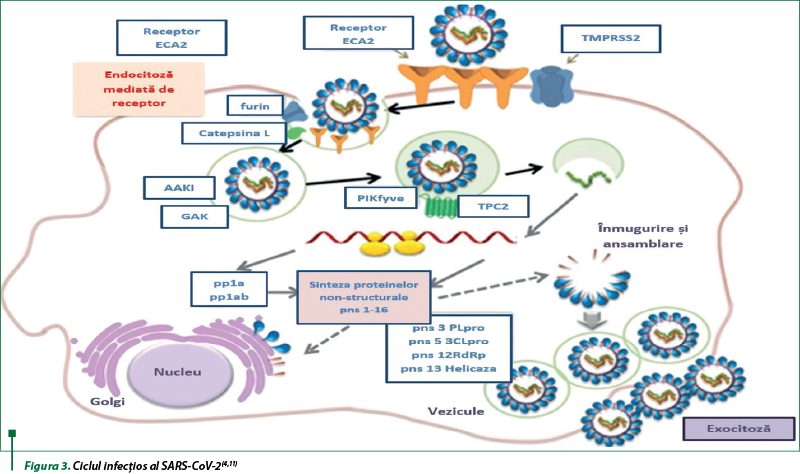
Ciclul infecţios al SARS-CoV-2 este caracteristic procesului de realizare a infecţiei virale, care include: ataşarea virusului; fuziunea capsidei cu membranele celulei-gazdă; formarea endozomului; liza endozomului cu eliberarea materialului genetic; translarea şi replicarea; înmugurirea şi asamblarea virionilor. Procesul de intrare a SARS-CoV-2 în celulă are loc prin interacţiunea proteinei spike (S) cu ECA2 umană printr-un proces de glicozilare, cu participarea gangliozidelor, în special GM-1, care acţionează drept cofactori de ataşare la membrana lipidică. Ulterior, SARS-CoV-2 pătrunde în celulă prin endocitoză, iar proteazele lizozomale precum catepsinele, serin proteaza transmembranară 2 (TMPRSS2) şi furinele activează procesul de fuziune prin scindarea proteinelor de suprafaţă ale coronavirusului cu formarea endozomului. Materialul genetic al ARN-ul este eliberat la liza endozomului, cu iniţierea proceselor de replicare şi translare, cu sinteza unei game variate de proteine structurale şi nonstructurale. În final au loc înmugurirea şi asamblarea noilor virioni, care sunt eliberaţi din celulă prin exocitoză şi capabili să infecteze alte celule epiteliale (figura 3)(4,5,10).
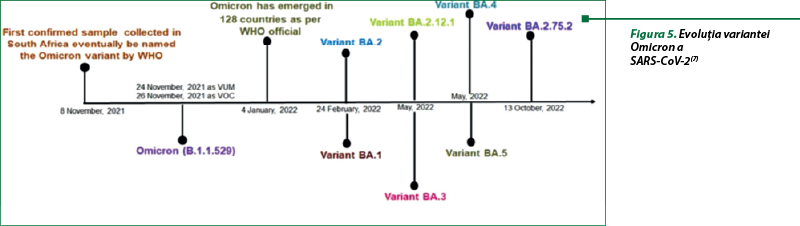
SARS-CoV-2 a evoluat, în consecinţă; în etapa actuală, mutaţiile au contribuit la evoluţia coronavirusului, cu identificarea diferitelor variante în timpul pandemiei. Ameninţarea unei noi variante depinde de trei factori principali (transmisibilitatea, severitatea şi evaziunea imună) şi de interacţiunile acestora. Variantele au evoluat prin mutaţii multiple, în principal în proteina spike (subunităţile S1 şi S2) a virusului, care ajută la iniţierea ciclului de viaţă al coronavirusului. Variantele au fost clasificate ca: variante sub monitorizare, variante de îngrijorare şi variante de interes. Aceste variante sunt Alfa (B.1.1.7), Beta (B.1.351), Gama (P.1), Delta (B.1.617.2) şi o variantă nouă, Omicron (B.1.1.529) (figura 4)(7).
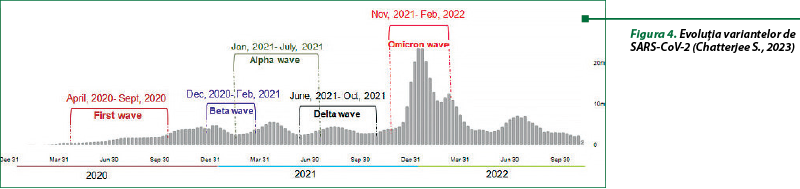
Varianta Omicron a fost observată prima dată în Africa de Sud şi în Botswana, în noiembrie 2021 (figura 5). Peste 130 de milioane de cazuri, inclusiv 500000 de decese, au fost raportate la nivel mondial de când Omicron a fost declarat de OMS varianta care a condus la o creştere cu 44% a numărului mediu de cazuri de COVID-19. Varianta Omicron se caracterizează printr-o transmisibilitate mai mare, adică o rată de infectare mult mai rapidă decât la celelalte patru variante, severitate şi letalitate mai reduse (forme uşoare, cu mai puţine spitalizări în secţiile de terapie intensivă), cu o evaziune imună (mai puţin susceptibilă la vaccinuri) şi letalitate mai mică decât ale altor tulpini(7).
Materiale şi metodă
S-a efectuat o analiză în bazele de date electronice, în special PubMed, biblioteca Cochrane, Google Scholar şi ale Organizaţiei Mondiale a Sănătăţii (OMS), cu selectarea articolelor publicate între 1 ianuarie 2020 şi 31 ianuarie 2023, prin utilizarea cuvintelor-cheie „COVID-19”, „patogeneza SARS-CoV-2”, „tromboembolie şi COVID-19”. S-au analizat articolele care vizau aspectele patogenetice ale infecţiei cu SARS-CoV-2 care se realizează la nivelul plămânilor, ale procesului inflamator şi ale evenimentelor tromboembolice la pacienţii cu COVID-19.
Rezultate şi discuţie
Patogeneza COVID-19. Cercetările experimentale şi studiile clinice au progresat pe parcursul pandemiei şi au permis elucidarea, deşi parţială, a verigilor patogenetice ale infecţiei cu SARS-CoV-2. Au fost propuse trei faze patogenetice (replicarea virală, hiperactivitatea imună şi distrucţia pulmonară) şi trei faze clinice (viremie, faza acută şi faza de recuperare/deces). S-a presupus că infecţia trece prin următoarele etape: invazia şi replicarea virală; dereglarea răspunsului imun; afectarea poliorganică; recuperarea. La etapa de invazie şi replicare virală, are loc intrarea virusului în celulă prin interacţiunea cu receptorii celulei-gazdă, urmată de replicare, multiplicare şi maturare, cu eliberarea extracelulară a virionilor noi şi cu deteriorarea celulelor parenchimatoase, inclusiv a celulelor epiteliale alveolare. Concomitent, este eliberat un număr mare de molecule, inclusiv molecule asociate patogenului (PAMP) şi molecule asociate leziunii (DAMP), care stimulează răspunsul imun înnăscut, induc infiltrarea cu celulele inflamatoare, eliberează citokine, chemokine, proteaze şi radicali liberi. Patologic, pneumonia în COVID-19 se caracterizează prin modificări acute bilaterale cu leziuni alveolare difuze, congestie vasculară, infiltrare celulară inflamatorie, edem intralveolar, exsudat proteic, hemoragie, hiperplazie reactivă a pneumocitelor şi prezenţa celulelor polinucleare gigantice. După stadiul iniţial, are loc rezolvarea procesului inflamator, cu recuperarea organelor afectate, iar în unele organe se dezvoltă fibroză şi procese cronice. Aceste modificări pot fi cauzate de efectul citopatic direct al coronavirusului şi, indirect, de răspunsurile imune nedorite, care pot fi esenţiale(17).
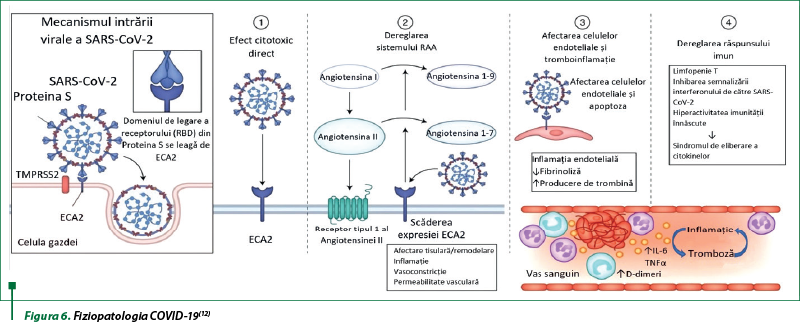
SARS-CoV-2 intră în celulele-gazdă prin interacţiunea proteinei sale spike cu receptorul de intrare ECA2 în prezenţa TMPRSS2. Mecanismele propuse pentru COVID-19 includ: (1) leziuni directe celulare mediate de virus; (2) dereglarea SRAA ca o consecinţă a reglării descendente a ECA2 legată de intrarea virală, ceea ce duce la scăderea scindării angiotensinei I şi angiotensinei II; (3) afectarea celulelor endoteliale cu formarea de trombi şi inflamaţie; (4) dereglarea răspunsului imun şi hiperinflamaţie cauzată de inhibarea semnalizării interferonului de către virus, limfopenie T şi producerea de citokine proinflamatorii, în special IL-6 şi TNF‑α (figura 6)(12).
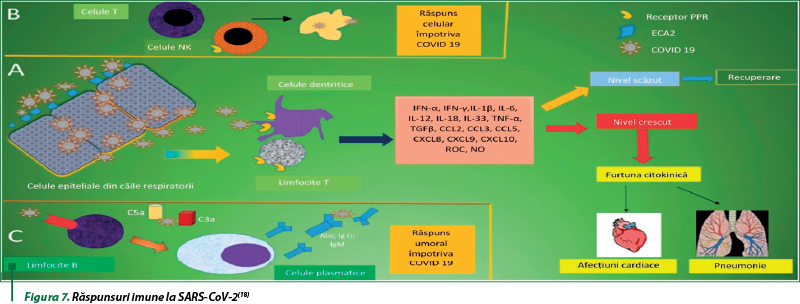
Dovezile din studiile clinice şi studiile experimentale referitoare la mecanismele moleculare potenţiale ale COVID-19 au sugerat că răspunsul imun-inflamator are un rol crucial în infecţia cu SARS-CoV-2. Un număr tot mai mare de studii au sugerat rolul central al unui răspuns imun dereglat sau exacerbat împotriva SARS-CoV-2, ceea ce duce la un răspuns inflamator intens. Acest răspuns inflamator dereglat este sistemic, dar afectează în primul rând plămânii. Astfel, SARS-CoV-2 invadează gazda, care este recunoscută mai întâi de receptorul ECA 2 prezent pe celulele epiteliale respiratorii, cu intrarea virală. După replicarea virală, virusul este eliberat, fiind întâmpinat de sistemul imunitar înnăscut. Limfocitele T şi celulele dendritice sunt activate prin intermediul receptorilor paterni de recunoaştere (PRR) Toll receptori (TLR), receptor de tip NOD (NLR) şi receptor de tip RIG-I (RLR). Virusul induce expresia a numeroşi factori inflamatori, maturarea celulelor dendritice şi sinteza IFN de tip I, care limitează răspândirea virală şi accelerează fagocitoza antigenelor virale de macrofage, cu recuperarea clinică. Proteina N a SARS-CoV-2 poate ajuta virusul să scape de răspunsurile imune, cu o reacţie exagerată a sistemului imunitar care generează niveluri ridicate de mediatori inflamatori şi radicali liberi. Aceştia din urmă induc leziuni locale severe în plămâni şi în alte organe, cu dezvoltarea insuficienţei poliorganice şi deces (figura 7A). Răspunsul imun adaptiv se alătură luptei împotriva virusului. Celulele T CD4+ stimulează celulele B să producă anticorpi specifici virusului, iar celulele T CD8+ sunt capabile să distrugă direct celulele infectate de virus. Celulele T helper produc citokine proinflamatorii, care sunt îndreptate pentru apărare. SARS-CoV-2 poate inhiba celulele T prin inducerea morţii celulare programate (apoptoză) (figura 7B). Imunitatea umorală prin factorii complementului (C3a şi C5a) şi anticorpi specifici derivaţi din celule B sunt esenţiale în combaterea infecţiei cu SARS-CoV-2 (figura 7C)(8,18).
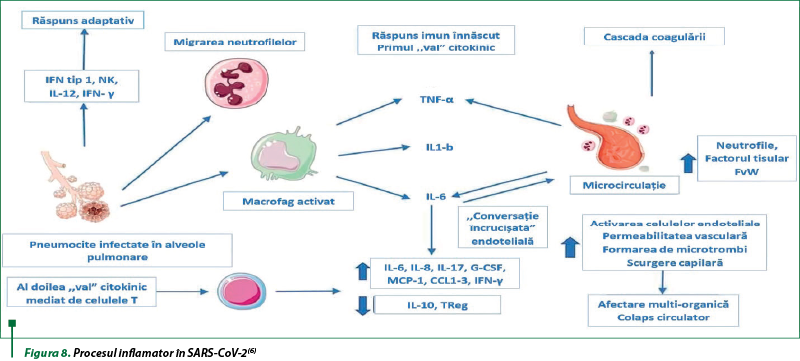
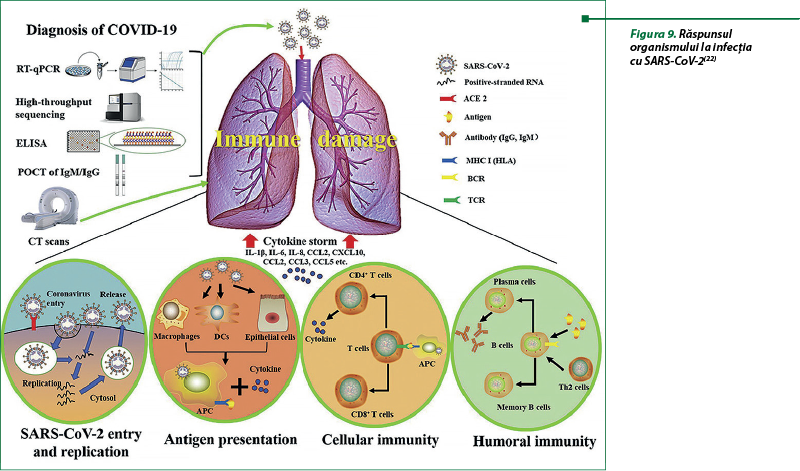
Infecţia cu SARS-CoV-2 a fost percepută ca o patologie respiratorie cu simptome pulmonare variate ca severitate, dar actualmente COVID-19 este considerată o maladie sistemică, fiind caracterizează de afecţiuni cardiovasculare, gastrointestinale, hepatice, renale, neurologice, endocrine etc., cauzate de leziuni microvasculare, cu ostare proinflamatorie şi de hipercoagulabilitate. Mecanismele care stau la baza acestor manifestări variate, deşi nu sunt încă pe deplin elucidate, pot fi determinate, posibil, de dereglările sistemului imunitar , determinate de virus, prin răspunsurile aberante cauzate de interferoni. Aceste răspunsuri contribuie la producerea de citokine, care epuizează celulele imune care recrutează macrofagele hiperactivate şi neutrofilele modificate funcţional, cu deplasarea echilibrului imun spre imunitatea înnăscută. Hiperactivarea macrofagelor şi neutrofilelor epuizează limfocitele B şi T, natural killer, cu accentuarea stării proinflamatorii, care stimulează activitatea necontrolată a complementului, cu dezvoltarea stării de tromboinflamaţie (figura 8)(6).
Odată cu intrarea virusului în celulă şi iniţierea replicării şi multiplicării lui, antigenul său va fi prezentat celulelor de prezentare a antigenului, partea centrală a imunităţii antivirale a organismului. Peptidele antigenice sunt prezentate prin complexul major de histocompatibilitate sau antigenul leucocitar uman (HLA) la om şi apoi recunoscute de limfocitele T citotoxice specifice virusului. La prezentarea antigenului se stimulează imunitatea umorală (celulele B) şi celulară (celulele T) a organismului (figura 9). Răspunsurile umorale se manifestă prin producerea de IgM (apar la 10-12 zi) şi IgG (se produc la a 12-16 zi). Imunoglobulinele IgM specifice SARS-CoV-2 dispar la sfârşitul săptămânii 12, iar IgG pot dura mult timp, fapt ce demonstrează că IgG pot juca un rol protector, deoarece sunt în principal anticorpi S- şi N-specifici. Imunitatea celulară este semnificativ redusă, se caracterizează prin reducerea numărului de celule T CD4+ şi CD8+ din sângele periferic al pacienţilor infectaţi cu SARS-CoV-2, în timp ce statutul său arată activarea excesivă, evidenţiată prin proporţiile mari de HLA-DR CD4 şi CD8. În stările grave şi critice, SDRA este evenimentul imunopatologic al infecţiei cu SARS-CoV-2. Mecanismul principal pentru SDRA este furtuna de citokine, răspunsul inflamator sistemic necontrolat mortal care rezultă din eliberarea unor cantităţi mari de citokine proinflamatorii (IFN-α, IFN-γ, IL-1β, IL-6, IL-12, IL-18, IL-33, TNF-α, TGF‑β etc.) şi chemokine (CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10 etc.) de către celulele efectoare imune. Procesul inflamator sistemic va declanşa un atac violent al sistemului imunitar asupra organismului, care va provoca SDRA şi insuficienţă poliorganică şi, în cele din urmă, deces(22).
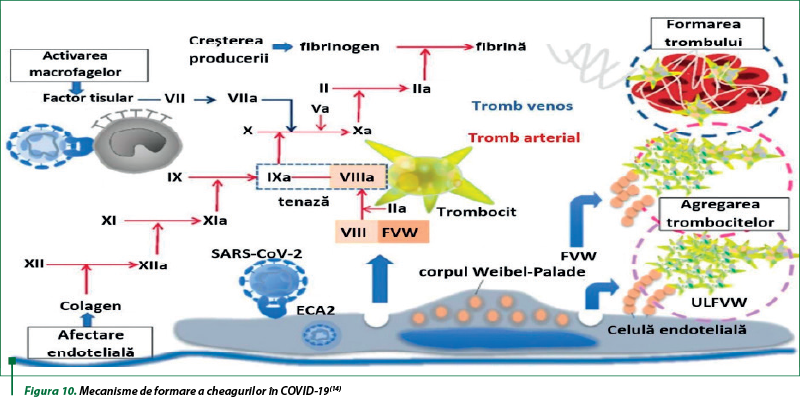
SARS-CoV-2 provoacă un efect inflamator acut, cu hipercoagulabilitate, activare trombocitară şi disfuncţie endotelială, cu dezvoltarea coagulopatiei asociate cu COVID-19 (CAC) şi a complicaţiilor tromboembolice soldate cu deces, inclusiv în cazul COVID-19 asimptomatic. Pacienţii cu CAC prezintă adesea, iniţial, un nivel crescut de fibrinogen şi D-dimeri, cu modificări minore ale timpului de protrombină (TP), timpului de tromboplastină parţial activat (TTPA) şi numărului de trombocite. Concomitent, mai poate fi constatată creşterea factorului VIII şi a factorului von Willebrand (vWF), prezenţa anticorpilor antifosfolipidici şi creşterea activităţii sistemului complementului. Patogeneza coagulopatiei în COVID-19 este complexă. Afectarea endoteliului patului microcirculator în plămâni şi alte regiuni vasculare constituie o caracteristică esenţială pentru CAC. Funcţia normală a endoteliului determină capacitatea de a regla tonusul vascular, permeabilitatea, adeziunea celulară şi statusul anticoagulant. Celulele endoteliale normale sintetizează oxidul nitric (NO), care previne aderenţa leucocitelor şi a trombocitelor, migrarea celulelor inflamatorii în peretele vasului, proliferarea celulelor musculaturii netede şi suprimă apoptoza şi inflamaţia. SARS-CoV-2 infectează direct celulele endoteliului vascular prin endocitoză, mediată de interacţiunea cu enzima ACE-2 şi serin proteaza transmembranară 2 (TMPRSS-2), care determină reducerea activităţii antitrombotice a suprafeţei luminale. Celulele endoteliale infectate îşi pierd capacitatea de a menţine funcţiile fiziologice, iar deteriorarea endoteliului determină modificarea procoagulantă a lumenului vascular, formarea de imunotromboză şi reducerea circulaţiei în organe. Endoteliul vascular este acoperit de glicocalix, constituit din sulfatul de heparină cu sarcini negative, care reglează fluxul sangvin vascular prin furnizarea unei suprafeţe antitrombotice prin legarea antitrombinei. Glicocalixul perturbat, la un nivel normal de antitrombină circulantă la bolnavii cu COVID-19, determină o reducere a proprietăţilor antitrombotice locale a suprafeţei endoteliale. Rezultatul răspunsului vascular la infecţia cu SARS-CoV-2 în CAC este reprezentat decreşterea VWF şi a factorului VIII, eliberaţi ca răspuns la stimuli infecţioşi (figura 10). SARS-CoV-2 infectează monocite/macrofage şi celule endoteliale vasculare, cele două verigi ale ciclului vicios al formaţiei trombului. Monocitul/macrofagul infectat exprimă factorul tisular la suprafaţă şi iniţiază cascada de coagulare. Lezarea endoteliului expune colagenul, cu iniţierea cascadei de coagulare pe cale intrinsecă. Factorul VIII, eliberat la nivelul celulelor endoteliale infectate, şi factorul von Willebrand (VWF), eliberat din corpul Weibel-Palade, accelerează coagularea. VWF eliberat stimulează agregarea plachetară şi un nivel al VWF foarte mare (ULVWF) activează aderenţa trombocitelor la celula endotelială. Aceste modificări protrombotice multifactoriale au ca rezultat tromboza arterială, venoasă şi microvasculară(14).
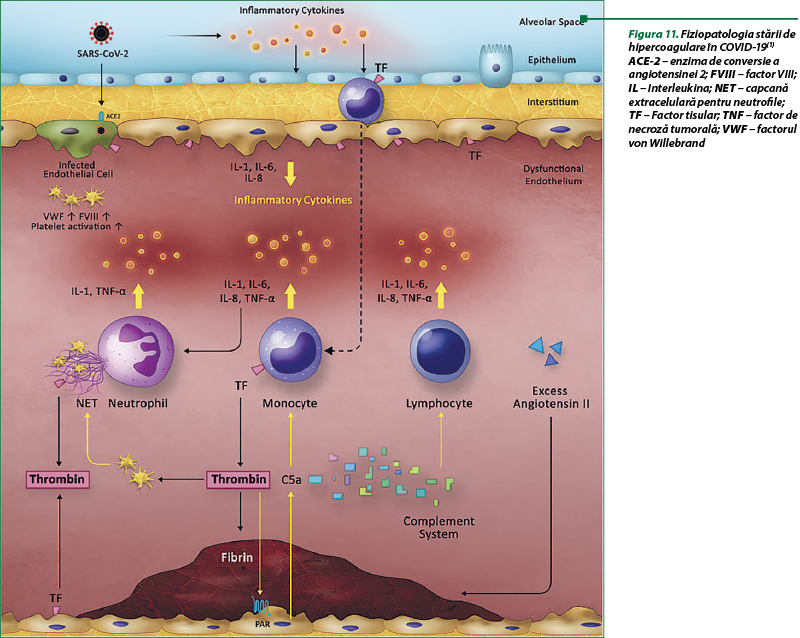
La pacienţii cu COVID-19 s-a constatat o relaţie cauzală, bidirecţională, între inflamaţie şi tromboză. COVID-19 provoacă o stare proinflamatoare marcantă, relevată prin creşterea nivelului proteinei C reactive, lactat dehidrogenazei, feritinei, IL-6 şi D-dimerilor. Nivelul de IL-6 şi al fibrinogenului se corelează la pacienţii cu COVID-19, fapt care indică, cu certitudine, o tromboză inflamatorie. Cercetătorii susţin că evenimentul iniţiator care declanşează ciclul de inflamaţie survine în alveolele pulmonare, prin mecanisme fiziopatologice multiple (figura 11). Leziunile virale iniţiale în alveole generează inflamaţie şi tromboză pulmonară microvasculară locală, urmate de o disfuncţie endotelială mai generalizată şi de o tromboinflamaţie în patul microvascular a majorităţii organelor, care conduc la o stare de hipercoagulabilitate şi insuficienţă multiplă de organe. Eliberarea marcantă de citokine contribuie la tromboză prin mecanisme multiple, inclusiv activarea monocitelor, neutrofilelor şi a endoteliului. Disfuncţia endotelială în COVID-19 poate surveni prin mai multe mecanisme: generarea de citokine inflamatorii în interstiţiul pulmonar; activarea componentelor complementului în sânge; acţiunea directă a infecţiei cu SARS-CoV-2 asupra celulelor endoteliale prin receptorul ACE-2. Endoteliita, ca rezultat al acestor mecanisme, predispune către tromboză, îndeosebi în situaţiile asociate cu obezitatea, cu hipertensiunea arterială şi cu diabetul. La disfuncţia endotelială şi la activarea în COVID-19 pot contribui şi prezenţa anticorpilor antifosfolipidici, a anticorpilor anticardiolipinici, a anticorpilor β2 glicoproteinei şi a anticoagulantului lupus pozitiv. Activarea monocitelor şi macrofagelor joacă un rol crucial în inflamaţia şi tromboza la pacienţii cu COVID-19 prin producerea de citokine. SARS-CoV-2, pentru a pătrunde în celule, fuzionează cu enzima de conversie a angiotensinei 2 (ACE-2), prin intermediul proteinei Spike (S), cu o disfuncţie a sistemului renină-angiotensină (SRA) rezultată prin diminuarea nivelului ACE-2. Se constată producţia excesivă de angiotensină II (AgII), care reglează negativ, şi de ACE-2, de pe celulele epiteliale alveolare pulmonare, celulele epiteliale tubulare renale, enterocitele din intestinul subţire, celulele endoteliale, cardiomiocite, fibroblaste şi pericite din inimă. Scăderea ACE-2 reduce degradarea AgII, care stimulează receptorii angiotensinici de tip 1, cu creşterea leziunilor pulmonare, stimularea eliberării IL-6 cu dezvoltarea furtunii citokinice, tipice infecţiei severe cu COVID-19. Studiile au demonstrat corelaţia dintre nivelul încărcăturii virale şi al leziunilor pulmonare cu nivelul plasmatic al AgII. S-a demonstrat că AgII induce expresia TF şi a inhibitorului activator al plasminogenului 1 (PAI-1) de către celulele endoteliale prin AT1R, determinând o stare de hipercoagulare. Astfel, investigarea mecanismelor moleculare implicate în tromboinflamaţie, indusă de SARS-CoV-2, este esenţială pentru a înţelege patofiziologia bolii şi pentru a dirija intervenţii terapeutice adecvate(1,19).
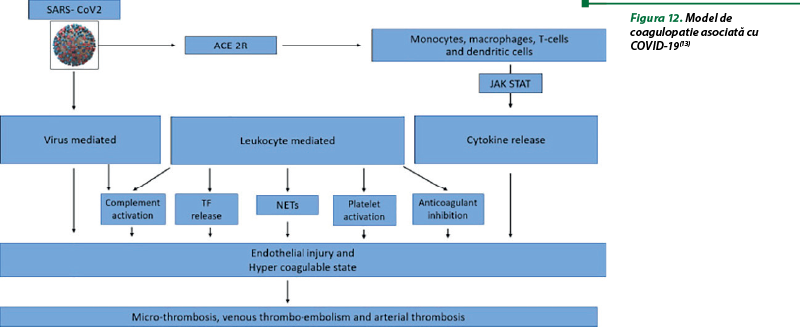
SARS-CoV-2 intră în celule prin intermediul receptorului enzimei de conversie a angiotensinei 2 (ACE-2R), ceea ce duce la activarea sistemului imunitar înnăscut. Infecţia virală directă a celulelor imune duce la dereglarea şi eliberarea de citokine. Monocitele activate şi macrofagele stimulează căile Janus kinase şi activatorul transcripţiei (JAK STAT) prin semnalizarea cis/trans, cu amplificarea eliberării de citokine. SARS-CoV-2 infectează celulele endoteliale direct, rezultând leziuni endoteliale, şi dezvoltă o stare de hipercoagulare. Activarea leucocitelor şi furtuna de citokine ulterioară duc la o stare de hipercoagulare prin cinci căi principale: eliberare crescută de factor tisular, capcane extracelulare de neutrofile, activarea trombocitelor, inactivarea căilor anticoagulante şi activarea complementului. Dereglarea sistemului imunitar în infecţia cu SARS-CoV-2 şi leziunea endotelială rezultată, precum şi starea de hipercoagulare culminează cu microtromboza răspândită, tromboembolismul venos şi tromboza arterială (figura 12)(13).
Fiziopatologia stării de hipercoagulabilitate în COVID-19 este extrem de complexă şi multifactorială. Este important de remarcat faptul că dovezile existente sunt derivate în primul rând din câteva mici analize retrospective şi trebuie efectuate evaluări suplimentare cu studii de cohortă prospective mari, pentru a înţelege mai bine această boală. O posibilă explicaţie studiază efectul infecţiei cu SARS-CoV-2 asupra proceselor individuale implicate în triada Virchow, şi anume: leziunea endotelială, staza fluxului sangvin şi starea de hipercoagulabilitate. Semnificaţia acestei triade este că ea unifică căile inflamatorii şi pe cele de coagulare în geneza coagulării. Fiecare dintre aceste componente este explorată în contextul COVID-19. Factorii endoteliali pot iniţia tromboza, iar disfuncţia endotelială contribuie la pierderea funcţiei fibrinolitice a celulelor endoteliale. Perturbarea endoteliului în COVID-19 determină eliberarea masivă a factorului von Willebrand (VWF). Propagarea trombozei poate fi ajutată de inflamaţia indusă de disfuncţia endotelială. Celulele endoteliale eliberează interleukina 6 (IL-6), ca răspuns la invazia virusului, care amplifică răspunsul imun al gazdei până la starea sindromului de furtună de citokine. COVID-19 sever se caracterizează prin dezvoltarea furtunii citokinice, iar activarea subiacentă a cascadei de coagulare predispune la coagulopatia indusă de sepsis şi la coagularea intravasculară diseminată(3).
Managementul convenţional al tulburărilor trombotice se bazează pe utilizarea anticoagulantelor, antiagregantelor şi fibrinoliticelor. În ciuda progresului remarcabil în medicină, aceste medicamente rămân încă o provocare şi un mister pentru noi, iar utilizarea lor este departe de a fi optimizată. Noile ţinte anticoagulante, inclusiv situsuri specifice din reţeaua hemostatică, cum ar fi factorul de ţesut, factorii individuali de coagulare (IIa, VIIa, IXa, Xa, XIIa şi XIIIa), formele recombinante de serpine (antitrombina, cofactorul II al heparinei şi calea factorului tisular). Au fost dezvoltate, de asemenea, proteina C activată recombinantă, trombomodulina şi complexele inhibitori de serin protează specifici locului. Există un impuls major asupra dezvoltării medicamentelor anticoagulante biodisponibile oral (agenţi anti-Xa şi anti-IIa), care să înlocuiască anticoagulantele orale (figura 13). Atât agenţii anti-factor Xa, cât şi antitrombina au fost dezvoltaţi pentru uz oral şi au oferit rezultate clinice impresionante în studiile sponsorizate pentru profilaxia postchirurgicală a trombozei venoase; cu toate acestea, odată cu utilizarea lor, au fost raportate preocupări legate de siguranţă, legate de creşterea enzimelor hepatice şi de revenirea trombozei(15).

Concluzii
În baza analizei literaturii cu privire la particularităţile structurale şi la ciclul infecţios al SARS-CoV-2, precum şi la mecanismele patogenetice responsabile de dezvoltarea COVID-19, putem concluziona:
SARS-CoV-2 reprezintă o variantă a beta-coronavirusurilor care se caracterizează printr-o contagiozitate înaltă şi o diseminare a infecţiei extrem de rapidă, cu mutaţii rapide, care au generat o gamă mare de variante (Alfa, Beta, Delta, Omicron) şi subvariante în evoluţie permanentă.
Elucidarea particularităţilor structurale şi de multiplicare a permis în termeni restrânşi înţelegerea mai amplă a mecanismelor patogenetice de realizare a infecţiei şi întreprinderea unor măsuri nefarmacologice şi farmacologice pentru împiedicarea transmisiei şi influenţarea prognosticului.
Analiza verigilor patogenetice a demonstrat cu certitudine că boala COVID-19 este o afecţiune sistemică şi care, deşi determină o afectare primară a plămânilor, produce dereglări gastrointestinale, cardiovasculare, neurologice, endocrine, hepatice, renale etc.
Afectarea pulmonară este cauzată de infectarea alveolocitelor de tip II, cu un dezechilibru al sistemului imunitar înnăscut şi adaptiv, hiperproducerea de citokine şi chemokine, migrarea şi activarea macrofagelor, monocitelor şi leucocitelor, alături de activarea sistemului complementului.
Infecţia cu SARS-CoV-2 determină dezvoltarea unui ciclu infecţios caracteristic, cu implicarea şi perturbarea sistemului imunitar înnăscut şi al celui adaptiv, dezvoltarea unui proces inflamator exagerat (furtuna citokinică) şi dereglări de coagulabilitate, cu risc de tromboze, care duce la instalarea sindromului de detresă respiratorie acută şi la insuficienţă poliorganică.
La pacienţii cu COVID-19 s-a constatat o relaţie cauzală, bidirecţională, între inflamaţie şi tromboză, cu instalarea imunotrombozei, caracterizată printr-o stare proinflamatorie marcantă, cu creşterea nivelului proteinei C reactive, lactat dehidrogenazei, feritinei, IL-6 şi al D-dimerilor.
Disfuncţia endotelială în COVID-19 poate surveni prin mai multe mecanisme: acţiunea directă a infecţiei cu SARS-CoV-2 asupra celulelor endoteliale prin receptorul ECA2; generarea de citokine inflamatorii în interstiţiul pulmonar; activarea componentelor complementului în sânge.
Elucidarea mecanismelor patofiziologice ale infecţiei cu SARS-CoV-2 a permis optimizarea tratamentului antitrombotic prin utilizarea diferenţiată a anticoagulantelor, antiagregantelor şi fibrinoliticelor.
Studiile permanente şi tot mai aprofundate asupra patogenezei COVID-19 au permis perfecţionarea managementului clinic, diagnostic şi farmacoterapeutic, prin elaborarea de noi strategii de profilaxie, de tratament şi de obţinere a vaccinurilor.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Abou-Ismail MY, Diamond A, Kapoor S, Arafah Y, Nayak L. The hypercoagulable state in COVID-19: Incidence, pathophysiology, and management. Thromb Res. 2020 Oct;194:101-115. doi: 10.1016/j.thromres.2020.06.029.
-
Agrahari R, Mohanty S, Vishwakarma K, Nayak SK, Samantaray D, Mohapatra S. Update vision on COVID-19: Structure, immune pathogenesis, treatment and safety assessment. Sens Int. 2021;2:100073. doi: 10.1016/j.sintl.2020.100073.
-
Ahmed S, Zimba O, Gasparyan AY. Thrombosis in Coronavirus disease 2019 (COVID-19) through the prism of Virchow’s triad. Clin Rheumatol. 2020 Sep;39(9):2529-2543. doi: 10.1007/s10067-020-05275-1.
-
Alturki SO, Alturki SO, Connors J, Cusimano G, Kutzler MA, Izmirly AM, Haddad EK. The 2020 Pandemic: Current SARS-CoV-2 Vaccine Development. Front Immunol. 2020 Aug 19;11:1880. doi: 10.3389/fimmu.2020.01880.
-
Bergmann CC, Silverman RH. COVID-19: Coronavirus replication, pathogenesis, and therapeutic strategies. Cleve Clin J Med. 2020 Jun;87(6):321-327. doi: 10.3949/ccjm.87a.20047.
-
Borczuk AC, Yantiss RK. The pathogenesis of coronavirus-19 disease. J Biomed Sci. 2022 Oct 26;29(1):87. doi: 10.1186/s12929-022-00872-5.
-
Chatterjee S, Bhattacharya M, Nag S, Dhama K, Chakraborty C. A Detailed Overview of SARS-CoV-2 Omicron: Its Sub-Variants, Mutations and Pathophysiology, Clinical Characteristics, Immunological Landscape, Immune Escape, and Therapies. Viruses. 2023 Jan 5;15(1):167. doi: 10.3390/v15010167.
-
Chedid M, Waked R, Haddad E, Chetata N, Saliba G, Choucair J. Antibiotics in treatment of COVID-19 complications: a review of frequency, indications, and efficacy. J Infect Public Health. 2021 May;14(5):570-576. doi: 10.1016/j.jiph.2021.02.001. Epub 2021 Feb 9. PMID: 33848886; PMCID: PMC7870433.
-
Dhama K, Khan S, Tiwari R, Sircar S, Bhat S, Malik YS, Singh KP, Chaicumpa W, Bonilla-Aldana DK, Rodriguez-Morales AJ. Coronavirus Disease 2019-COVID-19. Clin Microbiol Rev. 2020 Jun 24;33(4):e00028-20. doi: 10.1128/CMR.00028-20.
-
Echeverría-Esnal D, Martin-Ontiyuelo C, Navarrete-Rouco ME, De-Antonio Cuscó M, Ferrández O, Horcajada JP, Grau S. Azithromycin in the treatment of COVID-19: a review. Expert Rev Anti Infect Ther. 2021 Feb;19(2):147-163. doi: 10.1080/14787210.2020.1813024.
-
Gil C, Ginex T, Maestro I, Nozal V, Barrado-Gil L, Cuesta-Geijo MÁ, Urquiza J, Ramírez D, Alonso C, Campillo NE, Martinez A. COVID-19: Drug Targets and Potential Treatments. J Med Chem. 2020 Nov 12;63(21):12359-12386. doi: 10.1021/acs.jmedchem.0c00606.
-
Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, Bikdeli B, Ahluwalia N, Ausiello JC, Wan EY, Freedberg DE, Kirtane AJ, Parikh SA, Maurer MS, Nordvig AS, Accili D, Bathon JM, Mohan S, Bauer KA, Leon MB, Krumholz HM, Uriel N, Mehra MR, Elkind MSV, Stone GW, Schwartz A, Ho DD, Bilezikian JP, Landry DW. Extrapulmonary manifestations of COVID-19. Nat Med. 2020 Jul;26(7):1017-1032. doi: 10.1038/s41591-020-0968-3.
-
Ayarangaiah A, Kariyanna PT, Chen X, Jayarangaiah A, Kumar A. COVID-19-Associated Coagulopathy: An Exacerbated Immunothrombosis Response. Clin Appl Thromb Hemost. 2020 Jan-Dec;26:1076029620943293. doi: 10.1177/1076029620943293.
-
Iba T, Connors JM, Levy JH. The coagulopathy, endotheliopathy, and vasculitis of COVID-19. Inflamm Res. 2020 Dec;69(12):1181-1189. doi: 10.1007/s00011-020-01401-6.
-
Kim JH, Lim KM, Gwak HS. New Anticoagulants for the Prevention and Treatment of Venous Thromboembolism. Biomol Ther (Seoul). 2017 Sep 1;25(5):461-470. doi: 10.4062/biomolther.2016.271.
-
Kumar M, Al Khodor S. Pathophysiology and treatment strategies for COVID-19. J Transl Med. 2020 Sep 15;18(1):353. doi: 10.1186/s12967-020-02520-8.
-
Liu C, Wen Y, Wan W, Lei J, Jiang X. Clinical characteristics and antibiotics treatment in suspected bacterial infection patients with COVID-19. Int Immunopharmacol. 2021 Jan;90:107157. doi: 10.1016/j.intimp.2020.107157.
-
Mortaz E, Tabarsi P, Varahram M, Folkerts G, Adcock IM. The Immune Response and Immunopathology of COVID-19. Front Immunol. 2020 Aug 26;11:2037. doi: 10.3389/fimmu.2020.02037.
-
Salabei JK, Fishman TJ, Asnake ZT, Ali A, Iyer UG. COVID-19 Coagulopathy: Current knowledge and guidelines on anticoagulation. Heart Lung. 2021 Mar-Apr;50(2):357-360. doi: 10.1016/j.hrtlng.2021.01.011.
-
Saville JW, Berezuk AM, Srivastava SS, Subramaniam S. Three-Dimensional Visualization of Viral Structure, Entry, and Replication Underlying the Spread of SARS-CoV-2. Chem Rev. 2022 Sep 14;122(17):14066-14084. doi: 10.1021/acs.chemrev.1c01062.
-
Velagacherla V, Suresh A, Mehta CH, Nayak UY, Nayak Y. Multi-Targeting Approach in Selection of Potential Molecule for COVID-19 Treatment. Viruses. 2023 Jan 12;15(1):213. doi: 10.3390/v15010213.
-
Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal. 2020 Apr;10(2):102-108. doi: 10.1016/j.jpha.2020.03.001.