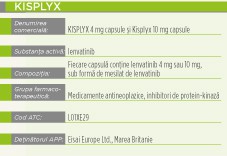
Indicaţii terapeutice
Kisplyx este indicat în asociere cu everolimus, pentru tratamentul pacienţilor adulţi cu carcinom renocelular (CRC) după un tratament anterior având ca ţintă factorul de creştere a endoteliului vascular (VEGF).
Mecanism de acţiune
Lenvatinib este un inhibitor al receptorilor tirozin kinazei (RTK), care inhibă selectiv activităţile kinazice ale receptorilor factorului de creştere a endoteliului vascular (FCEV), RFCEV1 (FLT1), RFCEV2 (KDR) şi RFCEV3 (FLT4), în plus faţă de alţi RTK legaţi de căile proangiogene şi oncogene, inclusiv receptorii factorului de creştere a fibroblaştilor (FCF) RFCF1, 2, 3, şi 4, receptorul factorului de creştere derivat din plachete sangvine (FCDP) RFCDPa, KIT şi RET. Asocierea dintre lenvatinib şi everolimus a indicat o creştere a activităţii antiangiogenice şi antitumorale, demonstrată prin scăderea proliferării celulelor endoteliale umane, formării de tuburi şi semnalizării VEGF in vitro şi a volumului tumorii în modele xenogrefe murine de cancer renocelular uman, mai mare decât în cazul fiecărui medicament în monoterapie.
Produsul conţine o entitate moleculară nouă şi a fost autorizat prin procedura centralizată de către EMA (Agenţia Europeană a Medicamentului). CHMP (Comitetul pentru medicamente de uz uman), pe baza evaluării calităţii, siguranţei şi eficacităţii din datele prezentate, consideră că produsul Kisplyx prezintă un raport beneficiu-risc pozitiv şi de aceea recomandă eliberarea autorizaţiei de punere pe piaţă.
Indicaţii terapeutice
Qtern, combinaţie în doză fixă de saxagliptin şi dapagliflozin, este indicat la pacienţii adulţi cu vârsta de 18 ani şi peste, cu diabet zaharat de tip 2:
pentru îmbunătăţirea controlului glicemic, atunci când metformin şi/sau sulfoniluree (SU) şi una dintre monocomponentele din Qtern nu asigură un control adecvat al glicemiei;
atunci când sunt deja trataţi cu combinaţia liberă de dapagliflozin şi saxagliptin.
Mecanism de acţiune
Qtern combină saxagliptin şi dapagliflozin, medicamente cu mecanisme de acţiune distincte şi complementare pentru îmbunătăţirea controlului glicemic. Saxagliptin, prin inhibarea selectivă a dipeptidil peptidazei-4 (DPP4), stimulează secreţia de insulină mediată de glucoză (efect incretinic).
Dapagliflozin, un inhibitor selectiv al co-transportorului 2 de sodiu/glucoză (SGLT2), inhibă independent de insulină reabsorbţia renală de glucoză. Acţiunile celor două medicamente sunt reglate de concentraţia plasmatică a glucozei.
Produsul este o combinaţie în doză fixă nouă şi a fost autorizat prin procedura centralizată de către EMA (Agenţia Europeană a Medicamentului). CHMP (Comitetul pentru medicamente de uz uman), pe baza evaluării calităţii, siguranţei şi eficacităţii din datele prezentate, consideră că produsul Qtern prezintă un raport beneficiu-risc pozitiv şi de aceea recomandă eliberarea autorizaţiei de punere pe piaţă. Ca urmare a deciziei Comisiei Europene, autorizaţia de punere pe piaţă este validă pe întreg teritoriul Uniunii Europene.
Indicaţii terapeutice
Tratamentul adenocarcinomului pancreatic metastazat, în asociere cu 5-fluorouracil (5-FU) şi leucovorin (LV), la pacienţi adulţi la care afecţiunea a progresat sub tratament pe bază de gemcitabină.
Mecanism de acţiune
Substanţa activă din ONIVYDE este irinotecanul (un inhibitor al topoizomerazei I), încapsulat într-o veziculă cu două straturi lipidice sau lipozom.
Irinotecanul este un derivat al camptotecinului. Camptotecinul acţionează ca un inhibitor specific al ADN-topoizomerazei I. Irinotecanul şi metabolitul său activ SN-38 se leagă reversibil la complexul topoizomerază I-ADN şi induce leziuni la nivelul ADN-ului pe o singură direcţie şi blochează furca de replicare a ADN şi este responsabil de citotoxicitate. Irinotecanul este metabolizat de carboxilesterază în SN-38. SN-38 este de aproximativ 1 000 de ori mai potent decât irinotecanul ca inhibitor al topoizomerazei I purificate din linii celulare tumorale de la om şi rozătoare.
Produsul este o entitate moleculară cu o formulare nouă şi a fost autorizat prin procedura centralizată de către EMA (Agenţia Europeană a Medicamentului). CHMP (Comitetul pentru medicamente de uz uman), pe baza evaluării calităţii, siguranţei şi eficacităţii din datele prezentate, consideră că produsul Onivyde prezintă un raport beneficiu-risc pozitiv şi de aceea recomandă eliberarea autorizaţiei de punere pe piaţă. Onivyde are desemnare de medicament orfan, adică se adresează unei boli rare. Ca urmare a deciziei Comisiei Europene, autorizaţia de punere pe piaţă este validă pe întreg teritoriul Uniunii Europene.
Indicaţii terapeutice
Truberzi este indicat la adulţi pentru tratamentul sindromului de colon iritabil cu diaree (SCI-D).
Mecanism de acţiune
Eluxadolina este un agonist mixt al receptorilor opioizi miu (ROµ) şi antagonist al receptorilor opioizi delta (ROd), cu acţiune locală. De asemenea, eluxadolina este un agonist al receptorilor opioizi kappa (ROk). Afinităţile de legare (Ki) ale eluxadolinei la ROµ şi ROd umani sunt de 1,8 nM, respectiv 430 nM. Afinitatea de legare (Ki) a eluxadolinei la ROk umani nu a fost determinată; cu toate acestea, Ki pentru ROk din cerebelul de porc de Guineea este de 55 nM. La animale, eluxadolina interacţionează cu receptorii opioizi din intestin. Eluxadolina a demonstrat eficacitate în normalizarea tranzitului gastrointestinal şi a defecării în mai multe modele de funcţie gastrointestinală indusă de stres sau funcţie gastrointestinală modificată după inflamaţia gastrointestinală la animale. Eluxadolina are o biodisponibilitate orală foarte scăzută şi nu exercită nici un efect detectabil mediat de sistemul nervos central (SNC) atunci când este administrată la animale, pe cale orală, în doze eficace. De asemenea, eluxadolina inversează răspunsurile hiperalgice la un model animal al durerii viscerale acute induse de colită.
Produsul conţine o entitate moleculară nouă şi a fost autorizat prin procedura centralizată de către EMA (Agenţia Europeană a Medicamentului). CHMP (Comitetul pentru medicamente de uz uman), pe baza evaluării calităţii, siguranţei şi eficacităţii din datele prezentate, consideră că produsul Truberzi prezintă un raport beneficiu-risc pozitiv şi de aceea recomandă eliberarea autorizaţiei de punere pe piaţă.
Toate medicamentele prezentate fac obiectul unor monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informaţii referitoare la siguranţă. Profesioniştii din domeniul sănătăţii sunt rugaţi să raporteze orice reacţii adverse suspectate.