The increasing incidence of drug-related renal pathology represents a pressing problem for medical specialties and clinical pharmacology, which requires a multilateral approach. The elucidation and analysis of the mechanisms of drug nephrotoxicity, the processes that influence them and the specific biomarkers that allow the early detection of reversible renal lesions will significantly reduce the undesirable consequences of the drugs on the kidneys. The review of nephrotoxic drugs and of the responsible pathogenic mechanisms will allow the development of principles for monitoring, prevention and correction of renal disorders, which will complement the pharmacovigilance compartment of clinical pharmacology.
Nefrotoxicitatea medicamentelor: mecanisme şi biomarkeri
Nephrotoxicity of drugs, biomarkers and mechanisms
First published: 16 aprilie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.193.2.2020.3091
Abstract
Rezumat
Din cauza incidenţei în creştere, patologia renală medicamentoasă reprezintă o problemă stringentă pentru specialităţile medicale şi farmacologia clinică şi necesitând o abordare multilaterală. Elucidarea şi analiza mecanismelor nefrotoxicităţii medicamentelor, ale proceselor care le influenţează şi ale biomarkerilor specifici care permit depistarea precoce a leziunilor renale reversibile vor permite reducerea semnificativă a consecinţelor nedorite ale medicamentelor asupra rinichilor. Revizuirea medicamentelor nefrotoxice şi a mecanismelor patogenetice responsabile va permite elaborarea principiilor de monitorizare, prevenire şi corectare a afecţiunilor renale, care va completa compartimentul de farmacovigilenţă al farmacologiei clinice.
Incidenţa nefrotoxicităţii produse de medicamente este determinată de creşterea numărului de preparate utilizate, inclusiv a celor eliberate fără prescripţie medicală (lista OTC). În circa 14-26% dintre cazuri, insuficienţa renală acută (IRA) este cauzată de administrarea medicamentelor, care creşte până la 50‑66% la pacienţii cu afecţiuni cardiovasculare, diabet zaharat şi politerapie sau polipragmazie(1,5,9,10,11,14,16,17).
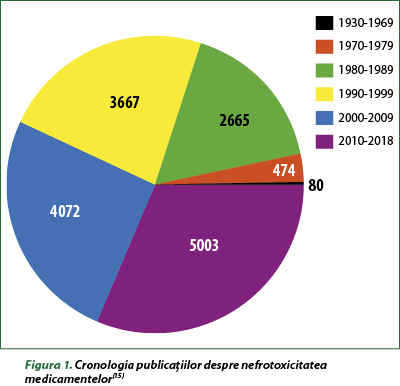
O analiză a articolelor din PubMed privind nefrotoxicitatea a relevat o creştere continuă a rapoartelor de cercetare în domeniul nefrotoxicităţii induse de medicamente, de la 80 de articole în anii 1930-1969 până la peste 5000 în anii 2010-2018 (figura 1)(15).
Afectarea numeroaselor tipuri de celule ale nefronului poate induce leziuni renale şi insuficienţă renală. Cauzele insuficienţei renale pot fi intrinseci sau extrinseci. Cauzele extrinseci includ maladii cardiovasculare, obezitate, diabet zaharat, sepsis, insuficienţă pulmonară şi hepatică. Cauzele intrinseci includ glomerulonefrita, boala polichistică renală, fibroza renală, calculii renali şi ischemia rinichilor. Numeroase medicamente, poluanţi de mediu şi substanţe naturale pot produce leziuni toxice ale rinichilor. Acestea pot determina leziuni renale acute şi boală renală cronică, în funcţie de deficienţa funcţională şi de durata în care funcţia renală este diminuată. S-a constatat că există mai multe verigi patogenetice comune între nefrotoxicitatea medicamentoasă şi patologia renală. Important este că ambele sunt cauzate de modificări în structura nefronului şi includ leziuni ale glomerulelor, tubulilor, interstiţiului şi vaselor intrarenale. Structurile respective asigură procesele de filtrare şi epurare a deşeurilor din sânge, menţinerea echilibrului hidroelectrolitic şi a pH-ului sângelui, controlul hormonal al producţiei eritrocitelor, reglarea tensiunii arteriale şi a homeostaziei organismului(2,18).
Mecanismele care mediază moartea celulelor renale induse de substanţele nefrotoxice şi cele implicate în patologiile renale sunt în mare parte similare. Astfel, insuficienţa renală acută (IRA) indusă de preparatul antitumoral cisplatină şi cea indusă de ischemie implică mecanisme similare, precum depleţia adenozin trifosfatului (ATP), stresul oxidativ, moartea celulelor tubului proximal, afectarea membranei bazale şi polarizarea celulelor. Nefrotoxicitatea indusă de substanţele de contrast se caracterizează prin stres oxidativ, pierderea ATP şi moartea celulelor tubului proximal, manifestări depistate şi în nefropatia diabetică. Furosemidul, D-penicilamina şi preparatele aurului produc proteinurie, fibroză glomerulară şi fibroză interstiţială, leziuni renale similare cu cele cauzate de hipertensiunea arterială şi hiperglicemie(2,18).
Mecanismele nefrotoxicităţii
Numeroase studii s-au concentrat asupra mecanismelor biochimice şi moleculare ale nefrotoxicităţii, care induc moartea celulară prin apoptoză, autofagie şi necroză. Apoptoza şi autofagia celulelor renale prin căi intrinseci şi extrinseci pot fi induse de preparate antitumorale, antibiotice, ciuperci, mucegai, metale (mercur etc.) şi oxidanţi. O gamă variată de compuşi induc necroză la nivelul rinichilor, dar şi apoptoză sau autofagie. Mecanismul exact depinde de tipul de celule implicat, de doză şi de durata expunerii, dar şi de factorii dependenţi de pacient (sex, vârstă, maladii concomitente etc.). Concomitent, acţiunea nefrotoxică se poate reflecta asupra mai multor tipuri de celule şi se poate dezvolta pe fundalul hipertensiunii arteriale, al obezităţii, al maladiilor hepatice, pulmonare, cardiace sau al abuzului de substanţe chimice (alcoolul, fumul de ţigară, drogurile etc.)(2).
Nefrotoxicitatea indusă de medicamente poate fi dependentă de doză (reacţii de tip A) sau independentă de doză (reacţii de tip B). Toxicitatea dependentă de doză este previzibilă, determinată de efectele farmacologice ale preparatului şi de gradul de expunere în timp la medicamente şi parametrii farmacocinetici/toxicodinamici, precum concentraţia maximă (Cmax), aria de sub curba concentraţiei (ASC), perioada de înjumătăţire (T0,5) şi capacitatea de cumulare. Nefrotoxicitatea medicamentelor dependentă de doză poate fi atenuată prin reducerea dozei sau suspendarea/ajustarea terapiei. Toxicitatea independentă de doză este reprezentată de reacţiile idiosincrazice care apar în orice moment în timpul terapiei şi sunt variabile de la pacient la pacient. În cazul IRA induse de medicamente nefrotoxice, expunerea la medicament ar trebui să preceadă modificările funcţiei renale, alterarea nivelului creatininei şi/sau volumul de urină cu cel puţin 24 de ore, pentru a fi considerate responsabile de afectarea renală(6).
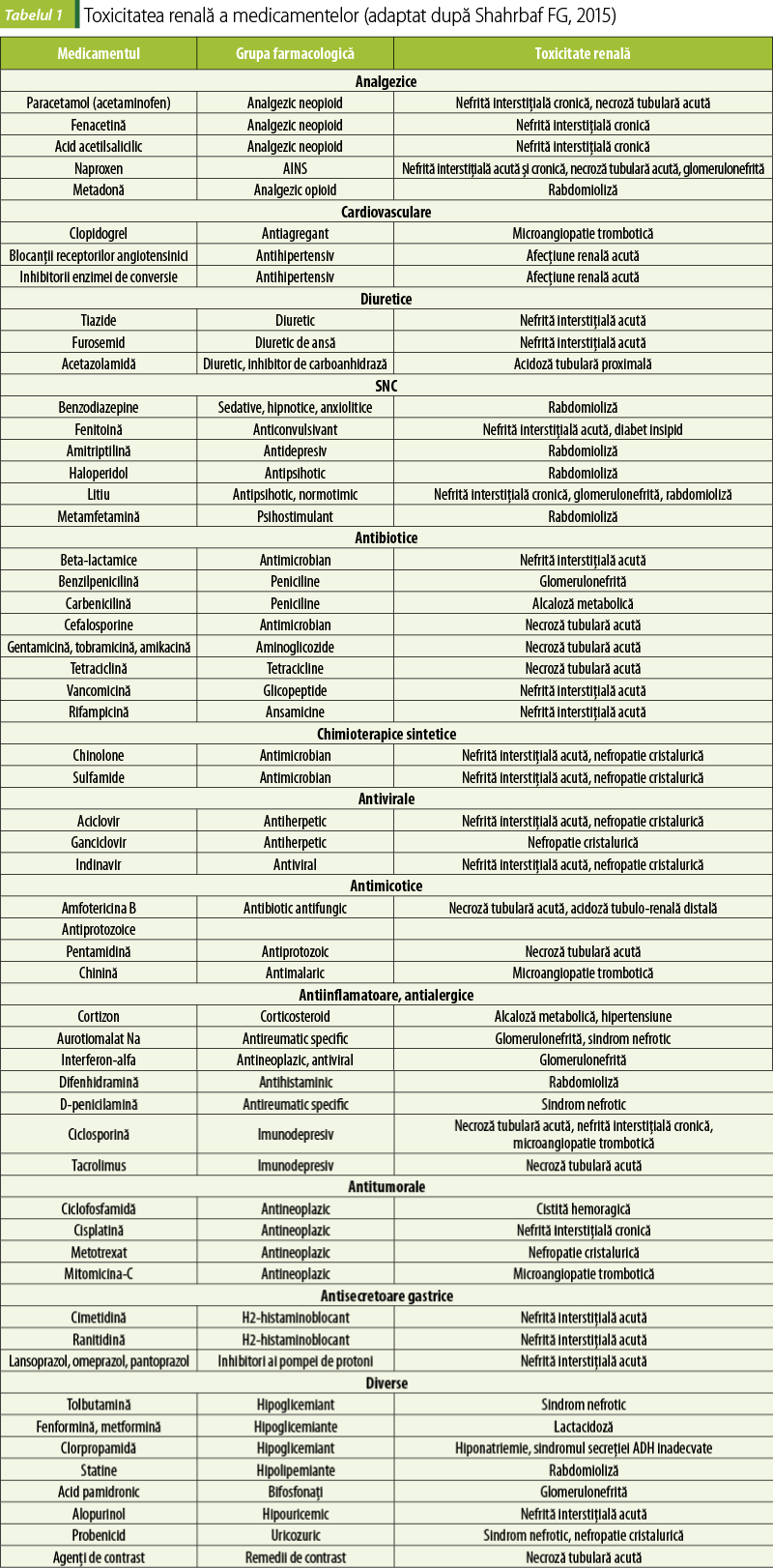
Există diferite mecanisme de nefrotoxicitate, inclusiv alterarea hemodinamicii intraglomerulare renale, toxicitate tubulară renală, inflamaţie (glomerulonefrită şi nefrită interstiţială), leziuni glomerulare, nefropatie cauzată de cristale, sindrom nefrotic şi microangiopatie trombotică (tabelul 1)(1,8,10,11,16,17).
Alterarea hemodinamicii intraglomerulare renale
Insuficienţa renală mediată de dereglările hemodinamice survine când sunt afectate mecanismele de menţinere a presiunii intraglomerulare: diminuarea fluxului renal, vasoconstricţia arteriolelor aferente sau vasodilataţia arteriolelor eferente glomerulare. Autoreglarea presiunii intraglomerulare este esenţială pentru menţinerea ratei filtrării glomerulare (RFG) şi a producţiei de urină determinate de prostaglandine (vasodilataţia arteriolei aferente) şi angiotensina II (vasoconstricţia arteriolelor eferente). Prin urmare, AINS (diclofenac etc.), blocantele receptorilor angiotensinici (valsartan) şi inhibitorii enzimei de conversie a angiotensinei (captopril etc.) pot determina deteriorarea severă a presiunii intraglomerulare şi reducerea RFG. Ciclosporina şi tacrolimus provoacă vasoconstricţia dependentă de doză a arteriolelor aferente(1,8,10).
Citotoxicitatea tubulară renală
Tubii proximali renali joacă un rol major în eliminarea deşeurilor din organism, inclusiv a medicamentelor şi a metaboliţilor acestora. Mecanismele de secreţie activă şi reabsorbţie împreună cu capacitatea de biotransformare fac ca celulele tubulare proximale să fie sensibile la toxicitatea indusă de medicamente şi la leziunile renale acute ulterioare. De asemenea, epiteliul tubului proximal exprimă o gamă largă de transportori funcţionali şi enzime metabolice care acţionează în concordanţă cu eliminarea renală a medicamentului. Transportorii renali de medicamente sunt foarte condensaţi, contribuind la sensibilitatea relativ ridicată a tubilor renali proximali la agenţii toxici, cum ar fi medicamentele antiretrovirale şi cisplatina(1,8,16,17).
Glomerulonefrita şi nefrita interstiţială
Afectarea renală în glomerulonefrită se datorează reacţiilor inflamatorii, infiltrării proteinelor şi proceselor imune celulare. Acest mecanism poate fi cauzat de preparatele aurului, interferoni, AINS, litiu, hidralazină, ampicilină, rifampicină, foscarnet şi pamidronat. Răspunsul alergic la medicamente poate provoca nefrită interstiţială ca în cazul alopurinolului, rifampicinei, sulfamidelor, lansoprazolului şi chinolonelor. Unele medicamente, precum ciclosporina, plante medicinale chinezeşti şi AINS, pot provoca nefrită interstiţială cronică. Antibioticele b-lactamice, vancomicina, AINS şi inhibitorii calcineurinei pot dezvolta nefrite interstiţiale acute alergice, mediate de reacţii inflamatorii la nivelul tubilor renali şi interstiţiului(1,8,16,17,18).
Necroza tubulară acută
Se caracterizează prin lezarea celulelor tubulare ca urmare a efectelor ischemice, datorate expunerii la aminoglicozide şi amfotericină B. Celulele tubulare au cea mai mare expunere la toxinele circulante, deoarece concentrează şi reabsorb filtratul glomerular. Necroza tubulară este mediată de alterarea funcţiei mitocondriilor, de stresul oxidativ sau de formarea de radicali liberi. Necroza papilară este asociată cu utilizarea analgezicelor neopioide: acetaminofen şi AINS(8,10).
Nefropatia obstructivă prin cristalurie
Unele medicamente şi metaboliţii acestora pot produce cristale insolubile în urină şi precipitate în tubii renali distali, care provoacă reacţie interstiţială şi obstrucţie. Cele mai frecvente medicamente care generează cristale sunt sulfamidele, ampicilina, aciclovirul, ciprofloxacina, triamterenul şi metotrexatul. Majoritatea dintre acestea sunt precipitate în principal în urina acidă, cu dezvoltarea nefropatiei, iar tratamentul cu antitumorale cauzează liza tumorii, cu producerea semnificativă a acidului uric şi a calciului, care induce formarea cristalelor şi insuficienţă renală acută(1,8,9,10,17).
Microangiopatia trombotică
Microangiopatia indusă de medicamente se datorează unei reacţii imune, care duce la purpura trombocitopenică trombotică şi la activarea trombocitelor, care produc citotoxicitate endotelială. Prin acest mecanism pot acţiona ticlopidina, ciclosporina şi chinina(1,8,9,17,18).
Rabdomioliza
Statinele, alcoolul, heroina, ketamina, metamfetamina, metadona, benzodiazepinele, haloperidolul, amitriptilina, difenhidramina şi cocaina pot produce efect rabdomiolitic prin leziuni ale muşchilor scheletici, din cauza efectului toxic direct asupra miocitelor, cu liza miocitelor şi a mioglobinei intracelulare şi a creatininkinazei. Mioglobina duce la leziuni renale din cauza toxicităţii directe şi a obstrucţiilor tubulare(1,8,10,17).
Sindromul nefrotic
Medicamentele sunt o cauză frecventă a IRA la copiii cu sindrom nefrotic (SN). S-a estimat că, la mai mult de jumătate dintre copiii spitalizaţi, SN a fost cauzat de utilizarea unui preparat nefrotoxic, iar la 20% – de cel puţin două medicamente nefrotoxice. Preparatele medicamentoase responsabile de SN pot fi inhibitorii enzimei de conversie a angiotensinei (IECA), inhibitorii calcineurinei şi antibioticele nefrotoxice. Incidenţa creşte la asocierea de medicamente nefrotoxice, la majorarea duratei şi intensităţii expunerii, cu un risc mai mare pentru IRA(12).
Biomarkerii nefrotoxicităţii
Markerii tradiţionali ai nefrotoxicităţii şi ai disfuncţiei renale sunt rata filtrării glomerulare, ureea sau azotul ureei, creatinina serică şi volumul urinei, care sunt specifice, dar cu sensibilitate redusă în detectarea leziunilor renale în stadii incipiente. Astfel, determinarea precoce a leziunii renale necesită noi biomarkeri, mai sensibili şi extrem de specifici, care oferă o perspectivă pentru identificarea localizării afectării renale(1,2,4,5,8,10,12,16,18).
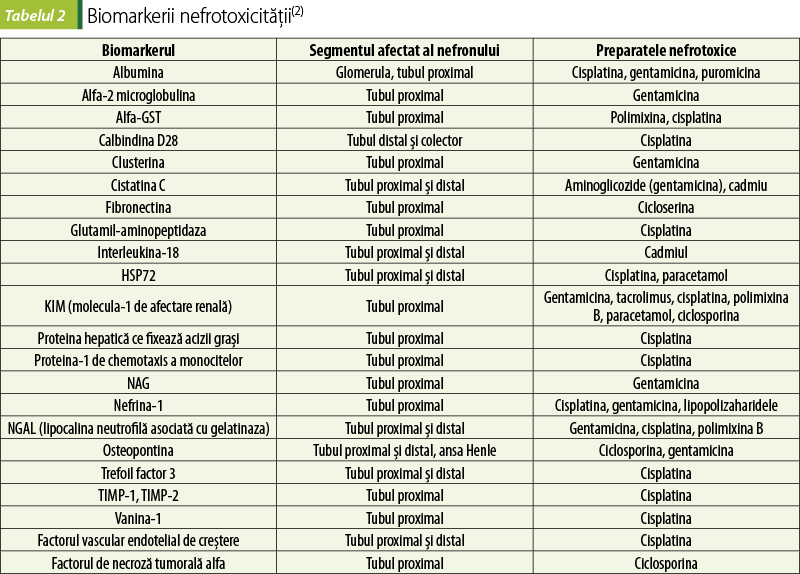
Proteinele urinare pot fi considerate potenţiali markeri ai afectării renale acute şi cronice, induse de medicamente nefrotoxice. În mod normal, glomerulele împiedică transportul şi migrarea proteinelor cu greutate moleculară mare din sânge în lumenul nefronului, dar în condiţii patologice, din cauza disfuncţiei nefronilor, proteinele cu greutate moleculară mare pot fi detectate în urină. Proteinele cu o greutate moleculară mare, cum ar fi albumina, transferina şi imunoglobulina G, sunt proteine mai sensibile în depistarea timpurie a disfuncţiei filtrării glomerulare, a leziunilor structurilor glomerulare. În mod normal, proteinele cu greutate moleculară mică sunt reabsorbite la nivelul tubilor proximali renali, dar creşterea excesivă a concentraţiei acestora duce la suprasolicitarea nefronilor, cu depăşirea ulterioară a capacităţii de reabsorbţie a tubilor renali proximali. Prin urmare, deteriorarea tubilor renali proximali duce la o prezenţă a proteinelor cu greutate moleculară mică din cauza afectării capacităţii de reabsorbţie(1,8).
Proteinele cu greutate moleculară mică, cum ar fi a1-microglobulina, b2-microglobulina, cistatina C (Cys C), proteina de legare a retinolului şi molecula-1 de afectare a rinichilor (KIM-1), sunt înregistrate ca fiind principalele proteine care reflectă baza leziunii glomerulare renale şi/sau tubulare în timpul nefrotoxicităţii. Agenţii nefrotoxici, cisplatina, AINS şi aminoglicozidele determină creşterea expresiei KIM‑1, din cauza leziunii ischemice. Astfel, nivelul seric al KIM-1 este corelat cu răspunsul imun al afectării tubilor proximali în timpul nefrotoxicităţii. În plus, ARNm al KIM-1 este exprimat în mod semnificativ în rinichiul lezat, care este expus şi apoi eliberat în lumen şi, în cele din urmă, este excretat în urină. Mai mult, KIM-1 este detectat în sânge, deoarece este stabil şi poate fi identificat direct(1,4,8,13,16).
Lipocalina neutrofilă asociată cu gelatinaza (NGAL), proteină ataşată de granulocite, se corelează cu nefrotoxicitatea, deoarece este responsabilă de inflamaţie în cazul ischemiei renale şi al leziunilor renale acute. Diferite citokine, cum ar fi interleukina-18 (IL-18), interferonul şi factorii de stimulare colonială joacă un rol important şi integral în afectarea şi recuperarea tubulară renală, astfel încât sunt considerate ca biomarkeri ai leziunilor renale în cazul nefrotoxicităţii induse de medicamente(4,13,16).
Toţi aceşti biomarkeri pot fi detectaţi atât în urină, cât şi în sânge, pentru estimarea nefrotoxicităţii induse de medicamente. Din acest motiv, măsurarea proteinelor din urină este considerată un test de bază pentru estimarea nefrotoxicităţii şi a afectării renale. Astfel, IL-18 a fost descrisă iniţial ca factor inductor al interferonului gamma, care este activat de caspaza-1 în timpul apoptozei. IL-18 acţionează asupra receptorilor specifici care se găsesc pe mastocite, celulele dendritice, limfocitele T şi bazofile şi este implicată în patogeneza obezităţii şi a bolilor inflamatorii intestinale şi renale cronice. Nivelul seric crescut al IL-18 este asociat cu atrofie tubulară renală şi fibroză interstiţială şi se corelează cu leziunile renale acute şi cu nefrotoxicitatea indusă de medicamente, dar poate acţiona şi ca factor de protecţie, care împiedică evoluţia ulterioară a acestei boli(1,4,8).
Cistatina C a fost determinată ca urmă de proteină în urină şi lichidul cefalorahidian la pacienţii cu insuficienţă renală. Cistatina C împreună cu ureea şi creatinina sunt utilizate pentru evaluarea funcţiei renale şi a RFG. Cistatina C este o proteină cu greutate moleculară mică, excretată prin filtrare glomerulară, iar creşterea nivelului acesteia este legată de reducerea RFG şi a filtrării glomerulare. S-a demonstrat că nivelul seric al cistatinei C serveşte ca un prognostic al stadiului şi evoluţiei bolilor renale. Nivelul cistatinei C este crescut, de asemenea, la fumători, în cancer, în maladiile neurologice şi în ateroscleroză(1,8).
Vitronectina (VTN), glicoproteină sintetizată de hepatocite, circulă în plasmă şi este asociată cu activarea cascadei complementului (C5b-9) şi cu depozitarea glomerulară a complexelor imune în patogeneza bolii renale şi în leziuni interstiţiale. Nivelurile serice ale VTN sunt corelate cu fibroza în maladiile renale. Mai mult decât atât, VTN se leagă şi prelungeşte timpul de înjumătăţire al inhibitorului activatorului plasminogenului 1, care duce la creşterea producerii de plasmină, având un efect protector glomerular în timpul leziunilor renale acute(1,8).
Integrina (ITN) este un receptor transmembranar care asigură adeziunea extracelulară a matricei şi constă din subunităţi a şi b. ITN reglează funcţiile celulare critice şi homeostazia în timpul leziunilor glomerulare prin efect antifibrotic, ceea ce duce la o protecţie glomerulară semnificativă. Pe de altă parte, ITN a2b1 poate duce la leziuni glomerulare prin creşterea sintezei de colagen. Inhibitorii ITN a2b1 pot avea o valoare mare în reducerea afectării renale. În plus, inhibitorii ITN a2b1 atenuează nefrotoxicitatea indusă de ciclosporină, prin inhibarea producţiei mezangiale de colagen(1,8).
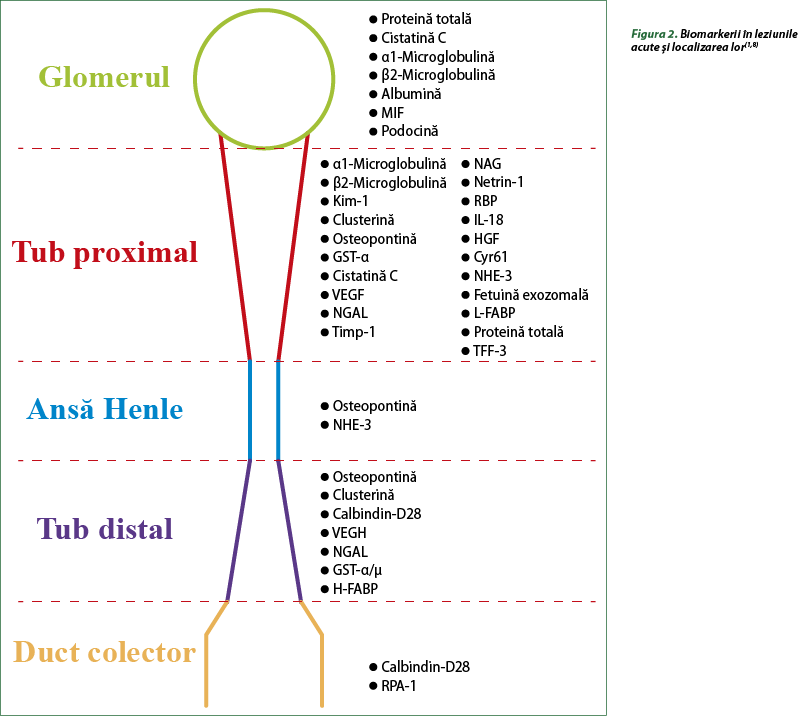
Prin urmare, biomarkerii noi pot ajuta la estimarea leziunilor renale oferind o imagine importantă despre evoluţia bolii şi rezultatele clinice (figura 2).
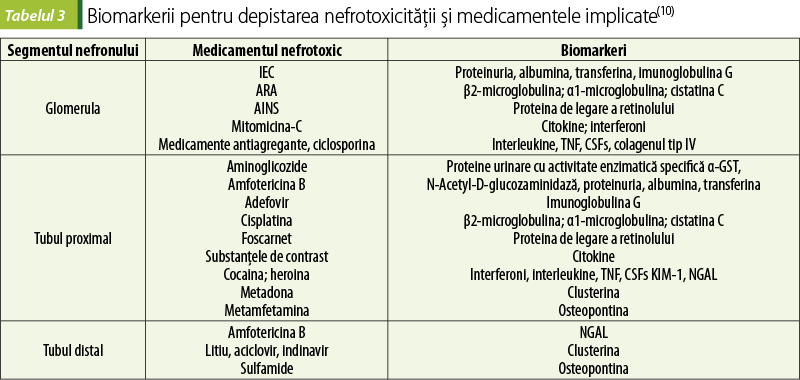
Monitorizarea parametrilor respectivi va permite o depistare precoce a nefrotoxicităţii medicamentelor, cu ajustarea ulterioară a tacticii de tratament. În tabelele 2 şi 3 sunt reflectate perturbările la nivelul diferitelor segmente ale nefronului, cu elucidarea preparatelor implicate şi parametrii care necesită a fi utilizaţi pentru depistarea nefrotoxicităţii.
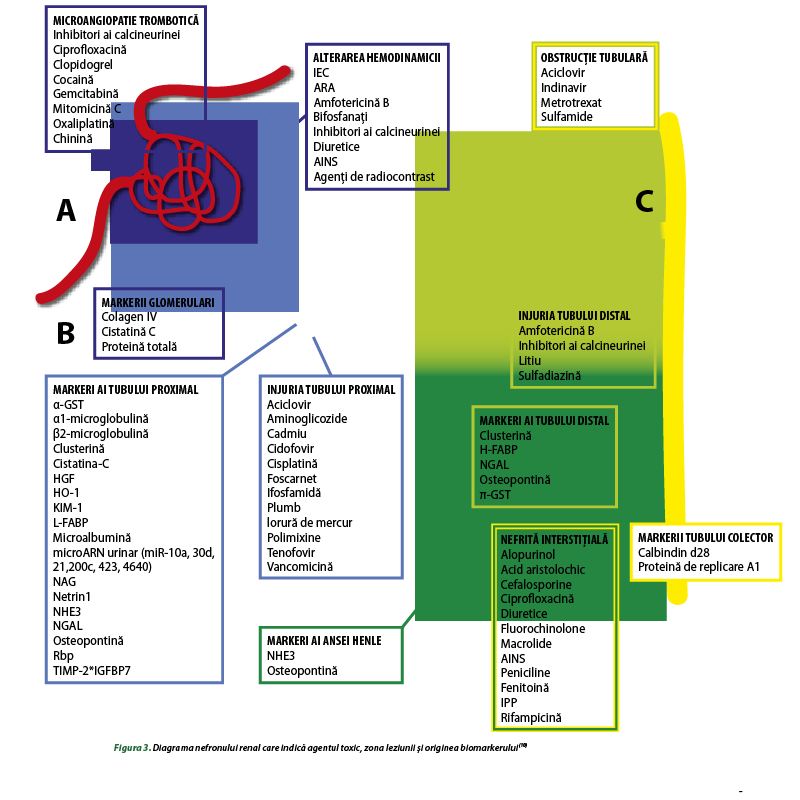
În figura 3 sunt ilustrate procesele patologice, biomarkerii caracteristici şi preparatele nefrotoxice responsabile de acestea.
A) Filtrarea pasivă este primul proces care poate fi realizat de glomerulă în cazul în care modificările hemodinamice şi/sau microangiopatia trombotică, induse de medicamente nefrotoxice, determină dezvoltarea insuficienţei renale acute.
B) Tubul proximal este ţinta primară a toxicelor, cu dezvoltarea insuficienţei renale acute care duce la pierderea integrităţii şi cumularea biomarkerilor în urină.
C) Ansa Henle, tubul distal şi tubul colector pot fi compromise în insuficienţa renală acută, cu dezvoltarea nefritei interstiţiale şi cumularea biomarkerilor în urină.
Concluzii
Nefrotoxicitatea medicamentelor necesită o abordare complexă şi minuţioasă, pentru prevenirea leziunilor renale, diferenţierea dintre acţiunea lezantă a preparatelor şi afecţiunea renală propriu-zisă, alături de selectarea biomarkerilor adecvaţi specifici şi timpurii. Elucidarea acestor compartimente va permite o abordare adecvată şi raţională a tratamentului şi o monitorizare precoce pentru rezolvarea problemelor nefrotoxicităţii în stadiul proceselor reversibile.
Bibliografie
- Al-Naimi MS, Rasheed HA, Hussien NR et al. Nephrotoxicity: Role and significance of renal biomarkers in the early detection of acute renal injury. J Adv Pharm Technol Res. 2019 Jul-Sep;10(3):95-99.
- Barnett LMA, Cummings BS. Nephrotoxicity and Renal Pathophysiology: A Contemporary Perspective. Toxicological Sciences. 2018 August, 164(2), 379–390.
- Cleto-Yamane TL, Gomes CLR, Suassuna JHR et al. Acute Kidney Injury Epidemiology in paediatrics. Braz. J. Nephrol. (J. Bras. Nefrol.) 2019;41(2):275-283.
- Devarajan P. Biomarkers for the Early Detection of Acute Kidney Injury. Curr Opin Pediatr. 2011 Apr; 23(2): 194–200.
- Divya M, Nivetha SR, Mohan L et al. Drug-induced renal disorder – A Mini Review. International Journal of Research in Pharmaceutical Sciences, 2020, 11(1), 166-172.
- Downes KJ, Hayes M, Fitzgerald JC et al. Mechanisms of antimicrobial-induced nephrotoxicity in children. J Antimicrob Chemother. 2020 Jan 1;75(1):1-13. doi: 10.1093/jac/dkz325.
- Faught LN, Greff MJE, Rieder MJ, Koren G. Drug-induced acute kidney injury in children. Br J Clin Pharmacol. 2015 Oct; 80(4): 901–909.
- Girardi A, Raschi E, Galletti S et al. Drug-Induced Renal Damage in Preterm Neonates: State of the Art and Methods for Early Detection. Drug Saf. 2015,38, 535–551.
- Hemalatha S et al. Nephrotoxicity, its mechanism and biomarkers: A systematic review. IP Journal of Urology, Nephrology & Hepatology Science. October – December 2019;2(4): 45 – 49.
- Kim SY, MoonA. Drug-Induced Nephrotoxicity and Its Biomarkers. Biomol Ther (Seoul). 2012 May; 20(3): 268–272.
- Lucas GNC, Leitão ACC, Alencar RL et al. Pathophysiological aspects of nephropathy caused by non-steroidal anti-inflammatory drugs. J Bras Nefrol. 2019 Jan-Mar;41(1):124-130.
- Menon S. Acute Kidney Injury in Nephrotic Syndrome. Front. Pediatr. 2019, 6:428.
- Muhle-Goll C, Eisenmann P, Luy B et al. Urinary NMR Profiling in Pediatric Acute Kidney Injury – A Pilot Study. Int. J. Mol. Sci. 2020, 21, 1187, 1-16.
- Perazella MA. Pharmacology behind Common Drug Nephrotoxicities. CJASN December 2018, 13(12) 1897-1908.
- Rankin GO, Valentovic MA. Historical Perspective of Nephrotoxicity. Toxicol Sci. 2018 Aug; 164(2): 377–378.
- Sales GTM, Foresto RD. Drug-induced nephrotoxicity. Rev. Assoc. Med. Bras. 2020; 66(l.), 82-90.
- Shahrbaf FG, Assadi F. Drug-induced renal disorders. J. Renal Inj Prev. 2015; 4(3): 57–60.
- Weber EJ, Himmelfarb J, Kelly EJ. Concise Review: Current and Emerging Biomarkers of Nephrotoxicity. Curr Opin Toxicol. 2017 Jun; 4: 16–21.
Articole din ediţiile anterioare
Contribuţii personale la bazele știinţifice, teoretice și practice, ale homeopatiei
În ultimii ani am constatat un atac concertat împotriva homeopatiei. După Schopenhauer, „orice adevăr parcurge trei etape: ridiculizare, combatere ...
Abordări farmacoterapeutice ale tusei cronice
Tusea constituie un simptom frecvent, care face pacientul să solicite asistenţă medicală când aceasta nu se mai ameliorează şi devine supărătoare. ...
Mecanismele şi managementul rezistenţei la diuretice
Creşterea incidenţei rezistenţei la diuretice poate fi cauzată de: necomplianţa pacientului, diagnosticul incorect, proprietăţile farmacocinetice ş...