The plants have been used since ancient times to prevent and treat diseases. To guarantee the safety, effectiveness and quality of herbal medicines products, European Union legislation regulates this authorization and placement on the market. Herbal medicines with traditional use may benefit from a simplified authorization procedure. This procedure is intended for herbal medicines with a long tradition of medical use, administered orally, externally and/or by inhalation, without the need for medical supervision. Some products may have a long tradition as medicinal products, but do not meet the conditions for authorization through the simplified authorization procedure. In order to protect public health, the basic conditions of the simplified registration procedure should be maintained.
Procedura de autorizare a medicamentelor din plante medicinale cu utilizare tradiţională
Authorization procedure for medicines from medicinal plants with traditional use
First published: 26 aprilie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.211.2.2023.7961
Abstract
Rezumat
Plantele sunt utilizate din cele mai vechi timpuri pentru prevenirea şi tratarea bolilor. Pentru a garanta siguranţa, eficacitatea şi calitatea medicamentelor pe bază de plante, legislaţia din Uniunea Europeană reglementează autorizarea şi punerea pe piaţă a acestora. Medicamentele din plante cu utilizare tradiţională pot beneficia de o procedură de autorizare simplificată. Această procedură este destinată medicamentelor pe bază de plante cu o tradiţie îndelungată de utilizare medicală, administrate pe cale orală, externă şi/sau prin inhalare, fără a fi necesară supravegherea unui medic. Unele produse pot avea o tradiţie îndelungată ca medicamente, dar nu îndeplinesc condiţiile de autorizare prin procedura simplificată. Pentru protejarea sănătăţii publice, ar trebui menţinute condiţiile fundamentale ale procedurii de înregistrare simplificate.
Introducere
Oamenii au utilizat plantele în scop medicinal din cele mai vechi timpuri. Descoperirile arheologice au arătat că sumerienii le foloseau cu 6000 de ani î.Hr., iar în Egipt, pe ziduri şi sarcofage, datând din 4000 î.Hr., s-au găsit imagini ale plantei Aloe vera, pe care egiptenii o numeau chiar „planta nemuririi”. Pe teritoriul ţării noastre, plantele ,,de leac” au un rol important, încă, în medicina populară.
Acum este dovedit ştiinţific faptul că unele plante conţin substanţe care pot fi utilizate în tratamentul bolilor. Medicamentele fabricate din aceste substanţe sunt cunoscute sub denumirea de „medicamente pe bază de plante”. Deşi conţin ingrediente naturale, unele dintre aceste produse pot fi dăunătoare pentru sănătate şi, de aceea, este necesar să fie reglementate de legislaţia farmaceutică, cu scopul de a proteja sănătatea publică prin garantarea siguranţei, eficacităţii şi calităţii medicamentelor.
Procedura simplificată de înregistrare clarifică diferenţele şi incertitudinile privind starea medicamentelor tradiţionale pe bază de plante şi facilitează libera circulaţie a acestor produse prin intermediul unor norme armonizate(1).
Se crede că o abordare mai restrictivă ar crea riscul ca produsele în cauză să sfârşească prin a fi comercializate sub o altă clasificare (nu ca medicamente, ci ca suplimente alimentare sau dispozitive medicale), fără controalele de calitate, siguranţă şi eficacitate necesare, aplicabile în legislaţia farmaceutică(2).
Medicamente pe bază de plante cu utilizare tradiţională
Medicamente, substanţe şi preparate din plante
Legislaţia comunitară defineşte medicamentul din plante ca fiind orice medicament care conţine ca ingrediente active exclusiv una sau mai multe substanţe din plante ori unul sau mai multe preparate din plante ori una sau mai multe astfel de substanţe din plante, în combinaţie cu unul sau mai multe astfel de preparate din plante(3).
Plantele, algele, ciupercile sau lichenii, întregi sau fragmentate, neprelucrate, de obicei uscate, dar şi unele exsudate care nu au fost supuse unui tratament specific sunt considerate substanţe din plante. Acestea sunt definite cu exactitate de partea din plantă folosită şi de denumirea botanică potrivit sistemului binomial (genul, specia, varietatea şi autorul)(3).
Preparatele din plante includ substanţe din plante mărunţite sau sub formă de pudră, tincturi, extracte, uleiuri esenţiale, sucuri stoarse şi exsudate prelucrate(3).
Criterii de eligibilitate
Având în vedere particularităţile medicamentelor pe bază de plante, în Agenţia Europeană a Medicamentului (EMA) a fost înfiinţat, în 2004, Comitetul pentru Medicamente din Plante (HMPC). Acesta se reuneşte în mod regulat şi înfiinţează, de asemenea, grupuri de lucru temporare şi elaborează un număr de documente orientative. Acestui comitet i-a fost atribuit rolul de a stabili monografiile medicamentelor tradiţionale pe bază de plante şi de a propune o listă de substanţe pe bază de plante care au fost utilizate ca medicamente de peste 30 de ani şi care, prin urmare, nu sunt considerate ca fiind dăunătoare în condiţii normale de utilizare(1).
În urma reuniunilor de lucru ale HMPC, se oferă publicităţii rapoarte vizând substanţele pe bază de plante propuse către HMPC pentru evaluare, monografiile nou intrate în listă şi declaraţiile publice pentru adoptarea finală, precum şi monografiile care sunt revizuite. Sunt evaluate datele din practica clinică pediatrică pentru utilizarea în siguranţă a substanţelor din plante la copii şi se urmăreşte întotdeauna îmbunătăţirea utilizării surselor de date, pentru a obţine evaluări relevante ale siguranţei produsului vizat.
Agenţia Naţională a Medicamentelor şi Dispozitivelor Medicale din România (ANMDMR) desemnează, pentru un mandat de trei ani, care poate fi reînnoit, un membru şi un înlocuitor în HMPC, aleşi în funcţie de rolul şi experienţa lor în evaluarea medicamentelor din plante(4).
Procedura de înregistrare este destinată medicamentelor pe bază de plante cu o tradiţie îndelungată de utilizare medicală, dar care nu îndeplinesc cerinţele de utilizare bine stabilite pentru autorizaţia de introducere pe piaţă, cum ar fi eficacitatea şi siguranţa dovedite prin studii ştiinţifice(1).
Pentru a beneficia de o autorizare prin procedura simplificată, medicamentul trebuie să îndeplinească, cumulativ, mai multe criterii: dovezi bibliografice sau expertize care să ateste că medicamentul în cauză sau produsul corespondent a fost utilizat în scopuri medicale pe parcursul unei perioade de cel puţin 30 de ani înainte de data cererii, incluzând cel puţin 15 ani în interiorul Comunităţii Europene; este destinat utilizării fără supravegherea unui medic, în scop de diagnosticare sau pentru prescrierea ori monitorizarea tratamentului; se administrează numai pe cale orală, externă şi/sau prin inhalare(4).
Medicamentul din plante poate conţine vitamine sau minerale a căror acţiune să fie auxiliară acţiunii ingredientelor active din plante, care priveşte indicaţia sau indicaţiile specificate.
În urma adoptării în 2010 a unui plan de acţiune(5) pentru medicamente pe bază de plante de către consiliul de administraţie al EMA, sunt publicate rapoarte periodice privind utilizarea sistemului de înregistrare a utilizării tradiţionale (TUR) în statele membre ale UE.
Conform ultimului raport din 31 decembrie 2016, autorităţile naţionale competente au furnizat numărul de autorizaţii pentru utilizare tradiţională acordat pentru medicamentele tradiţionale pe bază de plante (THMP), în conformitate cu art. 16a din Directiva 2001/83/CE (figurile 1 şi 3) şi privind autorizaţiile de introducere pe piaţă pentru medicamentele pe bază de plante (HMP) pe baza „utilizării bine stabilite” (WEU MA), conform art. 10a din Directiva 2001/83/CE (figurile 2 şi 4). Perioada de raportare este din 2004 până în decembrie 2016.
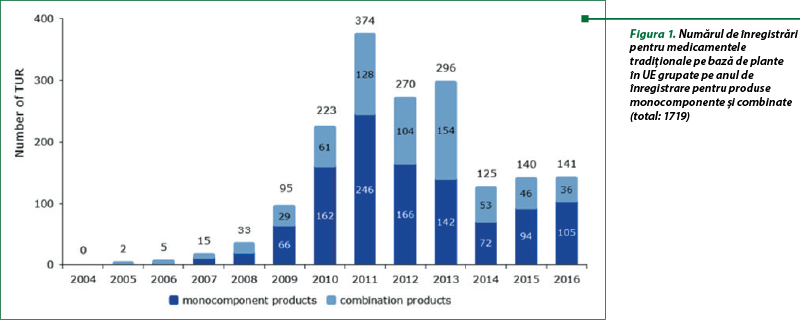
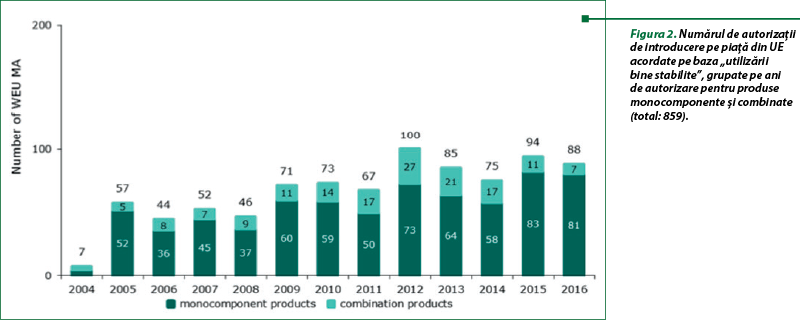
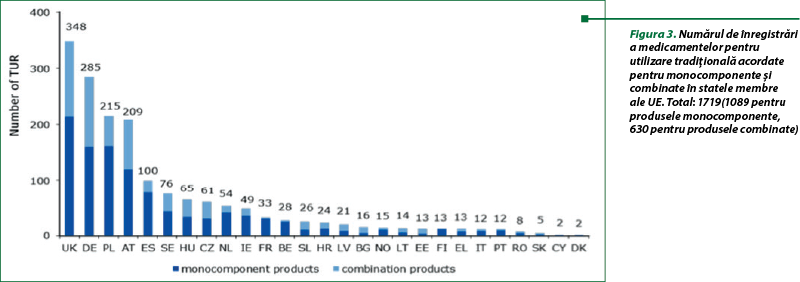
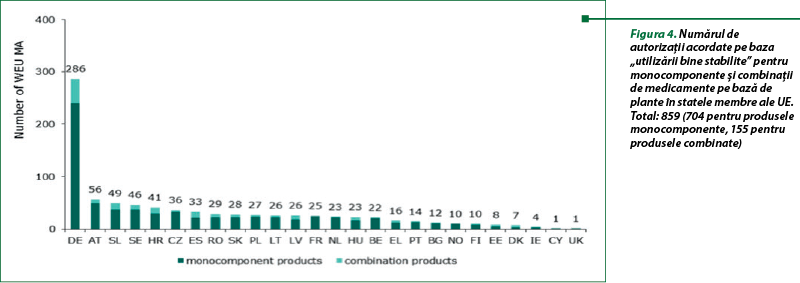
Procedura de autorizare simplificată
În România, această procedură de autorizare simplificată pentru medicamentele din plante cu utilizare tradiţională a fost reglementată prin Legea nr. 95/2006. Instituţia care se ocupă cu autorizarea medicamentelor în ţara noastră este ANMDMR.
Solicitantul, care trebuie să fie stabilit in România sau într-un stat membru UE, depune o cerere către ANMDMR, conţinând numele sau denumirea şi domiciliul ori sediul social ale solicitantului şi, unde este cazul, ale fabricantului, denumirea medicamentului, caracteristicile calitative şi cantitative ale tuturor constituenţilor, precum şi un document care să ateste faptul că fabricantul este autorizat să producă medicamente în ţara sa(4). Sunt descrise metoda de fabricaţie, indicaţiile terapeutice, contraindicaţiile şi reacţiile adverse, posologia, forma farmaceutică, modul şi calea de administrare şi perioada de valabilitate prezumată(4). Sunt prezentate măsurile de precauţie şi de siguranţă care trebuie luate pentru depozitarea medicamentului, administrarea sa la pacienţi şi eliminarea reziduurilor, precum şi indicarea potenţialelor riscuri pe care medicamentul le poate avea pentru mediu. Dacă solicitantul deţine o autorizaţie de punere pe piaţă (APP) obţinută într-un alt stat sau i-a fost refuzată APP în UE ori într-o ţară terţă, trebuie să notifice ANMDMR, precizând şi motivele care au dus la o decizie negativă(4).
Faptul că medicamentul respectiv sau un medicament corespondent a fost utilizat cel puţin 30 de ani înainte de data depunerii cererii, dintre care cel puţin 15 ani în UE, trebuie susţinut bibliografic sau prin opinia unui expert. Cerinţa de a demonstra utilizarea medicală pe o perioadă de 30 de ani este îndeplinită chiar şi atunci când produsul nu a fost comercializat pe baza unei autorizaţii specifice sau dacă numărul ori cantitatea ingredientelor medicamentului s-a redus în această perioadă(4).
Dacă medicamentul este eligibil pentru autorizare simplificată sub celelalte aspecte, dar nu îndeplineşte condiţia de utilizare de minimum 15 ani în UE, ANMDMR se adresează HMPC din cadrul EMA, trimiţând documentaţia pentru susţinerea procedurii de arbitraj. HMPC poate elabora o monografie comunitară, care trebuie să fie luată în considerare de către ANMDMR.
Dacă o cerere de autorizare se referă la o substanţă din plante, un preparat sau o combinaţie care se află pe lista elaborată de HMPC, nu este obligatoriu să fie furnizate date privind siguranţa, iar autoritatea competentă nu poate să solicite date suplimentare.
În cazul în care o substanţă vegetală, un preparat pe bază de plante sau o combinaţie a acestora nu mai este inclusă în lista elaborată de HMPC, autorizaţiile eliberate pentru medicamentele din plante conţinând această substanţă, preparate pe bază de plante sau combinaţie a acestora se retrag, dacă nu sunt trimise într-un interval de trei luni informaţii şi documente suplimentare, care să ateste siguranţa şi eficacitatea produsului(4).
ANMDMR poate refuza autorizarea pentru utilizare tradiţională dacă se constată o neconcordanţă între compoziţia calitativă şi cantitativă declarată şi cea reală, indicaţiile nu sunt conforme cu condiţiile prevăzute de lege sau produsul poate fi dăunător în condiţii normale de utilizare. De asemenea, dacă, ţinând cont de vechimea utilizării şi de experienţă, efectele farmacologice sau eficacitatea nu sunt plauzibile, datele referitoare la utilizarea tradiţională sunt insuficiente sau nu se demonstrează calitatea farmaceutică, cererea de autorizare simplificată va fi refuzată(4). Orice decizie de respingere şi motivaţia trebuie comunicate solicitantului, Comisiei Europene şi oricărei autorităţi competente care solicită aceasta.
Pe ambalajul şi prospectul unui medicament din plante medicinale cu utilizare tradiţională, care se foloseşte pentru indicaţia specificată, exclusiv pe baza utilizării îndelungate, trebuie specificat foarte clar, cu recomandarea de a cere sfatul medicului sau al farmacistului în cazul în care simptomele persistă în timpul utilizării medicamentului ori dacă apar reacţii adverse care nu sunt menţionate în prospect(4).
Medicamente din plante cu utilizare tradiţională aflate pe piaţa din România
Prin Directiva 2004/24/CE s-a acordat o perioadă de tranziţie de şapte ani pentru înregistrarea medicamentelor tradiţionale din plante care se aflau deja pe piaţă la data intrării în vigoare a directivei. Medicamentele tradiţionale din plante care se aflau pe piaţă în mod legal înainte de 30 aprilie 2004 au primit permisiunea de a rămâne pe piaţă până la finalul perioadei de tranziţie, 30 aprilie 2011. Autorităţile naţionale sunt cele care au competenţa şi responsabilitatea de a decide, de la caz la caz, dacă un produs din plante respectă definiţia medicamentului, adică poate fi folosit pentru prevenirea sau tratarea bolilor(6).
Cu toate că procedura de autorizare simplificată este o procedură de înregistrare mai rapidă, mai simplă şi mai puţin costisitoare, care facilitează introducerea pe piaţă a medicamentelor tradiţionale din plante pentru toate societăţile comerciale, inclusiv pentru întreprinderi mici şi mijlocii(6), pe parcursul ultimilor ani nu s-au înregistrat foarte multe medicamente prin această procedură. Mulţi producători au preferat să autorizeze produsele ca suplimente alimentare şi dispozitive medicale.
Printre medicamentele cu utilizare tradiţională, aflate pe piaţa farmaceutică românească, se numără siropul antitusiv Herbion®, cu extract de lichen de piatră (Cetraria islandica (L.) Acharius s.l., tallus), Bronchostop® gumă orală sau sirop, conţinând extract uscat din părţile aeriene de Thymus vulgaris L. şi Thymus zygis L. (cimbru), şi extract din rădăcina de Althaea officinalis L. (rădăcina de nalbă), sau Persen®, cu extracte uscate de valeriană, melisă şi mentă. Pe prospectele acestora se precizează că sunt medicamente din plante medicinale cu utilizare tradiţională şi se folosesc pentru indicaţia specificată exclusiv pe baza utilizării îndelungate.
Produse cu utilizare tradiţională care nu pot fi autorizate prin procedura simplificată
Situaţia unor forme de medicină tradiţională
Domeniul de aplicare a Directivei 2004/24/CE a fost limitat, în mod deliberat, la medicamentele tradiţionale din plante. Alte produse pot avea o tradiţie îndelungată ca medicamente, dar nu îndeplinesc condiţiile pentru o autorizare integrală de introducere pe piaţă sau pentru o autorizare pe baza utilizării consacrate.
Medicina antropozofică este practicată în Germania, Ţările de Jos, Regatul Unit, Italia, Spania, Polonia şi Franţa, printre altele, încă din 1920. Aceasta urmează o abordare terapeutică globală, care se referă la individ ca la un întreg, luând în considerare atât personalitatea, cât şi corpul. Produsele antropozofice sunt concepute pentru a stimula puterile de autovindecare ale pacientului şi folosesc materii prime de origine minerală, vegetală, animală sau metalice şi pot fi utilizate sub orice formă de dozare sau administrare, inclusiv pe cale parenterală(2).
Medicamentele ayurvedice conţin ingrediente de origine vegetală, animală sau minerală, iar substanţele conţinute în produse sunt descrise în monografiile farmacopeii ayurvedice. Tradiţia ayurvedică nu face o distincţie specifică în ceea ce priveşte clasificarea juridică (pe bază de reţetă medicală sau nu) a produselor. În mod caracteristic, ele sunt prescrise de specialişti în urma examinării şi diagnosticării pacientului, iar administrarea lor este urmărită de-a lungul utilizării, în general în centre medicale(2).
Medicamentele tradiţionale chineze pot, de asemenea, să se prezinte sub formă de injecţii şi sunt adesea produse combinate pe bază de plante, dar pot, totodată, să conţină ingrediente animale, minerale şi metalice(2).
Motivele refuzării autorizării prin procedura simplificată
Unele produse tradiţionale pot include componente minerale, produse animale sau produse metalice, dar medicamentele tradiţionale din plante trebuie să fie compuse exclusiv din preparate sau substanţe din plante, cu excepţia vitaminelor şi a mineralelor, care au o acţiune complementară(2).
Medicamentele tradiţionale din plante trebuie administrate oral, extern sau prin inhalare. Conform declaraţiei publice a HMPC privind interpretarea termenului „uz extern” spre a fi folosit în domeniul medicamentelor tradiţionale din plante, acesta semnifică, în principal, aplicarea pe piele, dar include şi utilizarea locală, orală, nazală, rectală, vaginală, oculară sau auriculară. Medicamentele din alte tradiţii pot fi administrate şi prin injectare(2).
Înregistrarea simplificată nu necesită studii clinice referitoare la siguranţă şi eficacitate, fiind o procedură mai simplă prin comparaţie cu procedura de autorizare de introducere pe piaţă, de aceea pare oportun să se limiteze domeniul de aplicare al înregistrării simplificate la produsele care vizează boli minore, care pot fi tratate fără intervenţia unui specialist(2).
HMPC consideră că întotdeauna ar trebui să fie evaluat potenţialul genotoxic al preparatelor din plante şi să se efectueze teste suplimentare. Se pare că cererea sistematică de date privind genotoxicitatea a contribuit la numărul relativ mic de cereri de autorizare, deoarece sunt disponibile puţine date referitoare la acest aspect(2).
Condiţia utilizării tradiţionale timp de cel puţin 15 ani în UE a fost introdusă deoarece s-a considerat că este mai dificil să se colecteze informaţii referitoare la utilizarea tradiţională a unui produs din alte părţi ale lumii, în special date referitoare la siguranţă, deoarece sistemele de farmacovigilenţă diferă considerabil, în întreaga lume. Totuşi ,utilizarea în Comunitatea Europeană poate fi acceptată chiar dacă această utilizare a fost făcută fără înregistrare sau autorizare ca medicament.
Produsele cu o tradiţie îndelungată în UE, cum ar fi mierea, lăptişorul de matcă, propolisul, uleiurile de peşte, mineralele sau microorganismele, nu sunt eligibile pentru procedura de înregistrare simplificată, în vederea comercializării lor ca medicamente tradiţionale(2), aşa că sunt comercializate ca suplimente alimentare.
Concluzii
Procedura de autorizare simplificată elimină diferenţele între statele membre în ceea ce priveşte clasificarea şi comercializarea medicamentelor din plante, pentru a asigura protecţia sănătăţii publice, prin evaluarea, în cursul procedurii de înregistrare simplificate, a calităţii, siguranţei şi eficacităţii produselor în cauză.
Sistemele de medicină alternativă existente de secole în alte părţi ale lumii au remediile lor specifice, iar unele dintre aceste remedii ar putea îndeplini condiţiile de încadrare ca medicamente tradiţionale din plante. Cu toate acestea, ar trebui menţinute condiţiile fundamentale ale procedurii de înregistrare simplificate, bazate pe analize din domeniul sănătăţii publice, cum ar fi limitarea la produsele având 15 ani de utilizare în Comunitatea Europeană, la anumite căi de administrare şi la produse care nu au nevoie de supravegherea unui medic.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
https://ec.europa.eu/health/human-use/herbal-medicines_en
-
Comisia Comunităţilor Europene, Comunicare a Comisiei către Consiliu şi Parlamentul european privind Raportul referitor la experienţa dobândită ca urmare a aplicării dispoziţiilor capitolului 2a din Directiva 2001/83/CE, astfel cum a fost modificată prin Directiva 2004/24/CE, asupra dispoziţiilor specifice aplicabile medicamentelor tradiţionale din plante (Document pe baza articolului 16i din Directiva 2001/83/CE) Bruxelles, 29.9.2008, disponibil la https://eur-lex.europa.eu/legal-content/RO/TXT/?qid=1553416348264
-
Directiva 2004/24/CE a Parlamentului European şi a Consiliului din 31 martie 2004 de modificare, în ceea ce priveşte medicamentele tradiţionale din plante, a Directivei 2001/83/CE de instituire a unui cod comunitar cu privire la medicamentele de uz uman. Jurnalul Oficial al Uniunii Europene L 136 din 30.4.2004.
-
Legea nr. 95/2006 privind reforma în domeniul sănătăţii, republicată în Monitorul Oficial al Romaniei, Partea I nr. 652 din 28 august 2015, cu modificările şi completările ulterioare.
-
European Medicines Agency, Action Plan for Herbal Medicines 2010-2011, EMA/831327/2009 Patient Health Protection, 11 June 2010.
-
http://europa.eu/rapid/press-release_MEMO-11-71_ro.htm