Introduction. Isthmocele is a a defect of the anterior wall of the uterine isthmus located at the site of a previous cesarean delivery scar. Although in the last two decades the number of caesareans is globally on an ascending trend and the incidence of isthmocele is directly proportional increasing, the effects of this condition are insufficiently known and debated. Material and method. This paper presents an analysis of the isthmocele consequences based on literature review. Results. Isthmocele represents a vicious scarring of the uterine wall that leads to anatomical distortion of the uterus. Isthmocele can cause abnormal uterine bleeding, chronic pelvic pain and secondary infertility. The obstetrical consequences are abnormal insertion of the placenta and uterine scar pregnancy. Conclusion. Isthmocele incidence is increasing and frequently underdiagnosed. Isthmocele causes uterine distortion, thereby affecting the quality of life of the patients and serious complications in future pregnancies. Minimally invasive surgery is recommended for preventing and improving complications determined by isthmocele.
Istmocelul - complicaţie a naşterii prin operaţie cezariană
Isthmocele - complication of caesarean section deliveries
First published: 15 aprilie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Introducere. Istmocelul reprezintă un defect al peretelui anterior al istmului uterin şi este localizat la nivelul cicatricei uterine apărute în urma naşterii prin operaţie cezariană. Cu toate că numărul cezarienelor se află pe un trend ascendent la nivel global în ultimele două decenii şi că incidenţa istmocelului are o creştere direct proporţională, efectele acestei patologii sunt insuficient cunoscute şi dezbătute. Material şi metodă. Lucrarea prezintă o analiză a consecinţelor determinate de prezenţa istmocelului bazată pe revizuirea literaturii de specialitate. Rezultate. Prezenţa istmocelului traduce cicatrizarea vicioasă a peretelui uterin care conduce la modificarea anatomiei uterului. Istmocelul poate determina apariţia menomentroragiilor, a durerii pelviene cronice şi a infertilităţii secundare. Consecinţele de natură obstetricală sunt reprezentate de inserţia anormală a placentei şi de sarcina implantată la nivelul cicatricei uterine. Concluzii. Incidenţa istmocelului este în creştere şi în multe cazuri subdiagnosticat. Istmocelul determină modificarea arhitecturii uterine, conducând astfel la afectarea calităţii vieţii pacientelor şi la complicaţii grave în cazul sarcinilor viitoare. Chirurgia minim-invazivă este recomandată pentru prevenirea şi ameliorarea patologiei determinate de prezenţa istmocelului.
Introducere
Numărul cezarienelor se află pe un trend ascendent la nivel global în ultimele trei decenii. Incidenţa operaţiei cezariene în ţările dezvoltate variază între 6,2% şi 36%, valoarea medie fiind de 21,1%(1). În Statele Unite ale Americii, incidenţa cezarienei în 1970 a fost de 5,5%, a crescut până la 24,7% în 1988 şi a înregistrat o scădere uşoară până la 20,7% în 1996(2-4). Între 2002 şi 2006, procentul naşterilor prin operaţie cezariană din SUA s-a majorat până la 30,5%(5), ajungând în 2007 la 31,8%(6). În România, incidenţa cezarienei a cunoscut o creştere constantă, de la 4,72% în 1988 la 12,39% în 1998(7) şi 35% în 2011.
Ruptura uterină, placenta praevia, aderenţa anormală a placentei la o sarcină viitoare şi sarcina implantată la nivelul cicatricei post-cezariană reprezintă complicaţii pe termen lung cunoscute ale cezarienei şi au fost tratate pe larg în literatura de specialitate(8,9).
În 1995, Morris a demonstrat pentru prima dată, analizând piesele de histerectomie, existenţa unei cicatrice la nivelul inciziei din operaţia cezariană şi a raportat o serie de manifestări patologice asociate cu aceasta(10). Prezenţa unui defect de cicatrizare la nivelul tranşei de histerotomie asociate cezarienei a fost descrisă ulterior şi de alţi autori(11-14): Monteagudo şi colab. au utilizat termenul de „nişă”(11), Gubbini şi colab. l-au denumit „istmocel”(22), pe când Regnard şi colab. l-au descris ca „dehiscenţă”(14). Istmocelul reprezintă un defect al peretelui anterior al istmului uterin şi este localizat la nivelul cicatricei uterine apărute în urma naşterii prin operaţie cezariană. Incidenţa istmocelului variază între 24% şi 84%(15), în funcţie de autor; incidenţa variabilă a diferitelor studii se datorează faptului că nu există criterii standard de diagnostic. Cu toate că istmocelul poate fi asimptomatic, prezenţa lui poate determina consecinţe ginecologice şi obstetricale care afectează calitatea vieţii pacientelor.
Cu toate că incidenţa istmocelului are o creştere direct proporţională cu numărul cezarienelor, etiologia şi efectele acestei patologii sunt incomplet elucidate. De asemenea, nu există la nivel mondial criterii standard de diagnostic şi tratament al istmocelului.
Lucrarea îşi propune o analiză a etiopatogenezei, a diagnosticului, a consecinţelor şi tratamentului istmocelului bazată pe analiza literaturii de specialitate.
Etiopatogeneza istmocelului
Istmocelul presupune o lipsă de substanţă miometrială la nivelul cicatricei rezultate în urma unei cezariene anterioare, care va determina distorsionarea anatomiei segmentului uterin inferior(10). Cezariana este cea mai comună intervenţie chirurgicală la nivelul uterului în cazul femeilor de vârstă fertilă(16), modalitatea de abord cea mai frecventă fiind incizia transversală joasă la nivelul segmentului inferior(17).
Formarea segmentului uterin inferior şi localizarea inciziei la nivelul uterului au fost incriminate în patogeneza istmocelului. Vikhareva Osser şi colab. consideră că prezentaţia angajată a mobilului fetal, dilataţia cervicală ≥5 cm sau durata travaliului ≥5 ore constituie factori de risc pentru dezvoltarea istmocelului(18). Un alt studiu raportează concluzii contradictorii conform cărora riscul apariţiei unei nişe la nivelul uterului este invers proporţional cu dilataţia cervicală(19). Cezariana de urgenţă şi prezenţa travaliului nu sunt considerate factori de risc pentru formarea istmocelului(19,20).
Tehnica de histerorafie a fost îndelung studiată în relaţie cu dezvoltarea istmocelului. Datorită diferenţei de contractibilitate miometrială de fiecare parte a inciziei, marginea superioară a tranşei uterine este în mod tipic mai groasă decât marginea inferioară. Reaproximarea defectuoasă a tranşei uterine cu margini de grosimi diferite conduce la apariţia unei nişe la nivelul peretelui uterin anterior. Studiul condus de Yazicioglu şi colab. a raportat o incidenţă mai scăzută a istmocelului la pacientele la care histerorafia s-a realizat în toată grosimea miometrului (incluzând stratul endometrial) în comparaţie cu pacientele la care s-a practicat sutura parţială a miometrului (excluzând endometrul)(19). Tehnica de sutură a uterului într-un singur strat miometrial fără includerea endometrului comportă un risc crescut de apariţie a nişei uterine faţă de sutura în două straturi miometriale sau într-un singur strat miometrial cu includerea endometrului(18,20).
Un studiu recent, publicat de Bennich şi colab. în 2016, şi-a propus să investigheze grosimea miometrului rezidual pe termen scurt (la externare) şi lung (la 5 luni postoperator) după histerorafia efectuată prin două tehnici - sutură cu fir continuu neîmpiedicat (de tip „surjet”) într-un singur strat versus sutură cu fir continuu neîmpiedicat în două straturi; ambele tipuri de suturi au cuprins întreaga grosime a miometrului, inclusiv stratul decidual(41). Rezultatele cercetării au arătat că miometrul rezidual are o grosime similară în ambele grupuri de studiu, atât la externare, cât şi la 5 luni după cezariană şi reprezintă aproximativ 50% din miometrul normal. Autorii sugerează că histerorafia în dublu strat nu creşte grosimea miometrului rezidual faţă de sutura monostrat, în cazul utilizării suturilor cu fir continuu neîntrerupt(41).
Numărul naşterilor prin cezariană influenţează în mod direct apariţia defectelor la nivelul peretelui uterin anterior; grosimea miometrului la nivelul istmului uterin scade şi prevalenţa istmocelului creşte cu numărul operaţiilor cezariene(20,21).
Retroflexia uterină contribuie la creşterea riscului de apariţie a istmocelului prin afectarea cicatrizării tranşei uterine. Pacientele cu retroflexie uterină au un risc de două ori mai mare de a dezvolta o cicatrice uterină vicioasă faţă de pacientele cu anteflexie uterină(20). Deoarece punctul de flexie al uterului este situat la nivelul orificiului cervical intern, segmentul inferior al uterului retroflex suportă un anumit grad de tensiune. Tracţiunea exercitată la nivelul tranşei uterine, coroborată cu perfuzia tisulară redusă la nivelul segmentului inferior, care determină reducerea producţiei de colagen, poate compromite vindecarea cicatricei uterine(20).
Simptomatologia istmocelului
Istmocelul se asociază cu modificări anatomice şi funcţionale ale uterului, cum ar fi distorsiunea şi lărgirea segmentului uterin inferior, tapetarea cicatricei cu ţesut endometrial congestiv, prezenţa infiltratului limfocitar, a capilarelor dilatate şi a hematiilor libere în stroma endometrială de la nivelul nişei uterine(22). Aceste modificări ale arhitecturii uterine post-operaţie cezariană contribuie la apariţia sângerărilor uterine anormale postmenstruale, a durerii pelviene cronice şi a infertilităţii secundare. Studiul publicat de Wang şi colab. în 2009 raportează, în cazul pacientelor cu istmocel, prezenţa dismenoreei în 53,1% din cazuri, a durerii pelviene cronice în 36,9% din cazuri şi a dispareuniei în 18,3% din cazuri(23).
Cercetarea condusă de Bij de Vaate şi colab. evidenţiază prezenţa spotting-ului postmenstrual la 34% din pacientele diagnosticate cu istmocel(12). Menada Valenzano şi colab. nu au identificat o asociere între prezenţa istmocelului şi sângerările uterine anormale (postmenstruale sau fără legătură cu menstruaţia); în schimb, acest studiu raportează o asociere între spotting-ul postmenstrual şi prezenţa unei cicatrice uterine de la o cezariană anterioară(24). Din cauza fibrozei din jurul cicatricei, care reduce contractibilitatea uterului, istmocelul poate încetini fluxul menstrual, prin acumularea sângelui la nivelul nişei uterine(10,22,25). Pe de altă parte, Morris sugerează prezenţa unei hemoragii la locul cicatricei uterine prin evidenţierea histologică a unor semne de hemoragie recentă în stroma din jurul nişei(10). Un lichid vâscos care nu este drenat în totalitate a fost descris la nivelul istmocelului(10,22). Oricare ar fi sursa sângelui de la nivelul istmocelului, persistenţa acestuia după menstruaţie, asociată cu secreţie locală mucoasă crescută datorată vascularizaţiei anormale, contribuie la apariţia sângerărilor uterine anormale postmenstruale. Sângerările uterine anormale se caracterizează prin eliminarea după menstruaţie, timp de câteva zile, a unei secreţii hematice de culoare închisă acumulată la nivelul istmocelului (care prin caracteristicile lui reduce fluxul menstrual).
Pe lângă contractibilitatea deficitară a miometrului din jurul cicatricei, mărimea nişei uterine contribuie la sângerările uterine anormale postmenstruale. Un volum mai mare al istmocelului a fost evidenţiat la pacientele cu spotting postmenstrual(12). Anumite studii au constatat că nişa uterină este semnificativ mai extinsă la pacientele cu spotting postmenstrual, dismenoree şi durere pelviană cronică şi că prevalenţa menometroragiilor şi a spotting-ului creşte direct proporţional cu diametrul istmocelului(23,26).
Mai multe cercetări au comunicat o asociere semnificativă statistic între istmocel şi infertilitatea secundară(13,22,27). Prezenţa istmocelului determină infertilitate secundară prin mai multe mecanisme: reducerea calităţii mucusului cervical prin persistenţa sângelui menstrual la nivelul cervixului, obstrucţionarea ascensiunii spermatozoizilor prin canalul cervical, afectarea calităţii spermei şi a procesului de implantare a embrionului(13). Istmocelul se caracterizează prin prezenţa unei vascularizaţii anormale, acoperită de o mucoasă fină care conduce la acumularea sângelui menstrual la nivelul nişei uterine. Contractibilitatea deficitară a miometrului adiacent cicatricei este un alt factor care împiedică eliminarea sângelui menstrual(27). Retenţia sângelui menstrual în cavitatea uterină asociată cu dehiscenţa cicatricei creează un mediu toxic, impropriu pentru implantarea embrionului, determinând astfel infertilitatea secundară(28).
Diagnosticul istmocelului
Istmocelul este de multe ori diagnosticat întâmplător la pacientele care se adresează medicului pentru sângerări uterine anormale postmenstruale, dismenoree, dispareunie sau dureri cronice pelviene. Integritatea peretelui uterin anterior se evaluează prin intermediul mai multor investigaţii paraclinice, care permit vizualizarea formei şi dimensiunilor defectului de la nivelul cicatricei post-cezariană.
Ultrasonografia transvaginală reprezintă investigaţia principală care stabileşte prezenţa istmocelului(13,21,29,30). O altă metodă ecografică introdusă mai recent utilizată în diagnosticul istmocelului este sonohisterografia(12,24,27,31). Momentul optim de diagnostic este în timpul menstruaţiei sau la câteva zile postmenstrual(13). Istmocelul se evidenţiază ca o suprafaţă aneocogenă de forma unui triunghi isoscel, cu vârful orientat către peretele anterior al istmului uterin şi baza către peretele posterior al canalului cervical. Ultrasonografia transvaginală este o investigaţie noninvazivă, ieftină şi uşor accesibilă care trebuie considerată ca primă alegere în diagnosticul istmocelului, deoarece este confirmată în procent de 100% de histeroscopie(13).
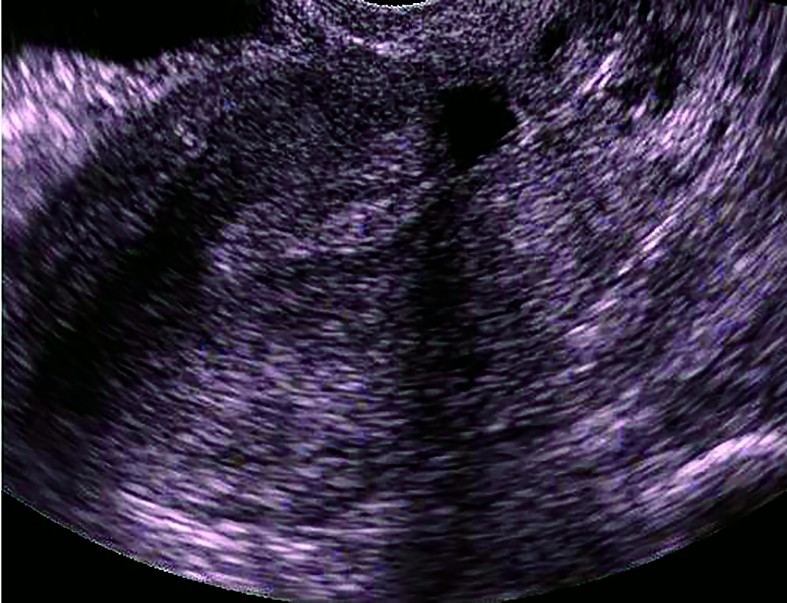
Cu toate că cel mai frecvent este descris sub forma unei zone anecogene triunghiulare(13,29,30), istmocelul se poate identifica şi sub alte forme. Vikhareva Osser şi colab. au raportat că 83% din nişele uterine au formă triunghiulară, 4% au formă ovală, 2% au formă rotundă şi 10% nu mai au miometru restant deasupra defectului(30), forma menţinându-se atât la ecografia transvaginală, cât şi la sonohisterografie(31). Utilizând sonohisterografia, Bij de Vaate şi colab. au identificat 50% din nişe de formă semicirculară, 32% de formă triunghiulară, 10% în formă de picătură şi 7% în forma unui chist de incluziune(12).
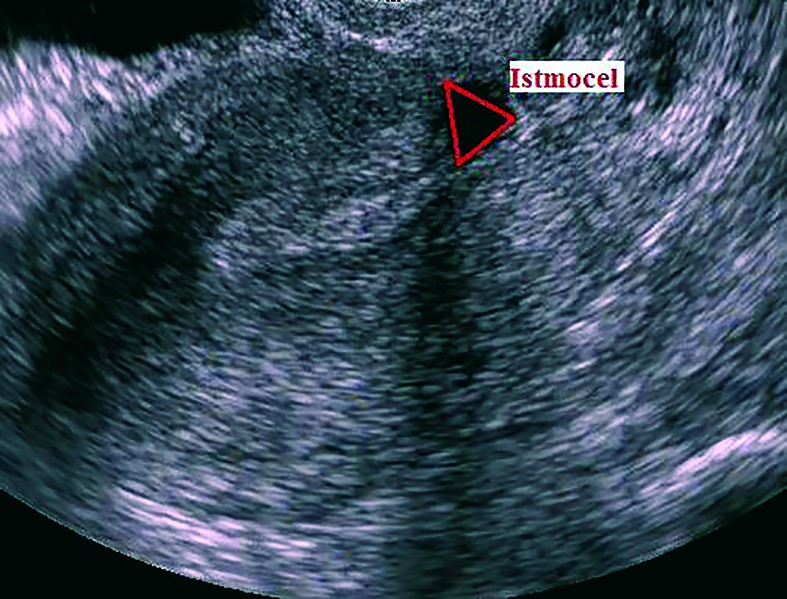
În prezent nu există un consens cu privire la clasificarea istmocelului în funcţie de dimensiunea lui. Vikhareva Osser şi colab. definesc istmocelul de mari dimensiuni dacă grosimea miometrului anterior restant este ≤2mm la examinarea ecografică transvaginală sau dacă este ≤2,5 mm la sonohisterografie(31). Alţi autori definesc istmocelul de mari dimensiuni atunci când nişa uterină cuprinde 50%(21) sau 80%(14) din miometrul anterior. Istmocelul total este definit când nu mai există miometru anterior restant care să acopere defectul uterin(30). Având în vedere că istmocelul are cel mai frecvent forma unui triunghi isoscel, Gubbini şi colab. propun o clasificare în 3 grade, bazată pe suprafaţa istmocelului calculată după formula: baza x înălţimea/2; astfel, istmocelul se clasifică în 3 grade: gradul 1 - mai puţin de 15 mm2, gradul 2 - între 16 şi 25 mm2, gradul 3 - mai mult de 25 mm2(22).
O metodă de diagnostic al istmocelului mai puţin utilizată este histerosalpingografia, care evidenţiază prezenţa unui diverticul la nivelul istmului uterin la pacientele cu istoric de operaţie cezariană. Din cauza acumulării de sânge şi mucus la nivelul cicatricei uterine, histerosalpingografia nu permite documentarea exactă a defectului uterin(32). O limitare importantă a histerosalpingografiei este reprezentată de imposibilitatea cuantificării exacte a defectului uterin şi a miometrului restant, măsurători care sunt uşor realizabile prin ecografie transvaginală sau sonohisterografie.
Histeroscopia reprezintă atât o metodă diagnostică(13,33,34), cât şi terapeutică a istmocelului. Histeroscopia diagnostică permite vizualizarea directă a istmocelului şi evidenţiază un defect anatomic sub formă de „buzunar” la nivelul peretelui anterior al istmului uterin, în treimea superioară a canalului cervical şi uneori în treimea medie sau inferioară a cervixului. Localizarea istmocelului depinde de incizia iniţială pentru realizarea histerotomiei în timpul cezarienei; în cazul cezarienelor elective, defectul se localizează în porţiunea superioară a cervixului, iar în cazul cezarienelor de urgenţă efectuate în travaliu, istmocelul este localizat în partea inferioară a canalului cervical(22,35).
Imagistica prin rezonanţă magnetică (IRM) s-a dovedit a fi investigaţia imagistică cea mai exactă care permite evaluarea cicatricei post-operaţie cezariană(36). Cu toate că este o investigaţie mai scumpă şi uneori greu accesibilă, IRM are avantajul unei rezoluţii superioare care permite vizualizarea detaliată a planurilor tisulare, astfel încât forma şi dimensiunile istmocelului pot fi optim cuantificate. IRM permite efectuarea diagnosticului diferenţial între hemoragie, hematom şi alte colecţii lichidiene sau mase tumorale.
Tratamentul istmocelului
Tratamentul istmocelului se impune în cazul apariţiei simptomatologiei sau a infertilităţii secundare. Pacientele care nu doresc să procreeze pot fi tratate conservativ prin administrarea de contraceptive orale monofazice sau radical prin histerectomie totală. În cazul pacientelor cu infertilitate secundară care doresc o nouă sarcină, tratamentul chirurgical este de primă alegere şi implică excizia ţesutului inflamat de la nivelul defectului uterin, intervenţie care ameliorează şi simptomatologia clinică.
O metodă interesantă de tratament conservativ al istmocelului este cea propusă de Ida şi colab.(37). Aceştia au prezentat în 2014 cazul unei paciente cu 4 naşteri (ultimele două fiind prin operaţie cezariană), care s-a prezentat la 9 luni după a doua cezariană cu sângerări uterine prelungite postmenstruale şi la care s-a identificat prezenţa unui istmocel prin ecografie transvaginală. Metoda terapeutică instituită a constat în lavajul cavităţii uterine cu soluţie salină (ser fiziologic), cu scopul de a elimina sângele şi cheagurile acumulate la nivelul defectului uterin. La prima şedinţă de lavaj, care s-a realizat prin sonohisterografie, soluţia salină a părăsit cavitatea uterină prin defectul peretelui anterior, ajungând în spaţiul vezico-uterin. După trei cure de lavaj cu soluţie salină s-a constatat vindecarea spontană a miometrului dehiscent demonstrată prin obliterarea traiectului fistulos(37).
Scopul tratamentului chirurgical conservativ este de a corecta defectul de la nivelul cicatricei uterine, printr-o intervenţie denumită istmoplastie(22). Istmoplastia se poate realiza prin mai multe proceduri chirurgicale: tehnica clasică prin laparotomie, istmoplastia laparoscopică(38), istmoplastia pe cale vaginală sau procedeu combinat laparoscopic-vaginal(39), tehnica laparoscopică prin chirurgie robotică(40) şi istmoplastia histeroscopică(22,25,35).
Rezultatele pe termen scurt şi lung asociate istmoplastiei histeroscopice, precum şi faptul că este o intervenţie minim-invazivă impun histeroscopia ca primă opţiune terapeutică. Istmoplastia histeroscopică presupune rezecţia marginilor inferioare şi superioare ale defectului uterin, cu excizia completă a ţesutului cicatriceal până la miometru indemn. Odată îndepărtate marginile nişei, se obţine refacerea continuităţii peretelui uterin anterior. Electrocauterizarea zonei fundice a nişei uterine cu ajutorul unui electrod în formă de bilă permite ablaţia ţesutului inflamator, a vaselor de sânge dilatate şi a ţesutului endometrial.
Studiul publicat de Gubbini analizează rezultatul tratamentului histeroscopic la 41 de paciente diagnosticate cu istmocel post-operaţie cezariană(35). Simptomatologia pacientelor a fost reprezentată de infertilitate secundară, sângerări uterine anormale postmenstruale şi durere pelviană cronică. Înaintea efectuării intervenţiei au fost excluse alte cauze de infertilitate de origine feminină sau masculină. S-a realizat corecţia defectului peretelui uterin anterior pe cale histeroscopică, care a avut o rată de succes de 100%.
Istmoplastia histeroscopică a avut drept consecinţă rezoluţia completă a sângerărilor uterine anormale postmenstruale şi a durerii pelviene cronice. Toate cele 41 de paciente au obţinut o sarcină pe cale naturală între 12 şi 24 de luni după corecţia histeroscopică a istmocelului(35). Examinarea histopatologică a ţesuturilor excizate a evidenţiat prezenţa infiltratului inflamator, a fibrozei, a ţesuturilor necrozate şi a focarelor de endometrioză(35), rezultate asemănătoare fiind raportate şi de alţi autori(22,25); ulterior, aceste ţesuturi au fost înlocuite de mucoasă endocervicală cu epiteliu cubic monostratificat(35). Rezultatele histopatologice obţinute pre- şi postoperator susţin că patogeneza infertilităţii secundare asociată istmocelului se datorează şi prezenţei ţesutului inflamator care împiedică procesul de implantare(35).
În mod justificat, se ridică problema creşterii riscului de ruptură uterină după corecţia histeroscopică a istmocelului. Examinarea histopatologică a ţesuturilor a evidenţiat că rezecţia histeroscopică nu reduce grosimea peretelui uterin, deoarece piesele excizate au conţinut ţesut fibrotic şi inflamator, fără miometru sănătos, iar suprafaţa tratată a fost înlocuită cu epiteliu cubic monostratificat(35).
Concluzii
Pe măsură ce rata operaţiilor cezariene creşte, morbiditatea asociată istmocelului va cunoaşte o creştere proporţională, afectând consecutiv calitatea vieţii pacientelor. Istmocelul este o cauză de apariţie a sângerărilor uterine anormale, a durerii cronice pelviene şi a infertilităţii secundare şi trebuie suspectat la pacientele care au născut prin operaţie cezariană, mai ales la cele cu uter retroflex şi cezariene multiple. Fiind o patologie relativ nouă şi incomplet elucidată, istmocelul este frecvent subdiagnosticat, iar aplicarea tratamentului optim este întârziată.
Pentru identificarea şi tratamentul corect al istmocelului se impune identificarea factorilor de risc, adoptarea unei definiţii unanim acceptate, stabilirea unor criterii comune de diagnostic, precum şi stabilirea unor metode terapeutice standardizate.
Corecţia histeroscopică a istmocelului este asociată cu dispariţia sângerărilor uterine anormale postmenstruale, a durerii pelviene cronice şi a infertilităţii secundare, motiv pentru care considerăm că ar trebui să reprezinte prima opţiune de tratament al acestei patologii.
Bibliografie
2. Menard MK. Cesarean delivery rates in the United States. The 1990s. Obstet Gynecol Clin North Am 1999; 26:275-86.
3. Hibbard LT. Changing trends in cesarean section. Am J Obstet Gynecol 1976; 125:798-804.
4. Placek PJ, Taffel SM. Trends in cesarean section rates for the United States, 1970-78. Health Rep 1980; 95:540-8.
5. Zhang J, Troendle J, Reddy UM, et al. Contemporary cesarean delivery practice in the United States. Am J Obstet Gynecol 2010; 203:326e1-10.
6. Menacker F, Hamilton BE. Recent trends in cesarean delivery in the United States. NCHS Data Brief 2010:18.
7. Munteanu I (2006). Tratat de Obstetrică, ediţia a II-a, volumul I. Bucureşti: Editura Academiei Române.
8. Diaz SD, Jones JE, Seryakov M, Mann WJ. Uterine rupture and dehiscence: ten-year review and case–control study. South Med J 2002; 95: 431–435.
9. Clark SL, Koonings PP, Phelan JP. Placenta previa/accreta and prior Cesarean section. Obstet Gynecol 1985; 66: 89–92.
10. Morris H., Surgical pathology of the lower uterine segment caesarean section scar: is the scar a source of clinical symptoms? International Journal of Gynecological Pathology, vol. 14, no. 1, pp. 16–20, 1995.
11.A. Monteagudo, C. Carreno, and I. E. Timor-Tritsch, “Saline infusion sonohysterography in nonpregnant women with previous cesarean delivery: the “niche” in the scar,” Journal of Ultrasound in Medicine, vol. 20, no. 10, pp. 1105–1115, 2001.
12. Bij de Vaate AJ, Brolmann HA, van der Voet LF, van der Slikke JW, Veersema S, Huirne JA. Ultrasound evaluation of the Cesarean scar: relation between a niche and postmenstrual spotting. Ultrasound Obstet Gynecol 2011; 37: 93–99.
13. Fabres C, Aviles G, De La Jara C, Escalona J, Munoz JF, Mackenna A, Fernandez C, Zegers-Hochschild F, Fernandez E. The cesarean delivery scar pouch: clinical implications and diagnostic correlation between transvaginal sonography and hysteroscopy. J Ultrasound Med 2003; 22: 695–700.
14. Regnard C, Nosbusch M, Fellemans C, Benali N, van Rysselberghe M, Barlow P, Rozenberg S. Cesarean section scar evaluation by saline contrast sonohysterography. Ultrasound Obstet Gynecol 2004; 23: 289–292.
15. Bij de Vaate AJ, van der Voet LF, Naji O, Witmer M, Veersema S, BrolmannHA, et al. Prevalence, potential risk factors for development and symptoms related to the presence of uterine niches following Cesarean section: systematic review. Ultrasound Obstet Gynecol. 2014;43(4):372–82.
16. Joseph KS, Young DC, Dodds L, et al. Changes in maternal characteristics and obstetric practice and recent increases in primary cesarean delivery. Obstet Gynecol 2003; 102:791–800.
17. Hofmeyr GJ, Mathai M, Shah A, et al. Techniques for caesarean section. Cochrane Database Syst Rev 2008:CD004662.
18. Vikhareva Osser O, Valentin L. Risk factors for incomplete healing of the uterine incision after caesarean section. BJOG 2010; 117: 1119–1126.
19. Yazicioglu F, Gokdogan A, Kelekci S, Aygun M, Savan K. Incomplete healing of the uterine incision after caesarean section: Is it preventable? Eur J Obstet Gynecol Reprod Biol 2006; 124: 32–36.
20. Hayakawa H, Itakura A, Mitsui T, Okada M, Suzuki M, Tamakoshi K, Kikkawa F. Methods for myometrium closure and other factors impacting effects on cesarean section scars of the uterine segment detected by the ultrasonography. Acta Obstet Gynecol Scand 2006; 85: 429–434.
21. Ofili-Yebovi D, Ben-Nagi J, Sawyer E, Yazbek J, Lee C, Gonzalez J, Jurkovic D. Deficient lower-segment Cesarean section scars: prevalence and risk factors. Ultrasound Obstet Gynecol 2008; 31: 72–77.
22. Gubbini G, Casadio P, Marra E. Resectoscopic correction of the isthmocele in women with postmenstrual abnormal uterine bleeding and secondary infertility. J Minim Invasive Gynecol 2008; 15:172–175.
23. Wang CB, Chiu WW, Lee CY, Sun YL, Lin YH, Tseng CJ. Cesarean scar defect: correlation between Cesarean section number, defect size, clinical symptoms and uterine position. Ultrasound Obstet Gynecol 2009; 34: 85–89.
24. Menada Valenzano M, Lijoi D, Mistrangelo E, Costantini S, Ragni N. Vaginal ultrasonographic and hysterosonographic evaluation of the low transverse incision after caesarean section: correlation with gynaecological symptoms. Gynecol Obstet Invest 2006; 61: 216–222.
25. Fabres C, Arriagada P, Fernandez C, et al. Surgical treatment and follow-up of women with intermenstrual bleeding due to cesarean section scar defect. J Minim Invasive Gynecol 2005; 12:25–28.
26. Uppal T, Lanzarone V, Mongelli M. Sonographically detected caesarean section scar defects and menstrual irregularity. J Obstet Gynaecol 2011; 31: 413–416.
27. Thurmond AS, Harvey WJ, Smith SA. Cesarean section scar as a cause of abnormal vaginal bleeding: diagnosis by sonohysterography. J Ultrasound Med 1999; 18:13–16.
28. Guzeloglu-Kayisli O, Kayisli UA, Taylor HS. The role of growth factors and cytokines during implantation: endocrine and paracrine interactions. Semin Reprod Med 2009; 27:62–79.
29. Chen HY, Chen SJ, Hsieh FJ. Observation of cesarean section scar by transvaginal ultrasonography. Ultrasound Med Biol1990; 16: 443–447.
30. Osser OV, Jokubkiene L, Valentin L. High prevalence of defects in Cesarean section scars at transvaginal ultrasound examination. Ultrasound Obstet Gynecol 2009; 34: 90–97.
31. Osser OV, Jokubkiene L, Valentin L. Cesarean section scar defects: agreement between transvaginal sonographic findings with and without saline contrast enhancement. Ultrasound Obstet Gynecol 2010; 35: 75–83.
32. Surapaneni K, Silberzweig JE. Cesarean section scar diverticulum: appearance on hysterosalpingography. R Am J Roentgenol 2008; 190:870–874.
33. Borges LM, Scapinelli A, de Baptista Depes D, Lippi UG, Coelho Lopes RG. Findings in patients with postmenstrual spotting with prior cesarean Section. J Minim Invasive Gynecol 2010; 17: 361–364.
34. El-Mazny A, Abou-Salem N, El-Khayat W, Farouk A. Diagnostic correlation between sonohysterography and hysteroscopy in the assessment of uterine cavity after cesarean section. Middle East Fertil Soc J 2011; 16: 72–76.
35. Gubbini G, Centini G, Nascetti D, et al. Surgical hysteroscopic treatment of cesarean-induced isthmocele in restoring fertility: a prospective study. J Minim Invasive Gynecol 2011; 18:234–237.
36. Dicle O, Küçükler C, Pirnar T, Erata Y, Posaci C. Magnetic resonance imaging evaluation of incision healing after cesarean sections. Eur Radiol 1997; 7(1):31–34.
37. Ida A, Kubota Y, Nosaka M, Ito K, Kato H, Tsuji Y.Successful management of a cesarean scar defect with dehiscence of the uterine incision by using wound lavage. Case Rep Obstet Gynecol. 2014:421014.
38. Donnez O, Jadoul P, Squifflet J, et al. Laparoscopic repair of wide and deep uterine scar dehiscence after cesarean section. Fertil Steril 2008; 89:974–980.
39. Klemm P, Koehler C, Mangler M, et al. Laparoscopic and vaginal repair of uterine scar dehiscence following cesarean section as detected by ultrasound. J Perinat Med 2005; 33:324–331.
40. Yalcinkaya TM, Akar ME, Kammire LD, et al. Robotic-assisted laparoscopic repair of symptomatic cesarean scar defect: a report of two cases. J Reprod Med 2011; 56:265–270.
41. G. Bennich, M. Rudnicki, C. Wilken-Jensen, T. Lousen, P.D. Lassen, K. Wojdemann. Impact of adding a second layer to a single unlocked closure of a Cesarean uterine incision: randomized controlled trial. Ultrasound Obstet Gynecol 2016; 47: 417–422.
Articole din ediţiile anterioare
Particularităţi ale evoluţiei materno-fetale la pacientele cu diabet gestaţional
Studiul elaborat a avut ca obiectiv identificarea complicaţiilor, a factorilor de risc şi a altor particularităţi asociate diabetului gestaţional.
Relaţia dintre cicatricea uterină determinată de intervenţii histeroscopice şi abdomenul acut chirurgical în sarcină - prezentare de cazuri -
Abdomenul acut chirurgical în cursul sarcinii reprezintă o entitate patologică, plurietiologică, cu evoluţie rapidă şi risc vital atât pentru partu...
Rolul sarcinii şi al naşterii în apariţia tulburărilor de statică pelvică
Introducere. Multiple studii subliniază consecinţele naşterii vaginale asupra planşeului pelvic, însă sarcina în sine reprezintă un factor de risc ...
Indicaţiile şi contraindicaţiile naşterii vaginale după operaţie cezariană
În ultimii ani, modalitatea de naștere este reprezentată de operația cezariană într-un procent foarte ridicat. Operația cezariană reprezintă aproap...