Bacterial infections are an important public health issue, especially those difficult to treat due to antibiotic resistance. Besides the antibiotic resistance, the majority of bacterial strains have the ability of forming specific multicellular communities, named biofilms, which have an increased tolerance to all known antimicrobial substances, and also to the host protection mechanisms. This study had as objective the analysis of the antibiotic susceptibility, adherence capacity and biofilm development, as well as producing of soluble virulence factors, with an important role in the progression of an infectious process for Staphylococcus spp. strains used to obtain bacterial autologous vaccines.
Most bacteria were resistant to penicillin, erythromycin, fusidic acid and clindamycin. All tested strains, particularly Staphylococcus epidermidis ones, produced biofilm and adhered to cell cultures in vitro. They also had the ability to produce various soluble virulence factors (i.e., protease, pore forming toxins etc.).
In some cases, the treatment of pathogens involved in bacterial infections requires a personalized therapy, depending on the virulence particularities and resistance of the infective agent, in order to be effective, and at the same time, to have minimal side effects, both on normal microbiota and host tissues.
Evaluarea sensibilităţii la antibiotice şi a unor factori implicaţi în virulenţă şi persistenţă la tulpini de Staphylococcus spp. utilizate în prepararea vaccinurilor autologe
Evaluation of the antibiotic susceptibility and virulence factors production in Staphylococcus spp. strains used to obtain autologous vaccines
First published: 26 iunie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Inf.54.2.2018.1833
Abstract
Rezumat
Infecţiile bacteriene, în special cele produse de tulpini rezistente la antibiotice, reprezintă o problemă majoră de sănătate publică. Pe lângă rezistenţa codificată genetic, naturală şi dobândită la antibiotice, majoritatea tulpinilor bacteriene prezintă şi rezistenţă fenotipică, determinată de capacitatea de a forma comunităţi multicelulare specifice, numite biofilme, care le conferă o toleranţă crescută la toate substanţele antimicrobiene cunoscute, dar şi la mecanismele de apărare ale gazdei.
Acest studiu a avut ca scop analiza sensibilităţii la antibiotice, a capacităţii de aderenţă şi producere de biofilme, precum şi de producere a unor factori de virulenţă solubili, cu rol esenţial în progresia unui proces infecţios, la tulpini de Staphylococcus spp. izolate în vederea realizării unui vaccin autolog bacterian.
Majoritatea bacteriilor au fost rezistente la penicilină, eritromicină, acid fusidic şi clindamicină. Toate tulpinile testate, mai ales cele de Staphylococcus epidermidis, au produs biofilm şi au aderat la culturile celulare in vitro. De asemenea, acestea au avut capacitatea de a produce diverşi factori solubili de virulenţă (protează, toxine formatoare de pori etc.).
Date fiind particularităţile unice de virulenţă şi rezistenţă ale agenţilor infecţioşi, în unele cazuri tratamentul infecţiilor bacteriene asociate necesită o abordare personalizată, care să asigure eradicarea infecţiei, cu efecte secundare minime asupra microbiotei normale şi a ţesuturilor gazdei.
Introducere
Infecţiile dificil de tratat induc morbiditate şi mortalitate crescute, cu impact direct atât asupra calităţii vieţii individului, cât şi asupra costurilor pe care le implică tratarea acestora(1). În unele infecţii, în ciuda tratamentelor aplicate corespunzător, bacteriile reuşesc să persiste şi, în anumite situaţii, să genereze infecţii recurente sau cronice(1). Factorii care contribuie la instalarea acestei stări ţin atât de gazdă, cât şi de potenţialul patogen al speciei bacteriene, precum şi de capacitatea acesteia de a scăpa de mecanismele de apărare ale gazdei(1). De exemplu, infecţiile pot fi localizate în zone în care antibioticele penetrează greu sau există situaţii în care prin acţiunea sau răspunsul imun izolează patogenul(1).În alte situaţii, unele specii microbiene au capacitatea să dezvolte biofilme mono- sau polispecifice, în interiorul cărora celulele bacteriene au un comportament modificat, fiind mult mai rezistente la acţiunea antibioticelor şi a dezinfectantelor sau la acţiunea efectorilor imunitari(2). Biofilmul reprezintă un complex microbian, în care celulele aderă strâns una de cealaltă sau de diverse suprafeţe, fiind înconjurate de o matrice de exopolizaharide, prezentând un fenotip modificat şi o rată de transcriere a genelor diferită de cea a celulelor planctonice(2).
Persistenţa unor bacterii în prezenţa dozelor crescute de antibiotic poate îngreuna tratamentul bolilor infecţioase(3). Termenul de celule bacteriene persistente a fost folosit prima dată de Joseph Bigger, pentru a descrie o subpopulaţie bacteriană de Staphylococcus spp., care, în ciuda tratamentului antibiotic corespunzător, deşi nu erau rezistente, reuşeau să supravieţuiască(3). Spre deosebire de celulele rezistente, cele persistente pot, în marea lor majoritate, să îşi recapete sensibilitatea la antibiotice după multiplicare, iar fracţia de celule persistente rămâne într-o proporţie restrânsă(3). Celulele tolerante la antibiotice reprezintă o proporţie mai mare şi reuşesc să fie protejate de acţiunea antibioticelor doar pentru o scurtă perioadă(3).
Persisterii sunt celule bacteriene care nu se multiplică sau care prezintă un ritm foarte lent de dezvoltare şi au procesele metabolice încetinite, dar îşi pot continua procesul de creştere după ce factorul stresant a fost îndepărtat(4).
Pentru Staphylococcus aureus au fost descrise şi alte fenotipuri asociate infecţiilor persistente, cum sunt small colony variants, care exprimă mai puţin toxine, dar au peretele mai gros, capacitate crescută de aderenţă şi rezistenţă la antibiotice(1). Mai mult, în funcţie de antibioticul administrat, unele tulpini de S. aureus pot produce radicali hidroxili, producţia fiind crescută în prezenţa norfloxacinei şi a dozei letale de vancomicină, dar absentă pentru cloramfenicol sau doze subletale de vancomicină(5).
Pentru tratamentul infecţiilor dificil de tratat au fost folosite şi alte terapii, precum terapia cu fagi, diverse nanoparticule sau autovaccinul. Autovaccinul este un preparat personalizat realizat pornind de la tulpina bacteriană incriminată, izolată de la pacient şi inactivată, în scopul tratării unor infecţii persistente(6).
Materiale şi metodă
În cadrul studiului de faţă au fost analizate datele privind autovaccinurile realizate în perioada ianuarie 2017 – ianuarie 2018. Pentru tulpinile de Staphylococcus spp. folosite în producerea autovaccinurilor, în primele două luni a fost testată sensibilitatea la antibiotice, a fost evaluată capacitatea acestora de a produce biofilm, factorii de virulenţă solubili şi aderenţa la substrat celular sensibil.
Etapa de izolare şi identificare
Tulpinile au fost izolate în cultură pură, în condiţii de laborator, şi ulterior identificate prin metode microbiologice clasice şi confirmate prin metoda automatizată MALDI-TOF mass spectrometry.
Determinarea patternului de sensibilitate la antibiotice
Sensibilitatea la antibiotice a fost testată conform recomandărilor EUCAST (The European Committee on Antimicrobial Susceptibility Testing), prin metoda disc-difuzimetrică (metoda standard Kirby Bauer), iar rezultatele au fost interpretate conform recomandărilor Comité de l’antibiogramme de la Société Française de Microbiologie, 2018.
Evaluarea producerii unor enzime implicate în virulenţa şi persistenţa tulpinilor bacteriene în diferite medii
A fost evaluată capacitatea de a produce enzime precum lecitinază, lipază (enzime care pot acţiona ca toxine formatoare de pori), cazeinază, gelatinază (proteaze care pot fi implicate în invazia ţesuturilor gazdei şi în inactivarea efectorilor imunitari), amilază (care poate favoriza multiplicarea bacteriană şi depăşirea mecanismelor de clearance ale organismului-gazdă), DN-ază (cu rol în neutralizarea fagocitelor) şi esculinază (cu rol de producere a pseudosideroforilor) prin însămânţarea în spot pe mediile corespunzătoare şi examinarea acestora la 24, 48 şi 120 de ore.
Evaluarea semicantitativă a capacităţii de aderenţă la substrat inert
Producerea de biofilm a fost evaluată la intervale de 24 şi 48 de ore, prin metoda microtitrării. În acest scop, într-o placă de plastic cu 96 de godeuri s-au adăugat în fiecare godeu câte 150 µl bulion simplu şi 15 µl de suspensie bacteriană McFarland 0,5 (respectiv 1,5 x 108 UFC/ml), preparată anterior din culturi bacteriene însămânţate de 24 de ore pe geloză sânge 5%. Probele au fost însămânţate în duplicat. Ulterior, pentru evaluarea gradului de aderenţă la substrat inert a tulpinilor testate, godeurile au fost spălate de trei ori cu apă fiziologică sterilă (AFS) şi fixate cu metanol rece timp de 5 minute. După îndepărtarea metanolului, plăcuţele uscate au fost colorate cu soluţie de cristal violet 1% timp de 20 minute. După colorare, excesul de colorant a fost spălat cu apă de robinet, iar biofilmul colorat a fost repus în suspensie cu o soluţie de acid acetic 33%. Suspensiile astfel obţinute au fost utilizate pentru cuantificarea gradului de dezvoltare a biofilmului, pe baza citirilor spectrofotometrice ale absorbanţei suspensiilor colorate la 492 nm.
Evaluarea calitativă şi semicantitativă a capacităţii de aderenţă la substrat celular sensibil (metoda Cravioto modificată)
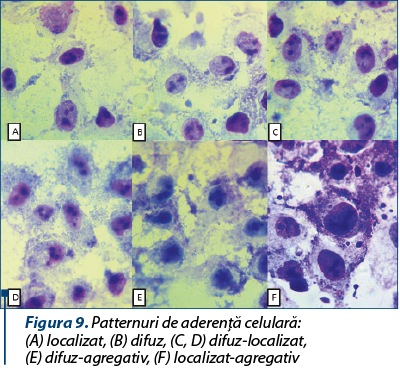
Pentru evaluarea capacităţii de aderenţă la substrat celular a fost utilizată linia celulară de origine tumorală Hep-2 (human epithelioma), cultivată pe mediu Eagle MEM (EMEM) (Gibco), cu adaos de 10% ser fetal de viţel, glutamină 1%, penicilină-streptomicină 1%, fungizon 1%, în plăci cu 6 godeuri, pentru a forma un monostrat cu confluenţă de 80-100%, după 24 de ore de incubare la 37°C în atmosferă cu 5% CO2. Peste monostratul celular, spălat în prealabil de 3 ori cu tampon fosfat salin (TFS), s-a adăugat 1 ml din suspensiile bacteriene cu densitate standard McFarland 0,5; plăcile au fost incubate la 37°C, timp de 2 ore, timp în care bacteriile au aderat la suprafaţa celulelor substratului; monostratul celular infectat cu suspensie bacteriană a fost spălat cu TFS (x 3) şi fixat cu metanol rece (5 minute); monostratul celular şi celulele bacteriene aderate au fost colorate cu soluţie Giemsa 10%, timp de 20 de minute; godeurile au fost spălate cu apă de robinet; după uscarea completă, godeurile au fost examinate la microscopul optic, cu obiectivul de imersie (x 100), pentru determinarea patternului de aderenţă (localizat, difuz sau agregativ) şi a indicelui de aderenţă (ID), prin raportarea numărului de celule Hep-2 la care bacteriile au aderat, din 100 de celule HeLa din câmpul microscopic.
Rezultate
În perioada analizată au fost produse 959 de autovaccinuri bacteriene. Mediana vârstei persoanelor care au necesitat aceste preparate a fost de 38 de ani (figura 1).
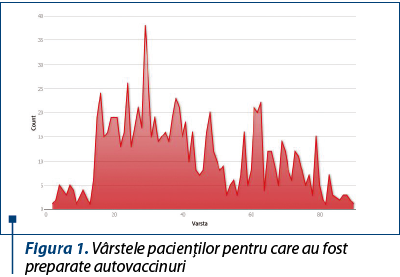
Patologiile pentru care au fost preparate vaccinurile au fost reprezentate cel mai frecvent de secreţii purulente cutanate (31,17%), urmate de infecţii de tract urinar (27,53%) şi mai rar de altele, precum hidrosadenite, prostatite, osteomielite etc.
Tulpinile bacteriene izolate din infecţiile persistente din acest studiu au aparţinut frecvent genului Staphylococcus spp. (53,39%). Alte specii bacteriene implicate au fost Escherichia coli (24,48%), Klebsiella pneumoniae (8,6%), Pseudomonas aeruginosa (5%), Enterococcus faecalis (2,36%), Proteus mirabilis (2,17%) şi altele. Tulpinile de Staphylococcus spp. au fost investigate în continuare pentru stabilirea profilurilor fenotipice de sensibilitate la antibiotice şi virulenţă.
Din punctul de vedere al sensibilităţii la antibiotice, din cele 50 de tulpini de Staphylococcus spp. testate, doar cinci au prezentat fenotip de rezistenţă la meticilină (fenotip MRSA). Tulpinile au prezentat rate mai ridicate de rezistenţă la penicilină, eritromicină, acid fusidic şi clindamicină, fiind urmate de gentamicină şi fosfomicină (figura 2).
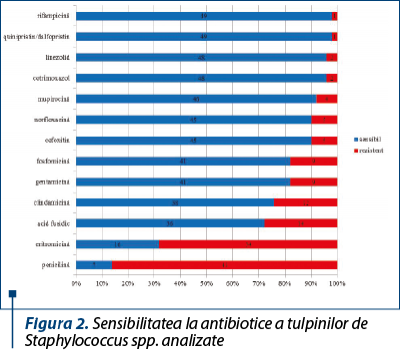
Dintre cele patru tulpini rezistente la norfloxacină, una a fost reprezentată de o tulpină MRSA sensibilă la ciprofloxacină şi levofloxacină, dar rezistentă la moxifloxacină şi ofloxacină; celelalte trei au fost tulpini de S. epidermidis rezistente şi la celelalte fluoroquinolone.
Dintre tulpinile de S. aureus, tulpina cu capacitatea cea mai mare de a produce biofilm a fost reprezentată de o tulpină rezistentă la meticilină (figura 3)
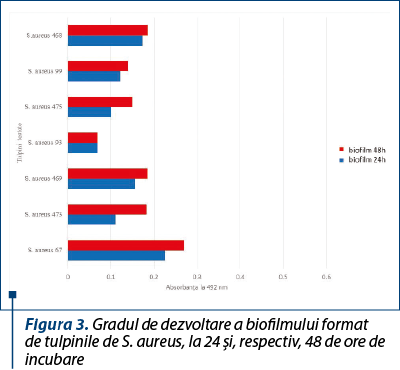
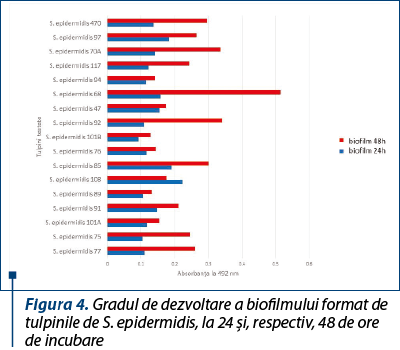
Pentru tulpinile de S. epidermidis s-a observat o capacitate mai mare de a produce biofilm (figura 4), spre deosebire de tulpinile de S. aureus sau alte tulpini de stafilococi coagulazo-negativi (figura 5), în special pentru tulpina numărul 68, care a avut cea mai pronunţată abilitate de a produce biofilm, dar în ceea ce priveşte rezistenţa la antibiotice şi producerea factorilor de virulenţă a avut capacitatea cea mai redusă.
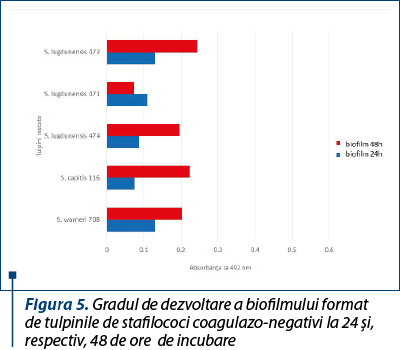
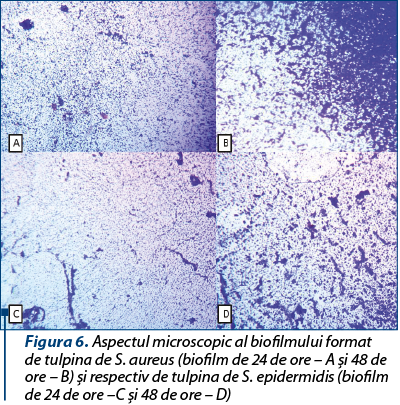
Biofilmul a fost mai pronunţat la 48 de ore decât la 24 de ore (figura 6), ceea ce demonstrează capacitatea acestor tulpini de a genera biofilme mature, cu risc crescut de a induce infecţii cronice.
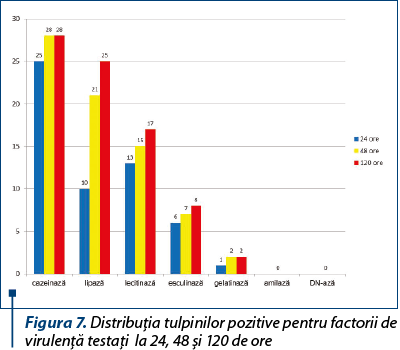
În ceea ce priveşte producerea factorilor solubili de virulenţă, dintre tulpinile testate niciuna nu a produs amilază sau DN-ază, majoritatea fiind producătoare de cazeinază, aproximativ jumătate lecitinază, o treime lipază la 24 de ore, o mică parte esculinază şi doar două dintre ele gelatinază (figura 7).
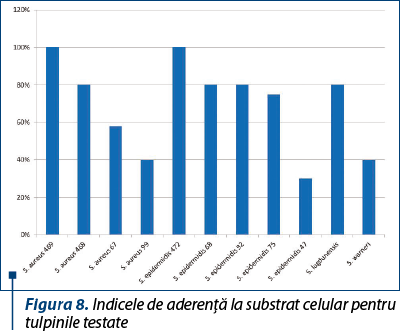
Capacitatea de aderenţă la substratul celular sensibil a fost evidenţiată la toate tulpinile testate, valoarea indicelui de aderenţă variind între 30% şi 100%, cu o medie de 70%, cel mai intens efect fiind observat la o tulpina de S. aureus rezistentă la meticilină (figura 8).
Patternurile de aderenţe identificate au fost difuz, localizat sau mixte – difuz-localizat, difuz-agregativ şi localizat-agregativ (figura 9).
Discuţii
În ceea ce priveşte sensibilitatea la antibiotice, rezultatele au fost asemănătoare cu cele raportate în alte studii, cu excepţia eritromicinei, în cazul căreia în alte articole majoritatea tulpinilor erau sensibile(8).
S. aureus reprezintă un important patogen al infecţiilor nosocomiale şi asociate îngrijirilor medicale, cu risc crescut de generare de biofilme la nivelul dispozitivelor medicale implantate în diferite situsuri în organism. Din structura biofilmelor mature se pot ulterior desprinde celulele bacteriene, care pot adera pe suprafeţe sau pentru a genera infecţii diseminate(9). În dezvoltarea biofilmului sunt implicate mai multe structuri de suprafaţă, de tipul proteinelor de perete celular, straturilor de polizaharide sau moleculelor specifice numite adezine(9).
Deşi S. epidermidis este considerată o bacterie cu virulenţă şi patogenitate scăzute, aceasta reprezintă cauza principală de infecţii asociate producerii de biofilme pe diverse suprafeţe şi dispozitive, precum implanturi chirurgicale, catetere venoase centrale, pacemakere(10). Această observaţie este susţinută şi de rezultatele prezentului studiu, în care tulpina de S. epidermidis a fost cea care a produs cel mai intens biofilm, caracteristică ce poate fi corelată şi cu capacitatea crescută de a adera la substratul celular sensibil.
În ceea ce priveşte rezistenţa la antibiotice, tulpina respectivă a fost sensibilă pentru toate antibioticele testate, cu excepţia penicilinei şi a cefoxitinului.
Tulpina care a avut cel mai mic procent de aderenţă la culturile celulare a fost, de asemenea, asociată cu o producere mai scăzută a biofilmului şi pozitivă doar pentru cazeinază şi lipază. În ceea ce priveşte sensibilitatea la antibiotice, aceasta a fost rezistentă doar la eritromicină. Tulpina a fost izolată de la nivelul pustulelor faciale la o persoană cu acnee. Unele studii raportează că aplicarea de concentraţii subinhibitorii de eritromicină, în pasaje succesive, ar putea să favorizeze producerea de biofilm în cazul tulpinilor de S. epidermidis(11).
Concluzii
Tulpinile incluse în acest studiu au fost izolate cel mai frecvent din afecţiuni tegumentare. Tulpinile cel mai frecvent identificate au fost cele de S. epidermidis, fiind caracterizate de o intensă capacitate de a produce biofilm şi aderenţă la culturile celulare.
Caracteristicile tulpinilor în ceea ce priveşte incidenţa, capacitatea lor de a produce factori de virulenţă, de a dezvolta biofilm, de a adera la suprafaţa celulelor sensibile şi patternul diferit de sensibilitate la antibiotice subliniază importanţa abordării personalizate de la caz la caz a patologiilor şi, de asemenea, a aplicării tratamentelor personalizate, în funcţie de alte aspecte ce ţin de pacient, de tulpina identificată şi de terapiile anterioare.
Conflicts of interest: The authors declare no conflict of interest.
Bibliografie
- Grant SS, Hung DT. Persistent bacterial infections, antibiotic tolerance, and the oxidative stress response. Virulence. 2013;4:273–83.
- Mihai MM, Preda M, Lungu I, et al. Nanocoatings for chronic wound repair –
- modulation of microbial colonization and biofilm formation. Int J Mol Sci. 2018;19:1179.
- Cabral DJ, Wurster JI, Belenky P. Antibiotic Persistence as a Metabolic Adaptation: Stress, Metabolism, the Host, and New Directions. Pharmaceuticals (Basel). Multidisciplinary Digital Publishing Institute (MDPI). 2018;11.
- Fisher RA, Gollan B, Helaine S. Persistent bacterial infections and persister cells. Nat Rev Microbiol. Nature Publishing Group. 2017;15:453–64.
- Kohanski MA, Dwyer DJ, Hayete B, et al. A Common Mechanism of Cellular Death Induced by Bactericidal Antibiotics. Cell. 2007;130:797–810.
- Zagólski O, Stręk P, Kasprowicz A, Białecka A. Effectiveness of Polyvalent Bacterial Lysate and Autovaccines Against Upper Respiratory Tract Bacterial Colonization by Potential Pathogens: A Randomized Study. Med Sci Monit. International Scientific Information. 2015;21:2997–3002.
- Mihai MM, Holban AM, Giurcăneanu C, et al. Identification and phenotypic characterization of the most frequent bacterial etiologies in chronic skin ulcers. Rom J Morphol Embryol. 2014;55:1401–8.
- Caraciolo FB, Maciel MAV, Santos JB dos, et al. Antimicrobial resistance profile of Staphylococcus aureus isolates obtained from skin and soft tissue infections of outpatients from a university hospital in Recife -PE, Brazil. An Bras Dermatol. 2012;87:857–61.
- Lister JL, Horswill AR. Staphylococcus aureus biofilms: recent developments in biofilm dispersal. Front Cell Infect Microbiol. 2014;4:178.
- He H-J, Sun F-J, Wang Q, et al. Erythromycin resistance features and biofilm formation affected by subinhibitory erythromycin in clinical isolates of Staphylococcus epidermidis. J Microbiol Immunol Infect. 2016 Feb 1;49:33–40.
- Wang Q, Sun FJ, Liu Y, et al. Enhancement of Biofilm Formation by Subinhibitory Concentrations of Macrolides in icaADBC-Positive and -Negative Clinical Isolates of Staphylococcus epidermidis. Antimicrob Agents Chemother. 2010;54:2707–11.
Articole din ediţiile anterioare
Rolul colonizării bacteriene în fiziopatologia hidradenitei supurative
Hidradenita supurativă reprezintă o patologie inflamatorie cronică, recurentă, caracterizată prin formarea de abcese dureroase, traiecte sinuoase, ...
Patogeneza infecţioasă și antibioterapia hidradenitei supurative
Hidradenita supurativă (HS), cunoscută și sub denumirile de hidrosadenită, acnee inversă, maladia Verneuilh, sindrom de obstrucție foliculară sau a...
Factori de virulenţă implicaţi în infecţiile cu Candida albicans și relevanţa lor clinică
Majoritatea infecțiilor fungice sunt superficiale și relativ ușor de tratat. Totuși, există și milioane de infecții fungice invazive. Discriminarea...