Irritable bowel syndrome is a frequent digestive condition, with an unclear etiopathogeny. Very probably intestinal dysbiosis plays an important role. For the moment there are no guidelines for treatment. There is scientific evidence for several therapies: modification of diet, non-resorbable antibiotics (rifaximin-α) and probiotics. Giving probiotics after each antibiotic course (an association of Bifidobacterium longum BB536 and Lactobacillus rhamnosus HN001) supplemented with vitamin B6 may be an optimal strategy.
Sindromul de intestin iritabil şi locul probioticelor în strategiile terapeutice
Irritable bowel syndrome and probiotics place in therapeutic strategies
First published: 02 martie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Inf.56.4.2018.2188
Abstract
Rezumat
Sindromul de intestin iritabil este o afecţiune digestivă frecvent întâlnită, cu etiopatogenie incomplet înţeleasă, în care disbioza intestinală joacă probabil un rol important. Nu există în prezent un tratament standardizat. Principiile de tratament pentru care există dovezi ştiinţifice sunt: modificarea dietei, tratamentul cu antibiotice neresorbabile (rifaximină-α) şi administrarea de probiotice. Administrarea după fiecare cură de antibiotic a unei asocieri de probiotice (Bifidobacterium longum BB536 şi Lactobacillus rhamnosus HN001) suplimentată cu vitamina B6 poate fi o variantă optimă de tratament.
Actualităţi în etiopatogenia şi fiziopatologia SII
Sindromul de intestin iritabil (SII) este o afecţiune digestivă frecvent întâlnită. Se estimează că în ţările industrializate SII are o prevalenţă de 10-15% în populaţia generală, fiind un factor cu impact semnificativ asupra indivizilor, dar şi asupra societăţii, în ceea ce priveşte calitatea vieţii, productivitatea muncii şi costurile cu asistenţa medicală. Deşi pacienţii cu SII sunt îngrijiţi în principal în ambulatoriu, un studiu publicat în 2017 a arătat că în perioada 1997-2010 SII a fost responsabil în SUA de circa 12000 de spitalizări anual, cu o durată medie de 3,7 zile(1).
În funcţie de simptomatologie, comorbidităţi, alterarea calităţii vieţii şi necesarul de servicii medicale, SII poate avea formă uşoară, medie sau severă. Unele studii au arătat că forma severă se poate regăsi la 15-40% din totalul pacienţilor cu SII(2).
SII se defineşte sintetic ca o afecţiune intestinală care asociază dureri abdominale şi tulburări de tranzit, în absenţa unei patologii demonstrabile prin investigaţii paraclinice. Mai exact, până în 2016 diagnosticul se punea în funcţie de criteriile ROMA III, respectiv: durere sau disconfort la nivelul abdomenului care apar cel puţin 3 zile pe lună în ultimele 3 luni, cu debut de cel puţin 6 luni; la acestea se asociază cel puţin două dintre următoarele: simptomele sunt ameliorate după defecaţie, apariţia simptomelor s-a asociat cu modificarea frecvenţei scaunului şi cu modificarea aspectului scaunului. Criteriile ROMA IV, prezentate la Digestive Disease Week din mai 2016, au adus modificări semnificative ale criteriilor de diagnostic, în ceea ce priveşte simptomatologia şi frecvenţa de apariţie: SII se diagnostichează în prezenţa durerii abdominale, apărute cel puţin o dată pe săptămână în ultimele 3 luni. Termenul de „disconfort” a fost eliminat, fiind prea vag. De asemenea, s-au modificat şi criteriile asociate. Noţiunea de „ameliorare după defecaţie” a fost înlocuită cu cea de „influenţată de defecaţie”, deoarece defecaţia nu ameliorează întotdeauna simptomele dureroase. În plus, s-a eliminat cerinţa ca modificările de frecvenţă şi de aspect ale scaunului să apară concomitent cu debutul durerii abdominale (tabelul 1)(3,4).

În funcţie de caracteristicile scaunului, există trei subtipuri de SII, prezentate în tabelul 1: cu predominanţa constipaţiei (SII-C), cu predominanţa diareii (SII-D) şi mixt (SII-M). Pacienţii care nu pot fi încadraţi în niciunul dintre subtipuri formează subtipul de SII neclasificabil. În SUA, studiile au arătat o prevalenţă relativă de 28% a SII-C, 26% a SII-D şi de 44% a SII-M. În timp, pacienţii pot trece de la un subtip la altul(1).

Tipurile de scaun conform scalei Bristol(3,5):
-
Tip 1 – fragmente dure, asemănătoare nucilor, separate (întâlnit în constipaţia severă)
-
Tip 2 – fragmente individualizate, dar eliminate sub forma unui cârnat (întâlnit în constipaţia moderată)
-
Tip 6 – fragmente de consistenţă moale, cu margini franjurate (întâlnit în diareea uşoară)
-
Tip 7 – scaun apos, fără fragmente solide (întâlnit în diareea severă)
Pe lângă criteriile necesare pentru diagnostic, pacienţii cu SII asociază frecvent şi alte semne sau simptome: distensie abdominală, balonare, flatulenţă, senzaţie de scaun imperios.
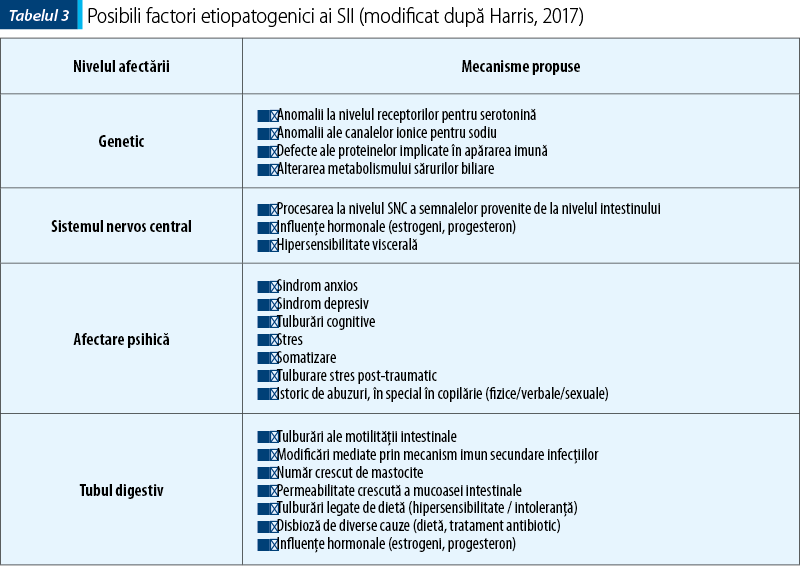
Modificarea criteriilor ROMA a apărut ca o necesitate generată de progresele din ultimii ani atât în cercetarea fundamentală, cât şi în urma studiilor clinice. Tulburările funcţionale digestive au fost redefinite ca fiind anomalii ale interacţiunii dintre intestin şi creier, respectiv un grup de afecţiuni caracterizate prin simptome gastrointestinale legate de o serie de anomalii (tabelul 3)(1,4):
-
tulburări de motilitate
-
hipersensibilitate viscerală
-
afectarea funcţiilor mucoasei digestive şi a mecanismelor locale ale imunităţii
-
alterarea microbiotei
-
alterarea procesării informaţiilor la nivelul SNC, cu consecinţe pe componenta senzitivă (hiperalgezie, alodinie) sau motorie
Unul dintre obiectivele ghidului ROMA IV a fost de a se evita pe cât posibil termenul de „funcţional”, deoarece este un termen nespecific şi cu posibilă conotaţie stigmatizantă. De altfel, pe măsura progreselor în elucidarea mecanismelor SII, cu siguranţă utilizarea termenului de „funcţional” se va restrânge progresiv.
Complexitatea modificărilor fiziopatologice implicate în tulburările funcţionale digestive impun o conduită terapeutică multimodală, adică o abordare biopsihosocială, care trebuie să ţină cont de o varietate de aspecte:
-
factorii care au influenţat pacientul în prima parte a vieţii: genetici, culturali şi de mediu;
-
factorii psihosociali: tipul de personalitate, stresul, starea psihologică, sprijinul din partea apropiaţilor;
-
elementele de fiziologie a tubului digestiv: motilitatea, sensibilitatea, funcţionarea mecanismelor apărării imune locale, microflora, calitatea alimentelor, dieta.
Principii de tratament în sindromul de intestin iritabil
Multiplele incertitudini la nivelul etiopatogeniei şi fiziopatologiei SII fac ca tratamentul acestei afecţiuni să ridice dificultăţi. Nu există în prezent un tratament standardizat. Se apelează la antispastice, antiflatulente, antidiareice şi antidepresive. În vederea optimizării tratamentului, Fundaţia ROMA a elaborat un instrument denumit „Multidimensional clinical profile” (MDCP), care permite evaluarea severităţii SII şi conturarea strategiei de tratament. MDCP evaluează o serie de elemente(1):
-
satisfacerea criteriilor de diagnostic ROMA IV
-
subtipul de SII
-
prezenţa factorilor psihosociali
-
impactul SII asupra activităţii zilnice
-
prezenţa unor probe de laborator asociate cu SII (biomarkeri, teste respiratorii)
Stabilirea strategiei terapeutice presupune în primul rând o evaluare individualizată centrată pe calitatea vieţii, precum şi o anamneză atentă, care poate decela situaţii stresante majore recente sau descoperirea altor motive de îngrijorare ale pacientului. Medicul trebuie să explice boala şi să transmită încredere către pacient (de accentuat că nu este o boală gravă, nu este de natură malignă, nu scade speranţa de viaţă), cu o componentă de psihoterapie, deoarece uneori felul cum pacienţii percep simptomele poate fi mai important decât simptomele propriu-zise. Trebuie făcute recomandări pentru un mod de viaţă sănătos (de exemplu, activitate fizică moderată minim 30 min/zi) şi de management al stresului, incluzând o durată de somn adecvată, tehnici de relaxare şi masaj, care pot contribui la starea de bine a pacientului.
Reguli generale legate de alimentaţie
Se recomandă ca mesele să fie la ore regulate, iar pacientul să stea la masă, nu în faţa televizorului sau a computerului. Trebuie mâncat încet, iar porţiile trebuie corect dimensionate, deoarece supraalimentaţia poate agrava simptomatologia. Alimentaţia trebuie să fie variată, cuprinzând zilnic alimente din toate grupele: pâine integrală şi cereale, legume şi fructe, lapte degresat şi produse lactate, carne slabă, ouă. Trebuie consumate suficiente lichide, reţinând că apa este cea mai bună opţiune!
Trebuie evitate alimente prăjite şi bogate în grăsimi (smântână, frişcă, îngheţată, shake-uri groase, maioneză), produsele de patiserie, plăcintele, mezelurile, ciocolata, alimentele producătoare de gaze (ceapă, usturoi, praz, ciuperci, conopidă, leguminoase – fasole, năut şi linte), băuturile care conţin cafeină (cafea, ceai şi băuturi energizante), condimentele iuţi.
Frecvent, ingestia anumitor alimente exacerbează simptomele pacientului cu SII. Alergiile alimentare propriu-zise sunt rare, dar frecvent pacienţii afirmă intoleranţă sau sensibilitate la anumite alimente. Circa 90% dintre pacienţii cu SII operează modificări ale dietei pentru a preveni sau ameliora simptomatologia. Unul dintre mecanismele propuse pentru explicarea rolului dietei în SII este acela că dieta poate influenţa, direct sau prin intermediul modificării microbiotei, celulele endocrine intestinale. Tot disbioza indusă de alimentaţie poate să producă balonare şi tulburări de tranzit(6,7,8).
Alimentaţia fără gluten
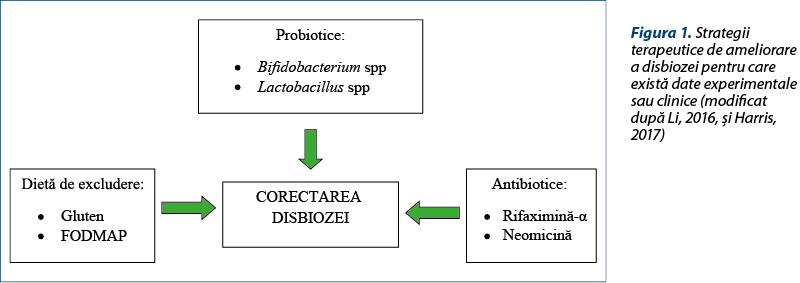
Boala celiacă trebuie exclusă prin analize serologice şi prin biopsie pe cale endoscopică. Sensibilitatea non-celiacă la gluten (la făina de grâu, orz, secară, uneori la ovăz prin contaminare cu celelalte în timpul procesării) are o simptomatologie asemănătoare cu SII: dureri abdominale, diaree sau constipaţie, vărsături, cefalee, depresie. Simptomele se ameliorează prin dietă fără gluten. Este posibil ca unii pacienţi diagnosticaţi cu SII să aibă de fapt sensibilitate la gluten, fapt confirmat indirect de ameliorarea simptomatologiei la o parte dintre pacienţi ca urmare a dietei fără gluten. Se presupune că substanţele care generează sensibilitatea non-celiacă sunt de natură proteică (gluten) sau glucide (mono-, di- şi oligozaharide fermentabile, polioli – FODMAP). O altă posibilitate este ca dieta fără gluten să influenţeze microbiota, iar aceasta la rândul ei să modifice simptomatologia SII (figura 1)(9).
Un studiu publicat în 2013, care a cuprins 37 de pacienţi cu SII cu sensibilitate non-celiacă la gluten, a urmărit simptomatologia lotului pe parcursul a două săptămâni de dietă fără FODMAP. Ulterior, pacienţii au fost randomizaţi pe dietă bogată în gluten / săracă în gluten / placebo timp de o săptămână. Simptomatologia (dureri abdominale, balonare, consistenţa scaunului, flatulenţa) a evoluat favorabil în primele 2 săptămâni, dar s-a înrăutăţit pe ansamblul lotului pe parcursul următoarelor 7 zile(10).
Pe de altă parte, un alt studiu efectuat pe un lot de 45 de pacienţi cu SII-D a arătat că dieta fără gluten a redus după 4 săptămâni semnificativ numărul scaunelor(9).
Alimentaţia săracă în FODMAP
Carbohidraţii care nu sunt digeraţi şi absorbiţi corespunzător în intestinul subţire, reuniţi sub termenul de FODMAP, ajung în colon şi au două efecte: efect osmotic, crescând hidratarea conţinutului intestinal, şi efect de producere de gaze, prin procesele de fermentaţie bacteriană. Acumularea de lichid şi gaze poate induce durere abdominală, senzaţie de balonare şi alterarea tranzitului.
Probe din fecalele pacienţilor cu SII care au consumat timp de 3 săptămâni o dietă săracă în FODMAP au prezentat o floră bacteriană mai săracă decât martorii. Scăderea a interesat printre altele bacteria producătoare de acid butiric Clostridium coccoides şi bacteria care metabolizează mucus Akkermansia muciniphila(11).
Un studiu randomizat publicat în 2015 a comparat o dietă săracă în FODMAP cu o dietă clasică recomandată în SII (săracă în grăsimi, condimente iuţi, cafea, alcool, varză, ceapă, fasole, băuturi carbogazoase). La o lună, ambele diete au dus la scăderea semnificativă a simptomatologiei legate de SII. De asemenea, o metaanaliză care a cuprins 10 studii clinice prospective a concluzionat că dieta clasică pentru SII şi dieta săracă în FODMAP au dus la ameliorarea simptomatologiei SII(12).
Pe termen lung, dieta săracă în FODMAP nu este recomandată, din cauza posibilelor deficite nutriţionale şi a efectului asupra microbiotei. Se recomandă mai degrabă ca, după ameliorarea simptomatologiei, pacientul să reintroducă progresiv componentele eliminate iniţial din dietă.
Tratamentul antibiotic
Motivaţia tratamentului antibiotic pentru SII se bazează pe ipoteza că, la cel puţin o parte dintre pacienţi, SII apare ca urmare a unui fenomen de suprapopulare bacteriană, care modifică echilibrul normal al speciilor care constituie microbiota.
Printre mecanismele care ar putea explica modul cum suprapopularea bacteriană induce SII prin mecanisme locale se numără: procesele de fermentaţie excesivă, microleziunile de la nivelul mucoasei digestive, modificarea motilităţii intestinului şi inducerea unor reacţii locale ale imunităţii nespecifice (inflamaţie) şi specifice (figura 2)(13).

Antibioticele orale cu efect sistemic nu sunt recomandate în tratamentul SII, din cauza riscurilor de reacţii adverse şi de dezvoltare a rezistenţei bacteriene. Soluţia este utilizarea unor antibiotice intestinale, neabsorbabile. Primul antibiotic neabsorbabil utilizat în tratamentul SII a fost neomicina. S-au obţinut rezultate pozitive, respectiv ameliorarea cu circa 50% a simptomatologiei globale comparativ cu placebo, dar medicaţia şi-a pierdut rapid eficienţa clinică(14).
În ultimii ani, cel mai utilizat antibiotic nonsistemic a devenit rifaximina-a, un derivat de rifamicină care inhibă expresia genelor bacteriene. Deoarece rifaximina-a se absoarbe foarte puţin din intestin, ea prezintă un risc scăzut de reacţii adverse şi este un antibiotic larg utilizat pentru tratamentul infecţiilor digestive(15). După mai mulţi ani de studiere a eficacităţii şi profilului de siguranţă, în 2015 FDA a aprobat utilizarea rifaximinei-a pentru tratamentul SII-D la adult în SUA(15).
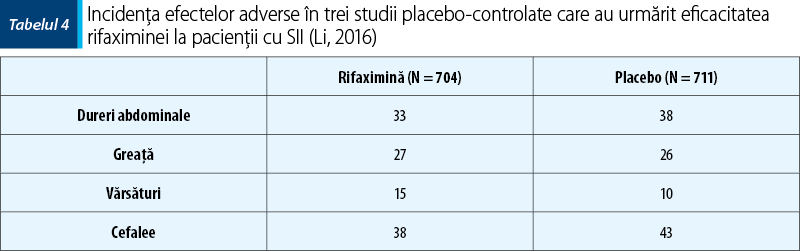
În perioada 2011-2014 s-au desfăşurat un studiu de fază IIb şi două studii de fază III care au evaluat eficacitatea rifaximinei-a la pacienţii cu SII-D. Studiile de fază III (TARGET 1 şi TARGET 2) au fost randomizate, placebo-controlate şi au evaluat eficacitatea rifaximinei-a 550 mg x 3/zi timp de 2 săptămâni la pacienţii cu SII-D. Un procent semnificativ superior dintre pacienţii care au primit rifaximină-a au înregistrat ameliorarea globală a simptomatologiei SII (40,7% faţă de 31,7%) şi ameliorarea balonării, durerilor abdominale şi a consistenţei scaunului (40,2% faţă de 30,2%) pentru o perioadă de peste două săptămâni în prima lună după încetarea tratamentului. În studiile amintite, rifaximina-a a prezentat un profil de siguranţă asemănător placebo în perioada de 10 săptămâni de urmărire după încheierea tratamentului, cu numai 1,6% efecte adverse severe faţă de 2,4% în grupul placebo. De remarcat că în niciunul dintre cele trei studii, care au totalizat peste 1800 de pacienţi, nu a apărut vreun caz de infecţie cu Clostridium difficile. Reacţiile adverse la cei 1008 pacienţi care au primit rifaximină-a au fost: cefalee, infecţii de tract respirator superior, greaţă şi dureri abdominale. Plecând de la aceste date, s-a calculat că tratamentul cu rifaximină-a pentru SII-D produce efecte adverse la câte un pacient pentru fiecare grup de 846 de pacienţi trataţi cu succes(16,17).
O evaluare complexă a efectelor şi a reacţiilor adverse ale rifaximinei-a administrate la pacienţii cu SII a fost făcută în cadrul unei metaanalize publicate în 2016. Din cele 108 studii publicate până la acel moment, au fost alese printr-o selecţie riguroasă numai patru studii randomizate, placebo-controlate, dublu-orb, publicate între 2006 şi 2011. Acestea au totalizat 1803 participanţi cu vârste cuprinse între 18 şi 45 de ani, cu SII fără constipaţie. În toate cele patru studii s-a obţinut remisiunea globală a simptomatologiei SII într-un număr de cazuri semnificativ superior grupului placebo, atât la finalul tratamentului, cât şi la finalul perioadei de urmărire. Distensia abdominală a fost urmărită ca parametru separat într-unul dintre studii. Rezultatele au arătat o scădere statistic semnificativă a distensiei abdominale la finele perioadei de urmărire în lotul care a primit rifaximină-a. Au fost semnalate reacţii adverse în trei dintre cele patru studii (dureri abdominale, greaţă, vărsături şi cefalee), dar analiza statistică a arătat că riscul de reacţii adverse al pacienţilor care au primit rifaximină-a nu a prezentat diferenţe semnificative faţă de lotul cu placebo(13).
Trebuie menţionat că, în mai multe studii pe modele animale şi la pacienţi cu SII, tratamentul timp de două săptămâni cu rifaximină-a nu a indus modificări majore ale microbiotei(18).
Următorul pas logic a fost verificarea efectului pe termen mai lung a eficacităţii tratamentului antibiotic al pacienţilor cu SII-D. În 2016 au fost publicate rezultatele studiului TARGET 3, care a urmărit eficacitatea şi profilul de siguranţă al tratamentului repetat cu rifaximină-a la pacienţii cu SII-D. Iniţial, studiul a inclus peste 2000 de pacienţi cu SII-D care au primit rifaximină 550 mg x 3/zi timp de 2 săptămâni şi au fost urmăriţi ulterior o perioadă maximă de 18 săptămâni. Din lotul iniţial care a primit rifaximină, un număr de 1074 de pacienţi (44,1%) au răspuns după această primă cură. Dintre ei, 382 (35,6%) nu au mai prezentat simptome de SII, dar la 692 de pacienţi simptomele au reapărut după 10 săptămâni, în medie.
Pacienţii care au prezentat recurenţa simptomelor de SII-D au primit încă două săptămâni rifaximină-a (328 de pacienţi) sau placebo (308 pacienţi). Un procent semnificativ mai mare dintre pacienţii care au primit rifaximină-a (38,1%) au răspuns pozitiv (scăderea cu cel puţin 30% a durerii abdominale evaluate ca scor mediu săptămânal şi scăderea cu cel puţin 50% a numărului de zile cu scaune moi sau apoase – scor 6 sau 7 pe scala Bristol) timp de peste două săptămâni pe parcursul perioadei de o lună posttratament, comparativ cu lotul placebo (31,5%). Cea mai mare diferenţă între rifaximină şi placebo s-a înregistrat în privinţa durerilor abdominale, care s-au ameliorat la 50,6% dintre subiecţii care au primit rifaximină faţă de 42,2% în grupul placebo, dar rezultate pozitive s-au înregistrat şi în privinţa senzaţiei de defecaţie imperioasă şi a duratei de menţinere a răspunsului terapeutic. Repetarea tratamentului cu rifaximină-a a fost bine tolerată, reacţiile adverse semnalate fiind greaţă, infecţii de tract respirator superior şi nazofaringite. Reacţiile adverse au fost rare şi similare ca incidenţă în lotul cu rifaximină-a şi placebo(19).
În prezent, rifaximina-a este singurul antibiotic intestinal cu beneficii dovedite în tratamentul SII. Unii autori atrag însă atenţia asupra unor aspecte: rifaximina-a este eficientă la circa 50% dintre pacienţi; nu s-au efectuat până în prezent studii pe loturi mari de pacienţi cu SII-C; nu se cunosc efectele rifaximinei-a asupra microbiotei în administrarea pe termen lung la pacienţii cu SII(20).
Microbiota intestinală şi disbioza la pacienţii cu sindrom de intestin iritabil
Microbiota umană este un ecosistem complex, în care se regăsesc în principal bacterii, dar şi virusuri (ex.: bacteriofagi), archaea (ex.: Methanobrevibacter), eucariote (fungi). Microbiota intestinală reprezintă o parte extrem de importantă din acest ansamblu. Ea este considerată un organ virtual, care influenţează activ şi modulează o multitudine de procese fiziologice ale gazdei, în principal legate de dezvoltarea intestinului, procesarea nutrienţilor, răspunsul imun specific local şi sistemic, rezistenţa faţă de bacteriile patogene, metabolismul energetic şi chiar activitatea SNC. Se estimează că ansamblul microbiotei conţine peste 3 milioane de gene, ceea ce depăşeşte numărul genelor umane într-un raport de 100/1.
Microbiota conţine peste 1000 de specii bacteriene, care aparţin de 50 de genuri, la rândul lor cuprinse în 17 familii, care aparţin în principal de 4 phylum (Firmicutes, Bacteroidetes, Actinobacteria şi Proteobacteria). Pe parcursul vieţii, tendinţa este de scădere a reprezentării Actinobacteria şi Proteobacteria, astfel că la adult ajung să predomine Firmicutes şi Bacteroidetes.
Compoziţia exactă a microbiotei este proprie fiecărui individ şi se modifică pe parcursul vieţii, sub influenţa unor factori de mediu: dietă, stil de viaţă, stres, consum de medicamente (în special antibiotice orale), unele proceduri invazive (ex.: colonoscopie)(20).
Se considera că numărul de bacterii din organismul uman depăşeşte numărul de celule ale gazdei într-o proporţie de 10/1, dar cercetări mai recente publicate în 2016 arată că raportul este de fapt de 130%, respectiv numărul de celule ale unui adult de 70 kg este de circa 30x1012, iar numărul estimat de bacterii din organismul acelui adult ar fi de 39x1012(21).
Numeroase studii au evidenţiat legături între disbioza intestinală şi o serie de patologii: diabet, sindrom metabolic, cancer, boli cu componentă inflamatorie, tulburări neuropsihice. Explicaţia este că microbiota intestinală interferează cu organismul gazdei prin contact direct, dar şi la distanţă.
Contactul direct se realizează cu epiteliul digestiv, celulele imune şi terminaţiile nervoase locale. Astfel, s-a demonstrat că prezenţa lactobacililor induce expresia receptorilor opioizi şi canabinoizi pe suprafaţa celulelor epiteliale intestinale, având efecte de modulare şi restabilire a percepţiei normale a durerii viscerale(22).
Un alt mod în care microbiota influenţează fiziologia intestinului este producţia locală de gaze: CO2, H2, metan, hidrogen sulfurat. Ultimul dintre acestea a fost recent inclus în categoria neuromodulatorilor / neuromediatorilor gazoşi, deoarece s-a demonstrat că poate modula inflamaţia şi sensibilitatea de la nivel intestinal(23).
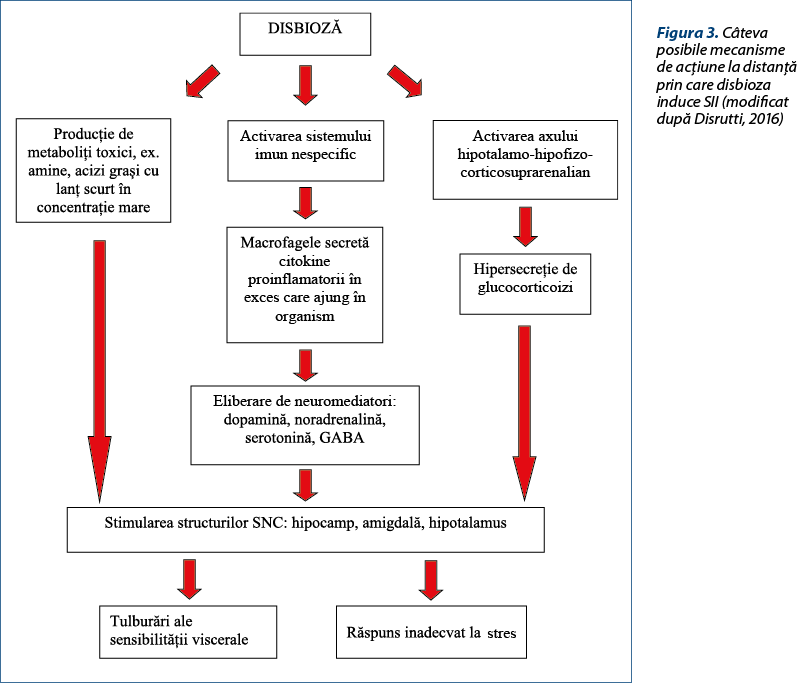
Totodată există şi interacţiuni la distanţă, prin multitudinea de metaboliţi bacterieni care se absorb în sânge. Aceştia influenţează sisteme neuronale care fac parte din aşa-numita „axă intestin-creier”, stimulând sinteza unor neurotransmiţători şi neuromodulatori (noradrenalină, dopamină, acetilcolină, serotonină, acid gama-aminobutiric – GABA). Tocmai pentru a sublinia legăturile existente, tot mai mulţi cercetători vorbesc despre „axa microbiotă-intestin-creier”(24).
Microbiota intestinală influenţează comunicarea bidirecţională între SNC şi sistemul nervos enteric şi modulează o serie de procese locale: motilitatea intestinală, activitatea secretorie de la acest nivel, apărarea imună nespecifică şi specifică, sensibilitatea.
Numeroase studii au sugerat că disbioza poate avea un rol important în etiopatogenia SII şi prin efecte la distanţă (figura 3).
Există numeroase date ştiinţifice care au demonstrat diferenţe ale microbiotei între pacienţii cu subtipurile de SII şi indivizii sănătoşi. În acest sens s-a pronunţat şi Grupul de Lucru ROMA, care în raportul fundaţiei publicat în 2013 a arătat că există dovezi solide în favoarea conceptului de perturbare a microbiotei intestinale la pacienţii cu SII(25).
Enumerăm în continuare câteva dintre modificările microbiotei constatate la pacienţii cu SII prin intermediul tehnicilor de analiză filogenetică a genelor din ARNr 16S bacterian:
-
scăderea diversităţii populaţiei microbiene;
-
modificarea raportului dintre genurile bacteriene, în principal scăderea Lactobacillus şi Bifidobacteria, în asociere cu creşterea proporţiei de aerobi faţă de anaerobi;
-
creşterea numărului de bacterii ataşate de mucoasa intestinală;
-
scăderea gradului de variabilitate a compoziţiei microbiotei;
-
un grad mai mare de instabilitate temporală a microbiotei.
Câteva mecanisme fiziopatologice prin care microbiota participă la SII:
-
Există dovezi în favoarea activării sistemului imunitar nespecific şi specific de la nivelul intestinului, caracterizat prin creşterea numărului de limfocite intraepiteliale, mastocite şi celule enterocromafine secretoare de serotonină(26).
-
Se ştie că microbiota influenţează procesele inflamatorii din bolile inflamatorii intestinale, prin alterarea echilibrului dintre factorii proinflamatori şi mecanismele de imunosupresie. Se poate presupune că antigenele microbiene acţionează asemănător, determinând o inflamaţie subclinică la pacienţii cu SII.
Dovezi indirecte în favoarea ipotezei că alterarea microbiotei este implicată în etiopatogenia SII:
-
Circa 10% dintre pacienţii cu SII afirmă că simptomatologia a fost declanşată de un episod de diaree infecţioasă.
-
Există concordanţă între SII şi administrarea de antibiotice pe cale orală(27,28).
Microbiota şi semnalizarea neuroimună
Sistemele de semnalizare neuroimune asigură interacţiunile complexe dintre sistemul nervos vegetativ, axul hipotalamo-hipofizo-corticosuprarenalian, sistemul nervos enteric şi mucoasa digestivă. Celulele efectorii sunt în principal celulele epiteliului digestiv, fibrele musculare netede şi celulele enterocromafine. Activarea acestora influenţează microbiota indirect, prin modularea unor procese locale (motilitatea, activitatea secretorie, modularea permeabilităţii intestinale, răspunsul imun local), dar şi direct, prin intermediul unor molecule de semnalizare. Influenţele se produc în ambele sensuri, deoarece microbiota influenţează la rândul ei centrii neuroendocrini prin stimularea directă a sistemului nervos enteric, dar şi la distanţă prin diverşi metaboliţi.
Microbiota şi imunitatea de la nivelul tubului digestiv
Mecanismele imunităţii nespecifice sunt deosebit de importante pentru funcţionarea corespunzătoare a tubului digestiv, deoarece ele sunt responsabile de echilibrul fin dintre toleranţa imună faţă de microflora comensală şi reacţiile de apărare faţă de cea patogenă. Agenţii patogeni sunt detectaţi prin intermediul unor receptori nespecifici din membrana şi citozolul enterocitelor, în principal din clasele TLR (toll-like receptors), NLR (Nod-like receptors) şi RIG (retinoic acid inducible gene-I‑like receptors). Aceşti receptori aparţin grupului denumit PRRs (pattern recognition receptors), care recunosc structuri microbiene comune pentru multe microorganisme patogene, denumite PAMPs (pathogen-associated molecular patterns).
Stimularea PRRs declanşează sinteza locală de citokine, care induc proliferarea epiteliului, activarea imunităţii nespecifice (inflamaţie, sinteza unor peptide antimicrobiene, ex.: defensine) şi specifice (sinteză de IgA).
Microbiota stimulează la rândul ei PRRs, modulând expresia genelor implicate în inflamaţie, producţia de peptide antimicrobiene, modularea senzaţiei dureroase etc. S-a constatat că disbioza modifică expresia TLR4 şi TLR7, care duce la tulburări ale sensibilităţii şi motilităţii colonice(29).
Pe de altă parte, şi expresia PRRs poate modifica microbiota. S-a demonstrat pe modele animale că scăderea expresiei NOD2 şi TLR5 produce disbioză(30).
Microbiota şi tulburările psihice
Există numeroase dovezi în favoarea ipotezei că disbioza poate afecta activitatea axului microbiotă-intestin-creier, prin inducerea de anomalii viscerale motorii sau senzitive:
-
Sindroamele anxioase şi depresive sunt comorbidităţi frecvente la pacienţii cu SII.
-
Raportul crescut dintre Firmicutes/Bacteriodes, care apare la unii pacienţi cu SII, se corelează cu sindroamele anxioase şi depresive(31).
-
La un lot de pacienţi cu SII care prezentau sindrom anxios, administrarea unui prebiotic galacto-oligozaharidic timp de patru săptămâni a dus la scăderea anxietăţii şi la ameliorarea calităţii vieţii(32).
Microbiota şi motilitatea intestinală
Deşi mult timp s-a presupus că tulburările de motilitate a tubului digestiv joacă un rol central în SII, studiile de manometrie intestinală la pacienţii cu SII nu au oferit rezultate concordante, care să structureze un profil caracteristic, cu posibilă valoare diagnostică şi terapeutică(33).
Astfel, s-a constatat de exemplu că un stres psihologic intens modifică motilitatea duodeno-jejunală atât la pacientul cu SII, cât şi la subiectul sănătos, iar pe de altă parte, peste 50% dintre pacienţii cu SII nu prezintă modificări de motilitate la manometria pe 24 de ore.
Există în schimb numeroase dovezi experimentale care evidenţiază relaţia biunivocă dintre microbiota intestinală şi motilitatea tubului digestiv:
-
La şobolanii germ-free s-a constatat că microbiota influenţează activitatea mioelectrică la nivelul intestinului subţire: Clostridium tabificum, L. acidophilus şi B. bifidum au accelerat tranzitul, în timp ce Micrococcus luteus l-a încetinit(34).
-
Unii produşi bacterieni pot modifica motilitatea intestinală prin stimularea receptorilor implicaţi în imunitatea nespecifică de pe suprafaţa celulelor epiteliale (TLR, NOD).
-
Pe preparate de colon uman in vitro s-a demonstrat că unii factori solubili produşi de tulpina probiotică E. coli Nissle 1917 au stimulat direct celulele musculare colonice, în schimb LPS provenit de la tulpini patogene de E. coli au inhibat contractilitatea acestora(35).
Microbiota şi sensibilitatea viscerală
Informaţiile senzoriale de la nivel intestinal trec prin mai multe staţii până ajung la ariile corticale, unde stimulii cu intensitate peste normal sunt integraţi sub forma senzaţiei de durere (figura 4). Staţiile senzoriale subcorticale şi ariile corticale sunt conectate cu centrii sistemului nervos vegetativ, care coordonează activitatea viscerelor, şi cu sistemul hipotalamo-hipofizo-corticosuprarenalian, care coordonează adaptarea organismului la stres. Aceste două sisteme pot modifica motilitatea şi sensibilitatea intestinului, pe căi nervoase şi umorale.
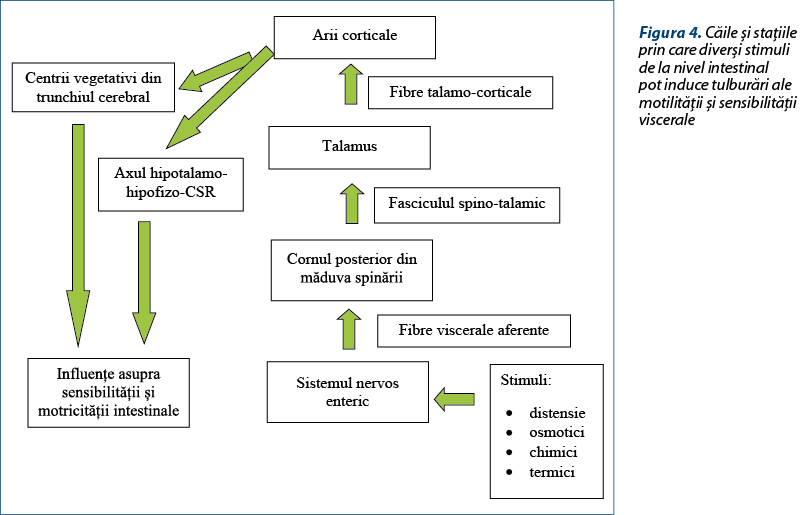
Se consideră că hipersensibilitatea viscerală reprezintă un element de primă importanţă în etiopatogenia SII. Aceasta poate să apară la oricare dintre staţiile de pe calea aferentă şi poate fi pusă în evidenţă relativ uşor prin scăderea pragului dureros la distensia rectală(36).
Ipoteza că la hipersensibilitatea viscerală contribuie o procesare defectuoasă a stimulilor intestinali la nivelul encefalului este susţinută de studii imagistice, care au arătat modificări de irigaţie a unor zone (aria corticală cingulată anterioară, amigdala, zone din cortexul frontal) ca răspuns la distensia intestinului la pacienţii cu SII. La nivelul encefalului, procesarea stimulilor viscerali poate fi influenţată de stimuli emoţionali sau stresanţi, ceea ce poate creşte percepţia stimulilor dureroşi(37).
Mai multe date experimentale au arătat că microbiota intestinală poate modula unele mecanisme ale hipersensibilităţii viscerale:
-
La şoarece, disbioza indusă de antibiotice a modificat sensibilitatea şi motricitatea intestinală prin creşterea expresiei TLR4 şi TLR7 şi prin scăderea expresiei receptorilor antinociceptivi canabinoid-1 şi µ-opioid pe epiteliul digestiv(38).
-
Tot la şoarece, modificarea microbiotei prin supunere la stres a crescut expresia locală a receptorilor canabinoid-2 şi a izoformei 1 a enzimei triptofan-hidroxilază, având ca efect creşterea sensibilităţii viscerale(39).
-
La pacienţii cu SII, suprapopulare bacteriană a intestinului subţire şi constipaţie cronică, disbioza a indus hipersensibilitate viscerală(40).
-
Şi bacteriile utilizate ca probiotice pot să modifice sensibilitatea intestinală: administrarea de L. reuteri la şoricei a inhibat răspunsul nociceptiv la distensia colorectală(41).
Probioticele în tratamentul sindromului de intestin iritabil
Numeroase studii clinice au investigat beneficiile terapeutice ale probioticelor la pacienţii cu SII. Rezultatele acestora au fost sintetizate în mai multe metaanalize care au luat în considerare numai studiile cu design corespunzător (studii randomizate şi controlate). Speciile de probiotice mai frecvent utilizate sunt prezentate în tabelul 5.

O metaanaliză publicată de Moayyedi et al. a evaluat 18 studii clinice randomizate şi controlate care au inclus în total 1650 de pacienţi cu SII. Rezultatele au fost concordante indiferent de specia utilizată ca probiotic: Lactobacillus în 3 studii care au cuprins 140 de pacienţi, Bifidobacterium în 2 studii cu 422 de pacienţi, Streptococcus într-un singur studiu cu 54 de pacienţi şi asocieri de probiotice în 4 studii, cu 319 pacienţi. Concluziile metaanalizei au fost(42):
-
Administrarea de probiotice a dus la ameliorarea globală a simptomatologiei comparativ cu placebo.
-
Analiza individualizată a simptomelor a arătat ameliorarea durerii, flatulenţei şi balonării.
-
Nu s-au înregistrat reacţii adverse.
O analiză a 42 de studii randomizate controlate, în care s-au administrat diverse specii producătoare de acid lactic (Lactobacillus, Bifidobacterium, Enterococcus şi Streptococcus) a fost publicată de Clarke et al. în 2011. S-au obţinut următoarele rezultate(43):
-
34 de studii au arătat rezultate benefice ale cel puţin unui simptom.
-
În 20 dintre cele 34 de studii s-a înregistrat ameliorarea senzaţiei de durere sau disconfort abdominal.
-
Dintre cele 24 de studii care au evaluat individual senzaţia de balonare sau distensia abdominală, în 12 s-a raportat ameliorarea acestora.
-
Dintre cele 24 de studii care au aplicat un index al funcţiei defecatorii, în 13 studii probioticele au fost superioare faţă de placebo.
-
Cele mai eficiente au fost probioticele care au conţinut tulpini de Lactobacillus şi Bifidobacterium.
O altă metaanaliză, publicată în World Journal of Gastroenterology de Didari et al. în 2015, a selectat 15 studii care au inclus 882 de pacienţi cu toate formele de SII definite conform criteriilor Roma II, Roma III şi ale World Organization of Family Doctors. Concluzia metaanalizei a fost că probioticele au redus durerea abdominală mai eficient decât placebo atât la 8, cât şi la 10 săptămâni de tratament(44).
Mecanismele prin care probioticele exercită efecte favorabile la pacienţii cu sindrom de intestin iritabil
Studiile experimentale şi clinice efectuate în ultimele decade au demonstrat sau sugerat mai multe mecanisme prin care probioticele modulează favorabil mecanismele fiziopatologice implicate în SII. Probioticele intervin la mai multe niveluri şi influenţează în principal:
-
compoziţia microbiotei intestinale
-
tulburările de motilitate intestinală
-
hipersensibilitatea viscerală de la acest nivel
-
alterările funcţiei imune ale epiteliului intestinal
-
procesele metabolice din lumenul intestinal
-
disfuncţiile axului microbiotă-intestin-creier
-
tulburările psihologice
Probioticele şi refacerea compoziţiei microbiotei
Prin creşterea numărului de lactobacili şi bifidobacterii, probioticele participă la refacerea şi stabilizarea unui ecosistem intestinal neprielnic pentru bacteriile patogene atât prin unii metaboliţi (acid lactic, acizi graşi cu lanţ scurt, peroxid de hidrogen), cât şi prin bacteriocine (lactocină, acidofilină, bifidină, bifidocină)(45,46).
Şi competiţia pentru substraturile nutritive are un efect de inhibare a dezvoltării patogenilor, care se remarcă îndeosebi asupra unor membri ai genurilor Clostridium, Escherichia coli, Salmonella, Shigella şi Pseudomonas.
Unele studii experimentale au arătat că probioticele stimulează producţia locală de mucine, scăzând astfel aderenţa bacteriilor patogene(47).
Probioticele şi ameliorarea motilităţii intestinale
Numeroase studii au demonstrat ameliorarea tranzitului la pacienţii cu constipaţie:
-
Administrarea de Bifidobacterium lactis HN019 şi Bifidobacterium lactis DN-173 010 a scăzut durata tranzitului la pacienţii adulţi cu constipaţie cronică.
-
Lactatele fermentate care conţin Bifidobacterium lactis DN-173 010 au scăzut distensia abdominală şi au scăzut durata tranzitului la un lot de pacienţi cu SII-C.
-
Administrarea zilnică de Bifidobacterium lactis a scăzut frecvenţa tulburărilor funcţionale la pacienţii care prezentau tranzit neregulat şi flatulenţă.
-
Asocierea probioticelor Bacillus subtilis şi Streptococcus faecium a ameliorat simptomele pacienţilor cu SII fără diaree.
-
O asociere de probiotice conţinând Lactobacillus acidophilus, L. plantarum, L. rhamnosus, Bifidobacterium breve, B. lactis, B. longum şi Streptococcus thermophilus a ameliorat simptomele unui lot de pacienţi cu SII-D.
-
O metaanaliză care a investigat studii randomizate controlate, publicată în 2014 în American Journal of Clinical Nutrition, a ajuns la concluzia că administrarea de Bifidobacterium lactis a scăzut durata tranzitului şi a crescut frecvenţa scaunelor la pacienţii cu constipaţie cronică(46,48,49,50,51,52).
Probioticele şi hipersensibilitatea viscerală
Mai multe studii pe modele animale au arătat că probioticele exercită un efect antinociceptiv direct la nivelul intestinului, asupra terminaţiilor nervoase senzitive, prin metaboliţi bacterieni cu rol de neurotransmiţători sau substanţe neuroactive(53,54).
Alte experimente susţin ipoteza că probioticele acţionează şi la distanţă, modulând echilibrul dintre stimulii nociceptivi şi antinociceptivi la nivelul SNC.
Studiile pe oameni sunt încă puţine. Un studiu publicat în 2013 a evaluat influenţa administrării timp de 4 săptămâni a unui produs lactat care conţinea Bifidobacterium animalis subsp. lactis, Streptococcus thermophiles, Lactobacillus bulgaricus şi Lactococcus lactis la indivizi sănătoşi, asupra zonelor din encefal care controlează procesarea emoţiilor şi senzaţiilor. Metoda de lucru a fost evaluarea prin rezonanţă magnetică a activităţii acestor zone în timpul unor activităţi care implicau atenţie emoţională şi în condiţii de repaus. Rezultatele au arătat că ingestia de probiotice a dus la scăderea răspunsurilor corticale la activităţile solicitante emoţional. Modificările mai accentuate au fost înregistrate la nivelul ariilor corticale implicate în procesele afective, viscerosenzitive şi somatosenzitive(55).
O metaanaliză publicată în 2014 a concluzionat că probioticele au avut efecte benefice la copiii cu SII sau cu durere abdominală funcţională, comparativ cu placebo, în sensul scăderii intensităţii durerii, dar nu şi a frecvenţei episoadelor(56).
Probioticele şi modularea proceselor inflamatorii şi imune la nivel local şi sistemic
Legătura dintre SII şi modificările de natură inflamatorie şi imună de la nivelul mucoasei intestinale sunt sugerate indirect de faptul că o parte dintre pacienţi afirmă apariţia simptomelor de SII după o infecţie intestinală bacteriană sau virală.
De asemenea, o serie de studii pe animale de experienţă şi la om a arătat că SII se însoţeşte de alterarea răspunsului imun nespecific şi specific la nivel intestinal şi sistemic:
-
Creşterea permeabilităţii mucoasei intestinale este considerată un marker de inflamaţie locală.
-
Stimularea locală a reacţiilor imunităţii nespecifice: acumularea subepitelială a mastocitelor, macrofagelor şi celulelor dendritice (cu rol de celule prezentatoare de antigen).
-
Activarea locală şi sistemică a răspunsului imun nespecific şi adaptativ, obiectivată prin creşterea nivelului unor citokine: TNF-a, IL-1b, IL-6, IL-8, IL-12.
-
Scăderea locală şi sistemică a unor citokine antiinflamatoare (IL-10)(57,58).
Există numeroase date experimentale şi rezultate din studii clinice care arată că probioticele scad fenomenele inflamatorii şi imune prezente în SII, prin mai multe mecanisme:
-
menţin permeabilitatea normală a barierei epiteliale intestinale;
-
refac echilibrul alterat dintre citokinele proinflamatoare şi antiinflamatoare (cuantificat prin raportul IL-10/IL-12);
-
scad nivelul local şi sistemic al unor citokine proinflamatoare (TNF-a, IFN-g)(59,60,61,62).
Probioticele şi răspunsul la stres
Numeroase date experimentale şi clinice arată că între microbiotă şi SNC există influenţe în ambele sensuri. Disbioza poate induce alterarea axului microbiotă-intestin-creier, în timp ce probioticele pot contribui la normalizarea interacţiunilor dintre componente. O parte dintre efectele benefice se exercită indirect, prin ameliorarea statusului proinflamator, protejarea barierei epiteliale intestinale etc.
Mai multe studii pe animale de laborator au evidenţiat efectul protectiv al probioticelor faţă de comportamentul anxio-depresiv indus prin stres psihic:
-
Unele probiotice (tulpini de Lactobacillus rhamnosus şi Lactobacillus helveticus) au normalizat răspunsul exagerat al axului hipotalamo-hipofizo-corticosuprarenalian la modele animale de SII.
-
Lactobacillus rhamnosus a scăzut creşterea de corticosteron indusă de stres prin modularea receptorilor GABA implicaţi în comportamentul anxios.
-
O tulpină de Bifidobacterium longum a avut efecte pozitive asupra proceselor cognitive la şoriceii supuşi la stres.
-
Un amestec de tulpini din opt specii probiotice (Lactobacillus casei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus, Bifidobacterium longum, B. breve, B. infantis şi Streptococcus salivarius) a dus la creşterea nivelului de factor neurotrofic produs de creier (BDNF – brain-derived neurotrophic factor) şi a scăzut alterările corespunzătoare vârstei în hipocamp într-un model animal de deteriorare a funcţiilor cognitive(63,64,65,66).
Sindromul de intestin iritabil şi deficitul de vitamină B6
Într-un studiu pe pacienţi cu SII diagnosticat conform criteriilor ROMA II, publicat în 2011, autorii au plecat de la premisa că cea mai mare parte acestei categorii de pacienţi corelează simptomatologia SII cu particularităţi ale dietei, dar că nu s-a explorat până atunci în detaliu aportul unor nutrienţi specifici. Autorii au efectuat un studiu transversal asupra a 17 pacienţi, care au notat zilnic simptomele SII şi ingestia de nutrienţi timp de 7 zile. S-a constatat că aportul de vitamină B6 a fost singurul parametru din dietă care s-a corelat cu simptomatologia SII. Pacienţii din lot au avut un aport mediu de vitamină B6 de 0,9 mg/zi, pe când doza zilnică recomandată este de 1,6 mg/zi pentru bărbaţi şi 1,2 mg/zi pentru femei.
Intensitatea simptomelor SII a fost cuantificată cu ajutorul unui scor zilnic, iar autorii au observat în cadrul lotului o corelaţie invers proporţională între aceasta şi aportul zilnic de vitamină B6, pacienţii care au înregistrat scorurile cele mai înalte (simptome severe de SII) având aportul cel mai mic de vitamină B6 prin dietă(67).
ZirComBi – un probiotic adaptat pentru tratamentul sindromului de intestin iritabil
Trecând în revistă multitudinea de date din literatura de specialitate, se desprinde concluzia că o asociere de probiotice care cuprinde tulpini de Lactobacillus şi de Bifidobacterium, la care se adaugă o suplimentare cu vitamina B6, ar putea să constituie o abordare terapeutică justificată şi eficientă la pacienţii cu SII, ca un mod de consolidare a beneficiilor reprezentate de ameliorarea simptomelor, obţinute prin antibioterapia cu rifaximină-a.
Se cunoaşte faptul că, pentru a fi eficient, un probiotic trebuie să reziste contactului cu acidul clorhidric şi cu sărurile biliare, iar apoi să adere de mucoasa digestivă. Dacă vorbim despre asocieri de probiotice, apare şi problema eventualului antagonism între tulpinile folosite.
În anii 2015 şi 2016 s-au publicat două studii care au evaluat aceste aspecte, în condiţii de laborator, referitoare la două tulpini de probiotice: Bifidobacterium longum BB536 şi Lactobacillus rhamnosus HN001, care se regăsesc în preparatul ZirComBi. Într-o primă etapă s-a evaluat posibilul antagonism dintre acestea, prin difuziune în agar, apoi s-a evaluat rezistenţa celor două tulpini, individual şi în asociere, în mediul simulat gastrointestinal (mai întâi pH de 3, 2,5 şi 2 şi apoi concentraţii de săruri biliare de 0,3%, 0,5% şi 0,7%) şi, în final, capacitatea de adeziune pe cultură de celule de cancer colonic HT-29.
Rezultatele studiului au fost următoarele: tulpinile probiotice B. longum BB536 şi L. rhamnosus HN001 nu au prezentat efecte de inhibiţie reciprocă in vitro, au dovedit rezistenţă bună la pH scăzut şi la concentraţiile progresive de săruri biliare, rezistenţă care s-a dovedit mai bună când cele două tulpini au fost testate împreună. Tulpinile testate izolat şi în asociere au prezentat, de asemenea, adeziune bună pe cultura de celule HT-29, fără să manifeste competiţie de adeziune(68,69.
Preparatul ZirComBi asociază aceste două tulpini de probiotice care acţionează sinergic, având o rezistenţă mai bună la pH scăzut şi în prezenţa sărurilor biliare când sunt administrate în asociere, fiind suplimentat cu doza zilnică recomandată de vitamină B6, ceea ce ar putea să contribuie suplimentar la ameliorarea simptomatologiei pacienţilor cu SII.
ZirComBi se recomandă în continuarea tratamentului cu rifaximină-a (Normix®) la pacienţii cu SII cu predominanţa diareii. Recomandarea producătorilor este ca, după ciclul de 14 zile de tratament cu Normix® 200 mg (1200 mg/zi) să se continue cu administrarea de ZirComBi® timp de încă cel puţin 12 zile. Se recomandă suplimentarea dietei cu ZirComBi® timp de 12 zile după fiecare ciclu de retratare a SII-D cu Normix® 200 mg.
Datele disponibile susţin ideea că ZirComBi poate fi asocierea probiotică de elecţie în dieta pacienţilor cu SII, care reechilibrează microbiota intestinală, deoarece este o combinaţie de probiotice (Bifidobacterium longum şi Lactobacillus rhamnosus) cu efect sinergic demonstrat prin studii ştiinţifice, suplimentată cu vitamina B6.
Conflict of interests: The author declares no conflict of interests
Bibliografie
- Harris LA, Baffy N. Modulation of the gut microbiota: a focus on treatments for irritable bowel syndrome. Postgraduate Medicine. 2017;129:8,872-888.
- Coffin B, Dapoigny M, Cloarec D, et al. Relationship between severity of symptoms and quality of life in 858 patients with irritable bowel syndrome. Gastroenterol Clin Biol. 2004;28:11-15.
- Lacy BE, Mearin F, Chang L, et al. Bowel Disorders. Gastroenterology. 2016;150:1393-1407.
- Drossman DA. Functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV. Gastroenterology. 2016;150:1262-1279.
- Lewis SJ, Heaton KW. Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol. 1997;32(9):920-4.
- Hayes P, Corish C, O’Mahony E, et al. A dietary survey of patients with irritable bowel syndrome. J Hum Nutr Diet. 2014;27:36-47.
- Heizer WD, Southern S, McGovern S. The role of diet in symptoms of irritable bowel syndrome in adults: a narrative review. J Am Diet Assoc. 2009;109:1204-1214.
- Rajilic-Stojanovic M, Jonkers DM, Salonen A, et al. Intestinal microbiota and diet in IBS: causes, consequences, or epiphenomena? Am J Gastroenterol. 2015;110:278-287.
- Vazquez-Roque MI, Camilleri M, Smyrk T, et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology. 2013;144:903-911.
- Biesiekierski JR, Peters SL, Newnham ED, et al. No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology. 2013;145:320-328.
- Shepherd SJ, Lomer MC, Gibson PR. Short-chain carbohydrates and functional gastrointestinal disorders. Am J Gastroenterol. 2013;108:707-717.
- Varju P, Farkas N, Hegyi P, et al. Low fermentable oligosaccharides, disaccharides, monosaccharides and polyols (FODMAP) diet improves symptoms in adults suffering from irritable bowel syndrome (IBS) compared to standard IBS diet: A meta-analysis of clinical studies. PLoS One. 2017;12:e0182942.
- Li J, Zhu W, MD, Liu W, et al. Rifaximin for Irritable Bowel Syndrome A Meta-Analysis of Randomized Placebo-Controlled Trials. Medicine 2016, Volume 95, Number 4.
- Pimentel M, Chow EJ, Lin HC. Eradication of small intestinal bacterial overgrowth reduces symptoms of irritable bowel syndrome. Am J Gastroenterol. 2000; 95: 3503-3506.
- Popa GL, Gheorghe SA, Preda M, Popa MI. The intestinal microbiota changes paradigms in irritable bowel syndrome. Infectio.ro. 2017;50(2):5-9.
- Pimentel M, Lembo A, Chey WD, et al. Rifaximin therapy for patients with irritable bowel syndrome without constipation. N Engl J Med. 2011;364:22-32.
- Shah E, Kim S, Chong K, et al. Evaluation of harm in the pharmacotherapy of irritable bowel syndrome. Am J Med. 2012;125:381-393.
- Ponziani FR, Zocco MA, D’Aversa F, et al. Eubiotic properties of rifaximin: Disruption of the traditional concepts in gut microbiota modulation. World J Gastroenterol. 2017; 23(25):4491-4499.
- Lembo A, Pimentel M, Rao SS, et al. Repeat treatment with rifaximin is safe and effective in patients with diarrhea-predominant irritable bowel syndrome. Gastroenterology. 2016;151:1113-1121.
- Distrutti E, Monaldi L, Ricci P, Fiorucci S. Gut microbiota role in irritable bowel syndrome: New therapeutic strategies. World J Gastroenterol. 2016; 22(7): 2219-2241.
- Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 2016;14(8):e1002533.
- Rousseaux C, Thuru X, Gelot A, et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med. 2007;13:35-37.
- Popa GL, Gheorghe SA, Preda M, Popa MI. The intestinal microbiota reconfigures the boundaries of knowledge. Infectio.ro. 2017;49(1):5-9.
- Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci. 2012;13:701-712.
- Simren M, Svedlund J, Posserud I, et al. Health-related quality of life in patients attending a gastroenterology outpatient clinic: functional disorders versus organic diseases. Clin Gastroenterol Hepatol. 2006;4:187-195.
- Spiller RC, Jenkins D, Thornley JP, et al. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut. 2000;47:804-811.
- Spiller R, Garsed K. Postinfectious irritable bowel syndrome. Gastroenterology. 2009; 136: 1979-1988 [PMID: 19457422].
- Villarreal AA, Aberger FJ, Benrud R, Gundrum JD. Use of broadspectrum antibiotics and the development of irritable bowel syndrome. WMJ 2012; 111: 17-20 [PMID: 22533211].
- Aguilera M, Cerda-Cuellar M, Martinez V. Antibiotic-induced dysbiosis alters host-bacterial interactions and leads to colonic sensory and motor changes in mice. Gut Microbes. 2015;6:10-23.
- Mu C, Yang Y, Zhu W. Crosstalk Between The Immune Receptors and Gut Microbiota. Curr Protein Pept Sci. 2015;16:622-631.
- Jeffery IB, O’Toole PW, Ohman L, et al. An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota. Gut. 2012;61:997-1006.
- Silk DB, Davis A, Vulevic J, Tzortzis G, Gibson GR. Clinical trial: the effects of a trans-galactooligosaccharide prebiotic on faecal microbiota and symptoms in irritable bowel syndrome. Aliment Pharmacol Ther. 2009; 29: 508-518 [PMID: 19053980].
- Staumont G, Delvaux M, Fioramonti J, Berry P, Bueno L, Frexinos J. Differences between jejunal myoelectric activity after a meal and during phase 2 of migrating motor complexes in healthy humans. Dig Dis Sci. 1992; 37: 1554-1561 [PMID: 1396003].
- Husebye E, Hellström PM, Sundler F, Chen J, Midtvedt T. Influence of microbial species on small intestinal myoelectric activity and transit in germ-free rats. Am J Physiol Gastrointest Liver Physiol. 2001; 280: G368-G380 [PMID: 11171619].
- Bär F, Von Koschitzky H, Roblick U, Bruch HP, Schulze L, Sonnenborn U, Böttner M, Wedel T. Cell-free supernatants of Escherichia coli Nissle 1917 modulate human colonic motility: evidence from an in vitro organ bath study. Neurogastroenterol Motil. 2009; 21: 559-566, e16-e17 [PMID: 19220758 DOI: 10.1111/ j.1365-2982.2008.01258.x].
- Ritchie JA, Ardran GM, Truelove SC. Observations on experimentally induced colonic pain. Gut 1972; 13: 841 [PMID: 5087084].
- Silverman DH, Munakata JA, Ennes H, Mandelkern MA, Hoh CK, Mayer EA. Regional cerebral activity in normal and pathological perception of visceral pain. Gastroenterology. 1997; 112: 64-72 [PMID: 8978344].
- Aguilera M, Cerdà-Cuéllar M, Martínez V. Antibiotic-induced dysbiosis alters host-bacterial interactions and leads to colonic sensory and motor changes in mice. Gut Microbes. 2015; 6: 10-23 [PMID: 25531553 DOI: 10.4161/19490976.2014.990790].
- Aguilera M, Vergara P, Martínez V. Stress and antibiotics alter luminal and wall-adhered microbiota and enhance the local expression of visceral sensory-related systems in mice. Neurogastroenterol Motil. 2013; 25: e515-e529 [PMID: 23711047 DOI: 10.1111/nmo.12154].
- Theodorou V, Ait Belgnaoui A, Agostini S, et al. Gut microbiota modulation in IBS WJG of commensals and probiotics on visceral sensitivity and pain in irritable bowel syndrome. Gut Microbes. 2014;5:430-436.
- Kamiya T, Wang L, Forsythe P, Goettsche G, Mao Y, Wang Y, Tougas G, Bienenstock J. Inhibitory effects of Lactobacillus reuteri on visceral pain induced by colorectal distension in SpragueDawley rats. Gut. 2006; 55: 191-196 [PMID: 16361309 DOI: 10.1136/gut.2005.070987].
- Moayyedi P, Ford AC, Talley NJ, Cremonini F, Foxx-Orenstein AE, Brandt LJ, Quigley EM. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010; 59: 325-332 [PMID: 19091823 DOI: 10.1136/gut.2008.167270].
- Clarke G, Cryan JF, Dinan TG, Quigley EM. Review article: probiotics for the treatment of irritable bowel syndrome--focus on lactic acid bacteria. Aliment Pharmacol Ther. 2012; 35: 403-413 [PMID: 22225517 DOI: 10.1111/j.1365-2036.2011.04965.x].
- Didari T, Mozaffari S, Nikfar S, Abdollahi M. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J Gastroenterol. 2015;21:3072-3084.
- Gibson GR, Wang X. Regulatory effects of bifidobacteria on the growth of other colonic bacteria. J Appl Bacteriol. 1994;77:412-420.
- Eskesen D, Jespersen L, Michelsen B, et al. Effect of the probiotic strain Bifidobacterium animalis subsp. lactis, BB-12®, on defecation frequency in healthy subjects with low defecation frequency and abdominal discomfort: a randomised, double-blind, placebocontrolled, parallel-group trial. Br J Nutr. 2015;114:1638-1646 .
- Kim Y, Kim SH, Whang KY, et al. Inhibition of Escherichia coli O157: H7 attachment by interactions between lactic acid bacteria and intestinal epithelial cells. J Microbiol Biotechnol. 2008;18:1278-1285.
- Miller LE, Ouwehand AC. Probiotic supplementation decreases intestinal transit time: meta-analysis of randomized controlled trials. World J Gastroenterol. 2013;19:4718-4725 .
- Agrawal A, Houghton LA, Morris J, et al. Clinical trial: the effects of a fermented milk product containing Bifidobacterium lactis DN-173 010 on abdominal distension and gastrointestinal transit in irritable bowel syndrome with constipation. Aliment Pharmacol Ther. 2009;29:104-114.
- Choi CH, Kwon JG, Kim SK, et al. Efficacy of combination therapy with probiotics and mosapride in patients with IBS without diarrhea: a randomized, double-blind, placebo-controlled, multicenter, phase II trial. Neurogastroenterol Motil. 2015;27:705-716.
- Ki Cha B, Mun Jung S, Hwan Choi C, et al. The effect of a multispecies probiotic mixture on the symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Gastroenterol. 2012;46:220-227 .
- Dimidi E, Christodoulides S, Fragkos KC, Scott SM, Whelan K. The effect of probiotics on functional constipation in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr. 2014;100:1075-1084.
- Mayer EA, Savidge T, Shulman RJ. Brain-gut microbiome interactions and functional bowel disorders. Gastroenterology. 2014;146:1500-1512.
- Johnson AC, Greenwood-Van Meerveld B, McRorie J. Effects of Bifidobacterium infantis 35624 on post-inflammatory visceral hypersensitivity in the rat. Dig Dis Sci. 2011;56:3179-3186.
- Tillisch K, Labus J, Kilpatrick L, et al. Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology. 2013;144:1394-1401.
- Korterink JJ, et al. Probiotics for childhood functional gastrointestinal disorders: a systematic review and meta-analysis. Acta Paediatr. 2014; 103(4): 365-372.
- Ohman L, Simrén M. Pathogenesis of IBS: role of inflammation, immunity and neuroimmune interactions. Nat Rev Gastroenterol Hepatol. 2010;7:163-173.
- Bashashati M, Rezaei N, Bashashati H, et al. Cytokine gene polymorphisms are associated with irritable bowel syndrome: a systematic review and meta-analysis. Neurogastroenterol Motil. 2012;24:1102-e566.
- Martín R, Chain F, Miquel S, et al. Effects in the use of a genetically engineered strain of Lactococcus lactis delivering in situ IL-10 as a therapy to treat low-grade colon inflammation. Hum Vaccin Immunother. 2014;10:1611-1621.
- O’Mahony L, McCarthy J, Kelly P, et al. Lactobacillus and bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles. Gastroenterology. 2005;128:541-551.
- Urbanska AM, Paul A, Bhathena J, Prakash S. Suppression of tumorigenesis: modulation of inflammatory cytokines by oral administration of microencapsulated probiotic yogurt formulation. Int J Inflam. 2010;2010:894972.
- Abbas Z, Yakoob J, Jafri W, et al. Cytokine and clinical response to Saccharomyces boulardii therapy in diarrhea-dominant irritable bowel syndrome: a randomized trial. Eur J Gastroenterol Hepatol. 2014;26:630-639 .
- Gareau MG, Jury J, MacQueen G, et al. Probiotic treatment of rat pups normalises corticosterone release and ameliorates colonic dysfunction induced by maternal separation. Gut. 2007;56:1522-1528.
- Bravo JA, Forsythe P, Chew MV, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci USA. 2011;108:16050-16055.
- Savignac HM, Tramullas M, Kiely B, et al. Bifidobacteria modulate cognitive processes in an anxious mouse strain. Behav Brain Res. 2015;287:59-72.
- Distrutti E, O’Reilly JA, McDonald C, et al. Modulation of intestinal microbiota by the probiotic VSL#3 resets brain gene expression and ameliorates the age-related deficit in LTP. PLoS One. 2014;9:e106503.
- Ligaarden SC, Farup PG. Low intake of vitamin B6 is associated with irritable bowel syndrome symptoms. Nutr Res. 2011;(5):356-61.
- Inturri R, Stivala A, Furneri PM, Blandino G. Microbiological characteristics of the probiotic strains B. Longum BB536 and L. Rhamnosus HN001 used in combination. Minerva Gastroenterol Dietol. 2015;61:191-7.
- Inturri R, Stivala A, Furneri PM, Blandino G. Growth and adhesion to HT-29 cells inhibition of Gram-negatives by Bifidobacterium longum BB536 e Lactobacillus rhamnosus HN001 alone and in combination. Eue Rev Med Pharma Sciences. 2016;20:4943-4949
Articole din ediţiile anterioare
Microbiota intestinală – o ţintă terapeutică raţională în colitele severe
Bolile inflamatorii intestinale sunt boli cronice, care afectează un număr tot mai mare de indivizi. Etiopatogenia acestor boli nu este clar stabil...
Locul probioticelor şi sinbioticelor în diareea asociată tratamentului cu antibiotice
Mecanismul principal al diareii asociate tratamentului cu antibiotice (DAA) şi al diareii cu Clostridium difficile este disbioza intestinală. Probi...
Disbioza cutanată – factor-cheie în dermatita atopică?
Dermatita atopică este o boală inflamatorie cutanată, caracterizată de perioade de exacerbare şi remisiune, ce afectează 15-30% dintre copii şi 2-1...
Microbiota intestinală schimbă paradigmele în sindromul intestinului iritabil
Sindromul intestinului iritabil (SII) este o afecțiune cronică ce se caracterizează prin dureri abdominale și modificări ale tranzitului intestinal...