High blood pressure (hypertension) is the most important factor in cardiovascular risk in the general population, affecting about a third of adults(1). Out of these, 30% have resistant hypertension, being comprised in a group of increased risk because of the potential target organ damage and cardiovascular complications(2). Sleep apnea syndrome (SAS) is represented by recurrent episodes of partial or complete obstruction of the upper airway(3). There is evidence that SAS is common among hypertensive patients, the percentage rising to 56%(4), being recognized as a secondary cause of hypertension. However, up to 80% of patients remain undiagnosed(5). SAS causes a cascade of side effects that influence blood pressure, including negative intrathoracic pressure, nocturnal hypoxemia, hypercapnia, which causes increased oxidative stress on the body, induction of inflammatory responses and endothelial damage. SAS treatment with continuous positive airway pressure (CPAP) during the night can reduce blood pressure(6).
Sindromul de apnee în somn - cauză a hipertensiunii arteriale secundare
First published: 06 februarie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Hipertensiunea arterială (HTA) este cel mai important factor de risc cardiovascular în populația generală, afectând aproximativ o treime din adulți(1). Dintre aceștia, 30% prezintă HTA rezistentă la tratament, fiind încadrați într-un grup de risc crescut din cauza posibilității leziunilor organelor-țintă și a complicațiilor cardiovasculare(2). Sindromul de apnee în somn (SAS) este reprezentat de episoade recurente de obstrucție parțială sau totală a căilor respiratorii superioare(3). Există dovezi că SAS este frecvent în rândul pacienților hipertensivi, cu procente ajungând până la 56%(4), fiind recunoscut ca o cauză secundară a HTA. Cu toate acestea, până la 80% din pacienți rămân nediagnosticați(5). SAS determină o cascadă de reacții adverse care influențează tensiunea arterială, printre care: presiune negativă intratoracică, hipoxemie nocturnă, hipercapnie care determină creșterea stresului oxidativ asupra corpului, inducerea reacțiilor inflamatorii și leziuni endoteliale. Tratamentul SAS cu presiune continuă pozitivă a căilor aeriene (CPAP) pe perioada nopții poate reduce tensiunea arterială(6).
Introducere
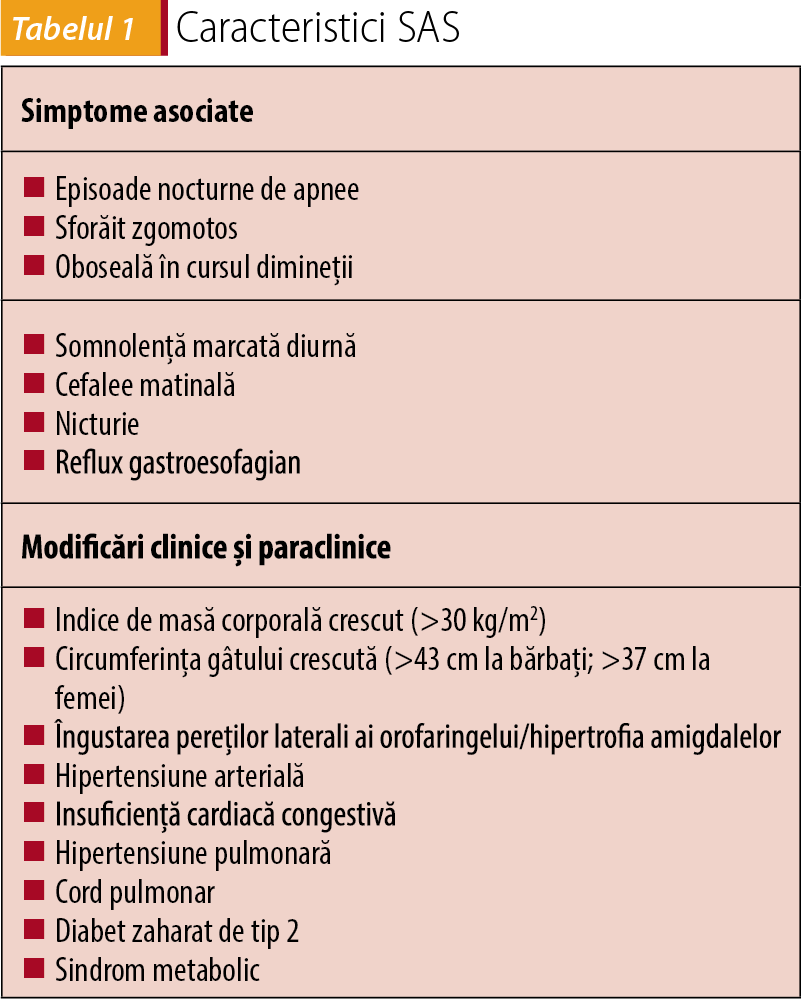
Afecțiunea, denumită sindrom de apnee în somn (SAS), reprezintă o tulburare de respirație asociată somnului, caracterizată prin episoade repetitive de flux inspirator redus sau apnee apărute din cauza obstrucției căilor respiratorii superioare în timpul somnului. Aceste episoade adesea trezesc bolnavul și împiedică un somn odihnitor. SAS este extrem de relevantă pentru pacienții cu HTA: aceste două condiții coexistă frecvent, iar dovezi recente sprijină ideea că apneea în somn reprezintă cel mai prevalent contributor la creșterea tensională în cadrul pacienților cu HTA rezistentă.
Există trei tipuri principale de apnee în somn, și anume:
- Apneea obstructivă, cea mai frecventă, care are loc atunci când musculatura gâtului se relaxează.
- Apneea centrală, care apare atunci când creierul nu trimite semnale corespunzătoare musculaturii care controlează respirația.
- Apneea mixtă, când ambele entități sunt prezente.
În funcție de numărul apneelor raportate prin index de apnee-hipopnee (IAH), SAS se clasifică în:
- SAS ușoară: 5-14 episoade/oră;
- SAS moderată: 15-60 episoade/oră;
- SAS severă: peste 30 episoade/oră.
Deși tehnicile de măsurare sau definiția poate varia, majoritatea studiilor au arătat că aproximativ 1 din 5 adulți prezintă cel puțin o formă ușoară de SAS, o creștere constantă datorată în principal creșterii obezității la nivel global. Cu toate acestea, 85% din pacienții cu simptome clinic semnificative nu au fost diagnosticați. În ciuda costului ridicat și a disponibilității reduse, polisomnografia (PSG) rămâne în continuare recomandarea principală de diagnostic, rezultând într-o discrepanță între cerere și capacitatea actuală a laboratoarelor de somnologie din România.
Când SAS a fost inițial documentat și diagnosticat ca afecțiune individuală, pacienții erau denumiți „de tip Pickwickian”, aceștia fiind bărbați de vârstă medie, cu obezitate morbidă și constant adormiți. Acest stereotip a influențat modul de depistare a pacienților cu SAS, ei fiind suprareprezentați de aceste caracteristici. Însă în prezent știm că SAS nu este rar la femei sau la persoanele normoponderale și este mult mai frecvent la persoanele în vârstă, comparativ cu cele de vârstă mijlocie.
Majoritatea persoanelor cu SAS și boală vasculară rămân nediagnosticate, în mare din cauza lipsei conștientizării medicilor despre această asociere. Toți pacienții hipertensivi, obezi sau care prezintă insuficiență cardiacă ar trebui chestionați de rutină despre SAS și, în cazul în care aceștia sunt simptomatici, trebuie recomandat un studiu de somn. Prin întrebări simple, ca „Adormiți des în timpul zilei?”, „Se întâmplă să sforăiți noaptea?” sau „Sunteți obosit dimineața când vă treziți?”, pot fi identificați marea majoritatea a pacienților cu această patologie.
Ghidul de HTA publicat în 2013 de către ESH/ESC în consens cu Societatea Europeană de Respirație (ERS) recunoaște sindromul obstructiv de apnee în somn ca fiind o cauză de HTA secundară, în special când este vorba de hipertensiune nocturnă. Din păcate însă, până în prezent, nu există trialuri controlate semnificative care să realizeze o analiză cost-eficiență a monitorizării variabilelor cardiovasculare și respiratorii la pacienții cu HTA rezistentă și se recomandă efectuarea unei monitorizări continue 24 de ore a tensiunii arteriale înaintea metodelor mai complexe. Terapia cu CPAP reprezintă procedura de ales în tratamentul SAS, însă efectele asupra tensiunii din ambulator sunt diminuate, probabil din cauza aderenței scăzute la o astfel de procedură(7).
Cu toate acestea, două studii prospective au raportat că subiecți normotensivi cu SAS urmăriți pe o perioadă de 12 ani au prezentat o creștere semnificativă a riscului de a dezvolta hipertensiune, iar riscul apariției HTA nou depistate a fost mai mic la subiecții tratați cu CPAP(8).
HTA rezistentă și SAS
Conform literaturii de specialitate, aproximativ 50-60% din pacienții cu SAS (exprimat clinic ca indicele de apnee/hipopnee; AHI) suferă de HTA. La acești pacienți, patogeneza hipertensiunii pare a fi multifactorială, prin creșterea sistemului nervos simpatic, ceea ce duce la creșterea tensiunii arteriale ca urmare a debitului cardiac crescut, a rezistenței vasculare și retenției de lichide secundar hipoxiei tisulare. Gonzaga et al., care au investigat prevalența hiperaldosteronismului primar și a apneei obstructive de somn la pacienții cu HTA rezistentă, au găsit SAS la 84% din pacienții cu hiperaldosteronism primar și la 74% din pacienții cu niveluri ale aldosteronului normale(9). Un alt studiu, semnat de Pedrosa et al., asupra cauzelor comune de HTA secundară, care a inclus 120 de pacienți cu HTA rezistentă, a găsit ca și cauze de SAS (64% dintre pacienți) hiperaldosteronism primar (5,6% din cazuri) și stenoză de arteră renală (2,4%)(10). Relația dintre SAS și HTA rezistentă este confirmată de studii care arată că utilizarea tratamentului cu CPAP reduce tensiunea arterială. S-a observat că pacienții hipertensivi tratați prin CPAP obțin un control tensional mai bun.
Cheia descifrării conexiunii dintre SAS și HTA stă în eliminarea variabilelor prezente, în special obezitatea și vârsta. Două studii longitudinale, prospective de cohortă, au abordat acest subiect având subiecți normotensivi și au ajuns la concluzii opuse: primul studiu a raportat că, după ajustarea pentru variabilele relevante, SAS nu a fost asociat cu HTA (1.180 de subiecți urmăriți în medie 7,5 ani)(11). Al doilea studiu (1.889 de participanți, urmăriți în medie 12,2 ani) a identificat un risc crescut de HTA la pacienții cu SAS, comparativ cu subiecții de control, iar în acest al doilea studiu, asociația SAS-HTA a rămas independentă de alți factori de risc, inclusiv vârsta și obezitatea. Mai mult decât atât, urmărirea pacienților din această cohortă a arătat o relație dependentă de doză între severitatea SAS și incidența HTA, oferind dovezi epidemiologice solide care implică SAS ca factor în dezvoltarea HTA(12).
Mecanisme fiziopatologice
Cauzele fiziopatologice ale SAS variază considerabil la fiecare individ. Printre componentele importante se regăsesc anatomia căilor respiratorii superioare, posibilitatea mușchilor dilatatori ai căilor respiratorii superioare de a răspunde la respirație în timpul somnului, stabilitatea sistemului respirator de control și potențialul de schimbare în volumele pulmonare.
Mecanismele posibile prin care SAS contribuie la HTA la persoanele obeze includ activarea simpatică, hiperleptinemia, rezistența la insulină, niveluri crescute de angiotensină II și aldosteron, stres oxidativ și inflamator, disfuncție endotelială, funcția baroreflex alterată și, probabil, efectele asupra funcției renale. Coexistența SAS cu obezitatea poate avea implicații mai extinse pentru controlul cardiovascular și poate contribui la o parte din gruparea modificărilor definite în sens larg ca sindrom metabolic. Din perspective clinice și terapeutice, prezența hipertensiunii rezistente și absența unei scăderi nocturne a tensiunii arteriale la persoanele obeze ar trebui să determine medicul să ia în considerare diagnosticul de SAS, mai ales dacă sunt prezente simptome clinice sugestive (calitatea slabă a somnului, apnee asistată, somnolență excesivă în timpul zilei și așa mai departe)(13).
a. Obezitatea
Deși este clar că obezitatea este un important factor de risc pentru dezvoltarea SAS, iar scăderea în greutate duce la ameliorarea severității SAS, mecanismele fiziologice rămân mai puțin clare. Depunerile de grăsime perifaringiene pot crește gradul de colaps al căilor aeriene. O altă explicație pentru relația dintre obezitate și SAS o reprezintă volumele respiratorii scăzute, în special capacitatea reziduală funcțională, care e mult scăzută la persoanele obeze. Depunerile de grăsime din jurul abdomenului duc la reducerea capacității reziduale funcționale, care determină reducerea volumului pulmonar al căilor aeriene superioare. Volumele pulmonare scăzute sunt, de asemenea, asociate cu o capacitate vitală scăzută, ceea ce ar contribui la instabilitatea controlului ventilator(14). Căile respiratorii pot fi, de asemenea, îngustate la pacienții obezi, ca rezultat al compresiei externe date de masele de grăsime localizate superficial, și asta ar explica corelația dintre circumferința gâtului crescută și riscul de SAS.
b. Funcția renală
Alterările în hemodinamica funcției renale joacă un rol important în HTA indusă de obezitate, în special în obezitate centrală. Aceasta este asociată cu retenția de sodiu și creșterea volumelor, ca urmare a alterării presiunii natriurezei și creșterii reabsorbției tubulare. Mecanismele exacte ale acestor alterări sunt neclare, dar pot fi legate de activarea sistemului nervos simpatic și a sistemului renină-angiotensină. Cu toate că este încă nedovedit, nu putem exclude faptul că, atunci când se asociază, SAS contribuie la acest proces prin creșterea activității simpatice sau prin creșterea rezistenței la insulină(15). Un aspect al funcției renale în HTA indusă de obezitate este reprezentat de compresia mecanică a rinichiului, care este legat de prezența unei capsule de grăsime extrarenale, ce poate pătrunde în hilul și sinusurile renale. Este posibil ca SAS să influențeze într-o anumită măsură acumularea de grăsime viscerală la acești indivizi(16).
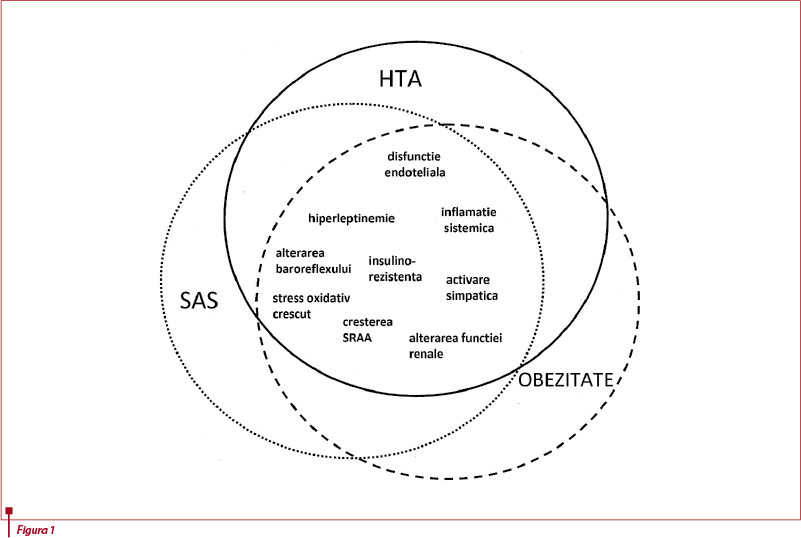
Studii recente au demonstrat că stresul oxidativ asupra vaselor sanguine și rinichilor este implicat în patologia hipertensiunii. Acesta determină vasoconstricție cu blocarea sau inactivarea sintezei de oxid nitric, activarea receptorilor angiotensinei II și tromboxanilor și creșterea producției de endotelina-1. În același timp, există date care sugerează că stresul oxidativ este caracteristic pentru apneea în somn; astfel, dacă SAS exercită un efect aditiv, sinergetic sau redundant în determinarea HTA rămâne de văzut(17).
c. Efecte hemodinamice
Episoadele de SAS produc hipercapnie, oscilații ale presiunii intratoracice și, în cele mai multe cazuri, întreruperea somnului. Presiunile intratoracice negative generate în timpul efortului respirator obstrucționat produc scăderi ale volumului bătaie al ventriculului stâng. Debitul cardiac scade în timpul apneei obstructive, secundar volumului bătaie și frecvenței cardiace scăzute.
Episoadele repetitive ale îngustării sau ocluziei căilor aeriene superioare determină factori de stres, cum ar fi hipoxia și reoxigenarea, modificări ale presiunii intratoracice și stimularea sistemului nervos simpatic. Aceste mecanisme, printre altele, sunt asociate cu creșterea vasoconstricției periferice și duc la HTA în timpul somnului. În mod normal, tensiunea arterială scade în timpul nopții la indivizii sănătoși (model „dipping”), însă acest model este modificat la cei cu SAS. HTA din timpul nopții poate reflecta un risc cardiovascular crescut, cu o rată mai mare a evenimentelor cardiovasculare.
Baroreflexul joacă un rol esențial în reglarea tensiunii arteriale. Alterarea funcției baroreflexe poate juca un rol important în fiziopatologia bolilor cardiovasculare, inclusiv HTA. Mai multe studii au descoperit că acesta poate fi redus la persoanele obeze, iar această reducere este în legătură directă cu nivelurile de grăsime viscerală.
Pacienții cu SAS au variabilitatea ritmului cardiac alterată și variabilitatea tensiunii arteriale crescută, ambele fiind asociate cu disfuncția baroreflexă. Deprecierea baroreflexă a fost într-adevăr demonstrată în OSA. Prin urmare, afectarea funcției baroreflexe poate fi un potențial mecanism care leagă SAS la un risc crescut de HTA(18).
d. Disfuncția endotelială
Consecințele unei disfuncții endoteliale în SAS includ scăderea producerii de oxid nitric. Niveluri mai scăzute ale oxidului nitric se găsesc la pacienții cu SAS, cu creșterea acestuia după tratamentul cu CPAP. Disfuncția endotelială și inhibarea producerii de oxid nitric pot fi implicate în HTA indusă de SAS, iar scăderea tensiunii arteriale după terapia cu CPAP poate fi legată de îmbunătățirea funcției endoteliale.
Factorii implicați în fiziopatologia apneei obstructive în somn sunt:
- Factori generali: antropometrici (sex masculin, vârstă, obezitate), medicamente (hipnotice, etanol).
- Scăderea calibrului căilor respiratorii superioare: modificări anatomice (amigdale mărite, polipi nazali), obstrucție nazală (deviație de sept).
- Factori mecanici: rezistență sau complianță crescută la nivelul căilor respiratorii superioare.
- Funcția musculaturii căilor respiratorii superioare: dilatarea anormală a activității mușchilor respiratori, alterarea relației dintre contracția diafragmatică și musculatura respiratorie.
- Reflexele căilor respiratorii superioare: alterarea răspunsului la presiunea negativă, alterarea feedback-ului pulmonar.
- Factori centrali: răspuns ventilator inadecvat în timpul somnului.
- Treziri: hiperventilație postapneică(19).
Relația dintre durata somnului și hipertensiune
Cantitatea și calitatea somnului arată tendințele actuale ale societății moderne, care necesită din ce în ce mai multe ore de muncă și care, împreună cu o disponibilitate continuă a produselor și serviciilor, determină o reducere a duratei medii a somnului. Această tendință crește preponderent cu gradul de dezvoltare economică, ducând la creșterea fenomenelor de fatigabilitate și somnolență diurnă excesivă(20).
Lipsa de somn exercită efecte dăunătoare asupra unei varietăți de sisteme cu modificări semnificative la nivel metabolic, endocrin și în cadrul sistemului imun, determinând reacții adverse asupra sănătății, incluzând diabet zaharat de tip 2, HTA, tulburări respiratorii și obezitate(21).
Calitatea și cantitatea somnului autoraportate au fost asociate cu tensiunea arterială în numeroase studii; unul dintre aceste studii a fost realizat pe 238 de adolescenți și a constatat că eficiența scăzută a somnului, dar nu și durata, a fost semnificativ asociată cu stări prehipertensive(22).
Studiul NHANES I (The National Health and Nutrition Examination Survey I) a arătat că, pe o perioadă de 10 ani de follow-up, într-o populație de vârstă medie, durata somnului raportată de către participanți a fost sub 7 ore pe noapte. În plus, aceasta a fost asociată cu un indice de masă corporală mai mare și cu o probabilitate crescută de obezitate, comparativ cu cei care au raportat peste 7 ore de somn(23). Deși nu este exclus ca apariția HTA să fie mediată în mare parte de obezitate, există date experimentale și observaționale care implică lipsa somnului ca un factor de risc independent pentru HTA. Această ipoteză are o explicație biologică, expunerea la un sistem nervos simpatic activat suplimentar din cauza timpului treaz prelungit având un efect cumulativ tensional, în timp ce efectele protectoare ale scăderii simpatetice din timpul nopții sunt reduse(24).
SAS este o cauză importantă de alterare a calității somnului. Mai multe studii au arătat corelații pozitive între privarea de somn și diverși factori de risc cardiovascular: rigiditatea arterială, disfuncția endotelială, activitatea simpatică sau modelul de non-dipping tensional nocturn(25).
Unul dintre cele mai întâlnite semne ale apneei obstructive în somn este sforăitul zgomotos, persistent. La acesta se pot adăuga și perioade scurte de apnee, care pot fi sesizate fie de către pacient, fie de persoane apropiate. Însă nu toți cei care sforăie au apnee în somn, iar de asemenea există persoane cu SAS care nu sforăie.
Un alt simptom comun este somnolența diurnă, care este direct proporțională cu severitatea apneei. Printre alte semne și simptome găsim cefalee matinală și gât uscat la trezire sau un somn agitat cu frecvente treziri, dar și depresie, iritabilitate sau modificări de personalitate.
Este important de reținut că apneea în somn poate apărea și la copii, cauzând cel mai frecvent hiperactivitate, performanțe școlare scăzute sau comportament agresiv. Copiii cu apnee în somn respiră de obicei pe gură, nu pe nas, în timpul somnului, și astfel sforăitul poate lipsi. Creșterea prevalenței obezității la copii a dus și la o creștere a sforăitului, cu o incidență de 10% în rândul copiilor preșcolari, cu scăderea frecvenței după vârsta de 9 ani(26).
Metode de diagnostic al SAS
Diagnosticul SAS necesită o polisomnografie (PSG) pentru a depista evenimentele apneice și hipoapneice. Aceasta se poate realiza într-un laborator de somnologie, unde se monitorizează atent timpul și stadiul somnului, efortul respirator, fluxul aerian, frecvența cardiacă, oximetria și mișcarea membrelor. Indexul de apnee-hipopnee (AHI) reprezintă numărul de episoade apneice raportate într-o oră.
În mod normal, sindromul obstructiv de apnee în somn este definit pentru un IAH de 5 sau mai mare, în asociere cu alte simptome (somnolență diurnă, oboseală, cefalee matinală, sforăit), sau un IAH de 15 sau mai mult, indiferent de simptomele asociate.
Este important de menționat că PSG se poate realiza și cu aparate portabile direct acasă la pacient, putându-se monitoriza episoadele apneice, frecvența cardiacă, oximetria etc.
Din cauza prevalenței crescute și a efectelor negative semnificative asupra sănătății, nu există nici o îndoială că SAS reprezintă o problemă de sănătate publică, atât pe termen scurt, cât și lung. Cu toate că procentul celor nediagnosticați este încă mare, din ce în ce mai mulți pacienți sunt depistați și tratați pentru această patologie, făcând dificilă monitorizarea și urmărirea de către medicii specialiști. Prin urmare, există o nevoie de a implica medicii de medicină de familie și alte specialități (medici interniști, cardiologi, nutriționiști) în depistarea precoce a acestor pacienți.
Ca și în cazul altor probleme de sănătate publică, cum ar fi obezitatea și diabetul, medicul de familie trebuie să dobândească cunoștințe și experiență suficientă atât pentru a depista și trimite un pacient cu suspiciune de SAS la specialistul adecvat, cât și să efectueze un follow-up minimal, indiferent dacă pacientului i-a fost prescris sau nu un tratament cu CPAP.
În 1999, Kramer și colab.(27) au realizat un studiu legat de rolul medicului de familie în recunoașterea SAS. S-a observat că 96% dintre pacienții trimiși către un specialist în somn de către medicul de familie au fost diagnosticați ca suferind de SAS. Într-un procent ridicat al acestor pacienți, SAS a fost severă (medie IAH: 44,2) și extrem de simptomatică (obezitate manifestă (IMC: 37,9 kg/mp), sforăit cronic (93%), hipersomnie excesivă (91%) și apneei raportate (64%). Autorii au ajuns la concluzia că numai acei pacienți cu un fenotip foarte clar sunt trimiși către un specialist și că acest lucru nu se aplică în cazurile atipice, în special la femei și vârstnici sau la cei cu probleme cardiovasculare. Una dintre concluzii a fost că majoritatea celor trimiși la specialistul în somn aparțineau unui număr mic de medici (72% dintre medicii de familie participanți au trimis doar un pacient); discrepanța nu poate fi explicată decât prin necesitatea de creștere a conștientizării acestui subiect prin sesiuni și cursuri complexe despre patologia și metodele de depistare a SAS.
În 2014, Colegiul American al Medicilor a publicat un ghid de practică clinică pentru apneea de somn obstructivă la adulți. Au fost utilizate 47 de studii cu privire la folosirea chestionarelor comparativ cu polisomnografia (PSG) în diagnostic, iar 18 studii de tip „low-quality” au adus dovezi care să susțină Chestionarul Berlin ca un ajutor în estimarea riscului de apnee de somn obstructivă. Cu toate acestea, sensibilitatea și specificitatea chestionarului au fost scăzute, din cauza nivelului de semnificație al IAH diferit. Alte studii care au descris ESS (22 de studii), indexul de predicție multivariată a apneei (3 studii), indexul Pittsburgh de calitate a somnului (3 studii) și chestionarul STOP-BANG (5 studii) au arătat că aceste chestionare nu au avut precizie suficientă pentru diagnostic(28).
Cu toate că diagnosticul standard al SAS necesită studii de polisomnografie, folosirea pulsoximetrului nocturn acasă este o bună metodă de screening al pacienților cu probleme respiratorii datorate somnului, având o probabilitate pre-test crescută. Un test pozitiv va indica cel mai probabil prezența apneei în somn, dar un test negativ are valoare predictivă negativă scăzută. Însă noi tehnici, implementate la pacient acasă, în scop de diagnostic și screening, sunt din ce în ce mai frecvente.
Chestionarele de somn, ca de exemplu ESS, ajută în evaluarea severității SAS, dar nu pot evalua IAH (o componentă necesară, dar insuficientă a SAS) și nu au suficientă sensibilitate și specificitate pentru a înlocui un studiu polisomnografic în diagnosticul SAS.
Există metode standardizate de evaluare rapidă a riscului de apnee în somn, cum ar fi Scala de Somnolență Epworth, care printr-un set de întrebări oferă o metodă rapidă de evaluare a oboselii, iar recent au fost dezvoltate noi aplicații pentru platformele mobile, care simplifică mult algoritmul de diagnostic și cresc rata de depistare a pacienților cu SAS (http://sasscore.appspot.com/).
În practica curentă este important un diagnostic rapid, astfel ca medicii din orice specialitate să poată trimite un pacient suspect de SAS pentru un consult de specialitate. Este necesar, astfel, un protocol care să nu ocupe mult timp și care acoperă toate caracteristicile de bază ale unui pacient suspect de SAS. Acest protocol poate clasifica pacientul ca având un risc crescut, moderat sau scăzut de SAS, cu posibilitatea recomandării unei investigații suplimentare, fie în mod preferențial, fie urgent(30).

Tratamentul sindromului obstructiv de apnee în somn
Pentru o persoană obeză care suferă de SAS, cel mai simplu tratament este să scadă în greutate, ceea ce duce la o îmbunătățire a apneei în somn. De asemenea, există multiple opțiuni terapeutice țintite să îmbunătățească SAS, printre care diferite proteze sau intervenții chirurgicale, care însă nu și-au dovedit științific eficiența. Nu există medicație care să trateze sau să îmbunătățească SAS.
Cel mai eficient tratament pentru apneea severă este terapia cu CPAP (continuous positive airway pressure), unde aerul din încăpere este luat și suflat cu o presiune pozitivă în căile aeriene pe toată durata nopții. Dispozitivele sunt pompe electrice mici, care trimit aerul printr-un furtun și o mască de plastic la nivelul nasului și al gurii. Acesta deschide căile respiratorii, în special la nivelul faringelui, prevenind colapsul țesutului moale(29).
Aderența la tratamentul cu CPAP este o problemă critică, rata ei variind între 30% și 60%, aceasta determinând scăderea efectului terapeutic, mulți pacienți rămânând la risc crescut de a dezvolta comorbidități cardiovasculare.
Bibliografie
2. Calhoun DA, Jones D, Textor S, Goff DC, Murphy TP, Toto RD, White A, Cushman WC, White W, Sica D, Ferdinand K, Giles TD, Falkner B, Carey RM; American Heart Association Professional Education Committee. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Hypertension. 2008;51:1403–1419.
3. Bradley TD, Floras JS. Obstructive sleep apnea and its cardiovascular consequences. Lancet. 2009;373:82–93.
4. Drager LF, Genta PR, Pedrosa RP, Nerbass FB, Gonzaga CC, Krieger EM, Lorenzi-Filho G. Characteristics and predictors of obstructive sleep apnea in patients with systemic hypertension. Am J Cardiol. 2010;105:1135–1139.
5. The epidemiology of adult obstructive sleep apnea. Proc Am Thorac Soc. 2008, 5 (2): 136-143. 10.1513/pats.200709-155MG.
6. Lozano L, Tovar JL, Sampol G, Romero O, Jurado MJ, Segarra A, Espinel E, Ríos J, Untoria MD, Lloberes P. Continuous positive airway pressure treatment in sleep apnea patients with resistant hypertension: a randomized, controlled trial. J Hypertens. 2010;28:2161–2168.
7. Giuseppe Mancia, Robert Fagard, Krzysztof Narkiewicz. 2013 ESH/ESC Guidelines for the management of arterial hypertension European Heart Journal Jul 2013, 34 (28) 2159-2219.
8. Marin JM, Agusti A, Villar I, Forner M. Association between treated and untreated obstructive sleep apnea and risk of hypertension. JAMA 2012;307:2169-2176.
9. Gonzaga CC, Gaddam KK, Ahmed MI: Severity of obstructive sleep apnoea is related to aldosterone status in subjects with resistant hypertension. JCSM 2010, 6, 4, 363–368.
10. Pedrosa RP, Drager LF, Gonzaga CC, Sousa MG, de Paula LK, Amaro AC, Amodeo C, Bortolotto LA, Krieger M, Bradley TD, Lorenzi-Filho G: Obstructive sleep apnoea: the most common secondary cause of hypertension associated with resistant hypertension. Hypertension 2011, 58, 811–817.
11. Cano-Pumarega I, Duran-Cantolla J, Aizpuru F, Miranda-Serrano E, Rubio R, Martinez-Null C, de Miguel J, Egea C, Cancelo L, Alvarez A, Fernandez-Bolanos M, Barbe F. Obstructive sleep apnea and systemic hypertension: Longitudinal study in the general population: The vitoria sleep cohort. Am J Respir Crit Care Med. 2011;184:1299–1304.
12. Marin JM, Agusti A, Villar I, Forner M, Nieto D, Carrizo SJ, Barbe F, Vicente E, Wei Y, Nieto FJ, Jelic S. Association between treated and untreated obstructive sleep apnea and risk of hypertension. JAMA. 2012;307:2169–2176.
13. Wolk R, Shamsuzzaman AS, Somers VK. Obesity, sleep apnea, and hypertension. Hypertension. 2003 Dec;42(6):1067-74.
14. Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA 2000;284:3015–3021.
15. Punjabi NM, Sorkin JD, Katzel LI, Goldberg AP, Schwartz AR, Smith PL. Sleep-disordered breathing and insulin resistance in middle-aged and overweight men. Am J Respir Crit Care Med. 2002; 165: 677–682.
16. Hall JE, Brands MW, Henegar JR. Mechanisms of hypertension and kidney disease in obesity. Ann N Y Acad Sci. 1999; 892: 91–107.
17. Dyugovskaya L, Lavie P, Lavie L. Increased Adhesion Molecules Expression and Production of Reactive Oxygen Species in Leukocytes of Sleep Apnea Patients. Am J Respir Crit Care Med. 2002; 165: 934–939.
18. Narkiewicz K, Montano N, Cogliati C, van de Borne PJ, Dyken ME, Somers VK. Altered cardiovascular variability in obstructive sleep apnea. Circulation. 1998; 98: 1071–1077.
19. P.C. Deegan, W.T. McNicholas, Pathophysiology of obstructive sleep apnea, Eur Respir J, 1995, 8, 1161–1178.
20. Akerstedt T, Nilsson PM. Sleep as restitution: an introduction. J Intern Med 2003;254:6-12.
21. Cappuccio FP, D'Elia L, Strazzullo P, Miller MA. Sleep duration and all-cause mortality: a systematic review and meta-analysis of prospective studies. Sleep 2010;33:585-592.
22. Javaheri S, et al. Sleep quality and elevated blood pressure in adolescents. Circulation. 2008;118:1034–1040.
23. Gangwisch JE, Malaspina D, Boden-Albala B, et al. Inadequate sleep as a risk factor for obesity: Analyses of the NHANES I. Sleep. 2005;28(10):1289–1296.
24. Egan BM. Sleep and hypertension: burning the candle at both ends really is hazardous to your health. Hypertension. 2006;47(5):816–817.
25. Sunbul M, Kanar BG, Durmus E, Kivrak T, Sari I. Acute sleep deprivation is associated with increased arterial stiffness in healthy young adults. Sleep Breath. 2014 Mar; 18(1):215-20.
26. Corbo GM, Forastiere F, Agabiti N. Snoring in 9- to 15-year old children: risk factors and clinical relevance. Pediatrics 2001;108:1149-1154.
27. Kramer NR, Cook TE, Carlisle CC, Corwin RW, Millman RP. The role of the primary care physician in recognizing obstructive sleep apnea. Arch Intern Med 1999; 159: 956–968.
28. Qaseem A, Dallas P, Owens DK, Starkey M, Holty JE, Shekelle P; Clinical Guidelines Committee of the American College of Physicians. Diagnosis of obstructive sleep apnea in adults: a clinical practice guideline from theAmerican College of Physicians. Ann Intern Med. 2014 Aug 5;161(3):210-20.
29. McDaid C, Griffin S, Duree K, et al. Continuous positive pressure devices for the treatment of obstructive sleep apnoes-hipopnoes syndrome: a systematic review and economic analysis. Health Technol Assess. 2009 Jan;13 (4): 1-119, 143-274.
30. M.A. Martínez-García, P. Catalán Serra. Is sleep apnoea a specialist condition? The role of general practitioners. Breathe Dec 2010, 7 (2) 144-156.
Articole din ediţiile anterioare
Infecţiile piciorului diabetic
Infecţiile piciorului diabetic (IPD) reprezintă cele mai comune probleme pe care le întâmpină pacientul diabetic, reprezentând o complicaţie cos...
Evaluarea clinică şi managementul cefaleei pacientului pediatric
Cefaleea este una din patologiile frecvent întâlnite în practica medicală şi unul din simptomele obişnuite de prezentare a pacienţilor pediatric...
Sindromul dureros de fosă iliacă dreaptă
Definit ca durerea resimţită de pacient în regiunea abdominală inferioară dreaptă, sindromul dureros de fosă iliacă dreaptă (SDFID) se asociază ade...
Hipertensiunea arterială. Ce aduc nou ghidurile actualizate?
Ghidurile de practică medicală (de diagnostic şi management) au, istoric, o dinamică aparte. Noi variante revizuite sunt publicate de societăţile...