PPPD, or 3PD, is a syndrome that defines a functional chronic vestibular manifestation characterized by the sensation of dizziness, postural instability and non-rotatory vertigo. The complaints are aggravated by orthostatism, active or passive movement and by complex visual stimuli. The symptomatology is fluctuating in appearance and intensity but persistent, and it frequently sets in after an acute vestibular imbalance on an anxious ground, significantly influencing the daily activity by perpetuating maladaptive balancing schemes. The current work aims to synthesize the existing data from the specialty literature for a simplified description of this syndrome.
Tendinţe în patologia vestibulară: ameţeala posturală perceptuală persistentă (PPPD)
Trends in vestibular pathology: persistent postural perceptual dizziness (PPPD)
First published: 28 noiembrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/ORL.57.4.2022.7288
Abstract
Rezumat
PPPD, sau 3PD, este un sindrom ce defineşte o manifestare vestibulară cronică funcţională, caracterizată prin senzaţia de ameţeală, instabilitate posturală şi vertij nonrotator. Acuzele sunt agravate de ortostatism, de mişcarea activă ori pasivă şi de stimuli vizuali complecşi. Simptomatologia este fluctuantă ca apariţie şi intensitate, dar persistentă, se instalează frecvent după un dezechilibru vestibular acut pe un teren anxios şi influenţează semnificativ activitatea cotidiană prin perpetuarea unor scheme de echilibrare maladaptative. Lucrarea de faţă îşi propune să sintetizeze datele existente în literatura de profil pentru o descriere simplificată a acestui sindrom.
Ce înseamnă?
PPPD, sau 3PD, este prescurtarea de la persistent postural-perceptual dizziness – în traducere, ameţeală posturală perceptuală persistentă. Este un sindrom definit recent, din necesitatea de a include sub umbrela unui diagnostic o serie de manifestări vestibulare cronice funcţionale care împărtăşesc un pattern similar. Ameţeala/vertijul postural perceptual persistent (PPPD) a fost inclus în anul 2017 în a 11-a ediţie a Clasificării Internaţionale a Tulburărilor Vestibulare (ICVD)(1).
Cât este de frecventă?
Datele epidemiologice din literatura de specialitate sunt puţine şi vor deveni mai concludente pe măsură ce lumea medicală se va familiariza cu această patologie. Deşi PPPD a fost definită ca entitate în 2017, au existat precursori ai acestui sindrom care nu au simptomatologie identică, dar au multe caracteristici comune cu 3PD. Aceşti precursori sunt: agorafobia, descrisă iniţial în 1870; răul de mişcare; vertijul vizual; vertijul postural fobic; ameţeala cronică subiectivă(3).
Observaţiile clinice publicate de Dieterich şi Staab, într-o lucrare din 2017, estimau că, în centrele de neurootologie, patologia vestibulară funcţională se ridică la aproximativ 10% din prezentările pentru sindroame vertiginoase(2).
Cum o recunosc?
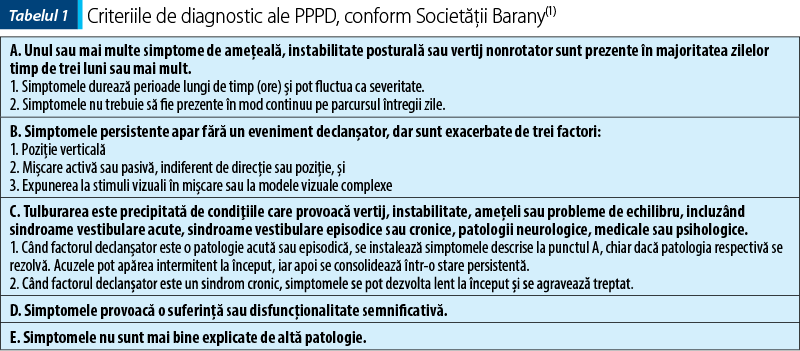
Pentru diagnosticul pozitiv al PPPD, Societatea Barany a publicat în 2017 criteriile de diagnostic ale acestei afecţiuni, cu menţiunea că toate cele cinci criterii sunt obligatorii.
Tabelul 1 redă criteriile diagnostice preluate din publicaţia Comitetului pentru clasificarea disfuncţiilor vestibulare a Societăţii Barany.
Acuzele sunt: ameţeală, instabilitate, falsă senzaţie de mişcare a propriei persoane sau a mediului înconjurător, agravate de ortostatism sau de mişcare (a propriei persoane sau a mediului).
Pentru a explica termenii:
-
Mişcare activă se referă la mişcarea propriei persoane – mersul, alergarea etc.
-
Mişcarea pasivă este mişcarea mediului înconjurător faţă de persoana care este într-o poziţie fixă; de exemplu, un pasager într-un mijloc de transport, călărit(1).
-
Stimulii vizuali complecşi pot fi modele încărcate ale pardoselii, culoarul plin de diverse mărfuri ale unui supermarket etc. (figurile 1 şi 2).
-
Stimulii vizuali în mişcare pot fi exemplificaţi de traficul aglomerat, mulţimi de oameni aflaţi în mişcare, imagini care se schimbă rapid – urmăriri cu maşini în filme (figura 3).
-
Simptomele trebuie să fie prezente cel puţin 15 zile pe lună; majoritatea pacienţilor descriu manifestările aproape zilnic, mai accentuate la sfârşitul zilei. Unii pacienţi descriu episoade simptomatice de ordinul secundelor, fără un factor declanşator(1,4).
Activităţile care necesită concentrare vizuală, cum ar fi lucrul la calculator sau privitul la televizor, pot agrava acuzele chiar dacă pacientul rămâne nemişcat(5). Dacă expunerea prelungită la stimuli vizuali complecşi este corelată cu ameţeala şi instabilitatea, chiar şi o stimulare vizuală de scurtă durată, pasageră, poate agrava simptomatologia pentru o durată semnificativă de timp, de ordinul orelor(6).



Deşi în istoric descoperim în majoritatea cazurilor o patologie vestibulară acută, fie periferică (VPPB, neuronită vestibulară), fie centrală (migrenă vestibulară), factorul declanşator poate să nu fie de natură vestibulară. Un atac de panică sau o tulburare anxioasă ce include în spectrul manifestărilor ameţeală, contuziile cerebrale, contuziile coloanei cervicale sau alte patologii ce provoacă instabilitate posturală, ameţeală sau tulburări de echilibru, inclusiv aritmiile sau efectele adverse medicamentoase, pot fi incriminate în apariţia 3PD(7). Rareori, pacienţii cu boală Parkinson sau altă patologie neurologică organică, precum bolile cerebeloase degenerative, pot dezvolta tulburări funcţionale(8). Bolile cu progresie în timp, precum cele degenerative şi disfuncţiile sistemului autonom, duc la instalarea lentă a manifestărilor PPPD, încât nu putem identifica mereu episodul cauzal(9).
După instalarea 3PD, senzaţia de ameţeală persistă, chiar dacă patologia iniţială este vindecată, şi nu necesită un factor declanşator evident(10).
Dacă patologia acută organică, considerată de obicei factorul declanşator al 3PD, are caracter episodic şi/sau recurent, cum este situaţia VPPB sau a migrenei vestibulare, şansele de instalare a 3PD cresc; în plus, tulburările funcţionale pot coexista cu patologia vestibulară organică(9,13).
Persoanele anxioase, cu personalitate nevrotică şi introvertită, au prezentat un risc crescut pentru dezvoltarea tulburărilor funcţionale în urma unui eveniment acut declanşator, comparativ cu restul pacienţilor. Inclusiv istoricul familial de tulburări anxioase a fost considerat un factor de risc(11).
În încercarea de a stabili relaţia dintre anxietate şi PPPD, Staab et al., într-un studiu efectuat la 132 de pacienţi, au descris trei situaţii cu o prevalenţă aproximativ egală:
-
tulburările anxioase au fost cauza manifestărilor vestibulare;
-
patologia neurootologică (neuronita vestibulară, VPPB şi migrena fiind cel mai frecvent întâlnite) a survenit pe un teren de tulburări psihice preexistente pe care le-a exacerbat;
-
patologia neurootologică a declanşat tulburări anxios-depresive de novo(12).
Anamneza atentă poate orienta spre una din situaţiile menţionate. Indiferent dacă este o anxietate otogenă (un dezechilibru organic acut, urmat de ameţeală şi instabilitate reziduală, ce declanşează anxietatea), o ameţeală psihogenă (ameţeala fiind o manifestare a sindromului anxios) sau o suprapunere a acestor două condiţii, 3PD şi sindromul anxios se potenţează reciproc, într-un cerc vicios ce trebuie întrerupt.
DHI (Dizziness Handicap Inventory) este un chestionar cu 25 de întrebări, utilizat frecvent pentru evaluarea impactului fizic, emoţional şi funcţional pe care ameţeala şi simptomatologia vestibulară le au asupra calităţii vieţii pacientului(14).
Necesitatea îndeplinirii tuturor celor cinci criterii de diagnostic pentru 3PD atrage atenţia asupra unei potenţiale greşeli, aceea de a clasifica drept 3PD sindroame vertiginoase nespecifice sau pe care nu le putem încadra în niciuna dintre patologiile vestibulare cunoscute. Pentru aceste situaţii, reevaluarea pacientului după o perioadă de timp poate clarifica o situaţie incertă. 3PD nu este un diagnostic de excludere(3).
Ce altceva poate fi?
Diagnostic diferenţial sau potenţiale erori de diagnostic
Din criteriile de diagnostic, putem observa că 3PD este un diagnostic clinic şi că anamneza are o deosebită importanţă. Ţinând cont de ultimul criteriu de diagnostic – simptomatologia nu este explicată mai bine de altă patologie –, este necesară excluderea altor patologii vestibulare, psihiatrice, autonome sau neurologice, pentru care sunt necesare o serie de investigaţii clinice, paraclinice, imagistice şi testări vestibulare.
Diferenţierea altor patologii ce se pretează la un diagnostic diferenţial cu PPPD se face pe baza anamnezei, a examenului clinic, a testărilor vestibulare în cazul în care suspectăm o altă patologie sau o suprapunere a două patologii. Imagistica cerebrală şi a coloanei cervicale, ecografia Doppler pentru vasele cervicale, consulturile interdisciplinare (neurologic, oftalmologic, psihiatric, reumatologic, cardiologic) sunt adaptate fiecărei situaţii în parte. Nu există teste patognomonice pentru PPPD şi majoritatea pacienţilor nu prezintă modificări la testele clinice uzuale (Romberg, Unterberger), cu excepţia situaţiilor de coexistenţă cu o patologie activă(1).
Unele studii efectuate pentru o patologie precursoare şi înrudită cu PPPD au evidenţiat rezultate mai slabe la posturografie decât la persoanele sănătoase, fără a demonstra un pattern(15).
Fiind o patologie funcţională, distragerea atenţiei prin executarea unor sarcini mentale (de exemplu, să numere descrescător de la 100 din 6 în 6) poate normaliza testele, oferind argumente suplimentare diagnosticului. Testarea în condiţii de dificultate mai mare (de exemplu, Romberg în tandem, Romberg unipodal) poate normaliza în mod paradoxal balansul(16).
Putem confunda PPPD cu:
-
Sechelele unei patologii acute, cum ar fi o neuronită vestibulară sau un AVC, incomplet vindecate sau compensate.
-
Vom considera 3PD dacă anamneza ne aduce argumente (ameţeală, instabilitate, agravate de ortostatism şi stimuli vizuali complecşi), iar testele vestibulare ne arată vindecarea sau compensarea patologiei acute (dispariţia nistagmusului, head-thrust negativ, dispariţia deviaţiilor segmentare sau tronculare) şi pacientul întruneşte toate cele cinci criterii de diagnostic. Vom lua în considerare un deficit rezidual sau poate o coexistenţă a celor două condiţii dacă acuzele par legate de mişcările capului, nu ca stare de ameţeală posturală persistentă, iar examinarea ne arată o compensare incompletă(1).
-
Recurenţa patologiei organice – un nou episod de VPPB, alt episod de migrenă vestibulară (aură, fono- sau/şi fotofobie, cefalee etc.)(17). Sau un atac acut de boală Ménière, adăugat tulburării vestibulare funcţionale de fond (auz fluctuant, tinitus, vertij)(18).
-
Deficitul vestibular bilateral va fi suspectat în urma istoricului (prezenţa oscilopsiei, administrarea unei medicaţii ototoxice, legătura dintre simptomatologie şi mişcarea capului – se simt mai bine când nu se mişcă etc.) şi a evaluării clinice ce va fi întărită şi confirmată de testarea vestibulară(19).
-
PPPD poate fi confundat sau poate coexista cu tulburările anxioase şi anxios-depresive, agorafobie, stres posttraumatic, condiţii cronice persistente, care au în spectrul de manifestări ameţeală, vertij şi instabilitate. Comportamentul de evitare a situaţiilor provocatoare, anxietatea, grija par să fie mai pregnante în aceste cazuri(20,21).
-
Sindroame postcontuzionale secundare traumatismelor cerebrale sau ale coloanei cervicale se manifestă cu cefalee, ameţeală, tulburări cognitive (dezorientare, dificultăţi de concentrare) sau cu modificări de dispoziţie şi comportamentale (iritabilitate, depresie, oboseală, labilitate emoţională) şi intră în diagnosticul diferenţial al 3PD(22).
-
Disfuncţii ale sistemului nervos autonom, precum sincopă vasovagală, hipotensiunea ortostatică, sindromul tahicardiei ortostatice posturale. Aceste disfuncţii, prin modificări ale tensiunii arteriale, respectiv ale ritmului cardiac, pot provoca secundar modificărilor hemodinamice instabilitate şi senzaţie de ameţeală, dar sunt mai puţin influenţate de stimulii vizuali(23).
-
Manifestări fruste ale unor boli neurologice degenerative, precum Parkinson, sindroame degenerative cerebeloase sau neuropatii periferice(1,24).
-
Existenţa patologiei funcţionale nu exclude posibilitatea unei patologii organice şi nu trebuie să priveze pacientul de o reevaluare minuţioasă atunci când apar manifestări suplimentare sau cele existente se amplifică(7).
De ce apare?
Corelaţii fiziopatologice
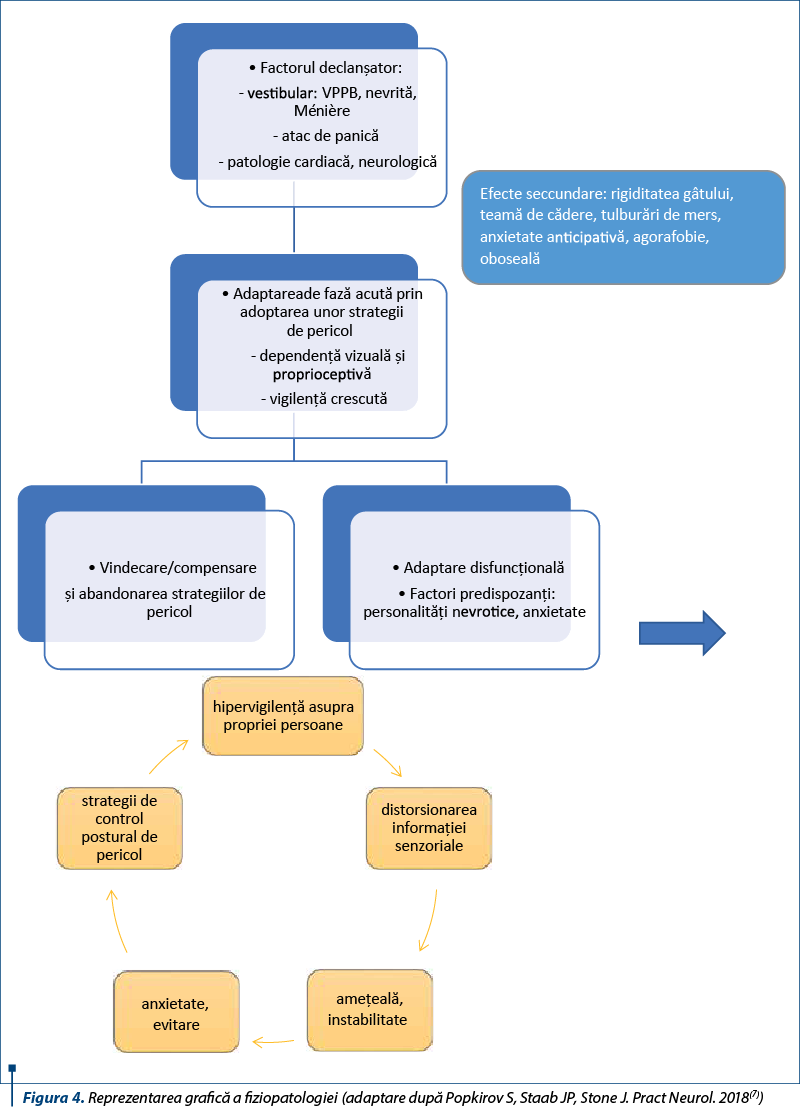
În figura 4 este redată succint fiziopatologia cunoscută până acum.
PPPD este de dată recentă, nu sunt foarte multe studii pe această temă şi numărul pacienţilor incluşi în studiile existente este relativ redus, dar s-a încercat corelarea observaţiilor clinice cu modificări structurale şi funcţionale cerebrale care să explice fiziopatologia acestui sindrom. Putem atribui PPPD unei translaţii/modificări între interacţiunile reţelelor neuronale vizuale, vestibulare, somatosenzoriale şi emoţionale cu activarea preponderentă a reţelelor vizuale(25).
La menţinerea echilibrului participă atât sistemele fiziologice (vedere, propriocepţie, vestibule, forţă musculară, timp de reacţie), cât şi sistemele de control (reactiv, anticipativ, senzorial, dinamic, al limitelor de stabilitate)(26,27). Sistemul somatosenzorial oferă informaţii despre poziţia şi mişcarea segmentelor corpului, sistemul vizual informează despre mediul înconjurător şi orientarea corpului, iar aparatul vestibular oferă informaţii despre poziţia şi orientarea spaţială a capului(26).
Răspunsul fiziologic la un episod vertiginos acut este adaptarea prin activarea unor strategii de control postural eficiente în situaţii de risc (când ne aflăm la înălţime pe marginea unei prăpastii, pe gheaţă, când informaţiile venite de la vestibul sunt acut inegale etc.), bazate mai mult pe informaţia vizuală şi proprioceptivă decât pe informaţia vestibulară. Aceste strategii sunt utile în situaţia acută, dar persistenţa lor după rezolvarea dezechilibrului acut generează simptomatologia 3PD(7). Au fost deduse interacţiuni anormale între ariile corticale vizuale şi vestibulare, zonele corticale superioare de execuţie, structurile limbice implicate în procesarea emoţiilor sau a stării de spirit şi ariile motorii ce constituie originea eferenţelor motorii(28).
Informaţiile senzoriale (vizuale, vestibulare, proprioceptive, somatosenzoriale, auditive) acţionează asupra unor zone ale creierului nostru pentru a realiza un control postural adaptativ. De exemplu, mersul necesită de principiu corelarea dintre efectuarea paşilor, reflexele posturale, alinierea corespunzătoare a segmentelor corpului şi nivelul optim de tonus muscular al muşchilor posturali, comanda motorie fiind transmisă prin căile descendente ce leagă trunchiul cerebral de măduva spinării(7,29). Ariile corticale motorii execută o ajustare posturală anticipativă, necesară realizării mişcărilor potrivite(29). Ariile premotorii aflate în cortexul frontal participă la planificarea comportamentului motor şi la decizia acţiunilor motorii(30). Mersul în circumstanţe deosebite necesită un proces cognitiv de control postural ce depinde de percepţia propriului corp în spaţiu(29).
Precuneusul are rol important în percepţia spaţiului înconjurător şi a poziţiei propriului corp, prin participarea la integrarea informaţiei vizuale şi vestibulare. Cortexul parietal, inclusiv precuneusul, integrează informaţia senzorială pentru a alcătui un model de estimare. Ulterior trimite aceste informaţii senzoriale către ariile motorii şi motorii accesorii şi, astfel, participă la controlul motor şi postural(31). Li et al., într-o lucrare publicată în 2020, bazată pe achiziţiile RMN a 12 pacienţi cu PPPD comparativ cu subiecţii sănătoşi, au concluzionat că pacienţii cu PPPD prezintă disfuncţia precuneusului şi conexiuni cerebrale mai slabe cu cortexul premotor, ceea ce poate provoca anomalii în monitorizarea mediului extern şi în reglarea posturii şi a mişcării. Adaptativ, sunt adoptate strategii compensatorii pentru menţinerea echilibrului, strategii justificate în situaţii de pericol (ajustarea echilibrului la înălţime sau pe suprafeţe alunecoase). Comunicarea între cele două emisfere cerebrale este crescută însă prin intermediul corpului calos(32). Prin îmbunătăţirea conexiunilor funcţionale vizuale, integrarea senzorială şi reglarea posturii şi mişcării sunt conduse în primul rând de informaţia vizuală(32). Activitatea funcţională cerebrală şi patternul conexiunilor cerebrale par a fi modulate de diverşi factori, precum trăsături de personalitate, comorbidităţi psihiatrice sau factori declanşatori. La pacienţii cu PPPD, activitatea şi conexiunile anumitor arii corticale vestibulare sunt diminuate comparativ cu cele ale subiecţilor sănătoşi; în schimb, sunt crescute conexiunile dintre ariile vizuale şi cortexul prefrontal responsabil pentru reglarea răspunsului emoţional şi a atenţiei(25).
A fost postulată o disfuncţionalitate a procesării multisenzoriale, nu doar reducerea funcţionalităţii şi conexiunilor între ariile responsabile de procesarea informaţiilor vestibulare şi accentuarea activităţii şi conexiunilor cu ariile vizuale(33).
În concluzie, modificările în funcţionalitatea creierului, surprinse pe imagistică, sugerează o disfuncţionalitate de procesare şi integrare a informaţiilor vestibulare şi multisenzoriale şi o dependenţă vizuală, traduse printr-o adaptare disfuncţională, ce generează mecanisme compensatorii(34).
Pentru a crea o legătură între modificările structurale şi funcţionale descrise de cercetările imagistice de până acum şi simptomatologia pe care pacientul o acuză, au fost încercate mai multe teorii.
Un concept interesant a fost propus de Klingner et al. într-o lucrare publicată în 2016 despre procesarea informaţiei vestibulare – şi anume, conceptul de codare predictivă. Prin integrarea informaţiilor primite, creierul îşi construieşte modele de estimare asupra lumii exterioare cu ajutorul cărora să deducă situaţia pe care i-o semnalează informaţiile senzoriale primite din periferie(28,35). Creierul încearcă astfel să diminueze elementul de surpriză, de incertitudine cu privire la informaţia senzorială, reducând diferenţa dintre senzaţiile neprevăzute şi cele estimate prin modelele predicţionate pentru a acorda atenţie şi a analiza doar informaţiile neaşteptate. Diferenţa dintre inputurile primite şi cele estimate de către modelele predictive va constitui o eroare de predicţie(28,35). Eroarea de predicţie cauzată de aşteptările interne incorecte devine exagerată la pacienţii cu 3PD, iar procesarea anormală de semnale apreciate ca fiind neprevăzute conduce la percepţia deformată a unui dezechilibru postural, oferind o explicaţie pentru instabilitatea resimţită de pacienţii cu 3PD. Deoarece aceste modele interne de predicţie sunt dinamice şi adaptative, vor fi aparent influenţate de eroarea de predicţie şi vor influenţa procesarea ulterioară a inputurilor senzoriale(28,35).
Subiecţii sănătoşi îşi modifică controlul postural atunci când percep o situaţie cu risc de dezechilibrare sau cădere şi îşi ajustează aferenţele senzoriale în corelaţie cu ameninţarea percepută(36), dar renunţă ulterior la aceste strategii de pericol. Pacienţii cu 3PD continuă însă să folosească strategiile de pericol ce devin inadecvate pentru situaţia reală a pacientului care a rezolvat cauza organică (a depăşit episodul de VPPB sau a compensat deficitul vestibular restant etc.)(37). Astfel, strategiile de echilibrare adoptate devin maladaptative, caracterizate prin hipervigilenţă în ce priveşte mediul înconjurător şi propria persoană, introspecţie şi disproporţii în ponderea acordată tipurilor de aferenţe senzoriale (vedere, proprioceptive, imputuri vestibulare)(28,37).
Riscul de a dezvolta o patologie funcţională de tipul 3PD este mai crescut la pacienţii cu un teren anxios sau anxios-depresiv, cu dependenţă vizuală, cu tendinţe spre somatizare, cu reactivitate vegetativă accentuată, persoane care se concentrează excesiv asupra senzaţiilor legate de echilibru. Anxietatea, dependenţa vizuală, comportamentul de evitare a situaţiilor ce provoacă ameţeală sau instabilitate constituie factori predispozanţi pentru dezvoltarea patologiei vestibulare funcţionale(38,39).
Există tratament?
Fiind un sindrom definit recent, diferitele terapii propuse pentru întreruperea cercului vicios fiziopatologic au nevoie de proba timpului pentru a-şi demonstra eficienţa.
Tratamentul
1. Terapia de reabilitare vestibulară
Este compusă dintr-o serie de exerciţii fizice care au rolul de a antrena pacienţii cu deficite vestibulare spre a obţine cât mai rapid şi în mod optim compensarea centrală a deficitului vestibular.
De asemenea, reabilitarea vestibulară are o componentă adresată ameţelii şi instabilităţii cronice, o desensibilizare, un antrenament al pacientului pentru a face faţă situaţiilor solicitante pentru echilibru, care îi provoacă simptomatologia. Această componentă a reabilitării joacă şi un rol psihologic pentru pacienţii cu teamă de cădere şi cu anxietate legată de menţinerea echilibrului(40).
2. Terapia cognitiv-comportamentală (CBT)
Este domeniul psihiatriei şi psihologiei şi are la bază ideea că felul în care privim lumea înconjurătoare, propria persoană sau aşteptările pentru viitor îşi are rădăcina în credinţele noastre fundamentale, iar aceste credinţe, gândurile conştiente şi cele subconştiente ne influenţează starea de spirit şi acţiunile viitoare(41). Gândurile negative şi anticiparea exagerată a unor consecinţe catastrofale generează comportamente automate (de exemplu, hipervigilenţa, rigiditatea posturală), care accentuează simptomele şi întăresc convingerile negative(42).
Mai concret, gânduri precum: „Mi-e teamă să scot câinele afară că sigur voi ameţi, voi cădea şi mă voi răni” sau „Precis o să am o zi proastă şi nu pot merge să fac cumpărăturile fiindcă trebuie să traversez Piaţa Unirii la ora de vârf şi îmi va fi rău toată ziua”, sau „Nu merg la ziua prietenei mele, unde va fi multă lume, mă voi simţi rău, mă voi face de ruşine şi vor crede toţi că sunt nebună, dacă toţi medicii mi-au spus că nu am nimic” etc.
CBT încearcă întreruperea cercului vicios al gândirii negative eronate care conduce la comportamente disfuncţionale, prin destructurarea schemelor de gândire nocivă. Un exemplu aplicat patologiei funcţionale vestibulare ar fi: dacă teama de consecinţele catastrofale ale instabilităţii determină comportamentul de evitare şi îi limitează pacientului activităţile cotidiene, se încearcă educarea acestuia prin explicarea patologiei, direcţionarea către conştientizarea schemelor de gândire negativă şi modificarea percepţiei asupra evenimentelor generatoare de ameţeală şi teamă de cădere(43).
3. Combinaţia între terapia cognitiv-comportamentală şi reabilitarea vestibulară pare să aibă rezultate favorabile(44).
4. Medicaţia: inhibitorii recaptării serotoninei şi inhibitorii recaptării serotoninei şi noradrenalinei sunt medicamente ce cresc cantitatea mediatorilor menţionaţi la nivelul fantei sinaptice prin diminuarea recaptării lor. Aceste medicamente folosite în tratamentul depresiei par a avea un efect benefic asupra senzaţiei de ameţeală la pacienţii cu simptomatologie psihiatrică minoră sau majoră, inclusiv la cei cu patologie vestibulară, patologia periferică având un răspuns mai bun decât cea centrală. Dozele folosite pentru vertijul cronic subiectiv (patologie precursoare PPPD, cu caracteristici similare) au fost mai mici decât cele folosite pentru tratamentul depresiei(45).
O constatare semnificativă legată de folosirea antidepresivelor în tratamentul patologiei vestibulare funcţionale a fost sensibilitatea mai mare la efectele adverse ale medicaţiei, în special la iniţierea terapiei, dintre care menţionăm stări de ameţeală, somnolenţă, tulburări de concentrare, greaţă sau creştere ponderală(46).
Efectele medicaţiei au fost remarcate la 8-12 săptămâni de la iniţierea terapiei şi recomandarea a fost de a menţine medicaţia cel puţin un an(7).
Un exemplu clinic
Prezentăm cazul unei paciente de 39 de ani, casnică, mamă a trei copii, care prezentase în urmă cu aproximativ doi ani câteva episoade vertiginoase recurente, primul episod dimineaţa la ridicarea din pat, manifestat prin vertij rotator violent cu durata scurtă, însoţit de greaţă, transpiraţii, agravat de mişcarea capului şi ameliorat de lipsa mişcării, neînsoţit de acufene sau de alte acuze auditive, dar cu persistenţa unei senzaţii de ameţeală reziduală pe tot parcursul zilei. Episoade similare, de intensitate mai mică, s-au repetat în următoarele zile, însoţite de o stare de anxietate pronunţată. Pacienta s-a adresat unui serviciu de urgenţă cu suspiciunea de accident vascular cerebral, a fost evaluată neurologic şi imagistic prin CT cerebral, care a infirmat o patologie neurologică acută. Au urmat o serie de consulturi neurologice, oftalmologice, ORL, reumatologice, a efectuat RMN cerebral şi pentru coloana cervicală, analize diverse al căror rezultat a fost constant normal. Urma să facă un consult psihiatric, pentru care avea deja programare.
În serviciul ORL a fost trimisă de către medicul de familie, cu suspiciunea de sinuzită pentru cefaleea de care se plângea uneori. Iniţial, anamneza a fost dificilă, pacienta fiind exasperată şi neîncrezătoare să repete aceeaşi poveste din care să nu rezulte nimic la sfârşitul vizitei medicale. Printre simptomele descrise erau ameţeală persistentă la una-două ore de când îşi începea activitatea, senzaţiile de ameţeală o însoţeau în majoritatea zilelor, mai accentuate către seară, când resimţea uneori dureri de cap şi o senzaţie de oboseală extremă. Ameţeala şi, în special, impredictibilitatea apariţiei simptomelor o afectau semnificativ. Trăia cu o constantă teamă că nu va putea avea grijă de copii, că va ameţi cu cel mic în braţe, că va declanşa un accident şi va răni pe cineva, privea cât mai puţin la televizor, nu tolera aglomeraţia, care o făcea să se simtă mai ameţită, şi percepea ca pe un efort considerabil să meargă într-un mall. Deşi descrierea şi investigaţiile normale efectuate anterior au fost suficient de sugestive pentru diagnosticul de PPPD, i-au fost efectuate probele vestibulare de care dispunem pentru diagnosticul diferenţial. Am constatat doar teama de a închide ochii şi un balans accentuat la efectuarea probei Romberg pe o suprafaţă de burete moale.
I-am explicat că nu avem vreun test obiectiv care să confirme diagnosticul, dar suspectăm o tulburare funcţională. Nu am încercat să o convingem că din punct de vedere organic este sănătoasă pentru că toate probele sunt normale, ci mai degrabă că rezultatele bune sunt un atu şi un argument în favoarea unei şanse mai mari de recuperare. I-am oferit un pliant cu exerciţii de reabilitare vestibulară şi i-am explicat cum să le facă singură acasă în mod progresiv (să gândească că şi-ar învăţa propriul copil să înoate, arătându-i cu răbdare fiecare mişcare, nu aruncându-l direct în apă adâncă). Am încurajat-o să consulte un psihiatru, care îi va recomanda şi psihoterapia potrivită. La o lună, se simţea mai bine şi mai încrezătoare. I-am cerut să revină peste trei luni pentru o reevaluare, din teama ca acest diagnostic funcţional să nu ascundă o patologie frustă organică pe care nu am remarcat-o iniţial.
Prescurtări:
PPPD = 3PD = ameţeală posturală perceptuală persistentă (Persistent Postural-Perceptual Dizziness)
AVC = accident vascular cerebral
VPPB = vertij paroxistic poziţional benign
Conflicts of interests: The authors declare no conflict of interests.
Bibliografie
-
Staab JP, Eckhardt-Henn A, Horii A, et al. Diagnostic criteria for persistent postural-perceptual dizziness (PPPD): Consensus document of the committee for the Classification of Vestibular Disorders of the Bárány Society. J Vestib Res. 2017;27(4):191-208.
-
Yagi C, Morita Y, Kitazawa M, Yamagishi T, Ohshima S, Izumi S, Takahashi K, Horii A. Subtypes of Persistent Postural-Perceptual Dizziness. Front Neurol. 2021 Apr 16;12:652366. doi: 10.3389/fneur.2021.652366.
-
Dieterich M, Staab JP, Brandt T. Functional (psychogenic) dizziness. Handb Clin Neurol. 2016;139:447–468.
-
Feuerecker R, Habs M, Dieterich M, Strupp M. Chronic subjective dizziness: Fewer symptoms in the early morning – a comparison with bilateral vestibulopathy and downbeat nystagmus syndrome. J Vestib Res. 2015;25:67–72.
-
Pavlou M, Davies RA, Bronstein AM. The assessment of increased sensitivity to visual stimuli in patients with chronic dizziness. J Vestib Res. 2006;16(4-5):223-231.
-
Longridge NS, Mallinson AI, Denton A. Visual vestibular mismatch in patients treated with intratympanic gentamicin for Meniere’s disease. J Otolaryngol. 2002;31(1):5-8.
-
Popkirov S, Staab JP, Stone J. Persistent postural-perceptual dizziness (PPPD): a common, characteristic and treatable cause of chronic dizziness. Pract Neurol. 2018;18(1):5-13.
-
Onofrj M, Thomas A, Tiraboschi P, et al. Updates on Somatoform Disorders (SFMD) in Parkinson’s disease and dementia with Lewy bodies and discussion of phenomenology. J Neurol Sci. 2011;310:166-71.
-
Staab JP. Psychiatric Considerations in the Management of Dizzy Patients. Adv Otorhinolaryngol. 2019;82:170-179. doi: 10.1159/000490286.
-
Staab JP. Chronic subjective dizziness. Continuum (Minneap Minn). 2012;18(5 Neuro-otology):1118-1141.
-
Dieterich M, Staab JP. Functional dizziness: from phobic postural vertigo and chronic subjective dizziness to persistent postural-perceptual dizziness. Curr Opin Neurol. 2017;30(1):107-113.
-
Staab JP, Ruckenstein MJ. Which comes first? Psychogenic dizziness versus otogenic anxiety. Laryngoscope. 2003;113:1714-1718.
-
von Brevern M, Bertholon P, Brandt T, et al. Benign paroxysmal positional vertigo: Diagnostic criteria. J Vestib Res. 2015;25(3-4):105-117.
-
Zamyslowska-Szmytke E, Politanski P, Jozefowicz-Korczynska M. Dizziness Handicap Inventory in Clinical Evaluation of Dizzy Patients. Int J Environ Res Public Health. 2021;18(5):2210.
-
Morisod B, Mermod M, Maire R. Posturographic pattern of patients with chronic subjective dizziness before and after vestibular rehabilitation. J Vestib Res. 2018;27(5-6):305-311. doi: 10.3233/VES-170628.
-
Querner V, Krafczyk S, Dieterich M, Brandt T. Patients with somatoform phobic postural vertigo: the more difficult the balance task, the better the balance performance. Neurosci Lett. 2000;285(1):21-24.
-
Lempert T, Olesen J, Furman J, Waterston J, Seemungal B, Carey J, Bisdorff A, Versino M, Eversi S, Newman-Toker D. Vestibular migraine: Diagnostic criteria. Consensus document of the Barany Society and the International Headache Society. J Vestib Res. 2012;22:167–172.
-
Lopez-Escamez JA, Carey J, Chung W-H, Goebel JA, Magnusson M, Mandala M, Newman-Toker DE, Strupp M, Suzuki M, Trabalzini F, Bisdorff A. Diagnostic criteria for Meniere’s Disease. Consensus document of the Barany Society, The Japan Society for Equilibrium Research, the European Academy of Otology and Neurotology (EAONO), the American Academy of Otolaryngology-Head and Neck Surgery (AAO-HNS) and the Korean Balance Society. J Vestib Res. 2015;25:1–7.
-
Strupp M, Feil K, Dieterich M, Brandt T. Bilateral vestibulopathy. Handb Clin Neurol. 2016;137:235-40. doi: 10.1016/B978-0-444-63437-5.00017-0.
-
Limburg K, Dinkel A, Schmid-Mühlbauer G, Sattel H, Radziej K, Becker-Bense S, Henningsen P, Dieterich M, Lahmann C. Neurologists’ Assessment of Mental Comorbidity in Patients with Vertigo and Dizziness in Routine Clinical Care – Comparison with a Structured Clinical Interview. Front Neurol. 2018 Nov 13;9:957. doi: 10.3389/fneur.2018.00957.
-
American Psychiatric Association. The Diagnostic and Statistical Manual of Mental Disorders, 5th Edition (DSM-5), American Psychiatric Association: Washington, DC, 2013.
-
Gianoli GJ. Post-concussive Dizziness: A Review and Clinical Approach to the Patient. Front Neurol. 2022 Jan 4;12:718318. doi: 10.3389/fneur.2021.718318.
-
Staab JP, Ruckenstein MJ. Autonomic nervous system function in chronic dizziness. Otol Neurotol. 2007;28:854–859.
-
Pasman EP, McKeown MJ, Garg S, Cleworth TW, Bloem BR, Inglis JT, Carpenter MG. Brain connectivity during simulated balance in older adults with and without Parkinson’s disease. Neuroimage Clin. 2021;30:102676. doi: 10.1016/j.nicl.2021.102676.
-
Indovina I, Passamonti L, Mucci V, Chiarella G, Lacquaniti F, Staab JP. Brain Correlates of Persistent Postural-Perceptual Dizziness: A Review of Neuroimaging Studies. J Clin Med. 2021 Sep 21;10(18):4274. doi: 10.3390/jcm10184274.
-
Casale J, Browne T, Murray I, et al. Physiology, Vestibular System. [Updated 2022 May 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK532978/
-
Dixona CJ, Knight T, Binnsc E, et al. Clinical measures of balance in people with type two diabetes: a systematic literature review. Gait & Posture. 2017;58:325–332.
-
Castro P, Bancroft MJ, Arshad Q, Kaski D. Persistent Postural-Perceptual Dizziness (PPPD) from Brain Imaging to Behaviour and Perception. Brain Sci. 2022 Jun 8;12(6):753. doi: 10.3390/brainsci12060753.
-
Takakusaki K. Functional Neuroanatomy for Posture and Gait Control. J Mov Disord. 2017;10(1):1-17.
-
Hoshi E, Tanji J. Distinctions between dorsal and ventral premotor areas: anatomical connectivity and functional properties. Curr Opin Neurobiol. 2007;17(2):234-242. https://doi.org/10.1016/j.conb.2007.02.003.
-
Shadmehr R. Distinct neural circuits for control of movement vs. holding still.
-
J Neurophysiol. 2017;117:1431–1460, 2017. doi:10.1152/jn.00840.2016.
-
Li K, Si L, Cui B, Ling X, Shen B, Yang X. Altered intra- and inter-network functional connectivity in patients with persistent postural-perceptual dizziness. Neuroimage Clin. 2020;26:102216. doi: 10.1016/j.nicl.2020.102216.
-
Sun L, Xiang K. A review on the alterations in the brain of persistent postural-perceptual dizziness patients and non-pharmacological interventions for its management. Rev Neurosci. 2020 Aug 27;31(6):675-680. doi: 10.1515/revneuro-2019-0109.
-
Im JJ, Na S, Jeong H, Chung YA. A Review of Neuroimaging Studies in Persistent Postural-Perceptual Dizziness (PPPD). Nucl Med Mol Imaging. 2021 Apr;55(2):53-60. doi: 10.1007/s13139-020-00675-2.
-
Klingner CM, Axer H, Brodoehl S, Witte OW. Vertigo and the processing of vestibular information: A review in the context of predictive coding. Neurosci Biobehav Rev. 2016 Dec;71:379-387. doi: 10.1016/j.neubiorev.2016.09.009.
-
Yagi C, Morita Y, Kitazawa M, Nonomura Y, Yamagishi T, Ohshima S, Izumi S, Takahashi K, Wada Y, Kitahara T, et al. Head Roll-Tilt Subjective Visual Vertical Test in the Diagnosis of Persistent Postural-Perceptual Dizziness. Otol Neurotol. 2021;42:e1618–e1624.
-
Staab JP. Persistent Postural-Perceptual Dizziness. Semin Neurol. 2020;40:130–137.
-
Cousins S, Kaski D, Cutfield N, et al. Predictors of clinical recovery from vestibular neuritis: a prospective study. Ann Clin Transl Neurol. 2017;4:340–6.
-
Bronstein AM, Dieterich M. Long-term clinical outcome in vestibular neuritis. Curr Opin Neurol. 2019 Feb;32(1):174-180. doi: 10.1097/WCO.0000000000000652.
-
Staab J. Behavioral aspects of vestibular rehabilitation. NeuroRehabilitation. 2011;29:179-83. doi: 10.3233/NRE-2011-0693.
-
Hain TC. Cognitive Behavioral Therapy (CBT) for dizziness and migraine. https://dizziness-and-balance.com/treatment/psychiatric/CBT.html
-
Leichsenring F, Steinert C. Is Cognitive Behavioral Therapy the Gold Standard for Psychotherapy?: The Need for Plurality in Treatment and Research. JAMA. 2017;318(14):1323-1324.
-
Holmberg J, Karlberg M, Harlacher U, Magnusson M. One-year follow-up of cognitive behavioral therapy for phobic postural vertigo. J Neurol. 2007;254(9):1189-1192.
-
Andersson G, Asmundson GJ, Denev J, Nilsson J, Larsen HC. A controlled trial of cognitive-behavior therapy combined with vestibular rehabilitation in the treatment of dizziness. Behav Res Ther. 2006 Sep;44(9):1265-73. doi: 10.1016/j.brat.2005.09.008.
-
Staab JP, Ruckenstein MJ, Amsterdam JD. A prospective trial of sertraline for chronic subjective dizziness. Laryngoscope. 2004 Sep;114(9):1637-41. doi: 10.1097/00005537-200409000-00025.
-
Staab JP, Ruckenstein MJ, Solomon D, Shepard NT. Serotonin reuptake inhibitors for dizziness with psychiatric symptoms. Arch Otolaryngol Head Neck Surg. 2002 May;128(5):554-60. doi: 10.1001/archotol.128.5.554.