Acute lymphoblastic leukemia (ALL) is the most common malignant condition in children, with a prevalence of 25% and a survival rate of approximately 85%. The patients with acute lymphoblastic leukemia are susceptible to infections (bacterial, viral, fungal, often severe, recurring) due to a compromised immune system. Infectious diseases are the main cause of morbidity and mortality in children’s cancer. Neutropenia has been documented as a major risk factor in the development of infections in patients with oncological diseases receiving chemotherapy. The mortality rate associated with infection is up to 10 times higher in low-income countries than in high-income countries. The prevention, recognition and early management of infectious complications remain a challenge. Staphylococcus aureus is the most common cause of infection in cancer patients.
Complicaţii infecţioase la un copil cu leucemie acută limfoblastică (prezentare de caz)
Infectious complications in a child with acute lymphoblastic leukemia (case study)
First published: 28 decembrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.52.4.2018.2159
Abstract
Rezumat
Leucemia acută limfoblastică (ALL) este cea mai frecventă afecţiune malignă la copii, cu o prevalenţă de 25% şi o rată de vindecare de aproximativ 85%. Pacienţii cu leucemie acută limfoblastică sunt susceptibili la infecţii (bacteriene, virale, fungice, deseori severe, recurente), din cauza unui sistem imunitar compromis. Bolile infecţioase sunt principala cauză a morbidităţii şi mortalităţii în cancerul la copii. Neutropenia a fost documentată ca un factor de risc major în dezvoltarea infecţiilor la pacienţii cu afecţiuni oncologice care primesc tratament citostatic. Rata mortalităţii asociată infecţiei este de până la 10 ori mai mare în ţările cu venituri mici şi medii decât în ţările cu venituri ridicate. Prevenirea, recunoaşterea şi gestionarea timpurie a complicaţiilor infecţioase sunt o provocare. Stafilococul auriu reprezintă una dintre cele mai frecvente etiologii a infecţiilor apărute la pacienţii cu cancer.
Prezentare de caz
R.S., de sex masculin, în vârstă de 4 ani, se internează în Secţia de Oncopediatrie a S.C.U.C. „M.S. Curie”, Bucureşti, în data de 6.11.2017, prin transfer de la Spitalul Judeţean Constanţa, cu suspiciunea de leucemie acută.
Din istoric reţinem debutul bolii în 15.10.2017, cu tumefacţie laterocervicală bilaterală; se prezintă la medicul de familie, care recomandă tratament cu Ospamox şi simptomatice. În evoluţie apar febra (39°C), paloare tegumentară şi mărirea de volum a abdomenului, fiind internat în Spitalul Judeţean Constanţa în perioada 4-6.11.2017. În urma investigaţiilor efectuate (hemogramă: leucocitoză importantă – 572000/mm3, anemie severă, Hb – 5,5g/dl, trombocitopenie – 51000/mm3, frotiu de sânge periferic – 55% blaşti atipici, sindrom inflamator intens pozitiv), se ridică suspiciunea de leucemie acută, copilul fiind transferat în secţia de oncopediatrie a S.C.U.C. „M.S. Curie”, Bucureşti.
Antecedentele personale fiziologice evidenţiază faptul că pacientul este al şaselea copil al unui cuplu tânăr, afirmativ sănătos, provenit dintr-o sarcină nedispensarizată, născut pe cale naturală, cu greutate normală, scor Apgar 10; a fost alimentat cu formulă de lapte şi lapte de vacă, diversificat incorect; a efectuat profilaxia rahitismului până la vârsta de 1 an; a efectuat doar vaccinarea BCG în maternitate. Dezvoltarea psihomotorie a fost normală pe etape de vârste. Antecedentele personale patologice nu relevă îmbolnăviri.
Copilul provine din mediul rural, dintr-o familie cu condiţie socială economică precară.
Examenul clinic la internarea în clinica noastră prezintă un pacient cu stare de nutriţie corespunzătoare vârstei G=20 kg, cu stare generală mediocră, febril (T=38,5°C), facies suferind, paloare cutaneo-mucoasă, celulită la nivelul mâinii stângi, tumefacţie dureroasă parotidiană bilateral, adenopatii periferice generalizate, ganglioni cu diametre între 1 şi 3 cm.
Examenul aparatului respirator relevă sindrom funcţional respirator, cu dispnee mixtă şi polipnee (frecvenţă respiratorie – 64 resp./min.), SatO2 – 95% în aerul atmosferic, fără modificări la auscultaţia pulmonară.
Copilul este tahicardic (AV=153 bpm), TA=110/65 mmHg.
Abdomenul este mărit de volum prin hepatosplenomegalie; diametrul prehepatic măsoară 114 cm. Splina se palpează la 9 cm sub rebordul costal. Diureza este prezentă. Nu prezintă semne de iritaţie meningeală.
Investigaţiile de laborator la internare au evidenţiat următoarele:
-
Hemograma: Hb=6,9 g/dL, leucocite=651000/mm3, trombocite=61000/mm3.
Examenul macroscopic al frotiului sangvin periferic arată limfoblaşti atipici 98%, neutrofile 1%, eozinofile 1%, frecvente umbre nucleare, eritroblaşti 1%.
-
Sindrom inflamator intens pozitiv: VSH=60 mm/oră, fibrinogen=480 mg/dL, CRP=28 mg/L.
-
Fără sindrom de citoliză hepatică, cu excepţia valorii foarte crescute a LDH-ului seric= 3629 UI/L.
-
Testele pentru funcţia renală au fost normale.
-
Examenul microscopic al măduvei osoase a evidenţiat o măduvă cu celularitate foarte densă, cu 98% celule blastice de talie medie/mică, cu nucleu rotund, foarte rari nucleoli vizibili, cromatină densă, citoplasmă săracă, bazofilă, fără granulaţii. Extrem de rare celule din seria granulocitară şi eritroblaşti, megacariocite absente. Aspectul măduvei osoase este de leucemie acută limfoblastică, cu inhibiţia severă a seriilor mieloide.
-
Imunofenotiparea din aspiratul medular confirmă diagnosticul de leucemie acută limfoblastică cu celulă T.
-
Cariotipul şi biologia moleculară au fost normale.
-
Lichidul cefalorahidian a fost normal.
S-au mai efectuat:
-
Ecografie abdominală, care a confirmat hepatosplenomegalia decelată la examenul clinic.
-
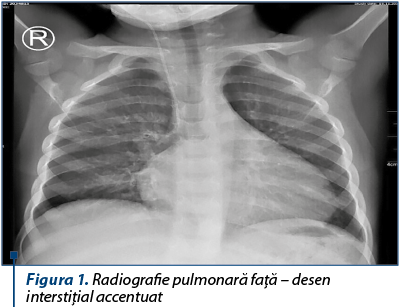
Radiografia pulmonară arată accentuarea desenului interstiţial pulmonar bilateral.
-
Ecocardiografia arată uşoară hipertrofie ventriculară stângă concentrică.
Coroborând datele clinico-anamnestice şi imagistice, se stabileşte diagnosticul de leucemie acută limfoblastică cu celulă T comună şi din 8.11.2017 se iniţiază chimioterapie, conform protocolului ALL BFM 2002/2008 – faza de inducţie.
După o săptămână de la iniţierea chimioterapiei, pacientul prezintă febră ridicată, asociată cu scaune diareice fetide. În coprocultură s-a izolat Clostridium difficile entero-toxigen, copilul fiind transferat la Spitalul de Boli Infecţioase „Dr. Victor Babeş”, Bucureşti, pentru tratament specific. La revenirea în clinică noastră s-a reluat tratamentul citostatic.
La circa trei săptămâni de la iniţierea tratamentului pentru leucemie, pe fondul neutropeniei severe induse de chimioterapie (leucocite=3140/mm3, neutrofile=300/mm3), pacientul redevine febril (39-40ºC), prezintă sindrom funcţional respirator marcat, cu dispnee, polipnee, tiraj intercostal, bătăi ale aripilor nazale, cu diminuarea murmurului vezicular posterobazal drept şi cu scăderea SatO2 la 90%.
Radiografia pulmonară evidenţiază opacităţi nodulare diseminate bilateral, cu dimensiuni între 5 şi 15 mm, fără participare pleurală.
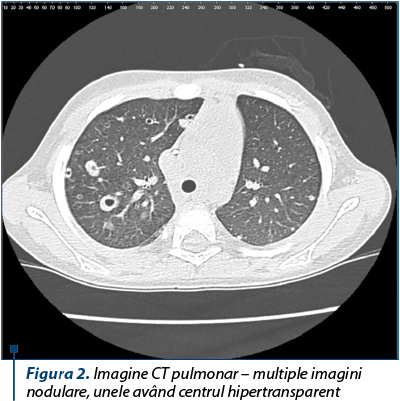
Examenul CT pulmonar relevă multiple imagini nodulare, unele având centrul hipertransparent, fiind delimitate de un inel cu grosime neregulată. Leziunile sunt diseminate difuz, la nivelul ambelor câmpuri pulmonare, în toate segmentele, unele dintre ele având tendinţa la confluare şi infiltrate alveolare în jur. Dimensiunile leziunilor variază de la 1-2 mm până la circa 25 mm. Aspect sugestiv de aspergiloză pulmonară.
S-a instituit tratament antibiotic complet (meronem + vancomicină), antifungic (fluconazol) şi ulterior voriconazol.
Se completează investigaţiile de laborator cu cercetarea antigenului Aspergillus (Galacto-manan), al cărui rezultat obţinut după trei săptămâni a fost negativ.
În 11.12.2017, starea pacientului se agravează brusc prin apariţia semnelor de insuficienţă respiratorie acută, cu desaturare până la 60-70% în aerul atmosferic, tahicardie 150 bpm, examenul fizic pulmonar decelând abolirea murmurului vezicular la nivelul hemitoracelui drept.
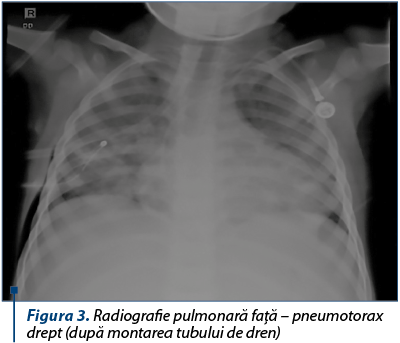
Radiografia pulmonară arată penumotorax masiv drept, cu deplasarea mediastinului spre stânga.
Sub anestezie generală şi intubaţie orotraheală se practică lavaj bronhoalveolar şi drenajul cavitaţii pleurale – se evacuează o cantitate mare de aer, fără puroi, şi se instalează un tub de dren.
Se practică lavaj bronhoalveolar şi drenajul cavitaţii pleurale drepte, evacuându-se o cantitate mare de aer sub presiune, fără puroi.
Tubul de dren a fost suprimat după nouă zile. În culturile din aspiratul traheal s-a izolat stafilococul auriu; de asemenea, hemoculturile au fost pozitive pentru stafilococul auriu.
În 22.12.2017 reapar semnele de insuficienţă respiratorie acută.
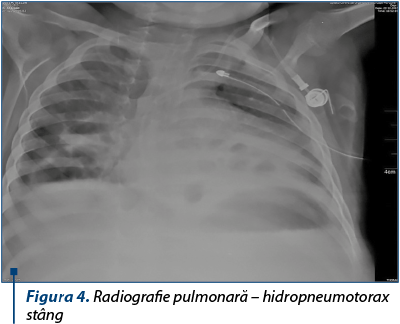
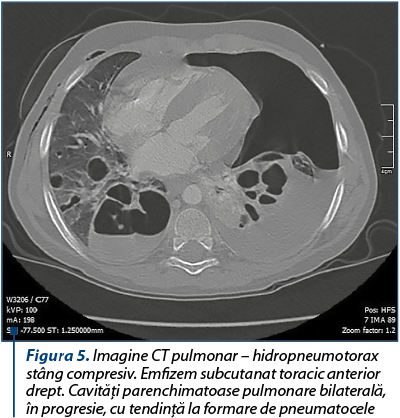
Radiografia pulmonară şi examenul CT toracic evidenţiază hidropneumotorax stâng compresiv. Cavităţile parenchimatoase pulmonare bilaterale în progresie, cu tendinţa la formare de pneumatocele.
Se practică drenajul cavităţii pleurale stângi, cu exteriorizarea de lichid purulent în cantitate moderată, aproximativ 250 ml. În culturile din lichidul pleural s-a izolat de asemenea acelaşi germen, stafilococul auriu.
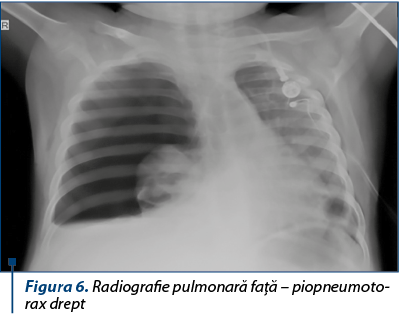
În 28.12.2017, copilul face al treilea piopneumotorax pe partea dreaptă, impunându-se pleurostomie dreaptă. În acest interval de timp s-a continuat tratamentul antibiotic cu spectru larg, adaptat după antibiogramă şi ţintit pentru stafilococul auriu (Tazocin® + ciprofloxacină + clindamicină + linezolid), concomitent cu tratamentul antifungic.
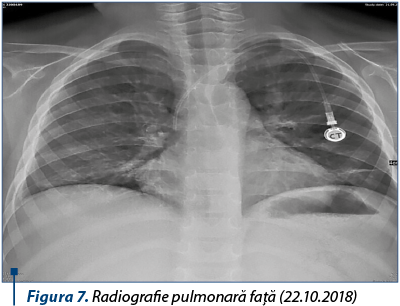
Evoluţia ulterioară din punct de vedere clinico-imagistic a fost progresiv favorabilă, permiţând reluarea chimioterapiei după o întrerupere de aproximativ două luni.
Pe parcursul spitalizării, copilul a mai prezentat herpes zoster (coapsă, regiunea inghinală şi organe genitale externe), confirmat virusologic, tratat cu aciclovir în Spitalul de Boli Infecţioase „Dr. Victor Babeş”, Bucureşti.
În prezent, pacientul se află în remisiune clinică şi hematologică pentru leucemie acută limfoblastică şi continuă tratamentul citostatic de întreţinere.
Discuţii
În cazul prezentat, tabloul imagistic iniţial (radiografie pulmonară + CT) a arătat un aspect de leziuni nodulare în ambele câmpuri pulmonare, cu tendinţa la confluare, aspect sugestiv pentru aspergiloză. Pentru acest diagnostic, pe lângă semnele clinico-imagistice, pleda şi existenţa unor construcţii în curtea spitalului, ştiut fiind faptul că acestea măresc riscul de infecţie cu Aspergillus la pacienţii imunodeprimaţi.
Este cunoscut, de asemenea, faptul că tabloul clinico-imagistic clasic de stafilococie constă în determinări pleuropulmonare (pleurezie purulentă, pneumatocele), în cazul nostru, cel puţin iniţial, fiind prezente numai determinările pulmonare. Evoluţia spre abcedare pulmonară urmată de episoade de pneumotorax repetate şi ulterior însămânţarea pleurală au permis stabilirea diagnosticului de stafilococie pleuropulmonară, punctul de plecare al acesteia fiind cel mai probabil infecţia cutanată de tip celulită, care, pe teren imunodeprimat, atât prin boala de bază (leucemia), cât şi prin tratamentul citostatic, a avut evoluţie atipică şi foarte severă.
Concluzii
Infecţiile (virale, bacteriene, fungice) continuă să prezinte o complicaţie redutabilă în cazul pacienţilor cu cancer, imunodeprimaţi.
Acestea pot avea unele manifestări înşelătoare comparativ cu cele apărute la copiii cu imunitate normală şi pot pune probleme de diagnostic pozitiv şi diferenţial, precum şi în alegerea schemei terapeutice optime.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Moschovi M, Adamaki M, Vlahopoulos SA. Progress in treatment of viral infections in children with acute lymphoblastic leukemia Hematology-Oncology Unit, First Department of Pediatrics, University of Athens, Aghia Sophi, Oncology Reviews. 2016; volume 10:300
- Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia. Lancet. 2013;381:1943-55.
- Benites ECA, Cabrini DP, Silva ACB, et al. Acute respiratory viral infections in pediatric cancer patients undergoing chemotherapy. J Pediatr. (Rio J). 2014;90:370-6.
- Bakhshi S, Padmanjali KS, Arya LS. Infections in childhood acute lymphoblastic leukemia: An Analysis of 222 Febrile Neutropenic Episodes, Pediatric Hematology and Oncology, 2008; 25:5, 385-392.
- Hakim H, Dallas R, Zhou Y et al. Acute respiratory infections in children and adolescents with acute lymphoblastic leukemia. Cancer. 2016; 1(122):798–805.
- De Pauw B, Walsh TJ, Donnelly JP et al. European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group; National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis. 2008; 46:1813–1821.
Articole din ediţiile anterioare
Portal cavernoma in children – complications and evolution
Tromboza de venă portă este o afecţiune rară, dar reprezintă o cauză importantă de hipertensiune portală în patologia pediatrică. Principalii facto...