The present paper constitutes a review of the existing literature data regarding direct and/or indirect diagnostic tests performance for canine leptospirosis, along with interpretations from the authors based on literature and personal experiences. Thus, depending on the method of choice, each test workflow is presented along with its limitations, the final goal being the implementation of a correct diagnostic protocol based on scientific facts.
Actualizarea protocolului de diagnostic în leptospiroza canină
Updates on canine leptospirosis diagnostic protocol
First published: 19 aprilie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.30.1.2018.1585
Abstract
Rezumat
Prezenta lucrare se constituie într-o sinteză a datelor existente în literatura de specialitate cu privire la performanţele testelor de diagnostic directe şi/sau indirecte pentru leptospiroză la câine, alături de opinii şi interpretări de ordin personal, bazate atât pe datele extrase, cât şi pe experienţa proprie. Astfel, în funcţie de testul de diagnostic ales, sunt descrise metodologia de lucru, aspecte de ordin tehnic care stau la baza fiecărui test, precum şi limitările acestuia, astfel încât medicul clinician să poată beneficia de un protocol de diagnostic adecvat şi susţinut ştiinţific.
Introducere
Leptospiroza este o zoonoză importantă, cu origine bacteriană şi distribuţie globală, fiind considerată o boală reemergentă pentru câine(1,23). Agentul patogen (Leptospira spp.) este o spirochetă subţire, Gram-negativă, care beneficiază de motilitate crescută(24). Există două mari categorii în ceea ce priveşte patogenitatea, şi anume speciile saprofite, apatogene, regăsite în mediu (în special apă şi sol), şi cele patogene.
Pentru cele patogene au fost descrise mai multe serogrupuri în cadrul cărora există peste 250 de serovariante, în funcţie de diferenţele la nivel de carbohidraţi conţinuţi în peretele liopolizaharidic(11,16), acestea fiind adaptate pentru anumite gazde, astfel că identificarea serovariantei are o importanţă epidemiologică majoră(1). De asemenea, este foarte important de menţionat faptul că imunitatea pentru leptospiroză este serogrup-specifică(1). Tradiţional, la câine, leptospiroza este produsă de serovariantele L. interrogans şi L. kirschneri, cu toate că au fost semnalate infecţii cu L. wolfii(28) sau L. noguchii(25). La nivel de serogrup, cele mai frecvente înainte de introducerea vaccinării au fost Icterohaemorrhagiae şi Canicola; totuşi, în ultimul timp, din ce în ce mai multe infecţii sunt semnalate cu Grippotyphosa, Pomona, Bratislava şi Autumnalis(4,6,10,11,20,23). La nivel european, serogrupurile predominant identificate sunt Icterohaemorrhagiae, Grippotyphosa, Australis, Sejroe şi Canicola(7,25).
Infecţia poate produce semne clinice de boală cu o paletă largă de manifestări, în principal în funcţie de serovariantă şi statusul imun al gazdei, pornind de la asimptomatic sau semne clinice şterse până la exprimări clinice severe, chiar fulminante(1). Astfel, după diseminarea pe cale hematogenă apar manifestări de disfuncţie în principal la nivel hepatic şi renal; totuşi, ca urmare a caracterului sistemic al bolii, pot fi întâlnite afectări pulmonare (sindromul LPHS – Leptospiral Pulmonary Hemorrhage Syndrome)(14), splenice, retiniene, cardiace, la nivel de sistem nervos central, pancreas sau aparat reproducător.
Având în vedere cele menţionate anterior, respectiv statutul de boală acută/supraacută şi repercusiunile asupra organismului-gazdă (principala cauză a insuficienţei renale acute cu origine infecţioasă, dar şi tabloul lezional cu implicaţii majore la nivel hepatic, renal, pulmonar etc.), se impune stabilirea unui protocol de diagnostic rapid şi precoce, alături de posibilitatea monitorizării eficienţei tratamentului instituit, precum şi a capacităţii de reacţie a organismului faţă de infecţie.
Teste paraclinice
Determinări hematologice şi biochimice
La examenul hematologic se constată leucocitoză semnificativă (40×109/L), ulterior o reacţie leucemoidă, cu un titru de celule albe de peste 80×109/L(14) şi anemie hemolitică generată de toxinele eliberate. Mai mult, are loc scăderea uneori semnificativă a plachetelor sangvine (trombocitopenie) prin diverse mecanisme: consumul datorat activării, aderării şi agregării la nivel de endoteliu vascular(22), fagocitozei la nivelul celulelor Kupffer(28), distrugerii imun-mediate(5,13) sau sechestrare splenică(25).
În ceea ce priveşte examenul biochimic, are loc o creştere aproape constantă a valorilor ureei şi creatininei serice, alături de hiperactivitatea alanin-aminotransferazei (ALT), aspartat-aminotransferazei (AST) şi fosfatazei alcaline (FA/ALP)(25). Hiperbilirubinemia apare constant însoţită de creşterea azotemiei(10,11).
La examenul biochimic urinar, în funcţie de gradul de afectare renală se poate întâlni izostenurie (mai rar hipostenurie)(2,11,18,24), alături de proteinurie de diverse grade (acest lucru fiind, de altfel, singura constantă în modificările renale)(25).
Rezumativ, modificările paraclinice susţin afectarea primară a funcţiilor hepato-renale, alături de fenomene de vasculită generalizată; totuşi, în opinia autorilor, acestea nu sunt capabile să genereze un diagnostic din cauza existenţei lor (cu diferite grade de exprimare) într-o multitudine de alte boli, mai ales cu origine infecţioasă şi/sau intoxicaţii. Acest lucru nu reduce însă cu nimic rolul acestor determinări, fiind extrem de importante în ceea ce priveşte prognosticul individual şi mai ales monitorizarea capacităţii funcţionale la nivel de organe vitale.
Examenul ultrasonografic
Cele mai importante şi vizibile modificări se regăsesc la nivel renal, constând în hiperecogenitate corticală, renomegalie, pielectazie de obicei moderată, dilataţie vasculară şi, foarte important, existenţa unei bandelete hiperecogene la nivel de medulară(8). La nivel hepatic se constată hepatomegalie de diferite grade (de obicei uşoară spre moderată), splenomegalie (similar ca amplitudine cu hepatomegalia), creşterea morfometrică a pancreasului, alături de hipoecogenitate(2,3,14,18,24,25).
Teste de confirmare
Diagnosticul de certitudine implică utilizarea testelor specifice de detecţie a patogenului, alături de testare serologică pentru identificarea răspunsului imun al gazdei. Standardul de aur este reprezentat de izolarea in vitro a patogenului; totuşi, valoarea de diagnostic reală a unei astfel de abordări este extrem de scăzută, în principal din cauza dificultăţilor de izolare şi a timpului necesar, de până la 6 luni(1,25). În trecut s-a mai utilizat şi microscopia în câmp întunecat, dar şi în acest caz valoarea de diagnostic este una extrem de redusă, din cauza viabilităţii scăzute a patogenului în proba biologică, precum şi a sensibilităţii şi specificităţii reduse a testului(1,25).
Examene serologice
Dintre toate categoriile de teste serologice care pot fi cel puţin teoretic disponibile, testul de aglutinare microscopică (MAT – microscopic agglutination test) este cel mai des utilizat, fiind de altfel testul de referinţă inclusiv la nivel european. Procedura de diagnostic implică, aşa cum sugerează şi denumirea, fenomenul de aglutinare a patogenului în prezenţa anticorpilor specifici. Aşadar, anticorpii din serul pacientului vor reacţiona specific cu serogrupul de Leptospira implicat în infecţie, cu posibilitatea de evaluare a titrului de anticorpi prin efectuarea de diluţii seriale – în acest caz, calculul titrului de anticorpi se efectuează prin identificarea diluţiei minime la care se observă fenomenul de hemaglutinare(17).
Din punct de vedere tehnic, coroborată cu specificitatea de serogrup a răspunsului imun, testarea implică existenţa în cadrul laboratorului a unei colecţii cât mai generoase, lucru de multe ori dificil de realizat din cauza dificultăţilor de cultivare in vitro a patogenului.
În ceea ce priveşte utilitatea, acesta poate fi aplicat în primul rând pentru evaluarea eficienţei de vaccinare, prin cuantificarea titrului de anticorpi vaccinali, dar şi pentru evaluarea răspunsului imun al gazdei în eventualitatea unei infecţii. Totuşi, din punct de vedere practic şi în special pentru perioada incipientă, în cazul în care testul este utilizat pentru diagnostic, este necesară o retestare după o perioadă de minimum una-două săptămâni, iar în funcţie de rezultat se stabileşte dacă este vorba despre o infecţie activă (caz în care titrul de anticorpi trebuie să fie semnificativ mai mare la a doua retestare)(9,21).
Examene genetice
La modul general, datorită unor avantaje majore legate în special de rapiditate, sensibilitate şi specificitate, testele de biologie moleculară au căpătat un rol important în identificarea şi caracterizarea agenţilor patogeni la animale. Sensibilitatea unor astfel de teste o depăşeşte constant pe cea a tehnicilor devenite clasice, astfel că de cele mai multe ori nu mai este nevoie de izolare/cultivare in vitro. Şi în cazul diagnosticării Leptospira spp. există progrese considerabile, fiind descrise numeroase abordări ale testului(16,19,27). Dintre toate variantele, PCR în timp real (qPCR) beneficiază de avantajul cuantificării ADN-ului, astfel că se poate vorbi fie de un test semicantitativ (încărcătură bacteriană ridicată/medie/scăzută), sau o opţiune superioară reprezentată de un examen cantitativ prin cuantificarea exactă a încărcăturii bacteriene prin utilizarea unor standarde bine caracterizate. Mai mult, au fost descrise protocoale care pot să diferenţieze serogrupurile/serovariantele apatogene de cele patogene, fapt important în ceea ce priveşte diagnosticul personalizat.
La fel ca şi în cazul testului de microaglutinare însă, nici în acest caz nu există o linie clară în ceea ce priveşte protocoalele de lucru care trebuie implementate, alături de date uneori incomplete legate de capacitatea de detecţie a tuturor serovariantelor patogene – fapt extrem de important, deoarece, spre deosebire de testele serologice unde anticorpii pot să detecteze toate serovariantele dintr-un serogrup (serogrup specifici), pentru testele genetice specificitatea este dată de capabilitatea de detecţie a tuturor variantelor genetice, inclusiv din cadrul aceleiaşi serovariante, astfel că acest lucru este mult mai greu de realizat. Din fericire însă, cel puţin pentru protocolul PCR implementat în cadrul laboratorului Facultăţii de Medicină Veterinară Bucureşti, testarea a fost realizată pe un număr mare de serogrupuri/serovariante, astfel încât putem afirma ca testul corespunde cerinţelor de utilizare atât în screening, cât şi în diagnostic personalizat (tabelul 1).
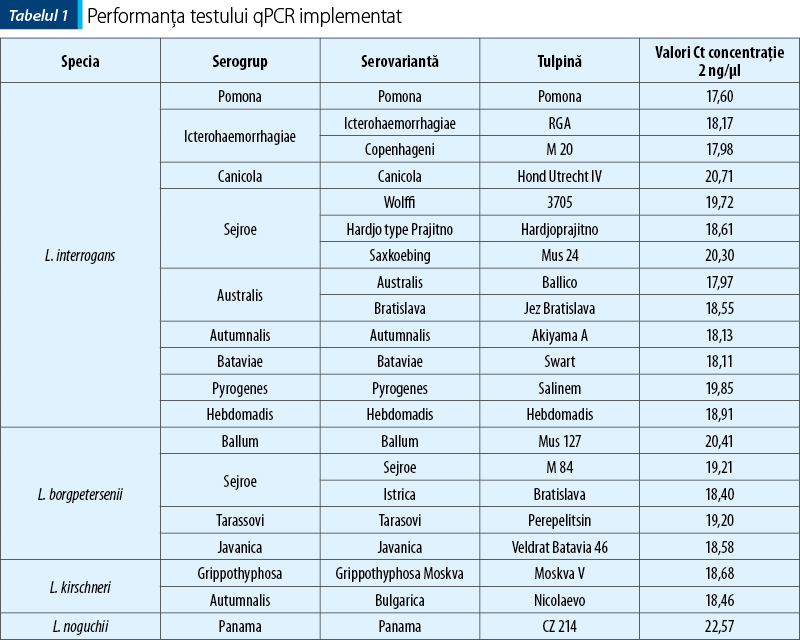
Actualizarea protocolului de diagnostic
Având în vedere cele prezentate anterior, se impune în mod natural o discuţie cu privire la avantajele şi dezavantajele celor două tehnici disponibile şi fezabile pentru un diagnostic personalizat, astfel încât, aşa cum am menţionat, medicul clinician să poată lua o decizie corectă, argumentată şi particularizată fiecărei situaţii.
Testul de microaglutinare
Avantajele acestui test sunt legate în special de posibilitatea de tipizare, aşa cum aminteam, la nivel de serogrup, fapt extrem de important în special din punct de vedere epidemiologic, pentru a beneficia de o situaţie exactă în ceea ce priveşte speciile patogene regăsite într-un anumit areal (de exemplu, la nivel naţional sau, mai restrâns, la nivelul unei anumite zone geografice – regiune, judeţ etc.); mai mult, testul poate fi utilizat pentru evaluarea eficienţei vaccinării, prin cuantificarea răspunsului imun generat (titrul de anticorpi specifici).
Dezavantajele acestuia sunt, din păcate, destul de numeroase, cele mai importante fiind următoarele:
1. Fiind un test serologic pentru dozare de anticorpi, necesită o perioadă considerabilă pentru pozitivare (de minimum 7 zile post-infecţie, de obicei 10 zile)(1,25).
2. Când se obţine un rezultat pozitiv, pentru discriminarea dintre o infecţie anterioară nedepistată şi una activă în acel moment, se recomandă retestarea la un interval de una-două săptămâni pentru evaluarea comparativă a titrului de anticorpi, astfel încât utilizarea ca test unic în formele evolutive supraacute sau acute este restrânsă ori, mai corect, nejustificată.
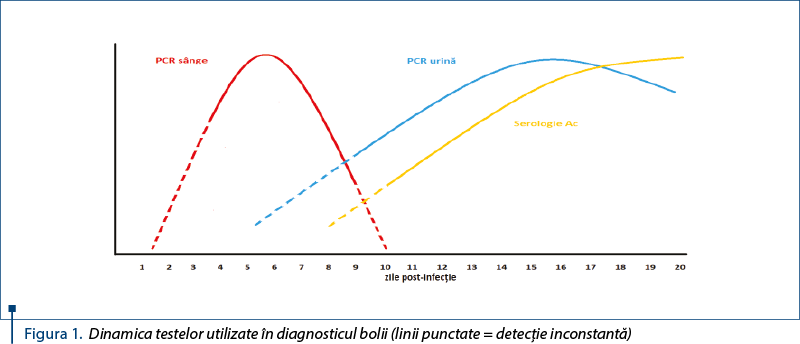
3. Necesită existenţa unui laborator ultraspecializat, cu personal foarte bine instruit, pentru menţinerea unei colecţii adecvate de tulpini bacteriene, fapt care nu este uşor de realizat. Mai mult, se impune existenţa unei palete largi de specii/serogrupuri, astfel încât şansa de a regăsi serogrupul suspicionat în paleta disponibilă să fie cât mai mare şi, consecutiv, să se evite un rezultat fals negativ (figura 1).
Testul qPCR
Cele mai importante avantaje pentru utilizarea acestui test sunt:
1. Sensibilitatea remarcabilă şi, consecutiv, posibilitatea de detecţie a infecţiei începând chiar din ziua a doua după producerea acesteia, când se analizează matricea biologică adecvată (sângele, corespunzător perioadei de bacteriemie). După aproximativ 10 zile însă, matricea biologică recomandată este urina, din cauza patogenezei figura 1).
2. Posibilitatea de cuantificare (identificare încărcătură bacteriană), astfel încât medicul curant să beneficieze de un nivel informativ adecvat (încărcătura bacteriană mare este, fireşte, specifică unei infecţii active/stare de boală).
3. Posibilitatea de monitorizare a răspunsului terapeutic, prin repetarea testului post-administrare antibioterapie şi reevaluarea încărcăturii bacteriene. Când protocolul terapeutic ales este unul eficient, bineînţeles că titrul bacterian descreşte semnificativ sau chiar testul se negativează; dimpotrivă, dacă acest protocol este unul ineficient, titrul bacterian se menţine.
În ceea ce priveşte limitările testului, trebuie menţionate cel puţin următoarele:
1. Testul implementat nu poate face tipizarea la nivel de serogrup/serovariantă, astfel încât, dacă acest lucru este important (studii epidemiologice), se va recurge la testul de microaglutinare.
2. Pentru câinii recent vaccinaţi, testul se va pozitiva, totuşi trebuie făcută menţiunea că încărcătura bacteriană decelată este una scăzută, astfel încât prin cuantificare se face discriminarea dintre o infecţie latentă/vaccinare şi o infecţie activă.
3. Un rezultat slab pozitiv nu furnizează neapărat informaţii cu privire la stadiul evolutiv al bolii, această situaţie putând fi întâlnită atât la debutul infecţiei, în faza de reducere a bacteriemiei consecutiv localizării la nivel de organe, cât şi la pacienţii cu infecţii cronice. Pentru contracararea celei de-a doua situaţii, în vederea unui diagnostic cât mai corect, este necesară analiza simultană a celor două matrice biologice disponibile, şi anume sânge şi urină.
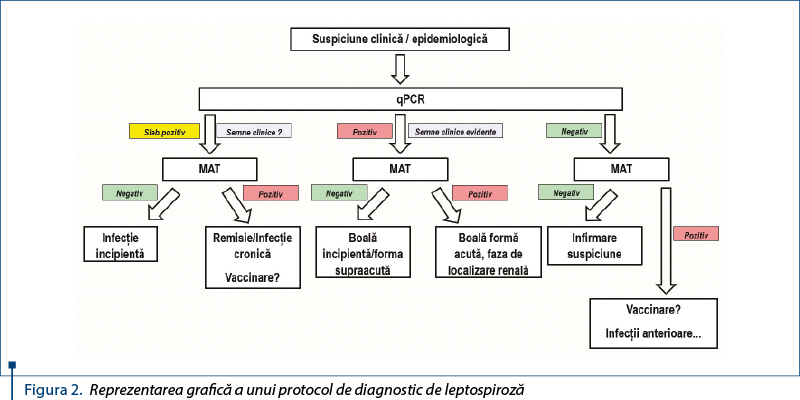
În concluzie, pentru un diagnostic corect şi complet în ceea ce priveşte leptospiroza, este necesară efectuarea ambelor teste confirmatorii discutate anterior, totuşi ţinând cont de utilitatea fiecăruia, în funcţie de stadializare/patogeneză, de avantajele şi limitările tehnice prezentate. Un exemplu al unui astfel de protocol de diagnostic este prezentat în figura 2.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Syke JE et al. ACVIM Small Animal Consensus Statement on Leptospirosis: Diagnosis, Epidemiology, Treatment, and Prevention. J Vet Intern Med. 2011;25:1–13.
- Adin, CA, Cowgill LD. Treatment and outcome of dogs with leptospirosis: 36 cases (1990-1998). Journal of American Veterinary Medical Association. 2000;216, 371-375.
- Birnbaum N, Barr SC, Center SA et al. Naturally acquired leptospirosis in 36 dogs: serological and clinicopathological features. Journal of Small Animal Practice. 1998;39, 231-236.
- Campbell RS. Canine leptospirosis. Aust Vet J. 2007;85:168.
- Davenport A, Rugman FP, Desmond MJ et al. Is thrombocytopenia seen in patients with leptospirosis immunologically mediated? The Journal of Clinical Pathology. 1989;42, 439-440
- Davis MA, Evermann JF, Petersen CR, et al. Serological survey for antibodies to Leptospira in dogs and raccoons in Washington State. Zoonoses Public Health. 2008;55:436–442.
- Ellis WA. Control of canine leptospirosis in Europe: time for a change? Veterinary Record. 2010;167, 602-605.
- Forrest LJ, O’Brien RT, Tremelling MS, et al. Sonographic renal findings in 20 dogs with leptospirosis. Veterinary Radiology & Ultrasound. 1998;39, 337-340
- Fraune CK, Schweighauser A & Francey T. Evaluation of the diagnostic value of serologic microagglutination testing and a polymerase chain reaction assay for diagnosis of acute leptospirosis in dogs in a referral center. Journal of American Veterinary Medical Association. 2013;242, 1373-1380.
- Geisen V, Stengel C, Brem S, et al. Canine leptospirosis infections – clinical signs and outcome with different suspected Leptospira serogroups (42 cases). Journal of Small Animal Practice. 2007;48, 324-328.
- Goldstein RE, Lin RC, Langston CE, et al. Influence of infecting serogroup on clinical features of leptospirosis in dogs. J Vet Intern Med. 2006;20:489–494.
- Ko AI, Goarant C, Picardeau M. Leptospira. The dawn ofthe molecular genetics era for an emerging zoonotic pathogen. Nat Rev Microbiol. 2009;7:736–747.
- Kohn B, Engelbrecht, R, Leibord W. Clinical findings, diagnostics and treatment results in primary and secondary immune-mediated thrombocytopenia in the dog. Kleintierpraxis. 2000;45, 893-907.
- Kohn B, Steinicke K, Arndt G, et al. Pulmonary abnormalities in dogs with leptospirosis. Journal of Veterinary Internal Medicine. 2010;24, 1277-1282.
- Lee SH, Kim KA, Park YG, et al. Identification and partial characterization of a novel hemolysin from Leptospira interrogans serovar lai. Gene. 2000;254, 19-28.
- Levett PN, Morey RE, Galloway RL, Turner DE, Steigerwalt AG, Mayer LW. Detection of pathogenic leptospires by real-time quantitative PCR. J Med Microbiol. 2005;54:45–49.
- Levett PN. Leptospirosis. Clin Microbiol Rev. 2001;14:296–326.
- Mastrorilli C, Dondi F, Agnoli C, et al. Clinicopathologic features and outcome predictors of Leptospira interrogans Australis serogroup infection in dogs: a retrospective study of 20 cases (2001-2004). Journal of Veterinary Internal Medicine. 2007;21, 3-10.
- Merien F, Portnoi D, Bourhy P, Charavay F, Berlioz-Arthaud A, Baranton G. A rapid and quantitative method for the detection of Leptospira species in human leptospirosis. FEMS Microbiol Lett. 2005;249:139–147.
- Miller RI, Ross SP, Sullivan ND, et al. Clinical and epidemiological features of canine leptospirosis in North Queensland. Aust Vet J. 2007;85:13–19.
- Miller MD, Annis KM, Lappin MR, et al. Variability in results of the microscopic agglutination test in dogs with clinical leptospirosis and dogs vaccinated against leptospirosis. Journal of Veterinary Internal Medicine. 2011;25, 426-432.
- Nicodemo AC, Duarte, MI, Alves VA, et al. Lung lesions in human leptospirosis: microscopic, immunohistochemical, and ultrastructural features related to thrombocytopenia. The American Journal of Tropical Medicine and Hygiene. 1997;56, 181-187.
- Ortega-Pacheco A, Colin-Flores RF, Gutierrez-Blanco E, et al. Frequency and type of renal lesions in dogs naturally infected with leptospira species. Ann NY Acad Sci. 2008;1149:270–274.
- Rentko VT, Clark N, Ross LA, et al. Canine leptospirosis. A retrospective study of 17 cases. J Vet Intern Med. 1992;6:235–244.
- Schuller S, Francey T, Hartmann K, Hugonnard M, Kohn B, Nally JE, Sykes J. European consensus statement on leptospirosis in dogs and cats. Journal of Small Animal Practice. 2015;56, 159–179.
- Silva EF, Cerqueira GM, Seyffert N, et al. Leptospira noguchii and human and animal leptospirosis, Southern Brazil. Emerg Infect Dis. 2009;15:621–623.
- Slack AT, Symonds ML, Dohnt MF, Smythe LD. Identification of pathogenic Leptospira species by conventional or real-time PCR and sequencing of the DNA gyrase subunit B encoding gene. BMC Microbiol. 2006;6:95.
- Yang HL, Jiang XC, Zhang XY, et al. Thrombocytopenia in the experimental leptospirosis of guinea pig is not related to disseminated intravascular coagulation. BMC Infectious Diseases. 2006;6, 19.
- Zakeri S, Khorami N, Ganji ZF, et al. Leptospira wolffii, a potential new pathogenic Leptospira species detected in human, sheep and dog. Infect Genet Evol. 10:273–277.