Acute idiopathic polyradiculoneuritis (AIP) is an acute, immune-mediated, post-infectious polyneuropathy with symmetrical ascending weakness, diminished deep tendon reflexes, and nonspecific sensory symptoms. Based on electrophysiological and pathological findings, a demyelinating variant and an axonal variant can be differentiated. Molecular mimicry with common epitopes between infective agents and peripheral nerves is discussed as an important pathophysiological principle. The symptoms progress for a mean of 14 days (up to 4 weeks) and after a plateau of 2-4 weeks can remit spontaneously. Physical rehabilitation consisting in physiotherapy (massage, passive movements) and hydrotherapy (swimming), aimed at stimulating neuromuscular function and preventing early muscle atrophy is the most efficient methods of treatment for AIP in recently years.
Poliradiculoneurita acută idiopatică - diagnostic și tratament
Acute idiopathic polyradiculoneuritis - diagnosis and treatment
First published: 10 aprilie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.26.1.2017.571
Abstract
Rezumat
Poliradiculoneurita acută idiopatică (PAI) descrie o polineuropatie post-infecțioasă, acută, mediată imun, caracterizată prin slăbiciune musculară simetrică, diminuarea reflexelor tendinoase profunde și simptome senzoriale nespecifice. Pe baza constatărilor electrofiziologice și patologice, se pot diferenția formele demielinizantă și axonală. Mimetismul molecular cu epitopi comuni între agenții infecțioși și nervii periferici este luat în discuție ca un principiu fiziopatologic important. Simptomele progresează în medie timp de 14 zile (până la 4 săptămâni) și, după un platou de 2-4 săptămâni, aceasta se poate remite spontan. Reabilitarea fizică reprezentată de fizioterapie (masaj, mișcări pasive) și hidroterapie (înot), cu scopul de stimulare a funcției neuromusculare și prevenire a atrofiei musculare precoce, reprezintă cea mai eficientă metodă de tratament în PAI, în ultimii ani.
Poliradiculoneurita acută idiopatică (PAI), un model animal pentru forma axonală acută a sindromului Landry-Guillain-Barré (LGB) la om, este o boală inflamatoare demielinizantă a sistemului nervos periferic (SNP), mediată imun, cu patogeneză de origine necunoscută, care afectează sistematic și concomitent rădăcinile rahidiene și nervii periferici și doar uneori nervii cranieni (Cuddon, 1998).
Epidemiologic, la om, boala apare la orice vârstă, cu o incidență de 1-2 cazuri la 100.000 de locuitori. La câine, aceasta poate afecta orice rasă și vârstă și se caracterizează frecvent printr-o tetrapareză ascendentă acută cu diferite grade de severitate și prin disfonie; ocazional, asociază pareză de nerv facial și, în cazuri grave, tulburări respiratorii (Holt și col., 2011).
Mecanismul de producere pare să fie autoimun, declanșat probabil prin sensibilizarea limfocitelor periferice la o componentă proteică a mielinei (în urma unei agresiuni cel mai frecvent virale), urmată de distrugerea mielinei prin migrarea limfocitelor sensibilizate la nivelul SNP. Conform altei ipoteze, agentul patogen poate leza celulele Schwann, cu eliberarea secundară de antigene, care prin mecanism imun conduc la demielinizare segmentară. Rezultatul este blocarea conducerii influxului nervos, care determină simptomatologia clinică (Dragomir, 2011). Studiile histopatologice (Rupp și col., 2013) au pus în evidență o dublă componentă a acestei boli: inflamatoare și demielinizantă focală și segmentară, caracterizată prin: infiltrat inflamator, interstițial și perivascular și zone de demielinizare segmentară. Aceste rezultate sunt similare celor descrise într-o boală cu un tablou clinic identic, cunoscută sub numele de paralizia Coonhound, întâlnită în zonele unde ratonii sunt endemici. Patogeneza exactă nu este cunoscută nici în cazul acesteia, dar apariția tulburărilor neurologice a fost asociată cu mușcătura de raton, modificările clinice fiind reproduse experimental prin injectarea de salivă de raton (Jaggy, 2007).
La om, sindromul LGB s-a dovedit a fi asociat cu o varietate de procese infecțioase care modifică sistemul imunitar. Factori antecedenți asociați cu sindromul LGB pentru care există studii includ: Mycoplasma pneumoniae, Campylobacter jejuni, HIV, cytomegalovirus, virusul Epstein-Barr, Borrelia burgdorferi, Toxoplasma gondii, vaccinările contra rabiei sau influenței suine și/sau procedurile chirurgicale (Holt și col., 2011). Mai multe teorii au fost propuse, de-a lungul timpului, pentru a explica modul în care sistemul imunitar stimulat ca răspuns la un factor incitant cauzează ulterior poliradiculoneurita; astfel, se crede că răspunsul imun poate fi montat pe un antigen patogen, similar antigenic cu epitopii din mielina nervilor periferici sau nodurile Ranvier (Bossi și col., 1998). Infecția cu agenți infecțioși specifici este asociată cu variante clinice distincte ale sindromului LGB, sugerând că antigenele-țintă nu sunt distribuite în mod egal de-a lungul sistemului nervos și că epitopi specifici sunt asociați cu anumiți agenți infecțioși.
Nu se cunoaște ce declanșează răspunsul imun la câinii cu PAI în lipsa expunerii la saliva de raton, însă, așa cum a fost demonstrat în sindromul LGB la om, poate exista o asociere între expunerea la unele bacterii, virusuri sau protozoare și debutul PAI. Astfel, în ultimele decenii, unele studii au pus în evidență prezența poliradiculoneuritei acute idiopatice după agenți ca: Ehrlichia canis, Borrelia burgdorferi, Toxoplasma gondii, Neospora caninum, Campylobacter jejuni și virusul Distemper canin (CDV) sau după vaccinarea cu vaccinuri multivalente sau antirabic (Collins, 1994).
În cele mai multe cazuri, tratamentul PAI în medicina veterinară este centrat pe fizioterapie și administrarea de neurotonice, atât timp cât pacientul are apetit prezent pentru apă și alimente, însă există raportări în care ventilația intermitentă cu presiune pozitivă a fost necesară pentru rezolvarea problemelor respiratorii (Rutter și col., 2011). În medicina umană, tratamentul pacienților diagnosticați cu sindromul LGB este mult mai complex, din cauza tulburărilor vegetative asociate cu complicațiile cardiovasculare, urinare și digestive. Implicarea sistemului autonom în evoluția bolii a fost semnalată în mai mult de 50% dintre cazurile grave și poate fi o cauză importantă a decesului (Dimario și col., 2012).
Diagnosticul de PAI se realizează prin coroborarea datelor anamnestice, ale examenului neurologic, lichidului cefalorahidian (LCR), determinarea anticorpilor antireceptori acetilcolină și a testelor de electrodiagnostic reprezentate de: electromiografie (EMG), viteză de conducere nervoasă motorie (VCNm), stimulare repetitivă (RNS) și unde F. Examenul neurologic se caracterizează prin semne de MNP traduse prin prezența de parapareze de tip flasc cu evoluție progresivă spre trenul anterior, absența reacțiilor posturale la nivelul membrelor posterioare și diminuarea acestora pe trenul anterior, cu reflexe miotatice ușor diminuate, uneori fasciculații clinice moderate, cu afectarea nervilor cranieni - voce voalată sau chiar afonie. Pe lângă tulburările de MNP, pacienții pot manifesta și tremor de intenție însoțit de dismetrie discretă pe membrele anterioare.
Diagnosticul diferențial în PAI include afecțiuni ale sistemului nervos, neuropatii periferice, miopatii și tulburări ale joncțiunilor neuromusculare și, în mod special, cuprinde botulismul, miastenia gravis, paralizia de căpușe, bolile produse de protozoare, hipertiroidismul asociat miopatiei sau intoxicațiile cu organofosforice (Rupp și col., 2013). Din cauza acestor posibile etiologii, trebuie realizate mai multe investigații.
Disociația albumino-citologică a lichidului cefalorahidian tipică pacientului cu sindrom LGB din medicina umană susține atingerea radiculară a bolii. Ea se traduce prin creșterea concentrației de proteine (peste 35 mg/dl) și celularitate normală. Titrul negativ al anticorpilor antireceptor acetilcolină se situează sub 0,2 nmol/L, spre deosebire de valoarea de peste 0,6 nmol/L considerată de literatura de specialitate (Faissler și col., 2007) ca fiind un indicator pentru miastenia gravis.
Paralizia de căpușe se poate exclude prin faptul că aceasta este descrisă numai în Australia și America de Nord. Boala se datorează unei neurotoxine care poate fi găsită în saliva femelelor de Dermacentor variabilis, andersoni sau Ixodes holocyclus, specii care nu se găsesc în Europa. Toxina blochează transmisia neuromusculară în termen de câteva zile, prin inhibarea depolarizării membranelor presinaptice. Detectarea căpușelor atașate și îndepărtarea lor conduc în aproximativ 24 de ore la îmbunătățirea statusului clinic (Jaggy, 2007). Paralizia de căpușe se poate exclude, de asemenea, și prin faptul că, la examenul clinic, căpușele nu sunt prezente.
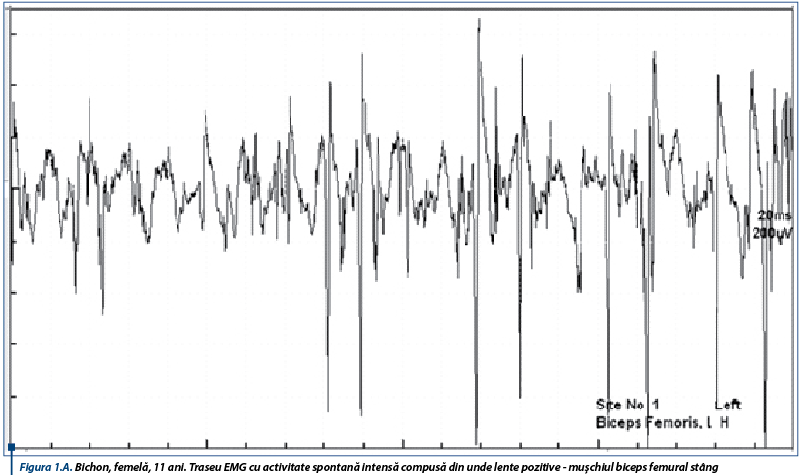
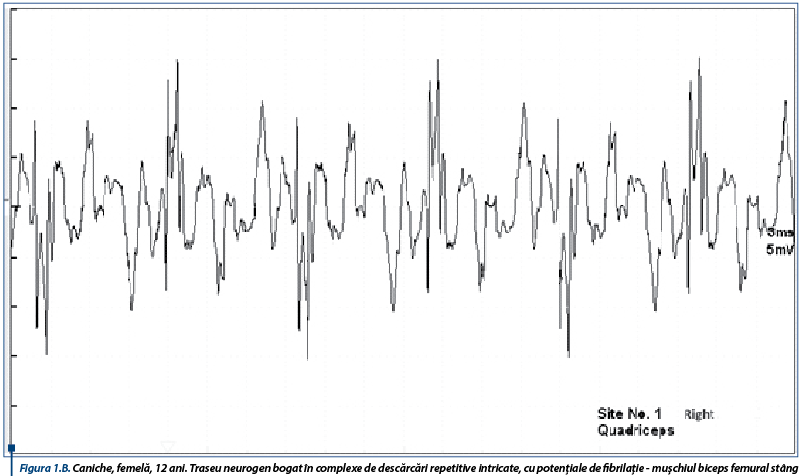
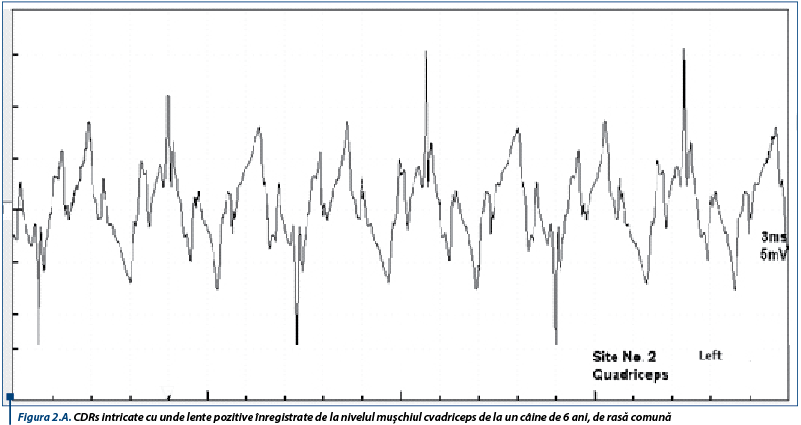
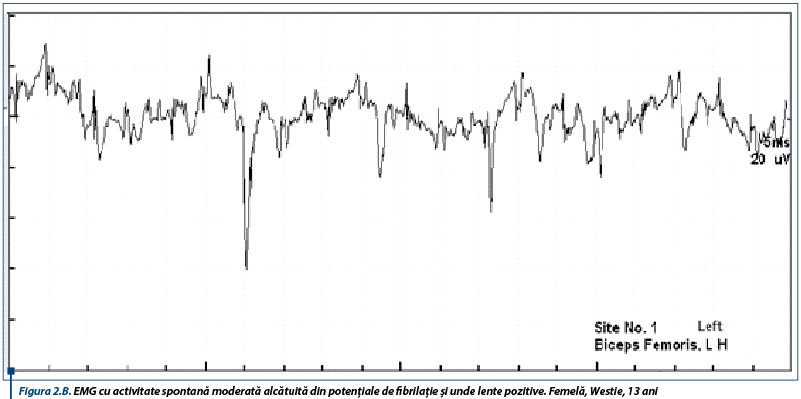
În susținerea diagnosticului de PAI, un rol important le revine testelor de electrofiziologie ce relevă anomalii care obiectivează afectarea nervilor periferici. Astfel, electromiografic, se înregistrează un traseu de tip neurogen, caracterizat prin activitate spontană moderată spre severă în mușchii apendiculari examinați, constând în principal din unde lente ascuțite (figura 1A), complexe de descărcări repetitive (CDRs) intricate cu rare potențiale de fibrilație (figura 1B), CDRs intricate cu unde lente pozitive (figura 2A) și potențiale de fibrilație și unde lente pozitive (figura 2B).
Electroneurograma pune în evidență cMAP polifazice însoțite de creșterea latențelor distale, bloc de conducere și dispersie temporală (figura 3A), acompaniate de reducerea amplitudinilor (figura 3B). Acestea conduc la scăderea VCNm nervilor examinați. Faptul că modificările EMG sunt atât de grave numai după câteva zile de la debutul semnelor ar elimina paralizia de căpușe și botulismul, crescând probabilitatea existenței unei polineuropatii. Existența unei miopatii e mai puțin posibilă, dată fiind anamneza.
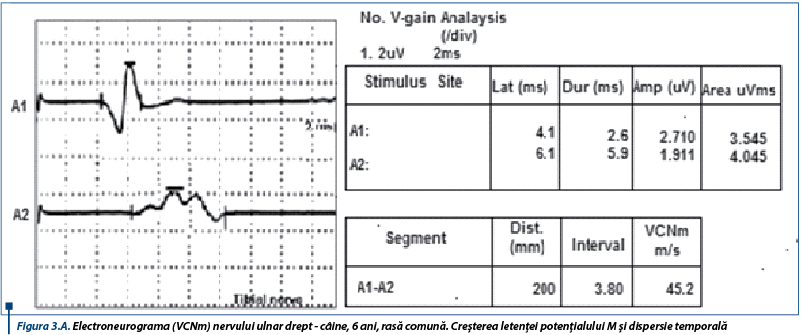
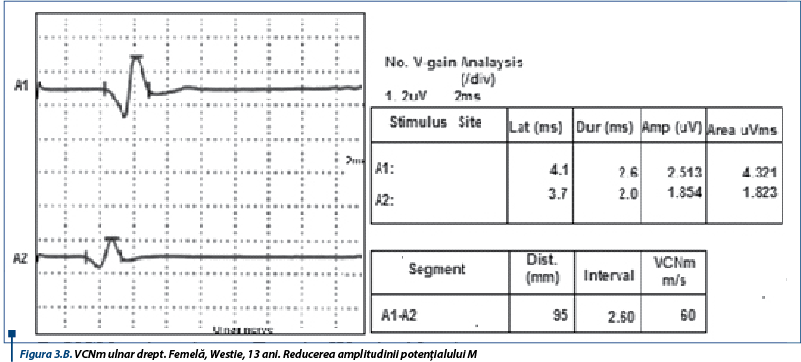
Tetrapareza flască însoțită de hiporeflexie, asociată cu electroneurografii caracterizate prin creșterea latențelor distale, blocuri de conducere și dispersie temporală care determină scăderea VCNm și creșterea latențelor undelor F sunt indicatori fideli ai PAI, rezultate similare fiind raportate și în literatura de specialitate (Hirschvogel și col., 2012).
Tratamentul pacienților este limitat la medicație de susținere cu neurotonice (vitamine din grupul B), antiinflamatoare nesteroidiene și reabilitare fizică. Aceasta din urmă constă în fizio- și hidroterapie pentru stimularea funcției neuromusculare prin menţinerea mobilităţii articulaţiilor, evitarea contracturilor și prevenirea instalării precoce a atrofiei musculare. Conform studiilor din ultimii ani, se pare că acestea sunt metodele cele mai importante de tratament pentru PAI (Faissler și col., 2007; Hirschvogel și col., 2012). De cele mai multe ori, perioada de recuperare a pacienților este cuprinsă între 2 și 14 săptămâni.
Corticosteroizii și chiar cele mai moderne metode de tratament reprezentate de plasmafareză, imunoabsorbția și administrarea de imunoglobuline umane polivalente care pot îmbunătăți evoluția bolii rămân terapii controversate, deoarece mecanismul lor de acțiune în PAI nu este pe deplin cunoscut (Hirschvogel et al., 2012), succesul acestora fiind de cele mai multe ori mai mic decât rata vindecării spontane, care poate atinge valori de până la 50%.
Bibliografie
2. Collins JR. 1994. Seizures and other neurologic manifestations of allergy. Vet Clinics North America Small Anim Pract. 24:735-748.
3. Cuddon PA. 1998. Electrophysiologic assessment of acute polyradiculoneuropathy in dogs: Comparison with Guillain-Barre syndrome in people. J Vet Intern Med 12:294–303.
4. Dimario FJ, Edwards C. 2012. Autonomic dysfunction in childhood Guillain-Barre syndrome. J Child Neurol 27(5): 581-586.
5. Dragomir D. 2001. Boli neuromusculare. În: Ciofu PE, Ciofu Carmen (ed.): Pediatria Tratat, 985-987, Editura Medicală, București.
6. Faissler D, K Jurina, L Cauzinille, F Gaschen, F Adama, A Jaggy. 2007. Peripheral Nervous System and Musculature. In: Atlas and Textbook of Small Animal Neurology-An Illustrated Text (Jaggy A ed.) 2nd Ed, Schluetersche, Germany, pp 271-333.
7. Hirschvogel K, Jurina K, Steinberg TA, Matiasek LA, Matiasek K, Beltrán E, Fischer A. 2012. Clinical course of acute canine polyradiculoneuritis following treatment with human IV immunoglobulin. J Am Anim Hosp Assoc, 48(5):299-309.
8. Holt N, Murray M, Cuddon PA, Lappin MR. 2011. Seroprevalence of various infectious agents in dogs with suspected acute canine polyradiculoneuritis. Journal of Veterinary Internal Medicine 25(2): 261-266.
9. Jaggy A, Platt S, 2007. Small Animal Neurology. An Illustrated Text. Ed. Schlutersche. Hannover, Germany, p. 113-160.
10. Rupp A, Galban-Horcajo F. 2013. Anti-GM2 ganglioside antibodies are a biomarker for acute canine polyradiculoneuritis. J Peripher Nerv Syst 18(1): 75-88.
11. Rutter CR, Rozanski EA, Sharp CR, Powell LL, Kent M. 2011. Outcome and medical management in dogs with lower motor neuron disease undergoing mechanical ventilation: 14 cases (2003-2009). J Vet Emerg Crit Care (San Antonio) 21(5): 531-541.
Articole din ediţiile anterioare
Afecțiuni neuromusculare la câini și pisici
Neuromuscular diseases are disorders of the motor unit (the basic functional and anatomical organization of neurons and muscle fibers). Neuromuscu...
Relevanţa examenelor imagistice în diagnosticul retenţiei urinare mecanice la câine
Retenţia urinară de tip mecanic este caracterizată prin imposibilitatea evacuării conţinutului vezicii urinare, din cauza unor obstrucţii sau ocluz...
Aspecte clinico-imagistice ale diverticulului arahnoidian spinal la câine
Diverticulul arahnoidian spinal este o dilataţie focală a spaţiului subarahnoidian plin cu lichid cefalorahidian, cauzând compresiune medulară şi a...
Particularităţi ecografice ale afecţiunilor hepatice la carnivorele de companie
Ecografia este o metodă de investigaţie medicală care se bazează pe reflectarea ultrasunetelor de către ţesuturi. Este o metodă neinvazivă şi uşor ...