Recurrent miscarriage (RM) is an early pregnancy complication that affects about 1-3% of couples. There are specific characteristics of T and NK cells associated with miscarriage. Successful pregnancy requires strict temporal regulation of maternal immune function to accommodate the growing foetus. Early implantation is facilitated by inflammatory processes that ensure adequate vascular remodelling and placental invasion. To prevent rejection of the fetus, this inflammation must be curtailed. For this article, we studied the literature regarding the immune mechanisms involved in RM and about the immunotherapeutic approaches. Although the lack of high-quality evidence means that immunotherapy is not feasible to use in every women with RM, it could be recommended in those with abnormal T and NK cells.
Cauzele imunologice în avortul spontan recurent
Immune cells in recurrent miscarriage
First published: 29 martie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.7.1.2023.7865
Abstract
Rezumat
Avortul spontan recurent (ASR) este o complicaţie de la începutul sarcinii care afectează aproximativ 1-3% dintre cupluri. Există caracteristici specifice ale celulelor T şi natural killer (NK) asociate cu avortul spontan. O sarcină reuşită necesită o reglare temporală strictă a funcţiei imune materne pentru a se adapta la creşterea fătului. La începutul sarcinii, implantarea timpurie este facilitată de procesele inflamatorii care asigură remodelarea vasculară adecvată şi invazia placentară. Pentru a preveni respingerea fătului, această inflamaţie trebuie să fie redusă. În acest articol am expus date din literatură cu privire la mecanismele imune implicate în ASR şi despre strategiile terapeutice. Cu toate că lipsa dovezilor de înaltă calitate nu permite folosirea imunoterapiei la toate femeile cunoscute cu ASR, există situaţii în care aceasta poate fi recomandată.

Introducere
Avortul spontan recurent (ASR) afectează 1-3% dintre cupluri, fiind definit prin trei pierderi consecutive de sarcină înainte de 20 de săptămâni de gestaţie (Günther et al., 2018). Conform Societăţii Americane pentru Reproducere (American Society for Reproductive Medicine (ASRM), ASR poate fi diagnosticat la femei după două sau mai multe pierderi de sarcină cu dovezi clinice (ultrasonografie sau histopatologie). Eşecul reproductiv cauzează o suferinţă emoţională semnificativă şi are un impact major asupra cuplurilor.
Există mai multe etiologii presupuse de respingere a embrionilor, inclusiv anomalii cromozomiale, tulburări genetice, endocrine, malformaţii uterine, modelul „alogrefei fetale”, infecţii, stresul şi toleranţa imunologică maternă dereglată (Sarkesh et al., 2022). Deoarece aproximativ 50% dintre cazuri sunt idiopatice, cercetările s-au concentrat asupra factorilor de risc imunologic (Günther et al., 2021). Pentru sistemul imunitar feminin, embrionul reprezintă un transplant semialogenic, deoarece jumătate din genele embrionului sunt de origine paternă. În locul unui răspuns imun convenţional, embrionul induce un mecanism secundar de protecţie. Este necesară o interacţiune imunologică intensă între embrion şi sistemul imunitar matern, de la dezvoltarea blastocistului şi până la implantare. Dereglarea imunităţii celulare este mediată de celulele natural killer (NK) şi de dereglarea echilibrului celulelor Th1/Th2/Treg care induc un mediu citotoxic în uter, o angiogeneză inadecvată, un stres oxidativ crescut sau modificări ischemice la nivelul trofoblastului, toate acestea făcând parte din etiologia pierderilor de sarcină. Opţiunile de tratament imunologic includ: infuzia cu intralipid, corticosteroizi, imunoglobuline intravenoase, preparate anti-TNF‑α sau imunoterapia limfocitară (Mekinian et al., 2016). Scopul imunoterapiei cu limfocite este de a regla echilibrul Th1/Th2/Treg şi de a scădea eliberarea de citokine proinflamatorii din celulele Th17 (Günther et al., 2021).
Celulele imune în interfaţa materno-fetală
Celulele imune materne din ţesuturile reproductive vin mai întâi în contact cu antigene paterne când lichidul seminal este ejaculat în vagin în timpul actului sexual. Lichidul seminal este compus din plasmă seminală şi spermatozoizi. Imunitatea maternă recunoaşte antigenele paterne care sunt conţinute în plasma seminală. Spermatozoizii ajung în trompele uterine şi fertilizează ovocitul prezent acolo. După fertilizare, blastocistul migrează spre uter în timp ce suferă clivarea celulară şi în cele din urmă se ataşează de decidua. În timpul perioadei de implantare, blastocistul aderă şi începe să invadeze uterul, endometrul uterin. În sarcina umană, celulele trofoblastului se diferenţiază în trofoblaste viloase şi extraviloase (EVT), formând placenta. EVT-urile invadează decidua şi miometrul. Ulterior implantării, EVT-urile pătrund în continuare în ţesutul matern, artera spirală maternă şi, în cele din urmă, înlocuiesc lumenul vascular (Tsuda et al., 2019). Astfel, se formează interfaţa feto-maternă, iar EVT-urile şi celulele imune materne intră în contact unele cu altele. EVT-urile scapă de celulele imune materne prin controlul complexului major de histocompatibilitate (MHC) şi exprimând molecule imunosupresoare. Sistemul imunitar matern se modifică, de asemenea, în dinamică, pentru a induce toleranţa împotriva ţesuturilor fetale (figura 1).
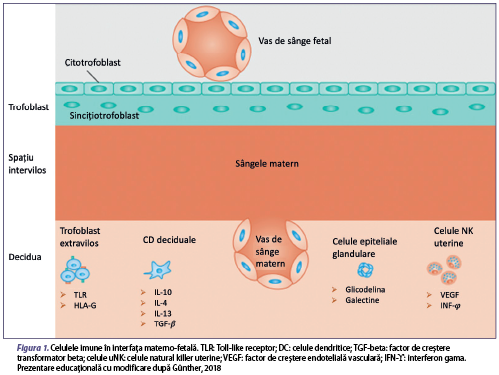
Celulele natural killer (NK)
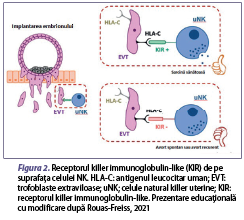
Celulele NK provin din celula stem limfoidă a măduvei osoase şi reprezintă o componentă primară a sistemului imunitar înnăscut. Pot fi identificate două fenotipuri ale celulelor NK: CD3-, CD56+ şi CD16+ formează mai mult de 90% din NK din sângele periferic, iar CD3-, CD56+ şi CD16- formează principala populaţie celulară uterină (NKu). Celulele NK din sângele periferic, pe lângă faptul că joacă un rol substanţial împotriva infecţiilor virale, au un rol tolerogenic în sarcină, prin recunoaşterea embrionului ca self. Un factor important în asigurarea menţinerii sarcinii este dobândit cu ajutorul modificării sistemului imunitar matern prin scăderea numărului de celule NK şi a producţiei de IFN-γ. Celulele NKu sunt eterogene faţă de cele din sângele periferic, au o expresie înaltă a markerului CD56 şi prezintă lipsa markerului CD16 şi nu au un rol fundamental în imunitatea înnăscută, astfel că nu sunt citotoxice. În faza timpurie a dezvoltării sarcinii, celulele NKu au rol în dezvoltarea placentei, iar după implantare secretă factorul endotelial de creştere vasculară (VEGF), angiogenină şi angiopoietină, pentru a asigura fluxul sangvin către făt (Sojka et al., 2019). Spre deosebire de majoritatea celulelor somatice care exprimă moleculele clasice ale complexului major de histocompatibilitate de clasă I (MHC-I), cum ar fi HLA-A sau HLA-B, trofoblastul exprimă doar câteva molecule HLA unice de clasă I, inclusiv HLA-E şi HLA-G neclasice şi singura clasă I polimorfă, de exemplu, HLA-C (Nowak et al., 2017), înducând efectul supresor asupra celulelor NK citotoxice şi determinând toleranţa materno-fetală. Receptorul killer immunoglobulin-like (KIR) de pe suprafaţa celulei NK care detectează MHC de clasa I limitează citotoxicitatea celulelor NKd şi contribuie la menţinerea echilibrului toleranţei imune (figura 2). Embrionul dobândeşte HLA-C de la ambii părinţi, astfel că partenerul ar avea o influenţă directă şi majoră asupra funcţiei celulelor NKu. Celulele NKu diferă semnificativ de celulele NK din sângele periferic şi au proprietăţi semnificativ mai mult secretorii decât citotoxice. Celulele NKu sunt inhibate de HLA-G care sunt exprimate de către trofoblast, cu toate acestea, când comunicarea intercelulară de la celulă la celulă este întreruptă la interfaţa materno-fetală şi celulele NKd sunt într-o stare insuficientă de maturizare, aceasta duce la scăderea toleranţei imune şi la creşterea citotoxicităţii. Se cunosc două interacţiuni extreme în prezent, unul fiind inhibitor KIR-A cu HLA-C2 şi celălalt fiind activator KIR-B cu HLA-C1. Combinaţiile KIR-AA cu HLA-C2 au risc crescut de preeclampsie şi ASR. Prin urmare, în aceste combinaţii, tratamentul imunosupresiv poate fi dăunător sau cel puţin ineficient (Sacks et al., 2021).
Celulele T reglatoare (Treg)
Celulele T reglatoare sunt responsabile de autotoleranţa sistemului imun şi previn apariţia bolilor autoimune. În timpul sarcinii, acestea suferă o creştere fiziologică şi constituie 10-20% dintre celulele imune deciduale în primul trimestru. În cazul în care acest mecanism nu are loc, se observă avorturi spontane recurente (Günther et al., 2018). Celulele Treg sunt esenţiale în controlul inflamaţiei din faza timpurie a sarcinii, prin asigurarea mediului receptiv decidual (Robertson et al., 2018). Primul mecanism descris al celulelor Treg deciduale este de a secreta IL-10 şi TGF-beta, alături de CD25, CTLA4 şi PDL1, mediatori distinctivi care inhibă funcţia celulelor T efectoare în faza incipientă a sarcinii. Celulele Treg mai au şi funcţia de a acţiona asupra altor leucocite şi asupra altor celule nehematopoietice, pentru a favoriza procesul de implantare. Promovează fenotipurile tolerogene ale macrofagelor şi ale celulelor dendritice prin eliberarea TGF-beta, IL-10 şi prin mecanismul CTLA4-mediat. Al doilea mecanism descris este reprezentat de coordonarea eliberării IL-15 de către celulele dendritice şi inhibarea activităţii citolitice a celulelor NKu, având astfel o importanţă în modularea fenotipului celulelor NKu şi în procesul de implantare. Al treilea mecanism este reprezentat de influenţa celulelor Treg asupra celulelor NKu, în vederea dezvoltării placentare adecvate.
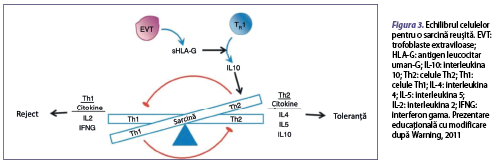
Celulele T helper sunt un grup de limfocite T şi au un rol de sprijin, de „ajutor” în ceea ce priveşte răspunsul imun. Două subgrupe de celule T sunt formate din CD4+ T helper, celulele CD8+ citotoxice şi Treg CD4+ CD25+ (mai sunt denumite celule T supresoare). Celulele pot fi descrise în funcţie de citokinele pe care le secretă: celulele Th1 (figura 3) sunt implicate în răspunsul imunitar celular, infiltrate la nivelul deciduei şi reglează invazia trofoblastului şi participă la remodelarea ţesutului şi la angiogeneză, eliberând IFN-γ, IL-2 şi TNF-α. În acest sens, celulele T citotoxice distrug celulele infectate; în schimb, celulele Th 2 sunt implicate în răspunsul imunitar umoral şi secretă citokinele IL-4, IL-5, IL-9, IL-10 şi IL-13. Aceste citokine întăresc producţia de anticorpi, precum şi proliferarea şi funcţia eozinofilelor. Răspunsurile Th1 suprimă răspunsurile Th2 şi viceversa, când nu sunt în echilibru şi eliberează citokine, influenţează implantarea şi dezvoltarea şi diferenţierea fetală (figura 3). Celulele Th17 se diferenţiază în prezenţa IL-1β, IL-6, IL-23 şi a TGF‑β. Celulele Treg se dezvoltă preferenţial în prezenţa TGF‑β. Un nivel mic de TGF‑β induce transformarea celulelor T CD4+ naive în celule Th17, pe când un nivel crescut stimulează aceste celule să se transforme în celule Treg. Este remarcată o cale patologică de transformare a celulelor Treg în celule proinflamatorii Th17 prin intermediul citokinelor IL-1 beta şi IL-2; mai mult de atât, liniile celulare Th1/Th2/Th17 şi Treg au capacitatea de a se transforma din unele în altele. Celulele Th17 se implică în infiltrarea neutrofilelor şi în inducerea imunităţii protectoare împotriva microbilor extracelulari în uter. De asemenea, celulele Th22 protejează celulele trofoblastice de agenţii patogeni şi de răspunsurile imune inflamatorii ale infecţiei intrauterine (figura 3).
Celulele B sunt un subset de limfocite care sunt implicate în procesul de adaptare şi joacă un rol central în imunitatea umorală, fiind capabile să prezinte antigene şi să elibereze o serie de citokine care influenţează imunitatea (Sarkesh et al., 2022). Celulele B reglatoare (Bregs) sunt produse de IL-10 şi au funcţii imunosupresoare, fiind implicate în reglarea tulburărilor autoimune. Aceste celule contribuie la dezvoltarea Tregs, precum şi la inhibarea maturării CD şi a celulelor T proinflamatorii, cum ar fi Th17 şi Th1, şi, prin urmare, au apărut ca noi mediatori ai toleranţei la sarcină
Tratament
Pentru cuplurile care încearcă să aibă un copil şi care suferă de avorturi spontane recurente, există numeroase abordări terapeutice care vizează exercitarea unui efect modulator asupra sistemului imunitar pentru a creşte şansa unei sarcini sănătoase. Pe lângă imunizarea activă cu limfocite ale partenerului, există, de asemenea, o serie de terapii imunitare suplimentare concepute pentru a avea un efect pozitiv asupra ratei de implantare, cum ar fi administrarea de glucocorticoizi, perfuzii cu intralipid, administrarea de imunoglobulină intravenoasă şi terapia cu agenţi anti-TNF-α.
Imunoglobulina intravenoasă (Ig i.v.)
Ig i.v. reglează raportul Treg/Th17 în favoarea celulelor Treg, scade acţiunea citotoxică şi numărul celulelor NK şi interacţionează cu complementul în scopul stimulării acţiunii antiinflamatorii.
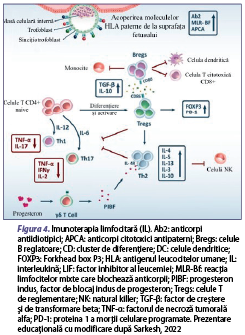
Imunoterapia limfocitară (IL)
IL este cea mai noua abordare de tratament care stimulează sistemul imunitar al mamei, permiţându-i acesteia să tolereze eficient sarcina din punct de vedere genetic. Limfocitele alogenetice se administrează pacientei de la partener sau de la o altă persoană care trebuie să corespundă conform criteriilor de includere (mai mult de două ASR înainte de 24 se săptămâni de gestaţie sau mai mult de două fertilizări, excluderea celorlalte cauze de ASR) după ce se efectuează prelevarea sângelui (70-100 ml), prepararea sângelui prin separarea limfocitelor, administrate subcutanat sau intradermal, intramuscular sau intravenos. Se consideră că doze mici de IL reglează echilibrul Th1/Th2/Treg şi descresc eliberarea citokinelor proinflamatorii din celulele Th17 (figura 4).
Infuzia cu intralipid
Această terapie oferă organismului femeii acizi graşi esenţiali, care ajută la diminuarea celulelor NK.
Preparate anti-TNF‑α
Terapia cu preparatele anti-TNF‑α reduce răspunsul inflamator, neutralizând TNF‑α. Utilizarea terapiei anti-TNF‑α în combinaţie cu doze mici de aspirină, heparină şi/sau Ig i.v. a oferit rezultate favorabile, crescând incidenţa naşterilor de feţi vii la femeile cunoscute anterior cu infertilitate.
Glucocorticoizi (GC)
Se consideră că tromboza uteroplacentară şi vasoconstricţia rezultă din legarea anticorpilor de membrana fosfolipidică endotelială. GC au efect supresor asupra autoanticorpilor.
Concluzii
Studiile recente arată că factorii imunologici, cum ar fi un răspuns anormal al sistemul imunitar al femeii la embrionul în curs de dezvoltare, pot fi cauza eşecului repetat al implantării embrionilor sau a avortului spontan recurent.
După ce s-au exclus celelalte cauze de ASR şi se suspectează o cauză legată de sistemul imunitar, pacientele pot apela la efectuarea testelor imunologice. În urma testului, dacă sunt detectate niveluri anormale de celule imune (analiza activităţii NK, testul citokinelor TH1/TH2, testul de activitate Treg, Kir- HLA C), specialiştii pot recomanda terapie adecvată fiecărei paciente. Reacţia imunologică de cauză aloimună se referă la reacţia organismului la componente celulare/tisulare provenite de la un alt organism din aceeaşi specie. Componenta din structura embrionului dată de antigenul patern face ca embrionul să fie comparat cu o alogrefă. Mecanismul prin care un embrion invadează endometrul pentru a se implanta este un mecanism pe cât de complex, pe atât de uimitor, care implică un echilibru perfect între componentele embrionului şi cele ale endometrului.
Într-o sarcină reuşită se formează conexiuni complexe între trofoblastul fetal şi sistemul imunitar al mamei din decidua. Embrionul însă, chiar dacă este considerat imunologic diferit faţă de mamă, va reuşi să se implanteze în endometru pentru a evolua. Studiile au arătat că sistemul imunitar înnăscut joacă un rol important în reproducere, iar celulele NKu sunt celulele principale în crearea şi menţinerea unei sarcini sănătoase. De-a lungul anilor, mai multe studii au încercat să găsească o legătură între bolile legate de infertilitate şi sistemul imunitar. De asemenea, se poate observa că, în conformitate cu dovezile şi studiile clinice, scăderea sau creşterea şi disfuncţia celulelor NK şi Th pot declanşa complicaţii ale sarcinii şi infertilitate. Studiile efectuate până în prezent au arătat că alterarea activităţii celulelor NK poate juca un rol în tratarea unor boli legate de infertilitate. Astăzi, aşteptările pacienţilor în ceea ce priveşte tratamentul tulburărilor de fertilitate sunt în creştere. Unele studii au sugerat rolul celulelor imune în complicaţiile asociate infertilităţii, în care imunoterapia vizează celulele imune, inclusiv celulele NK. De asemenea, în unele studii recente a fost investigat rolul unor medicamente imunosupresoare care au un efect de toleranţă imună asupra fătului în curs de dezvoltare. Una dintre moleculele HLA importante discutate în acest articol este HLA-G, care este un ligand al unor receptori, inclusiv al KIR2DL4, în celulele imune, în special în celulele NK. Această moleculă controlează funcţia celulelor imune în timpul sarcinii şi se pare că, odată cu mai multe cercetări clinice asupra ei, această moleculă poate fi utilizată ca indicator clinic şi ţintă terapeutică în bolile endometriale şi reproductive. Se pare că, în viitor, prin determinarea şi standardizarea clinicii ale analizei HLA-G şi introducerea acestei molecule în testele de rutină, va fi posibil să contribuie la diagnosticarea bolii şi la urmărirea pacientelor. În plus faţă de cele amintite, o sarcină reuşită necesită un echilibru între celulele NK reglatoare şi celulele NK citotoxice şi utilizarea medicamentelor care pot echilibra aceste celule pentru a trata complicaţiile sarcinii.

Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Günther V, Alkatout I, et al. Active Immunisation with Partner Lymphocytes in Female Patients Who Want to Become Pregnant - Current Status. Geburtshilfe Frauenheilkd. 2018 Mar;78(3):260-273. doi: 10.1055/s-0044-101609. PubMed PMID: 29576631; PubMed Central PMCID: PMC5862550.
- Practice Committee of the American Society for Reproductive Medicine. Electronic address: asrm@asrm.org. Definitions of infertility and recurrent pregnancy loss: a committee opinion. Fertil Steril. 2020 Mar;113(3):533-535. doi: 10.1016/j.fertnstert.2019.11.025. Epub 2020 Feb 27. PMID: 32115183.
- Günther V, Alkatout I, et al. Live Birth Rates after Active Immunization with Partner Lymphocytes. Biomedicines. 2021 Sep 29;9(10):1350. doi: 10.3390/biomedicines9101350. PubMed PMID: 34680467; PubMed Central PMCID: PMC8533392.
- Mekinian A, Cohen J, et al. Unexplained Recurrent Miscarriage and Recurrent Implantation Failure: Is There a Place for Immunomodulation? Am J Reprod Immunol. 2016 Jul;76(1):8-28. doi: 10.1111/aji.12493. PubMed PMID: 26847715.
- Shojaei Z, Jafarpour R, et al. Functional prominence of natural killer cells and natural killer T cells in pregnancy and infertility: A comprehensive review and update. Pathol Res Pract. 2022 Aug 8;238:154062. doi: 10.1016/j.prp.2022.154062. PubMed PMID: 35987030.
- Sojka DK, Yang L, Yokoyama WM. Uterine Natural Killer Cells. Front Immunol. 2019 May 1;10:960. doi: 10.3389/fimmu.2019.00960. PubMed PMID: 31118936; PubMed PMCID: PMC6504766.
- Nowak I, Wilczyńska K, et al. KIR, LILRB and their Ligands’ Genes as Potential Biomarkers in Recurrent Implantation Failure. Arch Immunol Ther Exp (Warsz). 2017 Oct;65(5):391-399. doi: 10.1007/s00005-017-0474-6. PubMed PMID: 28523429; PubMed PMCID: PMC5602049.
- Sacks G, Finkelstein E. Natural killer cells and reproductive success. Am J Reprod Immunol. 2021 Apr;85(4):e13291. doi: 10.1111/aji.13291. PubMed PMID: 32562587.
- Robertson SA, Care AS, Moldenhauer LM. Regulatory T cells in embryo implantation and the immune response to pregnancy. J Clin Invest. 2018 Oct 1;128(10):4224-4235. doi: 10.1172/JCI122182. PubMed PMID: 30272581; PubMed PMCID: PMC6159994.
- Ali S, Majid S, Niamat Ali M, Taing S. Evaluation of T cell cytokines and their role in recurrent miscarriage. Int Immunopharmacol. 2020 Mar 3;82:106347. doi: 10.1016/j.intimp.2020.106347. PMID: 32143004.
- Sarkesh A, Sorkhabi AD,et al. Allogeneic lymphocytes immunotherapy in female infertility: Lessons learned and the road ahead. Life Sci. 2022 Jun 15;299:120503. doi: 10.1016/j.lfs.2022.120503. PubMed PMID: 35381221.
- Tsuda S, Nakashima A, Shima T, Saito S. New Paradigm in the Role of Regulatory T Cells During Pregnancy. Front Immunol. 2019 Mar 26;10:573. doi: 10.3389/fimmu.2019.00573. PubMed PMID: 30972068; PubMed PMCID: PMC6443934.
- Warning JC, McCracken SA, Morris JM. A balancing act: mechanisms by which the fetus avoids rejection by the maternal immune system. Reproduction. 2011 Jun;141(6):715-24. doi: 10.1530/REP-10-0360. PubMed PMID: 21389077.
- Homayouni V, Dehghan F, Sherkat R. The Role of NK Cells in Recurrent Miscarriage (Abortion). Interchopen 2022. DOI:10.5772/intechopen.109572
- Rouas-Freiss N, Moreau P, LeMaoult J, Papp B, Tronik-Le Roux D, Carosella ED. Role of the HLA-G immune checkpoint molecule in pregnancy. Hum Immunol. 2021 May;82(5):353-361. doi: 10.1016/j.humimm.2021.01.003. PubMed PMID: 33745758.
Articole din ediţiile anterioare
Alergia alimentară la oul de găină. Actualizări în diagnosticul şi abordarea terapeutică
Alergia alimentară la ou este frecventă în rândul populaţiei pediatrice, manifestându-se prin diferite fenotipuri clinice. Lucrarea de faţă are ca ...
Sindromul polen-alimente (PFAS)
Alergiile sunt întâlnite în populaţie în proporţie de 20-30%, cele mai frecvente fiind cele respiratorii, determinate de polenul arborilor şi al pl...
Specialistul în faţa problemelor imunologice ale infertilităţii
Avortul spontan recurent (ASR) este o maladie multifactorială cu o etiologie complexă. Etiologia rămâne neidentificată în peste 50% dintre cazuri. ...
Noi direcţii în imunoterapia alergenică
Este cunoscut faptul că imunoterapia alergenică (AIT) este singurul tratament care poate modifica evoluţia bolii alergice şi poate conferi toleranţ...