SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2) infection, also called COVID-19 (coronavirus disease 2019), has been the main public health issue for over a year. There are over 160 million people diagnosed with COVID-19. The authorization of first vaccines in the European Union is the key factor in the global response to the health crisis. In Romania, four vaccines are in use: Pfizer-BioNTech (BNT162b2), Moderna (mRNA-1273), AstraZeneca-Oxford (Vaxzevria – ChAdOx1 nCoV-19) and Johnson and Johnson’s (Ad26.COV2.S). All four of them may cause adverse cutaneous reactions with different morphology. The most frequent are local adverse reactions, which do not require allergological assessment and do not contraindicate the administration of the second dose. Rarely, delayed cutaneous reactions such as “COVID arm” or dermal filler reactions have been reported and are accompanied by the need for elucidation of the pathophysiological mechanisms underlying them. There are also severe general reactions, but these are very rare. Allergological expertise is indispensable in the risk assessment of patients presenting with cutaneous reactions after the first dose of the vaccine. The allergist can also decide the need for skin testing to the vaccine. This approach could prevent patients from being deprived of the huge benefit of anti-COVID-19 immunization.
Reacţii adverse cutanate ale vaccinurilor anti-COVID-19. Ce ştim până acum?
Cutaneous adverse effects of COVID-19 vaccines: what do we know so far?
First published: 27 aprilie 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.5.2.2021.4898
Abstract
Rezumat
Infecţia cu sindromul respirator acut sever cu coronavirusul 2 (SARS-CoV-2), denumită şi COVID-19, reprezintă de peste un an principala problemă de sănătate publică cu care se confruntă populaţia globului. Numărul persoanelor diagnosticate cu această infecţie depăşeşte 160 de milioane. Autorizarea primelor vaccinuri anti-COVID-19 în Uniunea Europeană reprezintă piatra de temelie a răspunsului la criza de sănătate. În România se utilizează patru vaccinuri: Pfizer-BioNTech (BNT162b2), Moderna (mRNA-1273), AstraZeneca-Oxford (Vaxzevria – ChAdOx1 nCoV-19) şi Johnson and Johnson (Ad26.COV2.S). Administrarea acestora poate fi urmată de apariţia unor reacţii adverse cutanate cu diferite morfologii. Cele mai frecvente sunt reacţiile adverse locale, care nu impun evaluare alergologică şi nu contraindică administrarea celei de-a doua doze. De asemenea, au fost raportate şi reacţii cutanate tardive mai rare, precum „COVID arm”, sau reacţii cutanate la nivelul fillerelor dermice, în cazul cărora trebuie elucidate mecanismele fiziopatologice care stau la baza acestora. Pot apărea şi reacţii adverse generale severe, dar acestea sunt foarte rare. Expertiza alergologică este indispensabilă în stratificarea riscului pacienţilor cu reacţii cutanate debutate după prima doză de vaccin şi pentru evaluarea necesităţii testării cutanate. Prin aceasta, se poate evita privarea unor pacienţi de beneficiul imens al imunizării împotriva COVID-19.
Date generale
Infecţia cu SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2) reprezintă de peste un an principala problemă de sănătate publică cu care se confruntă populaţia globului. Până la sfârşitul lui aprilie 2021, peste 160 de milioane de oameni au fost diagnosticaţi cu această afecţiune şi peste 3 milioane de oameni şi-au pierdut viaţa din cauza infecţiei. Statistica aceasta sumbră este contracarată de eforturile intense internaţionale depuse pentru dezvoltarea promptă a vaccinurilor şi imunizarea extensivă a populaţiei(1).
Autorizarea primelor vaccinuri anti-COVID-19 reprezintă piatra de temelie a răspunsului la criza de sănătate. Acest răspuns rapid oferă, pe de o parte, speranţa controlului pandemiei şi, pe de altă parte, baza pentru o nouă abordare în cercetarea ştiinţifică pentru dezvoltarea vaccinurilor.
În decembrie 2020, la aproximativ nouă luni de la declararea pandemiei, Agenţia Europeană a Medicamentului (EMA – European Medicines Agency) a acordat o autorizaţie de urgenţă pentru primele două vaccinuri anti-COVID-19: Pfizer/BioNTech (Comirnaty-BNT162b2) şi Moderna (mRNA-1273). Ulterior, în februarie 2021 au fost aprobate alte două vaccinuri: AstraZeneca-Oxford (Vaxzevria-ChAdOx1 nCoV-19) şi Johnson and Johnson (Ad26.COV2.S)(2).
Deşi necesitatea vaccinurilor este evidentă, receptivitatea populaţiei la vaccinare este direct proporţională cu gradul de încredere în siguranţa şi eficienţa acestora.
Succesul programului de vaccinare depinde de acceptarea balanţei dintre beneficiile imunizării şi potenţialele riscuri postvaccinale.
Vaccinurile anti-COVID-19
Există trei tipuri de vaccinuri anti-COVID-19: vaccinuri de tip ARN mesager (ARNm) cu nucleozide modificate, Pfizer-BioNTech (Comirnaty – BNT162b2) şi Moderna (mRNA-1273), vaccinuri cu vector adenoviral, AstraZeneca-Oxford (Vaxzevria – ChAdOx1 nCoV-19), Johnson and Johnson (Jansen-Ad26.COV2.S) şi CanSinoBIO (Ad5-nCoV), precum şi vaccinuri cu virus inactivat, Sinofarm (BBIBP-CorV), Sinovac (CoronaVac)(3). În România sunt utilizate vaccinurile Pfizer începând din decembrie 2020, Moderna şi AstraZeneca – din februarie 2021 şi Johnson and Johnson – din mai 2021 (tabelul I)(4).
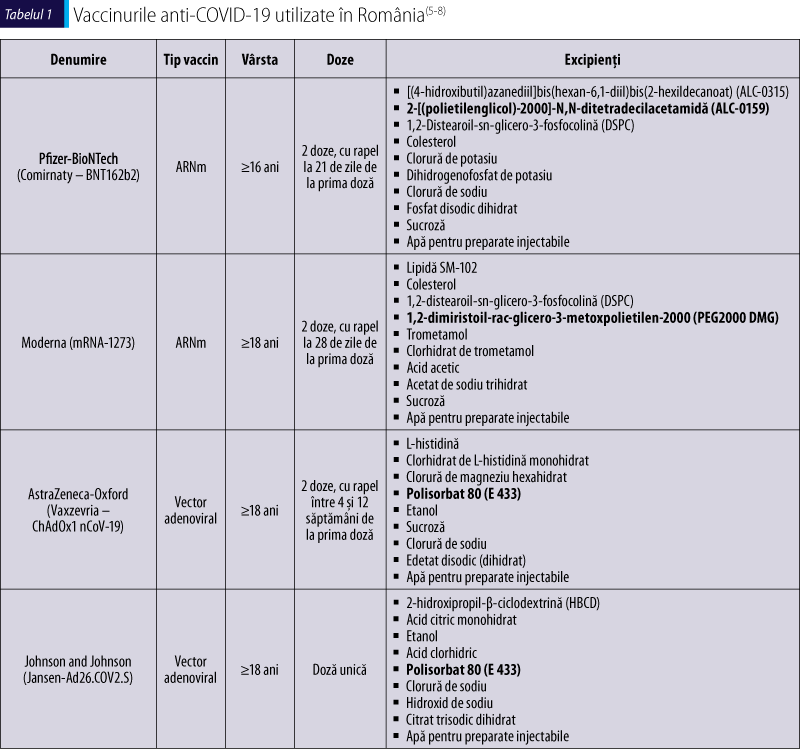
La nivel mondial, până la 5 mai 2021 au fost administrate 1171658745 de doze de vaccin şi 596981118 persoane au fost vaccinate cu cel puţin o doză (9). Conform datelor publicate în Platforma naţională de informare cu privire la vaccinarea împotriva COVID-19, în România au fost imunizate 3580368 de persoane până la 8 mai 2021. Au fost raportate 14709 reacţii adverse, majoritatea fiind de tip general. La data publicării, 135 de reacţii adverse erau în curs de investigare(4).
Tipuri de reacţii adverse
Ca în cazul oricărui medicament, administrarea vaccinurilor anti-COVID-19 poate fi urmată de diverse manifestări, catalogate drept reacţii adverse asociate imunizării. Acestea includ atât reacţii adverse cauzate de vaccin, cât şi manifestări care apar în imediata apropiere temporală de administrarea vaccinului, dar care nu au o legătură de cauzalitate cu acesta. În ceea ce priveşte extensia şi conexiunea cu locul de injectare, reacţiile adverse pot fi locale sau generale(10).
Cele mai frecvente reacţii adverse postvaccinale sunt cele locale, precum eritem, edem, durere, şi cele generale, precum febră, frison, cefalee, mialgii sau greaţă. Ele sunt puţin problematice şi adesea autolimitante(10).
Reacţiile adverse severe raportate în cursul vaccinării, care impun o monitorizare specială a pacientului afectat, sunt foarte rare. Ele sunt reprezentate de anafilaxie, în special pentru vaccinurile de tip ARNm(11), şi tromboze atipice de sinus venos cerebral sau vene periferice, pentru vaccinurile cu vector adenoviral(12).
Anafilaxia
Anafilaxia apare foarte rar după vaccinare(13). Ea poate surveni după administrarea oricărui tip de vaccin, însă cele mai multe cazuri au fost raportate după imunizarea cu vaccinurile Pfizer şi Moderna. Pentru vaccinul Pfizer, rata de apariţie a anafilaxiei este de 11,1 cazuri la un milion de doze administrate, 71% dintre ele manifestându-se în primele 15 minute(14). Pentru vaccinul Moderna a fost raportată o rată de 2,5 cazuri de anafilaxie la un milion de doze administrate, 9 din 10 cazuri prezentând simptomatologie în primele 15 minute(15). Se consideră că aceste reacţii de hipersensibilitate se datorează excipienţilor din compoziţia vaccinurilor(11). Polietilenglicolul (PEG) este un excipient comun prezent în vaccinurile de tip ARNm. Acesta este o parte componentă a nanoparticulei lipidice care protejează ARNm şi facilitează penetrabilitatea celulară. PEG, cunoscut şi ca macrogol, este un compus polieteric frecvent utilizat ca aditiv în diverse cosmetice, medicamente sau alimente.
În cazul vaccinurilor anti-COVID-19 ARNm, există o moleculă de PEG cu o greutate moleculară de 2000 g/mol (PEG2000), diferită de cea utilizată în preparatele comercializate în prezent. Polisorbatul 80 este excipientul prezent în vaccinurile cu vector adenoviral. PEG şi polisorbatul pot prezenta cross-reactivitate la testarea cutanată, aceasta fiind dovedită în câteva cazuri în care s-a evaluat sensibilizarea la ambii excipienţi simultan(16,17).
Trombocitopenia imună protrombotică indusă de vaccin
Până la 22 martie 2021, în baza de date europeană pentru siguranţa medicamentului (EudraVigilance) au fost raportate 62 de cazuri de tromboze de sinus venos cerebral şi 24 de cazuri de tromboze în teritoriul venos splanhnic, după vaccinarea cu vaccinul Vaxzevria (AstraZeneca)(18). Agenţia Europeană a Medicamentului (EMA) a emis ulterior un comunicat care listează evenimentele trombotice cu trombocitopenie ca un efect advers foarte rar al acestui vaccin, cu o incidenţă între 4,3 şi 5,8 la un milion de vaccinări. Pentru acest efect advers a fost propusă definiţia de trombocitopenie imună protrombotică indusă de vaccin. Ca mecanism patogenic, este incriminată trombocitopenia datorată unui răspuns imun declanşat de vaccin împotriva factorului plachetar 4(19). Acest tip de evenimente adverse severe rare poate asocia leziuni cutanate: erupţii peteşiale, eritem sau edem al extremităţilor, cu tegumente palide şi reci(18). Acelaşi tip de evenimente tromboembolice a fost raportat şi pentru vaccinul Johnson and Johnson(20).
Reacţiile adverse cutanate
Reacţiile adverse cutanate sunt de o intensitate uşoară sau moderată şi sunt adesea autolimitante. Ele se pot prezenta cu o morfologie diversă. Au fost raportate cele mai frecvente cinci tipuri de reacţii cutanate apărute după vaccinurile Pfizer şi Moderna. Ele sunt reprezentate de reacţii locale imediate şi tardive, urticarie, rash-ul morbiliform şi eritromelalgie (tabelul II)(21).
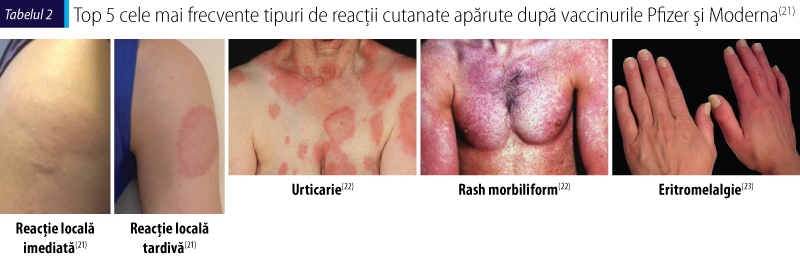
În funcţie de locul de apariţie şi extensie, reacţiile adverse cutanate pot fi locale sau generalizate şi, în funcţie de momentul apariţiei, pot fi imediate sau tardive. Reacţiile locale se întâlnesc cel mai frecvent.
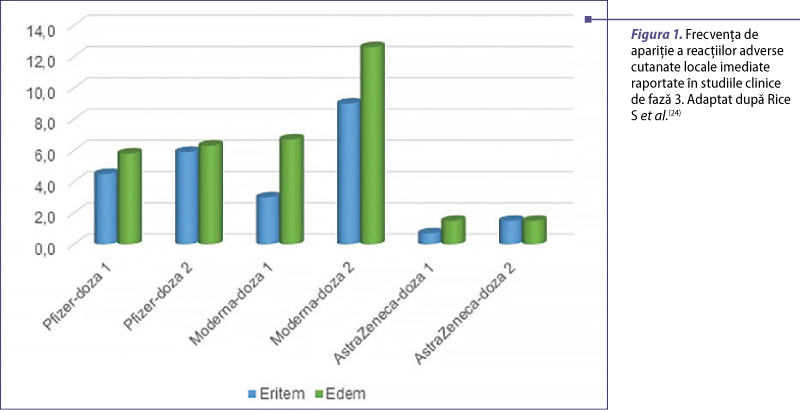
Conform studiilor clinice de fază 3 prelansare, reacţiile locale imediate cele mai frecvente sunt eritemul, edemul şi durerea, regăsindu-se cel mai des după administrarea vaccinului Moderna, în special după cea de-a doua doză (figura 1)(24).
Reacţiile cutanate locale tardive raportate debutează adesea la 4 până la 11 zile postvaccinare. Ele sunt reprezentate de plăci edematoase şi eritematoase cu intensitate şi extindere mai mari decât ale reacţiilor locale imediate. Studiile clinice de fază 3 raportează o incidenţă de 0,8% după prima doză şi de 0,2% după cea de-a doua doză, pentru vaccinul Moderna(25). CDC (Centers for Disease Control; Centrul pentru Controlul Bolilor) defineşte aceste reacţii cutanate tardive drept „COVID arm”.
Într-un studiu recent, au fost raportaţi 12 pacienţi cu acest tip de reacţii locale tardive. Aceştia au prezentat dispariţia simptomatologiei la aproximativ şase zile de la debut prin administrarea de antihistaminic H1 şi aplicarea locală de dermatocorticoizi şi gheaţă. Doar şase dintre cei 12 pacienţi au prezentat simptomatologie similară după administrarea dozei secundare, cu debut după un timp mai scurt postadministrare (ziua a doua postvaccinare). Aceste reacţii tardive pot fi mediate imunologic printr-un mecanism celular (tip IV), ipoteză susţinută de biopsia cutanată a unui pacient care a manifestat acest tip de reacţie adversă, care a arătat infiltrat limfocitar perivascular, asociat cu rare eozinofile şi mastocite(26).
Alte reacţii cutanate raportate au fost cele de la nivelul fillerelor dermice. Acestea pot debuta la 48-72 de ore după administrarea vaccinului, dar au fost raportate cazuri care au debutat la săptămâni sau chiar luni distanţă. Pacienţii pot prezenta edem şi eritem la locul de injectare al fillerului sau formarea de granuloame locale(3).
Mecanismul fiziopatologic al reacţiilor la nivelul fillerelor dermice nu este complet elucidat. Reacţiile de acest tip pot apărea la indivizii cu o anumită predispoziţie genetică, un risc mai mare avându-l persoanele cu subtip HLA B*08 şi DRB1*03. Indivizii au un prag scăzut pentru declanşarea inflamaţiei. Astfel, produşii de degradare ai acidului hialuronic injectat local pot declanşa un răspuns imun tardiv, mediat prin limfocitele T. Aceşti compuşi acţionează mai degrabă ca un adjuvant al sistemului imunitar decât ca un activator direct al limfocitelor T, amplificând astfel răspunsul imun antigen‑specific. Fillerele dermice care conţin acid hialuronic sau polimetilmetacrilat sunt mai frecvent implicate în acest tip de reacţii cutanate. Această informaţie vine în sprijinul cadrelor medicale, care pot îndruma pacientul în alegerea unei alternative de filler dermic, în special în lunile anterioare vaccinării(3,24).
Un alt mecanism propus pentru a explica reacţiile cutanate la nivelul fillerelor dermice este declanşarea răspunsului inflamator de către proteina S (Spike) a SARS-CoV-2, codificată prin vaccinurile anti-COVID-19. Aceasta interferează cu sistemul renină-angiotensină local de la nivel cutanat prin legarea ireversibilă de ACE2 (enzima de conversie a angiotensinei 2) şi creşterea consecutivă a nivelului local de angiotensină II. De asemenea, ATII (angiotensina II) conduce la creşterea nivelului glicoproteinei CD44, care se regăseşte pe suprafaţa a numeroase celule, incluzând limfocite, macrofage, celule epiteliale. CD44 are o afinitate ridicată de legare a acidului hialuronic liber extracelular, în special a celui cu greutate moleculară mică. Tratamentul eficient al acestor pacienţi cu inhibitori ai enzimei de conversie a angiotensinei susţine această ipoteză(27).
Un articol de referinţă din 2021 este reprezentat de un studiu care a cuprins 414 persoane cu manifestări cutanate postvaccinare, utilizând vaccinurile Pfizer şi Moderna, înregistraţi din decembrie 2020 până în februarie 2021(21). Din cei 414 pacienţi, 83% au avut o reacţie cutanată după administrarea vaccinului Moderna şi doar 17% după vaccinul Pfizer. Au fost observate reacţii cutanate postvaccinale variind de la reacţii cutanate locale atât imediate, cât şi întârziate, cu debut după o săptămână la locul de administrare a serului, până la urticarie şi manifestări rare, precum reacţii la nivelul fillerelor dermice sau leziuni similare cu cele care au fost raportate după infecţia cu SARS-CoV-2: eritromelalgie, pernio şi leziuni asemănătoare pitiriazisului rozat. Dintre persoanele care au manifestat o reacţie cutanată după prima doză, 43% au avut o reacţie cutanată şi după cea de-a doua doză. Reacţiile cutanate după a doua doză au debutat mai rapid (ziua a doua) şi au avut o intensitate similară sau mai redusă decât în cazul reacţiilor apărute după prima doză de vaccin. Pacienţii au prezentat o evoluţie favorabilă sub tratamentul cu dermatocorticoizi, antihistaminice H1 şi medicaţie antialgică. De asemenea, niciunul dintre cazurile de urticarie sau angioedem raportate de acest studiu nu s-a manifestat în ziua vaccinării, nefiind clasificate drept hipersensibilitate imediată la vaccin. În consecinţă, nu au existat contraindicaţii pentru administrarea dozei secundare de vaccin. Niciun caz de anafilaxie nu a fost raportat ulterior. Aceste informaţii cumulate vin în sprijinul cadrelor medicale care au sarcina de a-i consilia pe pacienţii care au avut manifestări cutanate după prima doză de vaccin, asigurându-i pe aceştia de siguranţa administrării dozei a doua(21).
Managementul pacienţilor cu reacţii adverse cutanate după administrarea vaccinului anti-COVID-19
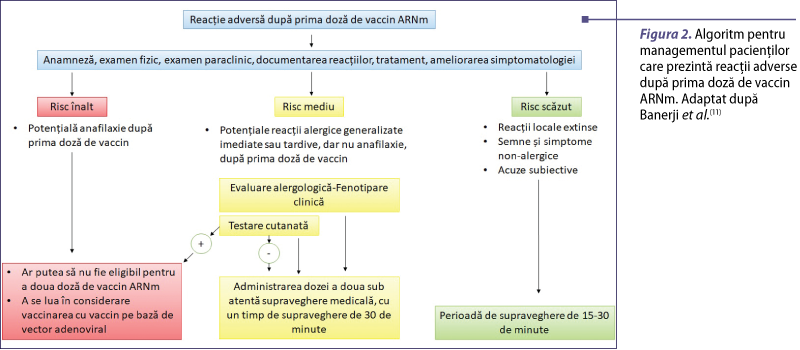
Riscul apariţiei unei reacţii severe trebuie evaluat atent de personalul din centrele de vaccinare. În acest sens, înaintea administrării fiecărei doze se realizează o stratificare a riscului persoanelor care urmează a fi vaccinate.
Reacţiile cutanate locale imediate şi tardive consecutive primei doze de vaccin nu impun evaluare alergologică. Nu există contraindicaţie pentru cea de-a doua doză, iar timpul de supraveghere postvaccinală este de 15 minute.
Pacienţii cu istoric de reacţii cutanate generalizate imediate sau tardive, fără anafilaxie, au indicaţie de consult alergologic anterior administrării celei de-a doua doze de vaccin. Medicul alergolog stabileşte necesitatea evaluării acestor pacienţi prin testare cutanată(11,16,29). Aceasta constă în testarea cutanată prick şi intradermică, utilizând surplusul de soluţie remanentă din flacoanele de vaccin folosite la vaccinare. Se poate utiliza soluţia de vaccin nativă, aceasta fiind concentraţia noniritativă raportată de câteva studii(28,30). Testele cutanate intradermice se citesc imediat, la 20 de minute.
Testarea cutanată cu vaccinurile anti-COVID-19 nu are încă o sensibilitate definită. Un test cutanat negativ nu exclude sensibilizarea, însă un test pozitiv este înalt sugestiv pentru aceasta. Nu este cunoscută o valoare predictivă (negativă sau pozitivă) a unui test cutanat negativ pentru a putea estima riscul unei reacţii generale severe după administrarea celei de-a doua doze. Cu toate acestea, testarea cutanată negativă vine în sprijinul clinicianului şi al pacientului cu manifestări cutanate după prima doză de vaccin. Ea oferă o obiectivare rezonabilă a recomandării de continuare a vaccinării cu o doză secundară, sub o atentă monitorizare medicală(11,16,17).
Un grup de şase pacienţi cu manifestări cutanate imediate după prima doză de vaccin Pfizer‑BioNTech au fost evaluaţi alergologic prin testare cutanată prick, care a fost negativă, toţi pacienţii tolerând şi a doua doză de vaccin. În cazul testării intradermice însă, deşi la citirea imediată a fost negativă, la 12 ore toţi pacienţii au prezentat induraţie şi eritem la nivelul testului intradermic. Testarea intradermică a fost repetată şi la alte trei grupuri de voluntari, fără manifestări cutanate postvaccinale raportate: voluntari vaccinaţi cu ambele doze, vaccinaţi cu o singură doză sau nevaccinaţi. Primele două grupuri au prezentat acelaşi pattern al reacţiei cutanate la testarea intradermică (eritem, edem şi induraţie la nivelul testului intradermic, la 12 ore de la testare), în timp ce la voluntarii nevaccinaţi testarea a rămas negativă. Se poate concluziona că pozitivarea testării intradermice la 12 ore ar putea fi un semn al imunităţii celulare dobândite împotriva proteinei S a SARS-CoV-2, şi nu o obiectivare a sensibilizării la vaccin. Sunt necesare studii ulterioare pentru a investiga utilitatea testării cutanate pentru vaccinurile anti-COVID-19(28).
În cadrul clinicii noastre, de la începutul campaniei de vaccinare am evaluat cinci persoane în vederea administrării celei de-a doua doze de vaccin Cominarty (Pfizer). Acestea au prezentat reacţii cutanate imediate generalizate. Trei persoane au prezentat rash pruriginos debutat la 10-15 minute de la administrarea primei doze de vaccin. De asemenea, o persoană a prezentat edem al pavilioanelor urechilor, debutat la mai puţin de 30 de minute după administrarea primei doze de vaccin. O persoană a fost trimisă pentru evaluare după ce a dezvoltat eritem la nivelul membrelor inferioare, debutat la 2 ore după administrarea serului. Deoarece la momentul prezentării primelor două paciente nu existau date publicate despre concentraţiile noniritative, nu am efectuat testare cutanată, însă am administrat doza a doua de vaccin sub supraveghere. Restul pacienţilor au beneficiat de testare cutanată prick şi intradermică. Toate testările cutanate au fost negative. Ulterior s-a administrat doza a doua de vaccin sub supraveghere, fără apariţia de reacţii de hipersensibilitate imediate sau tardive postvaccinale.
Concluzii
Majoritatea reacţiilor adverse cutanate postvaccinale sunt uşoare sau moderate şi nu impun evaluare alergologică. Acestea nu reprezintă o contraindicaţie pentru administrarea unei doze secundare de vaccin. Manifestările mai rare, precum cele de la nivelul fillerelor dermice, impun consilierea persoanelor care doresc să apeleze la astfel de tratamente în alegerea unui tip de filler care nu a fost raportat în reacţiile postvaccinale. Expertiza alergologică este indispensabilă în managementul pacienţilor care prezintă posibile reacţii de hipersensibilitate postvaccinale. Medicul alergolog realizează stratificarea riscului de reacţie severă după administrarea celei de-a doua doze de vaccin la pacienţii care prezintă reacţii cutanate generalizate după prima doză şi decide necesitatea testării cutanate cu vaccin anti-COVID-19. Testarea cutanată negativă oferă suport clinicianului pentru a evita excluderea nejustificată de la administrarea dozei a doua a pacienţilor cu reacţii cutanate după prima doză. Se evită astfel privarea accesului pacienţilor la elementul-cheie al luptei împotriva pandemiei – vaccinarea. Aşadar, reacţiile cutanate postvaccinale au o morfologie variabilă, iar recunoaşterea celor care impun evaluare alergologică este importantă. Este nevoie de studii ulterioare cu o bună raportare şi caracterizare a acestora, pentru un management eficient al procesului de vaccinare.
Bibliografie
- Coronavirus Resource Center. COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University & Medicine. Available from: https://coronavirus.jhu.edu/map.html. Accessed April 30, 2021.
- Cavaleri M, et al. The European Medicines Agency’s EU Conditional Marketing Authorisations for COVID-19 Vaccines. The Lancet. 2021 Jan; 397(10272):355–357.
- Bogdano G, Bogdano I, Kazandjieva J, Tsankov N. Cutaneous adverse effects of the available COVID-19 vaccines [published online ahead of print, 2021 Apr 27]. Clin Dermatol. 2021;doi:10.1016/j.clindermatol.2021.04.001
- Platforma naţională de informare cu privire la vaccinarea împotriva COVID-19 (n.d.). [online] . Available at: https://vaccinare-covid.gov.ro/wp-content/uploads/2021/05/Tabel-situatie-vaccinari_08.05.2021.pdf [Accessed 9 May 2021].
- Comirnaty, INN-COVID-19 mRNA Vaccine. Available at: https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_ro.pdf [Accessed 9 May 2021].
- COVID-19 Vaccine Moderna, INN-COVID-19 mRNA Vaccine. Available at: https://www.ema.europa.eu/en/documents/product-information/covid-19-vaccinemoderna-epar-product-information_ro.pdf [Accessed 9 May 2021].
- Vaxzevria, COVID-19 Vaccine. Available at: https://www.ema.europa.eu/en/documents/product-information/vaxzevria-previously-covid-19-vaccineastrazeneca-epar-product-information_ro.pdf [Accessed 9 May 2021].
- COVID-19 Vaccine Janssen, INN-Ad26.COV2-S, recombinant. Available at: https://vaccinare-covid.gov.ro/wp-content/uploads/2021/03/covid-19-vaccine-janssenepar-product-information_ro.pdf [Accessed 9 May 2021].
- World Health Organization (2021). WHO COVID-19 dashboard. [online] covid19.who.int. Available at: https://covid19.who.int/ [Accessed 9 May 2021].
- Gee J, Marquez P, Su J, Calvert GM, Liu R, Myers T, et al. First month of COVID-19 vaccine safety monitoring – United States, December 14, 2020 - January 13, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:283-8.
- Banerji A, Wickner PG, Saff R, et al. mRNA Vaccines to Prevent COVID-19 Disease and Reported Allergic Reactions: Current Evidence and Suggested Approach. J Allergy Clin Immunol Pract. 2021;9(4):1423-1437.
- European Medicine Agency Safety Committee (PRAC). AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. Available from: https://wwwemaeuropaeu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood [Accessed 5 May 2021].
- Dreskin SC, Halsey NA, Kelso JM, et al. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016;9(1):32.
- Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine – United States, December 14–23, 2020. MMWR Morb Mortal Wkly Rep. 2021;70:46–51. DOI: http://dx.doi.org/10.15585/mmwr.mm7002e1
- Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Moderna COVID-19 Vaccine — United States, December 21, 2020–January 10, 2021. MMWR Morb Mortal Wkly Rep 2021;70:125–129. DOI:http://dx.doi.org/10.15585/mmwr.mm7004e1
- Banerji A, Wolfson AR, Wickner PG, Cogan AS, McMahon AE, Saff R, Robinson LB, Phillips E, Blumenthal KG. COVID-19 Vaccination in Patients with Reported Allergic Reactions: Updated Evidence and Suggested Approach. The Journal of Allergy and Clinical Immunology. 2021 Apr 15;S2213-2198(21)00439-6.
- Sokolowska M, Eiwegger T, Ollert M, Torres MJ, Barber D, Del Giacco S, Jutel M, Nadeau KC, Palomares O, Rabin RL, Riggioni C, Vieths S, Agache I, Shamji MH. EAACI statement on the diagnosis, management and prevention of severe allergic reactions to COVID‐19 vaccines. Allergy. 2021 Jan 16;10.1111/all.14739.
- European Medicine Agency Safety Committee (PRAC). AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. Available from: https://wwwemaeuropaeu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood [Accessed 5 May 2021].
- Torjesen I. Covid-19: Risk of cerebral blood clots from disease is 10 times that fromvaccination, study finds. BMJ. 2021 Apr 16;373:n1005.
- Marks P, Schuchat A. Joint CDC and FDA Statement on Johnson & Johnson COVID-19 Vaccine. Available from: https://wwwfdagov/news-events/pressannouncements/joint-cdc-and-fda-statement-johnson-johnson-covid-19-vaccine
- McMahon DE, Amerson E, Rosenbach M, Lipoff JB, Moustafa D, Tyagi A, Desai SR, French LE, Lim HW, Thiers BH, Hruza GJ, Blumenthal KG, Fox LP, Freeman EE. Cutaneous reactions reported after Moderna and Pfizer COVID-19 vaccination: A registry-based study of 414 cases. Journal of the American Academy of Dermatology. 2021 Apr 7;S0190-9622(21)00658-7.
- Klaus W, et al. Fitzpatrick’s Color Atlas and Synopsis of Clinical Dermatology. New York, Mcgraw-Hill Education, 2017.
- Leroux, MB. Erythromelalgia: a cutaneous manifestation of neuropathy?. An Bras Dermatol. Jan-Feb 2018;93(1):86-94.
- Rice SM, Ferree SD, Mesinkovska NA, Kourosh AS. The Art of Prevention: COVID-19 Vaccine Preparedness for the Dermatologist. International Journal of Women’s Dermatology. 2021 Mar;7(2):209-212.
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CB, McGettigan J, Khetan S, Segall N, Solis J, Brosz A, Fierro C, Schwartz H, Neuzil K, Corey L and Gilber, P. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. New England Journal of Medicine. 2021 Feb 4;384(5):403-416.
- Blumenthal KG, et al. Delayed Large Local Reactions to mRNA-1273 Vaccine against SARS-CoV-2. The New England Journal of Medicine. 2021;384(13):1273-1277.
- Munavalli GG, Knutsen-Larson S, Lupo MP, Geronemus RG. (2021). Oral angiotensin-converting enzyme inhibitors for treatment of delayed inflammatory reaction to dermal hyaluronic acid fillers following COVID-19 vaccination – a model for inhibition of angiotensin II-induced cutaneous inflammation. JAAD Case Reports. 2021 Apr;10:63-68.
- Bianchi L, Biondi F, Hansel K, Murgia N, Tramontana M and Stingeni L. Skin tests in urticaria/angioedema and flushing to Pfizer‐BioNTech SARS‐CoV‐2 vaccine: Limits of intradermal testing. Allergy. 2021 Apr 2. doi: 10.1111/all.14839.
- Worm M, Bauer A, Wedi B, Treudler R, Pfuetzner W, Brockow K, Buhl T, Zuberbier T, Fluhr J, Wurpts G, Klimek L, Jakob T, Merk HF, Mülleneisen N, Roeseler S, Dickel H, Raap U and Kleine-Tebbe J. Practical recommendations for the allergological risk assessment of the COVID-19 vaccination – a harmonized statement of allergy centers in Germany. Allergologie Select. 2021 Jan 26;5:72-76.
- Marcelino J, Farinha S, Silva R, Didenko I, Proença M, Tomáz E. Nonirritant concentrations for skin testing with SARS-CoV-2 mRNA vaccine. The Journal of Allergy and Clinical Immunology Practice. 2021 Mar 23;S2213-2198(21)00329-9.
Articole din ediţiile anterioare
Exacerbările de astm induse viral
Astmul bronşic este cea mai frecventă boală respiratorie cronică a copilului, dar este prezentă cu o prevalenţă mare şi la adulţi(1).
Imunodeficienţele primare în contextul pandemiei cu SARS-CoV-2
Coronavirusurile (CoVs) sunt ARN virusuri monocatenare care aparţin subfamiliei Coronavirinae şi care au capacitatea să producă infecţii la o serie...
Organizarea activităţii în clinicile de alergologie în contextul pandemiei de COVID-19
COVID-19 este boala asociată coronavirusului sindromului respirator acut sever 2 (SARS-CoV-2). Aceasta este o nouă tulpină de coronavirus, care a f...