Sequencing techniques represent the gold standard in molecular diagnosis ofautosomal dominant polycystic kidney disease (ADPKD), being in this case able to accurately and concretely highlight mutations at the genome level. The PKD1 gene mutation detection technique using the Real Time PCR technique and LNA hydrolysis probes exploits the specific behavior of hybridization LNA probes under the conditions of maximum complementarity with the target sequence and consequently the theoretical possibility of designing two such probes, one for the wild genotype (WT) and the other to identify the point mutation (MUT). The technique of identifying the PKD1 gene mutation using the Real Time PCR technique and FRET type hydrolysis probes consists of a derivation of the Real Time PCR technique, with the detection of amplicons by means of fluorescence with hybridization probes. The technique of identifying the PKD1 gene mutation using the Real Time PCR technique coupled with HRM (High Resolution Melting) involves one of the variants of the Real Time PCR technique, namely the interpretation of the results according to the melting temperature.
Diagnosticul genetic al ADPKD
Genetic diagnosis of ADPKD
First published: 22 noiembrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.38.4.2022.7268
Abstract
Rezumat
Tehnicile de secvenţiere reprezintă standardul de aur în diagnosticul molecular al bolii polichisticerenale autozomaldominante (ADPKD), fiind în acest caz capabile să evidenţieze exact şi concret mutaţiile la nivel de genom. Tehnica detecţiei mutaţiei genei PKD1 utilizând tehnica Real Time PCR şi sonde de hidroliză de tip LNA exploatează comportamentul specific al sondelor de tip LNA de hibridizare în condiţiile existenţei unei complementarităţi maxime cu secvenţa‑ţintă şi, consecutiv, posibilitatea teoretică de design a două astfel de sonde, una pentru genotipul sălbatic (WT) şi cealaltă pentru identificarea mutaţiei de tip punctiform (MUT). Tehnica identificării mutaţiei genei PKD1 utilizând tehnica Real Time PCR şi sonde de hidroliză de tip FRET constă într-o derivaţie a tehnicii Real Time PCR, cu detecţia ampliconilor prin intermediul fluorescenţei cu sonde de hibridizare. Tehnica identificării mutaţiei genei PKD1 utilizând tehnica Real Time PCR cuplată cu HRM (High Resolution Melting) implică una dintre variantele tehnicii Real Time PCR – şi anume, interpretarea rezultatelor în funcţie de temperatura de topire.
Diagnosticul genetic al ADPKD
Identificarea mutaţiei genei PKD1 utilizând tehnici de secvenţiere genetică
Tehnicile de secvenţiere reprezintă standardul de aur în diagnosticul molecular, fiind în acest caz capabile să evidenţieze exact şi concret mutaţiile la nivel de genom. Cu toate că progresele tehnicilor de secvenţiere din ultimul deceniu sunt remarcabile (tehnici de secvenţiere de nouă generaţie), în practică se utilizează încă tehnicile de secvenţiere de tip Sanger datorită următoarelor avantaje:
-
flexibilitate înaltă în ceea ce priveşte matricea biologică şi, implicit, cantitatea de ADN care se doreşte a fi secvenţiată
-
standardizarea metodei de secvenţiere
-
costul redus şi disponibilitatea aparaturii la nivel de laborator
-
uşurinţa în interpretarea rezultatelor (comparativ cu tehnica NGS – secvenţiere de nouă generaţie).
-
În linii mari, tehnica urmăreşte fluxul de lucru al testului PCR convenţional, cu extracţia materialului genetic şi amplificarea fragmentului/fragmentelor care conţin evenimentul genetic ce se doreşte a fi identificat, urmate de purificarea acestuia/acestora şi efectuarea suplimentară a reacţiei PCR pentru secvenţiere, de această dată utilizând în reacţie şi nucleotide marcate fluorescent. Consecutiv acestui PCR suplimentar se obţin fragmente (ampliconi) care diferă ca dimensiune printr-o singură nucleotidă – şi anume, cea marcată fluorescent. Electroforeza acestor produşi de amplificare într-o matrice cu putere de rezoluţie ridicată (poliacrilamidă) conduce la separarea lor în funcţie de dimensiuni şi, ulterior, în funcţie de lungimea de undă emisă de nucleotide, citirea şi transpunerea automată.
Avantajele folosirii unei astfel de abordări constau în generarea secvenţei nucleotidice a produsului de amplificare care se doreşte a fi analizat, cu identificarea exactă şi irefutabilă a evenimentului genetic. Dezavantajele sunt date de: timpul semnificativ de obţinere a rezultatelor (2-3 zile), cost, metodă laborioasă şi, nu în ultimul rând, posibilitatea de contaminare masivă prin lucrul cu produşi de amplificare
2. Identificarea mutaţiei genei PKD1 utilizând tehnica Real Time PCR şi sonde de hidroliză de tip LNA (Locked Nucleic Acid)
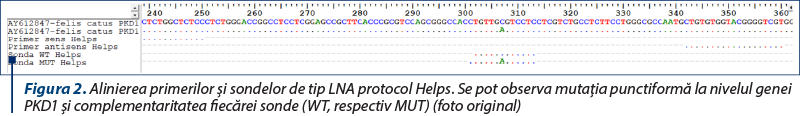
Această tehnică exploatează comportamentul specific al sondelor de tip LNA de hibridizare în condiţiile existenţei unei complementarităţi maxime cu secvenţa‑ţintă şi, consecutiv, posibilitatea teoretică de design a două astfel de sonde, una pentru genotipul sălbatic (WT) şi cealaltă pentru identificarea mutaţiei de tip punctiform (MUT). Pentru ADPKD au fost descrise numeroase astfel de abordări, una dintre acestea fiind exemplificată în figura 2.
Avantajele folosirii unei astfel de abordări sunt date de rapiditatea în obţinerea rezultatelor (aproximativ două ore de la recepţia probei în laborator) şi de flexibilitatea în scalarea fluxului de lucru (se pot lucra de la o probă la 94 de probe simultan), alături de posibilitatea redusă de intercontaminare şi, consecutiv, generarea de rezultate eronate (reacţia se desfăşoară în tub închis, fără manipularea ulterioară a produşilor de amplificare).
Ca dezavantaje, se pot menţiona costul substanţial al sondelor şi al reactivilor utilizaţi, alături de disponibilitatea redusă de sinteză a unor astfel de sonde (cel puţin pentru România).
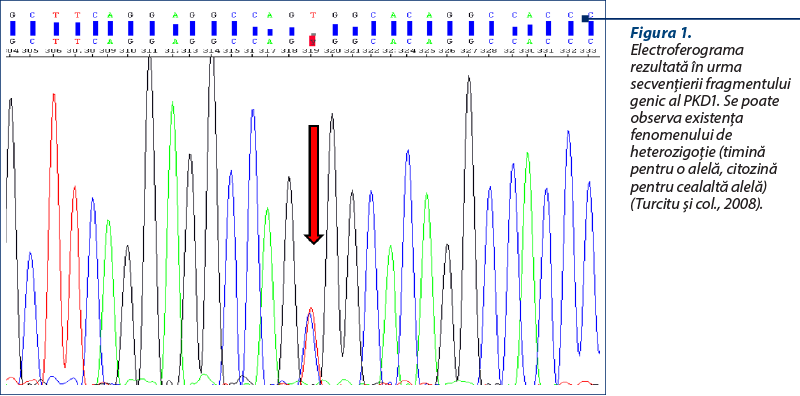
Identificarea mutaţiei genei PKD1 utilizând tehnica Real Time PCR şi sonde de hidroliză de tip FRET (Fluorescence Resonance Energy Transfer)
Similar tehnicii anterior descrise (LNA Real Time PCR), tehnica aceasta constă într-o derivaţie a tehnicii Real Time PCR, astfel: ampliconii sunt detectaţi prin intermediul fluorescenţei, unde se folosesc sonde de hibridizare, fiind compuse din oligonucleotide diferite care hibridizează la o secvenţă internă a produsului amplificat. Una dintre sonde este marcată la capătul 5’ cu fluoroforul LightCycler Red 640 şi fosforilată la capătul 3’ pentru evitarea extensiei. Cea de-a doua sondă este marcată la capătul 3’ cu LightCycler Fluorescein. În timpul hibridizării la fragmentul de ADN‑ţintă, ambele sonde se află în proximitate, având ca rezultat transferul de energie prin rezonanţă fluorescentă (fluorescence resonance energy transfer – FRET). În timpul acestui proces, LightCycler Fluorescein, sonda donor, este excitată; o parte din această energie de excitaţie este transferată către LightCycler Red 640, sonda acceptor. Luminiscenţa emisă de sonda acceptor este citită automat.
Determinarea mutaţiei (şi, consecutiv, genotipului) se realizează prin analiza curbelor de topire consecutiv formării ampliconilor. Astfel, sonda‑ancoră hibridizează la o regiune genică cu potenţial mutagenic redus. Secvenţa sondei II este complementară cu situsul mutagen. În acelaşi timp, sonda‑ancoră are avantajul unei temperaturi de topire (Tm) mai mari, astfel că semnalul fluorescent exprimat în timpul analizei curbelor de topire este oferit de sonda care cuprinde situsul mutant. Temperatura de topire (Tm) a sondei‑ancoră este influenţată, pe lângă conţinutul de adenină şi guanină (raportul A-T/G-C), de gradul de complementaritate dintre aceasta şi situsul de hibridare; astfel, în cazul prezenţei unei perechi de baze care nu este complementară (mutaţie punctiformă), Tm este mai mică (Turcitu şi col., 2008). Un exemplu pentru această abordare este redat în figura 3, după protocolul descris de Criado-Fornelio.
Avantajele şi dezavantajele folosirii unei astfel de abordări sunt în linii mari similare cu cele descrise pentru tehnica LNA, şi anume: rapiditate, posibilitate de scalare, alături de preţul de cost mare şi disponibilitatea echipamentelor de analiză.

Identificarea mutaţiei genei PKD1 utilizând tehnica Real Time PCR cuplată cu HRM (High Resolution Melting)
Metoda implică una dintre variantele tehnicii Real Time PCR, şi anume interpretarea rezultatelor în funcţie de temperatura de topire. Principiul metodei constă în amplificarea prin tehnica PCR a fragmentului care se intercalează la nivelul fragmentelor de acizi nucleici dublu catenare. Aşadar, pe măsură ce reacţia PCR avansează, are loc acumularea de produşi de amplificare şi, consecutiv, creşterea fluorescenţei detectată de aparat.
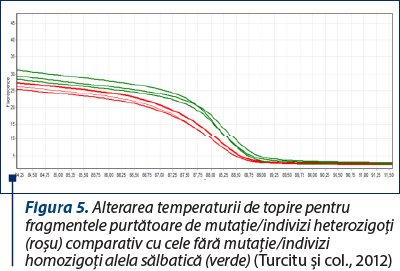
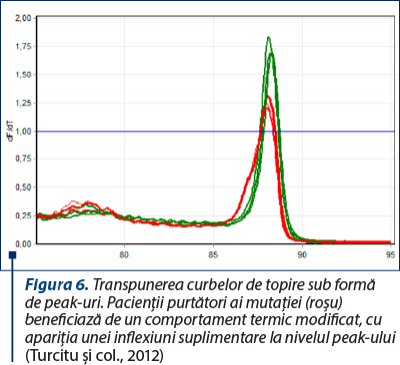
Ulterior acestei amplificări, pe baza principiului temperaturii de topire (definită ca temperatura la care jumătate dintre catenele ADN se denaturează şi, consecutiv, cele două catene se despart), aparatul monitorizează variaţia fluorescenţei şi o transpune sub formă de grafic. Pentru un individ heterozigot (aşadar purtător de mutaţie), temperatura de topire a fragmentului ADN este alterată de substituţia nucleotidică, fenomen care poate fi identificat prin această tehnică.
La finalul analizei, pentru uşurinţă în interpretare, software-ul aparatului transpune aceste variaţii ale temperaturii de topire în peak-uri (vârfuri) de topire.
Bibliografie
-
Helps CR, Tasker S, Barr FJ, Wills SJ, Gruffydd-Jones TJ. Detection of the single nucleotide polymorphism causing feline autosomal-dominant polycystic kidney disease in Persians from the UK using a novel real-time PCR assay. Mol Cell Probes. 2007 Feb;21(1):31-4.
-
Preda (Constantinescu) V, Turcitu M, Codreanu I, Popa (Cristian) AM, Codreanu M. The compared accuracy of the ultrasonographic examination and PCR technique in feline polycystic disease. Journal of Biotechnology. 2019;305(15):S81-S82.
-
Buset Ríos N, Rodríguez Pérez JC, Sánchez JJ, Hernández CR, Hernández E, Torres Galván MJ. Diagnóstico genético de poliquistosis renal autosómica dominante mediante PCR múltiple [Genetic diagnosis of autosomal dominant polycystic kidney disease using multiplex-PCR]. Nefrologia. 2009;29(4):327-30.
-
Turcitu MA, Codreanu MD, Fernoagă C, Codreanu I, Cioranu R. Implementation of molecular techniques for feline Autosomal dominant polycystic kidney disease (ADPKD). In: Symposium “Contribution of the scientific research to veterinary medicine progress”. Book of Abstracts November 22-23 2012.
-
Turcitu MA, Coste H, Alexandru N, Codreanu I, Codreanu MD, Olaru I, Tamba P, Zybaczynski I. Evaluation of molecular biology techniques for prionic protein genetic variability identification in sheep. Romanian Journal of Biochemistry. 2008 Jan-Jun;45(1).
Articole din ediţiile anterioare
Tumori maligne și tumori benigne - elemente citologice generale de diferenţiere
Citologia este una dintre metodele de diagnostic al diferitelor proceselor neoplazice. În cazul în care citologia nu este suficientă pentru ...
Actualizarea protocolului de diagnostic în babesioza canină
Babesioza este o hemoprotozooză importantă, cu răspândire geografică ce acoperă aproape toate continentele. Cu toate că, din punct de vedere strict...
Caracterizarea morfo-patogenetică a speciilor şi tulpinilor stafilocociilor implicate în bolile psitacinelor
În genul Staphylococcus sunt încadrate bacteriile în formă de coci, Gram-pozitive, care formează, cu precădere în unele situaţii, grupări caracteri...
Prevalenţa semnelor clinice în sindromul de disfuncţie cognitivă canină
Sindromul de disfuncţie cognitivă canină (SDCC) este o boală degenerativă a parenchimului cerebral, asemănătoare bolii Alzheimer de la om (Dewey, 2...