Allergic bronchopulmonary aspergillosis (ABPA) is a disease that occurs in patients with asthma or cystic fibrosis who have positive skin tests for immediate hypersensitivity against Aspergillus fumigatus, and elevated levels of serum IgE and IgG antibodies against fungal‑specific antigen, determined by fluoroimmunoenzymatic assay. In this review, we present the diagnostic criteria for ABPA revised in the last decade by several expert groups. The officially recognized molecular allergens of Aspergillus fumigatus used in commercially available singleplex and multiplex immunoassays for the determination of serum specific IgE are mitogillin Asp f 1 from ribonuclease family, fibrinogen binding-protein Asp f 2, peroxisomal membrane protein Asp f 3, group 4 fungal allergen Asp f 4, and Mn superoxide dismutase Asp f 6. The detailed evaluation of IgE sensitization molecular profiles, using the panel of recombinant allergenic components of Aspergillus fumigatus, is useful in clinical practice to identify genuine versus cross-reactive sensitization in patients sensitized to Aspergillus fumigatus, including patients with comorbid atopic dermatitis and sensitization to other fungi with cross-reactive allergenic components, for an accurate molecular allergy diagnosis of ABPA, and to distinguish ABPA from asthma with Aspergillus fumigatus sensitization without ABPA.
Abordarea diagnostică moleculară în aspergiloza bronhopulmonară alergică
Molecular diagnosis approach in allergic bronchopulmonary aspergillosis
First published: 22 octombrie 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.6.3.2021.5679
Abstract
Rezumat
Aspergiloza bronhopulmonară alergică (ABPA) este o afecţiune care apare la pacienţi cu astm sau fibroză chistică şi care prezintă teste cutanate de hipersensibilitate imediată pozitive la Aspergillus fumigatus şi valori serice crescute ale anticorpilor IgE şi IgG faţă de antigen fungic specific, determinate prin metodă de analiză fluoroimunoenzimatică. În această recenzie, prezentăm criteriile de diagnostic pentru ABPA revizuite în ultimul deceniu de mai multe grupuri de experţi. Alergenele moleculare ale Aspergillus fumigatus recunoscute oficial şi utilizate în metodele de imunoanaliză singleplex şi multiplex disponibile comercial pentru determinarea IgE specifice serice sunt: mitogilina Asp f 1 din familia ribonucleazelor, proteina de legare a fibrinogenului Asp f 2, proteina membranală peroxizomală Asp f 3, alergenul fungic de grup 4 Asp f 4 şi Mn superoxid dismutaza Asp f 6. Evaluarea detaliată a profilurilor moleculare de sensibilizare IgE, utilizând panelul de componente alergenice recombinante pentru Aspergillus fumigatus, este utilă în practica clinică pentru identificarea sensibilizării autentice faţă de cea cross-reactivă la pacienţii sensibilizaţi la Aspergillus fumigatus, inclusiv la pacienţii cu dermatită atopică asociată şi sensibilizare la alţi fungi cu componente alergenice cu reactivitate încrucişată, pentru diagnosticul alergologic molecular de precizie al ABPA şi pentru a distinge ABPA de astmul cu sensibilizare la Aspergillus fumigatus fără ABPA.
Aspergillus fumigatus este un fung filamentos trimorfic din încrengătura Ascomycota, clasa Eurotiomycetes, ordinul Eurotiales, familia Aspergillaceae, care prezintă în ciclul de viaţă(1,2) conidii (spori asexuaţi de 2,5 µm, cu propagare aeriană, produşi în lanţuri pe fialide dezvoltate pe conidiofori), ascospori (spori sexuaţi de 4-5 µm, dormanţi şi implicaţi în supravieţuirea în compost) şi micelii (forme vegetative cu hife filamentoase, care apar în sol pe materia organică în descompunere şi la nivel pulmonar)(3-5). Aspergillus fumigatus este răspândit la nivel global şi este comun în multe medii. Este prezent în aer, în sol şi în vegetaţia în descompunere, se găseşte în cantităţi mari în solul de grădină şi de seră şi în depozitele de compost. Deşi este capabil să provoace afecţiuni variate la om, Aspergillus fumigatus nu colonizează în mod obişnuit tractul respirator(5,6).
La oameni umani, speciile de Aspergillus determină un spectru variat de boli. În funcţie de statusul imunitar al fiecărui individ, afecţiunile produse de Aspergillus spp. pot fi clasificate în trei mari grupuri cu mecanisme patogenice şi manifestări clinice distincte, cu sau fără diferite grade de suprapunere:
la pacienţi imunocompetenţi – aspergilom, aspergiloză pulmonară cronică;
la pacienţi cu imunodepresie severă – aspergiloză pulmonară invazivă, aspergiloză bronşică invazivă, aspergiloză extrapulmonară la nivelul sistemului nervos central;
la pacienţi cu hipersensibilitate imunologică – astm sever cu sensibilizare fungică, aspergiloză bronhopulmonară alergică(4).
Aspergiloza bronhopulmonară alergică (ABPA) este o afecţiune de hipersensibilitate la Aspergillus fumigatus, care afectează aproximativ 2‑15% dintre pacienţii cu fibroză chistică şi 1‑3,5% dintre cei cu astm. În plus, ABPA este detectată la circa 25‑35% dintre pacienţii cu astm şi test cutanat prick pozitiv la Aspergillus fumigatus(7,8). În afară de fungul filamentos termotolerant Aspergillus fumigatus, alţi fungi care posedă termotoleranţă, cum ar fi fungii filamentoşi Aspergillus flavus, Aspergillus niger, Penicillium spp., Schizophyllum commune, dar şi Candida albicans, pot provoca patologii similare, denumite micoze bronhopulmonare alergice (MBPA)(9,10). Fungii termotoleranţi, în mod tipic Aspergillus fumigatus şi Candida albicans, pot coloniza căile respiratorii, în timp ce fungii care sunt rareori capabili să se dezvolte la 37 ⁰C, cum ar fi cei nontermotoleranţi Alternaria alternata şi Cladosporium herbarum, exacerbează astmul, acţionând ca aeroalergene(9-11).
De-a lungul timpului, criteriile de diagnostic pentru ABPA au fost reevaluate, fiind subliniată importanţa reacţiilor de hipersensibilitate mediate IgE (de tip I) şi mediate IgG (de tip III), a determinării nivelurilor serice ale IgE, respectiv IgG specifice fungice, împreună cu aspectele imagistice pulmonare sugestive(12).
Criteriile de diagnostic pentru ABPA au fost revizuite în ultimul deceniu de către mai multe grupuri de experţi(7,9,13), fiind prezentate în continuare (tabelele 1 şi 2).
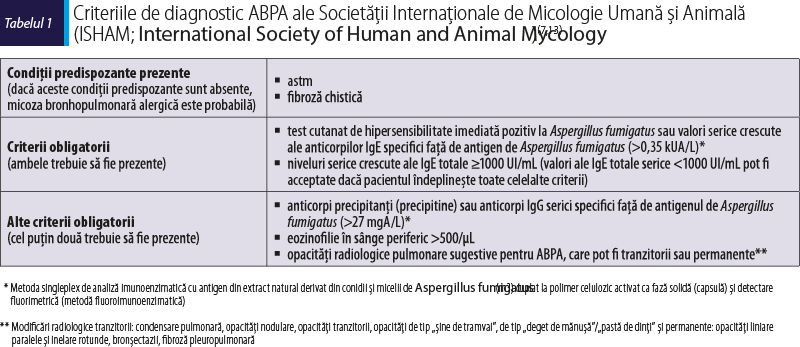

Deoarece Aspergillus fumigatus este cel mai frecvent fung care provoacă ABPA, criteriile de diagnostic ale ABPA se bazează pe reactivitatea imunologică a pacientului la extractul fungic natural specific. Cu toate acestea, din cauza reactivităţii încrucişate dintre extractele alergenice native din diferiţi fungi, sensibilizarea aparentă la astfel de extracte nu este întotdeauna autentică la Aspergillus fumigatus(14,15).
Aspergillus fumigatus este un fung ubicuitar peren în mediul interior şi exterior, fiind atât un agent patogen sau oportunist asociat cu multe afecţiuni patologice, cât şi o sursă majoră de aeroalergene(16,17).
Spectrul alergenelor produse de acest fung este extins pe o mare varietate de structuri moleculare, incluzând enzime şi proteine secretate, intracelulare sau structurale. Clasificarea în alergene majore şi minore este dificilă, deoarece sensibilizarea pe un profil foarte variabil de componente alergenice depinde semnificativ de statusul imunologic şi patologic al fiecărui individ. Alergia la Aspergillus fumigatus afectează rareori persoane atopice fără astm sau fibroză chistică, cunoscute ca afecţiuni cu multe fenotipuri(14).
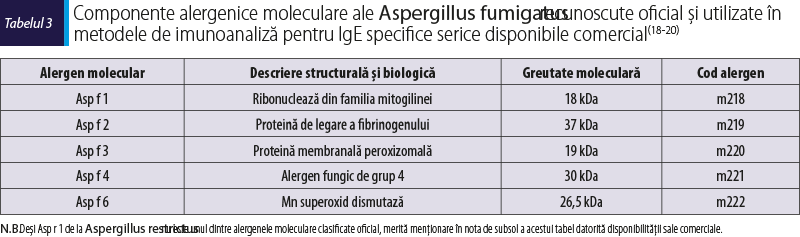
Alergenele moleculare ale Aspergillus fumigatus recunoscute oficial şi utilizate în metodele de imunoanaliză singleplex sau multiplex pentru IgE specifice serice sunt: mitogilina Asp f 1 din familia ribonucleazelor, proteina de legare a fibrinogenului Asp f 2, proteina membranală peroxizomală Asp f 3, Mn superoxid dismutaza Asp f 6 şi alergenul fungic de Grup 4 Asp f 4 (tabelul 3).
Alte componente alergenice ale Aspergillus fumigatus recunoscute oficial(18,20), care nu sunt utilizate în imunoanalizele IgE disponibile actual sunt:
proteaze – metaloproteaza Asp f 5 (40 kDa), aspartat proteaza Asp f 10 (34 kDa), serin proteaza alcalină Asp f 13 (34 kDa), serin proteaza vacuolară cerevisina Asp f 18 (34 kDa);
izomeraze – peptidil-prolil izomeraza Asp f 11 (24 kDa), ciclofilina/rotamaza Asp f 27 (18 kDa);
proteine ribozomale şi de şoc termic – proteine ribozomale P2 Asp f 8 (11 kDa) şi L3 Asp f 23 (44 kDa), proteina de şoc caloric P90 Asp f 12 (90 kDa);
enolaze – enzima glicolitică Asp f 22 (46 kDa);
tioredoxine – oxidoreductazele Asp f 28 (13 kDa) şi Asp f 29 (13 kDa);
glicozil hidrolaze – Asp f 16 (43 kDa), Asp f 9 (34 kDa);
proteine ale peretelui celular – cerato-platanina Asp f 15 (16 kDa); galactomananproteina Asp f 17 (27 kDa), proteina PhiA din peretele celular Asp f 34 (20 kDa);
alte alergene moleculare fără funcţie biologică definită – Asp f 7 (12 kDa).
Cu atât de multe alergene moleculare aprobate oficial de Subcomitetul pentru nomenclatura alergenelor al Organizaţiei Mondiale a Sănătăţii şi al Uniunii Internaţionale a Societăţilor de Imunologie (OMS/IUIS), Aspergillus fumigatus reprezintă una dintre cele mai complexe surse de alergene cunoscute până în prezent.
Aplicarea unui diagnostic alergologic molecular de precizie (PAMD) în ABPA este o abordare recent discutată, cunoscută anterior şi sub numele de diagnostic bazat pe componente alergenice(21). De-a lungul timpului au existat mai multe încercări menite să facă diferenţa dintre ABPA şi astmul cu sensibilizare mediată IgE la Aspergillus fumigatus fără ABPA, prin aplicarea diagnosticului alergologic molecular(15).
Componentele alergenice moleculare ale Aspergillus fumigatus utilizate uzual în PAMD pentru ABPA sunt Asp f 1, Asp f 2, Asp f 3, Asp f 4 şi Asp f 6.
Asp f 1 este o ribonuclează fungică de 18 kDa din familia mitogilinei. Această ribotoxină, inhibitoare potentă a sintezei proteinelor eucariote, este un alergen major produs de miceliile de Aspergillus fumigatus. Nu este prezent în spori şi este produs după germinarea şi creşterea fungică, de aceea sensibilizarea IgE la Asp f 1 poate fi considerată biomarker specific pentru expunerea la Aspergillus fumigatus care a germinat în căile respiratorii ale pacienţilor. Niveluri semnificative de anticorpi IgE specifici faţă de Asp f 1 sunt prezente la majoritatea pacienţilor cu ABPA din stadiile incipiente ale bolii(14,22-24). Asp f 1 este un alergen specific speciei Aspergillus fumigatus şi nu are omologie cu niciun alergen fungic cunoscut, cu excepţia restrictocinei Asp r 1, care este aproape identică cu Asp f 1(15). Asp f 1 a fost raportat ca inductor potent de răspunsuri IgE şi IgG specifice la pacienţii cu ABPA, dar nu şi la indivizii sănătoşi, sugerându-se astfel utilitatea sa ca biomarker pentru ABPA(25).
Asp f 2 este o proteină de legare a fibrinogenului, alergen major de 37 kDa al Aspergillus fumigatus, majoritatea persoanelor sensibilizate la acest fung având anticorpi IgE specifici serici faţă de Asp f 2. Cea mai mare parte a pacienţilor cu ABPA au anticorpi IgE direcţionaţi împotriva rAsp f 2(26,27). Asp f 2 poate fi, de asemenea, considerat ca alergen relativ specific pentru Aspergillus fumigatus şi/sau alţi fungi din genul Aspergillus. Similar Asp f 1, Asp f 2 poate fi considerat biomarker pentru sensibilizarea IgE autentică la Aspergillus fumigatus. Sensibilizarea şi nivelurile serice crescute de IgE specifice la Asp f 2 somatic şi Asp f 1 secretat au fost raportate la 60‑100% dintre pacienţii cu ABPA. Nivelurile de IgE specifice pentru Asp f 2 şi Asp f 1 sunt raportate discriminant, dar nivelul‑prag optim diferă de la un studiu la altul(27-30).
Asp f 3 este o proteină membranală peroxizomală de 19 kDa care poate fi considerată panalergen în alergia fungică. Asp f 3 prezintă omologie structurală semnificativă cu proteinele membranale peroxizomale din Candida spp. şi Malassezia spp. Sensibilizarea la Asp f 3 indică niveluri stabile ale IgE de-a lungul timpului, în ciuda episoadelor de exacerbare şi remisiune ale ABPA, sporind astfel diferenţierea pacienţilor cu ABPA de cei non-ABPA(31-35). Frecvenţele crescute ale sensibilizării IgE la Asp f 1, Asp f 2 şi Asp f 3 indică faptul că aceste trei componente alergenice pot fi considerate alergene majore ale Aspergillus fumigatus pentru ABPA(15,36).
Asp f 4 este un alergen fungic de grup 4 cu greutate moleculară de 30 kDa şi specificitate crescută pentru Aspergillus fumigatus. Sensibilizarea mediată IgE la Asp f 4 este un biomarker foarte specific pentru ABPA(15,37). Asp f 4, cu funcţie biologică necunoscută, împreună cu Asp f 6 sunt proteine somatice considerate alergene minore (mai puţin50% dintre pacienţii non-ABPA sensibilizaţi la Aspergillus fumigatus prezintă IgE specifice la aceste componente moleculare). Sensibilizările IgE la aceste alergene moleculare sunt raportate ca biomarkeri specifici pentru diagnosticul ABPA, atât la pacienţii cu fibroză chistică, dar şi la cei astmatici(30).
Asp f 6 este o superoxid dismutază de 26,5 kDa, foarte specifică ca alergen pentru ABPA şi care aparţine familiei de proteine superoxid dismutaze cu mangan (MnSOD). Diagnosticul serologic bazat pe rAsp f 4 şi rAsp f 6 al ABPA are specificitate de 100% şi atinge o sensibilitate de 90% la pacienţii astmatici sensibilizaţi la Aspergillus fumigatus, în timp ce distincţia serologică dintre sensibilizarea Aspergillus fumigatus şi ABPA la pacienţii care suferă de fibroză chistică ajunge la 100%(14,38,39). Asp f 6 este de asemenea un panalergen în alergia fungică. În particular, Mala s 11, care este MnSOD cross-reactivă din Malassezia sympodialis, reprezintă un alergen major implicat în dermatita atopică(32-35).
Combinaţiile de mai multe molecule alergenice fungice au fost sugerate pentru a ajuta diagnosticul ABPA în diferite studii. Pacienţii cu ABPA au niveluri semnificativ mai ridicate de IgE specifice la Asp f 1 şi Asp f 2 decât cei cu astm alergic(21). IgE specifice la rAsp f 2, rAsp f 4 şi rAsp f 6 au fost detectate semnificativ mai frecvent în serul pacienţilor cu ABPA relevantă clinic în comparaţie cu subiecţii sănătoşi sau astmatici(20). Într-o metaanaliză de studii, IgE specifice la Asp f 1 şi Asp f 3 au fost biomarkerii cei mai specifici pentru ABPA(40). Ratele de pozitivitate pentru Asp f 1, Asp f 2, Asp f 4 şi Asp f 6, precum şi nivelurile de IgE specifice la Asp f 1, Asp f 4 şi Asp f 6 sunt mai mari la pacienţii cu ABPA decât la pacienţii cu astm şi sensibilizare la Aspergillus fumigatus. Marea majoritate a pacienţilor cu ABPA şi majoritatea pacienţilor cu astm sensibilizaţi la Aspergillus fumigatus au sensibilizare la cel puţin un alergen molecular fungic(41). Detectarea IgE la alergenele specifice Asp f 1 şi Asp f 2 confirmă sensibilizarea autentică la Aspergillus fumigatus, în timp ce IgE la Asp f 3, Asp f 4 şi Asp f 6 indică gradul de complexitate al răspunsurilor IgE la Aspergillus fumigatus. Interesant, Asp f 3, Asp f 4 şi Asp f 6 nu sunt secretate, ci proteine somatice, spre deosebire de Asp f 1 şi Asp f 2, care sunt secretate extracelular. Distribuirea extinsă a răspunsurilor IgE faţă de alergene secretate ca sensibilizare benignă spre cele somatice în ABPA poate indica faptul că sistemul imunitar luptă împotriva unei încărcături mai mari de Aspergillus fumigatus sau împotriva unei devieri mai pronunţate către Th2 a răspunsului imunitar la Aspergillus fumigatus. În ambele cazuri, un răspuns IgE mai complex la acest fung poate fi predictiv pentru un risc mai mare de deteriorare clinică(30).
Astmul poate fi frecvent asociat cu dermatita atopică, care este asociată la rândul ei cu sensibilizarea transdermică la Malassezia spp. Ca urmare a reactivităţii încrucişate între unele alergene moleculare ale Malassezia spp. şi Aspergillus fumigatus, dermatita atopică trebuie luată în considerare drept comorbiditate în studiile de evaluare a diagnosticului alergologic molecular în alergia fungică(15). Malassezia, denumită anterior Pityrosporum, constituie o familie de fungi lipofili care cuprinde mai multe specii diferite aparţinând microflorei normale a pielii adulţilor sănătoşi, dar care, în anumite condiţii, pot acţiona ca agenţi patogeni oportunişti. Mai multe studii au raportat că Malassezia spp. au un rol important în eczema atopică(35). Mal f 2 şi Mal f 3, izolate din fungul lipofil Malassezia furfur, au omologie de secvenţă cu două proteine membranale peroxizomale ale Candida boidinii şi alergenul cu Asp f 3 al Aspergillus fumigatus(33). Mala s 10 (hsp-70) şi Mala s 11 (MnSOD) sunt alergene majore ale Malassezia sympodialis. Mala s 11 are identitate structurală de 56% cu alergenul MnSOD Asp f 6 al Aspergillus fumigatus(35). Mai mult, trebuie avertizat că Asp f 6 are reactivitate încrucişată cu alergene omoloage ale altor fungi, care ar trebui să fie luată în considerare în cazul dermatitei atopice asociate(30). În plus, dovezile de reactivitate încrucişată între Asp f 6 şi alergenul de Alternaria alternata Alt a 14 în cazul ABPA sugerează existenţa unui mecanism care poate fi legat de patogenia afecţiunii de hipersensibilitate(42).
Metodele de analiză imunoenzimatică pentru IgE specifice faţă de componente alergenice din Aspergillus fumigatus sunt de tip singleplex sau multiplex.
Metoda singleplex de analiză imunoenzimatică cu componente alergenice cuplate la polimer celulozic activat ca fază solidă (capsulă) şi detectare fluorimetrică poate fi utilizată pentru determinarea IgE specifice faţă de cele mai importante alergene moleculare recombinante ale Aspergillus fumigatus:
Aspergillus fumigatus rAsp f 1
Aspergillus fumigatus rAsp f 2
Aspergillus fumigatus rAsp f 3
Aspergillus fumigatus rAsp f 4
Aspergillus fumigatus rAsp f 6(43).
Metoda singleplex de imunoanaliză prin chemiluminiscenţă amplificată enzimatic cu alergene moleculare în fază lichidă poate fi utilizată pentru determinarea IgE specifice faţă de componenta alergenică nativă recombinantă nAsp r 1 a Aspergillus restrictus(44).
Metoda multiplex de analiză imunoenzimatică cu componente alergenice imobilizate în microarray pe lamă de sticlă preactivată ca fază solidă (chip) şi detectare fluorimetrică poate fi utilizată pentru determinarea IgE specifice faţă de următoarele alergene moleculare recombinante ale Aspergillus fumigatus:
Aspergillus fumigatus rAsp f 1
Aspergillus fumigatus rAsp f 3
Aspergillus fumigatus rAsp f 6(44).
Metoda multiplex de explorare alergologică prin analiză imunoenzimatică cu componente alergenice cuplate cu nanoparticule activate depozitate în macroarray pe membrană de nitroceluloză ca fază solidă (chip) şi detectare colorimetrică poate fi utilizată pentru determinarea IgE specifice faţă de alergenele moleculare recombinante importante ale Aspergillus fumigatus:
Aspergillus fumigatus rAsp f 1
Aspergillus fumigatus rAsp f 3
Aspergillus fumigatus rAsp f 4
Aspergillus fumigatus rAsp f 6(45).
Abordarea alergologică moleculară în algoritmul de diagnostic pentru ABPA este importantă, investigarea IgE serice specifice faţă de componentele alergenice moleculare importante ale Aspergillus fumigatus, prin metodele de imunoanaliză singleplex sau multiplex prezentate anterior, fiind utilă în practica clinică pentru diagnosticul ABPA, conform schemei decizionale prezentate mai jos(46) şi având potenţialul de a revizui suplimentar criteriile de diagnostic în viitor.
►Dacă factorii predispozanţi pentru ABPA sunt prezenţi – astm, fibroză chistică, bronhopneumopatie obstructivă cronică sau prezenţa anomaliilor de structură bronhopulmonară – şi dacă două criterii majore sunt prezente: nivel seric crescut ale IgE specifice faţă de Aspergillus fumigatus >0,35 kUA/L (sau test cutanat de hipersensibilitate imediată pozitiv în cazul în care determinarea IgE specifice nu este posibilă) şi nivel seric al IgE totale >500 UI/mL (evaluare imunologică de primă linie):
plus prezenţa a cel puţin două criterii minore dintre următoarele trei: precipitine sau IgG serice specifice faţă de Aspergillus fumigatus, modificări imagistice CT concludente pentru ABPA, eozinofilie în sânge periferic >500/µL (actuală sau în istoric) è diagnostic de ABPA
plus absenţa a cel puţin două criterii minore dintre următoarele trei: precipitine sau IgG specifice serice faţă de Aspergillus fumigatus, modificări imagistice CT concludente pentru ABPA, eozinofilie în sânge periferic >500/µL (actuală sau în istoric) (evaluare diagnostică de a doua linie, dificilă din cauza caracterului fluctuant al unor criterii) è Considerare: sensibilizare la Aspergillus fumigatus fără alergie, BPOC sau astm cu alergie la Aspergillus fumigatus, sau aplicarea diagnosticului molecular pentru ABPA (evaluare moleculară de a treia linie):
dacă sunt detectate IgE specifice serice crescute faţă de rAsp f 1 sau rAsp f 2 sau rAsp f 3 şi dacă sunt detectate IgE specifice serice crescute faţă de rAsp f4 sau rAsp f6 è ABPA probabilă
dacă sunt detectate IgE specifice serice crescute faţă de rAsp f 1 sau rAsp f 2 sau rAsp f 3 şi dacă nu sunt detectate IgE specifice serice crescute faţă de rAsp f4 sau rAsp f6 è se repetă evaluarea eozinofiliei şi a imagisticii toracice şi/sau se consideră diagnosticul de MBPA (micoză bronhopulmonară alergică)
dacă nu sunt detectate IgE specifice serice crescute faţă de rAsp f 1 sau rAsp f 2 sau rAsp f 3 è diagnostic de ABPA improbabil (!) şi se poate considera diagnosticul de MBPA.
►Dacă factorii predispozanţi pentru ABPA sunt prezenţi: astm, fibroză chistică, bronhopneumopatie obstructivă cronică sau prezenţa anomaliilor de structură bronhopulmonară, dar dacă nu sunt prezente ambele criterii majore: nivel seric crescut ale IgE specifice faţă de Aspergillus fumigatus >0,35 kUA/L (sau test cutanat de hipersensibilitate imediată pozitiv în cazul în care determinarea IgE specifice nu este posibilă), nivel seric al IgE serice totale >500 UI/mL è diagnosticul de ABPA este exclus.
Criteriile clinice actualizate pentru diagnosticul de micoză bronhopulmonară alergică (MBPA) sunt prezentate în continuare(9). Pacienţii fără fibroză chistică care prezintă cel puţin 6 dintre cele 10 criterii sunt diagnosticaţi definitiv cu MBPA, iar cei care au doar 5 criterii sunt diagnosticaţi cu MBPA probabilă. Cele 10 criterii pentru diagnosticul MBPA sunt:
astm sau simptome astmatice, inclusiv wheezing, preexistente sau actuale;
eozinofilie în sânge periferic >500/µL;
niveluri serice crescute ale IgE totale ≥ 417 UI/mL;
test cutanat de hipersensibilitate imediată pozitiv la fungi filamentoşi sau valori serice crescute ale anticorpilor IgE specifici faţă de antigen de fungi filamentoşi;
anticorpi precipitanţi (precipitine) sau anticorpi IgG serici specifici faţă de fungi filamentoşi* (corelaţi la nivel de gen cu criteriul anterior);
fungi filamentoşi* prezenţi în spută sau lavaj bronhopulmonar (cultura fungică pozitivă poate fi considerată când există acelaşi gen fungic cu testele serice din criteriile anterioare);
prezenţa hifelor fungice în dopurile de mucus bronşic;
bronşectazii centrale prezente la tomografie computerizată toracic;
dopuri de mucus în bronhiile centrale (CT/bronhoscopie/anamnestic, dopuri de mucus în expectoraţie);
dopuri de mucus hiperdense la CT cu rezoluţie crescută (HRCT).
*Aplicabile fungilor filamentoşi, dar nu şi fungilor de tip Candida spp.
Concluzii
Evaluarea detaliată a profilurilor moleculare de sensibilizare IgE, utilizând panelul de componente alergenice recombinante pentru Aspergillus fumigatus din metodele de imunoanaliză disponibile comercial este utilă în practica clinică pentru identificarea sensibilizării autentice faţă de cea cross-reactivă la pacienţii sensibilizaţi la Aspergillus fumigatus, inclusiv la pacienţii cu dermatită atopică asociată şi sensibilizare la alţi fungi cu componente alergenice cu reactivitate încrucişată, pentru diagnosticul alergologic molecular de precizie al ABPA şi pentru a distinge ABPA de astmul cu sensibilizare la Aspergillus fumigatus fără ABPA. Sunt necesare mai multe cercetări la diferite populaţii pentru a confirma validitatea generală a acestor abordări alergologice moleculare.
Bibliografie
-
Steenwyk JL, Shen XX, Lind AL, Goldman GH, Rokas A. A Robust Phylogenomic Time Tree for Biotechnologically and Medically Important Fungi in the Genera Aspergillus and Penicillium. mBio. 2019 Jul 9;10(4):e00925-19. doi: 10.1128/mBio.00925-19.
-
Thines M, Aoki T, Crous PW, Hyde KD, Lücking R, Malosso E, May TW, Miller AN, Redhead SA, Yurkov AM, Hawksworth DL. Setting scientific names at all taxonomic ranks in italics facilitates their quick recognition in scientific papers. IMA Fungus. 2020 Nov 17;11(1):25. doi: 10.1186/s43008-020-00048-6.
-
Tekaia F, Latgé JP. Aspergillus fumigatus: saprophyte or pathogen? Curr Opin Microbiol. 2005 Aug;8(4):385-92. doi: 10.1016/j.mib.2005.06.017.
-
Latgé JP, Chamilos G. Aspergillus fumigatus and Aspergillosis in 2019. Clin Microbiol Rev. 2019 Nov 13;33(1):e00140-18. doi: 10.1128/CMR.00140-18.
-
van de Veerdonk FL, Gresnigt MS, Romani L, Netea MG, Latgé JP. Aspergillus fumigatus morphology and dynamic host interactions. Nat Rev Microbiol. 2017 Nov;15(11):661-674. doi: 10.1038/nrmicro.2017.90.
-
Wéry N. Bioaerosols from composting facilities – a review. Front Cell Infect Microbiol. 2014;4:42. Published 2014 Apr 4. doi:10.3389/fcimb.2014.00042
-
Agarwal R, Chakrabarti A, Shah A, Gupta D, Meis JF, Guleria R, Moss R, Denning DW; ABPA complicating asthma ISHAM working group. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy. 2013 Aug;43(8):850-73. doi: 10.1111/cea.12141. PMID: 23889240.
-
Patel AR, Patel AR, Singh S, Singh S, Khawaja I. Diagnosing Allergic Bronchopulmonary Aspergillosis: A Review. Cureus. 2019 Apr 27;11(4):e4550. doi: 10.7759/cureus.4550.
-
Asano K, Hebisawa A, Ishiguro T, Takayanagi N, Nakamura Y, Suzuki J, Okada N, Tanaka J, Fukutomi Y, Ueki S, Fukunaga K, Konno S, Matsuse H, Kamei K, Taniguchi M, Shimoda T, Oguma T; Japan ABPM Research Program. New clinical diagnostic criteria for allergic bronchopulmonary aspergillosis / mycosis and its validation. J Allergy Clin Immunol. 2021 Apr;147(4):1261-1268.e5. doi: 10.1016/j.jaci.2020.08.029.
-
Chowdhary A, Agarwal K, Kathuria S, Gaur SN, Randhawa HS, Meis JF. Allergic bronchopulmonary mycosis due to fungi other than Aspergillus: a global overview. Crit Rev Microbiol. 2014 Feb;40(1):30-48. doi: 10.3109/1040841X.2012.754401.
-
Woolnough KF, Richardson M, Newby C, Craner M, Bourne M, Monteiro W, Siddiqui S, Bradding P, Pashley CH, Wardlaw AJ. The relationship between biomarkers of fungal allergy and lung damage in asthma. Clin Exp Allergy. 2017 Jan;47(1):48-56. doi: 10.1111/cea.12848.
-
Stevens DA, Moss RB, Kurup VP, Knutsen AP, Greenberger P, Judson MA, Denning DW, Crameri R, Brody AS, Light M, Skov M, Maish W, Mastella G; Participants in the Cystic Fibrosis Foundation Consensus Conference. Allergic bronchopulmonary aspergillosis in cystic fibrosis – state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis. 2003 Oct 1;37 Suppl 3:S225-64. doi: 10.1086/376525.
-
Saxena P, Choudhary H, Muthu V, Sehgal IS, Dhooria S, Prasad KT, Garg M, Saikia B, Aggarwal AN, Chakrabarti A, Agarwal R. Which Are the Optimal Criteria for the Diagnosis of Allergic Bronchopulmonary Aspergillosis? A Latent Class Analysis. J Allergy Clin Immunol Pract. 2021 Jan;9(1):328-335.e1. doi: 10.1016/j.jaip.2020.08.043.
-
Crameri R, Zeller S, Glaser AG, Vilhelmsson M, Rhyner C. Cross-reactivity among fungal allergens: a clinically relevant phenomenon? Mycoses. 2009 Mar;52(2):99-106. doi: 10.1111/j.1439-0507.2008.01644.x.
-
Tanimoto H, Fukutomi Y, Yasueda H, Takeuchi Y, Saito A, Watai K, Sekiya K, Tsuburai T, Asano K, Taniguchi M, Akiyama K. Molecular-based allergy diagnosis of allergic bronchopulmonary aspergillosis in Aspergillus fumigatus-sensitized Japanese patients. Clin Exp Allergy. 2015 Dec;45(12):1790-800. doi: 10.1111/cea.12590.
-
Horner WE, Helbling A, Salvaggio JE, Lehrer SB. Fungal allergens. Clin Microbiol Rev. 1995 Apr;8(2):161-79. doi: 10.1128/CMR.8.2.161.
-
Kodzius R, Rhyner C, Konthur Z, Buczek D, Lehrach H, Walter G, Crameri R. Rapid identification of allergen-encoding cDNA clones by phage display and high-density arrays. Comb Chem High Throughput Screen. 2003 Mar;6(2):147-54. doi: 10.2174/1386207033329751.
-
Allergen databases: http://allergen.org, www.allergome.org
-
Popescu FD, Vieru M. Precision medicine allergy immunoassay methods for assessing immunoglobulin E sensitization to aeroallergen molecules. World J Methodol. 2018 Nov 29;8(3):17-36. doi: 10.5662/wjm.v8.i3.17.
-
Kespohl S, Raulf M. Mould allergens: Where do we stand with molecular allergy diagnostics?: Part 13 of the series Molecular Allergology. Allergo J Int. 2014;23(4):120-125. doi:10.1007/s40629-014-0014-4
-
Steering Committee Authors; Review Panel Members. A WAO - ARIA - GA2LEN consensus document on molecular-based allergy diagnosis (PAMD@): Update 2020. World Allergy Organ J. 2020 Mar 7;13(2):100091. doi: 10.1016/j.waojou.2019.100091.
-
Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, Aalberse RC, Agache I, Asero R, Ballmer-Weber B, Barber D, Beyer K, Biedermann T, Bilò MB, Blank S, Bohle B, Bosshard PP, Breiteneder H, Brough HA, Caraballo L, Caubet JC, Crameri R, Davies JM, Douladiris N, Ebisawa M, EIgenmann PA, Fernandez-Rivas M, Ferreira F, Gadermaier G, Glatz M, Hamilton RG, Hawranek T, Hellings P, Hoffmann-Sommergruber K, Jakob T, Jappe U, Jutel M, Kamath SD, Knol EF, Korosec P, Kuehn A, Lack G, Lopata AL, Mäkelä M, Morisset M, Niederberger V, Nowak-Węgrzyn AH, Papadopoulos NG, Pastorello EA, Pauli G, Platts-Mills T, Posa D, Poulsen LK, Raulf M, Sastre J, Scala E, Schmid JM, Schmid-Grendelmeier P, van Hage M, van Ree R, Vieths S, Weber R, Wickman M, Muraro A, Ollert M. EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol. 2016 May;27 Suppl 23:1-250. doi: 10.1111/pai.12563.
-
Sporik RB, Arruda LK, Woodfolk J, Chapman MD, Platts-Mills TA. Environmental exposure to Aspergillus fumigatus allergen (Asp f I). Clin Exp Allergy. 1993 Apr;23(4):326-31. doi: 10.1111/j.1365-2222.1993.tb00330.x.
-
Mayer C, Hemmann S, Faith A, Blaser K, Crameri R. Cloning, production, characterization and IgE cross-reactivity of different manganese superoxide dismutases in individuals sensitized to Aspergillus fumigatus. Int Arch Allergy Immunol. 1997 May-Jul;113(1-3):213-5. doi: 10.1159/000237550.
-
Arruda LK, Platts-Mills TA, Longbottom JL, el-Dahr JM, Chapman MD. Aspergillus fumigatus: identification of 16, 18, and 45 kd antigens recognized by human IgG and IgE antibodies and murine monoclonal antibodies. J Allergy Clin Immunol. 1992 Jun;89(6):1166-76. doi: 10.1016/0091-6749(92)90301-h.
-
Banerjee B, Kurup VP, Greenberger PA, Kelly KJ, Fink JN. C-terminal cysteine residues determine the IgE binding of Aspergillus fumigatus allergen Asp f 2. J Immunol. 2002 Nov 1;169(9):5137-44. doi: 10.4049/jimmunol.169.9.5137.
-
Banerjee B, Kurup VP, Greenberger PA, Hoffman DR, Nair DS, Fink JN. Purification of a major allergen, Asp f 2 binding to IgE in allergic bronchopulmonary aspergillosis, from culture filtrate of Aspergillus fumigatus. J Allergy Clin Immunol. 1997 Jun;99(6 Pt 1):821-7. doi: 10.1016/s0091-6749(97)80017-6.
-
Bowyer P, Fraczek M, Denning DW. Comparative genomics of fungal allergens and epitopes shows widespread distribution of closely related allergen and epitope orthologues. BMC Genomics. 2006 Oct 9;7:251. doi: 10.1186/1471-2164-7-251.
-
Denning DW, O’Driscoll BR, Hogaboam CM, Bowyer P, Niven RM. The link between fungi and severe asthma: a summary of the evidence. Eur Respir J. 2006 Mar;27(3):615-26. doi: 10.1183/09031936.06.00074705.
-
Carsin A, Romain T, Ranque S, Reynaud-Gaubert M, Dubus JC, Mège JL, Vitte J. Aspergillus fumigatus in cystic fibrosis: An update on immune interactions and molecular diagnostics in allergic bronchopulmonary aspergillosis. Allergy. 2017 Nov;72(11):1632-1642. doi: 10.1111/all.13204.
-
Lindborg M, Magnusson CG, Zargari A, Schmidt M, Scheynius A, Crameri R, Whitley P. Selective cloning of allergens from the skin colonizing yeast Malassezia furfur by phage surface display technology. J Invest Dermatol. 1999 Aug;113(2):156-61. doi: 10.1046/j.1523-1747.1999.00661.x.
-
Hemmann S, Blaser K, Crameri R. Allergens of Aspergillus fumigatus and Candida boidinii share IgE-binding epitopes. Am J Respir Crit Care Med. 1997 Dec;156(6):1956-62. doi: 10.1164/ajrccm.156.6.9702087.
-
Yasueda H, Hashida-Okado T, Saito A, Uchida K, Kuroda M, Onishi Y, Takahashi K, Yamaguchi H, Takesako K, Akiyama K. Identification and cloning of two novel allergens from the lipophilic yeast, Malassezia furfur. Biochem Biophys Res Commun. 1998 Jul 20;248(2):240-4. doi: 10.1006/bbrc.1998.8944. PMID: 9675120.
-
Flückiger S, Scapozza L, Mayer C, Blaser K, Folkers G, Crameri R. Immunological and structural analysis of IgE-mediated cross-reactivity between manganese superoxide dismutases. Int Arch Allergy Immunol. 2002 Aug;128(4):292-303. doi: 10.1159/000063862.
-
Andersson A, Rasool O, Schmidt M, Kodzius R, Flückiger S, Zargari A, Crameri R, Scheynius A. Cloning, expression and characterization of two new IgE-binding proteins from the yeast Malassezia sympodialis with sequence similarities to heat shock proteins and manganese superoxide dismutase. Eur J Biochem. 2004 May;271(10):1885-94. doi: 10.1111/j.1432-1033.2004.04098.x.
-
Knutsen AP, Hutcheson PS, Slavin RG, Kurup VP. IgE antibody to Aspergillus fumigatus recombinant allergens in cystic fibrosis patients with allergic bronchopulmonary aspergillosis. Allergy. 2004 Feb;59(2):198-203. doi: 10.1046/j.1398-9995.2003.00310.x.
-
Li BCM, Huh SM, Prieto MD, Hong G, Schwarz C, Moss RB, Quon BS. Biomarkers for the Diagnosis of Allergic Bronchopulmonary Aspergillosis in Cystic Fibrosis: A Systematic Review and Meta-Analysis. J Allergy Clin Immunol Pract. 2021 May;9(5):1909-1930.e4. doi: 10.1016/j.jaip.2020.12.064.
-
Hemmann S, Menz G, Ismail C, Blaser K, Crameri R. Skin test reactivity to 2 recombinant Aspergillus fumigatus allergens in A fumigatus-sensitized asthmatic subjects allows diagnostic separation of allergic bronchopulmonary aspergillosis from fungal sensitization. J Allergy Clin Immunol. 1999 Sep;104(3 Pt 1):601-7. doi: 10.1016/s0091-6749(99)70330-1.
-
Hemmann S, Nikolaizik WH, Schöni MH, Blaser K, Crameri R. Differential IgE recognition of recombinant Aspergillus fumigatus allergens by cystic fibrosis patients with allergic bronchopulmonary aspergillosis or Aspergillus allergy. Eur J Immunol. 1998 Apr;28(4):1155-60. doi: 10.1002/(SICI)1521-4141(199804)28:04<1155::AID-IMMU1155>3.0.CO;2-6. PMID: 9565354.
-
Muthu V, Sehgal IS, Dhooria S, Aggarwal AN, Agarwal R. Utility of recombinant Aspergillus fumigatus antigens in the diagnosis of allergic bronchopulmonary aspergillosis: A systematic review and diagnostic test accuracy meta-analysis. Clin Exp Allergy. 2018 Sep;48(9):1107-1136. doi: 10.1111/cea.13216. Epub 2018 Jul 24. PMID: 29927507.
-
Luo W, Hu H, Wu Z, Wei N, Huang H, Zheng P, Liu Y, Sun B. Molecular allergen sensitization of Aspergillus fumigatus between allergic bronchopulmonary aspergillosis and A fumigatus-sensitized asthma in Guangzhou, Southern China. J Clin Lab Anal. 2020 Oct;34(10):e23448. doi: 10.1002/jcla.23448. Epub 2020 Jul 2. PMID: 32614101; PMCID: PMC7595924.
-
Gabriel MF, Postigo I, Gutiérrez-Rodríguez A, Suñén E, Guisantes J, Tomaz CT, Martínez J. Characterisation of Alternaria alternata manganese-dependent superoxide dismutase, a cross-reactive allergen homologue to Asp f 6. Immunobiology. 2015 Jul;220(7):851-8. doi: 10.1016/j.imbio.2015.01.006. Epub 2015 Jan 22. PMID: 25657116.
-
www.abacusdx.com/autoimmunity/new-thermo-fisher-2021-product-catalogue-now-available/
-
www.siemens-healthineers.com/laboratory-diagnostics/assays-by-diseases-conditions/allergy/laboratorian-information
-
www.macroarraydx.com/products/alex
-
Lukaszewicz R, Mahay G, Boyer O, Martinet J. Medical algorithm: Aspergillus fumigatus components in the diagnosis of Allergic Bronchopulmonary Aspergillosis. Allergy. 2021 Jul 12. doi: 10.1111/all.15001. Epub ahead of print. PMID: 34252208.
Articole din ediţiile anterioare
Diagnosticul molecular în bolile alergice respiratorii induse de alergene perene
Diagnosticul molecular se bazează pe identificarea, caracterizarea şi utilizarea componentelor alergenice din surse complexe de alergene. Expunerea...
Sensibilizarea la acarienii din praful de casă – o interpretare moleculară
Acarienii din praful de casă reprezintă principala cauză de alergie respiratorie, iar reactivitatea atopică la produsele lor este una dintre cele m...
Diagnosticul molecular în alergia la grâu
Alergia la grâu este o patologie frecventă în rândul pacienţilor pediatrici, dar poate fi întâlnită şi la adulţi, având potenţialul de a genera div...
Diagnosticul molecular în bolile alergice respiratorii induse de polenuri
Alergologia se află într-o perioadă de tranziţie în care diagnosticul bazat pe componente alergenice moleculare este integrat tot mai mult în pract...