Molecular diagnosis is currently based on the identification, characterization and use of molecular components from complex allergenic sources. Specific features of indoor allergen exposure are due to allergic patients’ quality of life impact of perennial exposure, with frequent development of rhinitis towards asthma. In this article we present the most common sources of perennial allergens (house dust mites, furry pets and moulds), as well as their allergenic molecular components. The major allergens responsible for primary sensitization, together with possible cross-reactivity manifestations with allergenic components from animal food sources or parasites are described.
Component-resolved diagnosis usefulness towards establishing an optimal approach of allergen immunotherapy, in accordance with the patient’s sensitization profile, is also addressed.
Diagnosticul molecular în bolile alergice respiratorii induse de alergene perene
Molecular Diagnostics in Allergic Respiratory Diseases Induced by Perennial Allergens
First published: 31 martie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.4.1.2020.2982
Abstract
Rezumat
Diagnosticul molecular se bazează pe identificarea, caracterizarea şi utilizarea componentelor alergenice din surse complexe de alergene. Expunerea la alergene de interior are particularităţile sale datorate expunerii perene, care are impact asupra calităţii vieţii pacienţilor alergici, cu evoluţie mai frecventă de la rinită spre astm.
În acest articol prezentăm principalele surse de aeroalergene perene (acarieni din praful de casă, animale de companie cu blană şi mucegaiuri), precum şi componentele moleculare alergenice. Sunt prezentate alergenele majore responsabile de sensibilizarea primară şi posibile manifestări de reactivitate încrucişată faţă de alte alergene de interior, alimente sau paraziţi.
Totodată, este abordată utilitatea diagnosticului molecular în vederea stabilirii imunoterapiei alergenice adaptate profilului de sensibilizare al pacientului.
Introducere
Incidenţa afecţiunilor alergice este în continuă creştere la nivel mondial, iar un număr tot mai mare de persoane se confruntă cu agravarea manifestărilor clinice de-a lungul vieţii, de la rinită alergică (cea mai frecventă afecţiune IgE-mediată) până la astm(1). Rinita alergică şi astmul au un impact negativ asupra calităţii vieţii pacienţilor şi presupun costuri mai mari odată cu creşterea severităţii bolii alergice(2). Din 2018, ghidul ARIA reiterează că alergia poate avea caracter sezonier sau peren în funcţie de tipul alergenului, durata expunerii şi de perioada apariţiei simptomelor. În zona de climă temperată, alergia perenă este cauzată de aeroalergene de interior (provenite din spaţiul habitual din încăperi) prezente tot timpul anului, precum acarienii din praful de casă, animale de companie şi mucegaiuri, în timp ce alergia sezonieră este cauzată în mare parte de aeroalergene de exterior (provenite din mediul exterior), cum sunt polenurile şi unii spori de mucegai.
Durata expunerii la un anumit alergen diferă în funcţie de zonă, astfel încât polenurile şi unele mucegaiuri pot deveni alergene perene (de exemplu, polenul de Parietaria în zona mediteraneeană). O problemă aparte o constituie faptul că majoritatea pacienţilor sunt polisensibilizaţi, fiind astfel expuşi la multiple alergene de-a lungul anului. În alte cazuri, chiar dacă expunerea este sezonieră, pacienţii prezintă simptome perene cu exacerbări sezoniere în funcţie de gradul de expunere la polenuri sau mucegaiuri. Pacienţii cu alergii respiratorii perene pot avea simptome doar la nivelul tractului respirator superior (rinită) şi/sau inferior (astm). Studiile relevă că afectarea bronşică este mai pronunţată la pacienţii cu rinite perene decât la cei cu rinite sezoniere(3). În situaţii particulare, simptomele alergiei perene pot fi absente în multe perioade din cursul anului (de exemplu, un număr semnificativ de pacienţi cu alergie la acarienii din praful de casă au manifestări intermitente de rinită) şi, viceversa, unii pacienţi sensibilizaţi doar la un tip de polen pot prezenta simptome perene. Totodată, expunerea la iritanţi respiratori nespecifici, precum poluarea atmosferică, poate agrava tabloul clinic la pacienţii alergici simptomatici şi poate induce simptome la cei asimptomatici(4).
Şi în cazul alergenelor perene, reactivitatea încrucişată apare când răspunsul imun adaptativ la o anumită componentă alergenică provoacă reacţii la alte componente cu omologie cu cea responsabilă de sensibilizarea primară(5).
În acest articol sunt prezentate principalele alergene de interior, componentele lor moleculare, inclusiv cele responsabile de reactivitate încrucişată cu alte aeroalergene, alergene alimentare sau din alte surse, relevanţa clinică a acestora şi rolul diagnosticului molecular în alergiile perene.
Alergia la acarieni din praful de casă
Acarienii din praful de casă sunt cauza principală a alergiilor respiratorii la nivel mondial şi reprezintă principala sursă de alergene de interior. Aceştia fac parte din încrengătura artropodelor, în zonele temperate cele mai comune specii fiind Dermatophagoides pteronyssinus (D. pteronyssinus) şi Dermatophagoides farinae (D. farinae), din familia Pyroglyphidae. Blomia tropicalis este un acarian din familia Echimyopodidae, tipic zonelor subtropicale şi tropicale. D. pteronyssinus are o distribuţie mai largă la scară globală, în special în zonele temperate, inclusiv în Europa (acarian din praful de casă de tip european), iar D. farinae este mai abundent în zonele mai uscate. Acarienii din praful de casă se găsesc mai ales în locuinţele din zone cu climat cald şi umed, dar şi în condiţiile unui climat rece şi uscat, prin invazia locuinţelor încălzite. Creşterea şi reproducerea acarienilor sunt optime la o umiditate relativă de peste 50% şi este redusă prin menţinerea umidităţii între 35% şi 50%. Alergenele din acarieni au fost identificate în praful depus pe covoare, pe lenjeria de pat, saltele, mobilă tapiţată şi pe haine. Alergenele provin din corpul acarienilor, fragmente din acesta, precum şi din peletele fecale eliminate. Particulele alergenice se depun predominant în căile respiratorii mari şi mai puţin în cele mici, deoarece dimensiunea acarienilor este de 0,2-0,4 mm, iar peletele fecale au un diametru de 10-24 mm(6).
Expunerea la praful de casă este perenă, dar variabilă, şi constituie un factor trigger important al exacerbărilor de astm la pacienţii sensibilizaţi(7). Făina poate fi contaminată cu acarieni, astfel că s-au raportat cazuri de reacţii sistemice la persoane care au ingerat produse de panificaţie contaminate cu acarieni (clătite, mămăligă, baghete, turte etc.) (6).
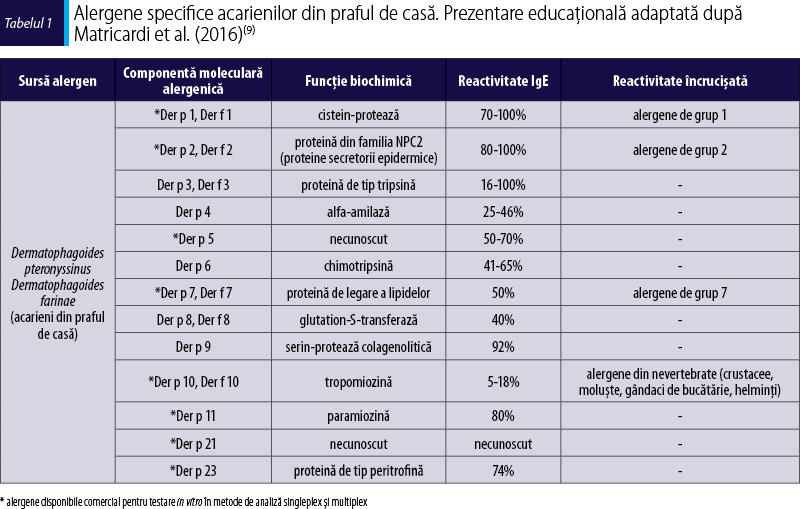
Ambele specii de acarieni din praful de casă din familia Pyroglyphidae sunt surse de alergene majore, descrise clasic ca proteine de grup 1 (Der p 1/ Der f 1 din familia cistein-proteazelor) şi grup 2 (Der p 2/ Der f 2 din familia NPC2). Der p 1 este alergenul clonat şi produs prima oară sub formă recombinată(8). Gradul de omologie structurală între alergenele din acelaşi grup este foarte mare, ceea ce determină frecvent reactivitate încrucişată(9). Au fost identificate la momentul actual peste 30 de alergene specifice acarienilor din praful de casă, în tabelul 1 fiind prezentate principalele alergene ale acestora.
Componentele moleculare principale ale acarienilor din praful de casă:
Der p 1/Der f 1 şi Der p 2/Der f 2, alergenele de grup 1 şi 2, sunt recunoscute de mult timp drept alergene majore specifice din acarieni(7,9-11). Totuşi, în medie, 20% dintre persoanele alergice la acarieni nu sunt sensibilizate la acestea. O proporţie semnificativă (63-97%) dintre pacienţii alergici la praf de casă sunt sensibilizaţi la Der p 1 şi Der p 2(12), astfel că un grup destul de mare de pacienţi ar putea rămâne nedepistaţi dacă se folosesc teste de determinare serologică a IgE conţinând doar componente de grup 1 sau 2. O particularitate a Der p 1 (protează) este capacitatea de a cliva receptorii CD23 ai limfocitelor B, aceştia devenind liberi, fără a mai putea fi implicaţi în autoreglarea răspunsului IgE mediat(13). Der p 1 şi celelalte proteaze din componenţa acarienilor (Der p 3, 6 şi 9), pe lângă rolul direct în inducerea răspunsului imun de tip alergic, sunt implicate şi în mecanisme inflamatorii non-IgE mediate, precum perturbarea funcţiei de barieră a epiteliului, clivarea receptorilor de suprafaţă, activarea unor receptori specifici imunităţii înnăscute (PAR), reducerea clearance-ului pulmonar(14).
Der p 23 a fost identificat recent ca un alergen major (rata de sensibilizare este de 74%)(15,16). A fost încadrat, prin analiza secvenţei peptidice, în grupul proteinelor de tip peritrofină (din stratul peritrofic care căptuşeşte epiteliul digestiv), fiind de asemenea detectat în peletele fecale ale acarienilor. Importanţa clinică a acestui alergen este legată de faptul că sensibilizarea la Der p 23 se asociază cu dezvoltarea astmului(17). La copii, sensibilizarea înaintea vârstei de 5 ani faţă de oricare din Der p 1, Der p 2 sau Der p 23 este asociată cu dezvoltarea simptomelor de astm(18,19). Acest alergen se găseşte în concentraţie scăzută în extractele de acarieni utilizate pentru testarea cutanată(15,16,20), 2, 5, 7, 10 şi 21. În consecinţă, pentru evidenţierea sensibilizării faţă de Der p 23 este necesară testarea moleculară in vitro singleplex şi/sau multiplex.
Der p 3 este un alergen major din familia proteinelor de tip tripsină, cu o reactivitate IgE-specifică de 50% în rândul pacienţilor sensibilizaţi la D. pteronyssinus, însă de obicei cu un titru scăzut(21,22).
Der p 4 este o alfa-amilază din familia hidrolazelor de glicozide cu o reactivitate IgE-specifică destul de mare, însă cu un titru scăzut(23). Sensibilizarea apare mai rar la copii (25%) comparativ cu adulţii (46%)(24). Pacienţii infectaţi cu Sarcoptes scabiei prezintă un titru crescut de IgE specifice faţă de Der p 4(25).
Der p 5 are o reactivitate IgE-specifică de 50%, însă de obicei cu un titru scăzut(21). Prevalenţa sensibilizării la acest alergen variază în funcţie de grupul de pacienţi testaţi, unele populaţii având titru IgE similar cu cel indus de alergenele majore Der p 1 şi Der p 2(26,27). Importanţa clinică a acestei componente alergenice este legată de faptul că sensibilizarea la Der p 5 se asociază cu dezvoltarea astmului(28).
Der p 6 este un alergen din familia chimotripsinelor, cu o reactivitate IgE-specifică de 40-50%, însă de obicei cu un titru scăzut(21,29). Der p 9 este un alergen omolog din punct de vedere structural atât cu Der p 3, cât şi cu Der p 6(30). Într-o cohortă de pacienţi alergici la acarieni, cu reacţie înaltă la alergenele majore Der p 1 (97%), Der p 2 (100%) şi Der p 3 (97%), s-a evidenţiat şi o rată de sensibilizare înaltă la Der p 9 (92%) şi Der p 6 (65%)(31).
Der p 7, o proteină de legare a lipidelor, induce o rată de sensibilizare de 50%, dar cu un titru IgE‑specific scăzut(21,32). Alergenul recombinat rDer p 7 prezintă o reactivitate similară cu cel natural(27). Prevalenţa sensibilizării la acest alergen este mai mică în rândul copiilor alergici la acarieni(33). La unii pacienţi sensibilizaţi la acarieni, titrul IgE Der p 7-specific poate fi mai mare decât titrul IgE Der p 2-specific(34).
Der p 8 este o proteină din familia glutation S-transferazelor, cu o reactivitate IgE-specifică de 40-56%. Importanţa clinică a acestei componente este legată de faptul că sensibilizarea la Der p 8 se asociază cu dezvoltarea astmului(21,35). Der p 8 prezintă o omologie structurală ridicată cu glutation S-transferaza din Sarcoptes scabiei, asociată cu mecanismele formării crustelor din scabie(36). Din punct de vedere structural, ar putea da reactivitate încrucişată cu Asc l 13, însă reactivitatea nu a putut fi confirmată prin studii(36-38).
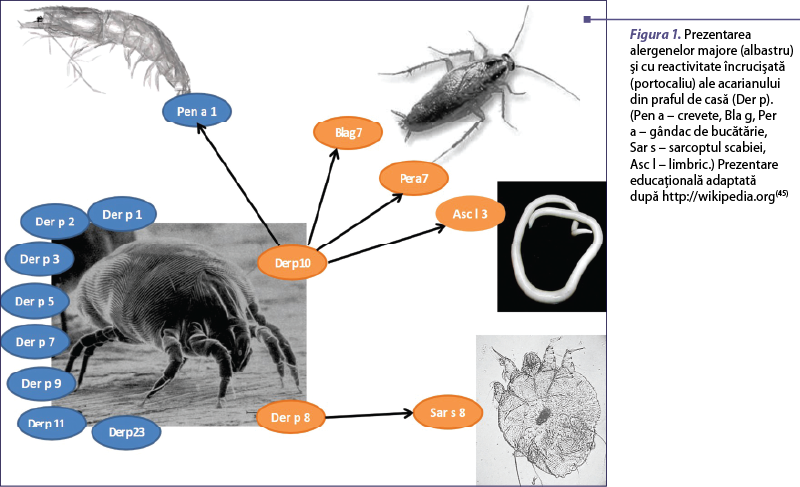
Der p 10 este o proteină din familia tropomiozinelor care induce o rată de sensibilizare redusă. Der p 10 este principalul alergen responsabil de reactivitatea încrucişată între acarian şi alte nevertebrate, spre exemplu, crustacee precum crevete (Pen a 1), homari (Hom a 1), moluşte cum sunt melci (Hel as 1), (Tur c 1) sau stridii (Cra g 1), gândaci de bucătărie (Bla g 7) şi helminţi (Asc l 3, Ani s 3)(39-42). Dacă în cazul alergiei la acarienii din praful de casă, tropomiozina este un alergen minor, în cazul alergiei la crevete este considerată alergen major (figura 1). Tropomiozinele sunt proteine stabile atât la căldură, cât şi la digestie, care produc reacţii şi după consumul alimentelor preparate termic. Acestea pot induce sindrom de alergie orală, dar şi reacţii sistemice severe. Un studiu populaţional în zone urbanizate cu venit scăzut din Columbia a găsit o rată mai mare de sensibilizare la tropomiozina din limbric (Asc l 3) în rândul pacienţilor astmatici alergici la praful de casă. Studiul sugerează că infecţiile intermitente cu acest parazit concomitent cu sensibilizarea la acarieni contribuie la sinteza continuă de IgE şi susţine inflamaţia alergică(39).
Der p 11 este o paramiozină (proteină structurală musculară) cu greutate moleculară mare (~100 kDa). Anticorpii IgE Der p 11-specifici sunt detectaţi mai frecvent în serul pacienţilor cu dermatită atopică(43).
Der p 21 este o proteină încă necaracterizată, care provine din epiteliul digestiv al acarienilor(44). Der p 21 induce răspuns IgE-specific mai frecvent la copiii astmatici alergici la acarieni faţă de cei nonastmatici(18).
Relevanţa clinică a identificării IgE specifice pentru moleculele alergenice din acarienii din praful de casă constă în:
Confirmarea sensibilizării primare la acarienii din praful de casă (Der p 1, Der p 2, Der p 23).
-
Evaluarea riscului de evoluţie spre astm a pacienţilor alergici la acarienii din praful de casă, prin profiluri de sensibilizare moleculară complexe ale IgE Der p-specifice (în particular Der p 1, Der p 2, Der p 23, Der p 5, Der p 7, Der p 8 şi Der p 21) sau cu titru înalt al acestor anticorpi(46). Cu cât o persoană este sensibilă la mai multe componente alergenice (pattern de sensibilizare mai complex), cu atât severitatea bolii alergice şi riscul de evoluţie spre astm sunt mai crescute(18).
-
Recomandarea imunoterapiei alergenice (AIT) adecvate. Pacienţii reactivi la Der p 1 sunt cei mai potriviţi candidaţi pentru AIT, deoarece alergenul este prezent în preparatele pentru imunoterapie şi este de aşteptat ca acestea să producă o ameliorare a simptomelor(9,10,11,12,16,18-20,47,48,49). Având în vedere că în preparatele imunoterapeutice bazate pe extracte alergenice componentele moleculare Der p 2, Der p 23 şi Der p 10 sunt prezente în cantitate redusă, pacienţii sensibilizaţi doar la acestea nu ar fi candidaţi potriviţi pentru AIT, fiind de aşteptat să nu producă efecte benefice(7-11,11-17,19,20,35-37,40,46-48,49) (tabelul 2).
-
Explicarea manifestărilor alergice în cazul pacienţilor sensibilizaţi la acarieni din praf de casă după ingerarea unor nevertebrate comestibile (crevete, stridii, midii, homari, melci etc.), datorată componentelor alergenice cu reactivitate încrucişată, cum ar fi tropomiozina Der p 10.
Alergia la epitelii ale animalelor de companie
Animalele de companie reprezintă o sursă importantă de aeroalergene, fiind considerate factori de risc pentru dezvoltarea rinitei şi astmului alergic în mediul domestic şi ocupaţional. Dintre acestea, alergia la epitelii de pisică şi câine este relevantă mai ales pentru mediul domestic, acestea fiind cele mai întâlnite animale de casă.
Efectele expunerii la câini şi pisici asupra dezvoltării atopiei şi a bolilor alergice sunt în prezent controversate, dacă în trecut expunerea era considerată un factor de risc major pentru dezvoltarea rinitei şi astmului alergic(52-54). De asemenea, există controverse şi cu privire la diferenţele dintre efectele protectoare faţă de alergii induse de expunerea la una dintre cele două specii(60).
Alergenele acestor animale sunt eliberate prin descuamaţii epiteliale, salivă şi urină, după care se dispersează în aerul din mediul ambiental, aderă la mobilier, dar pot fi şi transportate prin haine. Alergenele pot persista în locuinţe chiar şi şase luni după ce animalul a fost îndepărtat(61). Aceste alergene aparţin mai multor familii de proteine (figura 2), sursele alergenice conţinând atât componente specifice speciei, cât şi componente responsabile de reactivitate încrucişată.
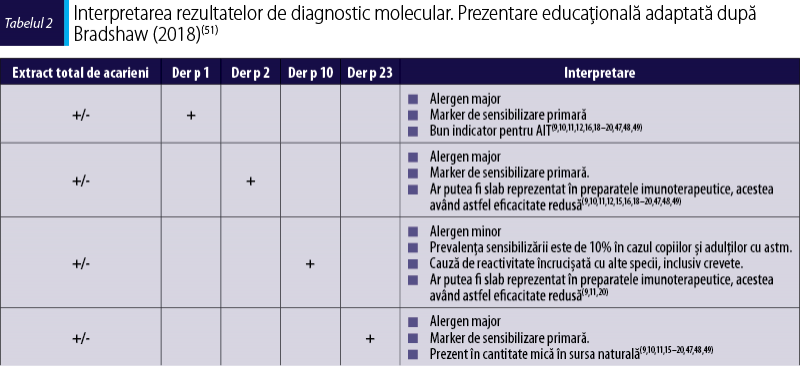

Până în prezent au fost identificate 8 alergene de la pisică şi 6 de la câine, în tabelul 3 fiind prezentate cele majore şi cele minore cu relevanţă clinică. Dintre acestea, lipocalinele reprezintă cea mai importantă familie de proteine alergenice, majoritatea fiind alergene majore – Fel d 4, Can f 1, Can f 6. Aceste proteine prezintă secvenţă primară cu similaritate scăzută, dar structură tridimensională comună, ceea ce determină reacţii de reactivitate încrucişată. Alergia la pisici este unică printre alergiile la mamifere, deoarece alergenul major, Fel d 1, este o proteină din familia uteroglobinelor (implicată în protejarea epiteliilor uscate), şi nu o lipocalină. Albuminele serice sunt considerate alergene minore care pot determina multiple răspunsuri pozitive la testarea cu extracte alergenice, din cauza reactivităţii încrucişate.
Alergenicitatea animalelor cu blană diferă în funcţie de statusul hormonal al acestora (care depinde de sexul animalului, dacă a fost castrat sau nu etc.). Existenţa unor rase hipoalergenice este controversată, nefiind identificate alergene specifice unor anumite rase de câini sau pisici. În ceea ce priveşte câinii, nu există un alergen major care să fie responsabil de o prevalenţă disproporţionat de înaltă a IgE specifice comparativ cu alte alergene, aşa cum este Fel d 1 la pisică (moleculă care induce o rată de sensibilizare de peste 95%). Nici în cazul alergiei la pisică, eliminarea Fel d 1 nu ar aduce un beneficiu major, deoarece 70% dintre pacienţi sunt sensibilizaţi la mai multe alergene specifice acesteia. În concluzie, nu există rase de pisică sau de câine cu adevărat hipoalergenice, deoarece ar fi necesară inactivarea expresiei tuturor acestor molecule alergenice, iar lipsa acestor proteine funcţionale ar putea avea un efect negativ asupra stării de sănătate a animalului(61).
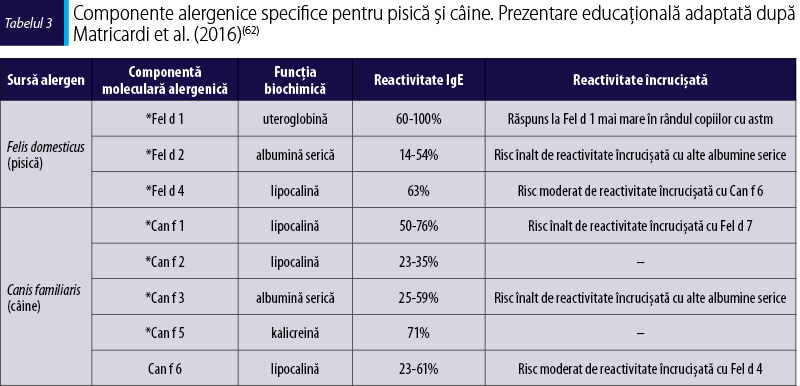
Alergenele epiteliilor de pisică
Pisica (Felis domesticus) este un mamifer carnivor de dimensiuni reduse. Pisica domestică este considerată o subspecie a pisicii sălbatice. Pisicile par să inducă sensibilizare mult mai frecvent decât câinii. S-a observat că 17% dintre persoanele care au pisici ca animale de casă prezintă reacţie cutanată pozitivă la testele prick faţă de 5% dintre cei care deţin câini(63).
Componentele moleculare alergenice feline:
-
Fel d 1 este alergenul major, cu o reactivitate IgE-specifică de peste 95%. Prezenţa reacţiei faţă de Fel d 1 este un marker al sensibilizării primare la pisică. Fel d 1 este o uteroglobină din familia secretoglobinelor, cu masa moleculară de 38 kDa, fiind produsă de glandele sebacee (în primul rând), anale şi salivare, după care ajunge pe pielea şi blana pisicii. Fel d 1 se răspândeşte în special pe cale aeriană, putând fi depistat şi în locuinţele fără pisici(64). Producţia de Fel d 1 este influenţată de hormonii sexuali(65). De exemplu, s-a observat că masculii produc mai mult Fel d 1 decât femelele, iar masculii castraţi produc mai puţin Fel d 1 decât cei necastraţi(65).
-
Fel d 2 este o proteină cu masa moleculară de 69 kDa din familia albuminelor serice, care se găseşte în ser, scuame şi salivă(66). Fel d 2 este implicat în sindromul porc-pisică, în care apar reacţii alergice induse de consumul cărnii de porc la persoanele sensibilizate la pisică, în urma reacţiei încrucişate între albumina serică de pisică şi cea de porc(67).
-
Fel d 3 este un alergen minor aparţinând familiei cistatinelor, care inhibă activitatea cistein-proteazei(68).
-
Fel d 4 (alergen major, marker al sensibilizării primare la pisică) şi Fel d 7 sunt alergene din familia lipocalinelor(69).
-
Fel d 5 şi Fel d 6 fac parte din familia imunoglobulinelor.
-
Fel d 8 este o laterină cu proprietăţi surfactante(70).
Alergenele epiteliilor de câine
Câinele (Canis familiaris) a fost unul dintre primele animale îmblânzite şi domesticite, înrudit cu şacalul şi vulpea. Alergenele provenite de la câine se găsesc în cantitate mare în ser, scuame, păr şi salivă, aceste produse biologice prezentând astfel un grad ridicat de alergenicitate, şi într-o foarte mică măsură în urină şi fecale, acestea fiind produse biologice cu alergenicitate redusă(71).
Componentele moleculare alergenice canine:
-
Can f 1, o proteină cu masa moleculară de 25 kDa din familia lipocalinelor, este cel mai important alergen major, cu o rată de sensibilizare de până la 90%. Can f 1 este marker al sensibilizării primare la câine(72). Acest alergen se găseşte pe păr, descuamaţii epiteliale şi în salivă. Poate deveni aeropurtat foarte uşor şi rămâne în aer o perioadă lungă, iar datorită dimensiunii mici poate ajunge în căile respiratorii inferioare, faţă de particulele mai mari, cum ar fi fecalele de acarieni şi grăuncioarele de polen. Există puţine studii cu privire la nivelurile de Can f 1 la diferite rase de câini, dar se pare că există variabilitate mai mare între exemplare de aceeaşi rasă decât între rase diferite(73).
-
Can f 2 este un alergen minor din familia lipocalinelor, cu masa moleculară cuprinsă între 19 kDa şi 27 kDa, care se găseşte în salivă şi descuamaţii epiteliale. Can f 2 prezintă un grad redus de reactivitate încrucişată cu Fel d 4, deşi secvenţele proteice sunt identice în procent de doar 22%.
-
Can f 3 este un alergen minor cu masa moleculară de 69 kDa, care face parte din familia albuminelor serice şi se găseşte din abundenţă în salivă şi descuamaţii epiteliale. Prezintă potenţial înalt de reacţii încrucişate cu alte albumine serice, precum Fel d 2.
-
Can f 4 este un alergen minor identificat în scuamele de câine, care aparţine familiei lipocalinelor.
-
Can f 5 este un alergen major din familia serin-proteazelor, fiind o kalicreină prostatică, izolată din urina câinilor masculi, dar care se găseşte şi în descuamaţii epiteliale şi pe păr(74). Acest alergen poate prezenta reactivitate încrucişată cu componente din fluidul seminal uman, putând determina manifestări alergice la persoanele sensibilizate(75). Pacienţii monosensibilizaţi la acest alergen pot tolera câinii femele(70).
Relevanţa clinică şi diagnosticul alergiilor la animalele de companie cu blană constă în:
-
Confirmarea sensibilizării primare prin reacţia IgE-mediată la alergenele majore (la pisică – Fel d 1, la câine – Can f 1, Can f 2, Can f 5).
-
Evaluarea severităţii bolii alergice la pacienţi prin identificarea de profiluri complexe ale IgE‑specifice la animale, asociate cu un grad crescut al inflamaţiei bronşice în cazul astmului sever(76).
-
Recomandarea imunoterapiei alergenice (AIT) adecvate. Animalele de companie produc molecule cu potenţial de reactivitate încrucişată, precum albuminele serice, unele lipocaline, posibil şi alte molecule, astfel că identificarea sursei de sensibilizare primară prin markerii specifici pentru sensibilizare este importantă pentru alegerea unei imunoterapii alergenice adecvate(77).
-
Explicarea simptomelor care apar în cazul pacienţilor alergici prin sensibilizarea la alergenele care induc reactivitate încrucişată; de exemplu, pentru clasa albuminelor, titrul ridicat de IgE Fel d 2-specific a fost asociat cu dermatita atopică la copiii cu alergie la pisici(78). De asemenea, albuminele serice sunt implicate în sindromul porc-pisică, unde sensibilizarea la albumina serică de pisică reprezintă evenimentul care declanşează producţia de IgE cu reactivitate încrucişată faţă de albumina serică de porc(79). În cazul lipocalinelor cu un grad scăzut de omologie structurală, IgE specifice nu determină apariţia simptomelor datorate reactivităţii încrucişate. În schimb, în cazul sensibilizării la lipocaline cu grad înalt de omologie structurală, sensibilizarea primară va determina apariţia simptomelor datorate reactivităţii încrucişate cu alte surse de alergene. Deoarece monosensibilizarea la aceste componente pare a fi rară, există puţine date legate de apariţia simptomelor datorate reactivităţii încrucişate.
-
Opţiunea pentru un animal de casă aparent mai puţin alergenic: femelă mai degrabă decât mascul, mascul castrat mai degrabă decât necastrat.
Alergia la fungi/mucegaiuri
Principalele genuri de fungi care produc sensibilizare alergică sunt Alternaria, Aspergillus, Cladosporium şi Penicillium, la care expunerea poate avea loc atât în interior, cât şi în exterior(51). Sporii acestora sunt de dimensiuni mici (3-10 mm), astfel încât penetrează profund în tractul respirator şi duc la dezvoltarea rinitei şi astmului(80). Expunerea la spori poate fi sezonieră – în cazul Cladosporium şi Alternaria (cu expunere maximă în timpul verii(80)) sau perenă – în cazul Aspergillus şi Penicillium, fiind favorizată şi de prezenţa acestora în alimente(80). Sensibilizarea la mucegaiuri asociată cu sensibilizarea la alergene din alte surse creşte riscul de dezvoltare a astmului sever, denumit „astm sever cu sensibilizare fungică“ (SAFS)(51). Alternaria alternata şi Aspergillus fumigatus sunt speciile care produc cel mai frecvent sensibilizare la mucegaiuri şi contribuie la declanşarea şi la creşterea severităţii astmului(81). Testarea reactivităţii la componente moleculare alergenice este o abordare diagnostică modernă in vitro a sensibilizării la mucegaiuri(51).
Alergenele din Alternaria alternata
Alternaria alternata (Alt a) este o sursă de alergene prezentă atât în exteriorul, cât şi în interiorul locuinţei. Sporii Alternaria aeropurtaţi sunt detectabili din luna mai până în luna noiembrie, cu un vârf la sfârşitul verii şi toamna în regiunile cu climă temperată(82). În spaţiile interioare, sporii Alternaria sunt prezenţi îndeosebi în praful de casă şi în spaţiile cu umiditate ridicată(83), ceea ce contribuie la o expunere perenă(84). Această specie de fungi este detectată în cereale şi în praful din ferme, astfel încât fermierii au un risc crescut pentru boli respiratorii ocupaţionale(85,86).
Alternaria alternata este una dintre principalele surse de alergene care afectează copiii şi adolescenţii cu rinită alergică şi astm(87-89). Sensibilizarea la A. alternata este recunoscută ca factor de risc atât pentru dezvoltarea şi persistenţa astmului, cât şi pentru severitatea şi exacerbările astmatice severe(51,83). Pacienţii sensibilizaţi la A. alternata au de asemenea risc să dezvolte forme severe de rinită alergică(51).
Componentele moleculare alergenice prezente în A. alternata:
-
Alt a 1 este alergenul major, care induce reacţie IgE-mediată la 80-100% dintre pacienţii alergici la acesta. Reacţia pozitivă la Alt a 1 indică faptul că sensibilizarea primară este la A. alternata(51). S-a descoperit recent că Alt a 1 este componenta alergenică implicată în sindromul Alternaria-spanac(90). Acesta se datorează unui tip de reactivitate încrucişată între aeroalergenele din Alternaria, alergenele alimentare din spanac şi ciupercile din specia Agaricus bisporus şi se datorează secvenţelor peptidice omoloage, care sunt recunoscute de anticorpii pacienţilor(42).
-
Au fost identificate şi caracterizate 11 alergene minore provenind de la A. alternata, dintre care 9 (Alt a 3, Alt a 5, Alt a 6, Alt a 7, Alt a 8, Alt a 10, Alt a 14, Alt a 15) induc reactivitate încrucişată cu alte specii de fungi provenind din genurile înrudite Cladosporium, Penicillium şi Aspergillus(83).
-
Alt a 6, o enolază, este un alergen minor, cu o rată de sensibilizare de 22%, care este inclus în setul de alergene utilizate pentru diagnosticarea moleculară a alergiei la A. alternata(91).
-
Alt a 14 este o mangan-superoxid dismutază şi un alergen minor recent identificat, care poate prezenta reactivitate încrucişată cu mangan-superoxid dismutaza de origine umană, proces care poate contribui la perpetuarea răspunsului inflamator în astm(83). În baza unor studii recente, se recomandă ca şi acest alergen să fie inclus în diagnosticarea moleculară a alergiei la A. alternata, alături de Alt a 1 şi Alt a 6(91).
Alergenele din Aspergillus fumigatus
Aspergillus fumigatus (Asp f) este o altă sursă importantă de spori, prezenţi atât la interior, cât şi la exterior. Expunerea la conidii şi micelii provenind de la A. fumigatus este perenă, fiind responsabilă pentru o serie de manifestări clinice, de la astm alergic, pneumonită de hipersensibilitate de tip „plămânul fermierului“ până la aspergiloză invazivă şi aspergilom. Complexitatea structurii antigenice a A. fumigatus şi răspunsurile imune variabile determină severitatea manifestărilor clinice(51). Unii autori estimează că între 15% şi 20% dintre cazurile de astm alergic se datorează sensibilizării la Aspergillus(92). De asemenea, A. fumigatus este agentul etiologic pentru cea mai întâlnită şi severă formă de micoză alergică bronhopulmonară, aspergiloza bronhopulmonară alergică (ABPA)(51).
Sensibilizarea la A. fumigatus nu este uşor identificabilă, acesta prezentând reactivitate încrucişată cu alte specii de fungi, ceea ce poate duce la rezultate nespecifice. De aceea, folosirea unor componente alergenice IgE-specifice pentru A. fumigatus poate ajuta la identificarea sensibilizării primare la A. fumigatus(51).
Procedura de rutină pentru diagnosticul ABPA presupune determinarea IgE specific la A. fumigatus. Componentele alergenice incluse în testul diagnostic ImmunoCAP pot diferenţia pacienţii care prezintă ABPA de cei sensibilizaţi doar la Aspergillus.
Componentele moleculare alergenice prezente în A. fumigatus:
-
Asp f 1, o ribotoxină, este o componentă alergenică majoră cu specificitate de specie şi o rată de sensibilizare de 83% la pacienţii cu ABPA.
-
Asp f 2 este o altă componentă cu specificitate de specie, care induce reacţie IgE‑specifică în 96% dintre cazurile clinice care manifestă ABPA.
-
Asp f 3 este o proteină peroxizomală cu o rată de sensibilizare de 88% pentru pacienţii cu ABPA şi de 52% pentru pacienţii alergici.
-
Asp f 4 induce reacţie IgE‑specifică în 96% dintre cazurile clinice care manifestă ABPA.
-
Asp f 6, o mangan superoxid dismutază, induce reacţie IgE‑specifică la 55% dintre pacienţii cu ABPA. Asp f 6 prezintă reactivitate încrucişată cu Alt a 14, alergen caracteristic A. alternata, şi cu mangan superoxid dismutaza de origine umană, proces care poate contribui la perpetuarea răspunsului inflamator în astm.
Componentele alergenice Asp f 2, Asp f 4 şi Asp f 6 pot fi folosite pentru a identifica exclusiv pacienţii cu ABPA, totuşi sunt necesare studii clinice pe cohorte mai mari pentru a confirma această asociere(51) (figura 3).

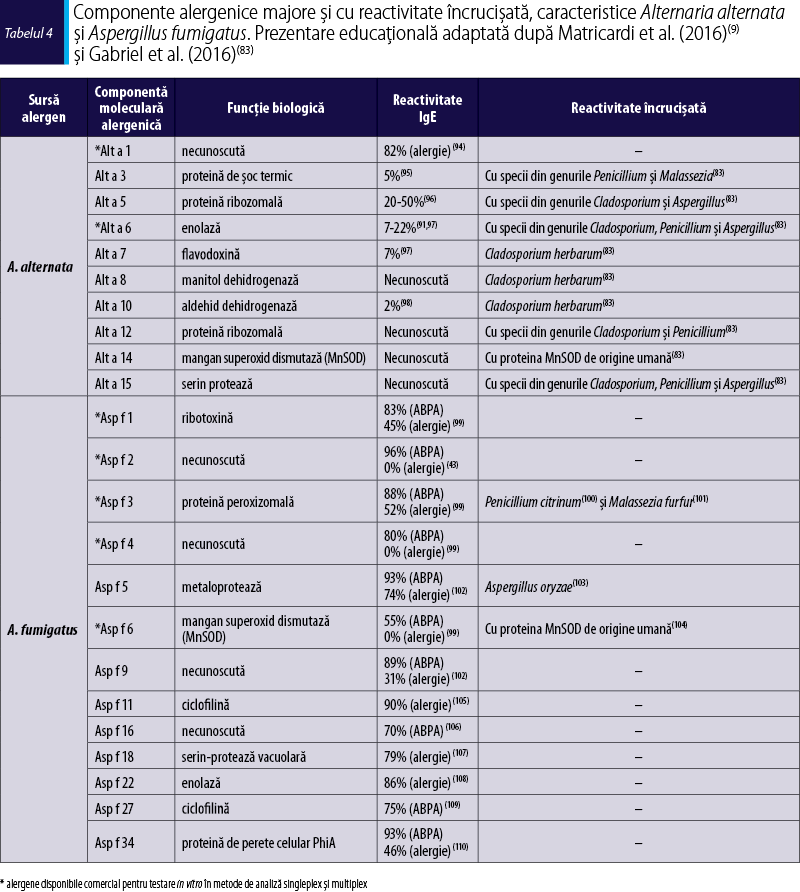
Principalele alergene caracteristice A. alternata şi A. fumigatus sunt prezentate în tabelul 4.
Concluzii
Identificarea anticorpilor IgE specifici faţă de componentele moleculare alergenice a îmbunătăţit semnificativ diagnosticul bolilor alergice. Diagnosticul molecular permite identificarea sensibilizării primare, diferenţierea între sensibilizare primară şi reactivitate încrucişată şi chiar evaluarea riscului de a dezvolta reacţii alergice severe din cauza particularităţilor unor componente alergenice (rezistenţă la pregătire termică a alimentelor şi digestie, capacitate de a induce anafilaxie). Este importantă şi cunoaşterea sindroamelor/asocierilor prin reactivitate încrucişată induse de alergenele de interior (sindrom porc-pisică, Alternaria-spanac, acarieni-crustacee) şi a componentelor alergenice implicate. Pacienţii sensibilizaţi la acarieni pot dezvolta reacţii alergice la alimente nevertebrate (crustacee, moluşte)(111). Pacienţii sensibilizaţi la epitelii de pisică pot semnala simptome alergice după consumul de carne de porc, ca urmare a reacţiei încrucişate a albuminelor. Pacienţii sensibilizaţi la epitelii de câine pot prezenta reactivitate încrucişată redusă cu carnea de porc şi mai ridicată cu componentele alergenice majore din epitelii de pisică(112). Rareori, un pacient alergic la mucegaiuri poate prezenta reacţie alergică după consumul de spanac, condiţie cunoscută drept sindromul Alternaria-spanac(90). Există reactivitate încrucişată între alergene din mucegaiuri şi alergene alimentare provenite din spanac şi ciuperci din genul Agaricus bisporus(42).
Imunoterapia alergenică este recomandată ca tratament specific în rinita alergică şi în astm, conform ghidurilor recente ARIA şi GINA, datorită faptului că, la momentul actual, este singura opţiune terapeutică disponibilă pentru a modifica evoluţia bolii alergice pe termen lung (ani), prin efectele de diminuare a răspunsului imun de tip IgE şi promovare a toleranţei imunologice nu doar faţă de alergenul vizat, ci şi ca mecanism de răspuns al organismului la alte potenţiale alergene. Pentru a selecta varianta imunoterapeutică optimă este necesar un diagnostic de precizie prin alergologia moleculară, cu identificarea sensibilizării primare şi distingerea între polisensibilizarea alergică determinată de reactivitatea încrucişată şi cosensibilizarea primară la alergene provenite din mai multe surse. Astfel, medicul alergolog are un rol foarte important în interpretarea corectă a rezultatelor diagnosticului molecular, cu identificarea relevanţei clinice a alergenelor, precum şi în administrarea şi monitorizarea imunoterapiei alergenice.
Acest articol a fost elaborat în cadrul proiectului INSPIRED (Innovative Strategies for Prevention, Diagnosis and Therapy of Ragweed Pollen Induced Respiratory Diseases), cod SMIS 103662.
Bibliografie
- Plaschke PP, Janson C, Norrman E, Bjornsson E, Ellbjar S, Jarvholm B. Onset and remission of allergic rhinitis and asthma and the relationship with atopic sensitization and smoking. Am J Respir Crit Care Med. 2000;162(3 I):920-924. doi:10.1164/ajrccm.162.3.9912030
- Belhassen M, Demoly P, Bloch-Morot E, et al. Costs of perennial allergic rhinitis and allergic asthma increase with severity and poor disease control. Allergy Eur J Allergy Clin Immunol. 2017;72(6):948-958. doi:10.1111/all.13098
- Ciprandi G, Cirillo I, Vizzaccaro A, et al. Seasonal and perennial allergic rhinitis: Is this classification adherent to real life? Allergy Eur J Allergy Clin Immunol. 2005;60(7):882-887. doi:10.1111/j.1398-9995.2005.00602.x
- Bousquet J, Khaltaev N, Cruz AA, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008;63 Suppl 8:8-160. doi:10.1111/j.1398-9995.2007.01620.x
- García B, Lizaso M. Cross-reactivity Syndromes in Food Allergy. J Investig Allergol Clin Immunol. 2011;21:162-170; quiz 2 p following 170.
- Portnoy J, Miller JD, Williams PB, et al. Environmental assessment and exposure control of dust mites: a practice parameter. Ann Allergy Asthma Immunol. 2013;111(6):465-507. doi:10.1016/j.anai.2013.09.018
- Calderón MA, Kleine-Tebbe J, Linneberg A, et al. House Dust Mite Respiratory Allergy: An Overview of Current Therapeutic Strategies. J Allergy Clin Immunol Pract. 2015;3(6):843-855. doi:10.1016/J.JAIP.2015.06.019
- Chua KY, Stewart GA, Thomas WR, et al. Sequence analysis of cdna coding for a major house dust mite allergen, Der p 1: Homology with cysteine proteases. J Exp Med. 1988. doi:10.1084/jem.167.1.175
- Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, et al. EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol. 2016;27(S23):1-250. doi:10.1111/pai.12563
- Canonica GW, Ansotegui IJ, Pawankar R, et al. A WAO – ARIA – GA2LEN consensus document on molecular-based allergy diagnostics. World Allergy Organ J. 2013;6(1):1-17. doi:10.1186/1939-4551-6-17
- Kleine-Tebbe J, Jakob T. Molecular Allergy Diagnostics: Innovation for a Better Patient Management.; 2017. doi:10.1007/978-3-319-42499-6
- Nolte H, Plunkett G, Grosch K, Larsen JN, Lund K, Bollen M. Major allergen content consistency of SQ house dust mite sublingual immunotherapy tablets and relevance across geographic regions. Ann Allergy, Asthma Immunol. 2016;117(3):298-303. doi:10.1016/J.ANAI.2016.07.004
- Hewitt CRA, Brown AP, Hart BJ, Pritchard DI. A major house dust mite allergen disrupts the immunoglobulin E network by selectively cleaving CD23: Innate protection by antiproteases. J Exp Med. 1995. doi:10.1084/jem.182.5.1537
- Reithofer M, Jahn-Schmid B. Allergens with protease activity from house dust mites. Int J Mol Sci. 2017. doi:10.3390/ijms18071368
- Weghofer M, Grote M, Resch Y, et al. Identification of Der p 23, a Peritrophin-like Protein, as a New Major Dermatophagoides pteronyssinus Allergen Associated with the Peritrophic Matrix of Mite Fecal Pellets. J Immunol. 2013;190(7):3059 LP – 3067. doi:10.4049/jimmunol.1202288
- Becker S, Schlederer T, Kramer MF, et al. Real-Life Study for the Diagnosis of House Dust Mite Allergy – The Value of Recombinant Allergen-Based IgE Serology. Int Arch Allergy Immunol. 2016;170(2):132-137. doi:10.1159/000447694
- Mueller GA, Randall TA, Glesner J, et al. Serological, genomic and structural analyses of the major mite allergen Der p 23. Clin Exp Allergy. 2016;46(2):365-376. doi:10.1111/cea.12680
- Resch Y, Michel S, Kabesch M, Lupinek C, Valenta R, Vrtala S. Different IgE recognition of mite allergen components in asthmatic and nonasthmatic children.
- J Allergy Clin Immunol. 2015;136(4):1083-1091. doi:10.1016/J.JACI.2015.03.024Posa D, Perna S, Resch Y, et al. Evolution and predictive value of IgE responses toward a comprehensive panel of house dust mite allergens during the first 2 decades of life. J Allergy Clin Immunol. 2017;139(2):541-549.e8. doi:10.1016/J.JACI.2016.08.014
- Casset A, Mari A, Purohit A, et al. Varying Allergen Composition and Content Affects the in vivo Allergenic Activity of Commercial Dermatophagoides pteronyssinus Extracts. Int Arch Allergy Immunol. 2012;159(3):253-262. doi:10.1159/000337654
- Thomas WR, Smith W-A, Hales BJ, Mills KL, O’Brien RM. Characterization and immunobiology of house dust mite allergens. Int Arch Allergy Immunol. 2002;129(1):1-18.
- Thomas WR, Smith WA, Hales BJ. The allergenic specificities of the house dust mite. Chang Gung Med J. 2004;27(8):563-569.
- Mills K, Thomas WR, Smith W. Characterisation of the Group 4 Allergens from the House Dust Mite. University of Western Australia; 2002.
- Lake FR, Ward LD, Simpson RJ, Thompson PJ, Stewart GA. House dust mite-derived amylase: Allergenicity and physicochemical characterization. J Allergy Clin Immunol. 1991;87(6):1035-1042. doi:10.1016/0091-6749(91)92147-S
- Sánchez-Borges M, González-Aveledo L, Capriles-Hulett A, Caballero-Fonseca F. Scabies, crusted (Norwegian) scabies and the diagnosis of mite sensitisation. Allergol Immunopathol (Madr). 2018;46(3):276-280. doi:10.1016/j.aller.2017.05.006
- Chen K-W, Zieglmayer P, Zieglmayer R, et al. Selection of house dust mite–allergic patients by molecular diagnosis may enhance success of specific immunotherapy.J Allergy Clin Immunol. 2019;143(3):1248-1252.e12. doi:10.1016/J.JACI.2018.10.048
- Shen HD, Chua KY, Lin WL, Hsieh KH, Thomas WR. Characterization of the house dust mite allergen Der p 7 by monoclonal antibodies. Clin Exp Allergy. 1995;25(5):416-422. doi:10.1111/j.1365-2222.1995.tb01072.x
- Lin K-L, Hsieh K-H, Thomas WR, Chiang B-L, Chua K-Y. Characterization of Der p V allergen, cDNA analysis, and IgE-mediated reactivity to the recombinant protein.J Allergy Clin Immunol. 1994;94(6):989-996.
- Yasueda H, Mita H, Akiyama K, et al. Allergens from Dermatophagoides mites with chymotryptic activity. Clin Exp Allergy. 1993;23(5):384-390.
- Bennett BJ, Thomas WR. Cloning and sequencing of the group 6 allergen of Dermatophagoides pteronyssinus. Clin Exp Allergy. 1996;26(10):1150-1154.
- Kinga C, Simpsonc RJ, Moritzc RL, Reedc GE, Thompsond PJ, Stewarta GA. The isolation and characterization of a novel collagenolytic serine protease allergen (Der p 9) from the dust mite Dermatophagoides pteronyssinus. J Allergy Clin Immunol. 1996;98(4):739-747.
- Shen H, Lin W, TSAI L, et al. Characterization of the allergen Der f 7 from house dust mite extracts by species‐specific and crossreactive monoclonal antibodies. Clin Exp Allergy. 1997;27(7):824-832.
- Shen H, Chua K, Lin K, Hsieh K, Thomas WR. Molecular cloning of a house dust mite allergen with common antibody binding specificities with multiple components in mite extracts. Clin Exp Allergy. 1993;23(11):934-940.
- Shen H, Chua KY, Lin WL, Chen HL, Hsieh K, Thomas WR. IgE and monoclonal antibody binding by the mite allergen Der p 7. Clin Exp Allergy. 1996;26(3):308-315.
- Huang CH, Liew LM, Mah KW, Kuo IC, Lee BW, Chua KY. Characterization of glutathione S-transferase from dust mite, Der p 8 and its immunoglobulin E cross-reactivity with cockroach glutathione S-transferase. Clin Exp Allergy. 2006;36(3):369-376. doi:10.1111/j.1365-2222.2006.02447.x
- Dougall A, Holt DC, Fischer K, Currie BJ, Kemp DJ, Walton SF. Identification and characterization of Sarcoptes scabiei and Dermatophagoides pteronyssinus glutathione S-transferases: implication as a potential major allergen in crusted scabies. Am J Trop Med Hyg. 2005;73(5):977-984.
- Acevedo N, Mohr J, Zakzuk J, et al. Proteomic and immunochemical characterization of glutathione transferase as a new allergen of the nematode Ascaris lumbricoides. PLoS One. 2013;8(11):e78353-e78353. doi:10.1371/journal.pone.0078353
- Mueller GA, Pedersen LC, Glesner J, et al. Analysis of glutathione S-transferase allergen cross-reactivity in a North American population: Relevance for molecular diagnosis. J Allergy Clin Immunol. 2015;136(5):1369-1377. doi:10.1016/j.jaci.2015.03.015
- Acevedo N, Caraballo L. IgE cross-reactivity between Ascaris lumbricoides and mite allergens: Possible influences on allergic sensitization and asthma. Parasite Immunol. 2011;33(6):309-321. doi:10.1111/j.1365-3024.2011.01288.x
- Ree R, Antonicelli L, Akkerdaas JH, et al. Asthma after consumption of snails in house-dust-mite-allergic patients: a case of IgE cross-reactivity. Allergy. 1996;51(6):387-393. doi:10.1111/j.1398-9995.1996.tb04635.x
- Ferreira F, Hawranek T, Gruber P, Wopfner N, Mari A. Allergic cross-reactivity: from gene to the clinic. Allergy. 2004;59(3):243-267. doi:10.1046/j.1398-9995.2003.00407.x
- Popescu F-D. Cross-reactivity between aeroallergens and food allergens. World J Methodol. 2017;5(2):31. doi:10.5662/wjm.v5.i2.31
- Banerjee B, Greenberger PA, Fink JN, Kurup VP. Immunological characterization of Asp f 2, a major allergen from Aspergillus fumigatus associated with allergic bronchopulmonary aspergillosis. Infect Immun. 1998;66(11):5175-5182.
- Weghofer M, Dall’Antonia Y, Grote M, et al. Characterization of Der p 21, a new important allergen derived from the gut of house dust mites. Allergy. 2008;63(6):758-767.
- https://en.wikipedia.org/.
- Arasi S, Porcaro F, Cutrera R, Fiocchi AG. Severe Asthma and Allergy: A Pediatric Perspective. Front Pediatr. 2019;7:28. doi:10.3389/fped.2019.00028
- Thomas WR. House Dust Mite Allergens: New Discoveries and Relevance to the Allergic Patient. Curr Allergy Asthma Rep. 2016;16(9). doi:10.1007/s11882-016-0649-y
- Asero R. Component-resolved diagnosis-assisted prescription of allergen-specific immunotherapy: A practical guide. Eur Ann Allergy Clin Immunol. 2012;44(5):183-187.
- Schmid-Grendelmeier P. Rekombinante Allergene: Routinediagnostik oder Wissenschaft? Hautarzt. 2010;61(11):946-953. doi:10.1007/s00105-010-1967-y
- Shafique RH, Inam M, Ismail M, Chaudhary FR. Group 10 allergens (tropomyosins) from house-dust mites may cause covariation of sensitization to allergens from other invertebrates. Allergy Rhinol. 2013;3(2):74-90. doi:10.2500/ar.2012.3.0036
- Bradshaw N. Part2. The allergen components. In: Go Molecular! A Clinical Reference Guide to Molecular Allergy. ThermoFisherScientific; 2018.
- Perzanowski MS, Rönmark E, Platts-Mills TAE, Lundbäck B. Effect of cat and dog ownership on sensitization and development of asthma among preteenage children. Am J Respir Crit Care Med. 2002;166(5):696-702.
- Remes ST, Castro-Rodriguez JA, Holberg CJ, Martinez FD, Wright AL, Remes ST. Dog exposure in infancy decreases the subsequent risk of frequent wheeze but not of atopy. J Allergy Clin Immunol. 2001. doi:10.1067/mai.2001.117797
- Wahn U, Lau S, Bergmann R, et al. Indoor allergen exposure is a risk factor for sensitization during the first three years of life. J Allergy Clin Immunol. 1997. doi:10.1016/S0091-6749(97)80009-7
- Ownby DR, Johnson CC, Peterson EL. Exposure to dogs and cats in the first year of life and risk of allergic sensitization at 6 to 7 years of age. J Am Med Assoc. 2002. doi:10.1001/jama.288.8.963
- Hesselmar B, Åberg N, Åberg B, Eriksson B, Björkstén B. Does early exposure to cat or dog protect against later allergy development? Clin Exp Allergy. 1999. doi:10.1046/j.1365-2222.1999.00534.x
- Custovic A, Hallam CL, Simpson BM, Craven M, Simpson A, Woodcock A. Decreased prevalence of sensitization to cats with high exposure to cat allergen. J Allergy Clin Immunol. 2001. doi:10.1067/mai.2001.118599
- Mandhane PJ, Sears MR, Poulton R, et al. Cats and dogs and the risk of atopy in childhood and adulthood. J Allergy Clin Immunol. 2009;124(4):745-50.e4. doi:10.1016/j.jaci.2009.06.038
- Almqvist C, Egmar AC, Van Hage-Hamsten M, et al. Heredity, pet ownership, and confounding control in a population-based birth cohort. J Allergy Clin Immunol. 2003. doi:10.1067/mai.2003.1334
- Custovic A, Simpson BM, Simpson A, et al. Current mite, cat, and dog allergen exposure, pet ownership, and sensitization to inhalant allergens in adults. J Allergy Clin Immunol. 2003. doi:10.1067/mai.2003.55
- Chan SK, Leung DYM. Dog and cat allergies: Current state of diagnostic approaches and challenges. Allergy, Asthma Immunol Res. 2018. doi:10.4168/aair.2018.10.2.97
- Matricardi PM, Kleine‐Tebbe J, Hoffmann HJ, et al. EAACI molecular allergology user’s guide. Pediatr Allergy Immunol. 2016;27:1-250.
- Butt A, Rashid D, Lockey RF. Do hypoallergenic cats and dogs exist? Ann Allergy, Asthma Immunol. 2012. doi:10.1016/j.anai.2011.12.005
- de Groot H, van Swieten P, van Leeuwen J, Lind P, Aalberse RC. Monoclonal antibodies to the major feline allergen Fel d I: I. Serologic and biologic activity of affinity-purified Fel d I and of Fel d I-depleted extract. J Allergy Clin Immunol. 1988;82(5, Part 1):778-786. doi:https://doi.org/10.1016/0091-6749(88)90079-6
- Charpin C, Zielonka TM, Charpin D, ANSALDI J, Allasia C, Vervloet D. Effects of castration and testosterone on Fel d I production by sebaceous glands of male cats: II—morphometric assessment. Clin Exp Allergy. 1994;24(12):1174-1178.
- Hilger C, Grigioni F, Hentges F. Sequence of the gene encoding cat (Felis domesticus) serum albumin. Gene. 1996;169(2):295-296. doi:https://doi.org/10.1016/0378-1119(95)00851-9
- Wallenbeck I, Einarsson R. Identification of dander-specific and serum-specific allergens in cat dandruff extract. Ann Allergy. 1987;59(2):131-134.
- Ichikawa K, Vailes LD, Pomes A, Chapman MD. Identification of a novel cat allergen--cystatin. Int Arch Allergy Immunol. 2001;124(1-3):55-56. doi:10.1159/000053667
- Smith W, Butler AJL, Hazell LA, et al. Fel d 4, a cat lipocalin allergen. Clin Exp Allergy. 2004;34(11):1732-1738. doi:10.1111/j.1365-2222.2004.02090.x
- Zahradnik E, Raulf M. Respiratory Allergens from Furred Mammals: Environmental and Occupational Exposure. Vet Sci. 2017;4(3). doi:10.3390/vetsci4030038
- Brehm K, Plock K, Doepp M, Baier H. [Antigenicity of serum albumin in allergy against cat or dog epithelium (significance of the radioallergosorbens test in the diagnosis of allergies)]. Dtsch Med Wochenschr. 1975;100(10):472-476. doi:10.1055/s-0028-1106240
- FORD AW, ALTERMAN L, KEMENY DM. The allergens of dog. I. Identification using crossed radio-immunoelectrophoresis. Clin Exp Allergy. 1989;19(2):183-190. doi:10.1111/j.1365-2222.1989.tb02362.x
- Vredegoor DW, Willemse T, Chapman MD, Heederik DJJ, Krop EJM. Can f 1 levels in hair and homes of different dog twbreeds: Lack of evidence to describe any dog breed as hypoallergenictw. J Allergy Clin Immunol. 2012. doi:10.1016/j.jaci.2012.05.013
- Schoos A-MM, Bønnelykke K, Chawes BL, Stokholm J, Bisgaard H, Kristensen B. Precision allergy: Separate allergies to male and female dogs. J Allergy Clin Immunol Pract. 2017;5(6):1754-1756.
- Basagaña M, Bartolome B, Pastor-Vargas C, Mattsson L, Lidholm J, Labrador-Horrillo M. Involvement of Can f 5 in a case of human seminal plasma allergy. Int Arch Allergy Immunol. 2012;159(2):143-146.
- Virtanen T. Immunotherapy for pet allergies. Hum Vaccines Immunother. 2018. doi:10.1080/21645515.2017.1409315
- Asarnoj A, Hamsten C, Wadén K, et al. Sensitization to cat and dog allergen molecules in childhood and prediction of symptoms of cat and dog allergy in adolescence: a BAMSE/MeDALL study. J Allergy Clin Immunol. 2016;137(3):813-821.
- Wisniewski JA, Agrawal R, Minnicozzi S, et al. Sensitization to food and inhalant allergens in relation to age and wheeze among children with atopic dermatitis: Clinical Mechanisms in Allergic Disease. Clin Exp Allergy. 2013;43(10):1160-1170.
- Hilger C, Kohnen M, Grigioni F, Lehners C, Hentges F. Allergic cross‐reactions between cat and pig serum albumin: Study at the protein and DNA levels. Allergy. 1997;52(2):179-187.
- Canonica GW, Ansotegui IJ, Pawankar R, et al. A WAO – ARIA – GA2LEN consensus document on molecular-based allergy diagnostics. World Allergy Organ J. 2013;6(1):17. doi:10.1186/1939-4551-6-17
- Byeon JH, Ri S, Amarsaikhan O, et al. Association Between Sensitization to Mold and Impaired Pulmonary Function in Children With Asthma. Allergy Asthma Immunol Res. 2017;9(6):509-516. doi:10.4168/aair.2017.9.6.509
- Weber RW. Alternaria alternata. Ann Allergy Asthma Immunol. 2001.
- Gabriel MF, Postigo I, Tomaz CT, Martinez J. Alternaria alternata allergens: Markers of exposure, phylogeny and risk of fungi-induced respiratory allergy. Environ Int. 2016;89-90:71-80. doi:10.1016/j.envint.2016.01.003
- Salo PM, Arbes Jr SJ, Sever M, et al. Exposure to Alternaria alternata in US homes is associated with asthma symptoms. J Allergy Clin Immunol. 2006;118(4):892-898. doi:10.1016/j.jaci.2006.07.037
- Prester L, Macan J. Determination of Alt a 1 (Alternaria alternata) in poultry farms and a sawmill using ELISA. Med Mycol. 2010;48(2):298-302. doi:10.1080/13693780903115402
- Pulimood TB, Corden JM, Bryden C, Sharples L, Nasser SM. Epidemic asthma and the role of the fungal mold Alternaria alternata. J Allergy Clin Immunol. 2007;120(3):610-617. doi:10.1016/j.jaci.2007.04.045
- Mari A, Schneider P, Wally V, Breitenbach M, Simon-Nobbe B. Sensitization to fungi: epidemiology, comparative skin tests, and IgE reactivity of fungal extracts. Clin Exp Allergy. 2003;33(10):1429-1438. doi:10.1046/j.1365-2222.2003.01783.x
- Katotomichelakis M, Anastassakis K, Gouveris H, et al. Clinical significance of Alternaria alternata sensitization in patients with allergic rhinitis. Am J Otolaryngol. 2012;33(2):232-238. doi:https://doi.org/10.1016/j.amjoto.2011.07.004
- Perzanowski MS, Sporik R, Squillace SP, et al. Association of sensitization to Alternaria allergens with asthma among school-age children. J Allergy Clin Immunol. 1998;101(5):626-632. doi:10.1016/S0091-6749(98)70170-8
- Melioli G, Spenser C, Reggiardo G, et al. Allergenius, an expert system for the interpretation of allergen microarray results. World Allergy Organ J. 2014;7(1):15. doi:10.1186/1939-4551-7-15
- Postigo I, Gutiérrez-Rodríguez A, Fernández J, Guisantes JA, Suñŕn E, Martínez J. Diagnostic value of Alt a 1, fungal enolase and manganese-dependent superoxide dismutase in the component-resolved diagnosis of allergy to pleosporaceae. Clin Exp Allergy. 2011. doi:10.1111/j.1365-2222.2010.03671.x
- Harris Steinman. Asp f 1 Aspergillus fumigatus. http://www.phadia.com/en/Products/Allergy-testing-products/ImmunoCAP-Allergen-Information/Molds-and-other-Microorganisms/Allergen-Components/rAsp-f-1-Aspergillus-fumigatus/.
- Kespohl S, Raulf MA. Mould allergens: Where do we stand with molecular allergy diagnostics? Part 13 of the series Molecular Allergology. Allergo J. 2014. doi:10.1007/s40629-014-0014-4
- De Vouge MW, Thaker AJ, Curran IH, et al. Isolation and expression of a cDNA clone encoding an Alternaria alternata Alt a 1 subunit. Int Arch Allergy Immunol. 1996;111(4):385-395. doi:10.1159/000237397
- De Vouge MW, Thaker AJ, Zhang L, Muradia G, Rode H, Vijay HM. Molecular cloning of IgE-binding fragments of Alternaria alternata allergens. Int Arch Allergy Immunol. 1998;116(4):261-268. doi:10.1159/000023954
- Breitenbach M, Simon-Nobbe B. The allergens of Cladosporium herbarum and Alternaria alternata. Chem Immunol. 2002;81:48-72. doi:10.1159/000058862
- Achatz G, Oberkofler H, Lechenauer E, et al. Molecular cloning of major and minor allergens of Alternaria alternata and Cladosporium herbarum. Mol Immunol. 1995. doi:10.1016/0161-5890(94)00108-D
- Sanchez H, Bush RK. A review of Alternaria alternata sensitivity. Rev Iberoam Micol. 2001.
- Crameri R, Hemmann S, Ismail C, Menz G, Blaser K. Disease-specific recombinant allergens for the diagnosis of allergic bronchopulmonary aspergillosis. Int Immunol. 1998;10(8):1211-1216. doi:10.1093/intimm/10.8.1211
- Shen HD, Wang CW, Chou H, et al. Complementary DNA cloning and immunologic characterization of a new Penicillium citrinum allergen (Pen c 3). J Allergy Clin Immunol. 2000;105(4):827-833. doi:10.1067/mai.2000.105220
- Lindborg M, Magnusson CG, Zargari A, et al. Selective cloning of allergens from the skin colonizing yeast Malassezia furfur by phage surface display technology. J Invest Dermatol. 1999;113(2):156-161. doi:10.1046/j.1523-1747.1999.00661.x
- Crameri R. Recombinant Aspergillus fumigatus allergens: from the nucleotide sequences to clinical applications. Int Arch Allergy Immunol. 1998;115(2):99-114. doi:10.1159/000023889
- Bowyer P, Fraczek M, Denning DW. Comparative genomics of fungal allergens and epitopes shows widespread distribution of closely related allergen and epitope orthologues. BMC Genomics. 2006. doi:10.1186/1471-2164-7-251
- Fluckiger S, Scapozza L, Mayer C, Blaser K, Folkers G, Crameri R. Immunological and structural analysis of IgE-mediated cross-reactivity between manganese superoxide dismutases. Int Arch Allergy Immunol. 2002;128(4):292-303. doi:10.1159/000063862
- Fluckiger S, Fijten H, Whitley P, Blaser K, Crameri R. Cyclophilins, a new family of cross-reactive allergens. Eur J Immunol. 2002;32(1):10-17. doi:10.1002/1521-4141(200201)32:1<10::AID-IMMU10>3.0.CO;2-I
- Banerjee B, Kurup VP, Greenberger PA, Johnson BD, Fink JN. Cloning and expression of Aspergillus fumigatus allergen Asp f 16 mediating both humoral and cell-mediated immunity in allergic bronchopulmonary aspergillosis (ABPA). Clin Exp Allergy. 2001. doi:10.1046/j.1365-2222.2001.01076.x
- Shen HD, Lin WL, Tam MF, et al. Identification of vacuolar serine proteinase as a major allergen of Aspergillus fumigatus by immunoblotting and N-terminal amino acid sequence analysis. Clin Exp Allergy. 2001. doi:10.1046/j.1365-2222.2001.01026.x
- Lai HY, Tam MF, Tang R Bin, et al. cDNA cloning and immunological characterization of a newly identified enolase allergen from Penicillium citrinum and Aspergillus fumigatus. Int Arch Allergy Immunol. 2002. doi:10.1159/000053862
- Glaser AG, Limacher A, Flückiger S, Scheynius A, Scapozza L, Crameri R. Analysis of the cross-reactivity and of the 1.5 Å crystal structure of the Malassezia sympodialis Mala s 6 allergen, a member of the cyclophilin pan-allergen family. Biochem J. 2006. doi:10.1042/BJ20051708
- Glaser AG, Kirsch AI, Zeller S, Menz G, Rhyner C, Crameri R. Molecular and immunological characterization of Asp f 34, a novel major cell wall allergen of Aspergillus fumigatus. Allergy Eur J Allergy Clin Immunol. 2009. doi:10.1111/j.1398-9995.2009.02029.x
- Bessot JC, Metz-Favre C, Rame JM, De Blay F, Pauli G. Tropomyosin or not tropomyosin, what is the relevant allergen in house dust mite and snail cross allergies? Eur Ann Allergy Clin Immunol. 2010;42(1):3-10.
- Mamikoglu B. Beef, Pork, and Milk Allergy (Cross Reactivity with Each Other and Pet Allergies). Otolaryngol Neck Surg. 2005;133(4):534-537. doi:10.1016/j.otohns.2005.07.016
Articole din ediţiile anterioare
Noi direcţii în imunoterapia alergenică
Este cunoscut faptul că imunoterapia alergenică (AIT) este singurul tratament care poate modifica evoluţia bolii alergice şi poate conferi toleranţ...
Reacţii de hipersensibilitate induse de sulfonamide nonantibiotice – prezentare de caz clinic
Această lucrare aduce în prim-plan, pornind de la prezentarea de caz a unei paciente, reacţiile de hipersensibilitate la sulfonamidele nonantibioti...
Abordarea diagnostică moleculară în aspergiloza bronhopulmonară alergică
Aspergiloza bronhopulmonară alergică (ABPA) este o afecţiune care apare la pacienţi cu astm sau fibroză chistică şi care prezintă teste cutanate de...
Alergia la ou. Diagnostic în alergia de tip imediat şi tardiv
Conform definiţiei EAACI, alergia la alimente este o reacţie adversă cu mecanisme imunologice mediate de anticorpi specifici de tip imunoglobulină ...