Parallel to the increasing use of non-β-lactam antibiotics (NBLA), allergic reactions to this drug group also increase. Data about NBLA hypersensitivity in children are limited. The incidence of induced ANBL hypersensitivity reactions is estimated to be 1-3% in the general population, in children beeing most commonly induced by sulfonamides and macrolides. From a clinical point of view, the reactions cover a broad spectrum, ranging from mild eruptions to severe, and sometimes fatal, systemic drug reactions. The diagnosis reliee upon medical history and remainess unconfirmed by allergological tests in most cases. The precise diagnosis is difficult, because the in vivo and in vitro tests for NBLAs are not validated. The gold standard for a definitive diagnosis of NBLA hypersensitivity is drug provocation test. A standardized diagnostic approach should be developed for pediatric patients in the evaluation of suspected hypersensitivity to NBLA.
Diagnosticul reacţiilor de hipersensibilitate la antibiotice non-betalactamice la copii
Diagnosis of hypersensitivity reactions to non‑betalactam antibiotics in children
First published: 15 mai 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.2.2.2018.1689
Abstract
Rezumat
Odată cu creşterea utilizării antibioticelor non-betalactamice (ANBL), creşte şi frecvenţa reacţiilor alergice la acest grup de medicamente. Datele despre reacţiile de hipersensibilitate la ANBL la copii sunt limitate. Incidenţa reacţiilor de hipersensibilitate induse de ANBL este estimată la 1-3% în populaţia generală, la copii cel mai frecvent fiind induse de sulfonamide şi macrolide. Din punct de vedere clinic, reacţiile acoperă un spectru larg, de la erupţii uşoare la forme severe, sistemice, uneori chiar fatale. Diagnosticul se bazează adeseori pe istoricul clinic şi de multe ori lipseşte confirmarea prin teste alergologice. Standardul de aur pentru diagnosticul de precizie rămâne testul de provocare la medicamente. Este nevoie de o abordare standardizată a diagnosticului reacţiilor de hipersensibilitate la ANBL la copil.
Reacţiile de hipersensibilitate induse de antibioticele non-betalactamice (ANBL) la copii acoperă un spectru larg de forme clinice, de la rash-uri uşoare până la reacţii severe, imediate sau tardive. Incidenţa reacţiilor de hipersensibilitate induse de ANBL este estimată la 1-3% în populaţia generală, la copii cel mai frecvent fiind induse de sulfonamide şi macrolide, mai rar de chinolone şi tetracicline(1).
Diagnosticul reacţiilor de hipersensibilitate la ANBL
Istoricul detaliat al reacţiei şi examenul clinic atent pot ajuta la încadrarea reacţiei de hipersensibilitate într-o categorie de mecanisme posibile (reacţii imediate IgE-mediate, reacţii de tip II mediate de imunoglobuline G sau M, reacţii de tip III mediate de complexe imune, de tip IV mediate celular sau reacţii non-imune).
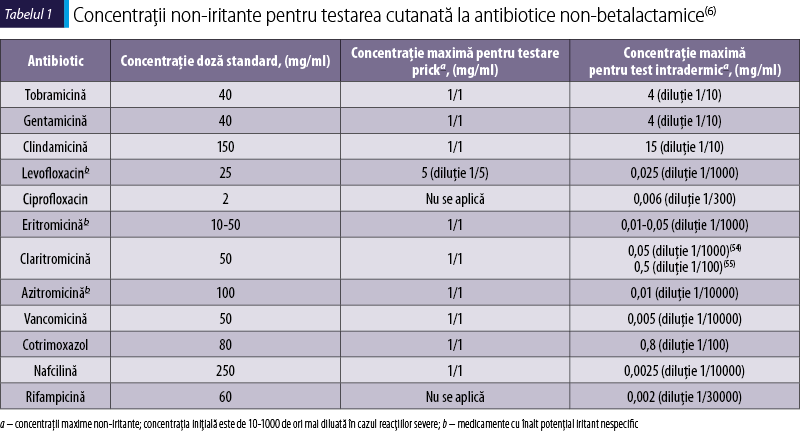
Pentru reacţiile imediate care ar putea fi IgE‑mediate, este recomandată testarea prick şi intradermică, cu concentraţii standardizate, în timp ce determinarea IgE specifice şi testul de activare a bazofilului sunt considerate experimentale pentru ANBL(2,3). Concentraţii non-iritante au fost propuse pentru unele antibiotice non-betalactamice, dar nu au fost foarte bine studiate şi la copil (tabelul 1). Un test pozitiv confirmă reacţia de hipersensibilitate, ceea ce conduce fie la utilizarea unui antibiotic care nu reacţionează încrucişat, fie la aplicarea unui protocol de desensibilizare, exceptând cazul în care istoricul reacţiei este unul de severitate, de tip sindrom Stevens-Johnson (SJS), necroliză epidermică toxică (TEN), reacţii medicamentoase cu eozinofilie şi simptome sistemice (DRESS), reacţie hematologică sau autoimună(3,4). Un test negativ nu exclude o reacţie de hipersensibilitate. Pentru diagnosticul reacţiilor tardive se pot utiliza testele patch, dacă istoricul reacţiei de hipersensibilitate nu este unul de severitate (SJS, TEN sau sindrom DRESS)(2,5). Testele cutanate nu sunt de folos în cazul reacţiilor de tip II sau III, iar testele de transformare limfoblastică sau activarea limfocitară prin citometrie de flux nu sunt validate ca teste diagnostice, ceea ce face dificil diagnosticul de precizie al reacţiilor de hipersensibilitate induse de medicamente(2,5).
Sulfamidele
Antibioticele sulfonamide (tabelul 2) fac parte din categoria sulfonil arilamine şi conţin gruparea sulfonamidă (SO2NH2) legată de un inel benzenic. Antibioticul cel mai frecvent folosit este combinaţia trimetoprim-sulfametoxazol (TMP-SMX). Spectrul clinic al reacţiilor de hipersensibilitate induse de sulfamide este extins: erupţii maculopapulare, eritem polimorf, SJS, TEN, erupţii fixe medicamentoase, febră, urticarie, angioedem, anafilaxie, pustuloză acută exantematoasă, reacţii tip boala serului, dermatită exfoliativă, discrazii sangvine, miocardită alergică, vasculită tip periarterită nodoasă, reacţii de fotosensibilitate, sindrom DRESS.
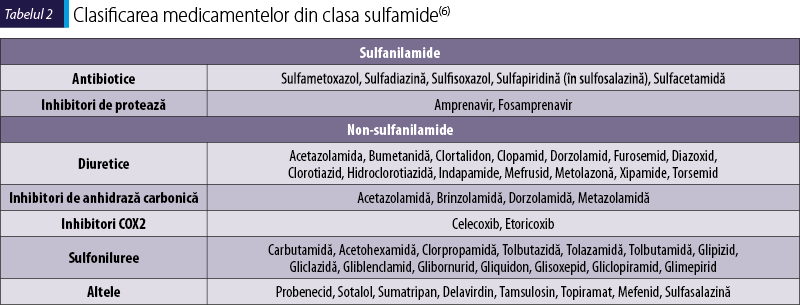
Reacţiile de hipersensibilitate cele mai frecvente sunt reacţii tardive mediate de limfocitele T, de tipul rash maculopapular sau erupţii fixe induse medicamentos, însă trebuie menţionat că riscul de SJS/TEN este mai mare pentru antibioticele sulfamidice decât pentru alte antibiotice(7). Un studiu multicentric european a arătat că antibioticele sulfonamidice reprezintă una din cele patru clase de medicamente asociate cel mai frecvent cu reacţii de tip SJS/TEN la copiii sub 15 ani(8). Sulfonamidele sunt responsabile de declanşarea rash-ului maculopapular mai frecvent decât alte clase de antibiotice, iar frecvenţa erupţiilor este mult mai mare la pacienţii infectaţi cu HIV care au număr scăzut de limfocite T CD4+(9). S-a raportat că 15% dintre copiii infectaţi cu HIV care primesc TMP-SMX dezvoltă reacţii de hipersensibilitate, unele chiar severe(10), dar, pe de altă parte, tratamentul pe termen lung al infecţiei cu HIV cu medicaţie antiretrovirală poate ajuta la inducerea toleranţei la sulfonamide(4). Dată fiind structura chimică diferită, reactivitatea încrucişată nu este teoretic prezentă şi există studii care atestă lipsa reacţiilor încrucişate clinice între antibiotice şi non-antibiotice sulfamidice(11,12). Date recente sugerează însă că pacienţii care au avut o reacţie de hipersensibilitate indusă de sulfametoxazol trebuie să evite şi sulfasalazina, la fel amprenavirul şi fosamprenavirul, doi inhibitori ai proteazei folosiţi în tratamentul infecţiei cu HIV. De asemenea, chiar dacă nu s-a demonstrat reactivitatea încrucişată in vivo sau in vitro, există autori care recomandă evitarea tuturor medicamentelor sulfonamidice în cazul unui istoric de reacţie severă la un antibiotic sulfamidic(13).
Diagnosticul reacţiilor induse de sulfamide este sugerat de mecanismul posibil al reacţiilor. În cazul reacţiilor imediate sunt recomandate testele prick şi intradermice, folosind o concentraţie de maximum 0,8 mg/ml descrisă ca non-iritativă pentru sulfametoxazol(6,14). Testele patch sau citirea tardivă a testelor intradermice (24, 48, 72 de ore) sunt considerate de folos în înlăturarea riscului de reacţie indus de reexpunerea la medicament. În cazul reacţiilor de tip eritem fix, testul patch trebuie aplicat pe zona de erupţie. Autori diferiţi recomandă concentraţii diferite pentru testarea patch la cotrimoxazol, sensibilitatea testului fiind scăzută, dar specificitatea este bună. Valoarea diagnostică a testelor de transformare limfocitară este încă neconfirmată, aşa încât testele de provocare rămân standardul de aur pentru diagnosticul de precizie şi se pot efectua dacă testele cutanate şi cele in vitro au fost negative, iar istoricul reacţiei nu a relevat o formă clinică severă(6).
Macrolidele
Se subîmpart în patru categorii, în funcţie de numărul de atomi conţinuţi în inelul lactonic: metimicină, picromicină (12 atomi), eritromicină, troleandomicină, roxitromicină, diritromicină, claritromicină (14 atomi), azitromicină (15 atomi), spiramicină, josamicină, midecamicină (16 atomi)(15). Macrolidele se leagă reversibil la subunităţi ribozomale bacteriene şi au molecule prea mici pentru a fi imunogenice. Nu se ştie dacă au capacitatea de a hapteniza anumite proteine serice şi în general se consideră că reacţiile de hipersensibilitate induse de macrolide sunt rare. Reacţiile raportate de părinţi în populaţia pediatrică variază între 0,07% şi 0,7%(1). Deşi formele clinice ale reacţiilor de hipersensibilitate care au fost asociate macrolidelor variază de la manifestări uşoare la manifestări severe, imediate sau tardive (urticarie, angioedem, erupţii maculopapulare, erupţii fixe medicamentoase, dermatită de contact, SJS, TEN, reacţii de fotosensibilitate, anafilaxie, pustuloză acută exantematoasă, hepatită, vasculită, DRESS), cel mai frecvent reacţiile sunt uşoare. Incidenţa anafilaxiei la claritromicină în populaţia pediatrică este extrem de mică (1/1 milion)(16), însă macrolidele au fost raportate ca una dintre cele mai frecvente cauze de SJS/TEN în populaţia pediatrică(17). Datele privind utilitatea testelor cutanate sunt conflictuale, cei mai mulţi autori considerând testarea cutanată nefolositoare. Dincolo de valoarea dubitativă a testării cutanate în sine, testarea este limitată şi de indisponibilitatea tuturor macrolidelor în formă injectabilă. Pentru testarea patch sunt recomandate diverse concentraţii, iar testele in vitro nu sunt pe larg evaluate(1). Testele de provocare au confirmat suspiciunea de reacţie de hipersensibilitate la claritromicină la 6-12% dintre copiii cu istoric pozitiv(6,9). Din punct de vedere practic, este important de ştiut că nu pare să existe o reactivitate încrucişată de clasă semnificativă clinic. În cazul în care un antibiotic din clasa macrolide a generat o reacţie de hipersensibilitate, se consideră că se poate alege un alt component al aceleiaşi clase, însă sunt necesare precauţii la administrare şi confirmare a toleranţei prin provocare orală controlată. Recent a fost raportat un caz de anafilaxie la un copil care a primit azitromicină şi claritromicină(18).
Glicopeptidele
Din această categorie fac parte antibiotice necesare în tratamentul pacienţilor cu infecţii cu germeni Gram‑pozitivi, ameninţătoare de viaţă, şi de obicei reprezintă o soluţie pentru pacientul alergic la betalactamine sau infectat cu germeni rezistenţi la betalactamine. Vancomicina este asociată cu reacţii uşoare, mai frecvent cu sindromul „red man” (RMS), datorat degranulării nespecifice a mastocitelor. Frecvenţa reacţiilor adverse la copii este joasă, factori de risc identificaţi pentru apariţia RMS fiind: rasa caucaziană, vârsta peste 2 ani, istoric de RMS în antecedentele personale, vancomicină în doză mai mare de 10 mg/kg, concentraţia vancomicinei mai mare de 5 mg/ml(19). Reacţiile cu mecanism imun induse de vancomicină sunt posibile, dar incidenţa lor este necunoscută. În general, 5-14% dintre copiii trataţi cu vancomicină dezvoltă o reacţie de hipersensibilitate(6). În scop diagnostic sunt recomandate testele cutanate (concentraţii non-iritante depistate prin studii pe voluntari adulţi şi copii), testul de activare a bazofilului, testul de provocare. Ori de câte ori apare RMS, se recomandă de primă intenţie continuarea tratamentului cu vancomicină, reducând rata de infuzare. Dacă simptomele nu cedează, se poate folosi teicoplanina, deşi nu sunt suficiente date despre beneficiul şi siguranţa la copil(6).
Aminoglicozidele
Sunt antibiotice active împotriva bacteriilor aerobe, Gram‑negative şi împotriva unor micobacterii, inclusiv Mycobacterium tuberculosis. Sunt clasificate în două grupe: grupul streptidină (streptomicină) şi grupul deoxistreptamină (kanamicină, amikacină, gentamicină, tobramicină, neomicină). Reacţiile adverse au fost descrise mai frecvent la copii cu fibroză chistică şi la cei care au primit tratamente repetate cu aminoglicozide. Sensibilizarea de contact la neomicină este frecventă (11,5% dintre copiii testaţi cu trusa standard europeană de testare patch)(21). Reacţiile alergice secundare administrării de vaccinuri care conţin neomicină sunt foarte rare, de aceea vaccinarea nu este contraindicată în cazul copiilor cu istoric de sensibilizare de tip tardiv, dar trebuie interzisă în cazul istoricului de anafilaxie la neomicină(6,21). Streptomicina, gentamicina şi tobramicina au fost rareori raportate ca triggeri prin utilizarea topică sau sistemică, atât în populaţia adultă, cât şi la copii. Reacţiile încrucişate între aminoglcozide sunt frecvente. S-au descris concentraţii non-iritante pentru testarea cutanată la gentamicină şi tobramicină (tabelul 1), dar valoarea lor diagnostică mai trebuie studiată(6).
Chinolonele
Antibioticele din această grupă sunt clasificate în chinolone de generaţia I (cinoxacin, acid nalidixic), de generaţia a II-a (ofloxacin, norfloxacin, ciprofloxacin, enoxacin), de generaţia a III-a (levofloxacin) şi de generaţia a IV-a (moxifloxacin, gemifloxacin). Deşi sunt mai rar utilizate la copil, incidenţa anafilaxiei induse de ciprofloxacin la copii este de 1:1000(22). Procedurile diagnostice uzuale (teste in vivo şi in vitro) trebuie confirmate în populaţia pediatrică. Date recente arată că 11,8-32% dintre adulţii cu istoric de reacţii adverse induse de chinolone au test de provocare pozitiv, numai 5% din pacienţii cu test cutanat negativ au test de provocare pozitiv, iar 50% dintre cei cu test cutanat pozitiv au test de provocare pozitiv(6,23). Reactivitatea încrucişată nu poate fi prezisă prin teste, dar s-a constatat că este mai mare între chinolonele de generaţiile I şi a II‑a(6).
Tuberculostaticele
Schemele curente de tratament în tuberculoză implică administrarea de izoniazidă (INH), rifampicină (RIF), pirazinamidă (PZA), etambutol (EMB) şi streptomicină, toate asociate cu o frecvenţă înaltă a reacţiilor adverse, care pot compromite tratamentul. Studiile la copii au arătat o rată a reacţiilor de hipersensibilitate care variază între 1,1% şi 65,7%(6,24). Cele mai frecvente reacţii sunt erupţiile maculopapulare, dar au fost descrise şi reacţii de tip urticarie, fotosensibilitate, SJS, TEN, DRESS şi vasculită, în special la adulţi. Factori de risc asociaţi cu reacţiile de hipersensibilitate la tuberculostatice sunt: polimorfisme ale citocromului P450, infecţia cu HIV, vârsta, durata tratamentului, alte tratamente asociate(6,25). De exemplu, reacţiile de hipersensibilitate induse de rifampicină (febră, rash, eozinofilie, anemie hemolitică) apar mai frecvent în cazul administrării intermitente de doze mari şi frecvenţa reacţiilor creşte cu vârsta(25). Confirmarea reacţiilor de hipersensibilitate induse de tuberculostatice prin teste diagnostice nu este facilă. Pentru rifampicină şi izoniazidă, concentraţia de 0,002 mg/ml este cea recomandată pentru efectuarea testelor intradermice, în vederea evaluării reacţiilor imediate. Pentru reacţiile tardive sunt utile: citirea tardivă a testelor intradermice, aplicarea testelor patch sau testelor de transformare limfocitară, cu sensibilitate diagnostică variabilă (în medie, 14,9%)
Tetraciclinele
Tetraciclinele reprezintă o clasă de antibiotice cu spectru larg, utilizate în tratamentul infecţiilor cu bacterii Gram‑pozitive, Gram-negative, anaerobe, micobacterii atipice şi Rickettsia(26). Tetraciclinele formează complexe cu ionii de calciu şi pot induce decolorări ale dinţilor aflaţi în perioada de mineralizare (înainte de 8 ani), efecte de intensitate variabilă, depinzând de doză, durata tratamentului, tipul de tetraciclină (doxiciclina are afinitate mai joasă pentru ionii de calciu comparativ cu alţi compuşi din această clasă), stadiul de mineralizare(27), motiv pentru care aceste antibiotice nu sunt folosite frecvent la copilul cu vârsta sub 8 ani. În general, pentru această grupă de vârstă, societăţile de pediatrie recomandă utilizarea unei tetracicline (de preferinţă, doxiciclină) numai dacă beneficiul depăşeşte riscurile (infecţii cu specii de Rickettsia, holeră sau antrax)(28). Frecvenţa scăzută a utilizării la copil presupune reacţii de hipersensibilitate rare, care pot îmbrăca tabloul clinic de urticarie, angioedem, anafilaxie, erupţii fixe medicamentoase, sindrom DRESS, reacţii de tip boala serului sau lupus indus de medicamente (lupusul indus de minociclină apare, în medie, la doi ani de la iniţierea tratamentului)(29). Reacţiile adverse care apar prin fototoxicitate (fotodermatozele, fotoonicoliza) sunt asociate mai ales cu administrarea de tetraciclină sau doxiciclină(6). Datele privind metodele de diagnostic in vivo sau in vitro ale reacţiilor de hipersensibilitate la tetracicline sunt limitate(6).
Concluzii
Prevalenţa reacţiilor de hipersensibilitate la medicamente la copii variază între 2,8% şi 5,4%. 10-20% dintre reacţii sunt declanşate de ANBL, în principal cotrimoxazol şi macrolide. Există un număr redus de studii care investighează valoarea procedurilor diagnostice ale reacţiilor induse de ANBL la copii. Extrapolarea datelor de la adult sugerează că doar 10-30% dintre reacţii pot fi confirmate la copil(6). Standardizarea procedurilor de diagnostic pentru populaţia pediatrică este absolut necesară, ţinând cont că unele dintre medicamente pot fi necesare şi de neînlocuit.
Bibliografie
- Macy E, Poon K‐Y. Self‐reported antibiotic allergy incidence and prevalence: age and sex effects. Am J Med. 2009;122: 778.e1–e7.
- The Joint Task Force on Practice Parameters. Drug allergy: an updated practice parameter. Ann Allergy Asthma Immunol. 2010;105: 259–73.e78.
- Brockow K, Romano A. Skin tests in the diagnosis of drug hypersensitivity reactions. Curr Pharm Des. 2008;14: 2778–91.
- Mirakian R, Ewan PW, Durham SR, et al. BSACI guidelines for the management of drug allergy. Clin Exp Allergy. 2008;39: 43–61.
- Barbaud A. Skin testing in delayed reactions to drugs. Immunol Allergy Clin North Am. 2009; 29: 517–35.
- Kuyucu S, Mori F, Atanaskovic‐Markovic M, Caubet JC, Terreehorst I, Gomes E, Brockow K. Hypersensitivity reactions to non‐betalactam antibiotics in children: An extensive review. Pediatric Task Force of EAACI Drug Allergy Interest Group. PAI, Volume 25, Issue 6, Pages 534-543.
- Macy E, Romano A, Khan D. Clinical Management Review Practical Management of Antibiotic Hypersensitivity in 2017. J Allergy Clin Immunol Pract. 2017;5:577-86.
- Levi N, Bastuji‐Garin S, Mockenhaupt M, et al. Medications as risk factors of Stevens‐Johnson syndrome and toxic epidermal necrolysis in children: a pooled analysis. Pediatrics. 2009;123: e297–304.
- Mori F, Barni S, Pucci N, et al. Sensitivity and specificity of skin tests in the diagnosis of clarithromycin allergy. Ann Allergy Asthma Immunol. 2010;104: 417–9.
- Chanock S, Luginbuhl L, McIntosh K, Lipsultz S. Life‐threatening reactions to trimethoprim‐sulfamethoxazole in pediatric human immunodeficiency virus infection. Pediatrics. 1994;93: 519–21.
- Dibbern DA Jr, Montanaro A. Allergies to sulfonamide antibiotics and sulfur containing drugs. Ann Allergy Asthma Immunol. 2008;100: 91–100.
- Strom B, Schinnar R, Apter A, et al. Absence of cross‐reactivity between sulfonamide antibiotics and sulfonamide nonantibiotics. N Engl J Med. 2003;349: 1628–35.
- Borras‐Blasco J, Navarro‐Ruiz A, Borras C, Caster E. Adverse cutaneous reactions associated with the newest antiretroviral drugs in patients with human immunodeficiency virus infection. J Antimicrob Chemother. 2008;62: 879–88.
- Empedrad R, Darter AL, Earl HS, Gruchalla RS. Nonirritating intradermal skin test concentrations for commonly prescribed antibiotics. J Allergy Clin Immunol. 2003;112: 629–30.
- Araújo L, Demoly P. Macrolides allergy. Curr Pharm Des. 2008;14: 2840–62.
- Craft JC, Siepman N. Overview of the safety profile of clarithromycin suspension in pediatric patients. Pediatr Infect Dis J. 1993;12: S142–7.
- Ferrándiz‐Pulido C, García‐Fernández D, Domínguez‐Sampedro P, García‐Patos V. Stevens‐Johnson syndrome and toxic epidermal necrolysis in children: a review of the experience with paediatric patients in a university hospital. J Eur Acad Dermatol Venereol. 2011;25: 1153–9.
- Mori F, Pecorarı F, Pantano A, et al. Azithromycin anaphylaxis in children. Int J Immunopathol Pharmacol. 2014;27: 81–6.
- Myers AL, Gaedigk A, Dai H, et al. Defining risk factors for red man syndrome in children and adults. Pediatr Infect Dis J. 2012;31: 464–8.
- Machovcova A. The frequency of contact allergy in children and adolescents in the Czech Republic. Acta Dermatovenerol Croat. 2012;20: 75–9.
- Watson JC, Hadler SC, Dykewicz CA, et al. Measles, mumps, and rubella–vaccine use and strategies for elimination of measles, rubella, and congenital rubella syndrome and control of mumps: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 1998;8: 1–57.
- Burke P, Burne SR. Allergy associated with ciprofloxacin. Br Med J. 2000;320: 679.
- Venturini Díaz M, Lobera Labairu T, del Pozo Gil MD, et al. In vivo diagnostic tests in adverse reactions to quinolones. J Investig Allergol Clin Immunol. 2007;17: 393–8.
- Frydenberg AR, Graham SM. Toxicity of first‐line drugs for treatment of tuberculosis in children: review. Tropical Medicine and International Health 2009, volume 14 no 11 pp 1329–1337.
- Smith MW, Unkel JH, Fenton SJ, et al. The use of tetracyclines in pediatric patients. J Pediatr Pharmacol Ther. 2001;6:66-7.
- Cohlan SQ. Tetracycline staining of teeth. Teratology. 1977;15:127-9.
- Tetracyclines. In: Pickering LK, Baker CJ, Kimberlin DW, Long SS, eds. Red Book. 2009 Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, IL: American Academy of Pediatrics. 2009;739.
- Shapiro LE, Knowles SR. Comparative safety of tetracycline, minocycline, and doxycycline. Shear NH Arch Dermatol. 1997 Oct;133(10):1224-30.
Articole din ediţiile anterioare
Forme gastrointestinale ale alergiilor alimentare non-IgE-mediate
Reacţiile de hipersensibilitate la alimente au impact negativ major asupra calităţii vieţii pacientului, dar nu numai asupra lui, ci şi asupra fami...
Diagnosticul principalelor erupţii cutanate la copil
Sunt nenumărate leziuni cutanate care pot să aducă micul pacient la consultaţie. Uneori aspectul leziunilor este înalt sugestiv pentru o boală, alt...
Recomandări de imunoterapie cu vaccinuri alergenice – ARIA 2019
Imunoterapia alergen specifică (AIT) este o opţiune terapeutică confirmată pentru tratamentul rinitei alergice şi/sau al astmului. S-au creat multe...
Clasificarea manifestărilor cutanate în reacţiile de hipersensibilitate la medicamente
Reacţiile de hipersensibilitate la medicamente (RHM) sunt comune, iar pielea este organul cel mai frecvent implicat într-un spectru larg de reacţii...