Tropomyosins are part of a muscular protein family that includes a large number of cross-reactive allergens originating mainly from invertebrates. Tropomyosins have been identified as food allergens of animal origin from shellfish, such as crustaceans and mollusks, and rarely from parasitic nematodes from fish or some edible insects, and as aeroallergens from arthropods (house dust mites, storage mites, cockroaches). In current allergy practice, in vitro analysis of IgE-mediated sensitization to tropomyosins can be performed using singleplex immunoassays such as fluorencence enzyme immunoassay and chemiluminescence or multiplex ones such as microarray on immuno solid phase allergen chip and macroarray nanotechnology based immunoassay used as a next‑generation molecular allergy explorer.
Evaluarea in vitro a sensibilizării mediate IgE la tropomiozină
In vitro evaluation of IgE mediated sensitization to tropomyosin
First published: 31 martie 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.5.1.2021.4450
Abstract
Rezumat
Tropomiozinele aparţin unei familii de proteine musculare care include un număr mare de alergene cu reactivitate încrucişată, majoritatea din surse de nevertebrate. Tropomiozinele au fost identificate ca alergene alimentare de origine animală din fructe de mare, precum crustacee sau moluşte, şi, mai rar, din nematode parazite din unii peşti sau unele insecte comestibile şi ca aeroalergene din artropode (acarieni din praful de casă sau de stocaj, gândaci de bucătărie). În practica alergologică actuală, explorarea in vitro a sensibilizării mediate IgE la tropomiozine se poate realiza utilizând metode de imunoanaliză singleplex de tip analiză fluoroimunoenzimatică şi chemiluminescenţă sau multiplex de tip microarray pe cip cu alergene în fază solidă şi imunoanaliză pe bază de nanotehnologie macroarray utilizată ca explorare alergologică macromoleculară de generaţie nouă.
Tropomiozinele aparţin unei familii de proteine musculare care include un număr mare de alergene cu reactivitate încrucişată, majoritatea din surse de nevertebrate (panalergen al nevertebratelor), cum ar fi crustacee şi moluşte, acarieni din praful de casă, insecte şi helminţi.
În funcţie de calea de expunere, sensibilizarea mediată IgE este asociată rareori cu simptome uşoare la ingestie, cum ar fi sindromul de alergie orală, manifestări intestinale sau cutanate generalizate, însă provoacă frecvent anafilaxie severă, iar inhalarea acestor alergene poate provoca simptome respiratorii, cum ar fi cele de rinită şi astm.
Tropomiozina este o proteină alfa-helicoidală care formează o structură spiralată cu două spirale paralele, care conţin două seturi de şapte locuri de legare alternante ale actinei. Tropomiozinele au fost identificate ca alergene alimentare de origine animală din fructe de mare, precum crustacee sau moluşte, şi, mai rar, din alte artropode ingerate. Tropomiozinele sunt, de asemenea, identificate ca aeroalergene din artropode (acarieni din praful de casă sau de stocaj, gândaci de bucătărie). Secvenţele de tropomiozine sunt foarte bine conservate, ceea ce explică sensibilizarea încrucişată frecventă între sursele de alergene care le conţin(1).
Tropomiozinele sunt prezente în toate celulele eucariote, asociate cu filamente subţiri din muşchi şi microfilamente în multe celule nemusculare, fiind implicate în activitatea contractilă a acestor celule şi, de asemenea, în ajustarea reglării morfologiei şi motilităţii celulare. Ca panalergene, acestea sunt rezistente la căldură, la pH‑ul gastric scăzut şi la peptidaza gastrointestinală, prin urmare alergenicitatea lor este menţinută în alimentele preparate termic şi digerate, provocând reacţii alergice sistemice până la anafilaxie. Tropomiozina naturală are o greutate moleculară medie de 37 kDa. Alergenele grupului 10 din acarienii prafului de casă sunt compuse din 284 de aminoacizi. Identitatea secvenţei în cadrul tropomiozinelor acarienilor din praf este mai mare decât la orice alt alergen al acarienilor. Tropomiozina Der p 10 are mai mult de 65% reziduuri identice cu alte tropomiozine nevertebrate(2-5). Regiunile adiacente poziţiilor 133-135 şi 201 ale tropomiozinelor nevertebrate prezintă o probabilitate mai mică de pliere a alfa-helixului decât cele ale vertebratelor şi sunt candidate responsabile de alergenicitate(6).
Tropomiozine relevante clinic ca aeroalergene dintre artropodele din clasa Arachnida sunt reprezentate de Der p 10 şi Der f 10, alergene din grupul 10 din acarienii din praful de casă din zona temperată Dermatophagoides pteronyssinus, respectiv Dermatophagoides farinae (ambii din familia Pyroglyphidae), Blo t 10 din acarianul de stocaj şi din praful de casă din zone tropicale/subtropicale Blomia tropicalis (familia Echimyopodidae), Tyr p 10 şi Lep d 10 din acarienii de stocaj Tyrophagus putrescentiae (familia Acaridae), respectiv Lepidoglyphus destructor (familia Glycyphagidae). Alergenele moleculare Blo t 10 şi Der p 10 au identitate de aminoacizi de 95% şi sunt semnificativ cross-reactive, iar Tyr p 10 are identitate de secvenţe de aminoacizi de 64-94% cu alte tropomiozine(7,8). Datele referitoare la prevalenţa sensibilizării mediate IgE la tropomiozinele acarienilor din praful de casă sunt insuficiente şi uneori contradictorii. Prevalenţa sensibilizării la Der f 10 a fost evaluată iniţial la 80,6%, în timp ce pentru Der p 10, la 5-18%, chiar 55% la populaţia africană. Date mai recente arată că sensibilizarea la rDer p 10 se întâlneşte la 15% dintre pacienţii cu alergie respiratorie la acarienii din praful de casă, iar pacienţii rDer p 10-reactivi sunt frecvent sensibilizaţi la alergene de acarieni, altele decât Der p 1 şi Der p 2. Puţini pacienţi cu simptome respiratorii la acarienii din praful de casă, fără alergie la fructele de mare, sunt monosensibilizaţi la Der p 10. Mai mult, sensibilizarea IgE la Der p 10 permite identificarea unui subgrup de pacienţi cu alergie respiratorie la acarieni care pot să nu aibă un răspuns terapeutic optim la imunoterapia alergenică cu extracte de acarieni disponibile în prezent(9). În anafilaxia la acarieni pe cale orală, cum ar fi cea la clătite contaminate cu acarieni, componentele alergenice responsabile sunt probabil alergenele din grupul 2 (termostabile, rezistente la digestie) reactive încrucişat între specii, în timp ce alergenele din grupul 1 sunt mascate prin legarea de prolamine din făină, iar tropomiozinele din grupul 10 nu sunt implicate(10-12).
Unele artropode din clasa Insecta conţin tropomiozine importante ca aeroalergene, precum gândacul de bucătărie Blatella germanica din familia Ectobiidae (Bla g 7) şi gândacul de canalizare Periplaneta americana din familia Blattidae (Per a 7). Dintre pacienţii alergici la gândacul Blatella germanica, 16,2% sunt sensibilizaţi la rBla g 7, alergene cu identitate de secvenţă de aminoacizi de până la 91% cu alte tropomiozine ale altor gândaci de casă(13). Dintre speciile de insecte utilizate ca hrană umană merită menţionate cele aprobate recent în Elveţia pentru acest scop: greierele de casă (Acheta domesticus), lăcusta europeană (Locusta migratoria) şi viermii de făină (Tenebrio molitor) ca larve, pentru aceştia din urmă fiind descrisă şi tropomiozina ca trofalergen (Ten m 7)(12,14,15). Anafilaxia la ingestia de insecte comestibile (larve de Tenebrio molitor, omida moliei africane Gonimbrasia belina) poate apărea la pacienţi sensibilizaţi inhalator la aceste insecte sau la acarienii din praful de casă şi gândaci de bucătărie, sugerându-se reactivitatea încrucişată a alergenelor de tip glutation transferaze sau tropomiozine cum ar fi Der p 10, Der f 10 şi Bla g 7(16,17).
Paraziţii din încrengătura Nematoda, ordinul Ascaridida, care conţin tropomiozine cu rol alergenic sunt viermele de hering Anisakis simplex din familia Anisakidae (Ani s 3) şi limbricul Ascaris lumbricoides din familia Ascarididae (Asc l 3)(1). Prevalenţa crescută a sensibilizării la Anisakis simplex, de aproximativ 15%, a fost raportată la pacienţii din zone în care consumul de peşte crud sau marinat este foarte frecvent, cum ar fi sudul Italiei, confirmând faptul că obiceiurile alimentare influenţează sensibilizarea mediată IgE la acest nematod. Doar 5,5% dintre pacienţii sensibilizaţi au avut antecedente de alergie la Anisakis simplex. Pacienţii sensibilizaţi la nematod au fost mai predispuşi la simptome alergice când au avut cosensibilizare la acarienii din praful de casă, ceea ce sugerează implicarea alergenelor cu reactivitate încrucişată clinic relevantă(18). Tropomiozina Asc l 3 a Ascaris lumbricoides este cross-reactivă cu tropomiozinele acarienilor. Sensibilizarea mediată IgE la acest alergen este foarte frecventă atât la astmatici, cât şi la cei fără astm, dar sensibilizaţi la nematod, şi s-a sugerat un rol potenţial al Asc l 3 în mecanismele patogenice ale astmului în regiunile tropicale(19).
Tropomiozina a fost considerată mult timp cel mai important alergen al crevetelor. Mai multe studii au relevat sensibilizare mediată IgE la tropomiozină la 72-98% dintre pacienţii sensibilizaţi la crevete, deşi un studiu italian multicentric a constatat acest aspect la mai puţin de 50% dintre pacienţii sensibilizaţi. Tropomiozinele crustaceelor, cum ar fi crevetele, homarii şi crabii, au identitate de secvenţă de 91-100%. Identitatea de secvenţă dintre tropomiozina crustaceelor şi moluştelor este mai mică, de aproximativ 65%(20).
Fructele de mare sunt definite ca orice nevertebrate marine comestibile. Crustaceele aparţin încrengăturii Arthropoda şi sunt clasificate taxonomic alături de insecte şi arahnide. Crustaceele includ specii de creveţi, homari şi crabi, toate acestea conţinând tropomiozine ca panalergene ale nevertebratelor, cu înaltă omologie de secvenţă, care favorizează reactivitatea încrucişată între crustacee şi între acestea şi alte artropode, cum ar fi acarienii sau gândacii. Moluştele aparţin încrengăturii Mollusca şi includ scoici, caracatiţe şi melci, iar probabilitatea de reactivitate încrucişată între aceste moluşte nu este foarte bine stabilită. Alergenele comune au omologie a secvenţei de aminoacizi mai redusă şi, prin urmare, sunt mai puţin susceptibile de a reacţiona încrucişat, deşi unele tropomiozine sunt cross-reactive între crustacee şi moluşte. Tropomiozina nevertebratelor comestibile este termostabilă şi rezistentă la digestie(20).
Artropodele din subîncrengătura Crustacea, ordinul Decapoda, conţin tropomiozine cross-reactive ca alergene de origine musculară. Creveta comună cenuşie Crangon crangon, din familia Crangonidae, conţine tropomiozina Cra c 1, iar cea nordică Pandalus borealis, din familia Pandalidae, Pan b 1. Crevetele cu tropomiozine specificate din familia Penaeidae sunt cele de tip tigrat uriaş Penaeus monodon (Pen m 1), brun Farfantepenaeus/Penaeus aztecus (Pen a 1), indian Fenneropenaeus/Penaeus indicus (Pen i 1), cu picioare albe de Pacific Litopenaeus vannamei (Lit v 1) şi regal occidental Melicertus latisulcatus (Mel l 1), iar din familia Palaemonidae, cei de apă dulce de tip gigant Macrobrachium rosenbergii (Mac r 1) şi siberian Exopalaemon modestus (Exo m 1). Tropomiozinele altor crustacee comestibile sunt Hom g 1 din homarul european Homarus gammarus şi Hom a 1 din cel american Homarus americanus (familia Nephropidae), Pan s 1 din langusta Panulirus stimpsoni (familia Palinuridae), Cha f 1 din crabul roşu înotător Charybdis feriata (familia Portunidae), Por p 1 din crabul albastru Portunus armatus/pelagicus şi Pro cl 1 din racul roşu Procambarus clarkii (familia Cambaridae)(2,21-25). Reactivitatea încrucişată a tropomiozinelor aparatului locomotor al acarienilor din praful de casă cu cele ale crustaceelor comestibile este semnificativă. Tropomiozina nu este însă singurul alergen cross-reactiv între crevete şi acarieni, fiind citate şi arginin kinaza (Der p 20), lanţul uşor al miozinei (Der p 26) şi alergene cu greutate moleculară mare, precum paramiozina (Der p 11) şi hemocianina(26,27).
Moluştele (încrengătura Mollusca) din clasa Bivalvia cu tropomiozine precizate ca alergene includ midia albastră/comună Mytilus edulis (Myt e 1), midia mediteraneeană Mytilus galloprovincialis (Myt g 1) şi midia verde asiatică Perna viridis (Per v 1) din familia Mytilidae, stridia de Pacific Crassostrea gigas (Cra g 1) şi cea de stâncă din Sydney Saccostrea glomerata (Sac g 1) din familia Ostreidae, scoica venus de nisip Chamelea/Venus gallina (Ven g 1) din familia Veneridae şi scoica-pieptene Mimachlamys nobilis (Mim n 1) din familia Pectinidae. Moluştele din clasa Cephalopoda includ caracatiţa comună Octopus vulgaris (Oct v 1) din familia Octopodidae, sepia aurie Sepia esculenta (Sep e 1) din familia Sepiidae, calmarul japonez Todarodes pacificus (Tod p 1) din familia Ommastrephidae şi cel indian Uroteuthis duvaucelii (Uro du 1) din familia Loliginidae. În plus, moluştele din clasa Gastropoda includ melcii marini abalone din familia Haliotidae, de tip disc Haliotis discus hannai (Hal di 1), tigrat Haliotis rubra x laevigata (Hal l 1) şi japonez Haliotis diversicolor (Hal d 1), melcul turban cu coarne Turbo cornutus (Tur c 1) din familia Turbinidae şi melcul brun de grădină Helix aspersa (Hel as 1) din familia Helicidae. Reactivitatea încrucişată a tropomiozinelor de la acarienii din praful de casă cu cele ale moluştelor marine sau terestre a fost de asemenea raportată(2,21-24).
Sindromul acarieni din praful de casă‑crustacee‑moluşte este o variantă relativ rară a alergiilor alimentare prin cross-reactivitate, în care acarienii din praful de casă sunt agenţii de sensibilizare IgE primari, în timp ce crustaceele pot induce alergii alimentare, până la anafilaxie, chiar şi la prima ingestie(28). În sindromul mai obişnuit, acarieni-creveţi, componenta tipică alergenică menţionată este tropomiozina Der p 10(29). Moleculele alergenice implicate în alergia la crustacee sunt reactive încrucişat cu componentele alergenice de la acarienii prafului de casă, în special anumite proteine cu rol în contracţia musculară. Reactivitatea încrucişată cu specii care nu sunt strâns înrudite este frecventă la pacienţii alergici la crustacee, unele alergene din fructele de mare fiind panalergene ale nevertebratelor distribuite pe scară largă(30). Tropomiozina a fost primul alergen identificat implicat în reactivitatea încrucişată între acarianul Dermatophagoides pteronyssinus, crevete şi insecte(31) şi este considerat alergen major al crustaceelor, responsabil frecvent de reactivitatea încrucişată clinică cu aeroalergenele de grup 10 din acarienii din praful de casă(24,32).
Aşa cum am menţionat anterior, tropomiozinele alergenice sunt proteine musculare foarte conservate, prezente la nevertebrate, cum ar fi arahnide (acarieni din praful de casă), insecte (gândaci de casă), crustacee (crevete, homari, languste, raci, crabi) şi moluşte (midii, stridii, sepii, caracatiţe, melci marini sau de grădină), fiind deci considerate panalergene ale nevertebratelor. Spre deosebire de acestea, tropomiozinele mamiferelor şi păsărilor, cum ar fi cele din carne de vită, porc, iepure sau pui, nu sunt alergenice(21,33). Tropomiozinele animalelor vertebrate nu sunt în general alergenice, o excepţie fiind tropomiozina provenind de la tilapia Oreochromis mossambicus (Ore m 4) din familia Cichlidae. Tropomiozinele altor peşti osoşi din clasa Actinopterygii au dovedit identităţi structurale, Pan h 4 de la somn Pangasianodon hypophthalmus (familia Pangasiidae), având 80% din secvenţă comună cu Sal s 4 de la somonul de Atlantic Salmo salar (familia Salmonidae), ambele tropomiozine având identitate de structură de peste 80% cu Ore m 4 de la tilapia. Tropomiozina este o proteină abundentă, după parvalbumină, în extractele de peşte, dar legarea IgE la tropomiozina peştilor este rară, cu puţine cazuri de alergie raportate(34-36).
Prevalenţa sensibilizării la tropomiozină în rândul pacienţilor alergici la acarienii din praful de casă, evaluată utilizând componentele alergenice din grupul 10, variază în funcţie de zona geografică(2,37). În multe ţări europene, această prevalenţă de sensibilizare la rDer p 10 variază între 9% şi 18%(38). Alte studii au arătat că ratele de sensibilizare la tropomiozină sunt depistate la valori mai mari de 30-55% în regiunile subtropicale sau tropicale, cum ar fi Australia sau Africa Centrală. Această variabilitate poate fi explicată prin expunerea diferită la alergene sensibilizante de nevertebrate în diferite părţi ale lumii(37). Anticorpii IgE rezultaţi sunt capabili să reacţioneze încrucişat cu diferite tropomiozine, chiar şi cu cele care nu au indus producţia lor. De exemplu, reactivitatea anticorpilor IgE la un alergen alimentar major, tropomiozina din crevete, poate apărea la subiecţi neexpuşi (care respectă legi dietetice care interzic consumul de crustacee), dar cu alergie respiratorie la acarieni din praf şi/sau gândaci de casă(39). Un alt studiu a dezvăluit că jumătate dintre pacienţii europeni alergici la acarienii din praful de casă cu sensibilizare IgE la tropomiozina Der p 10 au un istoric de reacţii clinic relevante la consumul de fructe de mare, cealaltă jumătate neavând reacţii alergice când consumă astfel de nevertebrate comestibile(32).
IgE serice specifice faţă de tropomiozina de crevete Pen a 1 constituie un predictor mai bun al alergiei la crevete decât IgE serice specifice la extract natural de crevete. Cu toate acestea, ar trebui luate în considerare anumite diferenţe regionale, deoarece rata de sensibilizare la tropomiozina Dermatophagoides pteronyssinus (Der p 10) poate influenţa sensibilizarea la Pen a 1, ca urmare a reactivităţii încrucişate ridicate(40).
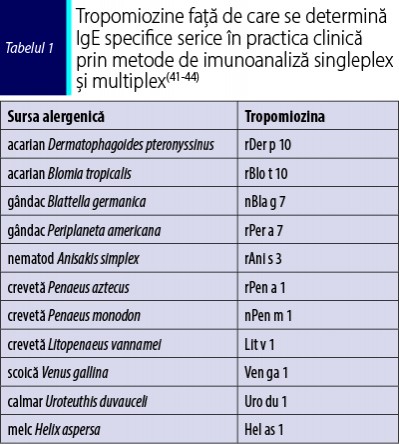
În practica alergologică actuală, explorarea in vitro a sensibilizării mediate IgE la tropomiozine cu reactivitate încrucişată se poate realiza utilizând metode de imunoanaliză singleplex şi multiplex (tabelul 1).
IgE serice specifice faţă de tropomiozine pot fi determinate in vitro prin analiză fluoroimunoenzimatică (FEIA) singleplex, cu alergene cuplate în fază solidă cu polimer de celuloză capsulată, utilizând alergenele recombinate rDer p 10 din acarianul din praful de casă Dermatophagoides pteronyssinus (d205) şi rPen a 1 din creveta Penaeus aztecus (f351). Prin metoda de chemiluminescenţă singleplex cu alergene biotinilate în fază lichidă pot fi determinate IgE serice specifice faţă de componenta alergenică purificată nativă nPen m 1 din creveta Penaeus monodon.
IgE serice specifice faţă de tropomiozine native înalt purificate (n) sau recombinate (r) pot fi determinate in vitro şi prin metode de imunoanaliză multiplex.
Prin imunoanaliză de tip microarray pe cip cu alergene în fază solidă (lamă de sticlă acoperită cu polimer) pot fi determinate IgE specifice faţă de tropomiozina de acarian Dermatophagoides pteronyssinus (rDer p 10), gândac Blattella germanica (nBla g 7), nematod Anisakis simplex (rAni s 3) şi creveta Penaeus monodon (nPen m 1).
Printr-o altă metodă de imunoanaliză multiplex bazată pe nanotehnologie de tip nano-bead array, pot fi determinate IgE specifice faţă de acarianul Dermatophagoides pteronyssinus (Der p 10), gândacul Periplaneta americana (Per a 7), nematodul Anisakis simplex (Ani s 3), creveta Litopenaeus vannamei (Lit v 1), scoica Venus gallina (Ven ga 1), calmar Uroteuthis duvauceli (Uro du 1) şi melc de grădină Helix aspersa (Hel as 1).
Prin metoda de imunoanaliză bazată pe nanotehnologie macroarray, folosită ca analiză de explorare alergologică moleculară de tip multiplex de ultimă generaţie, pot fi determinate IgE specifice faţă de acarianul din praful de casă european Dermatophagoides pteronyssinus (rDer p 10), acarianul din zone tropicale Blomia tropicalis (rBlo t 10), gândacul de casă american Periplaneta americana (rPer a 7), nematodul Anisakis simplex (rAni s 3) şi crevetele tigrat brun Penaeus monodon (nPen m 1).
În concluzie, tropomiozinele sunt alergene cu reactivitate încrucişată care aparţin unei familii de proteine musculare din surse variate de nevertebrate, cum ar fi crustacee şi moluşte, acarieni din praful de casă, insecte şi helminţi. Aceste alergene moleculare sensibilizează pe căi diferite şi sunt implicate în alergii respiratorii şi alimentare variate. În practica alergologică actuală, explorarea in vitro a sensibilizării mediate IgE la tropomiozine prin dozarea IgE specifice serice se poate realiza utilizând metode de imunoanaliză singleplex şi multiplex. n
Bibliografie
- Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, Aalberse RC, Agache I, Asero R, Ballmer-Weber B, Barber D, Beyer K, Biedermann T, Bilò MB, Blank S, Bohle B, Bosshard PP, Breiteneder H, Brough HA, Caraballo L, Caubet JC, Crameri R, Davies JM, Douladiris N, Ebisawa M, EIgenmann PA, Fernandez-Rivas M, Ferreira F, Gadermaier G, Glatz M, Hamilton RG, Hawranek T, Hellings P, Hoffmann-Sommergruber K, Jakob T, Jappe U, Jutel M, Kamath SD, Knol EF, Korosec P, Kuehn A, Lack G, Lopata AL, Mäkelä M, Morisset M, Niederberger V, Nowak-Węgrzyn AH, Papadopoulos NG, Pastorello EA, Pauli G, Platts-Mills T, Posa D, Poulsen LK, Raulf M, Sastre J, Scala E, Schmid JM, Schmid-Grendelmeier P, van Hage M, van Ree R, Vieths S, Weber R, Wickman M, Muraro A, Ollert M. EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol. 2016;27 Suppl 23:1-250. DOI: 10.1111/pai.12563.
- Shafique RH, Inam M, Ismail M, Chaudhary FR. Group 10 allergens (tropomyosins) from house-dust mites may cause covariation of sensitization to allergens from other invertebrates. Allergy Rhinol (Providence). 2012;3(2):e74-90. DOI: 10.2500/ar.2012.3.0036.
- Asturias JA, Arilla MC, Gómez-Bayón N, Martínez A, Martínez J, Palacios R. Sequencing and high level expression in Escherichia coli of the tropomyosin allergen (Der p 10) from Dermatophagoides pteronyssinus. Biochim Biophys Acta. 1998;1397(1):27-30. DOI: 10.1016/s0167-4781(98)00006-2.
- Ivanciuc O, Garcia T, Torres M, Schein CH, Braun W. Characteristic motifs for families of allergenic proteins. Mol Immunol. 2009;46(4):559-68. DOI: 10.1016/j.molimm.2008.07.034
- Liu GM, Huang YY, Cai QF, Weng WY, Su WJ, Cao MJ. Comparative study of in vitro digestibility of major allergen, tropomyosin and other proteins between Grass prawn (Penaeus monodon) and Pacific white shrimp (Litopenaeus vannamei). J Sci Food Agric. 2011;91(1):163-70. DOI: 10.1002/jsfa.4167.
- González-Fernández J, Rodero M, Daschner A, Cuéllar C. New insights into the allergenicity of tropomyosin: a bioinformatics approach. Mol Biol Rep. 2014;41(10):6509-17. DOI: 10.1007/s11033-014-3534-6.
- Yi FC, Cheong N, Shek LP, Wang DY, Chua KY, Lee BW. Identification of shared and unique immunoglobulin E epitopes of the highly conserved tropomyosins in Blomia tropicalis and Dermatophagoides pteronyssinus. Clin Exp Allergy. 2002;32(8):1203-10. DOI: 10.1046/j.1365-2745.2002.01449.x.
- Jeong KY, Lee H, Lee JS, Lee J, Lee IY, Ree HI, Hong CS, Yong TS. Molecular cloning and the allergenic characterization of tropomyosin from Tyrophagus putrescentiae. Protein Pept Lett. 2007;14(5):431-6. DOI: 10.2174/092986607780782777.
- Resch Y, Weghofer M, Seiberler S, Horak F, Scheiblhofer S, Linhart B, Swoboda I, Thomas WR, Thalhamer J, Valenta R, Vrtala S. Molecular characterization of Der p 10: a diagnostic marker for broad sensitization in house dust mite allergy. Clin Exp Allergy. 2011;41(10):1468-77. DOI: 10.1111/j.1365-2222.2011.03798.x.
- Sánchez-Borges M, Fernandez-Caldas E, Thomas WR, Chapman MD, Lee BW, Caraballo L, et al. International consensus (ICON) on: clinical consequences of mite hypersensitivity, a global problem. World Allergy Organ J. 2017;10(1):14. DOI: 10.1186/s40413-017-0145-4
- Mangodt EA, Van Gasse AL, Bridts CH, Sabato V, Ebo DG. Simultaneous oral mite anaphylaxis (pancake syndrome) in a father and daughter and a review of the literature. J Investig Allergol Clin Immunol. 2015;25(1):75-6.
- Popescu FD, Vieru M. The presence of aeroallergens in food products: a potential risk for the patient with allergic rhinitis. RJR. 2018;8(29):11-15. DOI: 10.2478/rjr-2018-0001
- Jeong KY, Lee J, Lee IY, Ree HI, Hong CS, Yong TS. Allergenicity of recombinant Bla g 7, German cockroach tropomyosin. Allergy. 2003;58(10):1059-63. DOI: 10.1034/j.1398-9995.2003.00167.x.
- Bundesamt für Lebensmittelsicherheit und Veterinärwesen (2017-04-28): Insects as food. www.blv.admin.ch/blv/de/home/lebensmittel-und-ernaehrung/lebensmittelsicherheit/einzelne-lebensmittel/insekten.html#-399311545
- Palmer LK, Marsh JT, Lu M, Goodman RE, Zeece MG, Johnson PE. Shellfish Tropomyosin IgE Cross-Reactivity Differs Among Edible Insect Species. Mol Nutr Food Res. 2020;64(8):e1900923. DOI: 10.1002/mnfr.201900923..
- Freye HB, Esch RE, Litwin CM, Sorkin L. Anaphylaxis to the ingestion and inhalation of Tenebrio molitor (mealworm) and Zophobas morio (superworm). Allergy Asthma Proc. 1996;17(4):215-9. DOI: 10.2500/108854196778996903.
- Kung SJ, Fenemore B, Potter PC. Anaphylaxis to Mopane worms (Imbrasia belina). Ann Allergy Asthma Immunol. 2011;106(6):538-40. DOI: 10.1016/j.anai.2011.02.003.
- Heffler E, Sberna ME, Sichili S, Intravaia R, Nicolosi G, Porto M, Liuzzo MT, Picardi G, Fichera S, Crimi N. High prevalence of Anisakis simplex hypersensitivity and allergy in Sicily, Italy. Ann Allergy Asthma Immunol. 2016;116(2):146-50. DOI: 10.1016/j.anai.2015.12.014.
- Acevedo N, Erler A, Briza P, Puccio F, Ferreira F, Caraballo L. Allergenicity of Ascaris lumbricoides tropomyosin and IgE sensitization among asthmatic patients in a tropical environment. Int Arch Allergy Immunol. 2011;154(3):195-206. DOI: 10.1159/000321106.
- Gelis S, Rueda M, Valero A, Fernández EA, Moran M, Fernández-Caldas E. Shellfish Allergy: Unmet Needs in Diagnosis and Treatment. J Investig Allergol Clin Immunol. 2020;30(6):409-420. DOI: 10.18176/jiaci.0565.
- Woo CK, Bahna SL. Not all shellfish “allergy“ is allergy! Clin Transl Allergy. 2011;1(1):3. DOI: 10.1186/2045-7022-1-3.
- Shiomi K. Current knowledge on molecular features of seafood allergens. Shokuhin Eiseigaku Zasshi. 2010;51(4):139-52. DOI: 10.3358/shokueishi.51.139.
- Taylor SL. Molluscan shellfish allergy. Adv Food Nutr Res. 2008;54:139-77. DOI: 10.1016/S1043-4526(07)00004-6.
- Popescu FD. Cross-reactivity between aeroallergens and food allergens. World J Methodol. 2015;5(2):31-50. DOI:10.5662/wjm.v5.i2.31
- Zhang Z, Li XM, Xiao H, Nowak-Wegrzyn A, Zhou P. IgE-binding epitope mapping of tropomyosin allergen (Exo m 1) from Exopalaemon modestus, the freshwater Siberian prawn. Food Chem. 2020;309:125603. DOI: 10.1016/j.foodchem.2019.125603.
- Bauermeister K, Wangorsch A, Garoffo LP, Reuter A, Conti A, Taylor SL, Lidholm J, Dewitt AM, Enrique E, Vieths S, Holzhauser T, Ballmer-Weber B, Reese G. Generation of a comprehensive panel of crustacean allergens from the North Sea Shrimp Crangon crangon. Mol Immunol. 2011;48(15-16):1983-92. DOI: 10.1016/j.molimm.2011.06.216.
- Asero R, Pravettoni V, Scala E, Villalta D. House Dust Mite-Shrimp Allergen Interrelationships. Curr Allergy Asthma Rep. 2020;20(4):9. DOI: 10.1007/s11882-020-0902-2.
- Kütting B, Brehler R. House dust mite-crustaceans-molluscs syndrome. A rare variant of food allergy in primary sensitization to inhaled allergens. Hautarzt. 2001;52(8):708-11. German. DOI: 10.1007/s001050170086.
- Melioli G, Spenser C, Reggiardo G, Passalacqua G, Compalati E, Rogkakou A, Riccio AM, Di Leo E, Nettis E, Canonica GW. Allergenius, an expert system for the interpretation of allergen microarray results. World Allergy Organ J. 2014;7(1):15. DOI: 10.1186/1939-4551-7-15.
- Pedrosa M, Boyano-Martínez T, García-Ara C, et al. Shellfish Allergy: a Comprehensive Review. Clinic Rev Allerg Immunol. 2015;49:203-216. DOI:10.1007/s12016-014-8429-8.
- Witteman AM, Akkerdaas JH, van Leeuwen J, van der Zee JS, Aalberse RC. Identification of a cross-reactive allergen (presumably tropomyosin) in shrimp, mite and insects. Int Arch Allergy Immunol. 1994;105(1):56-61. DOI: 10.1159/000236803.
- Becker S, Gröger M, Canis M, Pfrogner E, Kramer MF. Tropomyosin sensitization in house dust mite allergic patients. Eur Arch Otorhinolaryngol. 2012;269(4):1291-6. DOI: 10.1007/s00405-011-1826-1.
- Reese G, Ayuso R, Lehrer SB. Tropomyosin: an invertebrate pan-allergen. Int Arch Allergy Immunol. 1999;119(4):247-58. DOI: 10.1159/000024201.
- González-Fernández J, Veleiro B, Daschner A, Cuéllar C. Are fish tropomyosins allergens? Annals of Allergy, Asthma & Immunology. 2016;116(1):74–76.e5. DOI:10.1016/j.anai.2015.09.017.
- González-Fernández J, Daschner A, Cuéllar C. Allergenicity of vertebrate tropomyosins: Challenging an immunological dogma. Allergologia et Immunopathologia. 2017;45(3):297–304. DOI:10.1016/j.aller.2016.08.002.
- Ruethers T, Taki AC, Karnaneedi S, Nie S, Kalic T, Dai D, Daduang S, Leeming M, Williamson NA, Breiteneder H, Mehr SS, Kamath SD, Campbell DE, Lopata AL. Expanding the allergen repertoire of salmon and catfish. Allergy. 2020. DOI:10.1111/all.14574
- Pevec B, Pevec MR, Markovic AS, Batista I. House dust mite subcutaneous immunotherapy does not induce new sensitization to tropomyosin: does it do the opposite? J Investig Allergol Clin Immunol. 2014;24(1):29-34. PMID: 24765878.
- Weghofer M, Thomas WR, Kronqvist M, Mari A, Purohit A, Pauli G, Horak F, Grönlund H, van Hage M, Valenta R, Vrtala S. Variability of IgE reactivity profiles among European mite allergic patients. Eur J Clin Invest. 2008;38(12):959-65. DOI: 10.1111/j.1365-2362.2008.02048.x.
- Fernandes J, Reshef A, Patton L, Ayuso R, Reese G, Lehrer SB. Immunoglobulin E antibody reactivity to the major shrimp allergen, tropomyosin, in unexposed Orthodox Jews. Clin Exp Allergy. 2003;33(7):956-61. DOI: 10.1046/j.1365-2222.2003.01722.x.
- Tagami K, Nakayama S, Furuta T, Matsui T, Takasato Y, Sugiura S, Ito K. Pen a 1-specific IgE does not improve the accuracy of a shrimp allergy diagnosis among Japanese children due to cross-reactivity with Der p 10. Allergol Int. 2020;69(2):290-292. DOI: 10.1016/j.alit.2019.10.002.
- Thermoscientific: Product Catalog 2020. https://www.abacusdx.com/media/PU_Product%20Catalog_2020.pdf
- Siemens Healthineers: 3gAllergy™ Menu. https://cdn0.scrvt.com/39b415fb07de4d9656c7b516d8e2d907/1800000003516051/73f1640c25c4/160956-XC1_Allergy_Menu_OUS_Rev-01_1800000003516051.pdf
- Centri Associati di Allergologia Molecolare: Faber®.
- https://www.caam-allergy.com/pdf/Green_John_IgE_Multiplex_FABER244_ENG.pdfMacro Array Diagnostics: ALEX2® Allergen List. https://a.storyblok.com/f/69176/x/81f1990ace/alex2_allergen_list_en.pdf
Articole din ediţiile anterioare
Abordarea diagnostică moleculară în aspergiloza bronhopulmonară alergică
Aspergiloza bronhopulmonară alergică (ABPA) este o afecţiune care apare la pacienţi cu astm sau fibroză chistică şi care prezintă teste cutanate de...
Diagnosticul molecular în bolile alergice respiratorii induse de alergene perene
Diagnosticul molecular se bazează pe identificarea, caracterizarea şi utilizarea componentelor alergenice din surse complexe de alergene. Expunerea...
Teste moleculare şi de laborator specifice în bolile alergice
Bolile alergice au cunoscut o prevalenţă crescândă în ultimele decenii în întreaga lume. În ceea ce priveşte prevalenţa bolilor alergice în România...
Noi direcţii în imunoterapia alergenică
Este cunoscut faptul că imunoterapia alergenică (AIT) este singurul tratament care poate modifica evoluţia bolii alergice şi poate conferi toleranţ...