As asthma management has become increasingly focused on the personalized management of severe asthma, the recognition of the role and of the importance of comorbid conditions has increased. In different age groups, comorbidities can present varying challenges, including diagnostic difficulties due to mimicking or exacerbating asthma symptoms and therapy for comorbid conditions affecting asthma and vice versa. Asthma is frequently associated with multiple comorbidities that are more common in patients with severe asthma than in those with mild or moderate ashma, or in the general population. This group of patients have frequent exacerbations and hospitalizations, absences from work, generating high costs. Although some comorbidities are commonly known, some are likely to remain undiagnosed, requiring a thorough approach and further investigations. Asthma and comorbid conditions often share common risk factors, suggesting the presence of similar inflammatory pathways, where inflammation plays a key role in the onset and development of different comorbidities, so understanding the mechanisms involved is essential for the development of an effective treatment strategy. Systematic assessment of potentially severe asthma to identify treatment barriers and symptom triggers, including comorbidities, improves disease control and the quality of life for many patients considered to have severe asthma, reduces healthcare costs, while optimizing therapy by preventing overtreatment. In addition, the appropriate treatment of associated conditions is an essential step in distinguishing the subgroup of patients with severe biological asthma from the undifferentiated group of patients with difficult-to-treat asthma. This article provides an overview of the main comorbidities likely to be encountered in general practice, their prevalence and clinical impact on severe asthma, and provides a simplified and guideline-based approach to the assessment and management of these comorbid conditions.
Impactul clinic şi managementul comorbidităţilor în astmul sever
Clinical impact and management of comorbidities in severe asthma
First published: 18 octombrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.6.3.2022.7167
Abstract
Rezumat
Pe măsură ce managementul astmului s-a axat din ce în ce mai mult pe gestionarea personalizată a astmului sever, recunoaşterea rolului şi importanţei afecţiunilor comorbide a crescut. La diferite grupe de vârstă, comorbidităţile pot prezenta provocări variate, inclusiv dificultăţi de diagnostic datorate mimării sau exacerbării simptomelor de astm, alături de terapia pentru afecţiunile comorbide care afectează astmul şi viceversa. Astmul este frecvent asociat cu multiple comorbidităţi, care sunt mai des întâlnite la pacienţii cu astm sever decât la cei cu forme uşoare, moderate sau în populaţia generală. Acest grup de pacienţi prezintă exacerbări şi spitalizări frecvente, dar şi absenţe de la locul de muncă, generând costuri ridicate. Deşi unele comorbidităţi sunt cunoscute în mod obişnuit, este posibil ca o parte din ele să rămână nediagnosticate, necesitând o abordare minuţioasă şi investigaţii suplimentare. Astmul şi afecţiunile comorbide au adesea factori de risc comuni care sugerează prezenţa unor căi inflamatorii similare, unde inflamaţia joacă un rol esenţial în apariţia şi dezvoltarea diferitelor comorbidităţi, iar înţelegerea acestor mecanisme implicate este esenţială pentru dezvoltarea unei strategii de tratament eficiente. Evaluarea sistematică a astmului cu potenţial sever în vederea identificării obstacolelor în cursul tratamentului şi a factorilor declanşatori ai simptomelor, inclusiv a comorbidităţilor, îmbunătăţeşte controlul bolii şi calitatea vieţii pentru mulţi pacienţi consideraţi cu astm sever, reduce costurile asistenţei medicale, optimizând în acelaşi timp terapia prin prevenirea tratamentului excesiv. În plus, tratamentul adecvat al afecţiunilor asociate este un pas esenţial în distingerea subgrupului de pacienţi cu astm biologic sever din grupul nediferenţiat de pacienţi care prezintă astm dificil de tratat. Acest articol oferă o prezentare generală a principalelor comorbidităţi susceptibile de a fi întâlnite în practica generală, a prevalenţei şi impactului clinic asupra astmului sever şi oferă o abordare simplificată şi orientativă pentru evaluarea şi gestionarea acestor afecţiuni comorbide.
Introducere
Pacienţii cu astm sever reprezintă o minoritate din populaţia totală cu astm (3-10% dintre aceştia), afecţiunea fiind responsabilă pentru 60% din costurile de asistenţă medicală asociate bolii. Această afecţiune implică o scădere a calităţii vieţii, costuri directe şi indirecte ridicate de asistenţă medicală şi o rată relativ crescută a mortalităţii. Deşi ţinta principală a terapiei este de a ajunge la un control optim al bolii cu minim de medicamente antiastmatice, acest obiectiv poate fi deosebit de dificil de atins la pacienţii cu astm sever (Rogliani et al., 2020). În general, o serie de factori pot determina un control deficitar al bolii, cum ar fi aderenţa scăzută la tratament, factorii de mediu şi comorbidităţile (Porsbjerg & Menzies-Gow, 2017). Astmul este frecvent însoţit de diverse comorbidităţi care îi influenţează intensitatea clinică, severitatea sau controlul (Louis et al., 2022). Pacienţii cu astm prezintă un număr mai mare de comorbidităţi faţă de indivizii sănătoşi şi multiple comorbidităţi pot afecta acelaşi pacient. Fiecare comorbiditate suplimentară este asociată cu o scădere semnificativă a calităţii vieţii din punct de vedere clinic (figura 1) (McDonald et al., 2019; Rogliani et al., 2020). Mai mult decât atât, pacienţii cu risc crescut de exacerbări prezintă o prevalenţă mai mare a comorbidităţilor multiple, care cresc în funcţie de severitatea bolii (Denlinger et al., 2017). Prevalenţa comorbidităţilor la pacienţii astmatici variază de la un studiu la altul şi este ridicată în special la femeile astmatice de vârstă înaintată, la foştii fumători şi la pacienţii cu astm dependent de prednison (Tomisa et al., 2021). Aşadar, o evaluare multidimensională a factorilor de risc, a patogeniei căilor respiratorii, a comorbidităţilor şi a abilităţilor de autogestionare reprezintă un instrument util în managementul astmului (McDonald et al., 2017).
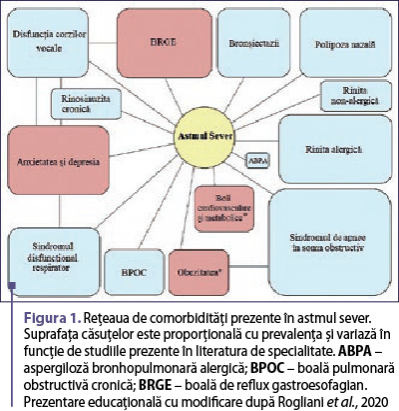
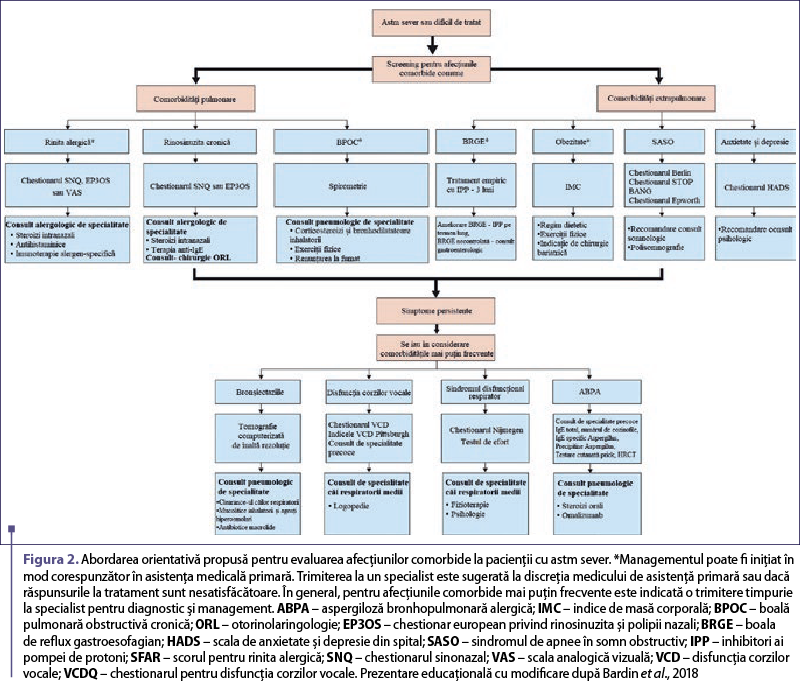
Termenul de comorbiditate se referă la prezenţa uneia sau a mai multor boli ori tulburări care apar concomitent cu o afecţiune sau o tulburare primară, deşi este în principal utilizat pentru a desemna două patologii care se influenţează reciproc (Bardin et al., 2018; Fuhlbrigge et al., 2021). Cu toate acestea, este dificil de a face distincţia între o comorbiditate şi o afecţiune coexistentă. Diferenţa dintre aceste două entităţi constă în faptul că prima contribuie la fiziopatogenia bolii şi duce la exacerbările acesteia, în timp ce cea de-a doua nu o face. Totodată, ambele trebuie să fie identificate şi tratate în mod corespunzător. În cazul astmului, afecţiunile comorbide sunt prezente frecvent, iar acest lucru contribuie la povara simptomelor respiratorii asociate cu afecţiunea primară. Adesea, acestea contribuie la un fenotip mai sever de astm şi dificil de tratat. Pentru a îmbunătăţi managementul şi asistenţa medicală, trebuie luate în considerare aceste afecţiuni concomitente, iar o modalitate de a simplifica acest proces este de a le considera ca fiind un grup de trăsături ale bolii care pot fi remediabile prin tratament, aşa-numitele trăsături tratabile (Agusti et al., 2016). Gestionarea corectă a afecţiunilor comorbide poate îmbunătăţi controlul astmului, reduce sau elimina necesitatea unor medicamente şi poate îmbunătăţi calitatea vieţii pentru mulţi pacienţi cu astm potenţial sever. Gruparea afecţiunilor comorbide în factori legaţi sau nu de căile respiratorii contribuie la simplificarea diagnosticului şi a managementului. Cu toate acestea, aplicarea în practica clinică poate fi dificilă, iar o abordare iterativă, algoritmică, bazată pe identificarea în primul rând a afecţiunilor comorbide comune, poate ajuta clinicienii să diagnosticheze, să redirecţioneze corespunzător şi, acolo unde este posibil, să gestioneze afecţiunile comorbide. Când simptomatologia persistă, se vor lua în considerare condiţiile comorbide mai puţin frecvente (figura 2) (Bardin et al., 2018).
Comorbidităţile de natură pulmonară sau extrapulmonară sunt mai frecvente la pacienţii cu astm sever decât în cazul formelor uşoare, moderate sau în populaţia generală (Gibson et al., 2021; Gaffin et al., 2022). Comorbidităţile pulmonare includ afecţiuni ale tractului respirator superior (sindromul de apnee în somn obstructiv – SASO, rinita alergică şi nonalergică, rinosinuzita cronică, polipoza nazală şi disfuncţia corzilor vocale/obstrucţia laringiană inductibilă) şi afecţiuni ale tractului respirator mediu/inferior (sindromul disfuncţional respirator, boala pulmonară obstructivă cronică – BPOC, bronşectaziile, aspergiloza bronhopulmonară alergică – ABPA şi astmul cu sensibilizare fungică). Comorbidităţile extrapulmonare includ boala de reflux gastroesofagian (BRGE), obezitatea, tulburări psihiatrice (anxietatea şi depresia), boli cardiovasculare şi metabolice (figura 1) (Rogliani et al., 2020; Gibson et al., 2021). Afecţiunile comorbide pot fi, în plus, rezultatul efectelor secundare ale tratamentului astmului sever, cunoscute sub denumirea de comorbidităţi iatrogene, care sunt de obicei legate de utilizarea steroizilor sistemici şi includ obezitatea, osteoporoza, depresia şi BRGE (Chung et al., 2014). Căile patogenetice care asociază astmul şi multe dintre comorbidităţi sunt încă necunoscute, ceea ce explică diagnosticul eronat ca boli legate de tratamentul afecţiunii. Cu toate acestea, astmul şi afecţiunile comorbide au adesea factori de risc şi căi inflamatorii comune care exacerbează boala (Cazzola et al., 2022).
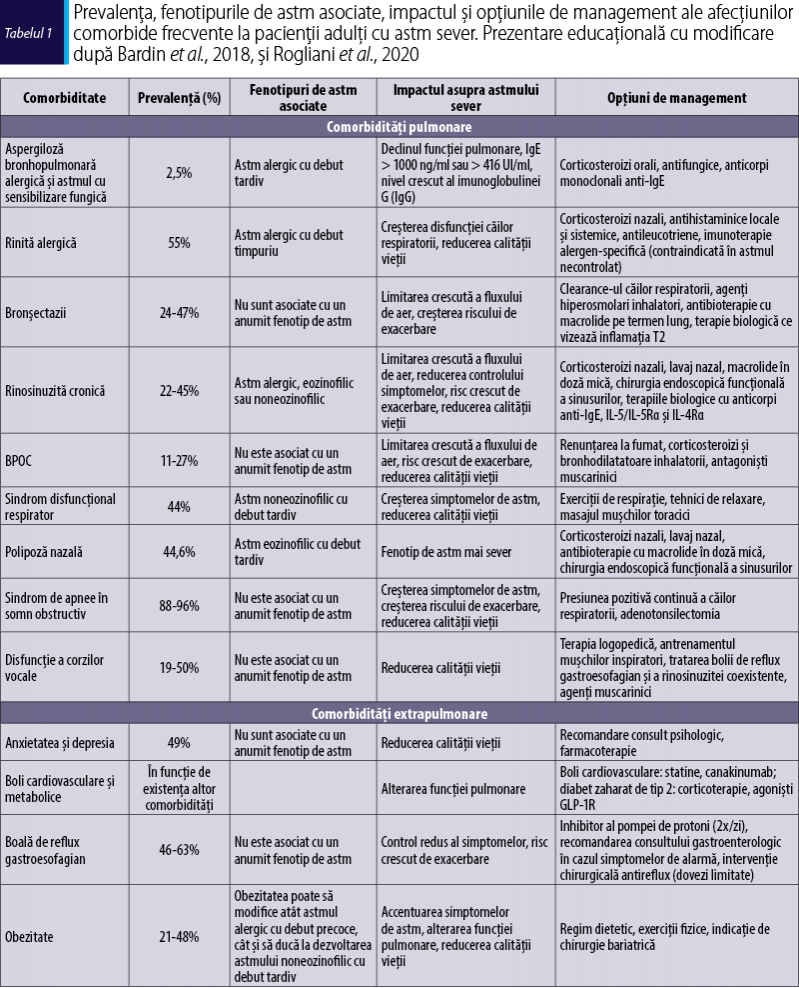
Unele comorbidităţi pot fi mai frecvente în anumite fenotipuri de astm sever, ceea ce poate ghida strategia de evaluare diagnostică, deşi dovezile în acest sens sunt încă limitate. Înţelegerea relaţiilor cauză-efect dintre astmul sever şi comorbidităţile specifice este importantă pentru a prezice impactul unor intervenţii ţintite, la fel ca şi recunoaşterea etiologiei afecţiunii comorbide, care este cauzată de un singur factor, dar care afectează atât astmul, cât şi alte afecţiuni coexistente (tabelul 1). Identificarea şi diagnosticarea comorbidităţilor reprezintă o parte importantă a evaluării sistematice a pacienţilor cu astm potenţial sever. Scopul evaluării sistematice este acela de a face diferenţa între astmul refractar cu adevărat sever şi pacienţii cu astm dificil de controlat, la care simptomele sunt determinate de alţi factori decât astmul, cum ar fi comorbidităţile (Porsbjerg & Menzies-Gow, 2017).
Comorbidităţi pulmonare: afecţiuni ale tractului respirator
Comorbidităţile pulmonare/tractului respirator afectează în mod specific tractul respirator superior şi mijlociu/inferior. Acestea includ afecţiuni ale tractului respirator superior (sindromul de apnee în somn obstructiv, rinita alergică şi nonalergică, rinosinuzita cronică, polipoza nazală şi disfuncţia corzilor vocale/obstrucţia laringiană inductibilă) şi afecţiuni ale tractului respirator mediu/inferior (sindromul disfuncţional respirator, boala pulmonară obstructivă cronică, bronşectaziile, aspergiloza bronhopulmonară alergică şi astmul cu sensibilizare fungică).
Comorbidităţi pulmonare: afecţiuni ale tractului respirator superior
Sindromul de apnee în somn obstructiv (SASO)
Prevalenţă. Această afecţiune este des întâlnită la pacienţii cu astm sever şi obezitate, contribuind la severitatea astmului şi la un control deficitar al bolii (Gaffin et al., 2022; Wang et al., 2022). Prevalenţa acestei afecţiuni poate ajunge până la 96% în cazul astmului sever (Rogliani et al., 2020) şi creşte odată cu severitatea progresivă a astmului (Teodorescu et al., 2015).
Fiziopatogenie. Această comorbiditate are un impact asupra astmului prin mecanisme multiple, deşi interacţiunea dintre cele două entităţi nu este încă pe deplin înţeleasă. Mecanismele potenţiale includ obstrucţia repetată a căilor respiratorii superioare şi hipoxia, care pot induce bronhoconstricţie, inflamaţia căilor respiratorii cu infiltrat predominant neutrofilic, stresul oxidativ şi inflamaţia sistemică. Poate exista, de asemenea, o hiperreactivitate a căilor respiratorii mediată vagal, secundară colapsului căilor respiratorii superioare. De asemenea, SASO determină modificări mecanice ale toracelui şi ale presiunilor intratoracice, care afectează tonusul bronşic (Bardin et al., 2018).
Simptome şi diagnostic. În mod similar cu obezitatea, asocierea dintre simptomele severe de astm şi SASO este bidirecţională. Această afecţiune comorbidă poate induce sau mima simptomele astmului şi, similar, astmul poate creşte riscul de SASO, independent de obezitate. Pacienţii cu cele două afecţiuni coexistente sunt mai predispuşi la a prezenta simptome de astm, în ciuda controlului concomitent al altor factori, cum ar fi obezitatea, afecţiunile nazale şi BRGE. Totodată, simptomele astmului nocturn pot exacerba sindromul de apnee în somn şi pot contribui la perturbarea somnului (Teodorescu et al., 2015).
Pacienţii cu astm sever trebuie supuşi unui screening de rutină pentru această afecţiune comorbidă. Screeningul este deosebit de important pentru pacienţii cu astm, supraponderali sau cu afecţiuni nazale comorbide, deoarece aceşti pacienţi prezintă un risc mai mare de a dezvolta sindrom de apnee în somn. Chestionarul Epworth, Standford, STOP BANG sau chestionarul Berlin sunt instrumente validate şi disponibile în practica clinică (Porsbjerg & Menzies-Gow, 2017; Chiang, 2018). Polisomnografia este standardul de aur pentru diagnosticarea acestei afecţiuni, iar ca alternativă în cazul în care polisomnografia nu este disponibilă, pulsoximetria nocturnă poate fi, de asemenea, utilizată ca instrument de screening. Cu toate acestea, trebuie remarcat faptul că o proporţie semnificativă dintre pacienţii cu această comorbiditate din populaţia cu astm sever pot să nu prezinte simptome clasice de apnee în somn, iar SASO poate fi trecut cu vederea (Porsbjerg & Menzies-Gow, 2017).
Conduită terapeutică. Tratamentele de primă linie care includ presiunea pozitivă continuă a căilor respiratorii (CPAP) şi adenotonsilectomia au rol benefic asupra controlului şi calităţii vieţii la pacienţii cu astm şi SASO concomitent, în special la cei cu astm sever sau greu de controlat (Wang et al., 2022). Terapia CPAP reduce nivelurile unor biomarkeri inflamatori, dar fără modificări asupra hiperreactivităţii bronşice (Cazzola et al., 2022).
Impactul asupra astmului. SASO este o afecţiune comună şi un factor de risc modificabil pentru controlul deficitar al astmului sever. Această comorbiditate reduce calitatea vieţii, agravează simptomele, creşte rata de exacerbare şi necesită a fi exclusă la pacienţii cu risc (indice de masă corporală crescut, istoric de sforăit, somnolenţă diurnă sau episoade de apnee observate) (Teodorescu et al., 2015; Rogliani et al., 2020).
Rinita alergică şi nonalergică
Prevalenţă. Mai mult de jumătate dintre pacienţii cu astm sever asociază rinită alergică, cu o incidenţă crescută chiar şi în astmul nonalergic (Shaw et al., 2015). Sensibilizarea la alergene perene creşte semnificativ predispoziţia dezvoltării astmului, faţă de sensibilizarea la alergenele sezoniere. Prevalenţa rinitei nonalergice şi alergice este de 15%, respectiv 55% în populaţia cu astm sever (Rogliani et al., 2020). Pacienţii cu astm alergic cu debut precoce tind să aibă o asociere clară între expunerea la alergene şi simptome, iar severitatea rinitei alergice este adesea proporţională cu cea a astmului (Porsbjerg & Menzies-Gow, 2017).
Fiziopatogenie. Inflamaţia indusă de alergene, secreţiile postnazale, reflexul nazobronhial şi răspunsul imun sistemic pot cauza o afecţiune iniţială a căilor respiratorii superioare, care modulează inflamaţia căilor respiratorii inferioare. O astfel de condiţie este prezentă atât în rinita nonalergică, cât şi în cea alergică şi poate explica corelaţia fermă cu astmul (Cazzola et al., 2022). Majoritatea pacienţilor cu astm asociază manifestări de rinită alergică sezonieră sau perenă, care se manifestă predominant printr-un răspuns imun de tip 2 (T2). Astmul şi rinita alergică prezintă factori declanşatori comuni, cu fiziopatogenie asemănătoare, care se caracterizează prin infiltrate inflamatorii celulare. Căile respiratorii superioare şi inferioare au aceleaşi caracteristici anatomice, funcţionale, clinice şi imunologice, inclusiv aceeaşi reţea limfoidă, reacţionând astfel la aeroalergene prin activarea unor celule efectoare similare. Astfel, ambele sunt mediate de imunoglobulina (Ig) E, induse de alergene şi care au căi inflamatorii şi fiziopatogenice comune. Alte mecanisme ale interacţiunii includ dezechilibrul autonom prin modificări ale tonusului neuronal la nivelul ţesuturilor efectoare, astfel că stimularea neuronală la nivel nazal poate duce la eliberarea de neurotransmiţători colinergici şi la contracţia musculaturii netede la nivel pulmonar. De asemenea, eliberarea de neuropeptide, interacţiunea cu celulele de recrutare şi creşterea expunerii căilor respiratorii inferioare la agenţii patogeni din aer sunt implicate în patogeneza celor două afecţiuni (Stachler, 2015).
Simptome şi diagnostic. Deoarece rinita şi astmul tind să coexiste, ghidurile subliniază importanţa investigării de rutină a prezenţei astmului la pacienţii cu rinită persistentă şi, respectiv, evaluarea rinitei alergice comorbide la pacienţii cu astm, în special în cazul formelor severe. Diagnosticul de rinită alergică este bazat pe simptomatologia aferentă examenului anamnestic şi obiectiv. Anamneza pacientului trebuie să acorde o atenţie deosebită expunerilor la mediul înconjurător, cu accent pe factorii precipitanţi şi pe impactul simptomelor asupra calităţii vieţii (Egan et al., 2015). Există chestionare validate, cu specificitate şi sensibilitate ridicate care includ scorul total al simptomelor nazale (SNQ) şi chestionarul sinonazal (SFAR), care pot fi utilizate pentru a oferi o evaluare obiectivă. Scala analogică vizuală (VAS) a fost validată pentru severitatea simptomatologiei şi evaluarea răspunsului la tratament în rinita alergică (Kirtsreesakul et al., 2020). Sensibilizarea la alergenele suspectate poate fi evaluată prin determinarea anticorpilor IgE specifice sau prin testare cutanată prick. Testarea in vitro a IgE serice alergen-specifice poate fi efectuată la pacienţii care nu pot realiza teste cutanate din cauza dermatografismului sau a utilizării recente de antihistaminice orale. Cu toate acestea, rezultatele unor astfel de teste faţă de alergene pot fi dificil de interpretat la pacienţii cu astm şi pot reflecta pur şi simplu expunerea, mai degrabă decât cauza simptomelor. De assemenea, pacienţii cu simptome de rinită alergică au adesea o funcţie pulmonară redusă la efectuarea spirometriei (Egan et al., 2015; Bardin et al., 2018)
Conduită terapeutică. Managementul rinitei alergice coexistente îmbunătăţeşte controlul astmului şi reduce utilizarea resurselor de asistenţă medicală. Rinita alergică în astmul sever este tratată în mod similar, ca şi în formele uşoare sau moderate, cu steroizi intranazali ca primă linie de tratament la pacienţii cu simptome persistente, eventual combinaţi cu antihistaminice locale şi sistemice, în funcţie de severitatea simptomelor (Porsbjerg & Menzies-Gow, 2017). Deşi simptomele nazale sunt ameliorate de corticosteroizii intranazali, această terapie nu ameliorează întotdeauna simptomele astmului. Terapia optimă cu corticosteroizi inhalatori (CSI) şi/sau antihistaminice de a doua generaţie la pacienţii cu astm şi rinită alergică este esenţială pentru scăderea riscului de apariţie a exacerbărilor (Massoth et al., 2019). Totodată, antileucotrienele pot fi luate în considerare ca tratament antiastmatic care vizează atât căile respiratorii superioare, cât şi pe cele inferioare, la pacienţii cu astm sever şi rinită alergică. Terapia biologică anti-IgE reprezintă o alternativă la pacienţii cu astm sever şi sensibilizare la aeroalergene perene, cu îmbunătăţirea simptomelor şi reducerea hiperreactivităţii bronşice (Rogliani et al., 2020).
Impactul asupra astmului. Pacienţi cu rinită alergică şi astm sever prezintă o calitate a vieţii redusă, o disfuncţie mai mare a căilor respiratorii, cu persistenţa simptomelor şi utilizarea frecventă a asistenţei medicale. De asemenea, asociază utilizarea crescută de CSI şi bronhodilatatoare (Bardin et al., 2018).
Rinosinuzita cronică şi polipoza nazală
Prevalenţă. Rinosinuzita cronică cu polipoză nazală, un subgrup de rinosinuzită cronică de o importanţă crescândă, se caracterizează prin afectarea calităţii vieţii, o povară remarcabilă a simptomelor, o recurenţă/recidivă frecventă şi o afectare olfactivă supărătoare şi dificil de tratat. Incidenţa rinosinuzitei cronice în rândul pacienţilor cu astm variază între 22% şi 45%, iar 20% din acest grup de pacienţi asociază şi polipoză nazală. Totodată, prezenţa polipilor nazali în astmul sever este de 44,6% (Rogliani et al., 2020). Rinosinuzita cronică cu polipi nazali se asociază frecvent cu astmul şi rinita alergică, însă mecanismele celulare şi moleculare care contribuie la simptomele clinice nu sunt pe deplin înţelese. De asemenea, se poate asocia cu alte comorbidităţi ale astmului, cum ar fi depresia, obezitatea şi disfuncţia corzilor vocale. Prezenţa rinosinuzitei cronice cu sau fără polipi nazali poate fi asociată cu mecanisme atât alergice, cât şi nonalergice şi poate creşte riscul de astm indus de aspirină la persoanele astmatice cu debut tardiv (Cazzola et al., 2022).
Fiziopatogenie. Rinosinuzita cronică cu polipi nazali şi astmul sever au în comun mecanisme‑cheie fiziopatogenice, inclusiv inflamaţia de tip 2 cu secreţie de interleukină (IL)-5, IL-4, IL-13, eozinofile şi IgE (Mümmler et al., 2021). Sinuzita este, de asemenea, asociată cu bronhoconstricţie, care este posibil susţinută de reflexe modulate la nivel faringian, prin intermediul receptorilor extratoracici (Rogliani et al., 2020).
Simptome şi diagnostic. Rinosinuzita cronică pare a fi un marker al astmului sever în sine. Există o corelaţie între nivelul de inflamaţie din căile respiratorii superioare şi inferioare ale pacienţilor cu cele două afecţiuni coexistente, dar nu este clar în ce măsură rinosinuzita cronică afectează căile respiratorii inferioare, de exemplu prin intermediul secreţiilor postnazale. Pacienţii cu astm necontrolat şi rinosinuzită cronică raportează mai multe simptome, în special de expectoraţie şi tuse, prezentând un risc crescut de exacerbări ale astmului (Porsbjerg & Menzies-Gow, 2017).
Conduită terapeutică. Tratamentul chirurgical sau medicamentos cu corticosteroizi nazali îmbunătăţeşte controlul astmului, calitatea vieţii şi funcţia pulmonară (Cao et al., 2019). Utilizarea corticoterapiei orale (CSO) la pacienţii cu astm sever care asociază această afecţiune comorbidă determină un risc semnificativ de efecte secundare. Terapiile biologice care includ anticorpi anti-IgE, IL-5/IL-5Rα şi IL-4Rα au revoluţionat tratamentul astmului sever şi s-au dovedit a fi eficiente şi în cazul rinosinuzitei cronice comorbide, forma severă (Rogliani et al., 2020; Mümmler et al., 2021).
Impactul asupra astmului. Rinosinuzita cronică este un factor predictor independent al exacerbărilor astmului sever şi reduce controlul simptomelor şi calitatea vieţii (Cazzola et al., 2022). În plus, prezenţa polipilor nazali este asociată cu un fenotip de astm mai sever (Kaplan et al., 2020; Rogliani et al., 2020).
Disfuncţia corzilor vocale/obstrucţia laringiană inductibilă
Prevalenţă. Disfuncţia corzilor vocale, denumită în prezent obstrucţia laringiană inductibilă, este definită ca fiind o mişcare paradoxală a corzilor vocale, un reflex laringian hiperfuncţional care are ca rezultat adducţia corzilor vocale, cu consecinţa limitării fluxului de aer. Diagnosticul acestei afecţiuni poate reprezenta o adevărată provocare, deoarece este o condiţie episodică şi dinamică, ce poate fi greu de provocat în momentul examinării şi are o prevalenţă care variază între 19% şi 50%, în funcţie de severitate. Adesea este un factor de confuzie şi poate conduce în mod eronat la diagnosticarea unui astm dificil de tratat (Rogliani et al., 2020, Cazzola et al., 2022).
Fiziopatogenie. Cauzele acestei afecţiuni sunt probabil multifactoriale. Potenţialii factori declanşatori sunt reprezentaţi de afecţiuni care duc la creşterea sensibilităţii laringelui, cum ar fi secreţiile postnazale, refluxul gastroesofagian şi infecţiile respiratorii (Rogliani et al., 2020; Gibson et al., 2021).
Simptome şi diagnostic. Pacienţii pot prezenta senzaţie de strângere a gâtului (senzaţie de globus), stridor, disfonie, wheezing, dispnee şi tuse, simptome comune astmului. De asemenea, acest grup de pacienţi pot experimenta adesea episoade de dispnee cu debut şi final definite, dar care nu răspund la bronhodilatatoare. Persoanele cu obstrucţie laringiană indusă de exerciţii fizice prezintă frecvent simptome la cel mai mic nivel de efort. Deoarece unele simptome se suprapun cu cele ale astmului, depistarea şi tratamentul acestora pot reduce riscul de spitalizare, de supramedicaţie şi costurile legate de sănătate (Cazzola et al., 2022). Testele de bază, cum ar fi spirometria şi testele de bronhodilataţie, sunt adesea normale şi au o valoare predictivă scăzută pentru diagnosticul afecţiunii. Curbele flux–volum demonstrează adesea aplatizarea curbei inspiratorii după efectuarea testului de provocare la metacolină. Cu toate acestea, specificitatea acestei constatări pentru respectiva afecţiune este limitată. Indexul disfuncţiei corzilor vocale (VCD) Pittsburgh are valoare predictivă bună de diagnostic (scorul cut-off ≥ 4) şi poate fi util pentru a face distincţia dintre obstrucţia laringiană inductibilă şi astm. Chestionarul pentru disfuncţia corzilor vocale (VCDQ) poate fi utilizat pentru a evalua răspunsul la tratament. Laringoscopia este instrumentul standard de diagnosticare a obstrucţiei laringiene inductibile, cu vizualizarea directă a mişcărilor paradoxale ale corzilor vocale. Totodată, această metodă poate prezenta rezultate fals negative când este efectuată în timpul unui interval fără exacerbări. Pacienţii cu un control deficitar al astmului, exacerbări frecvente sau wheezing cronic în repaus, în ciuda utilizării de bronhodilatatoare inhalatorii, necesită a fi investigaţi pentru această comorbiditate (Tiotiu et al., 2018).
Conduită terapeutică. Terapia logopedică este considerată piatra de temelie a tratamentului în obstrucţia laringiană inductibilă. Steroizii nazali ameliorează simptomatologia la pacienţii care asociază rinită cronică, iar pacienţii cu reflux gastroesofagian pot beneficia de medicaţia antiacidă. Agenţii antimuscarinici s-au dovedit a fi benefici şi sunt în curs de cercetare. Supraglotoplastia este uneori recomandată pentru obstrucţiile limitate la structurile supraglotice. O serie de tratamente comportamentale sunt menţionate în literatura de specialitate şi includ tehnici vizuale de biofeedback în timpul episoadelor bolii, antrenamentul muşchilor inspiratori şi sănătate comportamentală/psihoterapie (Gibson et al., 2021).
Comorbidităţi pulmonare: afecţiuni ale tractului respirator mediu/inferior
Sindromul disfuncţional respirator
Prevalenţă. Sindromul disfuncţional respirator cuprinde un grup de tulburări în care există o schimbare persistentă a ritmului respirator biomecanic, determinând simptome pulmonare şi extrapulmonare care duc la disconfort psihic (Gibson et al., 2021). La pacienţii cu astm, incidenţa acestei afecţiuni este de aproximativ 30%, iar în populaţia cu astm sever este de 44% (Rogliani et al., 2020; Gibson et al., 2021).
Fiziopatogenie. Mecanismele fiziopatogenice sunt puţin cunoscute şi pot fi legate de hipocapnie, de asincronia respiraţiei toraco-abdominale sau de hiperventilaţie. Hiperreactivitatea bronşică poate fi prezentă în această afecţiune din cauza hiperventilaţiei, care favorizează hipocapnia şi duce la creşterea rezistenţei căilor respiratorii la pacienţii astmatici. În plus, stresul poate provoca bronhoconstricţie fie în mod direct prin stimulare vagală, fie prin creşterea sensibilităţii calibrului căilor respiratorii la indivizii susceptibili (Cazzola et al., 2022).
Simptome şi diagnostic. Cele mai frecvente simptome sunt dispneea (de repaus şi în timpul exerciţiilor fizice), durerea şi constricţia toracică, căscatul excesiv, oftatul profund şi hiperventilaţia. Acestea apar în absenţa unei anomalii organice şi adesea în prezenţa unei funcţii pulmonare normale. Deoarece simptomele afecţiunii pot mima sau pot fi confundate cu cele ale astmului, acestea pot duce la diagnosticarea eronată a bolii şi chiar la supratratament (Rogliani et al., 2020; Cazzola et al., 2022). Chestionarul Nijmegen poate fi utilizat ca screening pentru identificarea simptomelor, fiind cel mai utilizat pe scară largă, în ciuda faptului că a fost validat iniţial pentru pacienţii cu hiperventilaţie indusă de efort. Testul la efort poate fi utilizat pentru a evalua modelul de respiraţie şi nivelurile de dioxid de carbon în timpul activităţii – cu toate acestea, nu au fost definite standarde precise pentru identificarea acestei afecţiuni în timpul efortului (Porsbjerg & Menzies-Gow, 2017).
Conduită terapeutică. Tehnicile de respiraţie ameliorează simptomele respiratorii, dar fără beneficii semnificative asupra funcţiei pulmonare. Asocierea acestor tehnici de respiraţie cu masajul muşchilor toracici (metoda Lotorp) poate ameliora simptomele şi poate îmbunătăţi fluxul expirator maxim (PEF), dar nu şi volumul expirator forţat în prima secundă (FEV1) (Lowhagen et al., 2014). De cele mai multe ori, sindromul disfuncţional respirator nu răspunde la terapia antiastmatică.
Impactul asupra astmului. Coexistenţa dintre astm şi sindromul disfuncţional respirator determină un control slab al astmului şi o calitate a vieţii mai scăzută faţă de persoanele doar cu astm. Femeile prezintă un risc mai mare, iar la pacienţii astmatici care asociază această afecţiune comorbidă creşte probabilitatea de a dezvolta multiple comorbidităţi, cum ar fi sinuzita, anxietatea, depresia, obezitatea şi episoade acute şi frecvente de astm (Denton et al., 2019; Rogliani et al., 2020; Gibson et al., 2021).
Boala pulmonară obstructivă cronică (BPOC)
Prevalenţă. Coexistenţa dintre astm şi BPOC este reprezentată de prezenţa unor entităţi care includ endotipuri şi fenotipuri diferite, care se află sub denumirea sindromului de suprapunere astm-BPOC (ACO). Ghidurile definesc ACO ca fiind o afecţiune clinică ce este caracterizată printr-o limitare persistentă a fluxului de aer cu caracteristici asociate atât de astm, cât şi de BPOC şi cu o prevalenţă între 11% şi 27% în cazul astmului sever (Cazzola et al., 2022).
Fiziopatogenie. O mare parte dintre pacienţii cu astm sever, de obicei fumători, prezintă obstrucţie fixă a căilor respiratorii, în principal din cauza remodelării căilor respiratorii, care asociază un model neutrofilic şi rezistenţă la corticosteroizi, similar cu BPOC. Pe de altă parte, există mulţi pacienţi cu BPOC care au o bună reversibilitate a obstrucţiei şi un număr crescut de eozinofile, ca urmare pot fi confundaţi cu pacienţii astmatici. Pacienţii cu ACO au o capacitate de difuzie mai slabă şi concentraţii mai mari de neutrofile şi IL-6 în comparaţie cu nefumătorii (Rogliani et al., 2016; Cazzola et al., 2016).
Simptome şi diagnostic. Există pacienţi, în special vârstnici, care prezintă caracteristici ale ambelor boli, unde prezentările astmului şi ale BPOC pot converge şi se pot mima reciproc, ceea ce face dificilă diagnosticarea acestor pacienţi cu oricare dintre aceste afecţiuni (Rogliani et al., 2016; Cazzola et al., 2016).
Conduită terapeutică. În cazul în care se suspectează un diagnostic concomitent de astm şi BPOC, farmacoterapia trebuie să urmeze în primul rând liniile directoare privind astmul, dar pot fi necesare şi abordări farmacologice şi nonfarmacologice pentru BPOC. Renunţarea la fumat este esenţială, iar CSI şi bronhodilatatoarele cu durată lungă de acţiune (LABA) reprezintă principalul tratament. Asocierea antagoniştilor muscarinici cu durată lungă de acţiune (LAMA) cu tiotropium la terapia combinată CSI/LABA a arătat o îmbunătăţire a funcţiei pulmonare şi o reducere a riscului de exacerbări (Leung et al., 2017).
Impactul asupra astmului. În general, pacienţii cu astm şi BPOC coexistent se confruntă cu rate mai mari de exacerbări şi mortalitate, cu o creştere a utilizării asistenţei medicale şi cu reducerea calităţii vieţii (Rogliani et al., 2020).
Bronşectaziile
Prevalenţă. Bronşectaziile se pot dezvolta ca urmare a unei afecţiuni pulmonare cronice şi pot fi rezultatul unui astm necontrolat pe termen lung (García-Clemente et al., 2020). Incidenţa lor este mai mare la persoanele în vârstă şi la fumători. Prevalenţa bronşectaziilor este semnificativ mai mare în cazul astmului sever, cu o valoare medie de 36,6%, comparativ cu 3% în formele uşoare de boală (Bardin et al., 2018; Zhang et al., 2021).
Fiziopatogenie. Inflamaţia bronşică necontrolată provoacă hipersecreţie de mucus şi leziuni locale ale mucoasei, culminând cu anomalii anatomice tipice bronşectaziei (García-Clemente et al., 2020). Inflamaţia neutrofilică a căilor respiratorii în contextul astmului poate provoca leziuni epiteliale, iar dezechilibrele dintre proteaze (în special elastază neutrofilică) şi antiproteaze pot induce chiar leziuni ale ţesutului pulmonar (Chung et al., 2017; Polverino et al., 2017). Acest profil patogenic este exacerbat de clearance-ul mucociliar alterat, ducând la leziuni suplimentare şi la remodelarea căilor respiratorii. Asociat, infecţiile recurente ale căilor respiratorii şi secreţiile bronşice crescute pot duce la limitarea fluxului de aer, cu exacerbarea sau agravarea simptomelor de bază ale astmului (Imam et al., 2020; Cazzola et al., 2020). Bronşectazia asociată astmului prezintă cel puţin două fenotipuri: bronşectazia eozinofilică şi bronşiolita cronică infecţioasă. Adesea, legătura directă între inflamaţia T2 şi bronşectazii nu poate fi exclusă sau confirmată. Eozinofilele provocă leziuni ale ţesutului bronşic prin degranulare şi producerea de enzime precum neurotoxina derivată din eozinofile, proteina cationică a eozinofilelor (ECP), peroxidaza eozinofilelor şi proteina bazică majoră. Această cale induce producerea de alarmine, cum ar fi IL-25, IL-33 şi limfopoietina timică stromală, de către celulele epiteliale bronşice (Crimi et al., 2021). La rândul lor, alarminele activează celulele limfoide înnăscute de tip 2 pentru a produce IL-5, IL-4 şi IL-13, ceea ce duce la un cerc vicios, cu recrutarea şi activarea în continuare a eozinofilelor, producţia de mucus şi dezvoltarea fibrozei subepiteliale, cu remodelarea căilor respiratorii.
Simptome şi diagnostic. Grupul de pacienţi cu cele două afecţiuni coexistente prezintă un raport mai mic între FEV1 şi capacitatea vitală forţată (CVF), exacerbări mai frecvente decât la cei care suferă doar de astm, fără diferenţe semnificative în ceea ce priveşte sexul, durata bolii sau nivelul IgE seric între pacienţii astmatici cu sau fără bronşectazii (Cazzola et al., 2022). La pacienţii cu astm sever care prezintă semne clinice de bronşectazie, cum ar fi tuse cu expectoraţie cronică sau infecţii recurente care necesită antibioterapie, tomografia computerizată de înaltă rezoluţie (HRCT) trebuie luată în considerare, fiind modalitatea de elecţie în diagnosticul bronşectaziilor.
Conduită terapeutică. Managementul bolii se axează pe îmbunătăţirea clearance-ului căilor respiratorii prin fizioterapie, inhalaţii cu agenţi hiperosmolari şi prin reducerea inflamaţiei căilor respiratorii. Terapia pe termen lung cu macrolide s-a dovedit a fi bine tolerată şi eficientă în tratamentul astmului noneozinofilic predispus la exacerbări şi se recomandă când cele două entităţi coexistă. Terapiile biologice care vizează inflamaţia T2 pot fi luate în considerare la pacienţii cu bronşectazie şi astm sever (Carpagnano et al., 2019).
Aspergiloza bronhopulmonară alergică (ABPA) şi astmul sever cu sensibilizare fungică
Prevalenţă. Aspergiloza bronhopulmonară alergică şi astmul sever cu sensibilizare fungică reflectă sindroame pulmonare alergice severe, cauzate de obicei de expunerea la Aspergillus fumigatus sau la alţi fungi. Sensibilizarea la Aspergillus în astmul sever, în absenţa altor caracteristici ale acestei afecţiuni comorbide, este cunoscută sunt denumirea de astm sever cu sensibilizare fungică. Deşi este o afecţiune relativ rară, ratele de prevalenţă pot ajunge până la 2,5% în cazul astmului sever (Denning et al., 2013).
Fiziopatogenie. Această afecţiune este considerată o reacţie de hipersensibilitate care acţionează prin intermediul căii limfocitelor T de tip 2 (Th2), observată în principal ca o complicaţie a astmului. Răspunsurile celulelor Th2 CD4+ la antigenele de Aspergillus pot fi observate în lavajul bronhoalveolar şi la nivel sistemic (Bardin et al., 2018).
Simptome şi diagnostic. Criteriile de diagnostic pentru astmul sever cu sensibilizare fungică includ: condiţie predispozantă cum ar fi astmul, testarea cutanată pozitivă pentru Aspergillus sau niveluri detectabile de IgE faţă de A. fumigatus, nivel IgE seric total crescut (>1 000 UI/mL) şi una dintre următoarele: anticorpi serici faţă de A. fumigatus, opacităţi pulmonare radiologice sau un număr total de eozinofile de peste 500 celule/µL (Agarwal et al., 2013).
Conduită terapeutică. Managementul acestei afecţiuni coexistente are ca scop reducerea inflamaţiei căilor respiratorii. Tratamentul-cheie este reprezentat de CSO pe termen lung, iar asocierea agenţilor antifungici reduce necesarul de CSO (Bardin et al., 2018; Rogliani et al., 2020). În unele cazuri, terapia cu anticorpi monoclonali anti-IgE cu omalizumab s-a dovedit a fi eficientă în ABPA şi se recomandă la pacienţii cu reducere semnificativă a IgE totale după iniţierea tratamentului (Voskamp et al., 2015).
Impactul asupra astmului. ABPA poate avea un impact semnificativ asupra astmului şi ar trebui inclusă în categoria comorbidităţilor evaluate în cazul astmului dificil de tratat. Pacienţii cu cele două entităţi coexistente raportează frecvent simptome cronice, astfel încât ABPA poate contribui la un controlul slab al astmului şi este un factor de risc pentru pierderea accelerată a funcţiei pulmonare (Greenberger et al., 2014). Pe de altă parte, declinul funcţiei pulmonare a fost identificat ca un factor de risc pentru dezvoltarea ABPA. Debutul tardiv al astmului şi, surprinzător, absenţa afecţiunilor atopice coexistente, cum ar fi eczema atopică şi rinita alergică, sunt asociate cu un risc crescut de dezvoltare ulterioară a ABPA (Tay et al., 2016).
Comorbidităţi extrapulmonare
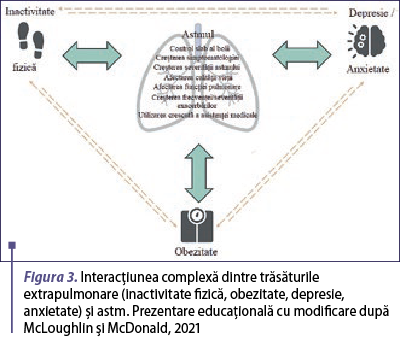
Există o serie de comorbidităţi extrapulmonare, care afectează în mod independent evoluţia astmului. Acest lucru evidenţiază importanţa strategiilor individualizate de gestionare a bolii care să privească dincolo de sistemul pulmonar. În cazul astmului sever, s-a demonstrat că inactivitatea fizică, obezitatea, simptomele de anxietate şi depresie şi inflamaţia sistemică sunt asociate în mod independent cu o afectare mai mare a calităţii vieţii. Având în vedere interrelaţia dintre aceste trăsături extrapulmonare (figura 3), nu este surprinzător faptul că ele coexistă adesea la persoanele cu astm, cu efecte dăunătoare adiţionale. Astfel, inactivitatea fizică este un factor de risc bine cunoscut pentru obezitate şi este asociată cu niveluri crescute de anxietate şi depresie, în timp ce persoanele cu obezitate au mai puţine şanse de a desfăşura activităţi fizice, întreţinând acest cerc vicios. Asemănător, persoanele cu comorbidităţi psihiatrice sunt mai puţin active din punct de vedere fizic, ceea ce poate contribui la creşterea în greutate (McLoughlin & McDonald, 2021).
Boala de reflux gastroesofagian (BRGE)
Prevalenţă. Prevalenţa refluxului gastroesofagian este cuprinsă între 46% şi 63% la pacienţii cu astm sever, comparativ cu 21% în cazul formelor uşoare până la moderate (Rogliani et al., 2020).
Fiziopatogenie. Obstrucţia căilor respiratorii poate cauza presiuni pleurale negative care cresc gradientul de presiune între cavitatea toracică şi cea abdominală, favorizând apariţia refluxului. Pe de altă parte, această afecţiune poate provoca simptome de astm în mod direct prin efectele sale asupra hiperreactivităţii bronşice şi indirect prin inflamaţia indusă de aspiraţie. Microaspiraţia acidului gastric la nivelul căilor respiratorii poate provoca constricţia acestora, fie direct prin activarea unui răspuns vagal care favorizează bronhoconstricţia, fie indirect prin inducerea unei modificări inflamatorii cronice care în cele din urmă contribuie la creşterea reactivităţii din căile respiratorii (Cazzola et al., 2022). Expunerea celulelor epiteliale bronşice la un amestec de pepsină, pH acid şi acizi biliari induce perturbări structurale, creşte permeabilitatea, secreţia de IL-33, eliberează mediatori inflamatori şi modifică expresia genică pentru o varietate de procese biologice (Perotin et al., 2022). Astfel, această comorbiditate poate juca un rol important în creşterea expunerii mucoasei subepiteliale a căilor respiratorii la alergene şi microorganisme patogene, crescând probabilitatea inflamaţiei şi a exacerbărilor.
Simptome şi diagnostic. Majoritatea pacienţilor prezintă dispepsie şi pirozis, însă o bună parte dintre pacienţi rămân asimptomatici. La pacienţii cu astm, BRGE comorbidă se suspectează atunci când simptomele de astm se agravează după ingestia unor alimente (cum ar fi ciocolata, alcoolul, menta, cafeaua etc.) sau dacă pacienţii prezintă tuse sau wheezing după consumul de băuturi, alimente acide sau după o masă copioasă. Alte simptome care ar putea indica o BRGE coexistentă includ disfonia, predominanţa simptomelor nocturne, pirozis şi regurgitare care survin la schimbarea poziţiei şi apariţia inexplicabilă a eroziunii dentare (Kaplan et al., 2020). Această afecţiune reprezentă o provocare de diagnosticare, deoarece poate avea simptome atipice sau extraesofagiene, cum ar fi tusea cronică, laringita şi durerea toracică noncardiacă. Pentru a confirma diagnosticul de BRGE ca fiind o afecţiune comorbidă, se recomandă efectuarea unor investigaţii specifice de evaluare, precum monitorizarea pH-ului şi/sau endoscopia gastroesofagiană (Ullmann et al., 2018).
Conduită terapeutică. Managementul afecţiunii cuprinde modificări ale stilului de viaţă, inclusiv pierderea în greutate, reducerea consumului de alcool şi renunţarea la fumat, care pot ajuta la gestionarea bolii. În plus, ridicarea capului patului sau sfătuirea pacientului de a nu sta culcat un interval de 2-3 ore după ce a mâncat poate ajuta la reducerea simptomelor de reflux. Medicaţia antiastmatică poate induce sau agrava această afecţiune, creând astfel un potenţial cerc vicios. Teofilina, albuterolul şi bronhodilatatoarele pot scădea tonusul sfincterului esofagian inferior, ceea ce duce la creşterea gradului de reflux. Similar, corticosteroizii sistemici pot creşte producţia de acid gastric, iar CSI pot duce la disfonie similară cu cea cauzată de BRGE (Kaplan et al., 2020). Tratamentul empiric cu inhibitori ai pompei de protoni (IPP) de două ori pe zi este pasul iniţial recomandat la pacienţii cu simptome de reflux. Nu există dovezi care să arate că tratamentul medicamentos la pacienţii cu reflux silenţios îmbunătăţeşte controlul astmului, în schimb tratamentul chirurgical al afecţiunii pare să reducă utilizarea medicamentelor antiastmatice (Rogliani et al., 2020).
Impactul asupra astmului. Această afecţiune coexistentă este asociată cu un control slab al simptomelor şi este un factor de risc pentru exacerbările astmului sever.
Obezitatea
Prevalenţă. În ultimele decenii, prevalenţa în creştere a obezităţii şi a astmului a fost direct proporţională, existând o asociere bidirecţională între cele două entităţi, care par a se potenţa reciproc. Prevalenţa astmului la persoanele supraponderale/cu obezitate depăşeşte 50%, în asociere strânsă cu valoarea IMC. De asemenea, obezitatea creşte riscul de astm la femei (Cazzola et al., 2020).
Fiziopatogenie. Printre factorii fiziologici care pot fi implicaţi se numără disfuncţia metabolică şi a microbiomului, inflamaţia locală şi sistemică legată de obezitate, predispoziţia genetică, sarcina/creşterea stresului mecanic asupra plămânilor şi modificările hormonale. De asemenea, factorii legaţi de stilul de viaţă, inclusiv calitatea scăzută a alimentaţiei, inactivitatea fizică şi supranutriţia, contribuie la acest mecanism inflamator (McLoughlin & McDonald, 2021). Hormonii sexuali feminini joacă un rol în etiologia astmului, obezitatea având un impact asupra nivelului de estrogen, care poate influenţa tranziţia de la un răspuns T1 la un răspuns T2 (Keselman et al., 2015). De asemenea, obezitatea poate influenţa inflamaţia căilor respiratorii prin alte mecanisme decât procesele alergice tipice mediate-IgE (McLoughlin & McDonald, 2021). O masă tisulară crescută în peretele toracic şi abdomen determină efecte mecanice directe asupra plămânilor şi poate determina hiperreactivitate bronşică sau poate agrava în mod direct simptomele astmului (Cazzola et al., 2013; Rogliani et al., 2020).
Conduită terapeutică. Persoanele cu obezitate au un răspuns redus la terapia antiastmatică. În ciuda acestui fapt, ghidurile de management al astmului nu diferenţiază în prezent alegerile sau dozele de medicaţie farmacoterapeutică pentru persoanele cu astm şi obezitate comorbidă (McLoughlin & McDonald, 2021). Programele de scădere în greutate şi chirurgia bariatrică pot fi explorate la persoanele obeze cu astm, în special la cele cu un control deficitar al bolii.
Impactul asupra astmului. Obezitatea este recunoscută ca un factor de risc independent pentru astm. În comparaţie cu persoanele astmatice normoponderale, cele cu obezitate şi astm comorbid par să aibă mai multe dificultăţi în controlul bolii, cu simptome de astm mai severe, mai puţine zile fără simptome, scăderea toleranţei la efort, funcţie pulmonară şi volume pulmonare reduse, creşterea frecvenţei şi a severităţii exacerbărilor de astm, creşterea riscului de spitalizări şi cu scăderea calităţii vieţii. Indicele de masă corporală este un predictor independent al scăderii calităţii vieţii. Astfel, calitatea vieţii este de peste cinci ori mai redusă la persoanele cu astm şi obezitate în comparaţie cu cele normoponderale. Acest grup de pacienţi prezintă, de asemenea, un risc crescut de multiple comorbidităţi, cum ar fi anxietatea, depresia şi sindromul de apnee în somn obstructiv, care pot, în mod similar, agrava controlul bolii. Cu toate acestea, rămâne neclar dacă obezitatea creşte sau nu severitatea astmului, fiind raportate dovezi contradictorii în literatura de specialitate (McLoughlin & McDonald, 2021).
Tulburări psihiatrice: anxietatea şi depresia
Prevalenţă. Aceste comorbidităţi sunt foarte răspândite în populaţia cu astm, anxietatea şi depresia fiind de până la şase ori mai frecvente la acest grup de pacienţi decât la cei fără astm. Problemele de anxietate afectează aproximativ 49% dintre persoanele cu astm sever, în comparaţie cu 29% dintre pacienţii cu alte boli respiratorii cronice. Anxietatea şi depresia sunt de aproximativ 1,4, respectiv 3,3 ori mai frecvente în astmul sever în comparaţie cu formele nonsevere (Cazzola et al., 2022).
Fiziopatogenie. Mecanismele care stau la baza asocierii dintre depresie, anxietate şi rezultatele clinice slabe la persoanele cu astm sunt complexe şi implică multiple procese inflamatorii. Persoanele cu depresie au niveluri crescute de citokine proinflamatorii, care joacă un rol important în patogeneza astmului. De asemenea, anxietatea poate afecta controlul astmului prin creşterea activităţii parasimpatice şi a secreţiei de citokine. Asociat, dezechilibrul sistemului de serotonină ar putea juca un rol în mecanismele implicate, însă datele privind relaţia dintre serotonină şi astm sunt contradictorii. Serotonina, care acţionează asupra receptorilor fibrei musculare netede, induce contracţia şi stimulează macrofagele alveolare să secrete citokine (Cardet et al., 2021; Cazzola et al., 2022).
Simptome şi diagnostic. În ciuda prevalenţei ridicate a anxietăţii şi depresiei la persoanele cu astm, aceste comorbidităţi sunt adesea subdiagnosticate şi subtratate în practica clinică. Anxietatea şi astmul au în comun o serie de simptome similare, inclusiv senzaţia de apăsare în piept, dificultăţi de respiraţie, respiraţie rapidă/hiperventilaţie şi sindrom vertiginos.
Conduită terapeutică. Depresia scade răspunsul la tratamentul antiastmatic cu bronhodilatatoare. Persoanele cu astm şi afecţiuni psihiatrice comorbide sunt tratate în prezent folosind aceeaşi abordare de îngrijire treptată utilizată în populaţia generală. Domeniul în expansiune al medicinei implică utilizarea unor intervenţii terapeutice bazate pe dovezi, cum ar fi modificarea dietei, activitatea fizică, gestionarea stresului (de exemplu, medicaţie, antrenament de respiraţie, relaxare), somnul de refacere şi reducerea sau evitarea substanţelor recreative, care abordează factorii‑cheie de risc, pentru a preveni şi trata bolile cronice, inclusiv comorbiditatea psihiatrică. Dozele frecvente şi mari de corticosteroizi sistemici utilizate pentru pacienţii astmatici cu forme severe pot duce la neurotoxicitate şi deficite cognitive. Deoarece anxietatea şi depresia pot modifica percepţia simptomelor specifice astmului, terapia psihologică şi exerciţiile de respiraţie pot ajuta pacienţii să îşi amelioreze calitatea vieţii şi să diminueze riscul de supramedicaţie, precum şi să ajute la identificarea persoanelor cu exacerbări reale (Cazzola et al., 2022).
Impactul asupra astmului. Prezenţa acestor comorbidităţi în astm este asociată cu un control deficitar al bolii, accentuarea simptomelor, cu o frecvenţă mai mare a exacerbărilor, doze mai mari de corticosteroizi şi cu un risc crescut de neaderenţă la tratamentul (Cazzola et al., 2022).
Afecţiunile cardiovasculare
Prevalenţă. Dovezile clinice sugerează o legătură puternică între bolile cardiovasculare şi morbiditatea din astm (Cazzola et al., 2013). Pacienţii cu astm au un risc cu 42% mai mare de afecţiuni cardiovasculare decât persoanele fără astm, cu incidenţă mai mare în rândul femeilor (Hekking et al., 2018; Cazzola et al., 2013). Din acest grup de pacienţi, cei care raportează alergii prezintă un risc crescut de boală coronariană (Ingebrigtsen et al., 2020). Deşi intensitatea asocierii este scăzută, hipertensiunea arterială este cea mai frecventă comorbiditate cardiovasculară întâlnită la pacienţii cu astm sever (Cazzola et al., 2013). Bolile cardiovasculare afectează evoluţia astmului, insuficienţa cardiacă jucând un rol important în dezvoltarea bronhoconstricţiei induse de edem (Sultana et al., 2019).
Fiziopatogenie. Inflamaţia sistemică asociată astmului poate afecta funcţia cardiovasculară. Mecanismele biologice specifice care pot facilita dezvoltarea comorbidităţii cardiovasculare rămân de determinat pe deplin. Citokinele proinflamatorii, interferonul-γ şi factorul de necroză tisulară-α (TNF- α) au efecte notabile în ambele afecţiuni, deşi reglarea inflamatorie în astm diferă de cea din ateroscleroză (Gurgone et al., 2020). Alte celule inflamatorii, inclusiv macrofagele, monocitele, limfocitele, neutrofilele şi mastocitele participă, de asemenea, într-o mare măsură la patogeneza ambelor boli, împărtăşind activităţi similare (Liu et al., 2016). Histamina, cisteinil leucotrienele şi factorul de activare plachetară (PAF), eliberate de mastocitele cardiace umane activate imun, influenţează puternic funcţia ventriculară stângă, ritmul cardiac şi tonusul coronarian, care exercită efecte inotrop negative şi induc depresia miocardică. Mai mult, mastocitele cardiace produc chimază şi renină, care stimulează local sistemul angiotensinei, ducând la vasoconstricţie arteriolară (Triggiani et al., 2008). Totodată, proliferarea musculaturii netede este frecventă atât în hipereactivitarea bronşică, dar şi în leziunile aterosclerotice (Liu et al., 2016).
Conduită terapeutică. Conform celor mai noi date, un singur medicament poate avea aceeaşi ţintă în ambele afecţiuni – şi anume, statina. Acest produs stă la baza prevenirii bolilor cardiovasculare, poate îmbunătăţi controlul astmului şi poate minimiza exacerbările (Cardet et al., 2021; Sutana et al., 2022). Canakinumab, un anticorp monoclonal anti-IL-1β, s-a dovedit a fi mai eficient în reducerea incidenţei evenimentelor cardiovasculare recurente, indiferent de nivelului lipidelor (Cazzola et al., 2022).
Diabetul zaharat
Prevalenţă. Există legături puternice între astm şi diabetul zaharat de tip 2 (DZ tip 2), mai frecvent la femei, cu o incidenţă aproape dublă a astmului la acest grup de paciente (Cazzola et al., 2013).
Fiziopatogenie. Calea inflamatorie sistemică pare a fi legătura comună dintre afecţiunile căilor respiratorii şi DZ tip 2, fiind sugerate mai multe mecanisme moleculare care implică inflamaţia vasculară şi căile proinflamatorii. Cu toate acestea, procesele componentei sistemice rămân necunoscute. Conform lucrărilor de specialitate, astmul şi diabetul zaharat de lungă durată sunt legate de o inflamaţie sistemică, ce poate fi dependentă sau independentă de adipozitate (Cazzola et al., 2022). Concentraţiile ridicate de glucoză determină hiperreactivitate bronşică şi eliberare crescută de calciu intracelular din celulele musculare netede ale căilor respiratorii, ceea ce semnifică faptul că aceste căi critice pot contribui la reducerea funcţiei pulmonare observată la pacienţii diabetici. Relaţia dintre DZ tip 2 şi funcţia pulmonară scăzută poate fi, de asemenea, legată de rezistenţa la insulină, care este mai puternic asociată cu riscul de astm la adulţi decât obezitatea. Cu toate acestea, nu este clar dacă rezistenţa la insulină este o cauză a astmului sau doar rezultatul activităţii mediatorilor inflamatori implicaţi în fiziopatogenia bolii. În orice caz, prin blocarea receptorilor muscarinici M2 neuronali şi prin stimularea eliberării de acetilcolină de către neuronii parasimpatici ai căilor respiratorii, hiperinsulinemia sporeşte bronhoconstricţia mediată vagal (Cardet et al., 2021; Cazzola et al., 2022).
Conduită terapeutică. În prezent, majoritatea abordărilor farmaceutice ale terapiei de lungă durată sunt reprezentate de simptomatice şi nu abordează cauzele care stau la baza acestor afecţiuni coexistente. Tratamentul inflamaţiei sistemice este recomandat ca o modalitate viabilă de tratare concomitentă a astmului şi a diabetului comorbid. DZ tip 2 drept comorbiditate poate fi tratat cu ajutorul corticosteroizilor, ceea ce poate duce la o creştere dependentă de doză a concentraţiei serice de glucoză. Agoniştii receptorului peptidei-1 de tip glucagon (GLP-1R) reduc inflamaţia mediată de produşii finali de glicare avansată, care sunt procese fiziopatogenice frecvente în obezitate şi astm. Tratamentul cu agonişti GLP-1R duce la îmbunătăţirea funcţiei pulmonare, indiferent de nivelul glicemiei la pacienţii cu DZ tip 2, în absenţa tulburărilor pulmonare obstructive subiacente (Cazzola et al., 2022).
Impactul asupra astmului. Există o relaţie negativă între severitatea diabetului (caracterizată de durata bolii şi de tipul de medicaţie antidiabetică) şi funcţia pulmonară, ceea ce sugerează că plămânul este un organ-ţintă al afecţiunilor diabetice. Nivelurile ridicate de hemoglobină glicată (Hb A1c) sunt legate de rata spitalizărilor în contextul astmului şi de mici scăderi ale funcţiei pulmonare (Yang et al., 2020).
Concluzii
Comorbidităţile sunt frecvente în cazul astmului sever şi pot contribui în mod semnificativ la un control deficitar al simptomelor şi la exacerbări. Evaluarea sistematică a pacienţilor cu astm potenţial sever pentru afecţiunile comorbide este importantă în vederea obţinerii unor rezultate terapeutice optime, dar şi pentru a face diferenţa între pacienţii cu astm sever refractar şi cei la care controlul deficitar al simptomelor este cauzat de prezenţa comorbidităţilor. Există o nevoie evidentă de clarificare suplimentară a mecanismelor care stau la baza asocierii dintre comorbidităţile specifice şi diferitele fenotipuri de astm sever. Acest lucru ar putea îmbunătăţi atât înţelegerea fenotipurilor, cât şi evaluarea şi gestionarea corectă la acest grup de pacienţi.
Bibliografie
- Agarwal R, Chakrabarti A, Shah A, et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy. 2013 Aug;43(8):850-73. doi: 10.1111/cea.12141. PubMed PMID: 23889240
- Agusti A, Bel E, Thomas M, et al. Treatable traits: toward precision medicine of chronic airway diseases. Eur Respir J 2016 Feb;47(2):410-9. doi: 10.1183/13993003.01359-2015. PubMed PMID: 26828055
- Bardin PG, Rangaswamy J, Yo SW. Managing comorbid conditions in severe asthma. Med J Aust. 2018 Jul 16;209(S2):S11-S17. doi: 10.5694/mja18.00196. PubMed PMID: 30453867
- Cao Y, Hong H, Sun Y, Lai Y, Xu R, Shi J, et al. The effects of endoscopic sinus surgery on pulmonary function in chronic rhinosinusitis patients with asthma: a systematic review and meta-analysis. Eur Arch Otorhinolaryngol. 2019; 276:1405–1411. doi: 10.1007/s00405-019-05337-4 PubMed: 30799521
- Cardet JC, Bulkhi AA, Lockey RF. Nonrespiratory comorbidities in asthma. J Allergy Clin Immunol Pract. 2021 Nov;9(11):3887-3897. doi: 10.1016/j.jaip.2021.08.027. PubMed PMID: 34492402
- Carpagnano GE, Scioscia G , Lacedonia D, Curradi G, Foschino Barbaro MP. Severe uncontrolled asthma with bronchiectasis: a pilot study of an emerging phenotype that responds to mepolizumab. J Asthma Allergy. 2019 Feb 5. doi.org/10.2147/JAA.S196200 PubMed PMID: 30881051 PubMed Central PMCID PMC6407514
- Cazzola M, Rogliani P, Calzetta L, Matera MG. Bronchodilators in subjects with asthma-related comorbidities. Respir Med. 2019 April 03. DOI:https://doi.org/10.1016/j.rmed.2019.04.001 PubMed PMID: 31047116
- Cazzola M, Rogliani P. Do we really need asthma–chronic obstructive pulmonary disease overlap syndrome?. J Allergy Clin. Immunol. 2016 Jun 03. doi:https://doi.org/10.1016/j.jaci.2016.04.028 PubMed PMID: 27372569
- Cazzola M, Segreti A, Calzetta L, Rogliani P. Comorbidities of asthma: current knowledge and future research needs. Curr Opin Pulm Med. 2013 Jan; 19(1):36-41. doi: 10.1097/MCP.0b013e32835b113a. Pubmed PMID: 23114561
- Chiang LK. Overnight pulse oximetry for obstructive sleep apnea screening among patients with snoring in primary care setting: clinical case report. J Fam Med Prim Care. 2018 Sep-Oct;7(5):1086-1089. doi: 10.4103/jfmpc.jfmpc_142_18. PubMed PMID: 30598963 PubMed Central PMCID: PMC6259496
- Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, Adcock IM, Bateman ED, Bel EH, Bleecker ER, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014 Feb;43(2):343-73. doi: 10.1183/09031936.00202013. PubMed PMID: 24337046
- Crimi C, Campisi R, Nolasco S, et al. Type 2‑high severe asthma with and without bronchiectasis: a prospective observational multicentre study. J Asthma Allergy. 2021 Nov 30;14:1441-1452. doi: 10.2147/JAA.S332245. PubMed PMID: 34880630
- Denlinger LC, Phillips BR, Ramratnam S, et al. Inflammatory and comorbid features of patients with severe asthma and frequent exacerbations. Am J Respir Crit Care Med. 2017 Feb 1;195(3):302-313. doi: 10.1164/rccm.201602-0419OC. PubMed PMID: 27556234
- Denning DW, Pleuvry A, Cole DC. Global burden of allergic bronchopulmonary aspergillosis with asthma and its complication chronic pulmonary aspergillosis in adults. Med Mycol. 2013 May;51(4):361-70. doi: 10.3109/13693786.2012.738312. PMID: 23210682
- Denton E, Bondarenko J, Tay T, et al. Factors associated with dysfunctional breathing in patients with difficult to treat asthma. J Allergy Clin Immunol Pract. 2019 May-Jun;7(5):1471-1476. doi: 10.1016/j.jaip.2018.11.037. PubMed PMID: 30529061
- Egan M, Bunyavanich S. Allergic rhinitis: the “Ghost Diagnosis” in patients with asthma. Asthma Res Pract. 2015 Sept 7. doi: 10.1186/s40733-015-0008-0. PubMed PMID: 27965762 PubMed Central PMCID: PMC5142399
- Fuhlbrigge A, Lockey RF. Asthma and Comorbid Conditions. J Allergy Clin Immunol Pract. 2021 Nov;9(11):3909-3910. doi: 10.1016/j.jaip.2021.09.007. PubMed PMID: 34749944
- Gaffin JM, Castro M, Bacharier LB, Fuhlbrigge AL. The Role of Comorbidities in Difficult-to-Control Asthma in Adults and Children. J Allergy Clin Immunol Pract. 2022 Feb;10(2):397-408. doi: 10.1016/j.jaip.2021.11.016. PubMed PMID: 34863928
- García-Clemente M, Enríquez-Rodríguez AI, Iscar-Urrutia M, et al. Severe asthma and bronchiectasis. J Asthma. 2020 May;57(5):505-509. doi: 10.1080/02770903.2019.1579832. PubMed PMID: 30784336
- Gibson PG, McDonald VM, Granchelli A, Olin JT. Asthma and Comorbid Conditions-Pulmonary Comorbidity. J Allergy Clin Immunol Pract. 2021 Nov 9(11):3868-3875. doi: 10.1016/j.jaip.2021.08.028. PubMed PMID: 34492401
- Gurgone D, McShane L, McSharry C, et al. Cytokines at the interplay between asthma and atherosclerosis? Front Pharmacol. 2020 Mar 4;11:166. doi: 10.3389/fphar.2020.00166. eCollection 2020. PubMed PMID: 32194407
- Greenberger PA, Bush RK, Demain JG, Luong A, Slavin RG, Knutsen AP. Allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2014 Nov-Dec;2(6):703-8. doi: 10.1016/j.jaip.2014.08.007. PubMed PMID: 25439360
- Hekking PP, Amelink M, Wener RR, et al. Comorbidities in difficult-to-control asthma. J Allergy Clin Immunol Pract. 2018 Jan-Feb;6(1):108-113. doi: 10.1016/j.jaip.2017.06.008. PubMed PMID: 28734857
- Imam JS, Duarte AG. Non‑CF bronchiectasis: Orphan disease no longer. Respir Med. 2020 May;166:105940. doi: 10.1016/j.rmed.2020.105940. PubMed PMID: 32250872
- Ingebrigtsen TS, Marott JL, Vestbo J, et al. Coronary heart disease and heart failure in asthma, COPD and asthma-COPD overlap. BMJ Open Respir Res. 2020 Feb;7(1):e000470. doi: 10.1136/bmjresp-2019-000470. PubMed PMID: 33371008
- Kaplan A, Szefler SJ, Halpin DMG. Impact of comorbid conditions on asthmatic adults and children. NPJ Prim Care Respir Med. 2020 Aug 20;30(1):36. doi: 10.1038/s41533-020-00194-9. PubMed PMID: 32820164 PubMed Central PMCID: PMC7441401
- Keselman A, Heller N. Estrogen Signaling Modulates Allergic Inflammation and Contributes to Sex Differences in Asthma. Front Immunol. 2015 Nov 16. doi.org/10.3389/fimmu.2015.00568 PubMed PMID: 26635789 PubMed Central PMCID: PMC4644929
- Kirtsreesakul V, Leelapong J, Ruttanaphol S. Can a Pretreatment Visual Analog Scale Predict Treatment Outcome in Allergic Rhinitis?. Int Arch Allergy Immunol. 2020;181(4):285-291. doi: 10.1159/000505745. PubMed PMID: 32018258
- Leung JM, Sin DD. Asthma-COPD overlap syndrome: pathogenesis, clinical features, and therapeutic targets. BMJ. 2017 Sep 25;358:j3772. doi: 10.1136/bmj.j3772. PubMed PMID: 28947632
- Liu CL, Zhang JY, Shi GP. Interaction between allergic asthma and atherosclerosis. Transl Res. 2016 Aug;174:5-22. doi: 10.1016/j.trsl.2015.09.009. Epub 2015 Oct 9. PubMed PMID: 26608212
- Louis R, Satia I, Ojanguren I, et al. European Respiratory Society Guidelines for the Diagnosis of Asthma in Adults. Eur Respir J. 2022 Feb 15;2101585. doi: 10.1183/13993003.01585-2021. PubMed PMID: 35169025
- Lowhagen O, Bergqvist P. Physiotherapy in asthma using the new Lotorp method. Complement Ther Clin Pract. 2014 Nov;20(4):276-9. doi: 10.1016/j.ctcp.2014.07.004. PubMed PMID: 25130138
- Massoth L, Anderson C, McKinney KA. Asthma and chronic rhinosinusitis: diagnosis and medical management. Med Sci (Basel). 2019 Mar 27;7(4):53. doi: 10.3390/medsci7040053. PubMed PMID: 30934800
- McDonald VM, Maltby S, Reddel HK, et al. Severe asthma: Current management, targeted therapies and future directions – a roundtable report. Respirology. 2017 Jan;22(1):53-60. doi: 10.1111/resp.12957. PubMed PMID: 27905186
- McDonald VM, Osadnik CR, Gibson PG. Treatable traits in acute exacerbations of chronic airway diseases. Chron Respir Dis. 2019 Jan-Dec;16:1479973119867954. doi: 10.1177/1479973119867954.PubMed PMID: 31409129
- McLoughlin RF, McDonald VM. The Management of Extrapulmonary Comorbidities and Treatable Traits; Obesity, Physical Inactivity, Anxiety, and Depression, in Adults With Asthma. Front Allergy. 2021 Sept 22. doi.org/10.3389/falgy.2021.735030 PubMed PMID: 35387051 PubMed Central PMCID: PMC8974714
- Mümmler C, Dünzelmann C, Kneidinger N, et al. Real-life effectiveness of biological therapies on symptoms in severe asthma with comorbid CRSwNP. Clin Transl Allergy. 2021 Jul;11(5):e12049. doi: 10.1002/clt2.12049. PubMed PMID: 34331521
- Perotin JM, Wheway G, Tariq K, et al. Vulnerability to acid reflux of the airway epithelium in severe asthma. European Respiratory Journal. 2022 Jan 7. doi: 10.1183/13993003.01634-2021. PubMed PMID: 34996831
- Polverino E, Rosales‑Mayor E, Dale GE, et al. The role of neutrophil elastase inhibitors in lung diseases. Chest. 2017 Aug;152(2):249-262. doi: 10.1016/j.chest.2017.03.056. PubMed PMID: 28442313
- Porsbjerg C, Menzies-Gow A. Co-morbidities in severe asthma: Clinical impact and management. Respirology. 2017 May;22(4):651-661. doi: 10.1111/resp.13026. PubMed PMID: 2832816
- Rogliani P, Ora J, Puxeddu E, Cazzola M. Airflow obstruction: is it asthma or is it COPD? Int J Chron Obstruct Pulmon Dis. 2016 Nov 30;11:3007-3013. doi: 10.2147/COPD.S54927. eCollection 2016. PubMed PMID: 27942210
- Rogliani P, Sforza M, Calzetta L. The impact of comorbidities on severe asthma. Curr Opin Pulm Med. 2020 Jan;26(1):47-55. doi: 10.1097/MCP.0000000000000640. PubMed PMID: 31644439
- Shaw DE, Sousa AR, Fowler SJ, et al. Clinical and inflammatory characteristics of the European U-BIOPRED adult severe asthma cohort. Eur Respir J. 2015 Nov;46(5):1308-21. doi: 10.1183/13993003.00779-2015. PubMed PMID: 26357963
- Stachler RJ. Comorbidities of asthma and the unified airway. Int Forum Allergy Rhinol. 2015 Sep;5 Suppl 1:S17-22. doi: 10.1002/alr.21615. PubMed PMID: 26335831
- Sultana RV, McKenzie DP, Fahey MT, et al. Beta-blocker use is an independent risk factor for thunderstorm asthma. Emerg Med Australas. 2019 Dec;31(6):955-960. doi: 10.1111/1742-6723.13275 PubMed PMID: 30887729
- Tay TR, Bosco J, Gillman A, Aumann H, Stirling R, O’Hehir R, Hew M. Coexisting atopic conditions influence the likelihood of allergic bronchopulmonary aspergillosis in asthma. Ann. Allergy Asthma Immunol. 2016 Jul;117(1):29-32.e1. doi: 10.1016/j.anai.2016.04.024. PubMed PMID: 27234940
- Teodorescu M, Broytman O, Curran-Everett D, et al. Obstructive sleep apnea risk, asthma burden, and lower airway inflammation in adults in the severe asthma research program (SARP) II. J Allergy Clin Immunol Pract. 2015 Jul-Aug;3(4):566-75.e1. doi: 10.1016/j.jaip.2015.04.002. PubMed PMID: 26004304
- Tiotiu, A, Plavec D, Novakova S, et al. Current opinions for the management of asthma associated with ear, nose and throat comorbidities. Eur Respir Rev. 2018 Nov 21;27(150):180056. doi: 10.1183/16000617.0056-2018. PubMed PMID: 30463872
- Tomisa G, Horváth A, Sánta B, et al. Epidemiology of comorbidities and their association with asthma control. Allergy Asthma Clin Immunol. 2021 Sep 22;17(1):95. doi: 10.1186/s13223-021-00598-3. PubMed PMID: 34551813
- Triggiani M, Patella V, Staiano RI, et al. Allergy and the cardiovascular system. Clin Exp Immunol. 2008 Sep;153 Suppl 1(Suppl 1):7-11. doi: 10.1111/j.1365-2249.2008.03714.x. PubMed PMID: 18721322
- Ullmann, N, Mirra V, Di Marco A, et al. Asthma: differential diagnosis and comorbidities. Front Pediatr. 6, 276 2018 Oct 3;6:276. doi: 10.3389/fped.2018.00276. eCollection 2018. PubMed PMID: 30338252 PubMed Central PMCID: PMC6178921
- Voskamp AL, Gillman A, Symons K, Sandrini A, Rolland JM, O’Hehir RE, Douglass JA. Clinical efficacy and immunologic effects of omalizumab in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2015 Mar-Apr;3(2):192-9. doi: 10.1016/j.jaip.2014.12.008. PubMed PMID: 25640470
- Wang R, Mihaicuta S, Tiotiu A, et al. Asthma and obstructive sleep apnoea in adults and children - an up-to-date review. Sleep Med Rev. 2022 Feb;61:101564. doi: 10.1016/j.smrv.2021.101564. PubMed PMID: 34902822
- Yang G, Han YY, Forno E, et al. Glycated hemoglobin A1c, lung function, and hospitalizations among adults with asthma. J Allergy Clin Immunol Pract. 2020 Nov-Dec;8(10):3409-3415.e1. doi: 10.1016/j.jaip.2020.06.017. PubMed PMID: 32569755
- Zhang SQ, Xiong XF, Wu ZH, et al. Clinical features of asthma with comorbid bronchiectasis: a systematic review and meta-analysis. Medicine (Baltimore). 2021 Jan 29;100(4):e23858. doi: 10.1097/MD.0000000000023858. PubMed PMID: 33530179
Articole din ediţiile anterioare
Terapiile biologice în astmul sever – o perspectivă moleculară
Astmul este o boală heterogenă definită printr‑un istoric de simptome respiratorii care variază în timp şi în intensitate, precum şi prin limitarea...
Tratamentul astmului alergic – noi perspective şi abordări terapeutice
Astmul este o afecţiune eterogenă, caracterizată prin inflamaţia cronică a căilor respiratorii şi definită printr‑un istoric de simptome respirator...
Rinita alergică locală în populaţia pediatrică
Rinita alergică locală se caracterizează prin sinteza la nivelul mucoasei nazale de imunoglobuline E specifice, în absenţa sensibilizării sistemice...
Boala respiratorie exacerbată de antiinflamatoare nesteroidiene (N-ERD) în populaţia pediatrică
Boala respiratorie exacerbată de AINS (N-ERD; NSAID exacerbated respiratory disease), cunoscută anterior sub numele de sindrom Widal, triada Samter...