Local allergic rhinitis is defined by specific immunoglobulin E antibodies synthesis in the nasal mucosa, in the absence of systemic sensitization to the culprit allergen. House dust mites and Alternaria alternata mold seem to be the most frequently involved allergens in the pathogenesis of the disease. The clinical differentiation between local allergic rhinitis and classic rhinitis is not possible. The gold standard in diagnosis is the nasal allergen challenge. In pediatric population, additional studies regarding the evolution of local allergic rhinitis into classic rhinitis are needed. Preventing allergen exposure measures, nasal antihistamines and nasal corticosteroids are effective treatment options. For moderate or severe stages, immunotherapy may be considered, which alleviates symptoms on the long term and seems to prevent asthma association.
Rinita alergică locală în populaţia pediatrică
Local allergic rhinitis in pediatric population
First published: 06 mai 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.6.2.2022.6599
Abstract
Rezumat
Rinita alergică locală se caracterizează prin sinteza la nivelul mucoasei nazale de imunoglobuline E specifice, în absenţa sensibilizării sistemice la alergenul incriminat. Acarienii din praful de casă şi mucegaiul Alternaria alternata par a fi alergenele cel mai frecvent implicate în patologia acestei afecţiuni. Diferenţierea clinică între rinita alergică locală şi cea clasică nu este posibilă. Standardul de aur pentru diagnostic este testul de provocare nazală. În populaţia pediatrică sunt necesare studii suplimentare privind evoluţia rinitei alergice locale către rinită alergică sistemică. Alături de măsurile de profilaxie a expunerii la alergene, antihistaminicele intranazale şi corticosteroizii administraţi intranazal reprezintă opţiuni eficiente de tratament. Pentru formele moderate sau severe se poate lua în considerare imunoterapia, care ameliorează simptomatologia pe termen lung şi are potenţialul să prevină dezvoltarea astmului.
Definiţie
Rinita alergică locală (RAL) reprezintă un fenotip particular de inflamaţie a mucoasei nazale, caracterizat prin existenţa unui răspuns alergic local, în absenţa sensibilizării sistemice la un alergen. Diagnosticul se stabileşte pe baza rezultatului pozitiv al testului de provocare nazală, însoţit de teste cutanate prick negative şi de imunoglobuline E (IgE) serice alergen-specifice absente(1,2).
Date epidemiologice
Actualmente se consideră că RAL este o patologie subdiagnosticată. La adult, aceasta are o prevalenţă de 50-75% în rândul indivizilor nonatopici, cu simptome nazale sugestive de alergie(1). În populaţia pediatrică, numărul studiilor efectuate este mai redus şi se înregistrează o variaţie largă a frecvenţei în populaţiile studiate – între 3,7% şi 83,3% dintre copiii diagnosticaţi anterior cu rinită nonalergică. Conform datelor din literatură, prevalenţa în rândul copiilor creşte uşor odată cu vârsta(5). Simptomele de rinită au debutat în copilărie la 36% dintre adulţii diagnosticaţi cu RAL(3). Variabilitatea mare poate fi explicată de diferenţele populaţionale şi regionale, dar şi de protocoalele diferite folosite în cursul testelor de provocare nazală(4). Prevalenţa pare să fie mai crescută în ţările vestice comparativ cu cele estice şi în cele europene comparativ cu cele asiatice(1,5). Diagnosticul mai dificil la copil, precum şi interesul scăzut pentru diferenţierea completă între RAL şi rinita nonalergică generează lipsa datelor privitoare la acest subiect(4). Autorii primului studiu care a evaluat reactivitatea nazală la un alergen şi sinteza locală de imunoglobuline E (IgE) specifice într-un lot de copii nonatopici (Fuiano et al., 2010) au raportat că 64% dintre copiii cu rinită cronică şi teste cutanate negative au IgE specifice nazale pozitive pentru Alternaria alternata(2). Datele raportate până acum indică faptul că acarienii din praful de casă, mucegaiurile, polenul de graminee şi mesteacăn, epiteliile de câine şi cele de pisică sunt cele mai frecvente alergene implicate în patologia RAL(2).
Mecanism fiziopatologic
Principalul mecanism considerat a fi implicat constă în sinteza locală, la nivelul mucoasei nazale, de anticorpi specifici de tip IgE şi în interacţiunea in situ a acestora cu alergenele. Limfocitele B din mucoasa nazală exprimă ARN mesager pentru lanţurile grele epsilon ale IgE, precum şi transcripte ale genelor din linia germinală epsilon, sugerând potenţialul secreţiei locale de IgE(5). Între 20% şi 40% dintre pacienţii diagnosticaţi cu RAL prezintă IgE specifice detectabile în secreţiile nazale. Procentajele relativ reduse sunt justificabile prin efectul de diluţie apărut prin utilizarea lavajului nazal pentru determinare. Sensibilitatea metodei de detecţie este astfel redusă. Totodată, existenţa alergenelor oculte şi implicarea altor mecanisme imunologice trebuie luate în considerare(2,6). În primele 24 de ore după testul de provocare nazală se înregistrează o creştere semnificativă a nivelului de IgE specifice în secreţiile nazale, comparativ cu nivelul iniţial(1). În favoarea unui mecanism IgE‑mediat pledează şi rezultatele pozitive la testul de activare a bazofilului înregistrate de o parte dintre pacienţii cu RAL. Cu toate că sensibilitatea sa este mai redusă, acest test are specificitate ridicată şi este considerat în prezent un test adiţional de diagnostic(2). Un alt argument indirect este reprezentat de răspunsul satisfăcător observat la imunoterapia alergen-specifică în populaţia adultă diagnosticată cu RAL, deşi răspunsul populaţiei pediatrice la imunoterapie a fost până acum mai puţin studiat(1,2,4).
Studiile recente, prin hibridizare in situ, au demonstrat implicarea răspunsului inflamator de tip Th2 în patogeneza RAL(5). Au fost observate niveluri crescute de eozinofile, mastocite şi limfocite T CD4+ în lichidul de lavaj nazal, pe durata expunerii la aeroalergene, citometria în flux realizată pe lichidul de lavaj nazal indicând un fenotip leucocitar-limfocitar similar în RAL şi în rinita alergică „sistemică” (RA)(6). Ca urmare a testului de provocare nazală, se înregistrează modificări ale nivelurilor triptazei şi proteinei cationice eozinofilice în secreţiile nazale. În funcţie de aceste valori s-au descris două tipuri de răspuns: imediat (triptază crescută la 15 minute şi la o oră) şi cu răspuns dual (triptază crescută de la 15 minute până la 6 ore ulterior testării)(2,7). Nivelul triptazei se corelează puternic cu pruritul nazal şi apariţia strănutului. Nivelul IgE specifice nazale prezintă, de asemenea, o creştere progresivă în 1-24 de ore după testul de provocare nazală, ceea ce sugerează existenţa unei producţii bazale persistente care este rapid amplificată la contactul cu alergenul sensibilizant(6).
În ciuda progreselor recente, există numeroase necunoscute în privinţa fiziopatologiei RAL. Sunt necesare studii suplimentare pentru clarificarea mecanismelor implicate(4).
Diagnostic, comorbidităţi şi prognostic
Tabloul clinic al rinitei alergice locale este foarte asemănător cu cel al rinitei alergice clasice. Prezenţa fenomenelor de rinită (obstrucţie nazală, rinoree apoasă, salve de strănut, prurit nazal) şi rezultatul negativ al testelor standard al bilanţului alergologic faţă de alergenele aeropurtate suspicionate, folosite atât in vivo (teste cutanate prick), cât şi in vitro (dozarea serologică a anticorpilor IgE specifici), ridică suspiciunea de RAL. În populaţia pediatrică, din punct de vedere clinic, nu este posibilă diferenţierea rinitei alergice locale de cea clasică, însă fiecare dintre acestea are asociate comorbidităţi diferite. Rinosinuzita, tulburările de somn, tulburările de atenţie/învăţare, otita medie seroasă şi scăderea calităţii vieţii pot apărea în cazul tuturor rinitelor cronice. Cu toate acestea, istoricul personal de atopie, precum astmul şi conjunctivita alergică, sunt frecvent asociate cu RAL. Standardul de aur pentru diagnosticul RAL este reprezentat de testul de provocare nazală (TPN) cu alergenele aeropurtate suspicionate(2,4). Cele mai frecvente alergene asociate cu RAL sunt acarienii din praful de casă şi mucegaiul Alternaria alternata(8,9). Indicaţiile şi contraindicaţiile TPN pentru populaţia generală au fost formulate de Grupul de lucru al EAACI, aşa cum este ilustrat în figura 1(10,11). Schema bilanţului alergologic este ilustrată în figurile 2 şi 3.
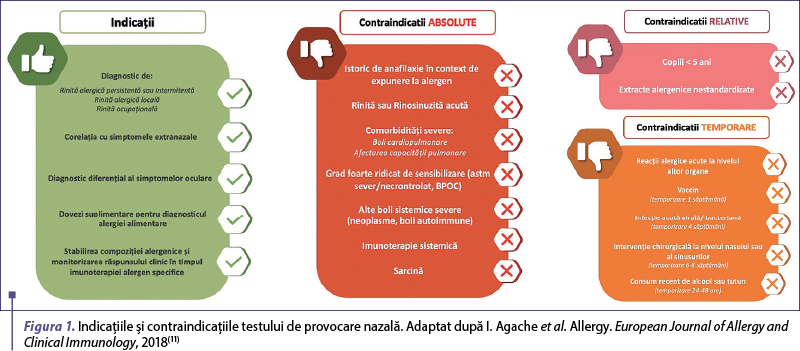
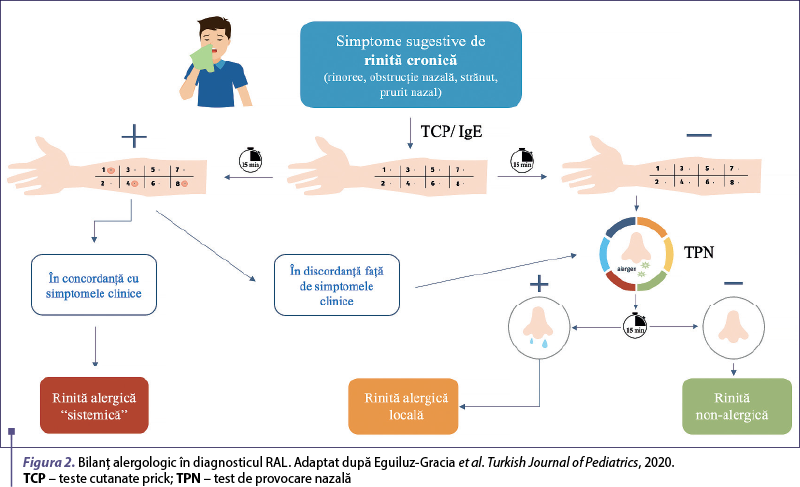
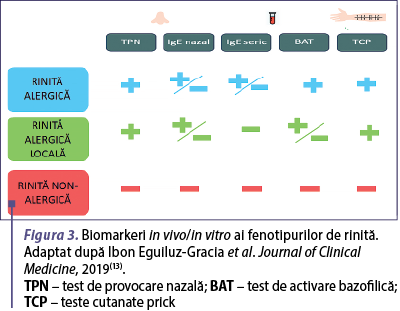
Cu toate acestea, testul nu este disponibil de rutină, este cronofag şi dificil de efectuat la copii, în special la cei mai puţin cooperanţi, astfel că lavajul nazal asociat cu dozarea IgE folosind metoda ImmunoCAP şi examinarea citologică a acestuia pot fi considerate o opţiune potrivită, deoarece sunt rapide şi uşor de obţinut chiar şi la copiii mici şi necooperanţi(12).
Dozarea anticorpilor IgE (ImmunoCAP – valoare cut-off 3,85 UI/ml) în lichidul de lavaj nazal (folosind 2 ml/nară de soluţie salină izotonă) ar putea fi considerată o alternativă mai uşoară şi mai rapidă a TPN la copiii cu suspiciune de RAL. În plus, este neinvazivă şi foarte specifică, deşi nu întotdeauna suficient de sensibilă. Performanţa testării IgE în secreţiile nazale la copii este încă necunoscută şi necesită investigaţii suplimentare pentru a putea fi folosită ca test de referinţă pentru diagnosticul RAL(12,13).
Un studiu-pilot a arătat că bazofilele din sângele periferic pot reacţiona la acelaşi extract alergenic care a declanşat un TPN pozitiv la pacienţii RAL IgE-seronegativi. Testul de activare a bazofilelor (BAT) a fost pozitiv la opt din 16 pacienţi adolescenţi şi adulţi cu RAL(14). Diagnosticul RAL se bazează pe rezultatul pozitiv al TPN, în timp ce BAT şi dozarea IgE din secreţiile nazale pot completa diagnosticul în anumite cazuri selecţionate. Astfel, implementarea TPN în algoritmii de diagnostic pentru rinita cronică este o condiţie necesară pentru recunoaşterea precoce a afecţiunii şi permite posibilitatea iniţierii unui plan terapeutic adecvat controlului rinitei, precum şi o monitorizare atentă a evoluţiei acesteia(1,12).
Evoluţia RAL către rinită alergică sistemică reprezintă un subiect de interes pentru cercetare.
În populaţia pediatrică nu există studii prospective randomizate. La populaţia adultă însă, un studiu prospectiv pe 10 ani, care a inclus 197 de pacienţi cu RAL şi 130 de subiecţi sănătoşi, care au fost monitorizaţi timp de 5, respectiv 10 ani, a arătat sensibilizări sistemice similare în grupul de pacienţi faţă de grupul de control. După 10 ani de monitorizare, un procentaj semnificativ de pacienţi cu RAL (42%) au raportat înrăutăţirea simptomelor şi scăderea semnificativă a calităţii vieţii. De asemenea, s-a raportat o creştere semnificativă a gradului de severitate al rinitei (de la 19 la 42%), iar în aproximativ 12% din cazuri s-au identificat astm la debut şi dublarea crizelor de astm. În plus, s-a observat şi o tendinţă spre polisensibilizare în timp, procentajul crescând de la valoarea iniţială de 36% la 53% după 10 ani de monitorizare. Rezultatele studiului susţin ideea că RAL este o boală respiratorie cu evoluţie cronică cu simptome care se agravează în timp ce asociază dezvoltarea de noi sensibilizări locale (intranazale), astm la debut, deteriorarea controlului acestuia şi scăderea calităţii vieţii(2).
În populaţia pediatrică, Arasi şi colaboratorii au formulat ipoteza a trei tipuri de progresie (figura 4).
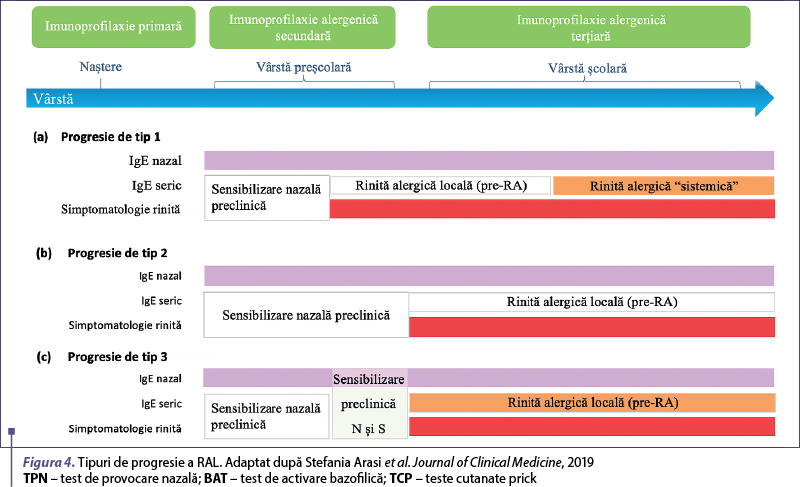
Progresie de tip 1: Simptomele nazale uşoare şi secreţia locală de IgE (RAL) încep la vârstele preşcolare, apoi sunt urmate de producţia sistemică de IgE la vârstele şcolare (RA).
Progresie de tip 2: Copiii prezintă secreţie locală de IgE, fără niciun simptom la vârsta preşcolară, simptomele nazale începând să apară la vârsta şcolară, dar fără nicio sensibilizare sistemică (RAL).
Progresie de tip 3: Sensibilizarea IgE locală şi cea sistemică încep împreună, fără o etapă anterioară de RAL(13).
Abordare terapeutică
Opţiunile terapeutice în RAL sunt similare celor utilizate pentru rinita alergică clasică(15). Prima linie de îngrijire este reprezentată de aplicarea măsurilor de reducere a expunerii la alergenele relevante implicate în declanşarea unei reacţii (acarieni, polenuri, animale de companie, mucegaiuri), precum şi a factorilor iritanţi (de exemplu, fumul de ţigară).
Performanţele terapeutice ale claselor de medicaţie utilizate obişnuit în tratamentul rinitei alergice sunt mai puţin studiate în RAL, însă experienţa clinică acumulată arată eficacitate similară, efect prezumabil ţinând cont de asemănările între mecanismele fiziopatologice ale formelor locale şi sistemice de alergie(2,15). În acest sens, tratamentul farmacologic al RAL se supune recomandărilor de tratament care se regăsesc în ghidul ARIA(16). Administrarea unui antihistaminic oral ori intranazal şi/sau a unui corticosteroid topic nazal aduce nu doar ameliorarea simptomelor, ci şi argumente în favoarea diagnosticului de rinită alergică locală, în condiţiile în care testele de provocare nazală sau testele de activare a bazofilului nu fac parte din evaluarea diagnostică de rutină. Asemănările patogenice şi de răspuns terapeutic întâlnite la pacienţii cu formele locale, respectiv clasice de rinită alergică au adus în atenţia cercetătorilor şi a clinicienilor posibilitatea ca imunoterapia alergen‑specifică să poată fi inclusă între posibilităţile de tratament al RAL, ca unică formă de terapie etiologică, modificatoare de boală, care poate induce toleranţa faţă de alergenul-ţintă şi care poate atenua răspunsul alergic(1). Studii clinice randomizate, dublu‑orb placebo‑controlate, au investigat efectele clinice şi imunologice ale imunoterapiei alergen‑specifice sub formă injectabilă cu administrare subcutanată (subcutaneous immunotherapy – SCIT) în RAL pentru pacienţi adulţi cu sensibilizare la acarieni din praful de casă(17) (Phleum Pratense(18) şi Betula verrucosa(2)), şi au relevat ameliorarea semnificativă statistic a calităţii vieţii pacienţilor şi creşterea dozei tolerate pentru TPN. Pentru populaţia pediatrică sunt necesare mai multe studii care să evalueze strategiile de tratament, inclusiv imunoterapia alergen‑specifică. Standardul de aur al diagnosticului în RAL rămâne evidenţierea sensibilizării prin TPN, însă metode care pot fi mai uşor aplicate copiilor, cum ar fi dozarea IgE specifice în secreţiile nazale sau BAT, permit o amplitudine mai mare a cercetării RAL în acest segment de populaţie.
Concluzii
Rinita alergică locală (RAL) este o patologie comună care poate afecta semnificativ calitatea vieţii pacienţilor. Caracterizată de manifestări clinice foarte asemănătoare cu ale rinitei alergice clasice, are ca mecanism un răspuns inflamator de tip Th2 la nivelul mucoasei nazale, în absenţa unei sensibilizări sistemice identificabile prin testare cutanată prick şi/sau IgE specifice în ser. Diagnosticul RAL se stabileşte prin documentarea răspunsului local după testul de provocare nazală cu alergene relevante pentru zona geografică din care face parte pacientul sau prin determinarea prezenţei IgE în secreţiile nazale. Dacă la adult fenotipul RAL este bine stabilit, la copil sunt încă insuficient studiate datele de prevalenţă, de evoluţie naturală, de stabilitate a fenotipului din perioada copilăriei către perioada de adult sau opţiunile terapeutice, însă cu certitudine fenotipul RAL îşi are locul său bine stabilit în populaţia pediatrică. Standardizarea TPN, standardizarea tehnicilor de măsurare a IgE specifice nazale utilizarea BAT sunt modalităţi de creştere a acurateţei informaţiei despre RAL. Opţiunile terapeutice în RAL sunt similare cu cele utilizate în îngrijirea RA clasice, incluzând posibilitatea de imunoterapie alergen‑specifică, însă sunt necesare studii suplimentare pentru a investiga fiziopatologia şi evoluţia RAL la copii, pentru a se putea recomanda strategii de intervenţie în copilărie.
Bibliografie
-
Eguiluz-Gracia I, Pérez-Sánchez N, Bogas G, Campo P, Rondón C. How to diagnose and treat local allergic rhinitis: A challenge for clinicians. J Clin Med. 2019;8(7).
-
Beken B, Eguiluz-Gracia I, Yazıcıoğlu M, Campo P. Local allergic rhinitis: A pediatric perspective. Turk J Pediatr. 2020;62(5):701–10.
-
Campo P, Rondón C, Gould HJ, Barrionuevo E, Gevaert P, Blanca M. Local IgE in non-allergic rhinitis. Clin Exp Allergy. 2015;45(5):872–81.
-
Matsumoto FY, Solé D, Wandalsen GF. Local allergic rhinitis in children: A systematic review. Allergol Immunopathol (Madr). 2022;50(2):40–7.
-
Terada T, Kawata R. Diagnosis and Treatment of Local Allergic Rhinitis. Pathogens. 2022;11(1).
-
Rondón C, Campo P, Togias A, Fokkens WJ, Durham SR, Powe DG, et al. Local allergic rhinitis: Concept, pathophysiology, and management. J Allergy Clin Immunol. 2012;129(6):1460–7.
-
Incorvaia C, Fuiano N, Martignago I, Gritti BL, Ridolo E. Local allergic rhinitis: Evolution of concepts. Clin Transl Allergy. 2017;7(1):1–4.
-
Gelardi M, Guglielmi AVN, Iannuzzi L, Quaranta VN, Quaranta N, Landi M, et al. Local allergic rhinitis: Entopy or spontaneous response? World Allergy Organ J [Internet]. 2016;9(1):39.
-
Tsilochristou O, Kyriakakou M, Manolaraki I, Lakoumentas J, Tiligada E, Maragkoudakis P, et al. Detection of local allergic rhinitis in children with chronic, difficult-to-treat, non-allergic rhinitis using multiple nasal provocation tests. Pediatr Allergy Immunol. 2019;30(3):296–304.
-
Altintoprak N, Kar M, Bayar Muluk N, Oktemer T, Ipci K, Birdane L, et al. Update on local allergic rhinitis. Int J Pediatr Otorhinolaryngol. 2016;87:105–9.
-
Augé J, Vent J, Agache I, Airaksinen L, Campo Mozo P, Chaker A, et al. EAACI Position paper on the standardization of nasal allergen challenges. Allergy Eur J Allergy Clin Immunol. 2018;73(8):1597–608.
-
Colavita L, Catalano N, Sposito G, Loddo S, Galletti B, Salpietro C, et al. Local allergic rhinitis in pediatric patients: Is IgE dosage in nasal lavage fluid a useful diagnostic method in children? Int J Mol Cell Med. 2017;6(3):174–82.
-
Arasi S, Pajno GB, Lau S, Matricardi PM. Local allergic rhinitis: A critical reappraisal from a paediatric perspective. Pediatr Allergy Immunol. 2016;27(6):569–73.
-
Gómez E, Campo P, Rondón C, Barrionuevo E, Blanca-López N, Torres MJ, et al. Role of the basophil activation test in the diagnosis of local allergic rhinitis. J Allergy Clin Immunol. 2013;132(4).
-
Wu AC, Dahlin A, Wang AL. The role of environmental risk factors on the development of childhood allergic rhinitis. Children. 2021;8(8).
-
Bousquet J, Pfaar O, Togias A, Schünemann HJ, Ansotegui I, Papadopoulos NG, et al. 2019 ARIA Care pathways for allergen immunotherapy. Allergy [Internet]. 2019
-
Rondón C, Campo P, Blanca-Lopez N, et al. Subcutaneous allergen immunotherapy in patient with “Local Allergic Rhinitis” sensitized to dermatophagoides pteronyssinus. J Allergy Clin Immunol. 2015; 135: AB171.
-
Rondón C, Blanca-López N, Campo P, et al. Specific immunotherapy in local allergic rhinitis: a randomized, double-blind placebo-controlled trial with Phleum pratense subcutaneous allergen immunotherapy. Allergy. 2018; 73: 905-915.
Articole din ediţiile anterioare
Rolul diagnosticului molecular în alergia IgE-mediată la proteinele laptelui de vacă
Proteinele laptelui de vacă se numără printre cei mai frecvenţi alergeni alimentari implicaţi în alergia IgE-mediată la copii.
Prezentarea farmaceutică a tabletelor pentru imunoterapie alergenică sublinguală disponibile la nivel mondial
Imunoterapia alergenică reprezintă o opţiune terapeutică ce are o eficienţă dovedită în cazuri atent selecţionate de pacienţi cu astm alergic şi/sa...
Sindromul polen-alimente (PFAS)
Alergiile sunt întâlnite în populaţie în proporţie de 20-30%, cele mai frecvente fiind cele respiratorii, determinate de polenul arborilor şi al pl...
Imunoterapia cu alergeni în astmul alergic
Imunoterapia cu alergeni (AIT) este recomandată pacienţilor simptomatici cu sensibilizare IgE mediată şi constă în administrarea unor cantităţi cre...