Asthma management has changed fundamentally over the past two decades. Central to these advances have been the further elucidation of the T2 mechanisms of airway inflammation and the use of biomarkers. In addition, epithelial cells are proving to be important contributors to inflammation by generating alarmins to initiate local lesions, as well as downstream pathways. International guidelines attest to the efficacy of inhaled corticosteroids in combination with long-acting β2-agonists for both control and as-needed treatment. Revolutionizing the approach to severe asthma, five biologics, such as mepolizumab, benralizumab, reslizumab, dupilumab and tezepelumab, have joined omalizumab, significantly contributing to the prevention of exacerbations and reducing the need for systemic corticosteroids, thus minimizing their side effects. For patients with allergic asthma, one of the most common asthma phenotypes, allergen immunotherapy can be an effective adjunctive treatment alongside pharmacological therapy. This review explores the integrated modalities for symptoms control and quality of life improvement in patients with asthma and aims to provide insight into current recommendations for therapies targeting the inflammatory pathway in allergic asthma, as well as the importance of combining allergen immunotherapy on disease progression.
Tratamentul astmului alergic – noi perspective şi abordări terapeutice
Treatment of allergic asthma – new perspectives and therapeutic approaches
First published: 21 decembrie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.7.4.2023.9256
Abstract
Rezumat
Managementul astmului s-a schimbat în mod fundamental în ultimele două decenii. Un element central al acestor progrese au fost clarificarea suplimentară a mecanismelor de tip T2 ale inflamaţiei căilor respiratorii şi utilizarea biomarkerilor. În plus, celulele epiteliale se dovedesc a fi factori contribuitori importanţi la inflamaţie, prin generarea de alarmine pentru a iniţia leziuni locale, precum şi căi în aval. Ghidurile internaţionale atestă eficacitatea corticosteroizilor inhalatori în combinaţie cu β2-agonişti cu acţiune prelungită atât pentru tratamentul de control, cât şi pentru cel la nevoie. Revoluţionând abordarea astmului sever, cinci produse biologice, mepolizumab, benralizumab, reslizumab, dupilumab şi tezepelumab, s-au alăturat omalizumabului, contribuind semnificativ la prevenirea exacerbărilor şi la reducerea necesităţii de corticosteroizi sistemici, minimizând astfel reacţiile adverse ale acestora. Pentru pacienţii cu astm alergic, unul dintre cele mai frecvente fenotipuri de astm, imunoterapia cu alergene poate reprezenta un tratament adiţional eficient alături de terapia farmacologică. Această revizuire explorează modalităţile integrate pentru controlul simptomelor şi îmbunătăţirea calităţii vieţii pacienţilor cu astm şi îşi propune să ofere o perspectivă asupra recomandărilor curente privind terapiile care vizează calea inflamatorie în astmul alergic, precum şi importanţa asocierii imunoterapiei cu alergene asupra evoluţiei bolii.
Introducere
Astmul este o afecţiune eterogenă, caracterizată prin inflamaţia cronică a căilor respiratorii şi definită printr‑un istoric de simptome respiratorii care variază în timp şi în intensitate, precum şi prin limitarea variabilă a fluxului de aer (GINA, 2023; Louis et al., 2022; Stanojevic et al., 2022). Patogeneza astmului este un proces complex şi multifactorial, care implică interacţiuni între factori genetici, de mediu şi imunologici, având drept rezultat diferite fenotipuri de astm şi caracterizat în majoritatea cazurilor de inflamaţie de tip 2 ridicată (T2) (Agache et al., 2022).
Astmul alergic este unul dintre cele mai frecvente fenotipuri de astm (60% dintre astmatici) (GINA, 2023). Este caracterizat prin inflamaţie de tip T2, indusă de sensibilizarea la alergene din mediu, cu apariţia ulterioară a simptomelor tipice de astm după expunerea la alergenul sensibilizant (GINA, 2023; Kappen et al., 2023). Debutul este frecvent în copilărie şi este adesea însoţit de alte comorbidităţi, precum dermatita atopică (DA; 20% dintre adulţii cu dermatită atopică au şi astm) şi rinita alergică (RA; 80% dintre pacienţii cu astm au şi rinită alergică şi 38% dintre pacienţii cu rinită alergică au şi astm) (Bailey, 2021; Acevedo-Prado et al., 2022). În mod remarcabil şi probabil din cauza lipsei de dovezi solide, până în prezent nu există instrumente sau algoritmi de diagnostic care să facă distincţia dintre astmul alergic indus de alergene şi astmul cu sensibilizare alergică (Kappen et al., 2023).
Proporţia de pacienţi astmatici cu sensibilizare alergică variază între 30% şi 79% la copii şi între 30% şi 60% la adulţi, în funcţie de obiectivele evaluate (sensibilizare sau boală alergică simptomatică). Deşi inflamaţia de tip 2 este crucială în astmul alergic, complexitatea mecanismelor fiziopatogenice care stau la baza acestuia sugerează existenţa unei varietăţi de endotipuri. Evaluarea endotipurilor este esenţială pentru un management individualizat, inclusiv pentru optimizarea imunoterapiei cu alergene (AIT) (Agache et al., 2019).
Este bine cunoscut faptul că acarienii din praful de casă (HDM), precum Dermatophagoides pteronyssinus sau Dermatophagoides farinae, sunt sursa celor mai importante alergene de interior asociate cu astmul la nivel mondial şi care conduc la producerea imunoglobulinelor (Ig) E alergen-specifice. Există dovezi semnificative care asociază afecţiunile alergice, precum astmul, RA, DA cu expunerea la HDM sau la alte alergene de interior, iar unele date sugerează că dezvoltarea sensibilizării la HDM are loc înaintea polisensibilizării (Miller, 2018; Posa et al., 2017; Agache et al., 2019). Conform ghidurilor Academiei Europene de Alergologie şi Imunologie Clinică (EAACI), un diagnostic precis de astm alergic indus de acarieni include (1) dovezi de sensibilizare alergică la HDM şi (2) confirmarea antecedentelor de expunere la HDM ca fiind principalul factor care determină apariţia simptomelor de astm şi nivelul de control al bolii. În unele cazuri pot fi necesare evaluări secvenţiale ale simptomelor pe o perioadă de un an, pentru a confirma diagnosticul de astm alergic, iar pentru unii pacienţi cu istoric neclar, provocarea nazală sau bronşică la alergenul incriminat poate fi luată în considerare (Agache et al., 2019).
Evaluarea rolului sensibilizării alergice relevante clinic în fiziopatogenia astmului este un pas important în diagnosticarea bolii, deoarece aceşti pacienţi ar putea beneficia de AIT ca terapie adiţională la tratamentul farmacologic (Del Giacco et al., 2017).
Clasificarea astmului în funcţie de severitate
Clasificarea severităţii astmului este o componentă importantă în gestionarea şi tratamentul acestei afecţiuni respiratorii cronice. Evaluarea severităţii bolii ajută la determinarea tratamentului adecvat şi la ajustarea acestuia pe măsură ce evoluţia astmului se schimbă în timp. Astfel, este important ca pacienţii cu astm să obţină un plan de tratament personalizat şi să îşi monitorizeze simptomele şi funcţia pulmonară cu regularitate (GINA, 2023).
Clasificarea astmului în funcţie de severitate ia în considerare gravitatea simptomelor, gradul de obstrucţie a căilor respiratorii (volumul expirator forţat în prima secundă – VEMS sau debitul expirator maxim – PEF) şi necesarul de medicaţie (tabelul 1) (Weinberger et al., 2019; GINA, 2019). Gradul severităţii se poate modifica în timp şi nu depinde numai de gravitatea bolii, ci şi de răspunsul la tratament, astfel că ghidurile internaţionale actuale iau în considerare evaluarea retrospectivă a severităţii astmului prin necesarul de tratament în vederea obţinerii controlului simptomelor şi al exacerbărilor (tabelul 2) (GINA, 2023).
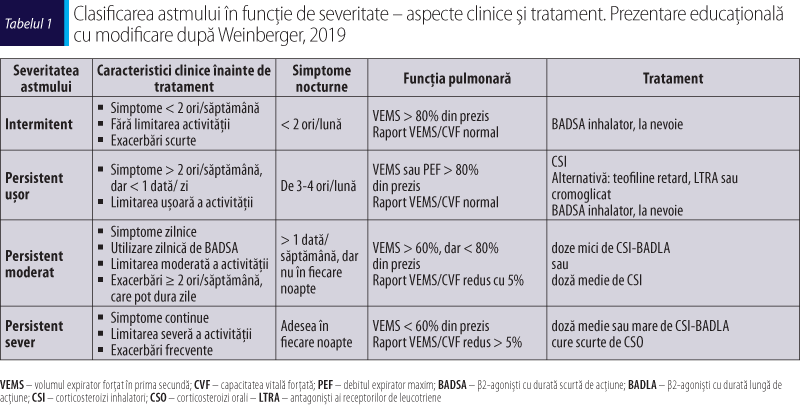

Managementul astmului
Asocierea terapiilor de control pentru ameliorarea răspunsurilor inflamatorii şi a terapiilor de ameliorare a simptomelor pentru reducerea răspunsurilor de remodelare constituie baza ghidurilor de management în astm. Fiziopatogenia bolii stă la baza terapiei în astm. Cu toate acestea, astmul este o afecţiune care poate prezenta exacerbări şi ulterior se poate ameliora, astfel necesitând ajustarea periodică a tratamentului pentru a menţine controlul bolii.
Tratamentul astmului alergic, atât la adulţi, cât şi la copii, se bazează pe utilizarea corticosteroizilor inhalatori (CSI) în combinaţie cu bronhodilatatoare, pentru a obţine şi menţine controlul bolii. Deşi majoritatea pacienţilor cu astm obţin un control bun al bolii prin utilizarea regulată a terapiei de control, 5-10% dintre pacienţi rămân slab controlaţi. Eşecul terapiilor convenţionale la pacienţii corticorezistenţi justifică asocierea unor terapii adiţionale pentru gestionarea bolii (Haidar şi Panaitescu, 2022). În acest sens, rolul central al celulelor T helper 2 (Th2) în reglarea inflamaţiei căilor respiratorii a determinat un interes mare pentru potenţialul terapeutic al abordărilor anti-Th2. Astfel, în prezent există terapii biologice pentru astm reprezentate de anticorpi monoclonali faţă de mediatori-cheie Th2, iar altele sunt în curs de dezvoltare. Mai mult, AIT, un tratament de lungă durată, care inhibă răspunsurile Th2-mediate, ameliorează simptomele la pacienţii cu sensibilizare alergică, evidenţiind astfel rolul patogen central al celulelor Th2 în fiziopatogenia afecţiunilor alergice (Xiaodi et al., 2023).
Principii generale în managementul astmului
Obiectivele pe termen lung ale managementului astmului, din perspectiva clinică, sunt:
- Obţinerea unui control bun al simptomelor şi menţinerea nivelurilor normale de activitate.
- Minimizarea riscului de deces cauzat de astm, a exacerbărilor, a limitării persistente a fluxului de aer şi a reacţiilor adverse ale medicamentelor.
Totodată, obţinerea obiectivelor pacientului în ceea ce priveşte astmul este un aspect important, deoarece acestea pot fi diferite de obiectivele medicale stabilite. Obiectivele comune de gestionare a astmului pot fi atinse în diverse moduri, ţinând cont de sistemele de asistenţă medicală diferite, de disponibilitatea medicamentelor şi de preferinţele culturale şi personale.
Recomandările la nivel populaţional privind tratamentul preferat pentru astm reprezintă cea mai bună abordare generală pentru majoritatea pacienţilor dintr-o anumită populaţie. Pentru astmul sever există recomandări diferite, în funcţie de endotipul inflamator (de tip T2 sau non-T2). Deciziile terapeutice individuale trebuie să ia în considerare toate caracteristicile personale, factorii de risc, comorbidităţile şi fenotipul de astm, care pot anticipa răspunsul la tratament atât în ceea ce priveşte simptomatologia, cât şi riscul de exacerbare, împreună cu obiectivele personale şi aspectele practice precum tehnica inhalatoare, aderenţa şi accesul la tratament. Pentru adulţi şi adolescenţi se recomandă două căi de tratament (tratamentul preferat şi alternativa), în funcţie de disponibilitatea medicamentelor, de factorii de risc şi de aderenţa pacientului (GINA, 2023).
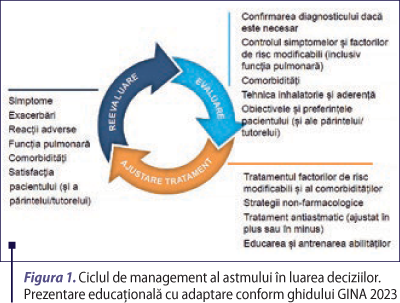
Managementul personalizat bazat pe controlul astmului
Controlul astmului include două aspecte: controlul simptomelor şi reducerea riscurilor. În managementul astmului bazat pe control, strategiile farmacologice şi nefarmacologice sunt adaptate printr-un proces continuu, care implică evaluarea, ajustarea tratamentului şi reevaluarea răspunsului (figura 1), pentru a atinge obiectivele tratamentului în astm.
- Evaluarea implică o serie de aspecte: confirmarea diagnosticului de astm dacă este necesar, controlul simptomelor şi al factorilor de risc pentru exacerbări, declinul funcţiei pulmonare, reacţiile adverse ale medicamentelor, tehnica inhalatoare şi aderenţa la tratament. Totodată, implică evaluarea comorbidităţilor, a obiectivelor şi a preferinţelor pacientului şi ale părintelui/tutorelui.
- Ajustarea tratamentului se realizează pe baza acestor evaluări şi include tratarea factorilor de risc modificabili şi a comorbidităţilor, strategiile nefarmacologice relevante, educarea şi antrenarea abilităţilor şi ajustarea medicaţiei după cum este necesar. Pentru adulţi şi adolescenţi, tratamentul de control şi la nevoie preferat, în toate treptele, este reprezentat de combinaţia CSI-formoterol.
- Reevaluarea pacientului în conformitate cu obiectivele tratamentului constă în evaluarea factorilor care influenţează simptomele, riscul de exacerbări şi reacţii adverse, comorbidităţile şi satisfacţia pacientului şi ale părintelui/tutorelui. Se recomandă determinarea de investigaţii suplimentare şi reajustarea tratamentului dacă este necesar (GINA,2 023).
Din 2014, conform ghidurilor internaţionale, managementul astmului s-a concentrat nu doar pe controlul simptomelor de astm, ci şi pe managementul personalizat al factorilor de risc modificabili ai pacientului pentru exacerbări, alte reacţii adverse şi multimorbiditate, luând în considerare şi preferinţele şi obiectivele pacientului. Odată cu introducerea CSI în managementul astmului, au fost observate îmbunătăţiri importante ale controlului simptomelor şi ale funcţiei pulmonare, iar exacerbările şi mortalitatea legate de astm au scăzut. Cu toate acestea, pacienţii cu astm aparent uşor şi simptome reduse sau intermitente pot fi încă expuşi riscului de exacerbări severe. În plus, unii pacienţi continuă să aibă exacerbări, în ciuda unui control bun al simptomelor, iar pentru pacienţii cu simptome continue, reacţiile adverse pot fi o problemă când dozele de CSI continuă să crească. Prin urmare, în managementul bazat pe control, ambele domenii ale controlului astmului trebuie luate în considerare când se alege tratamentul şi se evaluează răspunsul acestuia (GINA, 2023).
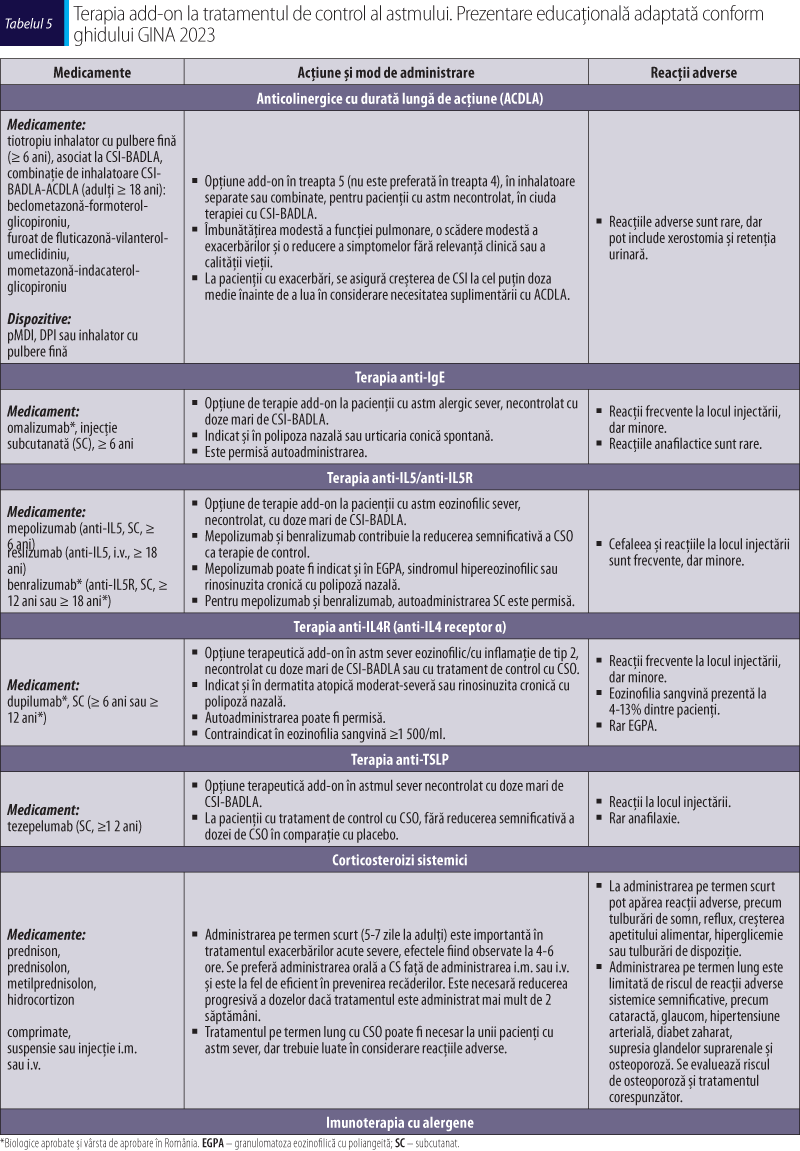
Strategii farmacologice pentru controlul simptomelor şi reducerea riscurilor
Opţiunile farmacologice pentru tratamentul pe termen lung al astmului sunt reprezentate de următoarele categorii principale:
Tratamentul de control (de întreţinere)
În cadrul GINA Track 1 (schema de tratament preferată), tratamentul de control în treptele 1-2 constă în administrarea la nevoie de CSI-formoterol în doză mică, administrate la apariţia simptomelor şi înainte de efortul fizic sau de expunerea la alergene. În treptele 3-5, tratamentul de control constă în administrarea zilnică sau de două ori pe zi de CSI-formoterol în funcţie de treapta de severitate, asociată cu administrarea la nevoie, şi poartă denumirea de terapie MART (maintenance-and-reliever therapy) (tabelul 3). Dozele şi schema tratamentului de control necesită optimizare pentru a diminua riscul de reacţii adverse ale medicamentelor, inclusiv necesitatea curelor cu corticosteroizi orali (CSO) (GINA, 2023).
Tratamentul la nevoie (de salvare sau reliever)
Recomandat pentru ameliorarea simptomelor (inclusiv în timpul agravării astmului sau în exacerbări) şi pentru prevenirea pe termen scurt a bronhoconstricţiei induse de efort. Medicaţia la nevoie include terapia bronhodilatatoare în combinaţie cu cea antiinflamatoare la nevoie (combinaţii CSI-formoterol sau CSI-BADSA) şi terapia bronhodilatatoare de scurtă durată (BADSA şi anticolinergicele cu durată scurtă de acţiune) (tabelul 4). Utilizarea în exces de BADSA (de exemplu, utilizarea într-un an a ≥ 3 flacoane de salbutamol a 200 de doze, corespunzând unei utilizări zilnice) creşte riscul de exacerbări în astm (GINA, 2023).
Tratamentul adiţional (add-on), care include pacienţii cu astm sever (tabelul 5)

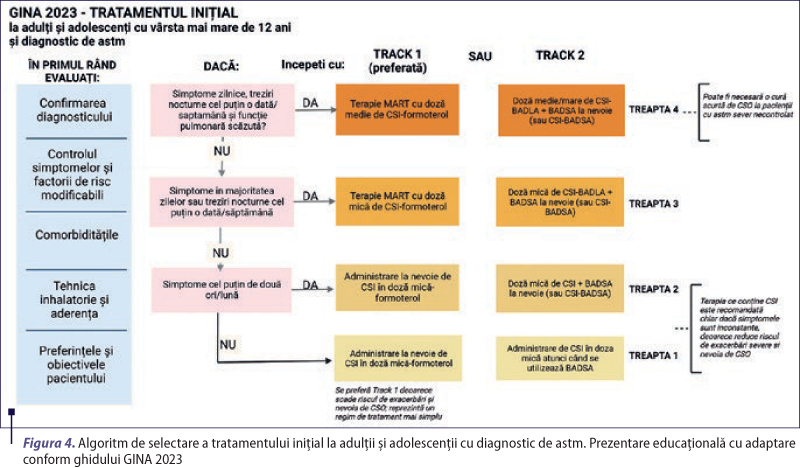
Tratamentul iniţial al astmului la adulţi şi adolescenţi
Pe baza dovezilor trecute şi actuale, ghidurile internaţionale recomandă tratamentul zilnic cu CSI în doză mică sau după cum este necesar, doză mică de CSI-formoterol la toţi adulţii şi adolescenţii cu astm uşor, pentru a reduce riscul de exacerbări severe (tabelul 6). De asemenea, toţi pacienţii trebuie să posede un inhalator pentru ameliorarea rapidă a simptomelor, de preferinţă un antiinflamator, la nevoie. Pentru a obţine cele mai bune rezultate, tratamentul antiinflamator trebuie iniţiat cât de repede posibil după stabilirea diagnosticului de astm, deoarece:
CSI-formoterol în doză mică, la nevoie, reduce riscul de exacerbări severe şi prezentări de urgenţă sau spitalizări cu 65% în comparaţie cu BADSA în monoterapie. Astfel, acest regim antiinflamator scade semnificativ riscul de exacerbări severe, indiferent de frecvenţa simptomelor iniţiale, funcţia pulmonară, istoricul de exacerbare sau profilul inflamator (T2-înalt sau non-T2).
Iniţierea tratamentului cu BADSA în monoterapie îi determină pe pacienţi să-l considere principalul tratament antiastmatic şi reprezintă un risc de aderenţă scăzută când este prescris ulterior un CSI zilnic.
Iniţierea precoce a tratamentului cu doze mici de CSI ajută la îmbunătăţirea funcţiei pulmonare, spre deosebire de tratamentul iniţiat la mai mult de 2-4 ani de la apariţia simptomelor.
Pacienţii fără tratament cu CSI, care prezintă o exacerbare severă, pe termen lung prezintă un declin al funcţiei pulmonare mai important faţă de cei la care s-a iniţiat tratamentul cu CSI.
În astmul ocupaţional, eliminarea timpurie a expunerii la agentul sensibilizant şi tratamentul precoce cu CSI cresc probabilitatea remiterii simptomelor, cu îmbunătăţirea funcţiei pulmonare şi a hiperreactivităţii căilor respiratorii (GINA, 2023).
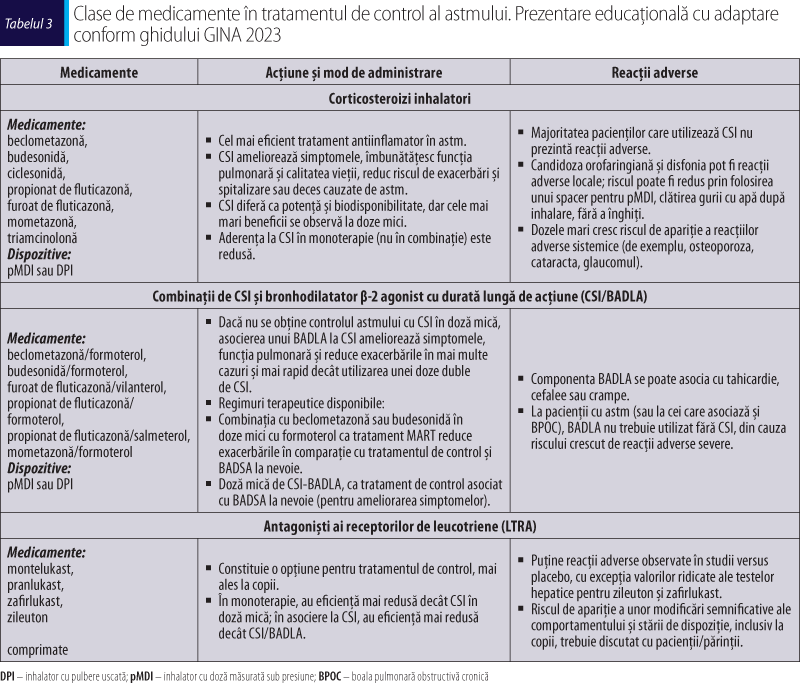
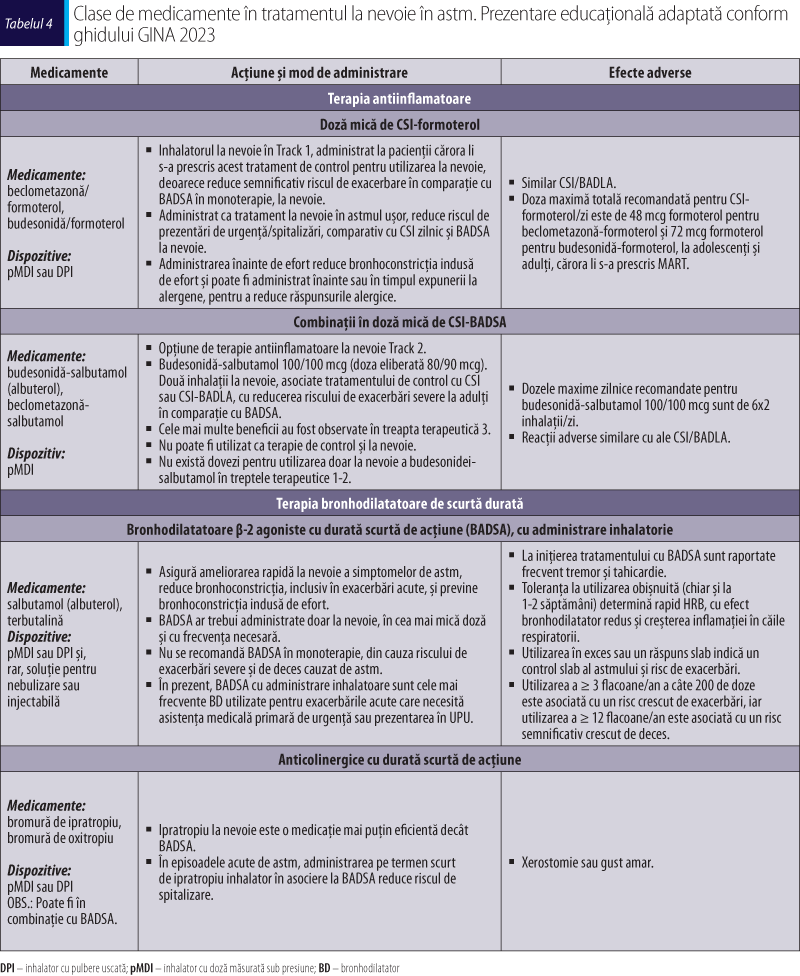
Ajustarea tratamentului de astm la adulţi şi adolescenţi
Odată ce tratamentul astmului a fost iniţiat, deciziile cu privire la continuarea tratamentului se bazează pe un ciclu continuu de evaluare, ajustare a tratamentului şi reevaluare a răspunsului. Pentru fiecare pacient, pe lângă tratamentul factorilor de risc modificabili, medicaţia antiastmatică poate fi ajustată fie într-o treaptă superioară (step-up), fie într-o treaptă inferioară (step-down), pentru a obţine un control bun al simptomelor şi a diminua riscul viitor de exacerbări, limitarea persistentă a fluxului de aer şi reacţiile adverse ale medicamentelor. Odată ce un control bun al astmului a fost menţinut timp de 2-3 luni, tratamentul poate fi redus la o treaptă terapeutică inferioară, pentru a determina un tratament minim eficient al pacientului (GINA, 2023; Agache şi Akdis, 2022).
Dacă un pacient are simptome şi/sau exacerbări persistente necontrolate în ciuda a 2-3 luni de tratament care conţine CSI, se recomandă evaluarea şi corectarea următoarelor aspecte înainte de a lua în considerare orice treaptă de tratament: tehnica inhalatoare incorectă, aderenţa slabă, expunerea persistentă la domiciliu/la locul de muncă la agenţi (de exemplu, alergene, fum de ţigaretă, poluarea aerului din interior sau exterior sau la unele medicamente), comorbidităţi care pot contribui la simptomele respiratorii şi la scăderea calităţii vieţii sau un diagnostic eronat (GINA, 2023).
Căi de tratament în astm pentru adulţi şi adolescenţi
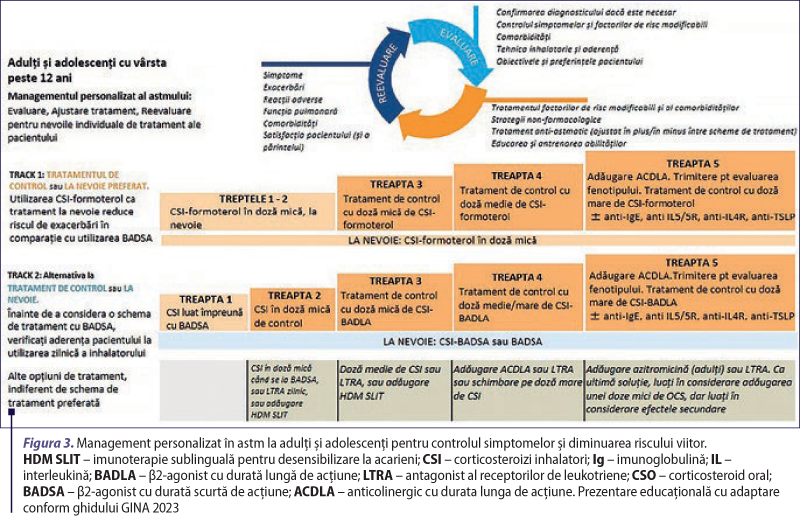
Figurile 2, 3 şi 4 prezintă cel mai recent algoritm pentru gestionarea astmului la adulţi şi adolescenţi, pe categorii de astm uşor, moderat şi sever. În schema de tratament 1 (Track 1) (preferată), medicaţia la nevoie este reprezentată de CSI-formoterol în doză mică, iar în schema de tratament 2 (Track 2) medicaţia la nevoie este reprezentată de BADSA sau CSI-BADSA. Cele două căi indică modul în care tratamentul poate fi intensificat sau redus folosind aceeaşi medicaţie la nevoie, la fiecare treaptă (GINA, 2023; O’Malley, 2023).
Track 1. CSI-formoterol în doză mică, la nevoie
Reprezintă abordarea recomandată de ghidurile internaţionale pentru adulţi şi adolescenţi, deoarece utilizarea de CSI-formoterol în doză mică (ca antiinflamator, la nevoie) reduce riscul de exacerbări severe în comparaţie cu utilizarea BADSA ca tratament la nevoie. Când este prescrisă, schema terapeutică este mai simplă, pacienţii utilizând un singur medicament de control şi la nevoie în toate treptele de tratament. Prin această abordare, când un pacient prezintă simptome de astm, indiferent de treapta terapeutică, se folosesc doze mici de CSI-formoterol într-un singur inhalator, pentru ameliorarea simptomelor şi pentru efectele sale antiinflamatoare. În treptele terapeutice 3-5, pacienţii au ca tratament zilnic de control şi la nevoie combinaţia CSI-formoterol (MART) (GINA, 2023).
Track 2. BADSA sau CSI-BADSA la nevoie
Opţiune alternativă când Track 1 nu este disponibil sau când astmul este stabil, cu o bună aderenţă şi fără exacerbări sub terapia curentă. Cu toate acestea, înainte de a prescrie o schemă de tratament care include BADSA în monoterapie, se ia în considerare dacă pacientul este în măsură să respecte terapia de control, în caz contrar există un risc mai mare de exacerbări. În treapta terapeutică 1 se utilizează BADSA şi CSI în doză mică pentru ameliorarea simptomelor când apar (într-un inhalator combinat sau administrarea de CSI imediat după BADSA). În treptele 2-5, BADSA sau combinaţia CSI-BADSA sunt utilizate pentru ameliorarea simptomelor la pacienţii cu tratament zilnic, de control, cu CSI. Dacă medicamentele de control şi la nevoie sunt în dispozitive diferite, este necesar ca pacientul să utilizeze corect fiecare inhalator (GINA, 2023).
Ajustarea medicaţiei antiastmatice (step-up şi step-down)
Tratamentul poate fi intensificat sau redus de-a lungul unei căi (Track), folosind acelaşi medicament la nevoie la fiecare treaptă terapeutică, sau poate fi schimbat între căi, în funcţie de nevoile şi de preferinţele individuale ale pacientului. Înainte de a intensifica tratamentul, se verifică dacă există aspecte comune, precum tehnica inhalatoare incorectă, aderenţa slabă, expunerea la factori de mediu şi se confirmă dacă simptomele se datorează astmului (GINA, 2023).
Abordarea progresivă, în trepte, pentru ajustarea tratamentului conform nevoilor individuale ale pacientului
După iniţierea tratamentului antiastmatic (figurile 2 şi 3), deciziile ulterioare se bazează pe un proces de evaluare a pacientului, de ajustare a tratamentului (farmacologic şi nefarmacologic) şi de reevaluare a răspunsului la tratament. Ghidurile internaţionale recomandă o abordare în cinci trepte, în care tratamentul este ajustat (step-up sau step-down) în funcţie de nivelul de control, astfel încât tratamentul să ofere o eficienţă crescută, cu medicaţie minimă necesară (GINA, 2023; O’Malley, 2023). Pentru fiecare treaptă sunt enumerate şi alte opţiuni pentru tratamentul de control cu eficienţă mai mică în comparaţie cu tratamentul de control preferat, dar pot fi luate în considerare la pacienţii cu anumiţi factori de risc sau dacă tratamentul de control preferat nu este disponibil (GINA, 2023).
TREAPTA TERAPEUTICĂ 1
Tratamentul preferat în treapta 1 pentru adulţi şi adolescenţi este combinaţia de CSI-formoterol în doză mică, la nevoie, pentru ameliorarea simptomelor şi dacă este necesar înainte de efortul fizic (Track 1) (GINA, 2023). Recomandările din treapta 1 sunt pentru: tratament iniţial al astmului, la pacienţii cu simptome mai puţin de două ori pe lună şi fără factori de risc de exacerbare; step-down la pacienţii cu astm bine controlat sub tratament regulat cu CSI sau antagonişti ai receptorilor de leucotriene (LTRA). În Track 1, tratamentul preferat (CSI-formoterol la nevoie) este acelaşi pentru treptele 1 şi 2. Aspectele importante pentru extinderea recomandării din treapta 2 pentru CSI-formoterol în doză mică, doar la nevoie, la treapta 1 (de exemplu, excluderea monoterapiei cu BADSA), sunt descrise în continuare.
- Pacienţii cu perioade scurte simptomatice pot avea exacerbări severe sau fatale. Se recomandă evaluarea şi abordarea factorilor de risc pentru exacerbări, precum şi controlul simptomelor.
- Reducerea riscului de exacerbări severe la administrarea de CSI-formoterol în comparaţie cu BADSA la nevoie, chiar şi la pacienţii cu utilizare BADSA de două ori pe săptămână sau mai puţin la momentul iniţial.
- Aderenţă redusă la administrarea zilnică de CSI la pacienţii cu simptomatologie mai puţin frecventă, care i-ar expune riscului de tratament cu BADSA în monoterapie.
- Utilizarea excesivă de BADSA (de exemplu, utilizarea a ≥ 3 flacoane/an a câte 200 de doze) este asociată cu un risc crescut de exacerbări şi mortalitate.
- Este importantă evitarea recomandărilor contradictorii, deoarece în trecut pacienţii primeau iniţial recomandări de a utiliza BADSA pentru ameliorarea simptomelor, dar ulterior (deşi acest tratament este eficient din perspectiva acestora) li s-a spus că este necesar să utilizeze zilnic un tratament de control pentru a reduce utilizarea BADSA şi pentru a preveni exacerbările (GINA, 2023).
Puncte practice în astmul uşor pentru CSI-formoterol cu administrare doar la nevoie
Doza uzuală de budesonidă-formoterol la nevoie în astmul uşor este de o inhalaţie a 200/6 mcg (doza eliberată 160/4,5 mcg) administrată ori de câte ori este nevoie, pentru ameliorarea simptomelor sau înaintea efortului fizic, dacă este necesar. Doza maximă totală recomandată/zi este de 72 mcg de formoterol (doza eliberată: 54 mcg). Cu toate acestea, în studiile clinice asupra astmului uşor, utilizarea medie de budesonidă-formoterol a fost de aproximativ 3-4 inhalaţii/săptămână. Toate dovezile de eficacitate şi de siguranţă pentru CSI-formoterol în doză mică disponibile în prezent sunt cu budesonidă-formoterol şi beclometazonă-formoterol. Ambele variante sunt bine cunoscute ca tratament de control şi la nevoie în treptele terapeutice 3-5. Utilizarea de budesonidă-formoterol în doză mică înaintea efortului fizic la pacienţii cu astm uşor ameliorează simptomele şi înainte de efort reduce bronhoconstricţia într-o măsură similară cu administrarea zilnică de CSI în doză mică cu BADSA pentru ameliorarea simptomelor şi înainte de efortul fizic.
Alte opţiuni pentru tratamentul de control în treapta 1
- CSI în doză mică utilizat oricând se utilizează BADSA. Se recomandă la pacienţii cu simptome mai puţin de două ori pe lună sau care sunt în măsură să renunţe la tratamentul regulat cu CSI. Pentru această recomandare, cele mai importante aspecte sunt asociate cu reducerea riscului exacerbărilor severe şi cu dificultatea de a obţine o aderenţă bună la CSI prescrise în mod regulat, la pacienţii cu simptome rare. De asemenea, este o opţiune în ţările în care CSI-formoterol nu este disponibilă sau accesibilă.
- Utilizarea zilnică de CSI în doză mică în treapta terapeutică 1 pentru pacienţii cu simptome mai puţin de două ori pe lună, pentru a reduce riscul de exacerbări. Totuşi, este puţin probabil ca aceşti pacienţi să utilizeze CSI regulat şi există riscul utilizării BADSA în monoterapie, aşadar nu se mai recomandă (GINA, 2023).
TREAPTA TERAPEUTICĂ 2
Tratamentul preferat în treapta 2 pentru adulţi şi adolescenţi este combinaţia de CSI-formoterol în doză mică, la nevoie pentru ameliorarea simptomelor şi dacă este necesar înainte de efortul fizic (Track 1) (GINA, 2023). Cele mai importante considerente ale ghidurilor internaţionale în recomandarea de CSI-formoterol în doză mică, doar la nevoie, în treapta 2, sunt: prevenirea exacerbărilor severe la pacienţii cu simptome uşoare sau rare, declanşate în prezenţa unor factori imprevizibili, precum infecţiile virale, expunerea la alergene, poluarea sau stresul; evitarea necesităţii administrării zilnice de CSI la pacienţii cu astm uşor, care prezintă aderenţă redusă la tratamentul cu CSI prescris, ceea ce îi expune la riscul unui tratament exclusiv cu BADSA; reducerea semnificativă a exacerbărilor severe sub terapie cu CSI-formoterol la nevoie, comparativ cu CSI zilnic, în rândul pacienţilor trataţi anterior cu BADSA în monoterapie, fără diferenţe semnificative pentru pacienţii cu astm bine controlat cu CSI sau LTRA la momentul iniţial; diferenţele mici în controlul simptomelor şi asupra funcţiei pulmonare în comparaţie cu CSI zilnic au fost considerate mai puţin importante, deoarece aceste rezultate au avut valori mai mici decât diferenţa minimă importantă clinic; reducerea oxidului nitric fracţionat exhalat (FeNO) după administrarea de budesonidă-formoterol la nevoie similară ca în cazul tratamentului de control cu CSI şi lipsa unei diferenţe semnificative în efectul tratamentului cu budesonidă-formoterol la nevoie în funcţie de eozinofilele iniţiale sau FeNO de bază (GINA, 2023).
Puncte practice în astmul uşor pentru CSI-formoterol cu administrare la nevoie
Doza uzuală de budesonidă-formoterol la nevoie în astmul uşor este de o inhalaţie a 200/6 mcg (doza eliberată: 160/4,5 mcg) administrată ori de câte ori este nevoie pentru ameliorarea simptomelor. Pe baza informaţiilor despre produs, doza maximă totală recomandată/zi este de 72 mcg de formoterol (54 mcg doză eliberată). Cu toate acestea, în studiile clinice asupra astmului uşor, utilizarea medie de budesonidă-formoterol a fost de aproximativ 3-4 inhalaţii/săptămână. Toate dovezile de eficacitate şi siguranţă pentru CSI-formoterol în doză mică disponibile în prezent sunt pentru budesonidă-formoterol în doză mică, dar şi beclometazona-formoterol poate fi utilizată. Ambele variante sunt bine cunoscute ca tratament de control şi la nevoie în treptele terapeutice 3-5. Utilizarea de budesonidă în doză mică şi formoterol înaintea efortului fizic la pacienţii cu astm uşor ameliorează simptomele şi înainte de efort reduce bronhoconstricţia într-o măsură similară cu administrarea zilnică de CSI în doză mică cu BADSA pentru ameliorarea simptomelor şi înainte de efortul fizic. În astmul uşor, utilizarea CSI-formoterol în doză mică la nevoie reduce riscul de exacerbări severe faţă de tratamentul cu BADSA în monoterapie (GINA, 2023).
Tratamentul alternativ în treapta 2 pentru adulţi şi adolescenţi: CSI în doză mică, zilnic, plus BADSA la nevoie (Track 2)
Se recomandă administrarea zilnică de CSI în doză mică la pacienţii cu simptome în majoritatea sau în toate zilele din săptămână. Tratamentul regulat cu CSI în doză mică reduce riscul de exacerbări severe, de spitalizare şi de mortalitate. De asemenea, reduce simptomele şi bronhoconstricţia indusă de efort (GINA, 2023).
Alte opţiuni pentru tratamentul de control în treapta 2
- CSI în doză mică utilizat oricând se utilizează BADSA (în combinaţie sau în inhalatoare separate), alternativă când CSI-formoterol la nevoie nu este disponibil şi este puţin probabil ca pacientul să utilizeze CSI cu regularitate.
- LTRA, cu eficacitate mai scăzută faţă de CSI de control, mai ales în prevenirea exacerbărilor. Înainte de a prescrie montelukast, trebuie luate în considerare beneficiile şi riscurile acestuia, iar pacienţii trebuie informaţi cu privire la riscul de evenimente neuropsihiatrice.
- Combinaţie de CSI-BADLA în doză mică cu utilizare regulată, zilnic, ca tratament iniţial de control (la pacienţii trataţi anterior cu BADSA în monoterapie), determină îmbunătăţirea rapidă a simptomelor şi creşterea VEMS în comparaţie cu CSI în doză mică, dar este mai costisitor, iar rata exacerbărilor este similară.
- Pentru astmul alergic strict sezonier (de exemplu, cu polen de mesteacăn), la apariţia simptomelor sugestive se recomandă iniţierea imediată a tratamentul zilnic, regulat, cu CSI sau CSI-formoterol în doză mică la nevoie şi continuarea pentru încă patru săptămâni după încheierea sezonului polinic.
- Pentru adulţii cu rinită şi sensibilizare la HDM şi VEMS > 70% din prezis, se ia în considerare adăugarea AIT (GINA, 2023).
TREAPTA TERAPEUTICĂ 3
Înainte de a lua în considerare o treaptă terapeutică superioară, se verifică existenţa unor aspecte precum tehnica inhalatoare incorectă, aderenţa redusă la tratament, expunerea la factori de mediu şi confirmarea simptomelor datorate astmului.
Pentru adulţi şi adolescenţi, opţiunea de tratament preferată în treapta 3 este CSI-formoterol în doză redusă, ca tratament MART, care reduce riscul de exacerbări severe în comparaţie cu alte opţiuni (tratament de control cu CSI-BADLA sau CSI în doză mare) cu BADSA la nevoie. În acest regim, budesonida-formoterol sau beclometazona-formoterol sunt utilizate atât ca tratament zilnic de control, cât şi la nevoie pentru ameliorarea simptomelor. Utilizarea de CSI-formoterol ca tratament antiinflamator la nevoie, în toate treptele terapeutice, constituie un regim simplu, cu o tranziţie uşoară în cazul în care tratamentul necesită a fi intensificat (de exemplu, de la treapta 2 la treapta 3 sau de la treapta 3 la treapta 4), fără a fi nevoie de un medicament adiţional, o prescripţie medicală suplimentară sau un alt tip de inhalator (GINA, 2023).
Puncte practice pentru tratamentul de control şi la nevoie cu CSI-formoterol în doză mică
Tratamentul de control şi la nevoie cu CSI-formoterol în doză mică în treapta 3 poate fi prescris cu budesonidă-formoterol în doză mică (≥ 12 ani) sau beclometazonă-formoterol în doză mică (≥ 18 ani). Doza uzuală de budesonidă-formoterol pentru MART este de 200/6 mcg doza măsurată (160/4,5 mcg doza eliberată), iar pentru beclometazonă-formoterol, este de 100/6 doză măsurată (87,5/5 mcg doza eliberată). Pentru fiecare dintre aceste combinaţii sunt prescrise 2x1 inhalaţie/zi plus 1 inhalaţie ori de câte ori este nevoie pentru ameliorarea simptomelor. Doza maximă totală recomandată pe zi (totalul dozelor de control şi la nevoie, pe baza informaţiilor despre produs) pentru budesonidă-formoterol este de 72 mcg de formoterol doză măsurată (54 mcg doză eliberată), respectiv 48 mcg de formoterol doză măsurată (36 mcg doză eliberată) pentru beclometazonă-formoterol. CSI-formoterol nu trebuie utilizat la nevoie la pacienţii cu un alt tratament de control cu CSI-BADLA, deoarece lipsesc dovezile clinice privind siguranţa şi eficacitate (GINA, 2023).
Tratament alternativ în treapta 3 pentru adulţi şi adolescenţi: CSI-BADLA în doză mică de control plus BADSA la nevoie sau plus combinaţie de CSI-BADSA la nevoie (Track 2)
Inhalatoarele combinate CSI-BADLA aprobate în prezent pentru tratamentul de control al astmului în treapta terapeutică 3 includ doze mici de propionat de fluticazonă-formoterol, furoat de fluticazonă-vilanterol, propionat de fluticazonă-salmeterol, beclometazonă-formoterol, budesonidă-formoterol, mometazonă-formoterol-indacaterol şi mometazonă-formoterol-indacaterol.
Tratamentul de control cu CSI-BADLA plus BADSA la nevoie este o abordare alternativă când MART nu este posibilă sau dacă astmul este stabil, aderenţa e bună şi nu sunt exacerbări sub terapia curentă. Pentru pacienţii cu CSI de control, trecerea la tratamentul combinat de control cu CSI-BADLA oferă îmbunătăţiri suplimentare ale simptomelor şi ale funcţiei pulmonare şi un risc redus de exacerbări în comparaţie cu aceeaşi doză de CSI. Tratamentul de control cu CSI-BADLA plus combinaţie de CSI-BADSA la nevoie (≥ 18 ani) este o abordare alternativă la pacienţii care prezintă un control slab al astmului şi cu antecedente de exacerbări severe, sub tratament de control cu CSI-BADLA în doză mică sau cu CSI în doză medie. Utilizarea CSI-BADSA la nevoie reduce riscul exacerbărilor severe în comparaţie cu BADSA în monoterapie. Cea mai mare parte a beneficiului este observată la pacienţii care urmează tratament de control în treapta 3. Pentru budesonidă-salbutamol pMDI de 100/100 mcg (doza eliberată 80/90 mcg), doza maximă este de 6x2 inhalaţii/zi. Sunt esenţiale educarea pacienţilor cu privire la scopul diferit al inhalatoarelor de control şi la nevoie şi instruirea cu privire la tehnica inhalatoare corectă cu ambele dispozitive, dacă acestea sunt diferite; acest lucru este valabil şi pentru medicaţia la nevoie cu BADSA (GINA, 2023).
Alte opţiuni pentru tratamentul de control în treapta 3 la adulţi şi adolescenţi
- Pentru pacienţii adulţi care asociază rinită alergică şi prezintă sensibilizare la HDM, care au astm necontrolat, în ciuda dozelor mici până la mari de CSI, şi VEMS > 70% din prezis, se poate lua în considerare adăugarea AIT.
- Alternativa este creşterea de CSI la doza medie, deşi la nivel populaţional aceasta este mai puţin eficientă decât adăugarea unui BADLA. Alte opţiuni mai puţin eficiente sunt CSI în doză mică-LTRA sau doză mică de CSI-teofilină cu eliberare prelungită (GINA, 2023).
TREAPTA TERAPEUTICĂ 4
Deşi cele mai multe beneficii ale CSI se obţin la doze mici, răspunsul individual variază, iar unii pacienţi al căror astm este necontrolat cu CSI-BADLA în doză mică, în pofida aderenţei bune şi a tehnicii corecte de inhalare, pot beneficia de creşterea dozei de control la doza medie. CSI în doză mare nu mai este recomandată în treapta terapeutică 4. Înaintea trecerii la o treaptă terapeutică superioară, se verifică dacă există aspecte precum tehnica inhalatoare incorectă, aderenţa slabă, expunerea la factori de mediu şi se confirmă dacă simptomele se datorează astmului. Combinaţia CSI-formoterol ca terapie MART este mai eficientă în reducerea exacerbărilor decât aceeaşi doză de CSI-BADLA de control sau doze mai mari de CSI. În treapta 4, regimul MART poate fi prescris ca tratament de control cu budesonidă-formoterol în doză medie sau beclometazonă-formoterol în doză medie, prin creşterea dozei de control de 2x2 inhalaţii/zi, iar la nevoie, o inhalaţie de CSI-formoterol în doză mică. Doza uzuală de budesonidă-formoterol pentru treapta 4 MART este de 200/6 mcg doză măsurată (doza eliberată: 160/4,5 mcg), iar pentru beclometazonă-formoterol, doza uzuală este de 100/6 doză măsurată (doza eliberată: 87,5/5 mcg), prescrise ca 2x2 inhalaţii/zi şi o inhalaţie ori de câte ori este nevoie pentru ameliorarea simptomelor. Pe baza informaţiilor despre produs, pentru budesonidă-formoterol doza maximă totală recomandată/zi de formoterol este de 72 mcg doză măsurată (doza eliberată 54 mcg) şi 48 mcg doză măsurată (doza eliberată: 36 mcg) pentru beclometazonă-formoterol (GINA, 2023).
Tratament alternativ în treapta 4 pentru adulţi şi adolescenţi: doză medie sau mare de CSI-BADLA plus BADSA la nevoie (Track 2)
Doza medie sau mare de CSI-BADLA de control plus BADSA la nevoie este o abordare alternativă atunci când MART nu este posibilă sau dacă astmul este stabil, aderenţa e bună şi nu sunt exacerbări sub terapia curentă. Răspunsul individual la CSI variază, iar unii pacienţi al căror astm este necontrolat sau cu exacerbări frecvente sub tratament cu CSI-BADLA în doză mică, în ciuda aderenţei bune şi a tehnicii corecte de inhalare, pot beneficia de tratament de control cu doză medie de CSI -BADLA plus BADSA la nevoie, dacă MART nu este disponibilă. Înainte de a prescrie un regim de tratament cu BADSA la nevoie, se ia în considerare posibilitatea ca pacientul să respecte tratamentul care conţine CSI, în caz contrar există riscul crescut de exacerbări. Ocazional, pot fi necesare doze mari de CSI-BADLA. Tratamentul de control cu doză mare de CSI-BADLA plus combinaţie de CSI-BADSA la nevoie (≥ 18 ani) reprezintă o nouă opţiune în treapta terapeutică 4. Pentru budesonidă-salbutamol pMDI cu doza măsurată 100/100 mcg (doza eliberată 80/90 mcg), doza maximă este de 6x2 inhalaţii/zi (GINA, 2023).
Alte opţiuni pentru tratamentul de control în treapta 4 la adulţi şi adolescenţi
- Antagoniştii muscarinici cu durată lungă de acţiune (ACDLA) pot fi luaţi în considerare ca terapie suplimentară pentru pacienţii cu vârsta ≥ 18 ani, sub formă de inhalator triplu combinat (beclometazonă-formoterol-glicopironiu, furoat de fluticazonă-vilanterol-umeclidiniu, mometazonă-indacaterol-glicopironiu) sau sub formă de inhalator separat pentru pacienţii cu vârsta de peste 6 ani (tiotropiu) dacă astmul este persistent necontrolat în ciuda terapiei cu doză medie sau mare de CSI-BADLA. Adăugarea ACDLA la tratamentul de control determină o creştere modestă a funcţiei pulmonare, o scădere redusă a riscului de exacerbări şi fără impact asupra simptomelor clinice. Înainte de a lua în considerare ACDLA pentru pacienţii cu exacerbări, se poate creşte doza de CSI, cel puţin la doza medie, sau se trece la MART.
- Imunoterapia cu alergene. La adulţii cu astm suboptimal controlat în ciuda dozelor mici sau mari de CSI, dar numai cu un VEMS > 70% din prezis şi care asociază rinită şi sensibilizare la HDM, se ia în considerare adăugarea imunoterapiei sublinguale cu alergene (SLIT).
- Alte opţiuni pentru adulţi sau adolescenţi care pot fi adăugate la CSI în doză medie sau mare includ LTRA şi teofilina cu eliberare prelungită. Pentru budesonidă cu administrare în doze medii sau mari, eficacitatea poate fi îmbunătăţită prin administrarea de patru ori pe zi, însă aderenţa la tratament poate reprezenta o problemă. Pentru alte CSI, este adecvată dozarea de două ori pe zi (GINA, 2023).
TREAPTA TERAPEUTICĂ 5
La pacienţii cu simptome persistente sau exacerbări în ciuda tehnicii corecte de inhalare şi a aderenţei bune la tratamentul de treaptă 4, la care au fost luate în considerare opţiuni de control (factori de risc, optimizarea tratamentului) se recomandă evaluarea de către medicul specialist, inclusiv pentru identificarea fenotipului astmului sever şi pentru tratamentul add-on potenţial (GINA, 2023).Terapia add-on (terapie asociată la tratamentul de control):
- Combinaţia de CSI-BADLA în doză mare poate fi luată în considerare la adulţi şi adolescenţi, dar pentru majoritatea pacienţilor creşterea dozei de CSI oferă puţine beneficii suplimentare şi există un risc crescut de reacţii adverse, inclusiv supresia suprarenală. O doză mare este recomandată provizoriu, timp de 3-6 luni când nu se poate obţine un control bun al astmului cu CSI în doză medie plus BADLA şi/sau un al treilea controlor (de exemplu, LTRA sau teofilină cu eliberare pelungită).
- ACDLA sunt recomandaţi pacienţilor ≥ 18 ani în inhalatoare combinate (beclometazonă-formoterol-glicopironiu, furoat de fluticazonă-vilanterol-umeclidiniu şi mometazonă-indacaterol-glicopironiu) şi copiilor ≥ 6 ani (tiotropiu) în inhalator separat, în astmul necontrolat în ciuda terapiei cu doză medie sau mare de CSI-BADLA. Adăugarea ACDLA la CSI-BADLA determină o creştere modestă a funcţiei pulmonare şi o mică scădere a exacerbărilor, fără impact asupra simptomelor clinice şi fără modificări importante asupra calităţii vieţii. Pentru pacienţii cu exacerbări în ciuda terapiei cu CSI-BADLA, este esenţial să se administreze o cantitate suficientă de CSI, cel puţin o doză medie de CSI-BADLA, înainte de a lua în considerare adăugarea de ACDLA. Pentru pacienţii cărora li s-a prescris un CSI-BADLA-ACDLA cu un BADLA, altul decât formoterol, medicaţia la nevoie este BADSA. Pacienţii cărora li s-a prescris CSI-formoterol-ACDLA pot continua tratamentul la nevoie cu CSI-formoterol.
- Azitromicina add-on poate fi luată în considerare (de trei ori pe săptămână) la pacienţii cu astm simptomatic persistent în ciuda tratamentului cu doză mare CSI-BADLA. Înainte de a lua în considerare adăugarea de azitromicină, se evaluează sputa pentru depistarea de micobacterii atipice, se efectuează ECG pentru identificarea intervalului QT alungit (cu repetare după o lună de tratament) şi se ia în considerare riscul de creştere a rezistenţei antimicrobiene. Cea mai frecventă reacţie adversă a azitromicinei la doza de 500 mg de trei ori pe săptămână este diareea. Se recomandă un tratament de cel puţin şase luni, deoarece în studiile clinice nu s-a observat un beneficiu clar până la trei luni. Dovezile pentru această recomandare includ o metaanaliză a două studii clinice la adulţii cu simptome persistente de astm unde s-a constatat reducerea exacerbărilor de astm sub terapie cu doze medii sau mari de CSI-BADLA şi un profil eozinofilic sau noneozinofilic şi la cei cu doze mari de CSI-BADLA. Azitromicina add-on la adulţi este recomandată doar în urma evaluării de către medicul specialist, din cauza potenţialului de dezvoltare a rezistenţei la antibiotice.
- CSO în doză mică sunt luaţi în considerare ca ultimă soluţie la unii pacienţi cu astm sever (≤ 7,5 mg/zi echivalent prednison), fiind adesea asociaţi cu reacţii adverse semnificative. Se indică numai în cazul unui control slab al simptomelor şi/sau cu exacerbări frecvente, în ciuda tehnicii inhalatorii bune şi a aderenţei la tratamentul de treaptă 5 şi după excluderea altor factori contributivi şi a altor tratamente suplimentare, inclusiv terapia biologică. Pacienţii trebuie informaţi cu privire la potenţialele reacţii adverse. Sunt necesare evaluarea şi monitorizarea pentru riscul de supresie suprarenală şi osteoporoză indusă de corticosteroizi, iar celor cu tratament prelungit (≥ 3 luni) trebuie să li se ofere consiliere adecvată privind stilul de viaţă şi prescrierea terapiei pentru prevenirea osteoporozei şi a fracturilor de fragilitate (dacă este cazul) (GINA, 2023).
- Terapia biologică – opţiunile actuale recomandate de ghiduri pentru pacienţii cu astm sever necontrolat în ciuda terapiei maxime optimizate includ:
- anticorpi antireceptor de IgE (anti-IgE), tratamentul cu omalizumab subcutanat pentru pacienţii cu astm alergic şi vârsta ≥ 6 ani
- anticorpi anti-IL5/anti-IL5R, tratamentul pacienţilor cu astm eozinofilic sever (mepolizumab subcutanat pentru pacienţii cu vârsta ≥ 6 ani; reslizumab intravenos pentru cei cu vârsta ≥ 18 ani sau benralizumab subcutanat pentru cei cu vârsta ≥ 12 ani, iar în România, pentru cei cu vârsta ≥ 18 ani)
- anticorpi anti-IL4-Rα, tratamentul pacienţilor cu astm eozinofilic sever/de tip 2 sau pentru adulţi sau adolescenţi care necesită cure cu CSO (dupilumab subcutanat pentru pacienţii cu vârsta ≥ 6 ani, iar în România, pentru cei cu vârsta ≥ 12 ani)
- anticorpi anti-TSLP (tezepelumab subcutanat pentru pacienţii cu vârsta ≥ 12 ani) cu astm sever.
Tratamentul este ghidat de examenul de spută pentru adulţii cu simptome şi/sau exacerbări persistente în ciuda dozelor mari de CSI sau CSI-BADLA. Tratamentul poate fi ajustat pe baza eozinofiliei (>3 %) din sputa indusă. În cazul astmului sever, această strategie duce la reducerea exacerbărilor şi/sau la doze mai mici de CSI.
Termoplastia bronşică este utilizată în cazuri severe selecţionate.
Managementul actual al astmului sever
Astmul sever este definit ca fiind astmul necontrolat în ciuda aderenţei la tratamentul cu doze mari de CSI în asociere cu BADLA (şi/sau corticosteroizi sistemici) şi a gestionării factorilor contributivi sau care se agravează la încercarea reducerii dozei de medicaţie (GINA, 2023; Holguin et al., 2020; Chung et al., 2013). În ciuda disponibilităţii medicamentelor eficiente pentru managementul astmului, exacerbările severe continuă să fie un factor major de risc pentru sănătate, putând duce la rezultate grave, precum spitalizarea sau decesul, exacerbările astmului fiind de trei ori mai probabil să apară la pacienţii cu astm sever necontrolat (Bourdin et al., 2019). Este important să se facă distincţia dintre astmul sever şi astmul dificil de tratat, care este astm posibil necontrolat din cauza altor factori, cum ar fi tehnica incorectă de inhalare, aderenţa slabă la tratament şi comorbidităţi precum obezitatea şi expunerea la diferiţi factori de mediu (Reddel et al., 2022). Ghidurile actuale pentru astm recomandă un algoritm de acţiune pentru diagnosticul şi gestionarea astmului sever, cu atribuţii de asistenţă medicală primară şi de specialitate, consolidând în acelaşi timp valoarea perspectivei pacientului, precum şi colaborarea dintre medicii de asistenţă primară, specialişti şi alţi profesionişti din domeniul medical (Agache et al., 2021).
După clasificarea astmului în funcţie de severitate şi gestionarea factorilor contributivi (tehnică inhalatoare incorectă, aderenţa redusă, comorbidităţi, factori declanşatori şi modificabili, utilizarea regulată sau excesivă de BADSA şi reacţiile adverse ale medicamentelor), se recomandă evaluarea fenotipului astmului sever (GINA, 2023). Îmbunătăţirea cunoştinţelor asupra mecanismelor etiopatogenice ale diferitelor fenotipuri şi endotipuri de astm sever au condus la disponibilitatea unor terapii inovatoare în ultimii ani. Astfel, majoritatea terapiilor biologice sunt îndreptate împotriva moleculelor implicate în inflamaţia T2, care modifică evoluţia naturală a bolii (anti-IgE, anti-IL.5/5R, anti-IL-4R sau anti-TSLP). În prezent, anticorpii monoclonali disponibili şi aprobaţi pentru astmul sever includ: omalizumab (anti-IgE); mepolizumab, reslizumab, benralizumab (căile anti-IL-5); dupilumab (anti-IL-4/IL-13) şi tezepelumab (anti-TSLP) (GINA, 2023; Agache et al., 2021; Holguin et al., 2020). O abordare orientativă pentru terapia biologică de primă linie care vizează calea T2 se bazează pe evaluarea biomarkerilor şi a factorilor de predicţie a răspunsului, luând în considerare criteriile de eligibilitate ale plătitorilor locali, costul, frecvenţa dozelor, calea (subcutanată sau intravenoasă) şi preferinţele pacientului.
Răspunsul la terapia biologică este evaluat după patru luni, iar în cazul unui răspuns favorabil, se continuă cu reevaluarea la fiecare 3-6 luni. Când pacientul nu răspunde la agentul biologic iniţial, dar este încă eligibil pentru tratamentul ţintit T2, ghidurile internaţionale recomandă trecerea la un alt agent biologic. În prezent nu există criterii clar definite pentru un răspuns favorabil, dar există factori importanţi ce sunt luaţi în considerare, precum frecvenţa exacerbărilor, controlul simptomelor, funcţia pulmonară, reacţiile adverse ale medicamentelor, intensitatea tratamentului (inclusiv doza de CSO) şi satisfacţia pacientului (GINA, 2023; Agache et al., 2021).
Terapiile biologice disponibile în prezent pentru astmul sever
Terapia anti-IgE (omalizumab)
IgE este imunoglobulina primară implicată în inflamaţia de tip T2. Omalizumab, singurul anticorp monoclonal anti-IgE umanizat prezent pe piaţă, se leagă de regiunea constantă a IgE şi împiedică interacţiunea dintre IgE serică circulantă şi receptorii specifici de afinitate înaltă şi scăzută, respectiv FcεRI şi FcɛRII (CD23) (Fahy et al., 1997) de pe suprafaţa mastocitelor şi bazofilelor. Ca rezultat al acestei blocări, omalizumab inhibă toate evenimentele celulare şi moleculare IgE-dependente, implicate în calea imunologică a astmului alergic, ducând la scăderea nivelurilor de IgE seric circulant şi a densităţii receptorilor pentru IgE de pe mastocite şi bazofile (Menzella et al., 2018). Până în prezent, studiile au arătat că tratamentul pacienţilor astmatici cu omalizumab are ca rezultat o reducere dependentă de doză a IgE serice libere, îmbunătăţirea funcţiei pulmonare, reducerea modestă a frecvenţei exacerbărilor şi a numărului de prezentări la urgenţe şi de spitalizări (Hanania et al., 2011; Normansell et al., 2014; Haidar şi Panaitescu, 2022). Studiile clinice au arătat şi îmbunătăţiri în controlul simptomelor, calitatea vieţii, alături de utilizarea redusă a CSO (Rodrigo et al., 2011; Normansell et al., 2014; Pelaia et al., 2018). O analiză retrospectivă amplă a 25 de studii clinice randomizate a demonstrat o reducere mai mare a frecvenţei exacerbărilor astmului la pacienţii cu eozinofilie sangvină crescută şi niveluri crescute ale FeNO, ceea ce sugerează o inflamaţie eozinofilică (Hanania et al., 2013). Pe baza acestor constatări, se justifică prescrierea de terapie biologică anti-IgE la astmaticii severi cu semne de atopie (Haidar şi Panaitescu, 2022).
Criterii de includere (pe lângă criteriile pentru astmul sever) a tratamentului cu omalizumab sunt reprezentate de vârsta ≥ 6 ani, sensibilizarea la aeroalergene la testarea cutanată prick sau IgE alergen-specifice, IgE serice totale şi greutatea corporală în intervalul de dozare locală şi exacerbări severe în ultimul an. Administrarea este subcutanată, la interval de două sau patru săptămâni, în funcţie de doza necesară. Doza maximă care poate fi administrată o dată este de 600 mg, ca urmare, pentru cei care necesită doze cuprinse între 750 şi 1200 mg pe patru săptămâni, se administrează jumătate (de exemplu, 375-600 mg) la fiecare două săptămâni. Doza administrată şi intervalul de dozare se aleg în funcţie de masa corporală şi de nivelul IgE serice totale. Autoadministrarea poate fi o opţiune.
Conform dovezilor disponibile, tratamentul cu omalizumab trebuie continuat fără întrerupere, deoarece nivelurile de IgE şi numărul de receptori FcɛRI cresc la trei-patru săptămâni după întreruperea acestuia, rezultând o înrăutăţire a controlului astmului, în special la pacienţii cu niveluri mai ridicate de eozinofilie, periostină şi FeNO. Prezenţa acestor biomarkeri pare să fie legată de un răspuns mai bun la omalizumab, dar şi de o pierdere mai rapidă a efectului acestuia după întrerupere. Prin urmare, selectarea corectă a pacientului pentru terapie cu omalizumab presupune nu doar un răspuns favorabil pe termen scurt, ci şi o creştere a eficacităţii clinice pe termen lung (până la nouă ani de urmărire), cu un profil cost-eficacitate favorabil la pacienţii cu astm sever, dacă este selectat corect (Haidar şi Panaitescu, 2022). Factorii potenţiali de predicţie a răspunsului bun la omalizumab în cazul astmului sunt reprezentaţi de astmul cu debut în copilărie şi de istoricul clinic sugestiv pentru simptomele determinate de expunerea la alergene. Reacţiile adverse posibile sunt cele la locul injectării, iar anafilaxia poate apărea la aproximativ 0,2% dintre pacienţi. De asemenea, terapia anti-IgE poate fi indicată şi în polipoza nazală sau în urticaria cronică spontană (GINA, 2023).
Terapia anti-IL-5
Având în vedere rolul IL-5 în declanşarea inflamaţiei eozinofilice, blocarea acestei citokine poate atenua inflamaţia de tip T2. Până în prezent au fost dezvoltaţi trei agenţi biologici care ţintesc IL-5. Mepolizumab şi reslizumab se leagă de IL-5, împiedicând această citokină să promoveze activarea eozinofilelor, iar benralizumab blochează receptorul pentru IL-5, IL-5Rα, rezultând depleţia aproape completă a eozinofilelor periferice prin citotoxicitate mediată celular anticorp-dependentă (ADCC), care implică celule natural killer (NK) (Haidar şi Panaitescu, 2022)
Numeroase studii au arătat că administrarea de mepolizumab la pacienţii cu astm sever cu eozinofilie dependenţi de CSO a dus la scăderea administrării acestora, a frecvenţei exacerbărilor, la îmbunătăţirea controlului astmului şi la îmbunătăţirea funcţiei pulmonare (Pavord et al., 2012; Bel et al., 2014; Domingo Ribas et al., 2021; Koistinen et al., 2022). Pentru a obţine aceste rezultate favorabile ale terapiei cu mepolizumab, este necesară o selecţie atentă a pacienţilor, beneficiind de acest tratament în primul rând pacienţii cu astm sever şi cu eozinofilie. Din acest motiv, eozinofilele din sângele periferic au fost alese iniţial ca biomarker în studiile cu mepolizumab (Ortega et al., 2016), acestea reprezentând una dintre cele mai simple şi practice modalităţi de identificare a inflamaţiei de tip T2 şi, ca atare, a pacienţilor care pot beneficia de terapia anti-IL-5. Cu toate acestea, ele prezintă dezavantajul de a avea valori fluctuante, din acest motiv eozinofilele din spută putând reprezenta un biomarker mai bun; însă, din păcate, există o lipsă de disponibilitate globală a laboratoarelor care pot determina eozinofilele din spută, ceea ce face dificilă utilizarea acestora ca biomarker pe scară mai largă. Deşi eozinofilia periferică poate prezice răspunsul la agenţii anti-IL-5, ea are un rol limitat în monitorizarea răspunsului la tratament, posibilă datorită eozinopeniei in situ. Astfel, utilizarea eozinofilelor din spută pentru a monitoriza răspunsul la tratament poate fi mai fiabilă decât utilizarea eozinofilelor periferice (Haidar şi Panaitescu, 2022). Cu toate acestea, în ciuda multiplelor studii care au arătat beneficii clinice, efectul mepolizumabului a fost incomplet, cu o reducere de aproximativ 50% a frecvenţei exacerbărilor, în ciuda ablaţiei eozinofiliei periferice (Ortega et al., 2020). În afară de eozinofile, în imunopatogeneza astmului sunt implicate şi alte celule efectoare şi citokine care pot fi la fel, dacă nu mai importante decât eozinofilele şi, ca atare, ar trebui vizate.
Reslizumab a fost al doilea agent biologic anti-IL-5 introdus pe piaţă. Studiile clinice la pacienţii cu astm sever şi cu eozinofilie au arătat că reslizumabul reduce eozinofilele din sânge, frecvenţa exacerbărilor şi îmbunătăţeşte scorul simptomelor şi funcţia pulmonară (Murphy et al., 2017; Wechsler et al., 2020; Bernstein et al., 2020). Este posibil ca pacienţii care nu răspund la regimul cu doză fixă de mepolizumab să poată beneficia de reslizumab ca alternativă (care se dozează în funcţie de greutatea corporală) (Mukherjee et al., 2018). Similar cu mepolizumab, reslizumab pare să aibă cele mai multe dovezi pentru eficacitatea clinică la pacienţii cu eozinofilie periferică.
Benralizumab, un anticorp specific pentru subunitatea α a receptorului pentru IL-5, a fost al treilea agent biologic care vizează calea IL-5. Efectele sale pe frecvenţa exacerbărilor, reducerea eozinofilelor din sângele periferic şi din spută şi pe îmbunătăţirea simptomelor au fost similare cu cele ale celorlalţi agenţi biologici anti-IL-5, cu toate că benralizumab utilizează o abordare alternativă, care vizează IL-5Rα (Sehmi et al., 2018; AlShareef et al., 2022; Miralles López et al., 2022).
Criteriile de includere (pe lângă criteriile pentru astmul sever) sunt reprezentate de vârsta ≥ 6 ani (mepolizumab), ≥ 12 ani sau ≥ 18 ani în România (bernalizumab) şi ≥ 18 ani (reslizumab), prezenţa exacerbărilor severe în ultimul an; eozinofile din sânge peste intervalul normal (de exemplu, ≥ 150/µl sau ≥ 300/µl). Modul de administrare: mepolizumab (anti-IL-5) pentru vârsta ≥ 12 ani: 100 mg, injecţie subcutanată la fiecare 4 săptămâni. Vârsta 6-11 ani: 40 mg, injecţie subcutanată la fiecare 4 săptămâni. Benralizumab (anti-IL-5Rα), 30 mg prin injecţie subcutanată la fiecare 4 săptămâni pentru trei doze, apoi la fiecare 8 săptămâni. Reslizumab (anti-IL-5), 3 mg/kg prin perfuzie i.v. la fiecare 4 săptămâni. Pentru vârstele 6-11 ani, mepolizumab (anti-IL-5), 40 mg prin injecţie SC la fiecare 4 săptămâni. Autoadministrarea poate fi luată în considerare. Factori potenţiali de predicţie a răspunsului bun la anti-IL5 sau anti-IL-5R: eozinofile sangvine crescute (puternic predictiv), număr mare de exacerbări severe în anul precedent (puternic predictiv), astm cu debut la vârsta adultă, polipoză nazală, CSO de control la momentul iniţial şi funcţie pulmonară scăzută (VEMS < 65% din prezis). Reacţiile adverse la adulţi sunt reprezentate de reacţii locale, la locul injectării, şi rar anafilaxie (GINA, 2023).
Terapia anti-IL-4/IL-13
Pentru a înţelege eficacitatea agenţilor biologici anti-IL-4/IL-13, este important să înţelegem semnalizarea prin receptorii pentru aceste două citokine. Calea de semnalizare pentru IL-13 se realizează prin interacţiunea sa cu receptorul IL-13, care prezintă două subtipuri – IL-13Rα1 şi IL-13Rα2. IL-13Rα1 leagă IL-13 cu afinitate scăzută, dar, când receptorul pentru IL-4 (IL-4Rα1) se uneşte de acesta pentru a forma un heterodimer, IL-13 este legat cu mai mare afinitate. IL-13Rα2 leagă IL-13 cu afinitate mare, dar nu poate transmite semnalul intracelular, deoarece îi lipseşte domeniul citoplasmatic; poate însă acţiona ca un reglator negativ al semnalizării prin IL-13 şi IL-4. Blocarea izolată, fie a IL-4, fie a IL-13, nu s-a dovedit a fi eficientă în tratamentul astmului sever, dar blocarea duală pare să fie promiţătoare (Haidar şi Panaitescu, 2022).
Dupilumab este primul biologic dual IL-4/IL-13 aprobat pentru tratamentul astmului. Acesta vizează receptorul comun IL-4Rα şi astfel blochează semnalizarea atât prin IL-4, cât şi prin IL-13. Un studiu iniţial în care s-a administrat dupilumab la pacienţi cu astm şi eozinofilie (eozinofile din sânge ≥ 300 celule/µl sau eozinofile din spută ≥ 3%) a relevat o reducere cu 87% a frecvenţei exacerbărilor. Aceste rezultate impresionante s-au obţinut deşi administrarea BADLA a încetat din săptămâna a patra de tratament, iar administrarea CSI, din săptămânile 6-9. Rezultate similare s-au obţinut şi la pacienţii fără eozinofilie, ceea ce denotă faptul că dupilumab poate fi eficient indiferent de statutul eozinofilic (Wenzel et al., 2013).
Criteriile de includere (pe lângă criteriile pentru astmul sever) sunt reprezentate de vârsta ≥ 12 ani şi ≥ 18 ani în România, un număr mare de exacerbări severe în anul precedent (puternic predictiv), nivelul crescut ai biomarkerilor de tip 2 (de exemplu, eozinofile din sânge ≥ 150/µl şi ≤ 1500/µl; sau FeNO ≥ 25 ppb) sau necesitatea controlului cu CSO. Modul de administrare pentru dupilumab în astmul eozinofilic sever/de tip 2 (vârstă ≥ 12 ani) este de 200 mg sau 300 mg prin injecţie subcutanată la fiecare două săptămâni; pentru astmul sever dependent de CSO sau dacă există DA moderată/severă asociată, dupilumab 300 mg injecţie subcutanată la fiecare două săptămâni. Poate fi indicat şi pentru tratamentul afecţiunilor pielii, inclusiv DA moderată până la severă, rinosinuzită cronică cu polipoză nazală şi esofagită eozinofilică. Autoadministrarea poate fi o opţiune (GINA, 2023).
Factori potenţiali de predicţie a răspunsului bun la anti-IL-4Rα sunt reprezentaţi de eozinofilele sangvine crescute (puternic predictiv) şi nivelul FeNO crescut (puternic predictiv). Reacţiile adverse pot fi la locul injectării; eozinofilie din sânge tranzitorie; cazuri rare de granulomatoză eozinofilă cu poliangeită (EGPA). Anti-IL-4Rα nu se recomandă pacienţilor cu eozinofile sangvine iniţiale sau din istoric > 1500 celule/µL, din cauza dovezilor limitate (GINA, 2023).
Terapia biologică anti-IL-4Rα îmbunătăţeşte calitatea vieţii, funcţia pulmonară, controlul simptomelor şi reduce riscul de exacerbări severe. La pacienţii cu rinosinuzită cronică cu polipoză nazală, dupilumab a redus dimensiunea polipilor nazali, a îmbunătăţit simptomele nazale şi a redus nevoia de CSO sau de intervenţie chirurgicală la nivelul sinusurilor (GINA, 2023).
Terapia anti-TSLP
Dezvoltarea produselor biologice antialarmine rămâne una dintre cele mai interesante inovaţii în terapia astmului până în prezent. Tezepelumab este primul anticorp uman IgG2 direcţionat împotriva limfopoietinei stromale timice (TSLP). Primul studiu clinic de evaluare a eficacităţii tezepelumabului s-a realizat la pacienţi cu astm uşor şi a relevat o îmbunătăţire semnificativă a funcţiei pulmonare, o reducere a eozinofilelor în sângele periferic şi în spută, a IgE serice şi a FeNO, precum şi a frecvenţei exacerbărilor (Gauvreau et al., 2014; Marone et al., 2019; Corren et al., 2021). Aceste date sugerează că ţintirea citokinelor din amontele inflamaţiei, precum TSLP, poate fi benefică în multiple endotipuri de astm, atât de tip T2, cât şi non-T2.
Criteriile de includere (pe lângă criteriile pentru astmul sever) sunt reprezentate de vârsta ≥ 12 ani şi exacerbări severe în ultimul an. Modul de administrare: tezepelumab, 210 mg prin injecţie subcutanată la fiecare 4 săptămâni. Autoadministrarea poate fi o opţiune. Factorii potenţiali de predicţie a răspunsului bun la anti-TSLP sunt eozinofile sangvine crescute (puternic predictiv) şi nivelul FeNO crescut (puternic predictiv). Reacţiile adverse sunt reprezentate de reacţii la locul injectării, iar anafilaxia este rară (GINA, 2023).
Imunoterapia cu alergene (AIT)
AIT este un tratament eficient pentru RA cu sau fără astm asociat. În cazul pacienţilor astmatici şi cu fenotip alergic, aceştia pot beneficia de AIT ca terapie suplimentară la tratamentul farmacologic. Studiile au arătat o îmbunătăţire a simptomelor de astm şi reducerea nevoii de medicaţie la nevoie (GINA, 2023; Agache et al., 2023). Căile de administrare aprobate sunt reprezentate de administrarea pe cale subcutanată (SCIT) sau sublinguală (SLIT), fie sub formă de picături, fie sub formă de tablete. Actualizarea din 2017 a ghidurilor internaţionale GINA a inclus comprimatele SLIT la HDM ca recomandare pentru pacienţii cu astm alergic la HDM, necontrolat cu tratamentul farmacologic. Această recomandare a rămas neschimbată în actualizările consecutive, ghidurile din 2021 adăugând comprimatele SLIT la opţiunile de control pentru adolescenţi şi adulţi cu astm indus de acarieni, asociat cu RA şi necontrolat cu CSI în doze mici-medii (Muraro, 2017; Agache et al., 2019; GINA, 2023; Agache et al., 2023).
Raţionamentul AIT constă în modificarea mecanismelor de bază ale bolii alergice care declanşează un efect clinic susţinut bazat pe toleranţa alergen-specifică, suprimarea inflamaţiei şi îmbunătăţirea clinică multicomponentă. Mecanismele principale care stau la baza AIT includ modificări ale claselor de imunoglobuline (IgA, IgE şi IgG), inducerea imunosupresoare a celulelor T reglatoare, modificări ale profilului de celule/citokine, de la celule Th2 la Th1, scăderea activităţii de reacţie în faza precoce şi a mediatorilor şi, respectiv, creşterea producţiei de IL-10, IL-35, a factorului de creştere transformator β (TGF-β) şi a interferonului γ (IFN-γ) (Agache et al., 2019).
Deoarece RA este considerată o trăsătură tratabilă în astmul alergic, se recomandă tratamentul şi reducerea simptomelor tuturor trăsăturilor tratabile. Din această perspectivă, AIT poate fi considerată un tratament care optimizează o trăsătură la un pacient în mod particular. Cu toate acestea, este încă neclar cum trebuie interpretate rezultatele tratamentului cu AIT, în special în ceea ce priveşte controlul bolii. Funcţia pulmonară, scorurile simptomelor şi chestionarele validate, numărul de exacerbări sau reducerea nevoii de medicaţie de control sunt considerate ca fiind criterii de evaluare primare (Agache et al., 2023). AIT este în prezent singura formă de tratament cu proprietăţi de modificare a evoluţiei astmului alergic şi conferă beneficii clinice pe termen lung după finalizarea tratamentului.
Reevaluarea răspunsului şi ajustarea tratamentului în astm
Se recomandă evaluarea pacienţilor la 1-3 luni de la iniţierea tratamentului, apoi la fiecare 3-12 luni, cu excepţia femeilor însărcinate, care necesită evaluare la fiecare 4-6 săptămâni. După exacerbări, evaluarea se efectuează în termen de o săptămână. Frecvenţa evaluărilor depinde de nivelul de control iniţial obţinut de pacient, de răspunsul acestuia la tratamentul anterior, respectiv de capacitatea şi de disponibilitatea implicării în automanagementul astmului cu un plan de acţiune scris. Astfel, astmul este o afecţiune variabilă şi poate necesita ajustarea periodică a tratamentului de control de către medic şi/sau pacient (GINA, 2023).
Trecerea la o treaptă de tratament superioară (step-up)
- Trecerea la o treaptă superioară de tratament susţinută (pe o perioadă de cel puţin 2-3 luni): dacă simptomele şi/sau exacerbările persistă în ciuda tratamentului de control timp de 2-3 luni, cu evaluarea următoarelor aspecte înainte de a trece la o treaptă superioară de tratament, precum tehnica inhalatoare incorectă, aderenţa scăzută, factori de risc modificabili, precum fumul de ţigaretă, simptome cauzate de comorbidităţi (de exemplu, RA).
- Trecerea la o treaptă superioară de tratament pe termen scurt (pe o perioadă de 1-2 săptămâni) iniţiată de medic sau de pacient, cu un plan de acţiune scris pentru astm (în timpul unei infecţii virale sau expunere la alergene).
- Ajustarea de la o zi la alta iniţiată de pacient în cazul prescrierii de CSI-formoterol în doză mică, ca tratament la nevoie în astmul uşor, sau CSI-formoterol în doză redusă, ca tratament MART.
Trecerea la o treaptă de tratament inferioară când astmul este bine controlat (step-down)
- După obţinerea unui control bun al astmului, menţinut pe o durată de trei luni, se va lua în considerare trecerea la o treaptă de tratament inferioară, pentru a identifica tratamentul optimal minim care poate controla atât simptomele, cât şi exacerbările, diminuând totodată reacţiile adverse.
- Alegerea un moment potrivit pentru trecerea la o treaptă de tratament inferioară (pacientul nu are infecţie respiratorie, nu călătoreşte, pacienta nu este însărcinată).
- Evaluarea factorilor de risc, inclusiv istoricul de exacerbări sau prezentări de urgenţă şi funcţia pulmonară scăzută.
- Documentarea statusului bolii în momentul iniţial (controlul simptomelor şi funcţia pulmonară), cu efectuarea unui plan de acţiune scris pentru astm, monitorizarea atentă şi reevaluare.
- Trecerea la o treaptă de tratament inferioară cu ajutorul recomandărilor disponibile pentru reducerea dozei CSI cu 25-50% la intervale de 2-3 luni.
- Dacă astmul este bine controlat cu CSI în doză mică sau LTRA, tratamentul cu CSI-formoterol în doză mică la nevoie reprezintă o opţiune de trecere la o treaptă de tratament inferioară.
- Nu se recomandă întreruperea completă a terapiei cu CSI la pacienţii cu astm decât dacă este necesară oprirea temporară, în vederea confirmării diagnosticul de astm (GINA, 2023).
Strategii şi intervenţii nefarmacologice
Pe lângă tratamentul farmacologic, pot fi luate în considerare şi alte terapii şi strategii, când sunt relevante, pentru a contribui la controlul simptomelor şi la reducerea riscului viitor. Strategiile nefarmacologice cuprind: consilierea pentru renunţarea la fumat şi evitarea fumatului pasiv, activitatea fizică, documentarea astmului profesional, identificarea bolii respiratorii exacerbate de aspirină sau de alte antiinflamatoare nesteroidiene, evitarea alergenelor de mediu, alimentaţia, scăderea în greutate şi strategii de evitare a poluării atmosferice. Aceste strategii sunt deseori complexe şi costisitoare şi nu există metode validate de identificare a pacienţilor care pot beneficia de pe urma acestora. Unii factori declanşatori întâlniţi frecvent în astm (de exemplu, efortul fizic sau râsul) nu ar trebui evitaţi, în timp ce alţii (de exemplu, infecţiile respiratorii virale sau stresul) sunt greu de evitat şi ar trebui gestionaţi când apar (GINA, 2023).
Controlul alergenelor de mediu în managementul astmului
Expunerea la alergene poate exacerba simptomele astmului la pacienţii sensibilizaţi. Reducerea alergenului sau măsurile de evitare au fost utilizate pe scară largă; cu toate acestea, există o controversă continuă cu privire la eficacitatea măsurilor specifice de control al acestora în managementul astmului. Adesea, strategiile de evitare a alergenelor nu sunt recomandate de ghiduri, deoarece pot fi complexe sau împovărătoare, deşi pot fi aplicate în mod particular la unii pacienţi (Kalayci et al., 2022). Tratamentul farmacologic rămâne pilonul principal în gestionarea bolii, deoarece pacienţii sunt adesea mai puţin afectaţi de factorii de mediu când astmul lor este bine controlat. Totodată, un control eficient al mediului este foarte dificil de realizat, deoarece pacienţii reacţionează adesea la o varietate de alergene şi alţi stimuli care sunt foarte greu sau imposibil de evitat. Prin urmare, este puţin probabil ca o singură măsură de evitare să conducă la rezultate clinice majore, iar studiile privind controlul simptomelor de astm prin reducerea alergenelor au arătat rezultate contradictorii (Kalayci et al., 2022; Ghidul GINA, 2023).
Principalele alergene implicate în astm sunt acarienii din praful de casă, animalele de companie cu blană, gândacii, rozătoarele, mucegaiurile din interior şi exterior şi polenurile.
La nivel mondial, aproximativ 40-85% dintre pacienţii cu astm alergic sunt sensibilizaţi la acarieni (Kalayci et al., 2022). Aceste alergene pot avea, de asemenea, un efect sinergic cu alţi factori declanşatori ai bolii, precum agenţii virali (Bossios et al., 2008). Cel mai mare beneficiu clinic este obţinut printr-o abordare multifaţetată şi cuprinzătoare a evitării HDM, care să includă educaţia cu privire la alergen, materialele folosite pentru acoperirea pernelor şi saltelelor, controlul umidităţii, aspiratoare dotate cu filtru de aer de înaltă eficienţă pentru particule (HEPA) şi eliminarea pe cât posibil a rezervoarelor de HDM prin renunţarea la covoare şi mobilier tapiţat. Măsurile de evitare multifaţetate, individualizate, la domiciliu, au demonstrat în mod constant o reducere semnificativă a alergenelor HDM, iar acest lucru s-a corelat cu reducerea complicaţiilor în astm. Totodată, efectul real al măsurilor de evitare a HDM asupra rezultatelor clinice rămâne controversat. Până în prezent nu există o recomandare definitivă, deoarece studiile sunt în general mici şi de calitate metodologică slabă, datorată dificultăţilor de standardizare a protocoalelor de evitare a alergenelor, cu multiple faţete şi personalizate. În viitor, ar putea fi identificate măsuri mai eficiente de evitare a HDM. În acest scop, trebuie să înţelegem mai bine natura fizică a expunerii cronice la aeroalergene. Trebuie identificate alergenele HDM mai relevante din punct de vedere clinic şi răspunsul potenţial diferit al acestora la măsurile specifice de evitare. Trebuie investigate interacţiunile dintre expunerea la alergene, modulatorii imunităţii înnăscute şi alţi factori declanşatori ai astmului, în special virusuri, în diferite stadii ale bolii (Kalayci et al., 2022; GINA, 2023).
Evitarea completă a alergenelor de la animalele de companie este aproape imposibilă pentru pacienţii sensibilizaţi, deoarece aceste alergene sunt omniprezente în afara casei, în şcoli, în mijloacele de transport în comun şi chiar în clădirile fără pisici, fiind probabil transferate pe haine. Deşi este încurajată îndepărtarea acestor animale din casa unui pacient sensibilizat, pot trece multe luni până când nivelurile de alergen scad, însă eficacitatea clinică a acestei strategii şi a altor măsuri de evitare rămâne nedovedită (GINA, 2023).
Pacienţii simptomatici suspectaţi de expunere domestică la rozătoarele dăunătoare ar trebui evaluaţi prin teste cutanate sau IgE specifice, deoarece expunerea poate să nu fie evidentă decât dacă există o infestare certă. Nu există dovezi privind eficacitatea eliminării rozătoarelor, deoarece majoritatea măsurilor de evitare integrată a dăunătorilor elimină şi alte surse de alergene; unele studii au arătat o ameliorare clinică semnificativă în cazul educaţiei pentru reducerea dăunătorilor şi în cel al gestionării integrate a acestora. Totodată, măsurile de evitare a gândacilor sunt doar parţial eficiente în eliminarea alergenelor reziduale şi lipsesc dovezile cu privire la beneficiile clinice (GINA, 2023).
Expunerea la mucegai a fost asociată cu exacerbări ale astmului. Numărul de spori poate fi cel mai bine redus prin îndepărtarea sau curăţarea obiectelor care prezintă mucegai. Se pot folosi aparate de aer condiţionat şi dezumidificatoare pentru a reduce umiditatea la mai puţin de 50% şi pentru a filtra sporii de dimensiuni mari. În ceea ce priveşte pacienţii sensibilizaţi la alergenele de exterior, precum polenul şi mucegaiurile, este imposibilă evitarea completă a acestora. Închiderea ferestrelor şi uşilor, statul în casă când cantitatea de polen şi mucegai este cea mai mare şi utilizarea aerului condiţionat pot reprezenta măsuri de control pentru a reduce expunerea (GINA, 2023).
Episoadele acute (exacerbările) în astm
Exacerbările astmului sunt episoade caracterizate de o agravare acută sau subacută a simptomelor şi de o scădere progresivă a funcţiei pulmonare, faţă de statusul normal de sănătate al pacientului, care este suficientă pentru a necesita ajustarea tratamentului. Exacerbările pot apărea la pacienţii cu un diagnostic preexistent de astm, iar uneori poate fi modalitatea iniţială de prezentare a bolii. În discuţiile cu pacienţii, este preferat termenul „criză”. Deseori se folosesc şi termenii „episoade”, „atacuri” şi „astm sever acut”, dar aceştia au semnificaţii diferite, în special pentru pacienţi (GINA, 2023).
Exacerbările apar frecvent ca răspuns al expunerii la un agent extern (de exemplu, infecţie virală de tract respirator superior, alergen sau poluare) şi/sau aderenţa slabă la tratamentul cu CSI; cu toate acestea, o parte dintre pacienţi prezintă episoade de acutizare în lipsa expunerii la factori de risc cunoscuţi. Totodată, exacerbările severe pot apărea la pacienţii cu simptome de astm uşoare sau bine controlate (GINA, 2023).
Factorii declanşatori comuni în apariţia exacerbării astmului includ: infecţii respiratorii virale (de exemplu, infecţia cu rinovirus, virus gripal, adenovirus, pertussis, virus sinciţial respirator), expunerea la alergene (de exemplu, polen de graminee, pulbere de soia, spori de fungi), alergia alimentară, poluarea atmosferică, schimbările sezoniere şi/sau reintrarea în colectivitate (de exemplu, începerea şcolii, toamna), aderenţa slabă la CSI.
Epidemiile de exacerbări severe ale astmului pot apărea brusc, punând presiune mare asupra răspunsurilor sistemului local de sănătate. Astfel de epidemii au fost raportate în asociere cu furtunile de primăvară sau de polen de secară, fie spori de fungi şi cu expunerea mediului la praful de soia. Managementul agravării astmului şi al exacerbărilor ar trebui văzut ca un continuum, de la automanagementul pacientului cu plan de acţiune scris pentru astm până la tratamentul simptomelor severe în cabinet, la camera de gardă şi în spital (GINA, 2023).
Concluzii
Înţelegerea caracteristicilor fenotipice şi identificarea biomarkerilor ajută la clasificarea endotipului bolii de bază şi la abordarea terapeutică adecvată. Astmul alergic este un fenotip aparte de astm. Este caracterizat prin inflamaţia de tip T2, indusă de sensibilizarea la alergene din mediu, cu apariţia ulterioară a simptomelor tipice de astm după expunere la alergenul sensibilizant. Asocierea terapiilor de control pentru ameliorarea răspunsurilor inflamatorii şi a terapiilor de ameliorare a simptomelor pentru reducerea răspunsurilor de remodelare constituie baza managementului în astmul alergic. Tratamentul farmacologic se bazează pe utilizarea corticosteroizilor inhalatori în combinaţie cu bronhodilatatoare, pentru a obţine şi menţine controlul bolii. Deşi majoritatea pacienţilor cu astm obţin un control bun al bolii prin utilizarea regulată a terapiei de control, o parte dintre pacienţi rămân slab controlaţi. Eşecul terapiilor convenţionale la pacienţii corticorezistenţi justifică asocierea unor terapii adiţionale pentru gestionarea bolii. În plus, imunoterapia cu alergene reduce în mod eficient simptomele astmului alergic şi ale rinitei asociate şi poate modifica evoluţia naturală a bolii.
Autor corespondent:
Carmen Panaitescu
E-mail: cbunu@umft.ro
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
Agache I, Akdis CA. Global Atlas of Asthma. Vol 2, Jun 9, 2022. https://eaaci.org/documents/focusmeetings/ISAF2021/AsthmaAtlas%20II%20v1.pdf
Agache I, Akdis CA, Akdis M, et al. EAACI Biologicals Guidelines-Recommendations for severe asthma. Allergy. 2021 Jan;76(1):14-44. doi: 10.1111/all.14425. 4.
Agache I, Lau S, Akdis CA, et al. EAACI guidelines on allergen immunotherapy: house dust mite-driven allergic asthma. Allergy. 2019; 74(5): 855-873.
Alshareef S, McDonald CF, Lee J. Clinical and Lung Function Outcomes After Anti-IgE or Anti-IL5 Therapy in Severe Asthma. J Asthma Allergy. 2022 Feb 15;15:209-217. doi: 10.2147/JAA.S348137.
Bailey A. Eczema and Asthma: Is There a Connection? September 28, 2021. https://www.verywellhealth.com/eczema-and-asthma-5201351
Basler L, Saxer S, Schneider SR, et al. Asthma rehabilitation at high vs. low altitude and its impact on exhaled nitric oxide and sensitization patterns: Randomized parallel-group trial. Respir Med. 2020;170:106040. doi:10.1016/j.rmed.2020.106040.
Bel EH, Wenzel SE, Thompson PJ, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014 Sep 25;371(13):1189-97. doi: 10.1056/NEJMoa1403291.
Bernstein JA, Virchow JC, Murphy K, et al. Effect of fixed-dose subcutaneous reslizumab on asthma exacerbations in patients with severe uncontrolled asthma and corticosteroid sparing in patients with oral corticosteroid-dependent asthma: results from two phase 3, randomised, double-blind, placebo-controlled trials. Lancet Respir Med. 2020 May;8(5):461-474. doi: 10.1016/S2213-2600(19)30372-8.
Bossios A, Gourgiotis D, Skevaki CL, et al. Rhinovirus infection and house dust mite exposure synergize in inducing bronchial epithelial cell interleukin-8 release. Clin Exp Allergy. 2008;38(10):1615-1626.
Bourdin A, Bjermer L, Brightling C, et al. ERS/EAACI statement on severe exacerbations in asthma in adults: facts, priorities and key research questions. Eur Respir J. 2019 Sep 28;54(3):1900900. doi: 10.1183/13993003.00900-2019.
Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014 Feb;43(2):343-73. doi: 10.1183/09031936.00202013. Erratum in: Eur Respir J. 2014 Apr;43(4):1216. Dosage error in article text. Erratum in: Eur Respir J. 2018 Jul 27;52(1): Erratum in: Eur Respir J. 2022 Jun 9;59(6): PMID: 24337046.
Corren J, Garcia Gil E, Griffiths JM, et al. Tezepelumab improves patient-reported outcomes in patients with severe, uncontrolled asthma in PATHWAY. Ann Allergy Asthma Immunol. 2021 Feb;126(2):187-193. doi: 10.1016/j.anai.2020.10.008.
Domingo Ribas C, Carrillo Díaz T, Blanco Aparicio M, et al. Real World Effectiveness and Safety of Mepolizumab in A Multicentric Spanish Cohort of Asthma Patients Stratified by Eosinophils: The REDES Study. Drugs. 2021 Oct;81(15):1763-1774. doi: 10.1007/s40265-021-01597-9. Erratum in: Drugs. 2021 Oct 21; PMID: 34586602; PMCID: PMC8550660.
Egan M, Bunyavanich S. Allergic rhinitis: the „Ghost Diagnosis” in patients with asthma. Asthma Res Pract. 2015 Sep 7;1:8. doi: 10.1186/s40733-015-0008-0.
Fahy JV, Fleming HE, Wong HH, et al. The effect of an anti-IgE monoclonal antibody on the early- and late-phase responses to allergen inhalation in asthmatic subjects. Am J Respir Crit Care Med. 1997 Jun;155(6):1828-34. doi: 10.1164/ajrccm.155.6.9196082.
Gauvreau GM, O’Byrne PM, Boulet LP, et al. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014 May 29;370(22):2102-10. doi: 10.1056/NEJMoa1402895. 2.
Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023. Updated July 2023. www.ginasthma.org
Global Initiative of Asthma. Difficult-to-treat & severe asthma in adolescent and adult patients. 2023. https://ginasthma.org/reports/
Haidar L, Panaitescu C. Terapiile biologice în astmul sever – o perspectivă moleculară. Alergologia. 2022 Mar;6(1). doi: 10.26416/Aler.6.1.2022.6274.
Hanania NA, Alpan O, Hamilos DL, et al. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann Intern Med. 2011 May 3;154(9):573-82. doi: 10.7326/0003-4819-154-9-201105030-00002. Erratum in: Ann Intern Med. 2019 Oct 1;171(7):528. PMID: 21536936.
Hanania NA, Wenzel S, Rosén K, et al. Exploring the effects of omalizumab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med. 2013 Apr 15;187(8):804-11. doi: 10.1164/rccm.201208-1414OC.
Holguin F, Cardet JC, Chung KF, et al. Management of severe asthma: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J. 2020 Jan 2;55(1):1900588. doi: 10.1183/13993003.00588-2019.
Kalayci O, Miligkos M, Pozo Beltrán CF, El-Sayed ZA, Gómez RM, Hossny E, Le Souef P, Nieto A, Phipatanakul W, Pitrez PM, Xepapadaki P, Jiu-Yao W, Papadopoulos NG. The role of environmental allergen control in the management of asthma. World Allergy Organ J. 2022 Mar 8;15(3):100634. doi: 10.1016/j.waojou.2022.100634.
Kappen J, Diamant Z, Agache I, et al. Standardization of clinical outcomes used in allergen immunotherapy in allergic asthma: An EAACI position paper. Allergy. 2023 Nov;78(11):2835-2850. doi: 10.1111/all.15817.
Koistinen V, Kauppi P, Idänpään-Heikkilä J, et al. Effectiveness of mepolizumab in patients with severe eosinophilic asthma: results from real-world clinical practice in Finland. J Asthma. 2022 Jan 30:1-11. doi: 10.1080/02770903.2021.2020813.
Louis R, Satia I, Ojanguren I, et al. European Respiratory Society Guidelines for the Diagnosis of Asthma in Adults. Eur Respir J. doi: 10.1183/13993003.01585-2021.
Lv X, Gao Z, Tang W, et al. Trends of therapy in the treatment of asthma. Ther Adv Respir Dis. 2023 Jan-Dec;17:17534666231155748. doi: 10.1177/17534666231155748.
Marone G, Spadaro G, Braile M, et al. Tezepelumab: a novel biological therapy for the treatment of severe uncontrolled asthma. Expert Opin Investig Drugs. 2019 Nov;28(11):931-940. doi: 10.1080/13543784.2019.1672657.
Menzella F, Bertolini F, Biava M, Galeone C, Scelfo C, Caminati M. Severe refractory asthma: current treatment options and ongoing research. Drugs Context. 2018 Dec 5;7:212561. doi: 10.7573/dic.212561.
Miller JD. The Role of Dust Mites in Allergy. Clin Rev Allergy Immunol. 2019;57(3):312-329. doi:10.1007/s12016-018-8693-0.
Miralles López JC, Andújar-Espinosa R, Bravo-Gutiérrez FJ, et al. Effectiveness of benralizumab in severe eosinophilic asthma under routine clinical practice. J Investig Allergol Clin Immunol. 2022 Feb 11:0. doi: 10.18176/jiaci.0793. 3.
Mukherjee M, Aleman Paramo F, Kjarsgaard M, et al. Weight-adjusted Intravenous Reslizumab in Severe Asthma with Inadequate Response to Fixed-Dose Subcutaneous Mepolizumab. Am J Respir Crit Care Med. 2018 Jan 1;197(1):38-46. doi: 10.1164/rccm.201707-1323OC.
Muraro R (ed.). EAACI: Allergen Immunotherapy Guidelines Part 2: Recommendations. 2017. European Academy of Allergy and Clinical Immunology (EAACI) 2017, ISBN Number: 978-3-9524815-1-6.
Murphy K, Jacobs J, Bjermer L, et al. Long-term Safety and Efficacy of Reslizumab in Patients with Eosinophilic Asthma. J Allergy Clin Immunol Pract. 2017 Nov-Dec;5(6):1572-1581.e3. doi: 10.1016/j.jaip.2017.08.024. Erratum in: J Allergy Clin Immunol Pract. 2018 May – Jun;6(3):1095.
Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014 Jan 13;(1):CD003559. doi: 10.1002/14651858.CD003559.pub4.
O’Malley PG. Asthma in Adults. N Engl J Med. 2023;389:1023-31. doi: 10.1056/NEJMcp230487.1
Ortega H, Hahn B, Bogart M, et al. Impact of mepolizumab on exacerbations in severe asthma: Results from a U.S. insurance claims data base. Allergy Asthma Proc. 2020 Sep 1;41(5):341-347. doi: 10.2500/aap.2020.41.200043.
Ortega HG, Yancey SW, Mayer B, et al. Severe eosinophilic asthma treated with mepolizumab stratified by baseline eosinophil thresholds: a secondary analysis of the DREAM and MENSA studies. Lancet Respir Med. 2016 Jul;4(7):549-556. doi: 10.1016/S2213-2600(16)30031-5. 3.
Papapostolou N, Makris M. Allergic Asthma in the Era of Personalized Medicine. J Pers Med. 2022 Jul 18;12(7):1162. doi: 10.3390/jpm12071162.
Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet. 2012 Aug 18;380(9842):651-9. doi: 10.1016/S0140-6736(12)60988-X.
Pelaia C, Calabrese C, Terracciano R, de Blasio F, Vatrella A, Pelaia G. Omalizumab, the first available antibody for biological treatment of severe asthma: more than a decade of real-life effectiveness. Ther Adv Respir Dis. 2018 Jan-Dec;12:1753466618810192. doi: 10.1177/1753466618810192.
Posa D, Hofmaier S, Arasi S, Matricardi PM. Natural evolution of IgE responses to mite allergens and relationship to progression of allergic disease: a review. Curr Allergy Asthma Rep. 2017;17(5):28.
Reddel HK, Bacharier LB, Bateman ED, et al. Global Initiative for Asthma Strategy 2021: Executive Summary and Rationale for Key Changes. J Allergy Clin Immunol Pract. 2022 Jan;10(1S):S1-S18. doi: 10.1016/j.jaip.2021.10.001.
Rodrigo GJ, Neffen H, Castro-Rodriguez JA. Efficacy and safety of subcutaneous omalizumab vs placebo as add-on therapy to corticosteroids for children and adults with asthma: a systematic review. Chest. 2011 Jan;139(1):28-35. doi: 10.1378/chest.10-1194. 9.
Sehmi R, Lim HF, Mukherjee M, et al. Benralizumab attenuates airway eosinophilia in prednisone-dependent asthma. J Allergy Clin Immunol. 2018 Apr;141(4):1529-1532.e8. doi: 10.1016/j.jaci.2018.01.008.
Stanojevic S, Kaminsky DA, Miller MR, Thompson B, Aliverti A, Barjaktarevic I, Cooper BG, Culver B, Derom E, Hall GL, Hallstrand TS, Leuppi JD, MacIntyre N, McCormack M, Rosenfeld M, Swenson ER. ERS/ATS technical standard on interpretive strategies for routine lung function tests. Eur Respir J. 2022 Jul 13;60(1):2101499. doi: 10.1183/13993003.01499-2021.
Wechsler ME, Hickey L, Garin M, Chauhan A. Efficacy of Reslizumab Treatment in Exacerbation-Prone Patients with Severe Eosinophilic Asthma. J Allergy Clin Immunol Pract. 2020 Nov-Dec;8(10):3434-3442.e4. doi: 10.1016/j.jaip.2020.06.009.
Wenzel S, Ford L, Pearlman D, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013 Jun 27;368(26):2455-66. doi: 10.1056/NEJMoa1304048.
Articole din ediţiile anterioare
Recomandări de imunoterapie cu vaccinuri alergenice – ARIA 2019
Imunoterapia alergen specifică (AIT) este o opţiune terapeutică confirmată pentru tratamentul rinitei alergice şi/sau al astmului. S-au creat multe...
Managementul optim în angioedemul ereditar
Disponibilitatea medicaţiei de urgenţă este absolut necesară pentru toţi pacienţii cu diagnostic confirmat de angioedem ereditar (AEE).
Managementul reacţiilor de hipersensibilitate întârziată (RHI) la interferonul alfa (IFN α)
Interferonul (IFN) α 2a şi 2b se utilizează în tratamentul hepatitei cronice cu virus C şi al melanomului. Din cauza similitudinii structurale cu I...
Impactul clinic şi managementul comorbidităţilor în astmul sever
Pacienţii cu astm sever reprezintă o minoritate din populaţia totală cu astm (3-10% dintre aceştia), afecţiunea fiind responsabilă pentru 60% din c...