A recent survey of the European Academy of Allergy and Clinical Immunology (EAACI) Drug Allergy Interest Group (DAIG) on how European allergy specialists deal with betalactam (BL) hypersensitivity demonstrated a significant heterogeneity in current practice, suggesting the need to review and update existing EAACI guidelines in order to make the diagnostic procedures as safe and accurate, but also as cost-effective as possible. For this purpose, a bibliographic search on large studies regarding BL hypersensitivity diagnosis was performed by an EAACI task force, which reviewed and evaluated the literature data using the GRADE system for quality of evidence and strength of recommendation.
The updated guidelines provide a risk stratification in BL hypersensitivity according to index reaction(s), as well as an algorithmic approach, based on crossreactivity studies, in patients with a suspicion of BL hypersensitivity and an immediate need for antibiotic therapy, when referral to an allergist is not feasible. Furthermore, the update addresses availability and concentrations of skin test (ST) reagents, ST and drug provocation test (DPT) protocols, and diagnostic algorithms and administration of alternative BL in allergic subjects. Specifically, distinct diagnostic algorithms are suggested depending on risk stratification of the patient into high and low risk based on the morphology and chronology of the reaction, immediate (i.e., occurring within 1-6 hours after the last administered dose) or nonimmediate (i.e., occurring more than 1 hour after the initial drug administration), and the reaction severity. Regarding the allergy workup, the main novelty of this document is the fact that in some low-risk nonimmediate reactions, ST are not mandatory, especially in children. For DPT, further studies are necessary to provide data supporting the standardization of protocols, especially of those regarding nonimmediate reactions, for which there is currently no consensus.
Ţintind un diagnostic mai precis în hipersensibilitatea la betalactamine
Towards a more precise diagnosis of hypersensitivity to betalactams
First published: 10 iunie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.4.2.2020.3537
Abstract
Rezumat
Un studiu recent al Grupului de interes pentru alergia medicamentoasă (DAIG) al Academiei Europene de Alergologie şi Imunologie Clinică (EAACI), despre modul în care medicii specialişti alergologi europeni abordează hipersensibilitatea la betalactamine (BL), a demonstrat o eterogenitate semnificativă în practica curentă, sugerând nevoia de a revizui şi de a actualiza ghidurile EAACI, cu scopul de a face procedurile diagnostice cât mai sigure şi exacte, precum şi cost-eficiente. În acest sens, un grup de lucru al EAACI a realizat o căutare bibliografică pe studii vaste privind diagnosticul hipersensibilităţii la BL, revizuind şi evaluând datele din literatură prin sistemul GRADE privind calitatea dovezilor, intervalul de încredere şi puterea recomandării.
Ghidurile revizuite realizează o stratificare a riscului în hipersensibilitatea la BL raportată la reacţia (reacţiile) iniţială (iniţiale), precum şi o abordare algoritmică bazată pe studiile de reactivitate încrucişată, la pacienţii cu suspiciune de hipersensibilitate la BL care necesită tratament antibiotic imediat, când consultul alergologic nu se poate realiza. Mai mult, actualizarea ghidului stabileşte disponibilitatea şi concentraţiile reactivilor pentru testare cutanată (TC), protocoalele pentru TC şi pentru testul de provocare la medicament (TPM), precum şi algoritmul diagnostic şi administrarea de BL alternative la pacienţii alergici. În mod precis, sunt sugeraţi algoritmi de diagnostic, diferiţi în funcţie de stratificarea riscului pacientului ca având risc înalt sau scăzut pe baza morfologiei şi cronologiei reacţiei – imediată (care apare între 1 şi 6 ore de la ultima doză administrată) sau nonimediată (care apare la mai mult de o oră de la administrarea iniţială a medicamentului) –, precum şi a severităţii reacţiei. În privinţa evaluării alergologice, principala noutate a acestui document este faptul că, în cazul unor reacţii nonimediate cu risc scăzut, TC nu este obligatorie, mai ales în cazul copiilor. În cazul TPM sunt necesare studii ulterioare, care să aducă date suplimentare în sprijinul standardizării protocoalelor, mai ales a celor privind reacţiile nonimediate, pentru care în prezent nu există consens.
Introducere
Betalactaminele (BL) sunt antibiotice de primă intenţie în tratamentul majorităţii infecţiilor bacteriene. Dintre acestea, amoxicilina reprezintă antibioticul cel mai utilizat în Europa(1). Uneori, agentul terapeutic devine însă problematic, alergia la antibiotice fiind în prezent o problemă de sănătate la nivel mondial. Diagnosticul alergiei la un antibiotic este complex, dar în general uşor pentru experţii alergologi. Totuşi, acest diagnostic poate fi dificil când pacienţii sunt trimişi pentru evaluare alergologică după o perioadă îndelungată şi când informaţiile despre natura simptomelor şi antibioticul suspicionat sunt incomplete. În plus, chiar şi o mică suspiciune de alergie la betalactamine are ca rezultat utilizarea unor tratamente alternative care pot fi mai puţin eficiente, pot conduce la prelungirea duratei de tratament, pot fi mai toxice, mai costisitoare şi pot contribui la creşterea rezistenţei bacteriene(2,3).
Abordarea diagnostică şi rezultatele investigaţiilor în cazul pacienţilor cu hipersensibilitate la BL sunt într-o continuă schimbare din cauza introducerii noilor BL şi, secundar, a modificării modului în care acestea sunt întrebuinţate în diferite ţări europene(1,4,5). Acest lucru influenţează sensibilitatea testelor, precum şi rata reactivităţii încrucişate şi poate, de asemenea, să explice rezultatele diferite în variate studii europene realizate conform recomandărilor ghidurilor EAACI pentru diagnosticul hipersensibilităţii la BL.
Din cauza prevalenţei scăzute a hipersensibilităţii reale la BL şi a dezavantajelor administrării tratamentelor alternative, toate persoanele cu istoric de hipersensibilitate la BL ar trebui să fie evaluate alergologic la scurt timp după astfel de reacţii, dacă este posibil, pentru stabilirea unui diagnostic cert(6,7). În acelaşi timp, în cele mai multe ţări există o nevoie urgentă de reducere a costurilor în sistemul de sănătate, fapt în general incompatibil cu medicina de precizie. De aceea, determinarea celei mai sigure, precise şi cost-eficiente metode de confirmare a hipersensibilităţii IgE-mediate sau mediate de limfocitul T, cu relevanţă clinică, a devenit extrem de importantă(8). În plus, un studiu al grupului de interes pentru alergia la medicamente al EAACI (DAIG) despre modul în care medicii specialişti alergologi europeni abordează hipersensibilitatea la BL(5) a demonstrat o eterogenitate semnificativă în practica medicală curentă nu numai între ţări, dar şi între centre aparţinând aceleiaşi ţări. Toate acestea sugerează necesitatea de a revizui şi actualiza algoritmii şi ghidurile curente ale EAACI, precum şi de a standardiza protocoalele de testare pentru diagnosticul hipersensibilităţii la BL. Scopul acestui document este de a răspunde la această necesitate, oferind date şi recomandări cu privire la diagnosticul hipersensibilităţii la BL bazate pe studiile publicate, astfel încât procedurile diagnostice să devină cât mai sigure, precise şi cost-eficiente posibil. De menţionat că acest document se concentrează în mod special asupra utilizării terapeutice a BL şi nu abordează specific problema ridicată de profilaxia antibiotică la pacienţii cu suspiciune de alergie la BL.
Metodă
Un grup de lucru al EAACI a realizat o căutare bibliografică în bazele de date electronice (MEDLINE şi PubMed), în bibliotecile electronice (Science Direct, OVID) şi o bază de date cu revizuire sistematică (biblioteca Cochrane). Au fost luate în considerare în mod deosebit publicaţiile din 2009 şi până în prezent. Cuvintele-cheie au fost: alergie, betalactamine, reactivitate încrucişată, diagnostic, teste de provocare la medicamente, hipersensibilitate, reacţii imediate, teste in vitro, reacţii nonimediate, teste patch, teste cutanate, IgE specific şi celule T. Autorii au evaluat relevanţa articolelor pe baza titlului şi a rezumatului. Articolele selectate au fost ulterior descărcate şi analizate. Rezultatul muncii fiecărui autor a fost discutat de membrii grupului de lucru, confirmat sau modificat prin consens la nivelul grupului. Enunţurile-cheie asupra calităţii dovezilor şi puterea de recomandare au fost realizate folosind sistemul GRADE(9). Intervalul de încredere a fost considerat înalt dacă este foarte puţin probabil ca cercetări ulterioare să ne schimbe încrederea în estimarea efectului; moderat dacă este probabil ca cercetări ulterioare să aibă un impact semnificativ asupra încrederii în estimarea efectului şi pot schimba estimarea; scăzut dacă este foarte probabil ca cercetări ulterioare să aibă un impact important asupra încrederii în estimarea efectului şi este probabil să schimbe estimarea; foarte scăzut dacă orice estimare a efectului este incertă. Recomandarea este puternică dacă clinicienii sunt siguri că beneficiile depăşesc riscurile; este slabă dacă beneficiile şi riscurile sunt relativ egale sau există o incertitudine considerabilă asupra dimensiunii riscului.
Evaluarea riscurilor
La majoritatea pacienţilor cu suspiciune de alergie la BL, procedura standard este evitarea sau oprirea antibioticului suspectat, urmând ca testarea să se efectueze ulterior (înalt/puternic). Decizia de a opri sau continua tratamentul cu BL este foarte importantă, deoarece deseori antibioticele alternative sunt mai puţin eficiente şi asociate cu un nivel mai ridicat de reacţii adverse, cum ar fi probleme gastrointestinale (greaţă, crampe, diaree) provocate de macrolide, rupturi de tendon cauzate de fluorochinolone, precum şi ototoxicitatea aminoglicozidelor (moderat/puternic). Indiciile pentru diagnostic cuprind morfologia (caracteristicile) şi cronologia reacţiei iniţiale, factorii de risc pentru potenţiala alergie la medicament, numărul de reacţii anterioare la acelaşi medicament, tratamentul necesar pentru reacţia iniţială şi orice alte antibiotice tolerate după această reacţie. În ceea ce priveşte factorii de risc, este recomandabil să se ia în considerare atât cei legaţi de medicament, cum ar fi tipul tratamentului (de exemplu, intermitent, repetat sau neîntrerupt) şi calea de administrare, cât şi cei legaţi de pacient, cum ar fi vârsta, caracteristicile genetice sau boli concomitente (de exemplu, fibroza chistică, infecţii cu EBV şi HIV), precum şi cei legaţide activitatea profesională.
Primul pas este să verificăm dacă aspectul clinic este compatibil cu cel al unei alergii la medicamente sau este mai probabil un diagnostic alternativ (de exemplu, exantem viral) (moderat/puternic)(10). Pentru mulţi pacienţi, dar şi pentru unii profesionişti în domeniul sănătăţii, orice reacţii adverse la BL, de tipul greaţă, vărsături, dureri de cap, sunt catalogate incorect ca fiind alergice. De asemenea, unii pacienţi au fost reexpuşi şi au tolerat acelaşi medicament după reacţia iniţială; la aceşti pacienţi, eticheta de alergie la medicamentul respectiv poate fi îndepărtată fără testare. La toţi pacienţii este obligatoriu să se verifice semnele de pericol (înalt/puternic) – tabelul 1.

Pasul următor este evaluarea cronologiei reacţiei, cu diferenţierea reacţiilor imediate de cele nonimediate, denumite uneori şi întârziate (moderat/puternic)(11). Primele reacţii apar de obicei în prima oră, dar pot apărea şi până la 6 ore de la ultima administrare, şi sunt asociate în mare parte cu un mecanism IgE mediat. De fapt, în reacţiile imediate la BL, activarea receptorului MRGPRX2 de pe suprafaţa mastocitelor nu joacă niciun rol, spre deosebire de reacţiile imediate la vancomicină şi fluorochinolone, care sunt cei mai cunoscuţi activatori mastocitari, ce determină astfel reacţii non-IgE mediate la antibiotice(12). Reacţiile imediate se manifestă de obicei ca simptome izolate, cum ar fi urticarie, angioedem şi bronhospasm, sau ca anafilaxie (tabelul 2). Reacţiile nonimediate pot apărea oricând, pornind de la o oră după administrarea iniţială a medicamentului, în mod obişnuit după mai multe zile de tratament, şi sunt adesea asociate cu un mecanism alergic dependent de limfocitele T(11,13). Exantemele maculopapuloase (EMP) şi urticaria întârziată sunt cele mai frecvente manifestări clinice ale reacţiilor nonimediate (tabelul 2).
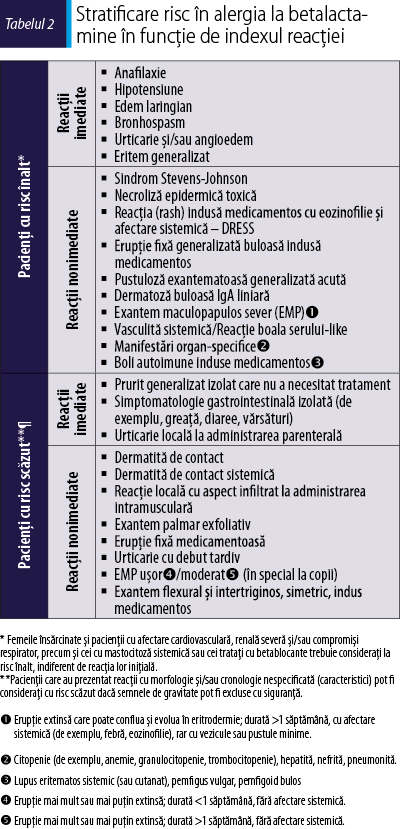
Totuşi, o clasificare făcută numai pe baza cronologiei poate duce la suprapuneri de diagnostice. De exemplu, o reacţie care se manifestă între 1 oră şi 6 ore de la prima (şi singura) doză administrată va fi clasificată atât ca imediată, cât şi ca întârziată. Prin urmare, pentru a depăşi această limitare, este recomandat să se ţină cont şi de morfologia reacţiei. Având în vedere particularităţile celor mai multe dintre reacţii (în tabelul 2, doar urticaria este listată atât la reacţiile imediate, cât şi la cele nonimediate), această abordare va limita numărul de suprapuneri posibile. În cazul unei reacţii urticariene care se manifestă după mai mult de o oră, dar în primele 6 ore de la administrarea primei doze de BL, se recomandă ca aceasta să fie considerată imediată.
Când caracteristicile şi cronologia reacţiei indică o reacţie de hipersensibilitate, tratamentul trebuie întrerupt. În unele cazuri (de exemplu, EMP uşor), administrarea BL ar putea fi continuată (tratare concomitentă, „treating through”) sub supraveghere atentă, dacă, după evaluarea întregului tablou clinic, nu se obiectivează semne clare de gravitate (tabelul 1) şi dacă beneficiul depăşeşte riscul (scăzut/slab)(14).
Gestionarea pacienţilor cu suspiciune de reacţii de hipersensibilitate la BL depinde de profilul lor de risc, de accesul la o unitate/secţie de alergologie şi de indicaţia clinică pentru BL sau pentru o alternativă.
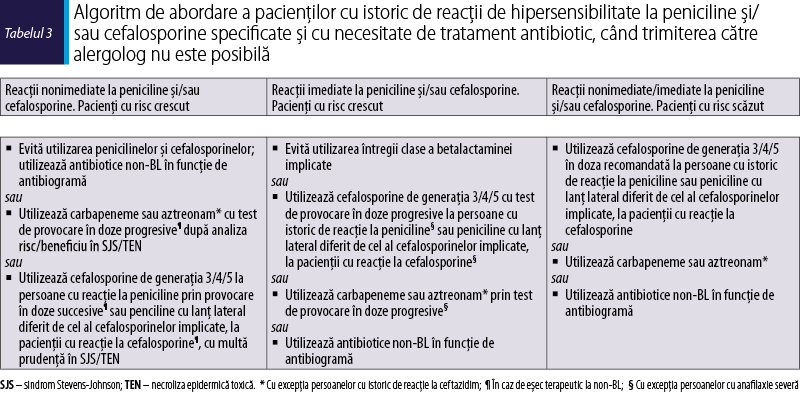
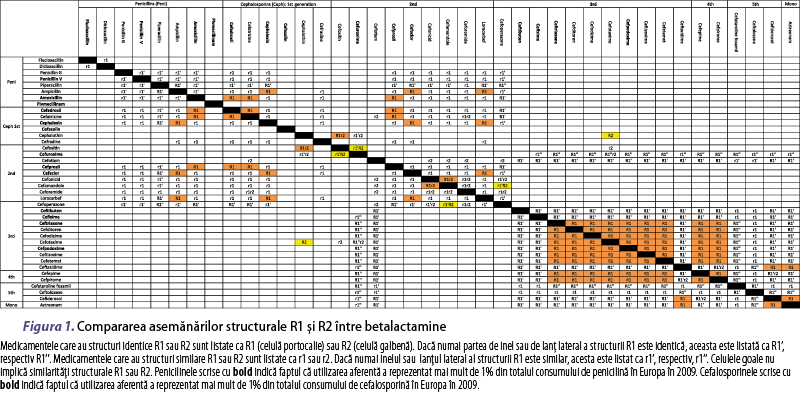
Tabelul 2 prezintă stratificarea riscului în alergia la BL şi abordarea acesteia. Pacienţii care au suferit reacţii severe sau care au o probabilitate crescută de a dezvolta o reacţie mai severă (de exemplu, anafilaxie) faţă de reacţia iniţială (de exemplu, urticarie) în cazul reexpunerii la BL incriminată sunt clasificaţi cu risc crescut. Pacienţii care au avut reacţii mai puţin severe sau care au o probabilitate scăzută de a dezvolta o reacţie mai severă decât reacţia iniţială, în cazul reexpunerii la medicamentul incriminat, sunt clasificaţi la risc scăzut. Primii prezintă un risc mai mare de a avea reacţii sistemice la testele alergologice decât cazurile cu risc scăzut. Tabelul 3 prezintă abordarea algoritmică a pacienţilor cu suspiciune de hipersensibilitate la anumite peniciline şi/sau cefalosporine şi care au nevoie imediată de antibioterapie, când evaluarea alergologică nu este posibilă. În toate cazurile, un antibiotic alternativ nonbetalactamic poate fi administrat fără restricţii (înalt/puternic). În cazul în care este nevoie de o altă BL, trebuie evitată administrarea substanţelor cu structură similară sau identică între medicamentul incriminat şi cel utilizat ca alternativă (înalt/puternic) – figura 1(15,16).
Diagnostic
Doar istoricul clinic nu este un instrument de diagnostic fiabil (înalt/puternic), iar modelele predictive, ca şi algoritmii de luare a deciziilor clinice, bazate pe istoricul clinic al pacienţilor cu suspiciune de reacţie alergică la BL, s-au dovedit instrumente ineficiente pentru a diferenţia cu exactitate indivizii alergici de cei nealergici (moderat/puternic)(17-19). Confirmarea sau excluderea alergiei la BL se bazează în principal pe teste cutanate (TC), teste cutanate patch şi teste de provocare la medicamente (TPM) (înalt/puternic). Testele in vitro clar pozitive (de exemplu, IgE specifice serice) pot fi utile pentru evitarea TPM, în special la pacienţii care au prezentat reacţii severe, precum anafilaxie (moderat/puternic). Cu toate acestea, sensibilitatea testului in vitro poate varia în funcţie de diverşi factori, cum ar fi intervalul de timp dintre reacţie şi test, severitatea reacţiei şi cronologia acesteia. În general, la evaluarea pacienţilor cu reacţii imediate, testele in vitro sunt mai puţin sensibile decât TC, în timp ce la evaluarea pacienţilor cu reacţii nonimediate este adevărat contrariul(20).
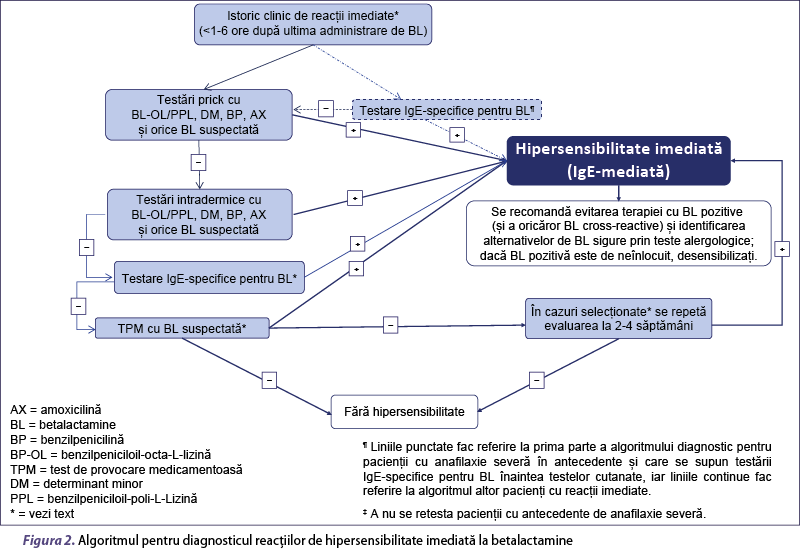
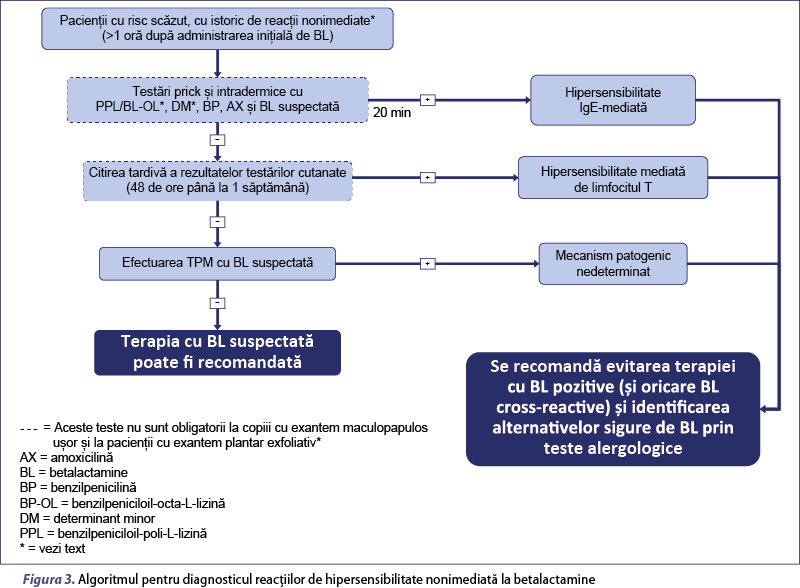
Diagnosticul poate fi stabilit prin algoritmi diferiţi, aplicaţi în funcţie de stratificarea riscului pacientului, ca fiind unul cu risc ridicat sau scăzut, stabilit pe baza morfologiei şi cronologiei reacţiei, imediate sau nonimediate, şi a gravităţii reacţiei (figurile 2 şi 3).
Testele cutanate prick/intradermice şi testele patch
Indicaţiile şi momentul efectuării
Testele cutanate (TC) cu citire imediată – şi anume, TC prick (TCP) şi intradermice sunt indicate pentru evaluarea pacienţilor cu reacţii imediate, în timp ce TC cu citire tardivă şi/sau TC patch sunt recomandate pentru evaluarea pacienţilor cu reacţii nonimediate(21).
În reacţiile imediate, TC trebuie efectuate după un interval de timp de 3-6 săptămâni de la reacţia iniţială (înalt/puternic), ceea ce permite, în general, remisiunea simptomelor clinice, precum şi clearence-ul medicamentelor incriminate şi cel al medicaţiei antialergice. Cu toate acestea, reactivitatea IgE-mediată a pielii faţă de BL scade cu timpul(22); prin urmare, se recomandă ca TC să fie efectuate cât mai curând posibil după ce s-au scurs cele 3-6 săptămâni menţionate anterior (înalt/puternic). Cu toate acestea, nu există o limită superioară în care TCP poate fi considerată inexact.
În reacţiile nonimediate se recomandă efectuarea TC la cel puţin 4 săptămâni după dispariţia reacţiilor adverse medicamentoase cutanate (RAMC), întreruperea glucocorticoizilor sistemici sau a medicamentelor imunosupresoare şi, în cazul TC patch, la 4 săptămâni după expunerea la ultraviolete pe aria cutanată de testat şi la o săptămână după întreruperea glucocorticoizilor topici pe zona testării (înalt/puternic)(21,23).
În reacţia indusă medicamentos însoţită de eozinofilie şi afectare sistemică (DRESS), TC patch trebuie efectuată la cel puţin 6 luni după dispariţia RAMC şi după verificare prin reacţie de polimerizare în lanţ (PCR) cantitativă în timp real, în ser, a absenţei reactivării virusurilor din grupul herpes (adică HHV6, HHV7, EBV şi citomegalovirusul uman) (înalt/puternic)(24,25).
Reactivi şi concentraţii
Panelul de reactivi pentru evaluarea reacţiilor de hipersensibilitate la BL prin TC include reactivii clasici de penicilină (determinanţii minori şi majori ai benzilpenicilinei şi benzilpenicilina), amoxicilină şi orice altă BL suspectată (înalt/puternic).
Benzilpeniciloil-poli-L-lizină (PPL, Pre-Pen®, AllerQuest LLC, Plainville, CT, SUA) şi benzilpeniciloil-octa-L-lizină (BP-OL, 0,04 mg/mL, DAP®, Diater, Leganés, Madrid, Spania) sunt determinanţii majori disponibili comercial. În Europa, singurul determinant minor (DM) disponibil în comerţ, altul decât benzilpenicilina, este benzilpeniloatul de sodiu (DM, 0,5 mg/ml, DAP®). Cu toate acestea, PPL, BP-OL şi DM nu sunt disponibile în toate ţările europene(5). Cele mai mari concentraţii neiritative recomandate atât în TC prick, cât şi intradermică(26,27) sunt prezentate în tabelul 4.
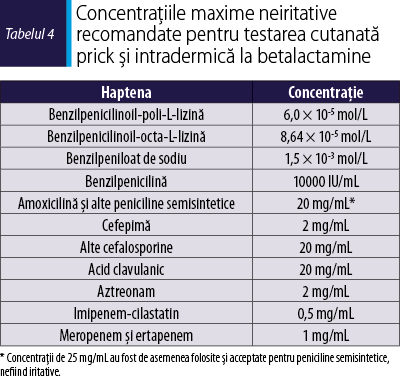
În reacţiile imediate se recomandă ca testarea cutanată să fie efectuată conform panelului de reactivi menţionat anterior, la concentraţii în creştere progresivă până la cea mai ridicată, neiritativă (înalt/puternic), în timp ce unele studii(28,29) au demonstrat că TC cu determinanţii majori şi minori ai benzilpenicilinei sunt puţin utile în reacţiile nonimediate (moderat/puternic).
TC prick trebuie efectuată cu soluţii injectabile. Cu toate acestea, dacă BL în cauză nu este disponibilă în această formă, TC prick se poate face cu orice formă de BL comercializată (moderat/slab)(21), deşi rezultatele trebuie interpretate cu precauţie, deoarece în acest caz nu se cunoaşte concentraţia exactă de medicament activ. Martorul pozitiv este histamina în concentraţie de 10 mg/ml sau codeina fosfat. Ca martor negativ se utilizează soluţie salină normală şi/sau orice alt solvent folosit pentru diluare.
Pentru TC intradermică este obligatorie utilizarea de soluţii injectabile sterile (înalt/puternic). Utilizarea unui martor pozitiv cu histamină 1 mg/ml nu este obligatorie, dacă se foloseşte un martor pozitiv pentru TC prick. Drept control negativ se utilizează soluţie salină normală şi/sau orice alt solvent folosit pentru diluare.
Pentru TC patch, ghidurile europene anterioare(30,31) sugerează o concentraţie de BL de 5% în petrolatum. Concentraţii mai mari (până la 50% în petrolatum) s-au dovedit a fi neiritante(232,33), dar nu sunt mai sensibile(32). În unele ţări europene sunt disponibile 11 BL diluate 10% în petrolatum şi sunt comercializate de Chemotechnique (Velinge, Suedia) ca produse gata pentru utilizare în seringă.
Când ingredientul activ este disponibil în forma pură (de exemplu, liofilizat), este recomandat să-l diluăm în 10% petrolatum (înalt/puternic)(23); în caz contrar, pudra conţinută în capsule sau obţinută prin îndepărtarea învelişului extern al tabletelor cu un bisturiu şi zdrobirea lor într-un mojar poate fi diluată 20%(21) sau 30% în petrolatum(23,34).
Testele cutanate prick
Testele cutanate reprezintă metoda de primă linie pentru evaluarea reacţiilor de hipersensibilitate imediată la BL (înalt/puternic)(22,31,35). Secvenţa sugerată a TC este următoarea: (a) TC prick (concentraţie 1/10 şi concentraţia cea mai mare neiritativă) la intervale de 20 de minute şi, dacă sunt negative, (b) TC intradermice (1/100 din concentraţia cea mai mare neiritativă, 1/10 şi concentraţiile cele mai mari neiritative) la intervale de 20 de minute. Procedura se opreşte când apare un TC pozitiv. În evaluarea pacienţilor cu reacţii anafilactice severe, concentraţiile de început ale reactivilor pentru TC ar trebui să fie cel puţin 10-3 din concentraţiile cele mai mari neiritative, pentru a evita reacţiile sistemice (înalt/puternic)(27,36). La pacienţii cu risc scăzut (tabelul 2), evaluarea poate fi simplificată efectuând TC prick şi intradermic direct cu cele mai mari concentraţii neiritative.
Reacţiile la TC prick sunt considerate pozitive când diametrul papulei este cel puţin 3 mm faţă de martorul negativ şi este înconjurată de eritem la 20 de minute după înţepătură(21,22). TC prick au valoare în evaluarea reacţiilor de hipersensibilitate imediată la BL (înalt/puternic)(22,31). Rareori, au fost raportate răspunsuri pozitive tardive la TC prick în EMP, DRESS şi pustuloza exantematică generalizată acută (PEGA)(24,25). Un TC prick are o reacţie pozitivă întârziată când există eritem şi infiltrare la locul puncţionării după una sau două zile(21).
Testele cutanate intradermice
TC intradermic se efectuează cu antibioticul BL vizat după ce ne asigurăm că TC prick este negativ (înalt/puternic). Volumul recomandat pentru injectare este 0,02 ml. Diametrul papulei injectate ar trebui măsurat imediat după injectare (Pi). Dacă papula nu este rotundă, diametrul mediu (mPi) este cel care ar trebui măsurat [(D+d)/2, unde D = cel mai mare diametru al papulei şi d = cel mai mare diametru perpendicular pe D]. Aceste diametre sunt apoi măsurate după 20 de minute. În acest moment, TC intradermic este considerat pozitiv dacă diametrul papulei (P20/mP20) este cu cel puţin 3 mm mai mare decât acela al Pi/mPi şi este înconjurat de eritem, care de asemenea trebuie măsurat(21,22).
La pacienţii cu reacţii nonimediate, TC intradermic poate fi pozitiv la citiri tardive (de exemplu, după 24, 48 sau 72 de ore). Orice reacţii tardive la TC intradermic trebuie documentate atât prin diametrul eritemului şi al zonei infiltrate, cât şi prin descrierea morfologică (edem eritematos, infiltrat eritematos, numai eritem, eczemă cu papule cu sau fără vezicule). Orice eritem infiltrat cu diametrul mai mare de 5 mm trebuie considerat o reacţie pozitivă(30). Pacienţii sunt sfătuiţi să revină, pentru a arăta orice reacţie pozitivă care apare în interval de o săptămână după TC intradermic şi, de asemenea, să facă poze la TC intradermice pozitive sau incerte. Citirea tardivă a TC intradermice are valoare în EMP, dar poate fi omisă în exantemele exfoliative palmare (înalt/puternic), unde sunt de obicei negative(37).
Testele cutanate patch
Testele cutanate patch sunt un instrument de diagnostic simplu şi sigur; de fapt, reacţiile sistemice la acestea sunt extrem de rare(25).
În evaluarea pacienţilor care au suferit reacţii cutanate severe, precum sindromul Stevens-Johnson (SJS), necroliza epidermică toxică (TEN), DRESS, PEGA, exantemele buloase sau exantemul maculopapulos cu simptome sistemice, TC patch cu BL suspectată trebuie folosită ca primă linie de investigaţie (înaintea TC prick şi intradermice), după cum se menţionează în ghidurile europene anterioare(21,30,31) (înalt/puternic). Dacă TC patch au rezultate pozitive, TC prick şi intradermice trebuie evitate, în timp ce, în caz de rezultate negative, se pot efectua, începând cu o concentraţie mai mică a medicamentului vizat (1 mg/ml pentru penicilinele semisintetice) (moderat/puternic)(24,38).
Referitor la pacienţii cu risc scăzut (tabelul 2), TC patch reprezintă metoda de elecţie pentru cei cu dermatită de contact; sunt utile în EMP, exantemele flexurale şi, dacă sunt efectuate in situ, de asemenea în erupţiile fixe postmedicamentoase (EFM) (înalt/puternic)(25). TC patch sunt aplicate la nivelul toracelui postero-superior utilizând camere de testare în conformitate cu metodele folosite pentru dermatita de contact. Când sunt negative, ele trebuie completate cu TC intradermică cu citiri tardive, care sunt mai sensibile decât TC patch(25,30). La pacienţii cu EFM, TC patch trebuie aplicate la locul erupţiei (leziune reziduală pigmentată). Sunt menţinute două zile, apoi se face citirea în ziua 2 (la 30 de minute după îndepărtarea camerei) şi în ziua 4 sau 5. Criteriile de interpretare a rezultatelor sunt identice cu cele utilizate în alergia de contact (de exemplu, negative, iritative, + până la +++)(21).
Testele in vitro
Principalele teste in vitro pentru evaluarea reacţiilor imediate la BL sunt determinarea IgE specifice serice (IgEsp) şi testul de activare a bazofilului (BAT)(20,39-41).
Aceste teste sunt complementare TC(22,31), deoarece există cazuri cu istoric clar de reacţie de hipersensibilitate imediată la BL, precum peniciline, cefalosporine şi acid clavulanic, dar cu TC negative şi IgEsp sau BAT pozitive(42-47). De aceea, se recomandă efectuarea de teste in vitro complementare celor cutanate la pacienţii cu risc crescut, cu scopul de a îmbunătăţi sensibilitatea evaluării alergologice, reducând astfel necesitatea efectuării TPM (moderat/puternic).
Aşa cum se întâmplă şi în cazul TC(22), şi sensibilitatea IgEsp şi a TAB scade în timp(48,49); de aceea, este recomandat să fie efectuate cât mai curând posibil după reacţie (înalt/puternic)(20). La pacienţii cu istoric de anafilaxie severă, efectuarea testelor in vitro anterior testării cutanate poate reduce necesitatea acesteia din urmă, diminuând riscul de reacţie sistemică (înalt/puternic) – figura 2(22,31). În plus, testele in vitro pot înlocui TC în cazurile în care acestea din urmă sunt contraindicate, nepotrivite sau imposibil de realizat(20) (de exemplu, la gravide, la pacienţi imunodeprimaţi sau cu patologie asociată necontrolată clinic, la cei cu dermografism etc.).
Metoda comercială cel mai larg utilizată este FEIA (fluorescent-enzyme-immunoassay; testul de imunofluorescenţă enzimatică) (ImmunoCAP®, Thermo-Fisher, Uppsala, Sweden). Totuşi, această metodă este disponibilă doar pentru benzilpenicilină (penicilină G), penicilină V, amoxicilină, ampicilină şi cefaclor. Sensibilitatea metodei este mai degrabă scăzută şi variabilă (0-50%) şi pare să se coreleze cu severitatea reacţiei(42,50,51). Scăderea pragului de la 0,35 la 0,1 kU/l va creşte sensibilitatea, deşi reduce în acelaşi timp şi specificitatea, în mod particular la pacienţii cu IgE total > 200 kU/l(20). Un studiu realizat de Vultaggio şi colab.(52) a demonstrat că un raport IgEsp/IgE total ≥ 0,002 creşte specificitatea ImmunoCAP®. Totuşi, au fost raportate şi rezultate fals pozitive la testul ImmunoCAP® pentru penicilină, precum şi la testele cutanate(53,54). Aceste teste fals pozitive ar putea face din ImmunoCAP® o alegere mai puţin indicată pentru diagnosticul alergiei la penicilină(54).
BAT poate fi folosit pentru evaluarea reacţiilor imediate la BL(20, 39-41,45,50,55,56), mai ales în cazul celor la acid clavulanic(49,57-59) şi cefazolin(60), pentru care nu sunt disponibile teste imunoenzimatice comerciale. Totuşi, cu acest test au fost observate 1-10% rezultate fals pozitive, precum şi lipsă de răspuns în 5-10% din cazuri (la un control pozitiv pentru eliberarea de mediatori bazofilici mediată de IgE prin anticorpi anti-IgE sau anti-FcεRI)(39). Această lipsă de răspuns a bazofilului a fost atribuită scăderii producerii de tirozin-kinază citoplasmatică (Syk), care este implicată în calea FcεRI de transmitere a semnalului intracelular(61,62).
Testul de transformare limfocitară (TTL) şi testul ELISpot (enzyme-linked immunosorbent spot), precum şi markerii celulari şi eliberarea de cytokine pot fi folosite pentru evaluarea reacţiilor nonimediate la BL(20,39,63-65). Testele in vitro pentru evaluarea reacţiilor nonimediate, în mod particular TTL, ar trebui utilizate la pacienţii cu risc crescut înainte de a lua decizia de efectuare a altor investigaţii (moderat/puternic). Totuşi, acestea sunt mai degrabă proceduri complexe, care necesită personal bine pregătit şi experienţă specifică(66). În plus, cele mai multe teste in vitro utilizate în diagnosticul reacţiilor nonimediate nu sunt disponibile comercial şi de aceea nu au acelaşi grad de standardizare ca acelea pentru reacţiile imediate(20). Din aceste cauze nu sunt folosite pe scară largă, astfel nefiind validate pe cohorte mari de pacienţi(20). Totuşi, este recomandabil ca testele in vitro (când sunt indicate) să fie folosite alături de TC pentru diagnosticul complet al reacţiilor nonimediate.
Testele de provocare medicamentoasă (TPM)
Un TPM constă în administrarea controlată a medicamentului suspectat, pentru a confirma sau infirma o reacţie de hipersensibilitate(11,67). În acest document, termenul de provocare cu doze progresive se referă la administrarea unei betalactamine alternative, cu probabilitate mare de a fi tolerată.
TPM au fost recomandate atât de ghidurile europene(22,30,31,67,68), cât şi de cele americane, ca parte din protocolul de evaluare a alergiei la betalactamine. Cu toate acestea, numai ghidurile europene(22,30,31,67,68) subliniază rolul acestora în stabilirea unui diagnostic ferm de hipersensibilitate la BL, în cazurile selecţionate cu teste cutanate şi teste in vitro standardizate negative, şi recomandă utilizarea de protocoale diferite de TPM în funcţie de tipul de reacţie, imediată sau nonimediată. Documentul american(35) recomandă TPM numai dacă probabilitatea unei reacţii de hipersensibilitate este mică şi scenariul clinic justifică posibilul risc – de exemplu, nu există o alternativă terapeutică comparabilă(27).
În ultima decadă, TPM cu BL suspectate au fost efectuate în serii de peste 100 de pacienţi, atât la populaţii de copii(69-86), cât şi la cele de adulţi(29,58,87-99) sau ambele(18,100-109), cu creşterea importantă a cunoştinţelor legate de utilitatea şi siguranţa acestei modalităţi diagnostice în evaluarea alergiei la BL. Aceste cunoştinţe au contribuit la obţinerea unui consens asupra mai multor aspecte din principiile generale ale TPM (înalt/puternic) – tabelul 5.

Cu toate acestea, protocoalele TPM variază în cadrul studiilor, inclusiv al celor europene, în ceea ce priveşte etapele de creştere a dozelor, intervalul de timp dintre dozele crescătoare şi numărul de zile de desfăşurare, precum şi criteriile de diagnostic pentru un rezultat pozitiv. De fapt, un sondaj european recent(5) demonstrează o eterogenitate semnificativă în practica zilnică, mai ales în ceea ce priveşte TPM. Mai mulţi factori contribuie la aceste diferenţe: cronologia reacţiei iniţiale (imediată versus nonimediată), severitatea reacţiei (anafilaxie versus urticarie/EMP), populaţia implicată (copii versus adulţi), precum şi experienţa şi resursele disponibile în clinici.
În ultima decadă, mai mulţi investigatori au efectuat TPM fără TC anterioare la pacienţi, în special la copii cu EMP uşoare sau urticarie întârziată(79,80,83,86,98,108,110,111). Această abordare a fost de asemenea propusă şi de alţi cercetători(82,85,95,105,112-116), ajungându-se la un consens general, fiind recomandată atât în Grupul de lucru pediatric EAACI DAIG(117), cât şi de Societatea Britanică de Alergologie şi Imunologie Clinică(68), pentru utilizare la copii. De asemenea, în opinia noastră, TPM fără TC anterioară poate fi efectuată la copii cu EMP uşor, precum şi la pacienţi cu exantem palmar exfoliativ, în schimb TPM fără TC anterioare nu sunt recomandate la adulţii cu reacţii nonimediate cu risc scăzut, altele decât exantemul palmar exfoliativ (figura 3).
Oricum, rămân încă două mari zone în care lipseşte un consens: (i) dozele optime şi schema de dozare pentru TPM; şi (ii) dacă expunerea pacienţilor cu reacţii nonimediate la o singură doză terapeutică zilnică (DTZ) sau la doză unică maximă (DUM; de exemplu, TPM într-o zi) este suficientă pentru a stabili un diagnostic ferm sau dacă este nevoie de un TPM prelungit (de exemplu, cu durată mai mare de o zi).
(i) Standardizarea dozelor este deficitară şi există câteva scheme de dozare diferite. Unele studii, care au evaluat fie reacţii nonimediate(29) sau atât imediate, cât şi nonimediate(71,73,103), au efectuat TPM cu BL suspectate utilizând trei paşi sau mai puţini: de exemplu, 1-10-100%(73), 25-25-50%(71), 10-100%(29) sau 100%(103) din DUM. Într-un studiu(95) au fost efectuate TPM atât cu doze progresive, cât şi cu doză unică, în funcţie de riscul estimat de a induce o reacţie pe baza severităţii reacţiei iniţiale şi a comorbidităţilor pacienţilor. TPM cu doze progresive au fost efectuate folosind trei etape (adică 1-10-100% din DUM). TPM cu doză unică s-au efectuat administrând direct o DUM. Un alt studiu a identificat concentraţiile-prag pe baza analizei supravieţuirii şi a sugerat următoarele etape pentru TPM, când se utilizează intervale de 30 de minute: 5-15-30-50% din DTZ, cu paşi suplimentari mai mici de 0,01%, 0,1% şi 1% pentru reacţiile iniţiale de tip anafilactic(106).
Având în vedere studiile care au evaluat un număr mai mare de subiecţi cu reacţii imediate(58,91,94,100,101) şi studiul menţionat anterior(106), pot fi utilizate două protocoale diferite la aceşti pacienţi (moderat/slab) (tabelul 6), în funcţie de profilul lor de risc (tabelul 2).

În ceea ce priveşte pacienţii cu reacţii nonimediate, la adulţii cu risc scăzut şi copiii cu MPE moderat la care testele alergologice sunt negative, este recomandabil să se efectueze TPM cu BL suspectată (ridicat/puternic). În acest sens, ar trebui administrată iniţial o zecime din DUM şi, dacă este tolerată, o doză unică totală la 1 până la 7 zile după, în funcţie de intervalul de timp al reacţiei iniţiale. Dacă pacientul necesită tratament în momentul provocării, o zecime de doză (dacă este tolerată) poate fi urmată o oră mai târziu de doza întreagă. Dacă această doză este tolerată, administrarea medicamentului poate urma un curs normal. Cu toate acestea, conform unor studii(77,84,86,95,97,98,103,107,108) şi opiniei unora dintre autorii acestei lucrări, pacienţii cu reacţii nonimediate cu risc scăzut ar putea efectua direct TPM cu 100% din DUM a BL suspectate.
După TPM, o reacţie întârziată poate fi exclusă dacă după atingerea dozei terapeutice a trecut un interval de timp egal cu cel al reacţiei iniţiale fără apariţia simptomelor. De asemenea, pacienţii sunt sfătuiţi să revină să raporteze sau să arate orice reacţii care apar în acest interval de timp, precum şi de a face fotografii cu acestea din urmă.
(ii) Unele grupuri consideră toleranţa unei DUM sau a unei DTZ suficiente pentru a exclude o reacţie de hipersensibilitate întârziată(18,29,73,74,80,87,89,92,93,97,98,103,106-108). În studiile conexe(18,29,73,74,80,87,89,92,93,97,98,103,106-108), rata răspunsurilor pozitive la TPM cu BL suspectată a variat de la 0%(29,89) la 7,7%(106).
Alte grupuri consideră că o expunere prea scurtă la BL (în termeni de zile) poate fi responsabilă pentru TPM fals negativ, acesta fiind motivul pentru efectuarea TPM cu o durată de 2 până la 5 zile(69-71,75-79,82,83,85,86,95,99,104,105,109,111,112) sau chiar de 7 până la 10 zile(70,81,88,90,95,104,111), pentru a confirma sau a exclude o reacţie de hipersensibilitate întârziată.
Trebuie menţionat că rezultatele fals negative pot apărea şi din cauza unei doze prea mici, a lipsei cofactorilor, precum a infecţiilor şi/sau a inducerii potenţiale a toleranţei prin procedura de provocare(67).
În studiile în care s-a efectuat TPM prelungit(69-71,75-79,81-83,85,86,88,90,95,99,104,105,109,111,112) a fost găsită o rată a rezultatelor pozitive cuprinsă între 2%(78) şi 17,2%(90). Deoarece o asemenea rată a fost mai mare de 10% în mai multe studii(69,70,88,90,95,105,111), s-a sugerat că TPM prelungit creşte sensibilitatea evaluării alergologice la pacienţii cu reacţii nonimediate la BL. Cu toate acestea, sunt dovezi că TPM cu durată de o zi poate determina reacţii chiar la 48 de ore după ultima doză administrată şi, în cazuri izolate, chiar mai târziu(80, 106, 111), demonstrând că cel puţin o parte dintre rezultatele pozitive ale TPM prelungit care nu respectă perioada de washout (i.e., intervalul de timp între atingerea dozei terapeutice şi administrările ulterioare ale acestei doze, care ar trebui să fie egal cu timpul scurs între administrarea primei doze terapeutice şi apariţia simptomelor reacţiei iniţiale(111)) ar putea fi obţinute prin TPM cu durată de o zi. Se subliniază astfel importanţa perioadei de washout după provocarea iniţială, însă numai două studii(71,111) au fost concepute să respecte o perioadă de washout de 24 de ore şi, respectiv, până la 10 zile.
Câteva dintre studiile efectuate au avut o perioadă de urmărire mai lungă, evaluând valoarea predictivă negativă (VPN) a TPM în condiţiile vieţii cotidiene(72, 80, 83, 84, 92, 118-121). În două studii care au realizat TPM cu durata de o zi la pacienţi cu reacţii nonimediate la betalactamine(80,118), VPN a fost 89,1% şi 94,9%, pe când în patru studii referitoare la o populaţie pediatrică cu TPM prelungită(73,83,84,119), VPN a fost de 92,5%, 95,5%, 96,7% şi, respectiv, 93,3%.
Reacţiile nonimediate care survin după un TPM negativ cu durata de o zi sau după un TPM prelungit sunt descrise ca uşoare/moderate. Cu toate acestea, în studiile care au efectuat TPM cu durata de o zi(80,92,118,120), proporţia subiecţilor care au luat din nou BL implicată în condiţiile vieţii reale s-a situat între 22%(80) şi 39%(118), pe când în studiile care au realizat TPM prelungite cu BL(72,83,84,109) această proporţie s-a situat între 52%(72) şi 71%(84). Mai mult, Ratzon et al.(122) au găsit că 100% (n = 18/18) dintre pacienţii supuşi la TPM prelungite şi care au necesitat o BL l-au folosit, comparativ cu doar 76% (n = 16/21) dintre pacienţii care au trecut prin TPM cu durata de o zi.
În ansamblu, la pacienţii care nu au alte probleme de sănătate, potenţialele dezavantaje ale TPM prelungite cu antibiotice, precum rezistenţa microbiană şi noi sensibilizări, ar trebui să fie compensate de potenţialele beneficii, precum identificarea mai multor reacţii nonimediate şi convingerea pacienţilor sau a părinţilor şi/sau a medicilor acestora că tratamentul cu BL implicată în condiţii normale de viaţă va fi tolerat(72,83,84,109). Potrivit majorităţii autorilor acestor lucrări, TPM cu durata de o zi ar trebui să fie preferat celui prelungit, deoarece este suficient pentru stabilirea unui diagnostic ferm. Totuşi, luând în considerare datele din literatură(72,80,83,84,92,109,118,120), TPM prelungit ar putea fi efectuat dacă este necesară convingerea pacienţilor sau a părinţilor şi/sau a medicilor acestora că tratamentul cu BL implicată va fi bine tolerat în condiţiile vieţii reale. Pentru pacienţii supuşi unei TPM prelungit, perioada de washout şi durata acestor TPM ar putea fi alese în funcţie de cronologia reacţiei iniţiale.
În concluzie, există în continuare aspecte importante referitoare la protocoalele pentru TPM unde lipseşte consensul, chiar printre autorii acestui articol. Diferenţele geografice subliniază faptul că este improbabil ca o abordare uniformă să aibă succes şi, în consecinţă, această lucrare nu face recomandări ferme cu privire la protocoalele de TPM, ci prezintă datele actuale din studii recente. Introducerea unei stratificări a riscului care să diferenţieze pacienţii cu risc crescut de cei cu risc redus va permite ca strategiile de investigare să fie adaptate fiecărui pacient, asigurând o abordare sigură, dar mai eficientă. Odată ce stratificarea riscului este mai larg implementată şi mai multe studii vor fi publicate, va fi posibilă atingerea unui consens şi a unor recomandări ferme pentru protocoalele de TPM.
Indicaţia pentru reevaluarea sensibilităţii pacientului
Câteva studii au demonstrat că până la 30% dintre pacienţii cu hipersensibilitate IgE-mediată la peniciline şi/sau cefalosporine îşi pierd sensibilitatea şi prezintă TC negative în decurs de un an, iar mai mult de 60%, în decurs de 5 ani(123,124). În alte studii efectuate pe eşantioane de cel puţin 50 de subiecţi cu suspiciune de hipersensibilitate la betalactamine şi teste alergologice negative, inclusiv TPM, care au fost reevaluaţi o lună mai târziu(94,100,125-127), a fost observată o resensibilizare (i.e., conversia către TC pozitiv) cu o frecvenţă care variază între 2%(127) şi 15,9%(100). Prin urmare, în cazul unei suspiciuni puternice de hipersensibilitate, deşi nu există un consens clar între experţi(128), marea majoritate a autorilor acestei lucrări consideră că este recomandabilă retestarea (2-4 săptămâni mai târziu) a pacienţilor care au suferit reacţii severe imediate la BL cu mai mult de 6 luni înainte şi a căror evaluare alergologică, inclusiv la TPM, a fost negativă (înalt/puternic).
Recent au fost raportate cazuri de dezvoltare a toleranţei naturale la antibiotice la copiii a căror reacţie iniţială a fost un exantem uşor tardiv, dovedit prin TPM(84), sugerând că anumite forme de hipersensibilitate la BL pot să nu fie o afecţiune permanentă.
Reactivitatea încrucişată printre betalactamine şi toleranţa la betalactamine alternative
Administrarea penicilinelor alternative la pacienţii cu alergie la penicilină
Datele din literatură indică un grad crescut de reactivitate încrucişată printre penicilinele semisintetice, în special aminopeniciline (adică amoxicilină, ampicilină, bacampicilină şi pivampicilină) care au în comun gruparea amino în catena laterală, ca şi între penicilinele semisintetice şi benzilpenicilină(15,16). Cu toate acestea, sunt studii în care pacienţii cu hipersensibilitate la aminopeniciline, fie mediată de IgE(91), fie mediată de limfocitele T(129), au trecut testele de provocare şi au tolerat doze progresive de penicilină G şi penicilină V, după testări cutanate negative.
Administrarea cefalosporinelor la pacienţii cu alergie la penicilină
În studiile realizate din 1990 pe eşantioane de cel puţin 30 de subiecţi cu hipersensibilitate IgE-mediată documentată la peniciline(130-134), proporţia răspunsurilor pozitive la TC cu cefalosporine a variat între 0%(131,133) şi 33%(134). Cea mai mare proporţie a fost găsită într-un studiu(134) în care TC a fost efectuate cu un panel de 9 cefalosporine, incluzând cefamandol şi aminocefalosporine, care au catenele laterale similare sau identice cu cele ale penicilinelor. În aceste studii(130-134), participanţii alergici la penicilină cu rezultate negative la TC la cefalosporine au fost supuşi testelor de provocare cu cefalosporine precum cefazolin, cefuroxim, ceftazidim şi ceftriaxon, care nu au lanţuri laterale similare sau identice în comun cu penicilina. Dintr-un total de 912 provocări, numai două (0,2%) au fost pozitive(133).
În cadrul celor trei studii(38,129,135) care au evaluat reactivitatea încrucişată cu cefalosporinele, la adulţi cu hipersensibilitate mediată prin celulele T – efectuând TC şi/sau TC patch şi, în cazul în care rezultatele au fost negative, s-au efectuat provocări cu întregul grup de cefalosporine testate(38,135) – s-a constatat o rată de reactivitate încrucişată cu aminocefalosporine de 19,1%, respectiv 31,2%. În aceste studii(38,129,135), dintr-un total de 1083 de provocări la cefalosporine, doar 3 (0,3%) au fost pozitive(38-129).
Administrarea de aztreonam şi carbapeneme la pacienţii cu alergie la penicilină
Studii prospective la subiecţi cu alergie IgE‑mediată la penicilină au demonstrat o rată de reactivitate încrucişată între peniciline şi carbapeneme şi/sau aztreonam mai mică de 1%(136-140). Două studii privind subiecţii cu hipersensibilitate mediată prin limfocite T la peniciline(38,141) au documentat absenţa reactivităţii încrucişate cu aztreonam sau carbapeneme. În studiile menţionate referitoare la sute de subiecţi cu reacţii de hipersensibilitate la peniciline, fie mediate celular(38,141), fie IgE‑mediate(136-140), toţi participanţii având rezultate negative la testele cutanate la aztreonam şi carbapeneme, le-au tolerat şi la testul de provocare.
Administrarea de peniciline, aztreonam, carbapeneme şi cefalosporine alternative la pacienţii cu alergie la cefalosporină
Într-un studiu cuprinzând 98 de subiecţi cu hipersensibilitate IgE‑mediată la cefalosporine(142), aproximativ 25% dintre subiecţi au avut teste alergologice pozitive la peniciline, 3% la aztreonam, 2% la imipenem/cilastatin şi 1% la meropenem. În acest studiu(142), toţi subiecţii care au prezentat atât IgE specifice, cât şi TC negative la aceste BL alternative le-au tolerat, cu excepţia unui singur pacient care a reacţionat la imipenem/cilastatin.
Un alt studiu(143), efectuat pe 102 adulţi cu o astfel de hipersensibilitate, a identificat trei grupuri de cefalosporine: grupul A, cuprinzând cele cu o grupă metoxi-imino în lanţurile lor laterale R1 (adică cefuroximă, ceftriaxonă, cefotaximă, cefodizimă şi cefepimă), plus ceftazidim; grupul B, compus din aminocefalosporine, şi grupul C, care include cefalosporine, altele decât cele aparţinând grupurilor A şi B. Acest studiu(143) a demonstrat utilitatea luării în considerare a lanţurilor/catenelor laterale la selectarea unor cefalosporine alternative la pacienţii alergici la o cefalosporină. De fapt, toate cele 323 de provocări cu cefalosporine alternative la care TC au fost negative au fost bine tolerate.
În general, datele din literatură indică faptul că reactivitatea încrucişată legată de inelul betalactamic comun, care implică teste alergice pozitive la toate BL, este foarte rară la pacienţii cu hipersensibilitate IgE‑mediată şi este absentă la cei cu hipersensibilitate mediată prin celule T(15). Mai frecvent, reactivitatea încrucişată între betalactamine este legată de structurile identice sau similare ale lanţurilor laterale(15,16). În acest sens, cefalosporinele cu lanţ lateral R1 similar sau identic reacţionează mai frecvent încrucişat decât cele cu inelul betalactamic identic(15,16,144). Totuşi, unele studii privind reactivitatea încrucişată între BL au găsit modele de pozitivare a testelor alergologice care nu pot fi explicate nici prin prezenţa inelului comun BL şi nici prin prezenţa lanţului lateral similar sau identic(129,132-134,142,143), indicând posibilitatea coexistenţei sensibilizării la betalactamine diferite prin expunere anterioară. Din această cauză este recomandată TC profilactică utilizând BL implicată, înainte de administrarea acesteia prin test de provocare cu doze progresive la pacientul alergic la BL care necesită o alternativă BL (înalt/puternic). În testul de provocare cu doze progresive, uzual, se începe cu 1/10 din DUM. La pacienţii cu rezultate negative se administrează DUM după o oră.
Dacă nu este posibilă efectuarea unei evaluări alergologice complete, la pacientul cu istoric de reacţii imediate la peniciline şi cu necesitatea administrării de cefalosporine sau altă betalactamină, se efectuează teste cutanate cu cefalosporine (sau carbapeneme, sau aztreonam) care au lanţ lateral diferit de penicilina incriminată şi, în caz de rezultate negative, se efectuează testul de provocare cu doze progresive la betalactamina alternativă (înalt/puternic). O abordare similară poate fi aleasă la pacienţii cu istoric de alergie la cefalosporine care necesită o altă betalactamină, inclusiv altă cefalosporină. La pacienţii cu risc scăzut, cu reacţii uşoare nonimediate la betalactamine, care necesită administrarea unei alte betalactamine, dacă nu este timp suficient pentru efectuarea TC înainte de administrare, se indică administrarea sub strictă supraveghere a unei doze unice totale a unei betalactamine cu structură diferită.
Concluzii
Acest document oferă o actualizare a ghidurilor anterioare ale EAACI DAIG pentru diagnosticul hipersensibilităţii la BL(31), care priveşte disponibilitatea reactivilor şi concentraţiile acestora pentru TC, protocolul de TC şi al TPM, precum şi al algoritmilor de diagnostic şi de administrare a unei BL alternative la pacienţii cu hipersensibilitate la betalactamine. În ceea ce priveşte DPM, luând în considerare datele din literatura din ultima decadă şi rezultatele studiilor recente ale EAACI DAIG, care au documentat excepţiile de la recomandările DAIG şi susţin necesitatea standardizării lor, autorii au încercat să rezolve aceste necesităţi. Oricum, sunt necesare studii ulterioare care să ofere date privind standardizarea protocoalelor TPM, în special în cazurile reacţiilor nonimediate, pentru care nu există un consens.
Spre deosebire de ghidurile anterioare(31), acest articol introduce stratificarea riscului în cazurile de hipersensibilitate la BL în acord cu tipul de reacţie iniţială, precum şi un model algoritmic de abordare, bazat pe studiile de reactivitate încrucişată, la pacienţii cu suspiciune de hipersensibilitate la betalactamine şi necesitate imediată de administrare a unui antibiotic, când adresabilitatea către un medic alergolog nu e posibilă.
În privinţa evaluării alergologice, principala noutate a acestui articol este faptul că în unele reacţii nonimediate cu risc mic TC nu sunt obligatorii, în special la copii. În general, un TC pozitiv sau teste in vitro pozitive permit alergologului să stabilească diagnosticul de hipersensibilitate la BL (chiar cu un risc mic de reacţii fals pozitive), pe când un test negativ are o valoare limitată în predicţia riscului pentru reacţiile viitoare. În acest caz, este indicat ca evaluarea alergologică să fie completată cu teste de provocare, dacă nu sunt contraindicate.
Mulţumiri. Îi mulţumim profesorului Massimo Castagnola (Instituto di Biochimica e Biochimica Clinica, Università Cattolica del Sacro Cuore, Roma) pentru ajutorul său valoros privind similarităţile structurale între betalactamine.
Bibliografie
- Versporten A, Coenen S, Adriaenssens N, et al. European Surveillance of Antimicrobial Consumption (ESAC): outpatient penicillin use in Europe (1997-2009). J Antimicrob Chemother. 2011;66 Suppl 6:vi13-23.
- Macy E, Contreras R. Healthcare utilization and serious infection prevalence associated with penicillin “allergy” in hospitalized patients: a cohort study. J Allergy Clin Immunol. 2014;133:790-796.
- Sacco KA, Bates A, Brigham TJ, Imam JS, Burton MC. Clinical outcomes following inpatient penicillin allergy testing: A systematic review and meta-analysis. Allergy. 2017;72:1288-1296.
- Versporten A, Coenen S, Adriaenssens N, et al. European Surveillance of Antimicrobial Consumption (ESAC): outpatient cephalosporin use in Europe (1997-2009). J Antimicrob Chemother. 2011;66 Suppl 6:vi25-35.
- Torres MJ, Celik G, Whitaker P, et al. A EAACI Drug Allergy Interest Group survey on how European allergy specialists deal with β-lactam allergy: heterogeneity in practice. Allergy. 2019;74:1052-1062.
- Penicillin Allergy in Antibiotic Resistance Workgroup. Penicillin Allergy Testing Should Be Performed Routinely in Patients with Self-Reported Penicillin Allergy. J Allergy Clin Immunol Pract. 2017;5333-5334.
- Tanno LK, Torres MJ, Castells M, Demoly P; Joint Allergy Academies. What can we learn in drug allergy management from World Health Organization’s international classifications? Allergy. 2018;73:987-792.
- Aberer W, Macy E. Moving Toward Optimizing Testing for Penicillin Allergy. J Allergy Clin Immunol Pract. 2017;5:684-685.
- Atkins D, Best D, Briss PA, et al. Grading quality of evidence and strength of recommendations. BMJ. 2004;328:1490-1494.
- Brockow K, Ardern-Jones MR, Mockenhaupt M, et al. EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity. Allergy. 2019;74:14-27.
- Demoly P, Adkinson NF, Brockow K, et al. International Consensus on drug allergy. Allergy. 2014;69:420-437.
- Blumenthal KG, Peter JG, Trubiano JA, Phillips EJ. Antibiotic allergy. Lancet. 2019;393:183-198.
- Pichler WJ. Immune Pathomechanism and Classification of Drug Hypersensitivity. Allergy. 2019;74:1457-1471.
- Trautmann A, Benoit S, Goebeler M, Stoevesandt J. “Treating Through“ Decision and Follow-up in Antibiotic Therapy-Associated Exanthemas. J Allergy Clin Immunol Pract. 2017;5:1650-1656.
- Romano A, Gaeta F, Arribas Poves MF, Valluzzi RL. Cross-Reactivity among Beta-Lactams. Curr Allergy Asthma Rep. 2016;16:24.
- Zagursky RJ, Pichichero ME. Cross-reactivity in β-Lactam Allergy. J Allergy Clin Immunol Pract. 2018;6:72-81.e1.
- Hierro SB, Mateos CJ, Cabero Morán MT, Mirón‑Canelo JA, Armentia MA. A Predictive Model for the Diagnosis of Allergic Drug Reactions According to the Medical History.
- J Allergy Clin Immunol Pract. 2016;4:292-300.e3.
- Soria A, Autegarden E, Amsler E, et al. A clinical decision-making algorithm for penicillin allergy. Ann Med. 2017;49:710-717.
- Chiriac AM, Wang Y, Schrijvers R, et al. Designing Predictive Models for Beta-Lactam Allergy Using the Drug Allergy and Hypersensitivity Database. J Allergy Clin Immunol Pract. 2018;6:139-148.e2.
- Mayorga C, Celik G, Rouzaire P, et al. In vitro tests for drug hypersensitivity reactions: an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2016;71:1103-1134.
- Brockow K, Romano A, Blanca M, Ring J, Pichler W, Demoly P. General considerations for skin test procedures in the diagnosis of drug hypersensitivity. Allergy. 2002;57:45-51.
- Torres MJ, Blanca M, Fernandez J, et al. Diagnosis of immediate allergic reactions to beta-lactam antibiotics. Allergy. 2003;58:961-972.
- Barbaud A, Gonçalo M, Bruynzeel D, Bircher A. Guidelines for performing skin tests with drugs in the investigation of cutaneous adverse drug reactions. Contact Dermatitis. 2001;45:321-328.
- Barbaud A, Collet E, Milpied B, et al. A multicenter study to determine the value and safety of drug patch tests for the three main classes of severe cutaneous adverse drug reactions. Br J Dermatol. 2013;168:555-562.
- Barbaud A. Skin testing and patch testing in non-IgE-mediated drug allergy. Curr Allergy Asthma Rep. 2014;14:442-448.
- Brockow K, Garvey LH, Aberer W, et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2013;68:702-712.
- Torres MJ, Romano A, Celik G, et al. Approach to the diagnosis of drug hypersensitivity reactions: similarities and differences between Europe and North America. Clin Transl Allergy. 2017;7:7.
- Romano A, Gaeta F, Valluzzi RL, Caruso C, Rumi G, Bousquet PJ. The very limited usefulness of skin testing with penicilloylpolylysine and the minor determinant mixture in evaluating nonimmediate reactions to penicillins. Allergy. 2010;65:1104-1107.
- Romano A, Gaeta F, Valluzzi RL, et al. Diagnosing nonimmediate reactions to cephalosporins. J Allergy Clin Immunol. 2012;129:1166-1169.
- Romano A, Blanca M, Torres MJ, et al. Diagnosis of nonimmediate reactions to betalactam antibiotics. Allergy. 2004;59:1153-1160.
- Blanca M, Romano A, Torres MJ, et al. Update on the evaluation of hypersensitivity reactions to betalactams. Allergy. 2009;64:183-193.
- Torres MJ, Sánchez-Sabaté E, Alvarez J, et al. Skin test evaluation in nonimmediate allergic reactions to penicillins. Allergy. 2004;59:219-224.
- Brajon D, Menetre S, Waton J, Poreaux C, Barbaud A. Non-irritant concentrations and amounts of active ingredient in drug patch tests. Contact Dermatitis. 2014;71:170-175.
- Assier H, Valeyrie-Allanore L, Gener G, Verlinde Carvalh M, Chosidow O, Wolkenstein P. Patch testing in non-immediate cutaneous adverse drug reactions: value of extemporaneous patch tests. Contact Dermatitis. 2017;77:297-302.
- Solensky R, Khan DA, Bernstein IL, et al. Drug allergy: an updated practice parameter. Ann Allergy Asthma Immunol. 2010;105:259-273.
- Co Minh HB, Bousquet PJ, Fontaine C, Kvedariene V, Demoly P. Systemic reactions during skin tests with beta-lactams: a risk factor analysis. J Allergy Clin Immunol. 2006;117:466-468.
- Gastaminza G, Audicana MT, Fernandez E, Anda M, Ansotegui IJ. Palmar exfoliative exanthema to amoxicillin. Allergy. 2000;55:510-511.
- Romano A, Gaeta F, Valluzzi RL, Maggioletti M, Caruso C, Quaratino D. Cross-reactivity and tolerability of aztreonam and cephalosporins in subjects with a T cell-mediated hypersensitivity to penicillins. J Allergy Clin Immunol. 2016;138:179-186.
- Ebo DG, Leysen J, Mayorga C, Rozieres A, Knol EF, Terreehorst I. The in vitro diagnosis of drug allergy: status and perspectives. Allergy. 2011;66:1275-1286.
- Ariza A, Montanez MI, Fernandez TD, Perkins JR, Mayorga C. Cellular Tests for the Evaluation of Drug Hypersensitivity. Curr Pharm Des. 2016;22:6773-6783.
- Mayorga C, Dona I, Perez-Inestrosa E, Fernandez TD, Torres MJ. The Value of In Vitro Tests to Diminish Drug Challenges. Int J Mol Sci. 2017;18.
- Blanca M, Mayorga C, Torres MJ, et al. Clinical evaluation of Pharmacia CAP System RAST FEIA amoxicilloyl and benzylpenicilloyl in patients with penicillin allergy. Allergy. 2001;56:862-870.
- Torres MJ, Romano A, Mayorga C, et al. Diagnostic evaluation of a large group of patients with immediate allergy to penicillins: the role of skin testing. Allergy. 2001;56:850-856.
- Torres MJ, Mayorga C, Cornejo-García JA, Romano A, Blanca M. IgE antibodies to penicillin in skin test negative patients. Allergy. 2002;57:965.
- Torres MJ, Padial A, Mayorga C, et al. The diagnostic interpretation of basophil activation test in immediate allergic reactions to betalactams. Clin Exp Allergy. 2004;34:1768-1775.
- Romano A, Guéant-Rodriguez RM, Viola M, et al. Diagnosing immediate reactions to cephalosporins. Clin Exp Allergy. 2005;35:1234-1242.
- Antunez C, Blanca-Lopez N, Torres MJ, et al. Immediate allergic reactions to cephalosporins: evaluation of cross-reactivity with a panel of penicillins and cephalosporins. J Allergy Clin Immunol. 2006;117:404-410.
- Fernandez TD, Torres MJ, Blanca-Lopez N, et al. Negativization rates of IgE radioimmunoassay and basophil activation test in immediate reactions to penicillins. Allergy. 2009;64:242-248.
- Salas M, Fernández-Santamaría R, Mayorga C, et al. Use of the Basophil Activation Test May Reduce the Need for Drug Provocation in Amoxicillin-Clavulanic Allergy. J Allergy Clin Immunol Pract. 2018;6:1010-1018.e2.
- Sanz ML, Gamboa PM, Antepara I, et al. Flow cytometric basophil activation test by detection of CD63 expression in patients with immediate-type reactions to betalactam antibiotics. Clin Exp Allergy. 2002;32:277-286.
- Fontaine C, Mayorga C, Bousquet PJ, et al. Relevance of the determination of serumspecific IgE antibodies in the diagnosis of immediate beta-lactam allergy. Allergy. 2007;62:47-52.
- Vultaggio A, Virgili G, Gaeta F, Romano A, Maggi E, Matucci A. High serum beta-lactams specific/total IgE ratio is associated with immediate reactions to beta-lactams antibiotics. PLoS One. 2015;10:e0121857.
- Macy E, Goldberg B, Poon KY. Use of commercial anti-penicillin IgE fluorometric enzyme immunoassays to diagnose penicillin allergy. Ann Allergy Asthma Immunol. 2010;105:136-141.
- Johansson SG, Adédoyin J, van Hage M, Grönneberg R, Nopp A. False-positive penicillin immunoassay: an unnoticed common problem. J Allergy Clin Immunol. 2013;132:235-237.
- De Week AL, Sanz ML, Gamboa PM, et al. Diagnosis of immediate-type beta-lactam allergy in vitro by flow-cytometric basophil activation test and sulfidoleukotriene production: a multicenter study. J Investig Allergol Clin Immunol. 2009;19:91-109.
- Gamboa PM, Garcia-Aviles MC, Urrutia I, Antepara I, Esparza R, Sanz ML. Basophil activation and sulfidoleukotriene production in patients with immediate allergy to betalactam antibiotics and negative skin tests. J Investig Allergol Clin Immunol. 2004;14:278-283.
- Longo N, Gamboa PM, Gastaminza G, et al. Diagnosis of clavulanic acid allergy using basophil activation and leukotriene release by basophils. J Investig Allergol Clin Immunol. 2008;18:473-475.
- Torres MJ, Ariza A, Mayorga C, et al. Clavulanic acid can be the component in amoxicillin-clavulanic acid responsible for immediate hypersensitivity reactions. J Allergy Clin Immunol. 2010;125:502-505.e2.
- Barbero N, Fernández-Santamaría R, Mayorga C, et al. Identification of an Antigenic Determinant of Clavulanic Acid Responsible for IgE-mediated Reactions. Allergy. 2019;74:1490-1501.
- Uyttebroek AP, Sabato V, Cop N, et al. Diagnosing cefazolin hypersensitivity: Lessons from dual-labeling flow cytometry. J Allergy Clin Immunol Pract. 2016;4:1243-1245.
- Kepley CL, Youssef L, Andrews RP, Wilson BS, Oliver JM. Syk deficiency in nonreleaser basophils. J Allergy Clin Immunol. 1999;104(2 Pt 1):279-284.
- Lavens-Phillips SE, MacGlashan DW Jr. The tyrosine kinases p53/56lyn and p72syk are differentially expressed at the protein level but not at the messenger RNA level in nonreleasing human basophils. Am J Respir Cell Mol Biol. 2000;23:566-571.
- Luque I, Leyva L, José Torres M, et al. In vitro T-cell responses to beta-lactam drugs in immediate and nonimmediate allergic reactions. Allergy. 2001;56:611-618.
- Rozieres A, Hennino A, Rodet K, et al. Detection and quantification of drug-specific T cells in penicillin allergy. Allergy. 2009;64:534-542.
- Perkins JR, Ariza A, Blanca M, Fernandez TD. Tests for evaluating non-immediate allergic drug reactions. Expert Rev Clin Immunol. 2014;10:1475-1486.
- Pichler WJ, Tilch J. The lymphocyte transformation test in the diagnosis of drug hypersensitivity. Allergy. 2004;59:809-820.
- Aberer W, Bircher A, Romano A, et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions: general considerations. Allergy. 2003;58:854-863.
- Mirakian R, Leech SC, Krishna MT, et al. Management of allergy to penicillins and other beta-lactams. Clin Exp Allergy. 2015;45:300-327.
- Chambel M, Martins P, Silva I, Palma-Carlos S, Romeira AM, Leiria Pinto P. Drug provocation tests to betalactam antibiotics: experience in a paediatric setting. Allergol Immunopathol (Madr). 2010;38:300-306.
- Ponvert C, Perrin Y, Bados-Albiero A, et al. Allergy to betalactam antibiotics in children: results of a 20-year study based on clinical history, skin and challenge tests. Pediatr Allergy Immunol. 2011;22:411-418.
- Zambonino MA, Corzo JL, Munoz C, et al. Diagnostic evaluation of hypersensitivity reactions to beta-lactam antibiotics in a large population of children. Pediatr Allergy Immunol. 2014;25:80-87.
- Misirlioglu ED, Toyran M, Capanoglu M, Kaya A, Civelek E, Kocabas CN. Negative predictive value of drug provocation tests in children. Pediatr Allergy Immunol. 2014;25:685-690.
- Picard M, Paradis L, Bégin P, Paradis J, Des Roches A. Skin testing only with penicillin G in children with a history of penicillin allergy. Ann Allergy Asthma Immunol. 2014;113:75-81.
- Fox SJ, Park MA. Penicillin skin testing is a safe and effective tool for evaluating penicillin allergy in the pediatric population. J Allergy Clin Immunol Pract. 2014;2:439-444.
- Mori F, Cianferoni A, Barni S, Pucci N, Rossi ME, Novembre E. Amoxicillin allergy in children: five-day drug provocation test in the diagnosis of nonimmediate reactions.
- J Allergy Clin Immunol Pract. 2015;3:375-380.e371.
- Barni S, Mori F, Sarti L, et al. Utility of skin testing in children with a history of nonimmediate reactions to amoxicillin. Clin Exp Allergy. 2015;45:1472-1474.
- Caubet JC, Frossard C, Fellay B, Eigenmann PA. Skin tests and in vitro allergy tests have a poor diagnostic value for benign skin rashes due to beta-lactams in children. Pediatr Allergy Immunol. 2015;26:80-82.
- Atanaskovic-Markovic M, Gaeta F, Medjo B, et al. Non-immediate hypersensitivity reactions to beta-lactam antibiotics in children - our 10-year experience in allergy work-up. Pediatr Allergy Immunol. 2016;27:533-538.
- Vezir E, Dibek Misirlioglu E, Civelek E, et al. Direct oral provocation tests in nonimmediate mild cutaneous reactions related to beta-lactam antibiotics. Pediatr Allergy Immunol. 2016;27:50-54.
- Mill C, Primeau MN, Medoff E, et al. Assessing the Diagnostic Properties of a Graded Oral Provocation Challenge for the Diagnosis of Immediate and Nonimmediate Reactions to Amoxicillin in Children. JAMA Pediatr. 2016;170:e160033.
- Manuyakorn W, Singvijarn P, Benjaponpitak S, et al. Skin testing with β-lactam antibiotics for diagnosis of β-lactam hypersensitivity in children. Asian Pac J Allergy Immunol. 2016;34:242-247.
- Lezmi G, Alrowaishdi F, Bados-Albiero A, Scheinmann P, de Blic J, Ponvert C. Nonimmediate-reading skin tests and prolonged challenges in non-immediate hypersensitivity to beta-lactams in children. Pediatr Allergy Immunol. 2018;29:84-89.
- Labrosse R, Paradis L, Lacombe-Barrios J, et al. Efficacy and Safety of 5-Day Challenge for the Evaluation of Nonsevere Amoxicillin Allergy in Children. J Allergy Clin Immunol Pract. 2018;6:1673-1680.
- Tonson la Tour A, Michelet M, Eigenmann PA, Caubet JC. Natural History of Benign Nonimmediate Allergy to Beta-Lactams in Children: A Prospective Study in Retreated Patients After a Positive and a Negative Provocation Test. J Allergy Clin Immunol Pract. 2018;6:1321-1326.
- Ibáñez MD, Rodríguez Del Río P, Lasa EM, et al. Prospective assessment of diagnostic tests for pediatric penicillin allergy: From clinical history to challenge tests. Ann Allergy Asthma Immunol. 2018;121:235-244.e3.
- Vila L, Garcia V, Martinez Azcona O, Pineiro L, Meijide A, Balboa V. Mild to moderate hypersensitivity reactions to beta-lactams in children: a single-centre retrospective review. BMJ Paediatrics Open. 2019;3:e000435.
- Holm A, Mosbech H. Challenge Test Results in Patients With Suspected Penicillin Allergy, but No Specific IgE. Allergy Asthma Immunol Res. 2011;3:118-122.
- Hjortlund J, Mortz CG, Skov PS, et al. One-week oral challenge with penicillin in diagnosis of penicillin allergy. Acta Derm Venereol. 2012;92:307-312.
- Rimawi RH, Cook PP, Gooch M, et al. The impact of penicillin skin testing on clinical practice and antimicrobial stewardship. J Hosp Med. 2013;8:341-345.
- Hjortlund J, Mortz CG, Skov PS, Bindslev-Jensen C. Diagnosis of penicillin allergy revisited: the value of case history, skin testing, specific IgE and prolonged challenge. Allergy. 2013;68:1057-1064.
- Blanca-Lopez N, Perez-Alzate D, Ruano F, et al. Selective immediate responders to amoxicillin and clavulanic acid tolerate penicillin derivative administration after confirming the diagnosis. Allergy. 2015;70:1013-1019.
- Bourke J, Pavlos R, James I, Phillips E. Improving the Effectiveness of Penicillin Allergy De-labeling. J Allergy Clin Immunol Pract. 2015;3:365-374.e1.
- Rosenfield L, Kalicinsky C, Warrington R. A retrospective comparison of false negative skin test rates in penicillin allergy, using pencilloyl-poly-lysine and minor determinants or Penicillin G, followed by open challenge. Allergy Asthma Clin Immunol. 2015;11:34.
- Moreno E, Laffond E, Muñoz-Bellido F, et al. Performance in real life of the European Network on Drug Allergy algorithm in immediate reactions to beta-lactam antibiotics. Allergy. 2016;71:1787-1790.
- Fransson S, Mosbech H, Kappel M, et al. The Importance of Prolonged Provocation in Drug Allergy - Results From a Danish Allergy Clinic. J Allergy Clin Immunol Pract. 2017;5:1394-1401.
- Mawhirt SL, Fonacier LS, Calixte R, Davis-Lorton M, Aquino MR. Skin testing and drug challenge outcomes in antibiotic-allergic patients with immediate-type hypersensitivity. Ann Allergy Asthma Immunol. 2017;118:73-79.
- Chen JR, Tarver SA, Alvarez KS, Tran T, Khan DA. A Proactive Approach to Penicillin Allergy Testing in Hospitalized Patients. J Allergy Clin Immunol Pract. 2017;5:686-693.
- Tucker MH, Lomas CM, Ramchandar N, Waldram JD. Amoxicillin challenge without penicillin skin testing in evaluation of penicillin allergy in a cohort of Marine recruits.
- J Allergy Clin Immunol Pract. 2017;5:813-815.
- Mohamed OE, Beck S, Huissoon A, et al. A Retrospective Critical Analysis and Risk Stratification of Penicillin Allergy De-labelling in a UK Specialist Regional Allergy Service. J Allergy Clin Immunol Pract. 2019;7:251-258.
- García Núñez I, Barasona Villarejo MJ, Algaba Mármol MA, Moreno Aguilar C, Guerra Pasadas F. Diagnosis of patients with immediate hypersensitivity to beta-lactams using retest. J Investig Allergol Clin Immunol. 2012;22:41-47.
- Iglesias-Souto J, González R, Poza P, Sanchez-Machín I, Matheu V. Evaluating the usefulness of retesting for beta-lactam allergy in children. Pediatr Infect Dis J. 2012;31:1091-1093.
- Rubio M, Bousquet PJ, Gomes E, Romano A, Demoly P. Results of drug hypersensitivity evaluations in a large group of children and adults. Clin Exp Allergy. 2012;42:123-130.
- Macy E, Ngor EW. Safely diagnosing clinically significant penicillin allergy using only penicilloyl-poly-lysine, penicillin, and oral amoxicillin. J Allergy Clin Immunol Pract. 2013;1:258-263.
- Mota I, Gaspar Â, Chambel M, Piedade S, Morais-Almeida M. Hypersensitivity to betalactam antibiotics: a three-year study. Eur Ann Allergy Clin Immunol. 2016;48:212-219.
- Confino-Cohen R, Rosman Y, Meir-Shafrir K, et al. Oral Challenge without Skin Testing Safely Excludes Clinically Significant Delayed-Onset Penicillin Hypersensitivity. J Allergy Clin Immunol Pract. 2017;5:669-675.
- Chiriac AM, Rerkpattanapipat T, Bousquet PJ, Molinari N, Demoly P. Optimal step doses for drug provocation tests to prove beta-lactam hypersensitivity. Allergy. 2017;72:552-561.
- Ramsey A, Mustafa SS. A penicillin skin testing initiative in an outpatient allergy office.
- J Allergy Clin Immunol Pract. 2018;6:1756-1757.
- Iammatteo M, Alvarez Arango S, Ferastraoaru D, et al. Safety and Outcomes of Oral Graded Challenges to Amoxicillin without Prior Skin Testing. J Allergy Clin Immunol Pract. 2019;7:236-243.
- Lachover-Roth I, Sharon S, Rosman Y, Meir-Shafrir K, Confino-Cohen R. Long-Term Follow-Up After Penicillin Allergy Delabeling in Ambulatory Patients. J Allergy Clin Immunol Pract. 2019;7:231-235.e1.
- Moral L, Garde J, Toral T, Fuentes MJ, Marco N. Short protocol for the study of paediatric patients with suspected betalactam antibiotic hypersensitivity and low risk criteria. Allergol Immunopathol (Madr). 2011;39:337-341.
- García Rodríguez R, Moreno Lozano L, Extremera Ortega A, Borja Segade J, Galindo Bonilla P, Gómez Torrijos E. Provocation Tests in Nonimmediate Hypersensitivity Reactions to β-Lactam Antibiotics in Children: Are Extended Challenges Needed?
- J Allergy Clin Immunol Pract. 2019;7:265-269.
- Caubet JC, Kaiser L, Lemaitre B, Fellay B, Gervaix A, Eigenmann PA. The role of penicillin in benign skin rashes in childhood: a prospective study based on drug rechallenge.
- J Allergy Clin Immunol. 2011;127:218-222.
- Mattheij M, de Vries E. A suspicion of antibiotic allergy in children is often incorrect.
- J Allergy Clin Immunol. 2012;129:583; author reply 583-584.
- Marrs T, Fox AT, Lack G, du Toit G. The diagnosis and management of antibiotic allergy in children: Systematic review to inform a contemporary approach. Arch Dis Child. 2015;100:583-588.
- Moral L, Caubet JC. Oral challenge without skin tests in children with non-severe betalactam hypersensitivity: Time to change the paradigm? Pediatr Allergy Immunol. 2017;28:724-727.
- Kuruvilla M, Thomas J. Direct oral amoxicillin challenge without antecedent penicillin skin testing in low-risk patients. Ann Allergy Asthma Immunol. 2018;121:627-628.
- Gomes ER, Brockow K, Kuyucu S, et al. Drug hypersensitivity in children: report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy. 2016;71:149-161.
- Chiriac AM, Romano A, Ben Fadhel N, et al. Follow-up of patients with negative drug provocation tests to betalactams. Clin Exp Allergy. 2019;49:729-732.
- Ponvert C, Weilenmann C, Wassenberg J, et al. Allergy to betalactam antibiotics in children: a prospective follow-up study in retreated children after negative responses in skin and challenge tests. Allergy. 2007;62:42-46.
- Demoly P, Romano A, Botelho C, et al. Determining the negative predictive value of provocation tests with beta-lactams. Allergy. 2010;65:327-332.
- Waton J, Pouget-Jasson C, Loos-Ayav C, et al. Drug re-challenges in cutaneous adverse drug reactions: information and effectiveness in the long-term management of patients. Allergy. 2011;66:941-947.
- Ratzon R, Reshef A, Efrati O, et al. Impact of an extended challenge on the effectiveness of beta-lactam hypersensitivity investigation. Ann Allergy Asthma Immunol. 2016;116:329-333.
- Blanca M, Torres MJ, García JJ, et al. Natural evolution of skin test sensitivity in patients allergic to beta-lactam antibiotics. J Allergy Clin Immunol. 1999;103:918-924.
- Romano A, Gaeta F, Valluzzi RL, Zaffiro A, Caruso C, Quaratino D. Natural evolution of skin-test sensitivity in patients with IgE-mediated hypersensitivity to cephalosporins. Allergy. 2014;69:806-809.
- Lopez-Serrano MC, Caballero MT, Barranco P, Martinez-Alzamora F. Booster responses in the study of allergic reactions to beta-lactam antibiotics. J Investig Allergol Clin Immunol. 1996;6:30-35.
- Matheu V, Perez-Rodriguez E, Sanchez-Machin I, Garcia-Robaina JC, de la Torre Morin F. Importance of repeat testing in the diagnosis of penicillin allergy. Br J Dermatol. 2006;154:198.
- Hershkovich J, Broides A, Kirjner L, Smith H, Gorodischer R. Beta lactam allergy and resensitization in children with suspected beta lactam allergy. Clin Exp Allergy. 2009;39:726-730.
- Torres MJ, Adkinson NF Jr, Caubet JC, et al. Controversies in Drug Allergy: Beta-Lactam Hypersensitivity Testing. J Allergy Clin Immunol Pract. 2019;7:40-45.
- Trcka J, Seitz CS, Brocker EB, Gross GE, Trautmann A. Aminopenicillin-induced exanthema allows treatment with certain cephalosporins or phenoxymethyl penicillin. J Antimicrob Chemother. 2007;60:107-111.
- Audicana M, Bernaola G, Urrutia I, et al. Allergic reactions to betalactams: studies in a group of patients allergic to penicillin and evaluation of cross-reactivity with cephalosporin. Allergy. 1994;49:108-113.
- Novalbos A, Sastre J, Cuesta J, et al. Lack of allergic cross-reactivity to cephalosporins among patients allergic to penicillins. Clin Exp Allergy. 2001;31:438-443.
- Romano A, Gueant-Rodriguez RM, Viola M, Pettinato R, Gueant JL. Cross-reactivity and tolerability of cephalosporins in patients with immediate hypersensitivity to penicillins. Ann Intern Med. 2004;141:16-22.
- Caimmi S, Galera C, Bousquet-Rouanet L, Arnoux B, Demoly P, Bousquet PJ. Safety of cefuroxime as an alternative in patients with a proven hypersensitivity to penicillins: a DAHD cohort survey. Int Arch Allergy Immunol. 2010;153:53-60.
- Romano A, Valluzzi RL, Caruso C, Maggioletti M, Quaratino D, Gaeta F. Cross- Reactivity and Tolerability of Cephalosporins in Patients with IgE-Mediated Hypersensitivity to Penicillins. J Allergy Clin Immunol Pract. 2018;5:1662-1672.
- Phillips E, Knowles SR, Weber EA, Blackburn D. Cephalexin tolerated despite delayed aminopenicillin reactions. Allergy. 2001;56:790.
- Romano A, Viola M, Guéant-Rodriguez RM, Gaeta F, Pettinato R, Guéant JL. Imipenem in patients with immediate hypersensitivity to penicillins. N Engl J Med. 2006;354:2835-2837.
- Romano A, Viola M, Guéant-Rodriguez RM, Gaeta F, Valluzzi R, Guéant JL. Brief communication: tolerability of meropenem in patients with IgE-mediated hypersensitivity to penicillins. Ann Intern Med. 2007;146:266-269.
- Atanaskovic-Markovic M, Gaeta F, Medjo B, Viola M, Nestorovic B, Romano A. Tolerability of meropenem in children with IgE-mediated hypersensitivity to penicillins. Allergy. 2008; 63:237-240.
- Atanaskovic-Markovic M, Gaeta F, Gavrovic-Jankulovic M, Velickovic TC, Valluzzi RL, Romano A. Tolerability of imipenem in children with IgE-mediated hypersensitivity to penicillins. J Allergy Clin Immunol. 2009;124:167-169.
- Gaeta F, Valluzzi RL, Alonzi C, Maggioletti M, Caruso C, Romano A. Tolerability of aztreonam and carbapenems in patients with IgE-mediated hypersensitivity to penicillins. J Allergy Clin Immunol. 2015;135:972-976.
- Romano A, Gaeta F, Valluzzi RL, et al. Absence of cross-reactivity to carbapenems in patients with delayed hypersensitivity to penicillins. Allergy. 2013;68:1618-1621.
- Romano A, Gaeta F, Valluzzi RL, Caruso C, Rumi G, Bousquet PJ. IgE-mediated hypersensitivity to cephalosporins: cross-reactivity and tolerability of penicillins, monobactams, and carbapenems. J Allergy Clin Immunol. 2010;126:994-999.
- Romano A, Gaeta F, Valluzzi RL, et al. IgE-mediated hypersensitivity to cephalosporins: Cross-reactivity and tolerability of alternative cephalosporins. J Allergy Clin Immunol. 2015;136:685-691.e3.
- Yang MS, Kang DY, Seo B, et al. Incidence of cephalosporin-induced anaphylaxis and clinical efficacy of screening intradermal tests with cephalosporins: A large multicenter retrospective cohort study. Allergy. 2018;73:1833-1841
Articole din ediţiile anterioare
Sindromul pasăre-ou
Sindromul pasăre-ou este o tulburare de hipersensibilitate IgE-mediată, care implică manifestări alergice la un individ care consumă gălbenuş, după...
Diagnosticul reacţiilor de hipersensibilitate la antibiotice non-betalactamice la copii
Odată cu creşterea utilizării antibioticelor non-betalactamice (ANBL), creşte şi frecvenţa reacţiilor alergice la acest grup de medicamente. Datele...
Alergia la veninul de himenoptere – date generale şi studii de caz
Alergia la veninul de himenoptere reprezintă o afecţiune severă, potenţial ameninţătoare de viaţă.
Alergenele recombinate – metode de producere şi utilitatea în diagnosticul molecular şi în imunoterapia alergenică
Extractele alergenice sunt folosite pe scară largă atât în diagnosticul in vivo, cât şi în terapia bolilor alergice, deşi prezintă multiple dezavan...