Alcohol use with drugs is quite common and is a difficult problem for the doctor and the patient. The interactions between ethanol and drug preparations may be pharmacokinetic and pharmacodynamic. Alcohol interactions with drugs in absorption, distribution, metabolism and elimination may result in changes in both the pharmacokinetics of drugs and ethanol, which will largely reflect on their pharmacological effects. The systematization and analysis of these interactions will help prevent unwanted consequences.
Interacţiunile farmacocinetice ale alcoolului etilic cu medicamentele
Pharmakonetic interactions of ethanol with drugs
First published: 24 mai 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.188.3.2019.2412
Abstract
Rezumat
Ingerarea alcoolului concomitent cu medicamentele este destul de frecventă şi constituie o problemă dificilă pentru medic şi pacient. Interacţiunile dintre etanol şi preparatele medicamentoase pot fi de ordin farmacocinetic şi farmacodinamic. Interacţiunile alcoolului etilic cu medicamentele la nivelul absorbţiei, distribuţiei, metabolismului şi eliminării se pot solda cu modificarea atât a farmacocineticii medicamentelor, cât şi a etanolului, care în mare parte se vor reflecta asupra efectelor farmacologice ale acestora. Sistematizarea şi analiza acestor interacţiuni vor permite prevenirea consecinţelor nedorite.
Consumul excesiv de alcool este o problemă globală de sănătate, cu consecinţe sociale, economice şi clinice. Utilizarea frecventă a alcoolului (etanolului) în asociere cu medicamentele, cu prescripţie sau fără prescripţie medicală, are o incidenţă periculoasă şi generează implicaţii clinice semnificative. Influenţa alcoolului asupra farmacocineticii medicamentelor, precum şi a preparatelor medicamentoase asupra farmacocineticii etanolului se poate constata atât la abuzul de alcool, cât şi la folosirea ocazională(10,11,20,25).
Absorbţia alcoolului din duoden şi jejun este mai rapidă decât din stomac, prin urmare viteza de golire gastrică este un factor determinant al ratei de absorbţie a alcoolului administrat oral. Pentru absorbţia alcoolului sunt caracteristice câteva particularităţi. Alcoolul traversează membranele biologice prin difuzie pasivă, după gradientul de concentraţie. Prin urmare, cu cât este mai mare concentraţia de alcool, cu atât mai mare este gradientul de concentraţie rezultat şi cu atât este mai amplă absorbţia. Îndepărtarea rapidă a alcoolului de la locul de absorbţie printr-un flux sangvin eficient va ajuta la menţinerea gradientului de concentraţie şi, prin urmare, va promova absorbţia. Alcoolul are proprietăţi iritante şi în concentraţii mari poate provoca eroziuni superficiale, hemoragii şi paralizii ale musculaturii netede ale stomacului, care vor reduce absorbţia alcoolului. Nivelurile maxime de alcool din sânge sunt mai mari dacă etanolul este ingerat ca o singură doză, decât în mai multe doze mai mici, probabil ca urmare a gradientului concentraţiei. Rata de absorbţie a aceleiaşi doze de alcool şi concentraţia de etanol din sânge nu sunt influenţate în mod semnificativ de tipul de băutură alcoolică consumată. Prezenţa alimentelor în stomac, inclusiv mesele bogate în grăsimi, carbohidraţi sau proteine, întârzie evacuarea gastrică şi, astfel, vor reduce absorbţia de alcool(11,14,15).
Concentraţia de alcool din sânge este determinată de cantitatea de alcool consumată, de prezenţa sau absenţa alimentelor în stomac, de factorii care influenţează golirea gastrică şi de rata de oxidare a alcoolului(3).
Interacţiunile dintre alcool şi medicamente la nivelul absorbţiei pot fi determinate de: modificarea solubilităţii preparatelor de către etanol; influenţarea evacuării stomacului de către alcool şi medicamente; intensitatea proceselor de metabolizare a alcoolului la nivelul stomacului; influenţa medicamentelor asupra activităţii alcooldehidrogenazei gastrice(3,8).
Etanolul poate creşte solubilitatea medicamentelor slab solubile în tractul gastrointestinal, fapt care poate determina o absorbţie mai rapidă şi mai eficientă, rezultând concentraţii variabile şi/sau mari de medicament în plasmă până la reacţii adverse la medicament (figura 1). În cadrul unui studiu s-a demonstrat creşterea solubilităţii cu mai mult de 7-25 de ori pentru compuşii neionizaţi (acid tofenamic, felodipină) în mediul gastric cu conţinut de 20% etanol. Pentru compuşii cu proprietăţi bazice slabe (cinarizină, dipiridamol, terfenadină), ionizaţi complet la pH-ul gastric, solubilitatea nu a fost afectată de etanol. Rata de absorbţie a compuşilor cu proprietăţi acide (indometacină) a crescut uşor, iar gradul de absorbţie nu a fost afectat, deoarece absorbţia acestor preparate a fost uşor de realizat şi fără etanol. Compuşii lipofilici neutri (griseofulvină, progesteron) au prezentat o creştere de 8-10 ori a solubilităţii la utilizarea cu 20% etanol. Aceste rezultate indică faptul că un consum concomitent de alcool poate creşte semnificativ solubilitatea şi, prin urmare, concentraţia plasmatică pentru compuşii neionizaţi, lipofili, cu posibilitatea dezvoltării reacţiilor adverse la medicament(8).

Evacuarea gastrică a unui medicament în intestinul subţire este controlată de activitatea motorie a stomacului şi este principalul factor care determină debutul absorbţiei. Rata de evacuare din stomac este în principal afectată de starea digestivă, proprietăţile formei farmaceutice şi de efectul medicamentelor, iar aceasta va determina variabilitatea ratei de absorbţie şi profilul farmacocinetic. Merită atenţie utilizarea etanolului cu un produs cu eliberare controlată pe cale orală, astfel încât mecanismul de control al eliberării medicamentului este afectat, cu majorarea dozei dizolvate în intestinul subţire şi absorbţia ulterioară cu concentraţii plasmatice periculoase. S-a constatat că utilizarea alcoolului până la 40% cu formele cu eliberare controlată a hidromorfonei a crescut concentraţia plasmatică maximă a opioidului de 16 ori, ca urmare a eliberării mai rapide a dozei integre. Astfel, este necesar de respectat un interval de timp de 2 ore între administrarea unui produs cu eliberare controlată cu consumul de băuturi cu concentraţii de etanol de până la 40%(15).
Unele medicamente precum cimetidina, ranitidina, H2-histaminoblocante şi metoclopramida, prokinetic dopaminoblocant periferic, au stimulat evacuarea gastrică a etanolului cu majorarea concentraţiei etanolului în sânge. În acelaşi timp, butilscopolamina, M-colinoblocant, prin întârzierea golirii stomacului, a crescut expunerea alcoolului la acţiunea alcooldehidrogenazei (ADH) gastrice şi a redus evacuarea etanolului în intestinul subţire cu diminuarea nivelului alcoolului în sânge(6,21).
Medicamentele eliberate fără prescripţie medicală (Over-The-Counter – OTC), inclusiv analgezicele-antipiretice, sunt frecvent folosite cu băuturile alcoolice precum berea sau vinul. Consumul de medicamente cu o băutură alcoolică poate creşte solubilitatea ingredientelor active în etanol. Concentraţia ibuprofenului în sânge a crescut uşor la administrarea cu 15% etanol, dar aceasta a fost scăzută când analgezicul a fost utilizat în asociere cu vin de orez. S-a subliniat faptul că băuturile alcoolice nu sunt soluţii cu etanol pur şi că băuturile alcoolice fermentate (berea şi vinul roşu) afectează golirea gastrică mai mult decât etanolul pur. Se consideră că presiunea osmotică este un factor important pentru întârzierea golirii stomacului. Băuturile alcoolice fermentate care conţin o cantitate mare de zahăr tind să menţină presiunea osmotică. Absorbţia ibuprofenului a fost inhibată de creşterea presiunii osmotice în tubul digestiv. Preparatele cu solubilitate crescută, cum ar fi ibuprofenul, sunt afectate de fluxul de apă la nivelul mucoasei intestinale. Absorbţia medicamentului este redusă prin diminuarea fluxului lichidului intestinal prin medii hipertonice(14).
Metabolizarea primară a alcoolului în stomac
Alcooldehidrogenaza (ADH) este o enzimă zinc-dependentă cu o specificitate largă a substratului, oxidând mulţi alcooli primari sau secundari. Enzima este implicată în oxidarea alcoolului endogen produs de microorganisme în intestin, a etanolului exogen şi altor alcooli consumaţi în dietă, precum şi în oxidarea substraturilor implicate în metabolismul steroizilor şi acizilor biliari. Cele mai mari cantităţi de ADH se disting în ficat, apoi în tractul gastrointestinal, în rinichi, mucoasa nazală, testicule şi în uter (tabelul 1)(3,5,26).
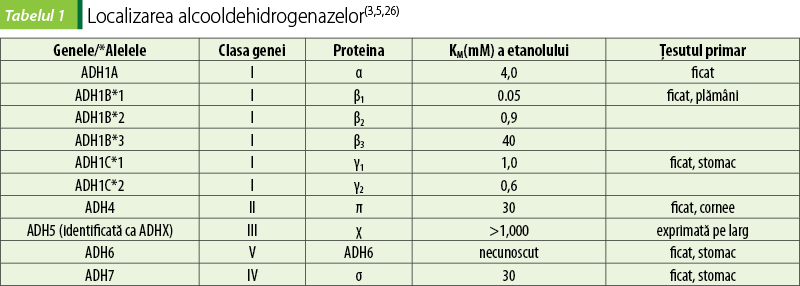
Stomacul poate metaboliza cantităţi importante de etanol cu relevanţă clinică datorită prezenţei unor izoenzime ale ADH, realizând aşa-numitul metabolism al primului pasaj. Astfel, infuzia intraduodenală sau intraportală a cantităţilor de etanol echivalente cu cele administrate în stomac a produs niveluri în sânge semnificativ mai mari decât administrarea intragastrică, documentând rolul metabolismului gastric al etanolului in vivo. Acest prim pasaj nu are loc după gastrectomie şi postul alimentar şi este parţial diminuat la alcoolici, ca urmare a evacuării gastrice accelerate şi a scăderii activităţii ADH gastrice. Activitatea ADH gastrice este, de asemenea, mai mică la femei decât la bărbaţi, cel puţin sub vârsta de 50 de ani. Unele izoenzime ale ADH necesită o concentraţie relativ mare de etanol pentru o activitate optimă; prin urmare, concentraţia băuturilor alcoolice influenţează cantitatea metabolizată. Medicamentele precum acidul acetilsalicilic, paracetamolul şi H2-histaminoblocantele diminuează activitatea ADH gastrice in vitro şi cresc nivelul de alcool în sânge in vivo, în special la o doză mică de alcool, echivalentă cu cea a băuturii sociale. Efectele la o doză mai mare de etanol sunt încă subiectul unor controverse(16).
O parte din alcoolul administrat intern nu va ajunge în circulaţia sistemică, deoarece poate fi oxidat în stomac prin izoformele ADH clasa I şi clasa III, fapt ce ar putea modula biodisponibilitatea şi toxicitatea alcoolului. Metabolismul primului pasaj s-a demonstrat a fi scăzut la alcoolici, în special la femeile alcoolice, din cauza micşorării activităţii ADH. Acest lucru poate determina sensibilitate crescută la alcool şi concentraţii mai mari de etanol în sânge la femei decât la bărbaţi după o doză orală echivalentă. Mai multe medicamente, inclusiv H2-histaminoblocantele (cimetidina, ranitidina etc.) sau acidul acetilsalicilic, inhibă activitatea ADH în stomac. Acest lucru va reduce metabolismul la primul pasaj prin stomac şi, prin urmare, va creşte concentraţiile de alcool în sânge(3).
Ingestia internă a alcoolului are ca rezultat concentraţii mai mici în sânge decât cele observate după administrarea intravenoasă a unei cantităţi egale de etanol. Acest fenomen se datorează, cel puţin parţial, metabolismului alcoolului de către ADH gastrică. În stomac există diferite izoenzime ale ADH, incluzând clasele I (, ), III () şi IV (). Toate aceste izoenzime, care contribuie la metabolizarea etanolului, au proprietăţi cinetice diferite. Activitatea totală a ADH gastrice variază odată cu concentraţia de etanol din băuturile alcoolice consumate. S-a demonstrat că activitatea ADH gastrice este afectată de diverşi factori, precum sexul, mediul înconjurător, concentraţia de etanol ingerat şi morfologia gastrică, inclusiv gastrita atrofică şi prezenţa Helicobacter pylori. În plus, modelul exprimării izoenzimei ADH în mucoasa gastrică determină de asemenea activitatea acesteia.
Astfel, prezenţa ADH1 şi ADH3 este asociată cu activitatea totală crescută a ADH gastrice. Este interesant de observat că postul şi gastrectomia scad în mod semnificativ metabolismul primar al etanolului, posibil din cauza golirii gastrice mai rapide şi a ratei crescute de absorbţie intestinală a etanolului. O viteză crescută a evacuării gastrice poate reduce timpul de expunere a etanolului la ADH gastrică, respectiv a metabolismului primar gastric al etanolului, cu o absorbţie accelerată a etanolului(21).
Activitatea ADH medie a fost mai mare în partea antrală decât în corpul stomacului. S-a constatat că aceasta a scăzut odată cu creşterea vârstei la bărbaţi, în timp ce la femeile între 41 şi 60 de ani a fost mai mare decât la femeile cu vârsta cuprinsă între 20 şi 40 de ani sau între 61 şi 80 de ani. La bărbaţii cu vârsta între 20 şi 40 de ani, consumul de cantităţi mai mari de alcool (>0,8 g/kg/zi) a fost asociat cu reducerea activităţii ADH. H2-histaminoblocantele au diminuat activitatea ADH gastrice. Rezultatele indică faptul că activitatea ADH în mucoasa gastrică umană este în corelaţie negativă cu consumul unor cantităţi mai mari de alcool. Activitatea ADH gastrice la bărbaţii tineri este în mod distinct mai mare comparativ cu femeile tinere, însă contrariul este valabil pentru pacienţii de vârstă mijlocie(23).
Gupta A.M. şi coaut.(12) au studiat la bărbaţi voluntari sănătoşi (20-40 de ani, cu o utilizare săptămânală de 60 g etanol) influenţa administrării repetate de alcool (0,6 g/kg) şi pe fundal de cimetidină (400 mg de 2 ori/zi timp de 7 zile) asupra nivelului alcoolului în sânge. Astfel, la 15 subiecţi, cu un metabolism substanţial la primul pasaj, după administrări repetate a crescut nivelul de alcool atât înainte, cât şi după cimetidină, un efect mult mai mare decât după o singură doză de alcool. La trei voluntari s-au depistat concentraţii ale etanolului de peste 50 mg/dl, ceea ce depăşeşte limita legală pentru conducere. Invers, la cinci subiecţi cu un metabolism minim de prim pasaj, cimetidina nu a crescut nivelul de alcool.
Astfel, în condiţii în care se imită o situaţie banală de utilizare a alcoolului, cimetidina a crescut concentraţia alcoolului în sânge capabilă să afecteze abilităţile psihomotorii şi aceasta a persistat la aceste niveluri pe perioade prelungite.
S-a demonstrat că H2-histaminoblocantele inhibă activitatea ADH gastrice într-o măsură variabilă în funcţie de metabolismul gastric al alcoolului. În caz că acesta este neglijabil, atunci această inhibare nu are relevanţă. H2-histaminoblocantele, la o doză de 0,15 g/kg de alcool, pot determina o creştere uşoară a concentraţiilor de alcool în sânge, iar la o doză de 0,3 g/kg şi mai mult nu s-au constatat interacţiuni semnificative între antisecretoare şi etanol. S-a estimat că majorarea absorbţiei etanolului la doze mici, repetate, de alcool ar fi datorată accelerării golirii gastrice de către aceste medicamente(6,7).
Metabolismul alcoolului la nivel hepatic
Alcoolul este metabolizat în principal în hepatocite, care exprimă cele mai mari niveluri ale enzimelor majore de oxidare a etanolului, ADH, localizată în citozol, şi ale citocromului P450 2E1 (CYP2E1), localizat în reticulul endoplasmatic neted (figura 2). Hepatocitele exprimă, de asemenea, niveluri foarte mari de catalază, care are un rol auxiliar în metabolismul etanolului prin utilizarea H2O2 pentru oxidarea etanolului la acetaldehidă. Oxidarea prin catalază este o cale relativ minoră în ficat, dar are o funcţie mai mare de metabolizare a etanolului în creier(22).
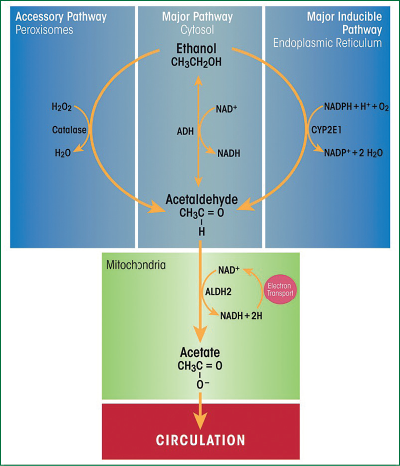
Oxidarea alcoolului este limitată de capacitatea maximă a ADH. Cantitatea de ADH din ficat este mai mare în faza de alimentare decât în starea de repaus, care joacă un rol major în creşterea ratei de oxidare a alcoolului la administrarea cu alimentele. Inhibitorii ADH blochează oxidarea etanolului în proporţie directă cu potenţa lor ca inhibitori ai enzimei. Efectele hormonilor asupra activităţii ADH sunt variate şi complexe. Astfel, se constată o anumită stimulare a activităţii ADH după tratamentul cu hormon de creştere, epinefrină sau estrogeni, în timp ce hormonii tiroidieni şi androgenii o inhibă(5,11).
Izoformele ADH de clasa I joacă cel mai important rol în oxidarea alcoolului. ADH este prezent la nivel scăzut în ficatul fetal, iar fătul elimină foarte lent etanolul din cauza maturizării tardive a genelor ADH. Abilitatea de a forma multe izoforme, cu proprietăţi cinetice variabile, probabil contribuie la variabilitatea mare a capacităţii de metabolizare a alcoolului pe care o prezintă populaţiile umane. ADH de clasa I este foarte sensibilă la acţiunea inhibitoare a derivaţilor pirazolului, fapt ce explică inhibarea marcată a metabolismului alcoolului de către aceşti agenţi(3,5).
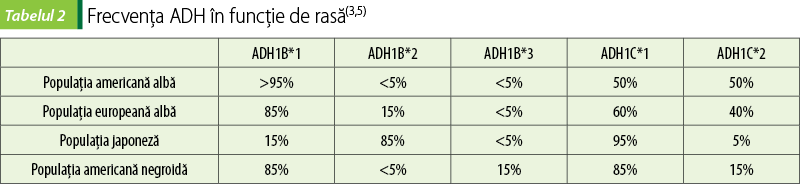
Formele polimorfe ale ADH (clasa I ADH1B, ADH1C) variază într-o oarecare măsură în diferite grupuri rasiale, aşa cum se arată în tabelul 2. Până în prezent nu au fost stabilite asociaţii clare între diferite izoenzime ADH şi dezvoltarea bolii alcoolice hepatice, susceptibilitatea la acţiunile alcoolului sau tendinţa de a consuma etanol. O metaanaliză a arătat că purtătorii alelelor ADH2*1 şi ADH3*2, alfa-dehidrogenazele metabolizante cu etanol mai puţin activ, şi ALDH2*1, alele cu activitate înaltă, au avut un risc crescut de alcoolism. Aceasta reflectă probabil acumularea redusă de acetaldehidă la aceşti indivizi. În boala hepatică, ALDH2*1 este un factor de protecţie, deoarece îndepărtează acetaldehida toxică. Nici polimorfismul ADH2, nici ADH3 nu au fost implicate în dezvoltarea bolii hepatice. Variantele alelelor ale CYP2E1 nu au fost implicate în determinarea riscului de alcoolism sau în boala hepatică alcoolică. Cercetări suplimentare în acest domeniu sunt necesare, precum şi studii asupra altor substraturi ale diferitor izoforme ale ADH(3,5).
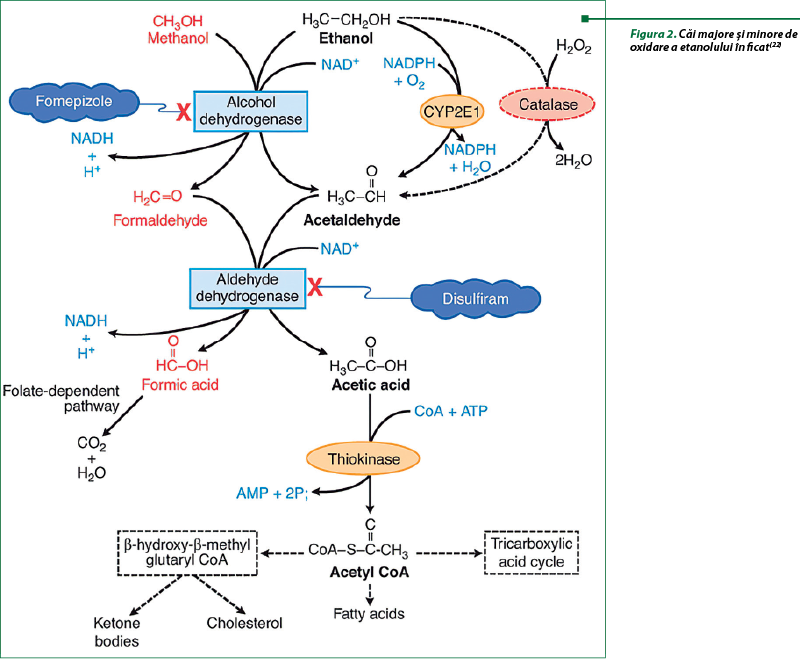
Alcooldehidrogenaza este cea mai eficientă enzimă de metabolizare a etanolului. Aceasta atinge viteza maximă când nivelurile de etanol în circulaţie sunt de aproximativ de la 5 până la 10 mg/dl, mult sub nivelurile care provoacă intoxicaţie. Oxidarea etanolului catalizată de ADH utilizează nicotinamida dinucleotidă (NAD +) drept cofactor, generând NADH redus şi acetaldehidă. Ultima este foarte reactivă şi toxică. Se poate lega covalent de proteine, lipide şi acizi nucleici pentru a forma aducte acetaldehidice, care la rândul lor pot afecta structura şi funcţia acestor macromolecule. O modalitate prin care hepatocitele minimizează toxicitatea acetaldehidei este oxidarea rapidă la acetat prin intermediul aldehiddehidrogenazei 2 (ALDH2) mitocondriale. Reacţia ALDH2 este o altă etapă de reducere a oxidării care generează NADH şi acetat – ultimul poate difuza în circulaţie pentru a fi utilizat în alte căi metabolice. Generarea de NADH, prin reacţiile catalizate de ADH şi ALDH2, scade raportul NAD+/NADH intrahepatic normal, numit potenţialul redox celular. Această schimbare provoacă modificări metabolice semnificative de la metabolismul oxidativ la sinteza reductivă, favorizând formarea de acizi graşi, care contribuie la dezvoltarea ficatului gras(22).
Citocromul P-450, izoenzima CYP2E1, este o altă enzimă hepatică majoră care catalizează oxidarea etanolului în acetaldehidă. Izoenzima CYP2E1 este inductibilă şi exprimată în concentraţii mari în ficat, precum şi în creier, rinichi, mucoasa nazală, piele, inimă, plămâni, ovar, testicule, muşchi scheletici şi măduva osoasă. În celule, CYP2E1 activă se găseşte atât în reticulul endoplasmatic (erCYP2E1), cât şi în mitocondrii (mtCYP2E1). Deşi eficienţa catalitică a CYP2E1 este considerabil mai lentă decât cea a ADH, acesta are o capacitate de 10 ori mai mare de metabolizare a etanolului, devenind semisaturată la 46‑92 mg/dl. De asemenea, important este faptul că CYP2E1 este o enzimă inductibilă; conţinutul său în hepatocite creşte în timpul consumului cronic de etanol. Inducţia CYP2E1 are mai multe efecte majore asupra consumatorilor de alcool. În primul rând, pentru că CYP2E1 oxidează mai mult etanol, consumatorii de alcool dezvoltă o „toleranţă metabolică” – adică trebuie să bea mai mult alcool pentru a atinge un nivel de ebrietate pe care l-au realizat anterior. În al doilea rând, metabolismul accelerat al alcoolului pune hepatocitele în pericol metabolic, deoarece mai mult CYP2E1 produce nu doar mai multă acetaldehidă, dar şi cantităţi mai mari de diferite alte specii reactive de oxigen (ROS), precum hidroxietil (radicali liberi de etanol), anioni superoxid (O2-) şi radicali hidroxil (OH). Generarea continuă a acestor molecule reactive creează o stare de stres oxidativ. În aceste condiţii, rata generării ROS depăşeşte capacitatea ficatului de a le neutraliza prin antioxidanţii naturali, precum glutationul şi vitaminele E, A şi C, sau pentru a le elimina folosind enzime antioxidante (superoxiddismutaza, catalaza, glutation peroxidaza, glutation reductaza). Stresul oxidativ este în continuare exacerbat atunci când ROS generate suferă reacţii secundare cu proteinele şi lipidele nesaturate. Aceste reacţii determină generarea de peroxizi lipidici, care interacţionează cu proteinele şi acetaldehida pentru a forma aducte mai mari (malondialdehidă-acetaldehidă) care sunt capabile să genereze un răspuns imun. În cele din urmă, datorită specificităţii largi a CYP2E1, nivelurile crescute ale enzimei accelerează de asemenea conversia cantităţilor excesive de substraturi, precum acetaminofenul. Inducţia CYP2E1 prin alcool favorizează transformarea paracetamolului în N-acetilbenzochinonimină, un metabolit mai toxic şi mai reactiv, care la utilizatorii cronici prezintă un risc substanţial pentru o boală hepatică sau insuficienţă hepatică acută, în special după o supradozare de analgezic (figura 3)(9,17,18,22).

Citocromul P450 este o familie de enzime care sunt implicate în oxidarea steroizilor, acizilor graşi şi xenobioticelor. Pe lângă etanol, CYP2E1 poate oxida acetona, acetaminofenul, benzenul, tetraclorura de carbon, halotanul, hidrocarburile halogenate în metaboliţi toxici reactivi şi, de asemenea, poate activa procancerigenii – nitrozaminele, compuşii azo-cancerigeni activi(3).
Izoenzima CYP2E1 are o afinitate de 10 ori mai mare pentru etanol decât ADH. La concentraţii mici de alcool, CYP2E1 poate metaboliza circa 10% din alcool, dar relevanţa ei creşte odată cu majorarea concentraţiilor de alcool în sânge. Nivelurile CYP2E1 sunt crescute la administrarea cronică de etanol printr-un mecanism care implică în mare măsură protecţia enzimei împotriva proteolizei de către complexul proteasom macromolecular. Izoenzima CYP2E1 este indusă la diabetici şi de anumite medicamente. Au fost identificate 13 polimorfisme diferite ale CYP2E1. Unele dintre acestea pot fi importante ca factori de risc pentru carncerigenitatea tutunului sau a unor toxine, dar nu există dovezi care să demonstreze corelaţia dintre aceste polimorfisme cu frecvenţa leziunilor hepatice alcoolice(3,18).
Etanolul şi preparatele concurează pentru metabolismul de către CYP2E1, care poate determina o hipersensibilitate la anumite medicamente, deoarece alcoolul va diminua metabolizarea medicamentului şi va prelungi perioada de înjumătăţire. Consumul cronic de alcool va induce metabolismul medicamentelor care sunt substraturi pentru CYP2E1, cu micşorarea timpului de înjumătăţire al medicamentului şi a eficacităţii lui. CYP2E1 este foarte activ în oxidarea multor substanţe chimice la intermediari reactivi – de exemplu, tetraclorură de carbon, benzen, nitrozamine, acetaminofen, halotan –, cu creşterea toxicităţii acestora(3).
Substraturi ale CYP2E1 sunt: molecule organice mici (etanol, acetonă şi pirazol); compuşi endogeni (acizi graşi, cetone, hormoni şi glicerol); medicamente – salicilaţi (acid salicilic), antituberculoase (izoniazidă), anestezice (halothan, enfluran, isofluran, metoxifluran, sevofluran), analgezice-antipiretice (paracetamol), metilxantine (teofilină), hipnotice (zopiclon, eszopiclon), miorelaxante centrale (clorzoxazonă), antitumorale (cisplatină); substanţe chimice toxice (tetraclorură de carbon, cloroform, nitrozamine, benzen, acrilamida, dimetilformamida)(1,13).
Alte căi de metabolizare a alcoolului
Reacţii de conjugare
Etanolul poate reacţiona cu acidul glucuronic pentru a forma etilglucuronidul, conjugat solubil şi uşor eliminat. Disponibilitatea cofactorului şi afinitatea mică pentru alcool pentru majoritatea enzimelor de conjugare limitează aceste căi. Etilglucuronidul este un metabolit direct, volatil, solubil în apă, care poate fi detectat în lichide, ţesuturi, transpiraţie şi păr un timp îndelungat după eliminarea alcoolului din organism. Astfel, s-a sugerat că etilglucuronidul poate fi un marker pentru consumul de alcool sau pentru detectarea recăderii la alcoolici(3).
Sinteza de acil esteri
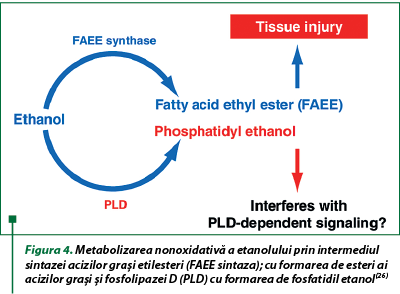
Sintazele de etil ester al acizilor graşi catalizează reacţia dintre etanol şi un acid gras pentru a produce un acil ester. Aceste sintaze sunt prezente în cele mai multe ţesuturi, în special ficat şi pancreas, organele cele mai sensibile la toxicitatea alcoolului. Aceşti esteri sunt sintetizaţi în reticulul endoplasmatic şi transportaţi în citoplasmă şi apoi eliminaţi din celulă prin legarea la lipoproteine şi albumină (figura 4). Esterii acizilor graşi inhibă ADN-ul şi sinteza proteinelor. Această cale devine importantă când metabolismul oxidativ al etanolului este blocat. Aceşti esteri pot fi detectaţi în sânge după ce alcoolul este eliminat şi pot servi drept marker al consumului de etanol(3,26).
Medicamente care produc reacţii de tip disulfiram
Medicamentele care produc reacţii asemănătoare disulfiramului şi pot fi utilizate în tratamentul alcoolismului sunt: disulfiram, carbimidă de calciu, cianamidă. Disulfiramul (teturam, antabus, esperal etc.), utilizat pentru tratamentul alcoolismului, are unele efecte caracteristice – tremor, spaimă, dispnee, tahicardie, hiperemia feţei, bufeuri, hipertermie, iar la doze mai mari de alcool se pot dezvolta hipotensiune arterială, paliditate, confuzie, cardialgii, ischemii ale miocardului şi creierului, convulsii etc., care survin într-un timp scurt după asociere, şi nu ca o consecinţă a efectului alcoolului de a doua zi(2,13).
Reacţii de tip disulfiram produc o gamă variată de medicamente, cu consecinţe mai mult sau mai puţin semnificative. Printre grupele de preparate putem menţiona:
-
Antivirale – abacavir;
-
Antibacteriene:
-
Cefalosporine – cefamandol, cefmetazol, cefonicid, cefoperazonă, cefotetan, ceftriaxon, cefuroxim, moxalactam;
-
Amfenicoli – cloramfenicol;
-
Sulfamide combinate – cotrimoxazol (trimetoprim/sulfametoxazol);
-
Antifungice – griseofulvină, ketoconazol;
-
Antituberculoase – hidrazine (izoniazidă);
-
Derivaţi de nitrofuran – furazolidonă, nitrofurantoină;
-
Derivaţi de nitroimidazol – metronidazol, ornidazol, tinidazol, benznidazol;
-
Antiprotozoice – mepacrină;
-
-
Nitraţi organici – nitroglicerină;
-
Diuretice: acid etacrinic;
-
Imunodepresive macrolidice – pimecrolimus, tacrolimus;
-
Antiandrogeni – nilutamidă;
-
Analgezice-antipiretice – fenacetină;
-
Antiinflamatoare nesteroidiene – fenilbutazonă;
-
Alfa-adrenoblocante – fentolamină, tolazolină;
-
Beta-adrenoblocante – propranolol;
-
Antidiabetice – clorpropamidă, glibenclamidă, gliburidă, tolbutamidă, metformină;
-
Antitumorale – hidrazine (procarbazină).
Reacţia de tip disulfiram poate să apară nu numai la administrarea internă a preparatelor antibacteriene, ci şi la utilizarea sub forme injectabile, picături oftalmice şi nazale, aerosoli, supozitoare vaginale, creme etc. Este necesar de menţionat că pericolul acestei reacţii se poate menţine de la câteva zile (2-4) până la două săptămâni după ultima doză a acestor medicamente(2,10,11,13,24).
Concluzii
Interacţiunile farmacocinetice ale alcoolului cu medicamentele prezintă o problemă dificilă pentru medic şi pacient atât din punct de vedere medical, cât şi social. Pentru a evita consecinţele imprevizibile ale unor astfel de interacţiuni este necesară o complianţă adecvată între participanţii la tratament. Din aceste considerente, sunt importante eforturile pentru explicaţiile de rigoare referitoare la influenţa alcoolului asupra farmacocineticii medicamentelor, precum şi a preparatelor asupra absorbţiei, distribuţiei şi metabolismului etanolului.
Bibliografie
- Abdelmegeed MA et al. Role of CYP2E1 in Mitochondrial Dysfunction and Hepatic Injury by Alcohol and Non-Alcoholic Substances. Current Molecular Pharmacology. 2017; 10(3): 207-225.
- Borja-Oliveira CR. Alcohol-Medication Interactions: The Acetaldehyde Syndrome. J Pharmacovigilance. 2014, 2:145. doi: 10.4172/2329-6887.1000145
- Cederbaum AI. Alcohol metabolism. Clin Liver Dis. 2012 Nov; 16(4): 667–685.
- Crabb DW et al. Overview of the role of alcohol dehydrogenase and aldehyde dehydrogenase and their variants in the genesis of alcohol-related pathology. Proceedings of the Nutrition Society (2004), 63, 49–63.
- Ethanol Metabolism. The Medical Biochemistry 1996-2019. 2004
- https://themedicalbiochemistrypage.org.
- Fraser AG. Is there an interaction between H2-antagonists and alcohol? Drug Metabol Drug Interact. 1998;14(3):123-45.
- Fraser AG. Pharmacokinetic Interactions Between Alcohol and Other Drugs. Clinical Pharmacokinetics. 1997;33, (2), pp 79–90.
- Fagerberg JH et al. Concomitant intake of alcohol may increase the absorption of poorly soluble. European Journal of Pharmaceutical Sciences. 2015;67; 12–20.
- Hartman JH, Miller GP, Meyer JN. Toxicological implications of mitochondrial localization of CYP2E1. Toxicol Res (Camb). 2017 May 1; 6(3): 273–289.
- Holton AE, et al. Consensus validation of the POSAMINO (POtentially Serious Alcohol–Medication Interactions in Older adults) criteria. BMJ Open. 2017;7:e017453.
- Goldman MP, Lance LL. Drug Information Handbook 15TH ed. Hudson, OH; LexiComp Inc. 2007;1899-1912.
- Gupta AM, Baraona E, Lieber CS. Significant increase of blood alcohol by cimetidine after repetitive drinking of small alcohol doses. Alcohol Clin Exp Res. 1995 Aug;19(4):1083-7.
- Karamanakos PN et al. Pharmaceutical agents known to produce disulfiram-like reaction: effects on hepatic ethanol metabolism and brain monoamines. Int J Toxicol. 2007 Sep-Oct;26(5):423-32.
- Komori K et al. Effect of Alcoholic Beverages on Drug Absorption: Blood Concentration Profile of Ibuprofen in Mice. J Appl Pharm. 2017;9:237.
- Lennernäs H. Ethanol-drug absorption interaction: potential for a significant effect on the plasma pharmacokinetics of ethanol vulnerable formulations. Mol Pharm. 2009 Sep-Oct;6(5):1429-40.
- Lieber CS, Gentry RT, Baraona E. First pass metabolism of ethanol. Alcohol Suppl. 1994;2:163-9.
- Mukherjee S. Alcohol metabolism and generation of free radicals: A deep insight. OA Alcohol 2014 Jul 18;2(1):10.
- Lieber CS. Microsomal ethanol-oxidizing system (MEOS): the first 30 years (1968-1998)--a review. Alcohol Clin Exp Res. 1999 Jun;23(6):991-1007.
- Nagaraj T et al. Alcohol-medcation interactions: A review. Journal of Medicine, Radiology, Pathology&Surgery. 2017; 4: 6-9.
- Noureldin M. et al. Drug-Alcohol Interactions: A Review of Three Therapeutic Classes. US Pharm. 2010;35(11):29-40.
- Oneta CM et al. First pass metabolism of ethanol is strikingly influenced by the speed of gastric emptying. Gut. 1998;43:612-619.
- Osna NA et al. Alcoholic Liver Disease: Pathogenesis and Current Management. Alcohol Research: Current Reviews. 2017;38 (2), 7-21
- Parlesak A et al. Gastric alcohol dehydrogenase activity in man: influence of gender, age, alcohol consumption and smoking in a Caucasian population. Alcohol and Alcoholism. 2002, July, 37(4,1): 388–393.
- Ren S et al. Cephalosporin Induced Disulfiram-Like Reaction: A Retrospective Review of 78 Cases. Int Surg. 2014 Mar-Apr; 99(2): 142–146.
- Srividya B. Impact of Alcohol on Drug Metabolism and Alcohol-Drug Pharmacokinetic. Interactions in Alcoholics. Research and Review. Journal of Pharmacology and Toxicological Studies. 2016;4(2); 112-119.
- Zakhari S. Overview:How is alcohol metabolized by the body? Alc.Res&health. 2006;29(4): 244-54.
Articole din ediţiile anterioare
Fumatul și interacţiunea cu medicamentele
În Uniunea Europeană, consumul de tutun este cel mai important risc pentru sănătate care poate fi evitat. El reprezintă cea mai importantă cauză de...
Gemoterapia, o cale naturală pentru menţinerea sănătăţii.Tulburările metabolismului glucidic
Sănătatea este un dar de mare preț, de o valoare inestimabilă. Din păcate, de cele mai multe ori realizăm acest lucru doar când sănătatea este comp...