The behavior of patients with diabetes mellitus during the COVID-19 pandemic is evolving with the review of information from randomized clinical trials, case reports, meta-analyses of publications and expert opinions. It is certain that blood glucose levels are a definite unfavorable factor in the evolution and prognosis of SARS-CoV-2 infection. The diabetic patient is predisposed to a more severe evolution associated with serious and fatal complications due to similar pathogenetic mechanisms found in diabetes and COVID-19. The specific healthcare algorithm of patients with type 2 diabetes mellitus will depend on the severity, healthcare settings (outpatient, general ward or intensive care), the pharmacodynamic and pharmacokinetic peculiarities of oral antidiabetic groups, and the new properties of preparations, elucidated during the evolution of the COVID-19 pandemic. Monitoring of glycemic profile and adverse reactions (hypoglycemia, posthypoglycemic hyperglycemia, lactacidosis, diabetic ketoacidosis, dehydration, dyspeptic disorders) are mandatory conditions in the management of patients with diabetes and COVID-19.
Preparatele antidiabetice la pacienţii cu diabet zaharat de tip 2 şi COVID-19
Antidiabetic preparations in patients with type 2diabetes and COVID-19
First published: 04 mai 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.199.2.2021.4874
Abstract
Rezumat
Conduita pacienţilor cu diabet zaharat în timpul pandemiei de COVID-19 evoluează odată cu revizuirea informaţiilor din studiile clinice randomizate, raportările de caz, metaanaliza publicaţiilor şi opinia experţilor. Este cert că nivelul glicemiei prezintă un factor nefavorabil în evoluţia şi prognosticul infecţiei cu SARS-CoV-2. Pacientul cu diabet zaharat este predispus la o evoluţie mai severă, cu complicaţii grave şi fatale din cauza unor mecanisme patogenetice similare constatate în diabet şi în COVID-19. Algoritmul de asistenţă medicală specifică al bolnavilor cu diabet zaharat de tip 2 va depinde de gradul de severitate, de condiţiile unde se va acorda asistenţa (ambulatoriu, secţie generală sau terapie intensivă), de particularităţile farmacodinamice şi farmacocinetice ale grupelor de antidiabetice orale, precum şi de noile proprietăţi ale preparatelor, elucidate pe parcursul evoluţiei pandemiei de COVID-19. Monitorizarea profilului glicemic şi a reacţiilor adverse (hipoglicemia, hiperglicemia posthipoglicemică, lactacidoza, cetoacidoza diabetică, deshidratarea, dereglările dispeptice) constituie condiţii obligatorii în gestionarea pacienţilor cu diabet zaharat şi COVID-19.
Introducere
Asocierea dintre diabetul zaharat (DZ) şi COVID-19 este o problemă majoră de sănătate publică, deoarece diabetul afectează milioane de oameni din întreaga lume. Controlul glicemic optim a fost întotdeauna o misiune prioritară şi dificilă la pacienţii spitalizaţi cu DZ, iar odată cu infecţia cu SARS-CoV-2 a devenit şi mai acut. Din aceste considerente, este important să abordăm strategiile farmacoterapeutice pentru gestionarea DZ la pacienţii spitalizaţi cu COVID-19 în secţii medicale speciale sau de terapie intensivă, pe baza dovezilor disponibile în prezent(4,8).
Datele studiilor demonstrează că DZ prezintă un risc major şi independent de morbiditate, forme severe, sindrom de detresă respiratorie acută (SDRA), internare în secţiile de terapie intensivă şi mortalitate în rândul pacienţilor cu infecţie cu SARS-CoV-2 sau COVID-19. Pacienţii cu diabet preexistent diagnosticaţi cu COVID-19 reprezintă 7-10% dintre cei internaţi şi 20-30% dintre cei care au decedat. Mai multe studii au demonstrat că, la pacienţii spitalizaţi cu COVID-19, diabetul preexistent este asociat cu rate crescute de progresie la complicaţii severe, cu o necesitate mai mare de ventilaţie mecanică, internare în unităţile de terapie intensivă şi cu o durată mai mare a spitalizării(3,4,8,11,12,15).
S-a raportat că formele severe de COVID-19 au prezentat rate extrem de ridicate de DZ coexistent (22,2-26,9%), iar progresia şi prognosticul nefavorabil au o incidenţă mai mare în rândul diabeticilor. Din aceste considerente, principiile tratamentului DZ la pacienţii cu COVID-19 prezintă mai multe neclarităţi, ceea ce face dificil modul de selectare raţională a antidiabeticelor prin prisma controlului eficient al glicemiei, evitării reacţiilor adverse şi a influenţei asupra susceptibilităţii şi severităţii infecţiei(10).
Material şi metodă
S-a efectuat o căutare a literaturii în baza de date PubMed prin utilizarea combinaţiilor de cuvinte-cheie: diabet, COVID-19, SARS-CoV-2 şi metformină, inhibitori SGLT-2, inhibitori DPP-IV, agonişti ai receptorilor GLP-1, tiazolidindione, insulină, în perioada martie 2020 – aprilie 2021.
Rezultate şi discuţie
Dovezile disponibile indică faptul că, indiferent dacă un pacient cu COVID-19 are DZ preexistent, a fost diagnosticat cu DZ de novo sau este nondiabetic, nivelul glicemiei este un factor crucial care poate determina: susceptibilitatea la infecţia cu SARS-CoV-2 în cazul unei expuneri; severitatea bolii; strategiile de tratament; rezultatele evoluţiei (internarea în terapie intensivă, leziuni cardiace, leziuni renale, SDRA, supravieţuire, mortalitate); recuperarea post-COVID-19. Hiperglicemia şi nivelul mai mare al glucozei à jeun au crescut, fără îndoială, severitatea bolii, incidenţa SDRA, afectarea cardiacă şi renală, internarea în secţiile de terapie intensivă şi mortalitatea la pacienţii cu COVID-19. Din aceste considerente, determinarea glicemiei este crucială şi trebuie monitorizată şi gestionată eficient sub tratament strict supravegheat(12).
Mecanismele potenţiale care pot creşte susceptibilitatea pacienţilor cu DZ la infecţia cu SARS-CoV-2 se consideră a fi: hiperglicemia, hipoglicemia, hiperglicemia posthipoglicemică şi fluctuaţiile semnificative ale nivelului glucozei care produc stres oxidativ, urmat de o producţie marcantă de citokine inflamatorii şi progresia procesului inflamator/infecţios, iar hiperglicemia promovează în mod direct replicarea virală a SARS-CoV-2. Controlul glicemic neadecvat a determinat modificări ale imunităţii înnăscute şi adaptive mediate celular. La persoanele cu DZ de tip 2 şi COVID-19, mortalitatea a fost mai mare la cei cu hemoglobina glicozilată (HbA1c) de 7,6%, comparativ cu 6,5-7%, iar riscul a crescut semnificativ odată cu creşterea nivelului de HbA1c peste 7,6%. Este necesar de menţionat faptul că nivelul HbA1c sub 6,5% a fost, de asemenea, asociat cu o creştere semnificativă a mortalităţii COVID-19. Astfel, un control excesiv de rigid al glucozei nu este probabil cea mai bună soluţie, deoarece poate creşte riscul de hipoglicemie (la pacienţii internaţi cu DZ), ceea ce poate duce şi la creşterea duratei spitalizării şi a mortalităţii în spital. S-a evidenţiat că glicemia à jeun peste 6,1-7 mmol/L la internare serveşte ca predictor independent de complicaţii în spital şi pentru mortalitatea de 28 de zile la pacienţii cu COVID-19 fără diagnostic anterior de DZ. Glicemia la internare a fost un factor de risc independent pentru prezicerea progresiei către cazuri critice/deces din cazuri necritice, iar nivelul iniţial al glicemiei a fost un factor de risc independent pentru mortalitatea în spitale în cazurile critice(2,4,6).
Există mai multe ipoteze referitoare la mecanismele care influenţează relaţia dintre diabet şi susceptibilitatea crescută pentru agravarea complicaţiilor legate de COVID-19. Potenţiale legături patogenetice între DZ şi COVID-19 includ proliferarea virală mediată prin hiperglicemie, dezechilibrarea sistemului imunitar, predispoziţia crescută la furtuna de citokine şi modificarea sistemului renină-angiotensină-aldosteron (SRAA) (figura 1). Prezenţa complicaţiilor tipice ale DZ (hipertensiune arterială, insuficienţă cardiacă, dislipidemii, boală cronică de rinichi) contribuie la mortalitatea din COVID-19. Un interes în acest sens prezintă datele despre efectele preparatelor antidiabetice la pacienţii cu SARS-CoV-2, deoarece modalităţile de scădere a glicemiei, independent de mecanismele lor de acţiune, pot să joace un rol în atenuarea severităţii complicaţiilor asociate cu COVID-19(3,7,11,15).
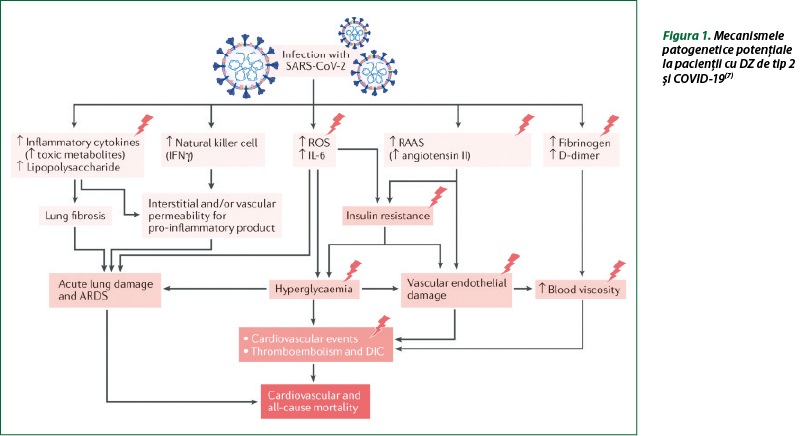
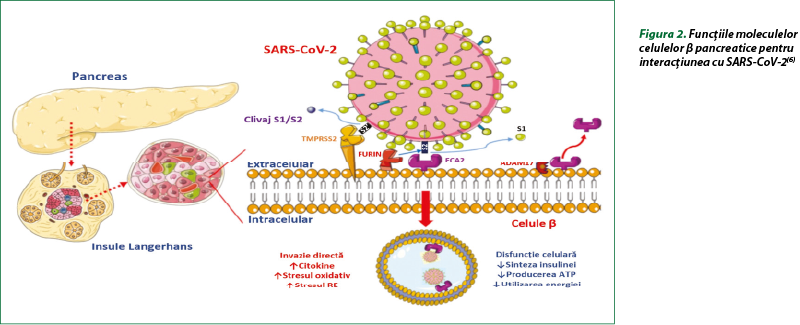
Vârsta înaintată, DZ, hipertensiunea arterială şi obezitatea marcantă (IMC ≥ 40 kg/m2) cresc morbiditatea şi mortalitatea la pacienţii cu COVID-19. Prevalenţa ridicată a bolilor cardiovasculare, a obezităţii şi a hipertensiunii arteriale la pacienţii cu DZ constituie factori suplimentari de risc, dar hiperglicemia şi DZ sunt predictori independenţi pentru mortalitate şi morbiditate la pacienţii cu SARS-CoV-2. Mecanismele potenţiale care pot creşte sensibilitatea la SARS-CoV-2 la pacienţii cu DZ includ: 1) ataşarea celulară cu afinitate mai mare şi intrare eficientă a virusului; 2) scăderea clearance-ului viral; 3) diminuarea funcţiei limfocitelor T; 4) susceptibilitate crescută la inflamaţie şi furtună citokinică; 5) prezenţa maladiilor cardiovasculare. La animalele cu DZ experimental, expresia ECA2 este majorată în alveolocitele pulmonare de tip 2, miocard, rinichi şi pancreas, care poate favoriza legarea celulară intensă a SARS-CoV-2 (figura 2)(6,9,16).
Administrarea insulinei atenuează expresia ECA2, în timp ce preparatele antidiabetice (agoniştii receptorilor GLP-1, tiazolidindionele), inhibitorii ECA şi statinele reglează ECA2. S-a determinat că DZ a fost asociat cu creşterea expresiei ECA2 în plămâni. La pacienţii cu DZ s-au constatat niveluri circulante mari de furină, o protează celulară implicată în facilitarea intrării virale prin scindarea domeniului S1 şi S2 al proteinei spike. Studiile recente susţin ipoteza că pacienţii cu DZ sunt sensibili la infecţia cu SARS-CoV-2, iar eliminarea virusului a fost întârziată. Diabetul zaharat inhibă chemotaxia neutrofilelor, fagocitoza şi inactivarea intracelulară a microbilor. La pacienţii cu DZ s-au observat afectări ale imunităţii adaptive caracterizate printr-o întârziere iniţială în activarea imunităţii mediate de celule Th1 şi un răspuns hiperinflamator tardiv. La pacienţii cu COVID-19, numărul periferic de limfocite T CD4+ şi CD8+ este scăzut, dar cu o proporţie mai mare de Th17 CD4+ extrem de proinflamatorii, precum şi niveluri crescute de citokine. Astfel, este probabil ca pacienţii cu DZ să aibă răspunsuri antivirale mediate de IFN reduse, iar activarea întârziată a Th1/Th17 poate contribui la răspunsuri inflamatorii accentuate(9,16).
Caracteristica-cheie a COVID-19 este disreglarea răspunsului imun, cu o creştere a eliberării citokinelor asociată cu o atenuare a răspunsului interferonilor, în principal din cauza limfopeniei, în paralel cu o hiperactivare a imunităţii înnăscute. Receptorii interferonilor de tip I şi de tip II sunt exprimaţi în celulele imune şi alte celule, iar receptorul interferonului de tip III este exprimat în celulele epiteliale din căile respiratorii superioare şi inferioare. Interferonii de tip I şi II produc un răspuns proinflamator, iar interferonii de tip III reduc replicarea virală, induc stabilitatea barierei epiteliale şi sunt mai puţin inflamatorii. Din aceste considerente, un răspuns adecvat la interferon este esenţial pentru combaterea unui virus şi eliminarea infecţiei virale. La persoanele în vârstă, la cei cu obezitate şi DZ, există un răspuns afectat al interferonilor antivirali timpurii, contribuind la susceptibilitatea pentru formele severe de COVID-19 la aceşti indivizi. Infecţia cu SARS-CoV-2 potenţează starea inflamatorie cronică existentă, rezultând o boală severă. În paralel cu atenuarea semnalizării interferonului, există o activare a neutrofilelor şi monocitelor-macrofagelor, care sunt principalii mediatori ai hiperinflamaţiei. Neutrofilele au un rol-cheie în patogeneza COVID-19, deoarece SARS-CoV-2 induce infiltrarea acestor celule în plămâni, cu declanşarea furtunii citokinice, a disfuncţiei endoteliale şi a trombozei venoase. În diabet, aceste efecte sunt potenţate, deoarece hiperglicemia activează neutrofilele care contribuie la furtuna citokinică şi sepsis în COVID-19, confirmate prin creşterea markerilor inflamatori în ser (VSH, proteina C reactivă, feritină, fibrinogen, D-dimeri, lactat dehidrogenază – LDH)(13).
Printre principale mecanismele care stau la baza corelaţiei dintre DZ şi evenimentele adverse din COVID-19 s-au menţionat: inflamaţie crescută, hipercoagulabilitate şi dereglarea răspunsurilor imune. Mecanisme suplimentare care pot contribui la sensibilitatea crescută la consecinţele adverse ale COVID-19 la pacienţii cu diabet sunt nivelul şi activitatea crescută a enzimei de conversie a angiotensinei 2 (ECA2) şi a enzimei DPP-4. Este bine cunoscut că ECA2 este receptorul care mediază intrarea SARS-COV-2 în celule, cu replicarea virală ulterioară, iar DPP-4 a fost sugerat că poate servi drept coreceptor pentru SARS-COV-2, deoarece acest virus are caracteristici similare cu ale altor coronavirusuri (MERS-CoV, SARS-CoV etc.). Aceste mecanisme pot duce la complicaţii suplimentare la pacienţii cu DZ şi COVID-19 (figura 3, tabelul 1)(3,7,15).
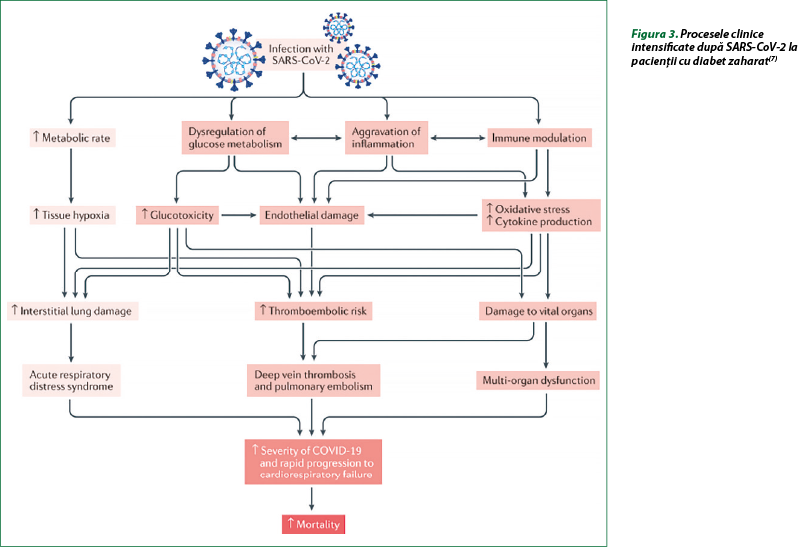
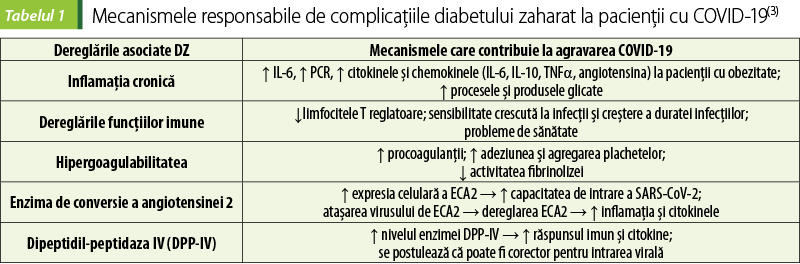
Datele din unele studii demonstrează corelaţii între gradul de hiperglicemie, gradul de variabilitate a glucozei şi riscurile de rezultate adverse şi mortalitate legate de COVID-19. La pacienţi spitalizaţi cu DZ de tip 2 şi COVID-19, cu concentraţia glucozei între 3,9 mmol/L şi 10 mmol/L (70-180 mg/dL), s-au constatat niveluri semnificativ mai reduse ale markerilor inflamaţiei (IL-6 şi PCR), alături de reducerea severităţii complicaţiilor şi a riscului de deces, comparativ cu cei cu glicemia de peste 10 mmol/L (180 mg/dL). S-a demonstrat că variabilitatea glucozei măreşte răspunsul inflamator, agravează prognosticul şi riscul de deces. Concentraţia plasmatică a glucozei à jeun peste 7 mmol/L (126 mg/dL) este un predictor independent al mortalităţii de 28 de zile la pacienţii spitalizaţi cu COVID-19 fără diagnostic anterior de diabet. S-a documentat că infecţia virală declanşează un răspuns la stres, determinând eliberarea hormonilor hiperglicemici (glucocorticoizi şi catecolamine), cu fluctuaţii ale nivelului de glucoză. Prin urmare, pentru pacienţii cu DZ, pentru a reduce riscurile şi severitatea complicaţiilor COVID-19, sunt necesare strategii de management al controlului optim al glucozei şi evitarea oscilaţiilor glicemiei(3).
Infecţia cu SARS-CoV-2 la pacienţii cu DZ de tip 2 măreşte riscul accidentului vascular cerebral acut (AVCA), prin provocarea unor tulburări cardiometabolice şi mecanisme precum hipercoagulare, furtună citokinică, vasculită, disfuncţie endotelială şi aritmii cardiace. Legarea SARS-CoV-2 la receptorii ECA2, abundenţi în endoteliul vascular, poate declanşa o reacţie inflamatoare şi endotelită limfocitară, cu dezvoltarea ulterioară a disfuncţiei endoteliale şi afectarea microcirculaţiei. Disfuncţia endotelială, indusă de SARS-CoV-2, şi disfuncţia endotelială, indusă de DZ de tip 2, determină insuficienţă microcirculatorie cerebrală, odată cu dezvoltarea ischemiei cerebrale şi a AVCA. Astfel, dezvoltarea AVCA la pacienţii cu DZ de tip 2 s-ar putea datora preexistenţei tulburărilor cardiometabolice în timpul dezvoltării pneumoniei COVID-19(1).
Asocierea dintre COVID-19 şi creşterea biomarkerilor inflamaţiei (PCR, feritină), coagulării (D-dimeri) şi a leziunilor ţesuturilor (LDH) sunt în concordanţă cu studiile recente publicate. Inflamaţia marcantă şi furtuna citokinică în COVID-19 cresc riscul de AVCA, din cauza vasodilataţiei endoteliale induse de heparină şi a activării complementului şi trombozei microvasculare, sugerând un mecanism specific de acţiune a SARS-CoV-2 în patogeneza AVCA. Legarea SARS-CoV-2 de receptorul ECA2 în cardiomiocite duce la leziuni miocardice, cu inducerea aritmiei cardiace şi creşterea riscului de AVCA determinat de tromboembolie. Hipoxemia provocată de insuficienţa respiratorie şi furtuna citokinică în COVID-19 provoacă leziuni indirecte ale cardiomiocitelor(1).
Preparatele antidiabetice, prin mecanismele de acţiune şi efectele hipoglicemiante, pot juca un rol în atenuarea progresiei către complicaţiile severe ale COVID-19, prin modificarea mecanismelor implicate în fiziopatologia COVID-19: diminuarea markerilor inflamaţiei, ameliorarea coagulopatiei şi modularea expresiei ECA2. O analiză recentă a remarcat acţiunea antiinflamatoare a unor antidiabetice, precum şi potenţiale efecte protectoare asupra sistemelor de organe afectate de SARS-CoV-2. Din acest considerente, este bine-venită elucidarea posibilităţilor de control al DZ de tip 2 în timpul pandemiei de COVID-19(3,15).
Biguanidele
Studiile realizate la începutul pandemiei au sugerat interzicerea metforminei la pacienţii cu DZ şi COVID-19, din cauza cetoacidozei diabetice anticipate în contextul dereglării poliorganice, în timp ce studii ulterioare au constatat că tratamentul cu metformină nu este dăunător şi ar putea fi benefic(15).
Mai multe studii au raportat rezultatele benefice ale metforminei la pacienţii cu DZ de tip 2 şi COVID-19, altele nu au găsit niciun beneficiu la utilizatorii de metformină în comparaţie cu neutilizatori în ceea ce priveşte severitatea şi mortalitatea, iar un studiu a raportat chiar o creştere a severităţii la utilizatorii de metformină(14).
Metformina are efecte benefice potenţiale asupra sistemului cardiovascular la pacienţii supraponderali cu diabet şi nu provoacă hipoglicemie. Utilizarea preparatului s-a asociat cu beneficii potenţiale în diferite infecţii virale, inclusiv gripa H3N2, hepatita C, hepatita B şi HIV. Un studiu observaţional la pacienţii cu DZ de tip 2 a demonstrat că cei menţinuţi în terapia cu biguanide au avut o incidenţă mai mică a infecţiilor cu gripă H3N2 comparativ cu pacienţii cu insulină şi sulfonilureice. Studiile experimentale şi clinice au demonstrat că metformina poate influenţa mecanismele responsabile de consecinţele severe ale COVID-19. Metformina, prin AMP protein kinaza activată (AMPK), determină fosforilarea directă a receptorului ECA2, fapt ce sugerează că această transformare ar putea duce la modificări conformaţionale ale site-ului de legare a SARS-CoV-2 la receptorii ECA2 şi, la rândul său, reduce recunoaşterea SARS-CoV-2. La pacienţii cu DZ şi COVID-19 cărora li se administra metformină, în comparaţie cu alte antidiabetice, inclusiv insulină, s-a constatat un nivel mai mic al IL-6 şi TNF-α. S-a demonstrat că utilizarea preparatului reduce nivelul inhibitorului activatorului plasminogen-1 şi factorului VII şi stabilizează trombocitele, cu diminuarea riscului de coagulare. Mai multe studii de cohortă retrospective şi o metaanaliză au raportat o reducere a mortalităţii la pacienţii cu DZ şi COVID-19 care utilizau metformină. S-a concluzionat că metformina, concomitent cu normalizarea nivelului glicemiei, manifestă mai multe mecanisme care pot oferi beneficii în timpul infecţiei cu SARS-CoV-2(3).
Utilizarea metforminei la pacienţii cu DZ de tip 2 este asociată cu un risc redus de tromboză venoasă profundă, aşa cum a fost raportat de un studiu de cohortă nerandomizat. Alte studii sugerează că metformina previne activarea trombocitelor şi eliberarea extracelulară a ADN-ului mitocondrial, prevenind astfel tromboza venoasă şi arterială, fără un timp de sângerare prelungit semnificativ. Efectele protectoare ale metforminei asupra endoteliului se explică prin activarea AMPK şi stimularea nitric-oxid-sintazei endoteliale (NOSe). Metformina poate proteja endoteliul prin reducerea stresului oxidativ, inhibarea inflamaţiei endoteliale şi suprimarea aderării leucocitelor la endoteliu, atenuând în acelaşi timp senescenţa şi apoptoza celulelor endoteliale şi păstrând glicocalixul endotelial, care protejează împotriva disfuncţiei endoteliale(12,14).
La pacienţii diabetici cu comorbidităţi (obezitate, hipertensiune arterială, maladii cardiovasculare), activarea aberantă a SRAA, creşterea stresului oxidativ şi a inflamaţiei şi activarea sistemului imunitar pot exacerba complicaţiile clinice în timpul infecţiei cu SARS-COV-2 şi pot contribui la creşterea mortalităţii la pacienţii cu COVID-19. Metformina poate fi recomandată (în absenţa unor afecţiuni renale severe) ca medicament preventiv pentru protejarea pacienţilor cu DZ de tip 2 şi obezitate în a dezvolt forme severe şi pentru creşterea supravieţuirii la pacienţii cu COVID-19. Efectele protectoare ale metforminei depăşesc efectul său antihiperglicemic şi capacitatea de a creşte sensibilitatea la insulină la pacienţii cu DZ cu comorbidităţi multiple. Studiile sunt justificate pentru a explora efectul antihiperglicemic, antiviral, antiinflamator, imunomodulator şi antitrombotic al metforminei, care poate contribui la efectele sale de protecţie la pacienţii diabetici cu COVID-19, în absenţa/prezenţa uneia sau mai multor comorbidităţi (figura 4)(5,12,14).
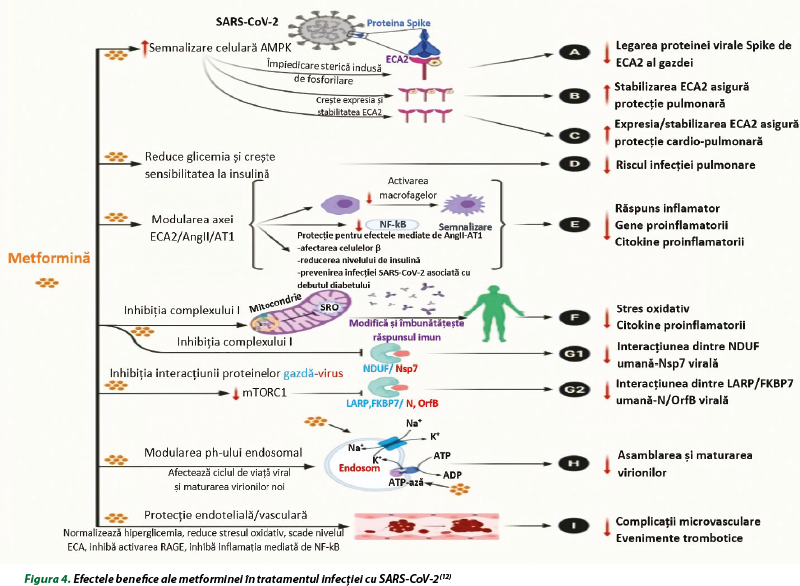
Majoritatea studiilor au evidenţiat efectele benefice ale metforminei la pacienţii cu COVID-19, în timp ce unele studii au raportat un risc crescut de acidoză (dar nu mortalitate) şi severitate a bolii la pacienţii cu COVID-19. Din aceste considerente, la utilizarea metforminei trebuie luate în consideraţie contraindicaţiile, precum şi faptul că preparatul nu este o alegere adecvată la pacienţii cu patologie respiratorie severă, insuficienţă renală, insuficienţă cardiacă şi subliniază importanţa luării în considerare a condiţiilor preexistente şi comorbidităţilor în selectarea medicamentului(12).
Riscul de lactacidoză cauzat de metformină se asociază cu creşterea ratei de mortalitate la pacienţii cu COVID-19 care dezvoltă hipoperfuzie şi hipoxemie. În formele critice de COVID-19, SDRA, cauza majoră a morbidităţii şi mortalităţii, se datorează în mare parte pneumonitei virale acute care evoluează către insuficienţă respiratorie acută hipoxemică, frecvent asociată cu instabilitate hemodinamică, care ar putea duce la formarea lactatului sub acţiunea metforminei. Incidenţa lactacidozei ar putea creşte ca urmare a insuficienţei cardiace acute decompensate preexistente sau nediagnosticate, a leziunii miocardice acute sau a utilizării preparatelor vasoconstrictoare în cazul hipotensiunii arteriale. În aceste cazuri, metformina trebuie suspendată cel puţin temporar la pacienţii spitalizaţi cu COVID-19 care au dezvoltat sau sunt susceptibili să dezvolte decompensare hemodinamică din cauza unui risc crescut de lactacidoză(4,6).
În cadrul studiului s-a constatat că metformina a ameliorat rezultatele clinice şi de laborator la pacienţii cu DZ de tip 2 şi COVID-19, în comparaţie cu pacienţii cu COVID-19 trataţi fără metformină. Terapia cu metformină la pacienţii cu DZ de tip 2 şi COVID-19 care au dezvoltat AVCA a fost asociată cu un profil cardiometabolic mai bun şi cu un nivel redus de citokine proinflamatorii comparativ cu pacienţii trataţi fără metformină. S-a constatat că terapia cu metformină este asociată cu o reducere a mortalităţii la pacienţii spitalizaţi cu COVID-19 şi DZ de tip 2 datorită efectului antiinflamator şi antiviral. Efectul antiinflamator al metforminei este determinat de activarea căii AMPK-azei, cu suprimarea ulterioară a IL-6 şi TNF-α şi activarea IL-10 antiinflamatoare. Aceste modificări declanşate de metformină sunt capabile să atenueze producţia de citokine, macrofage şi celule gliale activate în timpul neuroinflamaţiei marcante în COVID-19 şi induse de AVCA. S-a confirmat că metformina are un efect neuroprotector prin inhibarea apoptozei şi a stresului oxidativ în AVCA şi, prin urmare, poate fi privită ca un agent preventiv promiţător împotriva reperfuziei ischemice în AVCA(1).
Infecţia cu SARS-CoV-2, AVCA şi DZ de tip 2 determină un raport neutrofile/limfocite mai mare comparativ cu cel constatat în cazul persoanelor sănătoase, din cauza activării neutrofilelor şi a limfopeniei. Raportul neutrofile/limfocite cescut la pacienţii cu AVCA determină rezultate neurologice nefavorabile şi risc de hemoragie intracerebrală, iar la pacienţii cu COVID-19 este considerat un factor de risc independent pentru spitalizare şi asociat cu o rată ridicată a mortalităţii. S-a constatat că metformina reduce raportul neutrofile/limfocite la pacienţii cu DZ de tip 2. Neutrofilele joacă un rol fundamental în răspunsurile inflamatorii la leziunile ischemie/reperfuzie prin eliberarea de oxidanţi, proteaze, activarea toll receptorilor (TLR) şi eliberarea de produse inflamatorii. S-a raportat efectul dependent de doză al metforminei în reducerea activării şi recrutării neutrofilelor(1).
Terapia cu metformină, în comparaţie cu pacienţii cărora nu li s-a administrat preparatul, a determinat un risc mai mic al ictusului, datorită efectelor neuroprotectoare. Efectul potenţial neuroprotector al metforminei în AVCA a fost asociat cu inhibarea dependentă de AMPK a căii NF-κB, activarea citokinelor şi cu ameliorarea semnificativă a consumului neuronal de glucoză-oxigen. Terapia cu metformină a determinat un grad mai mic de afectare pulmonară, indusă de endotoxemie, la pacienţii cu DZ de tip 2 şi COVID-19, prin restaurarea inhibării pulmonare AMPK‑dependentă a semnalizării mTOR. Astfel, metformina la pacienţii cu DZ de tip 2, COVID-19 şi AVCA determină efecte protective atât asupra plămânilor, cât şi asupra creierului(1).
Metformina are efect antiviral potenţial împotriva diferitelor virusuri, prin activarea căii AMPK-azei. Studiile recente au confirmat efectul antiviral al metforminei împotriva replicării SARS-CoV-2. Activitatea anti-SARS-CoV-2 a metforminei este determinată de diferite mecanisme: a) activarea AMPK care duce la fosforilarea receptorului ECA2 la Ser-680, unde se produce interacţiunea, stabilizarea şi modificările conformaţionale ale ECA2 cu diminuarea sensibilităţii la legarea SARS-CoV-2; b) reglarea ECA2 pulmonară, care determină efecte antiinflamatoare şi antiapoptotice; c) reglarea ECA2 previne efectul dăunător al nivelului crescut de Ang II în pneumonia indusă de COVID-19; d) atenuarea afecţiunilor în pneumonia indusă de COVID-19 prin inhibarea migrării neutrofilelor şi a chemotaxiei, cu efect de stabilizare a mastocitelor(1).
Sulfonilureicele
Sulfonilureicele (gliclazida, gliburida, glipizida, glimepirida, glibenclamida) sunt asociate cu un risc crescut de hipoglicemie, care poate fi severă şi prelungită. Preparatele cu acţiune scurtă (gliclazida) pot fi utilizate în continuare la pacienţii spitalizaţi cu COVID-19 cu evoluţie stabilă a DZ de tip 2, dacă pacienţii pot respecta un regim alimentar adecvat. În cazul modificărilor neaşteptate ale aportului de alimente, în special în secţiile de terapie intensivă, poate creşte riscul de hipoglicemie severă(4).
Unele studii retrospective nu au raportat niciun prejudiciu sau beneficiu al sulfonilureicelor la pacienţii cu COVID-19 referitor la internarea în secţia terapie de intensivă, necesitatea de ventilaţie mecanică sau deces(14).
Sulfonilureicele stimulează secreţia de insulină din celulele β pancreatice, însă rezistenţa crescută la insulină ca urmare a inflamaţiei sau a infecţiei acute poate reduce efectul terapeutic al sulfonilureicelor. Pacienţii cu COVID-19 care prezintă simptome de anorexie pot prezenta un risc crescut de hipoglicemie. Sulfonilureicele trebuie evitate la pacienţii cu DZ care au COVID-19 sever(6).
O problemă discutabilă o reprezintă utilizarea sulfoniureicelor la pacienţii cu infarct miocardic având în vedere datele contradictorii referitoare la eficacitatea şi inofensivitatea lor. Infecţia cu SARS-CoV-2 la pacienţii cu boli severe poate duce la leziuni cardiace (creşterea enzimelor cardiace), astfel încât se recomandă prudenţă la utilizarea sulfonilureicelor. Rezultatele nefavorabile la pacienţii cu infarct miocardic la administrarea sulfonilureicelor pot fi atribuite legării neselective la receptorii pancreatici şi cardiaci. Prioritate pot avea preparatele mai noi (gliclazida, glimepirida), care se leagă selectiv de receptorii pancreatici, date confirmate prin rezultatele preliminare care au arătat ameliorarea stării de sănătate la pacienţii la care s-a folosit gliclazidă sau glimepiridă comparativ cu cei la care s-a folosit glibenclamidă. Sulfonilureicele, din cauza siguranţei cardiovasculare şi a riscului de hipoglicemie severă, ar trebui evitate la pacienţii spitalizaţi cu COVID-19, în special la cei aflaţi în stare gravă sau critică(4).
Meglitinidele
Meglitinidele (repaglinida, nateglinida) funcţionează similar cu sulfonilureicele, dar au o durată mai scurtă de acţiune, prezintă o mai bună reglare a glucozei prandiale şi pot fi preferate la pacienţii spitalizaţi cu COVID-19 şi DZ de tip 2 care se alimentează în regim normal. Meglitinidele trebuie utilizate cu precauţie, în special la pacienţii cu leziuni cardiace asociate COVID-19, dată fiind similitudinea lor privind modul de acţiune cu cel al sulfonilureicelor şi cu un risc cardiovascular similar(4).
Inhibitorii dipeptidil-peptidazei 4 (DPP-4)
Inhibitorii dipeptidil-peptidazei 4 (DPP-4), sau gliptinele (sitagliptina, saxagliptina, linagliptina, alogliptina, vildagliptina), blochează inactivarea hormonului insulinotrop, derivat din glucagon-like peptida-1 (GLP1) intestinală, implicat în reglarea pozitivă a nivelului glucozei, cu risc minim de hipoglicemie şi cu un profil favorabil de efecte secundare şi al costurilor competitive. Gliptinele inhibă degradarea peptidei de tip glucagon-1 care stimulează secreţia de insulină ca răspuns la alimente. Inhibitorii DPP-4 au proprietăţi farmacodinamice şi farmacocinetice specifice, cu eficacitate glicemică şi de inhibare a activităţii DPP-4 comparabile, cu implicaţii potenţial relevante pentru pacienţii cu boli hepatice sau renale. Spre deosebire de sulfonilureice, acestea afectează în principal nivelul de glucoză postprandială şi nu este raţional a fi utilizate la pacienţii cu COVID-19 care nu respectă regimul alimentar în timpul spitalizării. Utilizarea inhibitorilor DPP-4 nu a fost testată pe larg în cadrul îngrijirii acute. Unele studii au sugerat că inhibitorii DPP-4 pot fi rezonabil de eficienţi la pacienţii cu hiperglicemie uşoară cu DZ de tip 2 care se alimentează normal(4,8).
Dipeptidil-peptidaza-4, cunoscută anterior ca antigen al celulelor T CD26, este o serin-protează solubilă multifuncţională legată de celule, exprimată abundent în limfocite şi adipocite, precum şi în celulele endoteliale şi epiteliale, care joacă roluri critice în modularea homeostaziei glucozei şi a răspunsurilor inflamatorii. Enzima DPP-4 a fost identificată ca un receptor funcţional pentru coronavirusul uman, MERS-CoV şi, apropiat genetic de acesta, SARS-CoV-2. Anticorpii împotriva DPP-4 ar putea afecta infecţia cu coronavirus în celulele epiteliale bronşice umane. S-a observat că domeniul S1 al glicoproteinei SARS-CoV-2 interacţionează cu proteina receptorului gazdă DPP-4, fapt ce a ridicat ipoteza că SARS-CoV-2 poate folosi DPP-4, pe lângă ECA2, ca receptor funcţional suplimentar pentru intrarea în celula‑gazdă. Astfel, s-a înaintat ipoteza că inhibitorii DPP-4 ar fi utili în atenuarea infecţiei cu SARS-CoV-2, în special la pacienţii cu DZ de tip 2. Inhibitorii DPP-4, în afara efectului antihiperglicemic, legat de modularea dependentă de protează a axei enteroinsulare, posedă un potenţial terapeutic imunomodulator unic pentru tulburări autoimune şi reumatologice, cancer şi MERS(7,8).
Inhibitorii DPP-4 au demonstrat efecte favorabile asupra inflamaţiei şi coagulabilităţii, care pot avea un impact benefic asupra reducerii riscurilor complicaţiilor cauzate de COVID-19. Studiile au relatat că inhibitorii DPP-4 (sitagliptina) au redus producţia de citokine, în special IL-6, IL-8 şi TNF-α, şi agregarea plachetară. La pacienţii cu COVID-19 s-a raportat că blocarea DPP-4/CD26 receptorilor poate reduce intrarea şi replicarea virusului în tractul respirator dar şi inflamaţia în plămâni. Studiile clinice au furnizat dovezi preliminare ale efectelor inhibitorilor DPP-4 asupra mortalităţii la pacienţii cu DZ preexistent spitalizaţi cu COVID-19, iar suplimentarea de sitagliptină la un regim de insulină standard s-a asociat cu o mortalitate semnificativ redusă (18% vs 37%) şi rezultate clinice îmbunătăţite (60% vs 38%), comparativ cu cei care au administrat doar insulină. Utilizarea prealabilă a inhibitorilor DPP-4 la pacienţi spitalizaţi cu diabet cu COVID-19 s-a asociat cu pneumonie mai puţin severă, necesitate redusă de ventilaţie mecanică şi cu un risc mai mic de mortalitate independent de vârstă şi sex. Dovezile disponibile sugerează că inhibitorii DPP-4 reduc intrarea virală, inflamaţia, agregarea trombocitelor, necesitatea de ventilaţie mecanică şi mortalitatea(3,8,11).
Studiile experimentale şi clinice au arătat că inhibitorii DPP-4 exercită un puternic efect antiinflamator prin reducerea citokinelor proinflamatorii, efect benefic pentru reducerea furtunii inflamatorii la pacienţii cu COVID-19 sever. În baza datelor constatate în infecţia cu MERS-CoV s-a estimat că DPP-4, cunoscută şi sub numele de CD26, joacă un rol de receptor pentru MERS-CoV şi SARS-CoV-2, datorită omologiei lor remarcabile. Din aceste considerente s-a postulat că, prin interacţiunea dintre glicoproteina S1 şi DPP-4, se poate facilita ancorarea şi intrarea SARS-CoV-2 în celulele‑gazdă, se poate promova virulenţa, iar inhibarea acestei interacţiuni poate îmbunătăţi rezultatele clinice la bolnavii cu DZ şi COVID-19. Studiile experimentale şi clinice au arătat că inhibitorii DPP-4 manifestă proprietăţi antiinflamatorii, antifibrotice şi imunomodulatoare, care împreună cu efectul hipoglicemiant pot fi benefice la pacienţii cu DZ şi infecţie cu SARS-CoV-2, iar pentru confirmarea beneficiilor sunt necesare studii clinice randomizate(11,14,15).
Inhibitorii DPP-4, simultan cu implicarea în metabolismul glucozei şi insulinei, joacă un rol vital în reglarea sistemului imunitar, prin activarea limfocitelor T şi reglarea în sus a expresiei CD86 prin calea factorului nuclear-κB, în care inhibarea DPP-4 poate afecta negativ răspunsul imun la infecţia virală. Activarea căii factorului nuclear-κB poate duce şi la producerea diferitelor citokine proinflamatorii care ar putea contribui la inflamaţia pulmonară. Într-un alt model experimental al SDRA, inhibarea DPP-4 prin sitagliptină a atenuat leziunile pulmonare histologice prin inhibarea citokinelor proinflamatorii IL-1β, TNF-α şi IL-6. Cu toate acestea, au fost raportate mai multe cazuri de pneumonie interstiţială indusă de vildagliptină, care au pus la îndoială siguranţa folosirii vildagliptinei şi a altor inhibitori DPP‑4 la pacienţii cu infecţie pulmonară. Sitagliptina a fost asociată cu un risc crescut de tromboembolism venos, conform unui studiu recent de farmacovigilenţă, în care utilizarea continuă a sitagliptinei s-a dovedit a fi contraindicată la pacienţii cu COVID-19, din cauza tromboinflamaţiei(4).
Agonişti receptorilor glucagon like-peptidei-1 (AR GLP-1)
Agoniştii receptorilor GLP1 (AR GLP-1), sau incretinomimeticele (exenatida, liraglutida, lixisenatifa, dulaglutida, albiglutida, semaglutida), furnizează niveluri farmacologice de GLP-1 exogene care, în mod analogic hormonilor incretinici derivaţi din intestin, îmbunătăţesc homeostazia glucozei prin secreţia de insulină dependentă de glucoză, întârzierea golirii gastrice şi creşterea saţietăţii postprandiale. Preparatele reprezintă opţiunea de linia a II-a pentru pacienţii cu obezitate şi DZ de tip 2 controlat neadecvat, ca adjuvanţi la intervenţiile de stil de viaţă şi metformină. Agoniştii receptorilor GLP-1 în studiile clinice au manifestat efecte de protecţie cardiovasculară, fiind recomandaţi ca tratament de linia a II-a pentru pacienţii DZ de tip 2 cu boli cardiovasculare stabilite sau cu risc crescut asociat (≥55 de ani, cu stenoză coronariană, carotidiană sau a arterelor membrelor inferioare ori hipertrofie ventriculară stângă), indiferent de nivelul glicemiei. Agoniştii receptorilor GLP-1 prezintă proprietăţi farmacocinetice diverse cu timp diferit de înjumătăţire, care determină frecvenţa administrării: exenatidă de 2 ori/zi; liraglutidă şi lixisenatidă o dată/zi; dulaglutidă, albiglutidă şi semaglutidă o dată/săptămână. Agoniştii receptorilor GLP-1 sunt preparate antidiabetice pentru administrarea subcutanată, iar recent FDA a aprobat primul AR GLP-1 oral pentru tratamentul diabetului de tip 2 (semaglutidă – Rybelsus®). La AR GLP-1 a fost constatat efectul antiinflamator sistemic, ca o consecinţă a activităţii inhibitoare a eliberrării citokinelor, datorită interferenţei lor cu căile de semnalizare NF-κB(7,8).
Utilizarea AR GLP-1 la bolnavii cu DZ şi COVID-19 nu este bine definită şi necesită mai multe precizări prin faptul că peptidele GLP-1, în studiile experimentale la animalele cu DZ, au demonstrat un posibil potenţial în reglarea ascendentă a ECA2. Concomitent cu efectul hipoglicemiant AR GLP-1 manifestă proprietăţi benefice în tratamentul obezităţii şi al maladiilor cardiovasculare (liraglutida, semaglutida), cu un risc scăzut de hipoglicemie, precum şi cu o tolerabilitate bună (evenimente adverse predominant gastrointestinale). Agoniştii receptorilor GLP-1 se impun ca agenţi antidiabetici excelenţi în timpul perioadelor de pandemie de COVID-19 (pentru pacienţii cu COVID-19 bolnavi noncritici), deoarece au demonstrat eficacitate glicemică bună cu risc minim de hipoglicemie, iar terapia cu AR GLP-1 şi în combinaţie cu insulina bazală cu acţiune îndelungată a determinat o variabilitate mai mică a glucozei şi hipoglicemie(2,8,14,15).
Agoniştii receptorilor GLP-1, prin mecanismul de acţiune dependent de glucoză, prezintă un risc scăzut de hipoglicemie. Preparatele au demonstrat capacitatea de a preveni evenimentele cardiovasculare şi renale la pacienţii cu DZ. Complicaţiile renale şi miocardice sunt bine cunoscute la bolnavii cu COVID-19, în special la cei cu DZ de tip 2, şi probabil rezultă din răspunsul inflamator marcant la infecţie. La pacienţii cu DZ de tip 2, AR GLP-1 au determinat o reducere a IL-6 şi a biomarkerilor circulanţi ai afectării celulare, iar în studiile in vitro – şi o inhibare a agregării plachetare. Un studiu prospectiv de cohortă de 24 de luni la pacienţi cu DZ de tip 2 a demonstrat că tratamentul cu AR GLP-1, în raport cu metformina sau metformină + insulină, a îmbunătăţit semnificativ funcţia pulmonară, manifestată prin scăderea inflamaţiei şi acumulării de trombocite, împreună cu efecte protectoare asupra sistemului cardiovascular, renal şi respirator. În privinţa acestui aspect rămâne de văzut dacă acest lucru se traduce printr-un beneficiu clinic la pacienţii cu DZ şi COVID-19(3).
Agoniştii receptorilor GLP-1 în studiile experimentale au demonstrat proprietăţi antiinflamatoare prin blocarea activării protein-kinazei C sau a factorului nuclear‑κB (NF-κB), cu reducerea ulterioară a expresiei şi producţiei citokinelor şi chemokinelor (IL-1β, TNF-α, IL-6, VCAM-1, IFN-γ, MCP-1), care atenuează inflamaţia pulmonară, reduce producţia de citokine şi secreţia de mucus şi păstrează funcţia pulmonară. În studiile clinice s-a raportat că tratamentul cu AR GLP-1 ameliorează funcţiile respiratorii (volumul expirator forţat în 1 s, capacitatea vitală forţată, debitul expirator maximum la 75% şi 50%), indiferent de nivelul glicemiei, la pacienţii cu DZ de tip 2 fără tulburări pulmonare obstructive(2).
Agoniştii receptorilor GLP-1 sunt eficienţi în principal pentru controlul glicemiei postprandiale. Printre beneficiile AR GLP-1, s-a discutat despre utilizarea lor în tratamentul COVID-19, datorită potenţialului de modulare a sistemului renină-angiotensină pulmonar, cu preîntâmpinarea reglării descendente a ECA2 şi reducerii nivelului angiotensinei 1-7 (Ang 1-7), responsabile de dezvoltarea formelor severe de COVID-19. S-a constatat că liraglutida provoacă o creştere puternică a expresiei ECA2 în plămâni şi a nivelului de Ang 1-7 circulantă. Este necesar de reţinut că dereglările dispeptice (greaţă intensă, vomă) pot prezenta un posibil risc de deshidratare, care ar putea duce la leziuni renale acute sau la agravarea şocului septic la pacienţii cu forma critică de COVID-19. Din aceste considerente, utilizarea AR GLP-1 ar trebui probabil evitată în tratamentul pacienţilor spitalizaţi cu COVID-19. Efectul AR GLP-1 la pacienţii cu COVID-19 necesită studii clinice pentru a stabili eficacitatea şi siguranţa lor în COVID-19(4,8).
Inhibitorii cotransportorului sodiu-glucoză-2 (SGLT2)
Inhibitorii cotransportorului de sodiu-glucoză-2 (SGLT2), gliflozinele (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina), manifestă eficacitate glicemică similară, cu diferenţe în ceea ce priveşte selectivitatea faţă de SGLT2. Gliflozinele inhibă reabsorbţia renală a glucozei şi cresc excreţia urinară de glucoză într-o manieră independentă de insulină, fiind bine-venite pentru pacienţii cu un declin marcant al funcţiei celulelor β din cauza proceselor autoimune şi inflamatorii, inclusiv pancreatită, fibroză chistică şi hemocromatoză(8).
Studiile preclinice şi clinice au arătat că inhibitorii SGLT-2 posedă proprietăţi antiinflamatorii care pot influenţa favorabil hipoxia tisulară, stresul oxidativ, autofagia, precum şi metabolismul energetic, care pot avea un impact pozitiv asupra furtunii citokinice asociate cu COVID-19. Dapagliflozina a demonstrat că reduce semnificativ lactacidoza având potenţialul de a inversa echilibrul acido-bazic intracelular în timpul hipoxiei. Inhibitorii SGLT-2 au demonstrat un beneficiu cardiorenal semnificativ la pacienţii cu DZ de tip 2 cu risc cardiovascular ridicat şi boli renale(14).
În cele mai recente ghiduri, inhibitorii SGLT2 au fost propuşi ca a doua linie de tratament după metformină pentru gestionarea DZ de tip 2. Utilizarea inhibitorilor SGLT2 la pacienţii cu COVID-19 a stârnit discuţii contradictorii referitoare la beneficiile potenţiale. S-a raportat că inhibitorii SGLT2 cresc expresia ECA2 în rinichi şi, prin urmare, pot creşte susceptibilitatea la infecţia cu SARS-CoV-2. Un grup de experţi a recomandat evitarea inhibitorilor SGLT2 la pacienţii cu DZ şi COVID-19 moderat-sever, din cauza riscului de deshidratare şi cetoacidoză diabetică euglicemică. În acelaşi timp, în condiţii experimentale, inhibitorii SGLT2 au exercitat un efect antiinflamator, ceea ce ar putea avea un impact favorabil asupra furtunii citokinice în COVID-19. În mod contrar, s-a demonstrat că dapagliflozina reduce lactacidoza şi inversează echilibrul acido-bazic intracelular în timpul hipoxiei, contribuind astfel la prevenirea leziunilor celulare în timpul furtunii citokinice la pacienţii cu DZ şi COVID-19. În pofida beneficiilor inhibitorilor SGLT2, aceştia ar trebui reevaluaţi cu atenţie în cazul temperaturii corpului >38,5°C sau în caz de aport alimentar insuficient cu deficit de insulină(7,8,15).
Inhibitorii SGLT2 au redus riscul leziunilor cardiovasculare şi renale la pacienţii cu DZ de tip 2 pe fondul probabilităţii mici a hipoglicemiei. Mai multe studii au raportat că inhibitorii SGLT2 (empagliflozina, dapagliflozina) manifestă proprietăţi antiinflamatorii şi antiagregante, relevate prin diminuarea nivelului PCR, TNF-α şi IL-6 şi a activităţii trombocitelor. Studiul clinic randomizat în curs examinează efectele dapagliflozinei asupra progresiei COVID-19 la pacienţii cu DZ de tip 2, hipertensiune arterială, boli renale şi cardiovasculare cronice. Concomitent, alături de potenţialele beneficii ale inhibitorilor SGLT2, se analizează siguranţa preparatelor la pacienţii cu DZ şi COVID-19 în privinţa efectelor adverse, precum deshidratarea şi cetoacidoza diabetică euglicemică, care pot limita utilizarea(3,4,7).
Beneficiile potenţiale ale inhibitorilor SGLT2 se reduc la ameliorarea inflamaţiei, stresului oxidativ şi a hipoxiei ţesuturilor, prin reglarea descendentă a adipokinelor şi citokinelor. Inhibitorii SGLT2, prin creşterea hematocritului şi reducerea selectivă a volumului interstiţial, fără modificări semnificative ale volumului de sânge, pot manifesta efecte benefice la pacienţii cu COVID-19 care dezvoltă edem pulmonar interstiţial. Efectul protector potenţial al dapagliflozinei, relevat prin reducerea nivelului de lactat şi prevenirea scăderii pH-ului citozolic, poate fi mediat de mai multe mecanisme: reducerea consumului de oxigen în ţesuturi; promovarea metabolismului aerob al glucozei; micşorarea producerii de lactat, cu o creştere a excreţiei urinare de lactat şi o reducere a activării simporter lactat/H+. Raţionalitatea utilizării inhibitorilor SGLT2 la pacienţii cu DZ şi COVID-19 poate fi argumentată prin reducerea nivelului lactatului, care inhibă activitatea schimbului de Na+/H+ şi activează calea alternativă a SRAA prin activarea ECA2 şi reduce nivelul citokinelor proinflamatorii. Pe baza analizei datelor despre beneficiile şi dezavantajele inhibitorilor SGLT2 pentru pacienţii cu DZ care dezvoltă COVID-19, se poate concluziona că tratamentul trebuie continuat sau introdus pentru un control adecvat al glucozei la pacienţii cu DZ şi COVID-19 uşor sau asimptomatic şi ar trebui întrerupt la pacienţi cu COVID-19 mai sever, care prezintă simptome de scădere a poftei de mâncare, deshidratare, hipoxie, sepsis şi insuficienţă renală(6).
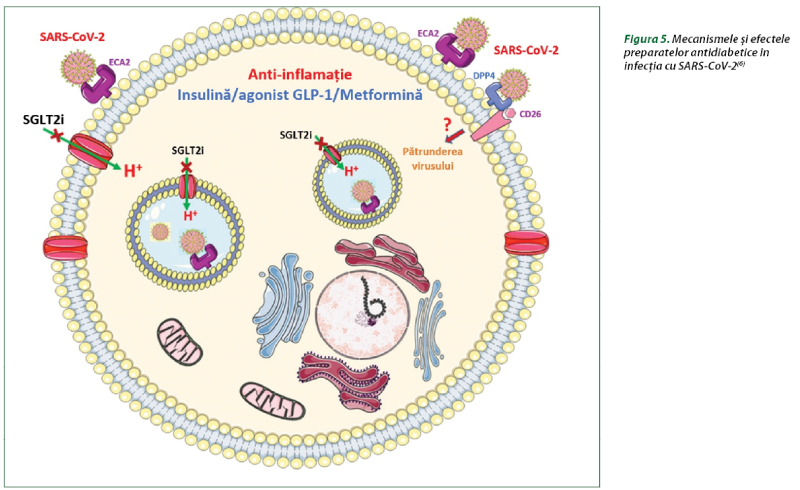
Pe baza analizei mecanismelor şi efectelor metforminei, sulfonilureicelor, AR GLP-1, inhibitorilor DPP-4 şi inhibitorilor SGLT2, se poate estima beneficiul la pacienţii cu DZ de tip 2 şi COVID-19 (figura 5), date care necesită a fi confirmate în studii clinice randomizate(6).
Tiazolidinedionele (TZD, pioglitazona)
Utilizarea TZD la pacienţii cu DZ şi COVID-19 a trezit iniţial semne de întrebare, din cauza creşterii expresiei ECA2 şi, respectiv, a sensibilităţii la SARS-CoV-2. În acelaşi timp, s-a recomandat întreruperea utilizării TZD, ca urmare a creşterii masei corporale, retenţiei de lichide şi a agravării insuficienţei cardiace. Ulterior, în baza datelor relatate până la pandemie despre efectele antiinflamatorii, antioxidante şi antifibrotice, s-a estimat că pioglitazona poate avea mai multe beneficii potenţiale şi ar putea fi continuată la persoanele cu COVID-19 moderat. S-a demonstrat că pioglitazona scade eliberarea diferitelor citokine proinflamatorii din monocite şi macrofage şi stopează furtuna citokinică prin blocarea caspazei 9. Prin simularea computerizată s-a demonstrat că pioglitazona influenţează proteaza asemănătoare 3-chimotripsinei şi poate inhiba sinteza şi replicarea ARN-ului SARS-CoV-2. În contextul celor relatate, sunt necesare studii clinice pentru a optimiza raportul risc-beneficiu al utilizării pioglitazonei la pacienţii cu COVID-19(7,14,15).
Tiazolidinidonele ar putea avea beneficii, prin scăderea evenimentelor cardiovasculare la pacienţii cu DZ şi boli macrovasculare cu risc scăzut de hipoglicemie. S-a demonstrat că TZD reduc proteinele de coagulare, markerii inflamaţiei şi activarea trombocitelor. S-a constatat că la persoanele cu rezistenţă la insulină administrarea de pioglitazonă a determinat reducerea nivelului TNF-α şi IL-6, inclusiv în lavajul bronşic la bolnavii cu leziuni pulmonare. Mai multe studii clinice au arătat că pioglitazona produce o reducere semnificativă a citokinelor proinflamatorii (IL-1β, IL-6, IL-8, TNF-α) şi a altor markeri ai rezistenţei la insulină. Efectele antiinflamatoare şi antiagregante promiţătoare ale TZD necesită a fi demonstrate la pacienţii cu DZ şi COVID-19(3,5,14).
Pioglitazona a fost sugerată recent ca o opţiune potenţială de tratament pentru pacienţii cu COVID-19 datorită dovezilor in vitro care indică faptul că limfocitele T, celulele dendritice şi macrofagele exprimă receptori gama activaţi de proliferatorul peroxizomilor (PPAR-γ). S-a observat că activarea PPAR-γ prin pioglitazonă ar putea inhiba calea factorului nuclear inflamator NF-κB şi a semnalizării protein‑kinazei activate de mitogen pentru producerea de citokine şi, prin urmare, ar putea atenua sindromul furtunii citokinice asociat cu COVID-19. Efectul benefic al pioglitazonei necesită validări preclinice şi clinice pentru a face recomandări privind utilizarea la pacienţii cu COVID-19. Tiazolidinedionele, din cauza riscului potenţial de edeme periferice, pot necesita suspendare temporară la pacienţii spitalizaţi cu COVID-19 şi DZ de tip 2(4,7).
Inhibitorii de alfa-glucozidază
Inhibitorii alfa-glucozidazei (acarboză, miglitol) sunt utilizaţi rar în condiţii de staţionar. Folosirea lor la pacienţii cu COVID-19, în special în secţiile de terapie intensivă, va fi limitată, deoarece preparatele inhibă absorbţia intestinală a carbohidraţilor, efecte pozitive numai la pacienţii care menţin un regim alimentar adecvat(4).
Insulina
Studiile limitate referitoare la influenţa insulinei asupra complicaţiilor cauzate de COVID-19 au demonstrat date contradictorii în privinţa mecanismelor responsabile de complicaţiile legate de COVID-19, inclusiv durata spitalizării, utilizarea ventilaţiei mecanice sau mortalitatea. Rezultatele raportate nu relevă dacă aceste constatări sunt efectele directe ale insulinei sau rezultatul caracteristicilor legate de pacient sau alţi factori. Insulina joacă un rol esenţial în obţinerea unui control glicemic optim, iar menţinerea nivelului adecvat şi evitarea fluctuaţiilor glicemiei au fost stabilite ca piatră de temelie a conduitei pacienţilor cu DZ şi COVID-19. Majoritatea pacienţilor cu DZ sunt transferaţi la terapia cu insulină la internarea în spital pentru COVID-19, pentru uşurarea dozării, titrarea şi siguranţa relativă, alături de potenţa şi predictibilitatea reducerii glicemiei(3).
Insulina la pacienţii cu DZ şi COVID-19, spitalizaţi în stări critice, a jucat un rol important în procesul inflamator (a redus markerii inflamaţiei) şi al coagulării. Terapia cu insulină subcutanată a fost o strategie utilă pentru tratamentul cetoacidozei diabetice necomplicate în timpul pandemiei. Un studiu observaţional a relevat necesităţi de insulină semnificativ mai mari în rândul pacienţilor cu COVID-19, care ar putea fi atribuită disfuncţiei celulelor beta induse de SARS-CoV‑2(15).
Insulina a diminuat severitatea bolii şi ratele de mortalitate la pacienţii cu DZ şi COVID-19. Efectele benefice ale insulinei ar putea fi corelate cu efectele sale antiinflamatorii şi imunomodulatoare şi cu realizarea controlului glicemic adecvat. În acelaşi timp, efectul inhibitor al insulinei asupra domeniului de dezintegrină şi metaloproteinază al proteinei-17, care facilitează scindarea proteolitică şi eliminarea ectodomeniului activ al ECA2, ar putea creşte disponibilitatea şi activitatea ECA2 pentru infecţia cu SARS-CoV-2 şi poate explica parţial agravarea tabloului clinic şi prognosticul nefavorabil la pacienţii cu COVID-19(12).
Pacienţii cu DZ de tip 1 necesită terapie cu insulină în timpul spitalizării pentru COVID-19, deoarece se pot constata fluctuaţii ale glicemiei. Insulina se administrează, de regulă, subcutanat sau intravenos la bolnavii în stare critică sau cu hiperglicemie marcantă. Pentru administrarea subcutanată se poate recomanda o insulină cu acţiune intermediară (insulina protamină neutră umană – NPH) sau un analog de insulină cu acţiune lungă (bazală – glargin, detemir, degludec), care poate fi combinată cu o insulină cu acţiune rapidă înainte de mese (lispro, aspart, glulizină) la pacienţii cu regim alimentar stabil (regim bazal – bolus). Insulina umană cu acţiune scurtă se utilizează mai rar, deşi nu există studii care să compare eficacitatea şi siguranţa acesteia cu cele ale analogilor mai costisitori cu acţiune rapidă. Dozele variabile de insulină cu acţiune rapidă pot fi adăugate înaintea mesei la pacienţii trataţi cu regim bazal – bolus pentru a corecta oscilaţiile de glucoză. Doza de insulină de corecţie trebuie individualizată pe baza caracteristicilor pacientului, cum ar fi controlul glicemic anterior, necesarul anterior de insulină şi, dacă este posibil, conţinutul de carbohidraţi al meselor(4).
Majoritatea pacienţilor cu COVID-19 şi DZ de tip 1 din secţii medicale standard pot fi trataţi cu insulină administrată subcutanat. În anumite circumstanţe, la pacienţii cu hiperglicemie marcantă (între 16,7 şi 19,4 mmol/L) şi la pacienţii trataţi în secţiile de terapie intensivă, se preferă fercvent o perfuzie intravenoasă cu insulină (insulină regular umană în soluţie). Există însă puţine dovezi care să sugereze că insulina intravenoasă este superioară insulinei subcutanate. Terapia cu insulină bazală subcutanată poate să fie continuată concomitent cu perfuzia intravenoasă datorită perioadei de înjumătăţire scurte a insulinei regular, pentru ca persoanele să aibă cel puţin o cantitate mică de insulină circulantă în orice moment, ceea ce va creşte semnificativ probabilitatea de a menţine un control optim al glicemiei(4).
Terapia cu insulină trebuie continuată la toţi pacienţii cu DZ de tip 2 şi COVID-19, care primesc deja insulină înainte de spitalizare, pentru a menţine un nivel bazal adecvat de insulină circulantă şi a evita hiperglicemiile severe sau chiar comele hipoglicemice. Necesarul de insulină poate fi mai mare decât de obicei din cauza factorilor de stres din COVID-19. Un regim bazal – bolus similar celui recomandat pentru pacienţii cu DZ de tip 1 poate fi utilizat pentru pacienţii trataţi în secţii medicale, care urmează un regim alimentar obişnuit. Diferite regimuri bazale – bolus sunt la fel de eficiente la pacienţii spitalizaţi când dozele de insulină sunt titrate pentru a atinge obiectivele glicemice. Un studiu care a comparat regimul insulină detemir/aspart versus insulină NPH/regular la pacienţii spitalizaţi (non-COVID-19) nu a constatat nicio diferenţă în controlul glicemic sau în frecvenţa hipoglicemiei între cele două regimuri(4).
Pacienţii cu COVID-19 trataţi cu formulări de insulină mai concentrate (insulina simplă cu 500 de unităţi/ml) la domiciliu pot continua aceste formulări, dacă acestea sunt disponibile în spital. Deoarece concentraţia mare de insulină întârzie absorbţia, profilul farmacologic al insulinei U-500 obişnuit este foarte similar cu cel al insulinei U-100. Astfel, dacă insulina simplă U-500 nu este disponibilă, poate fi utilizată insulina U-100 NPH. Erorile la administrarea insulinei concentrate sunt frecvente, iar comunicarea atentă între pacienţi, medici, personalul de asistenţă medicală şi farmacie este imperativă, pentru a asigura o dozare adecvată, în special pe fondul pandemiei de COVID-19, unde poate exista o lipsă de personal(4).
Terapia cu insulină este preferată pentru gestionarea hiperglicemiei la pacienţii spitalizaţi cu COVID-19 şi DZ de tip 2 care primesc concomitent antidiabetice orale. Pacienţii care, în condiţii de ambulatoriu, controlează adecvat diabetul cu preparate antidiabetice orale sunt relativ stabili şi se alimentează normal, îşi pot continua tratamentul cu medicamentele prescrise. La bolnavii cu un consum redus de alimente, hiperglicemia este încă probabilă şi ar trebui să se anticipeze că majoritatea pacienţilor spitalizaţi cu COVID-19 şi DZ de tip 2 ar putea avea nevoie de terapie cu insulină în anumite momente ale spitalizării. La unii pacienţi cu COVID-19 pot exista contraindicaţii specifice pentru utilizarea în continuare a antidiabeticelor orale care vor necesita suspendarea acestora. Hiperglicemia excesivă (>10 mmol/L) la pacienţii trataţi anterior cu antidiabetice orale sau cu dietă poate necesita utilizarea subcutanată pe un timp scurt a insulinei cu acţiune intermitentă (doze ajustate la fiecare 6 ore) sau cu acţiune rapidă (doze ajustate la fiecare 4-6 ore), cu condiţia ca glicemia să nu fie marcant crescută şi pacientul să răspundă bine la insulină. La pacienţii cu hiperglicemie persistentă poate fi preferată o schemă de insulină similară pentru pacienţii spitalizaţi cu DZ de tip 1 cu includerea insulinei bazale(4).
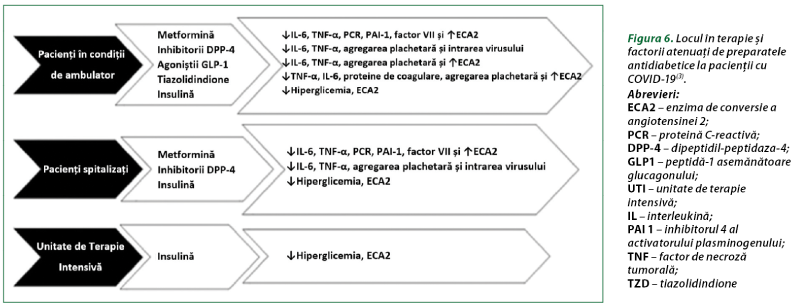
Toţi pacienţii cu DZ şi COVID-19 trebuie să continue regimurile de administrare a antidiabeticelor orale şi preparatelor insulinei. Ghidurile practice nu oferă în prezent recomandări privind utilizarea preparatelor antidiabetice la pacienţi cu DZ şi COVID-19. Unele date sunt oferite de opiniile experţilor, iar o cunoaştere suplimentară a efectelor antidiabeticelor asupra COVID-19 ar permite clinicienilor să evalueze dovezile şi să echilibreze profilurile de siguranţă şi eficacitate, pentru a lua cele mai bune decizii de conduită a pacientului. Consideraţiile-cheie pentru continuarea utilizării şi selectarea preparatelor antidiabetice ar trebui să includă stabilitatea clinică, siguranţa medicaţiei şi efectele potenţiale de protecţie în COVID-19. Stabilitatea clinică la pacienţii cu DZ infectaţi cu SARS-CoV-2 poate fi obţinută în funcţie de aflarea lor în ambulatoriu, internaţi în staţionar şi/sau în secţiile de terapie intensivă. În figura 6 este prezentat un rezumat al utilizării medicamentelor sugerate în fiecare dintre aceste situaţii pe baza beneficiilor corespunzătoare propuse în COVID-19(3).
Pacienţii cu DZ şi COVID-19 în condiţii de ambulatoriu, stabili din punct de vedere clinic, ar trebui să fie menţinuţi şi/sau optimizaţi cu privire la regimurile de terapie cu antidiabetice, pentru a reduce riscurile de complicaţii severe în timpul infecţiei cu SARS-CoV-2. Beneficiile-cheie ale antidiabeticelor raportate în literatură includ efectele lor antiinflamatorii, anticoagulante, antiagregante, imunomodulatoare şi influenţarea enzimelor/receptorilor. Inhibitorii DPP-4 sunt consideraţi cei mai promiţători în COVID-19, ţinând cont de beneficiile controlului glicemic şi de profilul de siguranţă favorabil. Inhibitorii DPP-4 sunt foarte bine toleraţi, cu o predispoziţie mai mică pentru efecte secundare şi au fost recomandaţi în diferite stadii ale stabilităţii clinice. Metformina este o opţiune promiţătoare, pe baza dovezilor, în tratarea DZ asociat cu COVID-19, în pofida unui risc mic de lactacidoză. Datele recente au raportat rezultate favorabile la pacienţii cu COVID-19 şi DZ în condiţii de ambulatoriu şi în spital, dar trebuie evitată la bolnavii în terapie intensivă, care se confruntă cu deshidratare, hipoxie şi cu funcţie renală compromisă. Agoniştii receptorilor GLP-1 au demonstrat beneficii la pacienţii cu risc ridicat în COVID-19 şi sunt consideraţi siguri la pacienţii stabili clinic. Aceşti agenţi trebuie evitaţi la pacienţii care se confruntă cu deshidratare sau sunt instabili clinic. Tiazolidindionele nu au probleme specifice de siguranţă în COVID-19, iar beneficiile propuse în COVID-19 nu sunt în prezent susţinute de rapoarte clinice. Este necesar de remarcat că DZ însuşi şi anumite antidiabetice au determinat creşterea expresiei celulare a ECA2. Tratamentele care cresc expresia ECA2 (metformina, GLP-1 RAs şi TZD) pot reduce leziunile pulmonare şi SDRA, considerată una dintre cele mai grave complicaţii ale COVID-19. În continuare sunt necesare studii clinice prospective şi randomizate care să demonstreze raţionalitatea utilizării lor la pacienţii cu DZ şi COVID-19(3).
Pacienţii spitalizaţi cu afecţiuni noncritice trebuie evaluaţi pentru contraindicaţii şi efecte adverse semnificative clinic, care pot fi exacerbate în COVID-19. Pacienţii stabili clinic pot fi menţinuţi pe schemele de tratament de stabilizare a glicemiei. După cum s-a menţionat anterior, s-ar putea acorda preferinţă inhibitorilor DPP-4 şi metforminei datorită beneficiilor propuse care se extind dincolo de controlul glicemic. Medicamentele care pot determina deshidratare, cetoacidoză sau lactacidoză, anorexie sau hipoglicemie trebuie monitorizate minuţios şi continuarea administrării lor în formele severe trebuie evaluată cu atenţie. Inhibitorii SGLT-2 pot provoca deshidratare şi cetoacedoză euglicemiantă, iar COVID-19 poate creşte riscul acestor complicaţii. La internarea în terapia intensivă, antidiabeticele orale trebuie suspendate şi iniţiată terapia cu insulină(3).
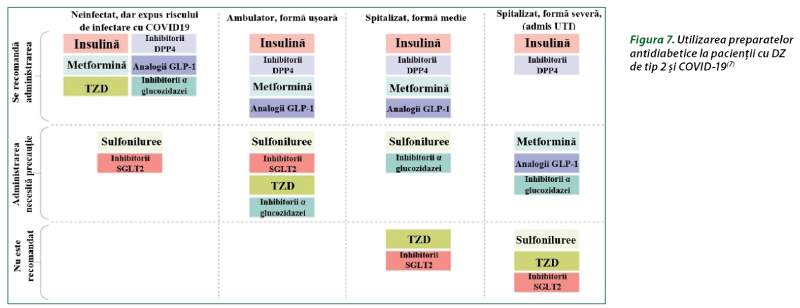
Pe baza datelor din studiile fundamentale anterioare şi clinice, precum şi a celor mai recente informaţii disponibile, se propun câteva linii directoare referitoare la utilizarea preparatelor antidiabetice la pacienţii cu DZ de tip 2 şi COVID-19, în funcţie de starea clinică a COVID-19, care se bazează pe scala de progresie clinică a OMS (figura 7). La pacienţii cu COVID-19 se poate constata o hiperglicemie acută (cauzată de rezistenţa la insulină asociată inflamaţiei) şi necesitatea de a asigura un control glicemic adecvat, eficient şi rapid. Selectarea antidiabeticelor ar trebui să fie ghidată în principal de presupusa lor eficacitate şi de efectele adverse potenţiale sau reale. La pacienţii cu simptome uşoare până la moderate, se recomandă inhibitorii DPP-4 şi AR GLP-1, care şi-au dovedit eficacitatea în reducerea nivelului glucozei în condiţii de staţionar şi ambulatoriu. În acelaşi timp, nu sunt date suficiente pentru a susţine utilizarea acestor grupe în locul insulinei la pacienţii cu DZ de tip 2 şi formă critică de COVID-19, mai ales dacă terapia trebuie iniţiată în condiţii de boală severă. Acţiunea antiinflamatoare a inhibitorilor DPP-4 şi AR GLP-1 sugerează necesitatea studiilor clinice la pacienţii cu DZ de tip 2 şi COVID-19(7).
Insulina este recomandată în principal pacienţilor cu DZ infectaţi cu SARS-CoV-2 în stări critice. Perfuzia de insulină a asigurat un control optim al glicemiei şi a redus semnificativ nivelul citokinelor inflamatorii, D-dimerului şi severitatea COVID-19. Metformina, datorită proprietăţilor antiinflamatorii prin reducerea nivelului biomarkerilor inflamaţiei la persoanele cu DZ de tip 2, poate fi utilizată la pacienţii cu DZ de tip 2 neinfectaţi sau la pacienţii din ambulatoriu cu forme uşoare de COVID-19, dar nu este recomandată la bolnavii cu boală critică. Sulfonilureicele pot fi utilizate la pacienţii cu DZ de tip 2 neinfectaţi, dar nu se recomandată la pacienţii cu COVID-19 sever, deoarece pot provoca hipoglicemie.
Tiazolidindionele au potenţialul de a media efecte protectoare asupra sistemului cardiovascular, dar din cauza creşterii în greutate şi a edemelor pot agrava insuficienţa cardiacă şi nu sunt recomandate la pacienţii cu COVID-19 sever. Inhibitorii DPP-4, datorită eficacităţii şi inofensivităţii acceptabile, pot fi recomandaţi pentru utilizarea la majoritatea pacienţilor cu un spectru larg de severitate a COVID-19.
Agoniştii receptorilor GLP-1, în baza priorităţilor descrise, ar putea fi o opţiune ideală pentru tratamentul pacienţilor cu DZ de tip 2 cu risc de boli cardiovasculare şi renale. Inhibitorii SGLT2, din cauza inducerii diurezei osmotice şi potenţialului de deshidratare, se consideră un factor de risc pentru leziunile renale acute şi cetoacidoză, de aceea nu se recomandă la pacienţii aflaţi în secţiile de terapie intensivă(7).
Pentru tratamentul cetoacidozei la pacienţii cu COVID-19 s-au făcut recomandări specifice, cu accent pe regimurile de insulină subcutanată. Monitorizarea glicemiei şi a compuşilor cetonici este obligatorie la pacienţii cu COVID-19 şi hiperglicemie. Pentru gestionarea echilibrului hidroelectrolitic la pacienţii cu DZ şi COVID-19 nu sunt recomandări specifice, de aceea managementul acestuia la pacienţii cu COVID-19 şi funcţie respiratorie afectată se realizează conform recomandărilor generale(7).
Utilizarea a glucocorticoizilor (GC) sistemici, în special a dexametazonei, la pacienţii cu COVID-19, după actualizările recente ale Organizaţiei Mondiale a Sănătăţii, a fost argumentată în ghidul de tratament al pacienţilor cu forme severe sau critice de boală, datorită beneficiilor sale asupra mortalităţii. Hiperglicemia, considerată un predictor independent al unui prognostic nefavorabil la pacienţii spitalizaţi cu DZ şi COVID-19, reprezintă o precauţie la administrarea GC, care ar putea provduce sau agrava hiperglicemia, care poate anula beneficiile acestora. Din aceste considerente, este important pentru clinicienii care utilizează GC la pacienţii cu COVID-19 de a prevedea în managementul terapeutic măsuri pentru a preveni hiperglicemia.
Gestionarea hiperglicemiei la administrarea GC implică utilizarea preparatelor insulinei cu un profil de scădere a glucozei care coincide cu profilul glicemic al GC, care este strâns legat de durata de acţiune. Efectul glicemic al dexametazonei, GC cu acţiune îndelungată, poate dura până la 48 de ore, astfel încât acoperirea cu insulină glargină sau insulină degludec cu efect de scădere a glicemiei care durează mai mult de 24 de ore şi/sau asociată cu insulină de durată rapidă/scurtă poate fi adecvată la pacienţii cu COVID-19 care nu au primit insulină şi care dezvoltă hiperglicemie persistentă după administrarea dexametazonei. Se poate lua în considerare protamine-insulina neutră umană (NPH) de două ori pe zi sau insulina detemir, dacă este necesară o mai mare flexibilitate, cu ajustarea dozei. Insulina de durată rapidă/scurtă trebuie administrată împreună cu GC şi doza iniţială trebuie titrată în funcţie de doza de dexametazonă administrată. Având în vedere schema recomandată de dexametazonă de 6 mg o dată pe zi la pacienţii gravi cu COVID-19, doza corespunzătoare de insulină va fi de 0,3 unităţi/kg. Cu toate acestea, la pacienţii cu COVID-19 care primesc deja insulină bazală sau insulină bazală – bolus, doza iniţială de insulină bazală poate fi crescută cu 20-40%, în funcţie de răspuns, dacă se detectează hiperglicemie persistentă la administrarea dexametazonei. Pe de altă parte, pacienţilor trataţi cu insulină premixată de două ori pe zi cu hiperglicemie persistentă la administrarea de dexametazonă li se poate creşte doza de dimineaţă cu 20-40%, deşi ar trebui să existe şi un prag scăzut pentru a trece la un regim de insulină bazală – bolus pentru a permite ajustarea dozei pentru o flexibilitate mai adecvată(4).
Concluzii
Hiperglicemia reprezintă un factor predictiv nefavorabil nu numai la bolnavii cu COVID-19 şi DZ, ci şi la nondiabetici, astfel încât necesită o monitorizare minuţioasă pentru prevenirea complicaţiilor infecţiei cu SARS-CoV-2.
Mecanismele patogenetice ale DZ de tip 2 şi ale infecţiei cu SARS-CoV-2 se suprapun, determinând creşterea severităţii, complicaţiilor şi letalităţii maladiei.
Preparatele antidiabetice orale, concomitent cu efectul hipoglicemic, manifestă proprietăţi antiinflamatorii, antioxidante, antifibrotice, imunomodulatoare şi antiagregante, care pot contribui la evoluţia benefică a DZ şi a COVID-19.
Reacţiile adverse caracteristice grupelor de antidiabetice orale, precum hipoglicemia (sulfonilureice, meglitinide, insulina), lactacidoza (metformina), cetoacidoza diabetică euglicemică (agoniştii GLP-1, inhibitorii SGT2), dereglările dispeptice cu deshidratare (inhibitorii DPP-4), edemele periferice, pancreatita (tiazolidindionele), risc de tromboembolism (inhibitorii DPP-4), necesită o monitorizare minuţioasă şi/sau elucidarea prealabilă a predispoziţiei la ele.
Consideraţiile-cheie pentru continuarea utilizării şi selectarea preparatelor antidiabetice ar trebui să includă stabilitatea clinică, siguranţa medicaţiei şi efectele potenţiale de protecţie în COVID-19.
Controlul adecvat al glicemiei constituie criteriul de bază în conduita pacienţilor cu DZ de tip 2 şi COVID-19, care poate fi realizat la nivel de ambulatoriu, internare în secţiile terapeutice şi/sau terapie intensivă, prin preparatele insulinei (durată ultrascurtă, scurtă, intermediară, bazale) şi inhibitorii DPP-4.
Biguanidele şi agoniştii receptorilor GLP-1 pot fi utilizaţi la pacienţii cu DZ de tip 2 şi COVID-19 cu forme uşoare şi moderate, iar sulfoniureicele, tiazolidindionele, inhibitorii alfa-glicozidazei şi inhibitorii SGLT2 sunt contraindicaţi sau trebuie utilizaţi cu precauţie.
Bibliografie
-
Al-Kuraishy HM, Al-Gareeb AI, Alblihed M, et al. COVID-19 and Risk of Acute Ischemic Stroke and Acute Lung Injury in Patients With Type II Diabetes Mellitus: The Anti-inflammatory Role of Metformin. Front Med (Lausanne). 2021 Feb 19;8:644295. doi: 10.3389/fmed.2021.644295.
-
Belančić A, Kresović A, Troskot Dijan M. Glucagon-like peptide-1 receptor agonists in the era of COVID-19: Friend or foe? Clin Obes. 2021 Apr;11(2):e12439. doi: 10.1111/cob.12439.
-
Berlie HD, Kale-Pradhan PB, Orzechowski T, Jaber LA. Mechanisms and Potential Roles of Glucose-Lowering Agents in COVID-19: A Review. Ann Pharmacother. 2021 Mar 4:1060028021999473. doi: 10.1177/1060028021999473.
-
Hasan SS, Kow CS, Bain A, et al. Pharmacotherapeutic considerations for the management of diabetes mellitus among hospitalized COVID-19 patients. Expert Opin Pharmacother. 2021 Feb;22(2):229-240. doi: 10.1080/14656566.2020.1837114.
-
Katsiki N, Ferrannini E. Anti-inflammatory properties of antidiabetic drugs: A “promised land” in the COVID-19 era? J Diabetes Complications. 2020 Dec;34(12):107723. doi: 10.1016/j.jdiacomp.2020.107723.
-
Liao Y-H, Zheng J-Q, Zheng C-M, et al. Novel Molecular Evidence Related to COVID-19 in Patients with Diabetes Mellitus. J. Clin. Med. 2020, 9, 3962. doi.org/10.3390/jcm9123962.
-
Lim S, Bae JH, Kwon HS, et al. COVID-19 and diabetes mellitus: from pathophysiology to clinical management. Nat Rev Endocrinol. 2021; 17, 11–30. doi.org/10.1038/s41574-020-00435-4.
-
Mirabelli M, Chiefari E, Puccio L, et al. Potential Benefits and Harms of Novel Antidiabetic Drugs During COVID-19 Crisis. Int J Environ Res Public Health. 2020 May 22;17(10):3664. doi: 10.3390/ijerph17103664.
-
Muniyappa R, Gubbi S. COVID‑19 pandemic, coronaviruses, and diabetes mellitus. Am J Physiol Endocrinol Metab. 2020; 318: E736–E741. doi.org/10.1152/ajpendo.00124.2020.
-
Qu H, Zheng Y, Wang Y et al. The potential effects of clinical antidiabetic agents on SARS-CoV-2. J Diabetes. 2021 Mar;13(3):243-252. doi: 10.1111/1753-0407.13135.
-
Pal R, Banerjee M, Mukherjee S, et al. Dipeptidyl peptidase-4 inhibitor use and mortality in COVID-19 patients with diabetes mellitus: an updated systematic review and meta-analysis. Ther Adv Endocrinol Metab. 2021 Feb 20;12:2042018821996482. doi: 10.1177/2042018821996482.
-
Samuel SM, Varghese E, Büsselberg D. Therapeutic Potential of Metformin in COVID-19: Reasoning for Its Protective Role. Trends Microbiol. 2021 Mar 14; S0966-842X(21)00063-9. doi: 10.1016/j.tim.2021.03.004.
-
Santos A, Magro DO, Evangelista-Poderoso R, Saad MJA. Diabetes, obesity, and insulin resistance in COVID-19: molecular interrelationship and therapeutic implications. Diabetol Metab Syndr. 2021 Mar 1;13(1):23. doi: 10.1186/s13098-021-00639-2.
-
Singh AK, Singh R, Saboo B, Misra A. Non-insulin anti-diabetic agents in patients with type 2 diabetes and COVID-19: A Critical Appraisal of Literature. Diabetes Metab Syndr. 2021 Jan-Feb;15(1):159-167. doi: 10.1016/j.dsx.2020.12.026.
-
Sun B, Huang S, Zhou J. Perspectives of Antidiabetic Drugs in Diabetes With Coronavirus Infections. Front Pharmacol. 2021 Jan 29;11:592439. doi: 10.3389/fphar.2020.592439.
-
Ugwueze CV, Ezeokpo BC, Nnolim BI, et al. COVID-19 and Diabetes Mellitus: The Link and Clinical Implications. Dubai Diabetes Endocrinol J. 2020; 26: 69–77 DOI: 10.1159/000511354.
Articole din ediţiile anterioare
Din secretele longevităţii… nutraceuticele – partea a IV-a Afecţiunile virale. Pandemia de coronaviroză (COVID-19)
Seria articolelor „Din secretele longevităţii… nutraceuticele” abordează în partea a IV-a o problemă de actualitate: bolile virale, insistând pe me...
Nutriţia şi stilul de viaţă sănătos, în contextul pandemiei de COVID-19
Un stil de viaţă sănătos trebuie să fie bazat pe următoarele aspecte: o alimentaţie sănătoasă şi echilibrată, însoţită de obiceiul de a practica ac...
Asprosin și glicerol 3-fosfat fosfataza, noi ţinte terapeutice în diabetul zaharat de tip 2
Asprosin și glicerol 3-fosfat fosfataza, noi ţinte terapeutice în diabetul zaharat de tip 2
Vaccinul BCG şi infecţia cu SARS-CoV-2
Până la elaborarea unui vaccin specific, pandemia de COVID-19, determinată de noul tip de coronavirus, SARS-CoV-2, necesită intervenţii terapeutice...