Cardiovascular diseases represent an important cause of mortality and morbidity in the world, and antiplatelet therapy is a cornerstone in their prophylaxis and treatment. Clopidogrel and acetylsalicylic acid are the most widely used antiplatelet agents as monotherapy or combination therapy for the secondary prophylaxis of major cardiovascular events. Recent studies have shown that some patients develop thrombotic complications during the treatment with clopidogrel and acetylsalicylic acid, due to the phenomenon of resistance. For these reasons, it is necessary to highlight the causes and mechanisms of resistance in order to develop an optimal management. Antiplatelet therapy requires a personalized approach to the patient, with the evaluation of genetic and nongenetic factors that may alter the response to clopidogrel and acetylsalicylic acid therapy.
Rezistenţa la tratamentul cu clopidogrel şi acid acetilsalicilic
Resistance to clopidogrel and acetylsalicylic acid therapy
First published: 27 noiembrie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.215.6.2023.8976
Abstract
Rezumat
Patologiile cardiovasculare reprezintă o cauză importantă de mortalitate şi morbiditate în lume, iar terapia antiagregantă constituie o verigă importantă în profilaxia şi tratamentul acestora. Clopidogrelul şi acidul acetilsalicilic sunt cele mai utilizate antiagregante ca monoterapie sau terapie combinată pentru profilaxia secundară a evenimentelor cardiovasculare majore. Studiile recente au arătat că unii pacienţi dezvoltă complicaţii trombotice sub tratamentul cu clopidogrel şi acid acetilsalicilic, din cauza fenomenului de rezistenţă. Din aceste considerente, este necesar să evidenţiem cauzele şi mecanismele rezistenţei, pentru elaborarea unui management optim. Terapia antiagregantă necesită o abordare personalizată a pacientului, cu evaluarea factorilor genetici şi nongenetici care pot modifica răspunsul la terapia cu clopidogrel şi acid acetilsalicilic.
Introducere
Activarea şi agregarea plachetară joacă un rol important în dezvoltarea evenimentelor ischemice în cazul sindromului coronarian acut (SCA) şi al intervenţiei coronariene percutanate (PCI). Terapia antiagregantă duală, care presupune administrarea unei combinaţii dintre acidul acetilsalicilic şi un antagonist al receptorului plachetar P2Y12, cel mai frecvent clopidogrel, şi-a demonstrat, în numeroase studii, eficacitatea în prevenţia secundară a evenimentelor cardiovasculare majore. Cu toate acestea, se atestă un răspuns variabil la tratamentul antiagregant, cu dezvoltarea complicaţiilor atât hemoragice, cât şi trombotice(8,15,38).
Termeni precum reactivitate trombocitară înaltă la tratament (HPR), absenţa de răspuns şi rezistenţă la antiagregante au fost folosiţi în studii, recenzii şi metaanalize pentru a descrie un scenariu clinic în care clopidogrelul şi/sau acidul acetilsalicilic nu realizează efectul antitrombotic dorit, în pofida dozării adecvate, soldat cu evenimente ischemice (tromboză de stent, infarct miocardic). Incidenţa fenomenului de rezistenţă la antiagregante este dificil de interpretat, din cauza lipsei unei definiţii unanim acceptate a acesteia. Studiile sugerează că incidenţa rezistenţei la clopidogrel variază între 16% şi 65%, iar aproximativ 20-30% dintre pacienţi sunt rezistenţi la terapia cu acidul acetilsalicilic(7,14,17).
Scopul acestui studiu a constat în evidenţierea şi descrierea cauzelor variabilităţii interindividuale la tratamentul cu antiagregante (genetice, nongenetice), precum şi elaborarea unui management optim de conduită în caz de dezvoltare a rezistenţei la tratament, care reprezintă un pas important pentru prevenirea complicaţiilor aterotrombotice şi hemoragice.
Materiale şi metodă
S-au efectuat o selectare şi o analiză a surselor bibliografice din PubMed referitoare la incidenţa, cauzele şi mecanismele rezistenţei, în vederea elaborării managementului optim de depăşire a rezistenţei la clopidogrel şi acid acetilsalicilic.
Clopidogrel
Proprietăţi farmacocinetice şi farmacodinamice
Clopidogrelul este un promedicament inactiv care se absoarbe din intestin prin intermediul glicoproteinei P (gp-P), codificată de gena ABCB1. Rata de absorbţie gastrointestinală a clopidogrelului poate varia de la o persoană la alta, afectând astfel debutul răspunsului. Nivelul de expresie al gp-P poate afecta permeabilitatea şi, astfel, poate modifica biodisponibilitatea orală a clopidogrelului. Medicamentul se absoarbe circa 50%, dar 85% din acesta este hidrolizat de carboxilesteraza 1 (CES1) şi transformat în forme inactive (acid carboxilic), în timp ce doar 15 procente vor fi accesibile pentru transformarea în metabolitul activ. Promedicamentul este convertit în forma sa activă în ficat, de către sistemul enzimatic al citocromului P450, prin două procese oxidative consecutive, cu implicarea a numeroase izoenzime CYP. Iniţial, izoformele CYP2C19, CYP2B6 şi CYP1A2 transformă clopidogrelul în 2-oxo-clopidogrel, iar apoi izoformele CYP3A4, CYP3A5, CYP2B6, CYP2C9, CYP2C19 şi enzima paraoxonaza-1 (PON1), în metabolitul său activ. Concomitent, circa 50% din 2-oxo-clopidogrel poate fi metabolizat de CES1 în compus inactiv. Metabolitul activ clopidogrel tiol (R130964) inhibă activarea şi agregarea trombocitelor, mediată de adenozin difosfat (ADP), pe durata vieţii lor de şapte-zece zile. După administrarea orală şi intravenoasă de clopidogrel, acţiunea antiagregantă se dezvoltă în două ore. După administrarea zilnică a 75 mg de clopidogrel, starea de echilibru se atinge peste trei-şapte zile, cu un nivel mediu de inhibiţie trombocitară de 40-60%. Agregarea trombocitară şi timpul de sângerare după suspendarea tratamentului revin treptat la valorile iniţiale în decurs de cinci zile(22,27,30,33,36,38).
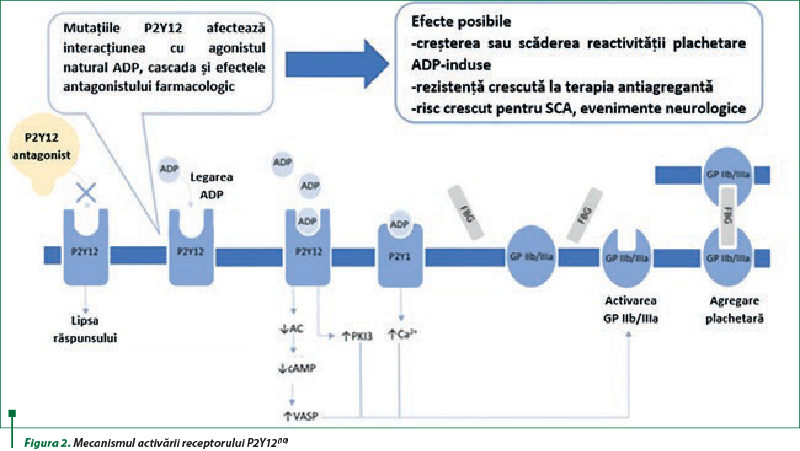
Metabolitul activ al clopidogrelului îşi exercită efectul farmacodinamic prin blocarea ireversibilă a receptorilor purinergici. La nivelul trombocitului au fost descrise trei tipuri de receptori ADP: P2X1, un canal cationic cuplat cu receptorul responsabil pentru influxul de calciu; receptorul P2Y1 cuplat cu proteina Gq, care este responsabil pentru modificarea formei trombocitelor, activarea fosfolipazei C şi eliberarea de calciu din depo; receptorul P2Y12 cuplat cu proteina Gi, care inhibă adenilatciclaza. Receptorul P2Y12 al trombocitelor a fost identificat ca ţintă pentru tienopiridine precum clopidogrelul. Toate trei tipurile de receptori adenozinici sunt implicaţi în agregarea completă a trombocitelor indusă de ADP. Afectarea funcţiei receptorului P2Y12, la un pacient cu deficit congenital de P2Y12, determină o agregare trombocitară rapidă şi reversibilă. Receptorul P2Y12 (spre deosebire de P2Y1) nu este desensibilizat rapid după expunerea la ADP, dar rămâne activ pe o perioadă mai lungă, menţinând astfel niveluri reduse de AMPc, mediator intracelular important pentru inhibarea agregării plachetare. Clopidogrelul, prin blocarea ireversibilă a receptorului P2Y12, previne degranularea trombocitelor şi inhibă acţiunea/funcţia receptorului glicoproteinei IIb/IIIa (GP IIb/IIIa), care este responsabil de legarea fibrinogenului şi agregarea trombocitelor. Unii agonişti fiziologici, precum tromboxanul A2, trombina, colagenul sau serotonina, contribuie, de asemenea, la activarea trombocitelor. Astfel, orice factor care influenţează activarea trombocitelor ar trebui să fie luat în considerare la evaluarea răspunsului la tratament şi a rezistenţei la clopidogrel(15,31,38).
Mecanisme şi factori care influenţează rezistenţa la clopidogrel
În baza analizei particularităţilor farmacocinetice şi farmacodinamice ale clopidogrelului, au fost identificaţi anumiţi factori genetici şi nongenetici care ar putea explica variabilitatea răspunsului interindividual la preparat.
Variabilitate genetică
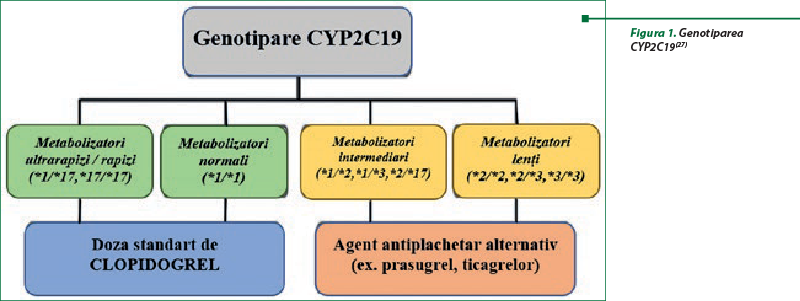
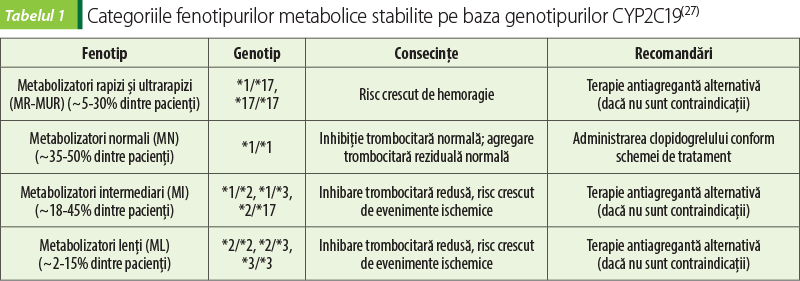
Polimorfismele genetice pot influenţa răspunsul la clopidogrel prin dereglarea procesului de absorbţie şi metabolism. Supraexprimarea genei ABCB1, responsabilă de producerea gp-P, s-a dovedit a fi asociată cu scăderea nivelului metabolitului activ al clopidogrelului şi creşterea reactivităţii plachetare în timpul tratamentului. La nivelul metabolismului, CYP2C19 este cea mai importantă enzimă implicată în ambele etape metabolice de activare a clopidogrelului. Polimorfismul CYP2C19, cu cel puţin 25 de variante de alele, este cel mai important şi mai studiat mecanism al rezistenţei la clopidogrel. Pacienţii, în funcţie de genotipul CYP2C19, sunt clasificaţi în diferite fenotipuri: metabolizatori lenţi (ML), cu două alele nefuncţionale (CYP2C19 *2/*2, *2/*3 sau *3/*3); metabolizatori intermediari (MI), cu o alelă nefuncţională şi o alelă cu funcţie normală sau cu o singură alelă nefuncţională şi o alelă cu funcţie crescută (CYP2C19 *1/*2, *1/*3 sau *2/*17); metabolizatori normali (MN), subiecţi cu două alele cu funcţie normală (CYP2C19 *1/*1); metabolizatori rapizi (MR), cu o alelă normală şi una cu funcţie crescută (CYP2C19 *1/*17) şi metabolizatori ultrarapizi (MUR), cu două alele cu funcţie crescută (CYP2C19 *17/*17) (tabelul 1, figura 1). Fenotipurile CYP2C19 ML-MI au fost asociate cu un răspuns scăzut la clopidogrel, deoarece, din cauza enzimelor cu activitate redusă/absentă, scade nivelul metabolitului activ. În consecinţă, aceşti pacienţi prezintă o eficacitate diminuată şi un risc mai mare de dezvoltare a trombozelor. Concomitent, prezenţa alelei *17 cu funcţie crescută determină creşterea nivelului de metabolit activ, care prezintă un risc mai mare de hemoragie din cauza inhibării trombocitelor şi a răspunsului crescut/exagerat la antiagregantul plachetar. Pacienţii cu fenotipurile MN şi MR-MU pot administra doze standard de clopidogrel, iar pentru pacienţii ML şi MI se recomandă terapie antiplachetară alternativă cu prasugrel sau ticagrelor
(tabelul 1, figura 1)(14,22,27,28,38).
Acţiune farmacodinamică
Polimorfismele genetice ale receptorului P2Y12 pot fi responsabile pentru modificări în structura receptorului, cu diminuarea eficacităţii terapiei antiplachetare (figura 2)(10).
Comorbidităţi
Prezenţa unei afecţiuni asociate, precum diabetul zaharat de tip 2 sau boala cronică de rinichi, poate determina un rezultat terapeutic slab. Diabetul zaharat (DZ) este considerat cel mai relevant indicator independent al rezistenţei la clopidogrel, concomitent cu statutul de purtător CYP2C19*2 al pacientului. Studiile au arătat că, la pacienţii cu DZ, nivelul metabolitului activ al clopidogrelului şi expunerea sistemică la medicament erau scăzute, deoarece DZ poate determina o suprimare semnificativă a capacităţii catalitice a CYP2C19, modificarea răspunsului plachetar fiind secundară. Glicarea proteică prelungită ca urmare a hiperglicemiei ar putea reduce biotransformarea clopidogrelului şi sensibilitatea receptorilor săi, cu lipsa răspunsului sau cu răspuns diminuat. Durata şi severitatea DZ au roluri semnificative în modificarea efectului antiagregant. Deşi mecanismul exact este încă neclar, mai mulţi factori, precum disfuncţia endotelială, hipercoagulabilitatea, afectarea fibrinolizei şi hiperreactivitatea trombocitară, pot contribui la complicaţiile protrombotice la pacienţii cu DZ(5,15,34,35).
Boala cronică de rinichi (BCR) a fost raportată la circa 30-50% dintre pacienţii cu SCA, care au prezentat un efect antiagregant redus la administrarea clopidogrelului ca urmare a reactivităţii plachetare crescute la aceşti bolnavi. S-a constatat asocierea dintre afectarea renală şi riscul de evenimente cardiace, cu deces după PCI. Boala cronică de rinichi, asociată cu comorbidităţi precum hipertensiunea arterială, DZ şi dislipidemia, poate determina dereglarea homeostaziei calciului şi fosforului, cu agravarea ulterioară a aterosclerozei coronariane. Concomitent, pacienţii cu BCR, în special în formă avansată, prezintă un risc mai mare de evenimente ischemice şi hemoragice din cauza disfuncţiei trombocitelor, inflamaţiei şi a stresului oxidativ declanşat de disfuncţia endotelială(5,12,25).
Interacţiuni medicamentoase
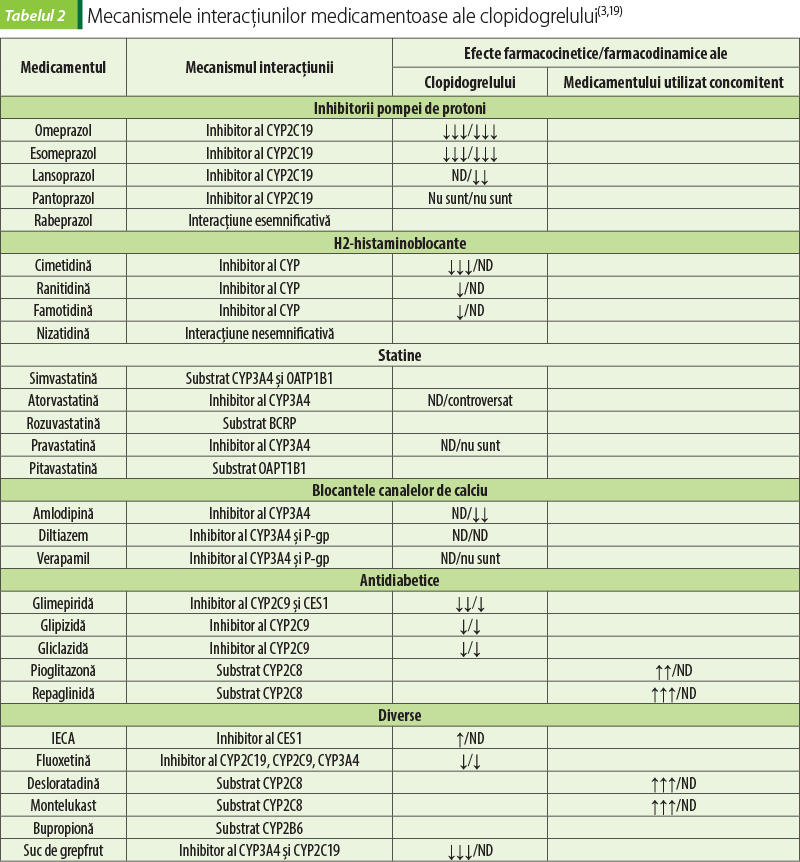
Mecanismele potenţiale ale interacţiunilor medicamentoase de tip farmacocinetic pot fi determinate de utilizarea medicamentelor: 1) care inhibă CYP2C19 şi CYP3A4, cu blocarea formării metabolitului activ al clopidogrelului; 2) care cresc activitatea CYP2C19 şi nivelul metabolitului activ al clopidogrelului; 3) care inhibă P-gp, cu reducerea efluxului şi creşterea absorbţiei clopidogrelului; 4) care concurează cu receptorul P2Y12, locul de legare pentru metabolitul activ al clopidogrelului(3,19).
Inhibitorii pompei de protoni (IPP) sunt promedicamente transformate în sulfenamidă, metabolitul lor activ, în mediul acid al stomacului. Izoenzimele CYP2C19 şi CYP3A4 sunt implicate în conversia IPP în metaboliţi inactivi. Gradul de interacţiune medicamentoasă cu clopidogrel variază în funcţie de potenţa inhibitorie a CYP2C19 de IPP (omeprazol > esomeprazol > lansoprazol > dexlansoprazol > rabeprazol > pantoprazol). Antagoniştii H2- histaminoreceptorilor (cimetidina, ranitidina, famotidina, nizatidina) sunt metabolizaţi în ficat şi sunt consideraţi inhibitori ai CYP; îndeosebi cimetidina ar putea determina interacţiuni cu clopidogrelul, dar semnificaţia clinică este incertă. Statinele, cu excepţia pravastatinei şi a pitavastatinei, sunt metabolizate predominant de izoenzimele CYP hepatice: CYP3A4 pentru atorvastatină, lovastatină şi simvastatină. Astfel, statinele metabolizate de CYP3A4 au potenţialul de a reduce efectele antiplachetare ale clopidogrelului ca urmare a interferenţei cu activitatea enzimei CYP3A4. Concomitent, clopidogrelul poate inhiba metabolismul statinei prin CYP2C8, CYP3A4 şi OATP1B1, cu creşterea concentraţiilor plasmatice ale statinelor şi a efectelor adverse, precum rabdomioliza. Există multe interacţiuni farmacodinamice clopidogrel-medicament, dar nu există dovezi consistente că aceste interacţiuni au semnificaţie clinică (tabelul 2)(3,19).
Acid acetilsalicilic
Particularităţi farmacocinetice şi farmacodinamice
Variabilitatea interindividuală a răspunsului la acidul acetilsalicilic poate fi determinată de mecanismul efectului antiagregant cauzat de blocarea selectivă a ciclooxigenazei (COX-1) trombocitare, inhibând astfel sinteza TxA2, substanţă proagregantă, vasoconstrictoare. Trombocitele, fiind celule anucleate, sunt incapabile să sintetizeze de novo enzima COX-1, iar efectul se menţine pe parcursul vieţii trombocitului (şapte-zece zile). Dezvoltarea rezistenţei sau nonrăspunsul la acidul acetilsalicilic constituie o problemă majoră, care necesită o abordare complexă. O singură doză de 100 mg de acid acetilsalicilic administrată la voluntari sănătoşi a arătat o inhibare completă a agregării trombocitelor induse de acidul arahidonic la 40 de minute, iar timpul stării de echilibru este de o zi. În acest context, este indicată o doză de încărcare de 250-300 mg, urmată de o doză zilnică de întreţinere de 75-100 mg, conform recomandărilor Societăţii Europene de Cardiologie (ESC), sau 81-325 mg, conform recomandărilor Colegiului American de Cardiologie(16,29).
Acidul acetilsalicilic are o biodisponibilitate de 40-50% datorită unei hidrolize presistemice substanţiale, cu transformarea esterazelor plasmatice şi endoteliale în metabolitul activ, acidul salicilic. Circulaţia portală este ţinta principală în care are loc inhibarea COX-1 trombocitară, aşa cum s-a demonstrat prin scăderea nivelului seric de TxB2, înainte de detectarea acidului acetilsalicilic în circulaţia sistemică. Capacitatea acidului acetilsalicilic de a inhiba COX-1 în megacariocite are ca rezultat intrarea în circulaţie a trombocitelor cu COX-1 deja inhibată(13).
Asociaţia Americană a Inimii şi Societatea de Chirurgie Vasculară recomandă o doză zilnică de acid acetilsalicilic între 81 şi 325 mg, cu scop de prevenire secundară a evenimentelor adverse, precum infarctul miocardic, accidentul cerebrovascular şi decesul cardiovascular. Deşi clopidogrelul şi alte antiagregante au demonstrat o eficacitate similară sau chiar superioară, acidul acetilsalicilic rămâne totuşi terapia antiagregantă de primă linie pentru această populaţie de pacienţi. Concomitent, s-a constatat o incidenţă de circa trei ori mai mare a riscului de evenimente cardiovasculare adverse ca urmare a fenomenului de rezistenţă la acidul acetilsalicilic. Acesta implică două definiţii largi: 1) o „rezistenţă clinică”, în care doza standard de acid acetilsalicilic nu previne evenimentele cardiovasculare adverse recurente; 2) o „rezistenţă de laborator”, în care doza standard de antiagregant nu produce efectul aşteptat, evaluat prin testele funcţionale plachetare, precum creşterea timpului de sângerare, reducerea sintezei TxA2 sau inhibarea agregării trombocitelor(17).
Anumiţi factori şi unele cauze pot determina un răspuns variabil la tratamentul cu acid acetilsalicilic, iar elucidarea lor ar permite abordarea personalizată a pacientului, cu evitarea complicaţiilor tratamentului medicamentos.
Biodisponibilitate redusă
Există factori care determină biodisponibilitatea redusă şi răspunsul variabil la acidul acetilsalicilic. Cercetările au demonstrat că o complianţă scăzută, o administrare neregulată şi a dozelor mici pot fi asociate cu un răspuns redus la acidul acetilsalicilic. Absorbţia acidului acetilsalicilic va avea loc la un pH < 3,5, când preparatul va fi în stare nedisociată, adică în mediul acid al stomacului şi al duodenului proximal. Absorbţia acidului acetilsalicilic va fi afectată la un pH de peste 3,5 şi la administrarea concomitentă cu IPP sau a comprimatelor enterosolubile, cu atingerea concentraţiilor subterapeutice de acid acetilsalicilic în circulaţia portală(9).
Comorbidităţi
Anumite comorbidităţi sunt asociate cu un răspuns biologic scăzut al trombocitelor la terapia antiagregantă cu acid acetilsalicilic. Glicarea avansată a proteinelor din trombocite la pacienţii cu DZ determină scăderea sensibilităţii trombocitelor la acidul acetilsalicilic. Există, de asemenea, o acţiune competitivă a glucozei şi acidului acetilsalicilic în procesele de glicozilare şi acetilare neenzimatică. Hiperglicemia este o cauză a formării de microagregate spontane în trombocite, care ar putea fi asociată cu dezvoltarea rezistenţei la acidul acetilsalicilic(35).
Hiperlipidemia este un alt factor care ar putea modifica răspunsul trombocitelor la acid acetilsalicilic. Cercetătorii au estimat că creşterea conţinutului de colesterol în compoziţia membranei lipidice a trombocitelor este asociată cu o sensibilitate mai mare a acestora la agonişti şi cu un metabolism crescut al acidului arahidonic. În dislipidemie, interacţiunile diadei imunomodulatoare CD40/CD40L cresc proprietăţile protrombotice ale trombocitelor şi reduc eficacitatea medicamentului antiagregant. Obezitatea reduce, de asemenea, răspunsul la acidul acetilsalicilic, ca urmare a creşterii leptinei şi a hipercoagulabilităţii induse secundar şi a nivelurilor scăzute de concentraţie din cauza distribuţiei medicamentului. Creşterea peroxidării lipidice determină activarea trombocitelor în procesele care ocolesc calea clasică legată de acetilarea ciclooxigenazei-1(35).
Insuficienţa renală cronică este asociată cu un răspuns biologic scăzut la acidul acetilsalicilic. Studiile au raportat nu numai o frecvenţă mai mare a reactivităţii trombocitelor la acidul acetilsalicilic în rândul subiecţilor cu insuficienţă renală cronică, dar şi o corelaţie semnificativă între un răspuns biologic scăzut la acidul acetilsalicilic şi severitatea bolii renale cronice. Acest lucru se poate datora metabolismului modificat al prostaglandinelor, concentraţiei crescute a factorului von Willebrand sau exprimării crescute a complexului glicoproteic IIb/IIIa în insuficienţa renală(35).
Interacţiuni medicamentoase
Anumite interacţiuni medicamentoase pot fi asociate cu niveluri mai mari de TxB2 (metabolit stabil al TxA2 în ser) şi agregarea trombocitară reziduală. Acestea se constată la asocierea acidului acetilsalicilic cu un antiinflamator nesteroidian (AINS), din cauza inhibării competitive a accesului la locul de acetilare al COX-1 trombocitare. Ibuprofenul şi naproxenul au cea mai mare afinitate in vitro pentru COX-1, prin urmare aceste medicamente trebuie administrate la câteva ore după acidul acetilsalicilic. Inhibitorii pompei de protoni afectează rata de absorbţie a acidului salicilic prin creşterea pH-ului peste nivelul constantei de disociere (3,5), ca urmare a reducerii lipofilităţii acidului salicilic şi a creşterii formei ionizate(16,20).
Acidul acetilsalicilic este un substrat pentru transportorul unidirecţional al anionului organic, cunoscut sub denumirea de proteină multimedicamentoasă rezistentă 4 (MRP4), care poate expulza acidul acetilsalicilic din trombocite. Efectul acidului acetilsalicilic asupra COX-1 la indivizii sănătoşi este puţin legat de transportul mediat de MRP4, iar o expresie mai mare a MRP4 poate fi constatată la pacienţii cu boli cardiovasculare, probabil datorită modulării genomice a megacariocitelor, indusă de tratamentul cu antiagregant. Inhibarea MRP4 prin administrarea de dipiridamol a crescut eficient acţiunea acidului acetilsalicilic la aceşti pacienţi(16).
Polimorfisme genetice
Rezistenţa la acidul acetilsalicilic a fost asociată cu mai multe variante genetice, dar cel mai frecvent studiată este PlA1/A2 a genei glicoproteinei IIIa (GPIIIa), care codifică receptorul de fibrinogen şi factorul von Willebrand. O metaanaliză care a evaluat efectul polimorfismelor PlA1/A2 asupra rezistenţei de laborator la acidul acetilsalicilic a arătat că nu a existat nicio diferenţă în riscul de deces, de infarct miocardic (IM) sau de revascularizare a vasului-ţintă între purtătorii P1A1/A2 faţă de cei care nu sunt purtători. Aceste rezultate sunt în concordanţă cu o altă metaanaliză, care a arătat că purtătorii sănătoşi de alele P1A1/A2 erau mai susceptibili de a fi rezistenţi la acidul acetilsalicilic, dar acest efect a fost absent în rândul persoanelor cu boli cardiovasculare. Enzimele COX sunt responsabile pentru formarea prostaglandinelor, prostaciclinei şi tromboxanului. Unele studii sugerează că variabilitatea răspunsului la acidul acetilsalicilic se poate datora variantelor genetice ale COX-1, deoarece acestea influenţează funcţia trombocitelor şi răspunsul la acidul acetilsalicilic(20,26).
Variaţiile genotipului COX-1 (polimorfisme cu un singur nucleotid) pot duce la modificări ale centrului activ, care ar putea bloca în mod eficient acetilarea acidului acetilsalicilic, determinând eşecul medicamentului. Polimorfismele COX-2, asociate cu hiperexpresia izoformelor, care nu sunt sensibile la acidul acetilsalicilic, sunt, de asemenea, cauze ale unui răspuns scăzut la agentul antiplachetar. Alte polimorfisme de un singur nucleotid care pot reduce efectul terapeutic al acidului acetilsalicilic sunt asociate cu: receptorul tromboxanului A2; gena factorului von Willebrand, glicoproteina; genele Ia/IIa, IIa/IIIb sau VI; genele P2RY1 sau P2RY12(35).
Managementul rezistenţei la clopidogrel şi acid acetilsalicilic
Managementul rezistenţei poate fi realizat prin: creşterea dozei; utilizarea terapiei antiagregante alternative; terapia antiagregantă combinată; evitarea interacţiunilor medicamentoase; monitorizarea testelor de laborator.
Creşterea dozei
Clopidogrel
Farmacocinetica clopidogrelului este liniară (concentraţiile plasmatice cresc proporţional cu doza) şi se administrează în doze de 50-150 mg/zi. Concentraţiile de echilibru sunt atinse la trei-cinci zile după administrarea unei doze zilnice de 75 mg de clopidogrel, ceea ce limitează utilizarea acestuia în situaţii acute. Cu toate acestea, eficacitatea sa clinică poate fi îmbunătăţită prin utilizarea unei doze orale de încărcare de 300 mg, care îşi atinge efectul antiplachetar maxim în 24 de ore, sau a unei doze de încărcare de 600 mg, care îşi realizează efectul antiplachetar maxim în patru ore(31).
Variabilitatea interindividuală a răspunsului la clopidogrel impune, de fapt, utilizarea terapiilor alternative. Totuşi, unii pacienţi necesită administrarea în continuare a clopidogrelului, din cauza costului, a contraindicaţiilor şi a reacţiilor adverse ale terapiei alternative. Astfel, este important de stabilit dacă creşterea dozei (150 mg sau 225 mg/zi) ar putea asigura beneficiul clinic dorit/aşteptat. Studiile privind această problemă sunt controversate. În multe studii s-a observat o creştere dependentă de doză a efectului antiagregant, iar această abordare poate fi eficientă în combaterea hiperreactivităţii trombocitelor şi rezistenţei la clopidogrel. Cu toate acestea, rezultatele clinice nu au arătat că aceasta ar putea reduce incidenţa evenimentelor cardiovasculare adverse majore. Astfel, datele au arătat doar eficacitatea bazată pe datele de laborator, iar eficacitatea clinică nu a fost demonstrată(11,14).
Studiul clinic de scară largă GRAVITAS (Gauging Responsiveness with A Verify Now assay – Impact on Thrombosis And Safety), privind ajustarea terapiei antiagregante la pacienţii cu rezistenţă la clopidogrel, nu a arătat nicio superioritate a dozei de 150 mg faţă de 75 mg. Studiile care au analizat tactica de utilizare a dozelor de încărcare au demonstrat că o doză de 600 mg de clopidogrel a determinat o inhibare mai rapidă şi mai stabilă a funcţiei trombocitelor şi o incidenţă mai mică a rezistenţei la clopidogrel în comparaţie cu doza de 300 mg. Valorile maxime ale markerilor serici (troponina I, CK-MB, mioglobina, PCR) au fost semnificativ mai mici la pacienţii trataţi cu regimul de 600 mg, fără o creştere a riscurilor de hemoragie. Doza de încărcare de 900 mg nu s-a dovedit însă a fi mai benefică decât cea de 600 mg(3,24).
Acidul acetilsalicilic
Creşterea complianţei pacientului sau creşterea dozelor de acid acetilsalicilic de la 75 la 150 mg sau la 300 mg/zi poate avea un efect pozitiv în reducerea fenomenului de rezistenţă. Particularităţile acidului acetilsalicilic (timpul scurt de înjumătăţire) şi a turnoverului trombocitelor (durată mai lungă a vieţii) la unele categorii de pacienţi (DZ etc.) pot determina ca o proporţie semnificativă de plachete să evite inhibarea de către acidul acetilsalicilic, administrat o dată pe zi. În aceste situaţii o opţiune ar fi administrarea antiagregantului de două ori pe zi(16,35).
Utilizarea terapiei antiagregante alternative
Variabilitatea răspunsului la clopidogrel, determinat de factorii genetici, în special polimorfismul CYP2C19, au necesitat utilizarea în calitate de terapie alternativă a ticagrelorului sau a prasugrelului (figura 3)(4,11).
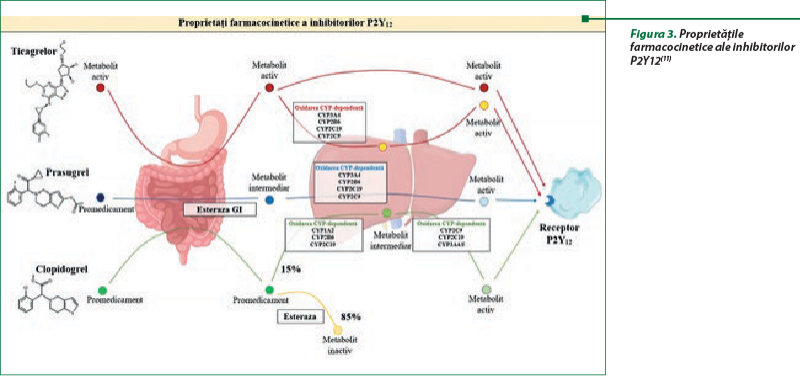
Prasugrelul reprezintă un antiagregant mai puternic care blochează receptorii P2Y12 şi acţiunea sa nu este afectată de polimorfismele CYP2C19. Mai multe studii au evidenţiat reducerea semnificativă a rezistenţei la administrarea unei doze zilnice de prasugrel, comparativ cu 150 mg de clopidogrel(14).
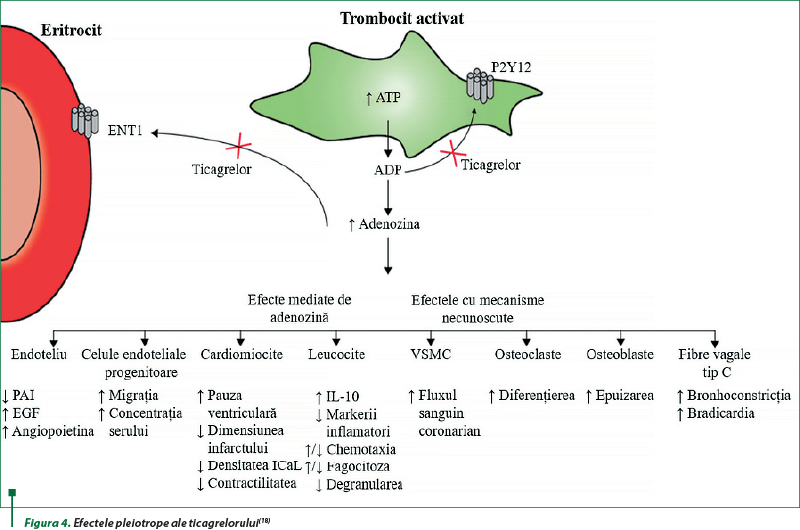
Ticagrelorul reprezintă o nouă clasă de antiagregante, care blochează receptorii plachetari P2Y12 şi, de asemenea, inhibă recaptarea celulară a adenozinei prin inhibarea transportorului nucleozidic echilibrat 1 (ENT1). Preparatul, prin inhibarea recaptării adenozinei, creşte nivelul plasmatic al acesteia la pacienţii cu sindrom coronarian acut (SCA), cu ameliorarea fluxului sangvin coronarian. Aceste mecanisme determină unele efecte pleiotrope benefice ale ticagrelorului (figura 4)(2,14,18,37).
Utilizarea prasugrelului şi a ticagrelorului a redus evenimentele trombotice mai pronunţat decât clopidogrelul la pacienţii cu insuficienţă coronariană acută, dar a fost asociată şi cu un risc mai mare de hemoragie. Concomitent, costul ridicat al preparatelor poate afecta complianţa pacientului la terapia de durată(11).
Terapia antiagregantă combinată
Trombina este un agonist important pentru activarea trombocitelor. În SCA se constată un nivel crescut de trombină, iar blocarea efectului trombinei constituie o strategie importantă pentru reducerea evenimentelor cardiovasculare la pacienţii cărora li se administrează terapia antiagregantă dublă. Există două abordări: modularea indirectă a efectelor trombinei prin blocarea receptorilor 1 activaţi de protează (PAR-1) şi inhibarea directă a trombinei şi a altor factori în cascada coagulării. Vorapaxarul reprezintă un antagonist pentru receptorul PAR-1, care blochează eficient activarea trombocitelor indusă de trombină. Studiile clinice au demonstrat că vorapaxarul reduce riscul de evenimente cardiovasculare la persoanele cu boală arterială periferică sau infarct miocardic, utilizat în monoterapie sau combinat cu tratamentul antiagregant standard.
Concomitent, vorapaxarul este asociat cu un risc ridicat de hemoragie, în special la persoanele cu un atac ischemic tranzitoriu anterior sau cu un accident vascular cerebral şi numeroase interacţiuni medicamentoase farmacocinetice(32).
S-a demonstrat că rivaroxabanul, în doză de 2,5 mg de două ori/zi, la pacienţii cu fibrilaţie atrială şi funcţie renală normală, reduce evenimentele ischemice şi decesul cardiovascular la cei trataţi cu acid acetilsalicilic şi clopidogrel după SCA. Siguranţa şi eficacitatea asocierii rivaroxabanului cu ticagrelor sau prasugrel nu a fost studiată, fapt care a împiedicat recomandarea acestei strategii ca terapie de primă linie la pacienţii cu SCA(23).
Studiile in vitro au demonstrat că asocierea rivaroxabanului şi acidului acetilsalicilic s-a dovedit superioară comparativ cu monoterapia acestora. Adăugarea de rivaroxaban în doză mică (2,5 mg) ex vivo a determinat diminuarea rezistenţei la acidul acetilsalicilic cu 58% la pacienţii testaţi. Un studiu recent a demonstrat că suplimentarea a 2,5 mg de rivaroxaban la terapia zilnică cu acid acetilsalicilic a redus semnificativ riscul de evenimente cardiovasculare adverse recurente la pacienţii cu boală cardiovasculară stabilă. Concomitent, s-a constatat existenţa unui risc crescut de hemoragie majoră la pacienţii cu terapie dublă(17,23).
Evitarea interacţiunilor medicamentoase
Beneficiul terapeutic al administrării concomitente a medicamentelor ar trebui să depăşească riscul, fie şi teoretic, al interacţiunilor uşoare ale clopidogrelului şi acidului acetilsalicilic cu alte medicamente, care sunt în funcţie de doză, de timp, în comparaţie cu provocările mai mari ale complianţei pacientului şi variabilităţii interindividuale a răspunsului(6,21).
Monitorizarea testelor de laborator
În acest context, se impune monitorizarea testelor genetice, deoarece polimorfismele genetice joacă un rol semnificativ în farmacocinetica, farmacodinamia şi eficacitatea clinică a clopidogrelului. Screeningul genetic poate fi utilizat pentru ghidarea terapiei antiagregante. Identificarea polimorfismelor genetice implicate în modificarea răspunsului la clopidogrel este importantă pentru schimbarea terapiei şi utilizarea antagoniştilor purinergici alternativi. Concomitent, se recomandă monitorizarea testelor funcţionale pentru depistarea rezistenţei la medicamentul antiagregant(1,29).
Concluzii
Rezistenţa la clopidogrel şi acid acetilsalicilic este determinată de proprietăţile farmacocinetice (biodisponibilitatea redusă, formarea metabolitului activ, timpul scurt de înjumătăţire), farmacodinamice (modificarea structurii şi sensibilităţii receptorilor, a inhibării enzimelor), de polimorfismele genetice (izoenzimelor citocromului P-450, transportorilor membranari, receptorilor), comorbidităţile pacienţilor (diabetul zaharat, maladiile cardiovasculare, afecţiunile renale etc.) şi de interacţiunile medicamentoase. Optimizarea managementului cu clopidogrel şi acid acetilsalicilic prevede creşterea dozelor, utilizarea terapiei antiagregante alternative, a terapiei antiagregante combinate, evitarea interacţiunilor medicamentoase şi monitorizarea testelor de laborator.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Al-Abcha A, Radwan Y, Blais D, Mazzaferri EL Jr, Boudoulas KD, Essa EM, Gumina RJ. Genotype-Guided Use of P2Y12 Inhibitors: A Review of Current State of the Art. Front Cardiovasc Med. 2022 Mar 23;9:850028. .
-
Alsharif KF, Thomas MR, Judge HM, Khan H, Prince LR, Sabroe I, Ridger VC, Storey RF. Ticagrelor potentiates adenosine-induced stimulation of neutrophil chemotaxis and phagocytosis. Vascul Pharmacol. 2015 Aug;71:201-7. .
-
Akkaif MA, Daud NAA, Sha’aban A, Ng ML, Abdul Kader MAS, Noor DAM, Ibrahim B. The Role of Genetic Polymorphism and Other Factors on Clopidogrel Resistance (CR) in an Asian Population with Coronary Heart Disease (CHD). Molecules. 2021 Apr 1;26(7):1987. .
-
Alexopoulos D, Dimitropoulos G, Davlouros P, Xanthopoulou I, Kassimis G, Stavrou EF, Hahalis G, Athanassiadou A. Prasugrel overcomes high on-clopidogrel platelet reactivity post-stenting more effectively than high-dose (150-mg) clopidogrel: the importance of CYP2C19*2 genotyping. JACC Cardiovasc Interv. 2011 Apr;4(4):403-10. .
-
Amin AM, Sheau Chin L, Azri Mohamed Noor D, Sk Abdul Kader MA, Kah Hay Y, Ibrahim B. The Personalization of Clopidogrel Antiplatelet Therapy: The Role of Integrative Pharmacogenetics and Pharmacometabolomics. Cardiol Res Pract. 2017;2017:8062796. 6.
-
Bates ER, Lau WC, Angiolillo DJ. Clopidogrel-drug interactions. J Am Coll Cardiol. 2011 Mar 15;57(11):1251-63. .
-
Berenson AM, Hawken TN, Fort DG, Money SR, Ramee SR, Sternbergh WC 3rd, Bazan HA. Clopidogrel resistance is common in patients undergoing vascular and coronary interventions. Vascular. 2023 Feb;31(1):58-63. .
-
Bonello L, Tantry US, Marcucci R, Blindt R, Angiolillo DJ, Becker R, Bhatt DL, Cattaneo M, Collet JP, Cuisset T, Gachet C, Montalescot G, Jennings LK, Kereiakes D, Sibbing D, Trenk D, Van Werkum JW, Paganelli F, Price MJ, Waksman R, Gurbel PA; Working Group on High On-Treatment Platelet Reactivity. Consensus and future directions on the definition of high on-treatment platelet reactivity to adenosine diphosphate. J Am Coll Cardiol. 2010 Sep 14;56(12):919-33. .
-
Bultas J. Antiplatelet therapy—A pharmacologist’s perspective. Cor et Vasa (English ed.). 2013;55:e86-e94.
-
Danielak D, Pawlak K, Główka F, Karaźniewicz-Łada M. Influence of Genetic and Epigenetic Factors of P2Y12 Receptor on the Safety and Efficacy of Antiplatelet Drugs. Cardiovasc Drugs Ther. 2022;10.1007/s10557-022-07370-8.
-
Ellithi M, Baye J, Wilke RA. CYP2C19 genotype-guided antiplatelet therapy: promises and pitfalls. Pharmacogenomics. 2020 Aug;21(12):889-897. .
-
Fischer MJ, Ho PM, McDermott K, Lowy E, Parikh CR. Chronic kidney disease is associated with adverse outcomes among elderly patients taking clopidogrel after hospitalization for acute coronary syndrome. BMC Nephrol. 2013 May 20;14:107. .
-
Floyd CN, Ferro A. Mechanisms of aspirin resistance. Pharmacol Ther. 2014 Jan;141(1):69-78. .
-
Guirgis M, Thompson P, Jansen S. Review of aspirin and clopidogrel resistance in peripheral arterial disease. J Vasc Surg. 2017 Nov;66(5):1576-1586. .
-
Jiang XL, Samant S, Lesko LJ, Schmidt S. Clinical pharmacokinetics and pharmacodynamics of clopidogrel. Clin Pharmacokinet. 2015 Feb;54(2):147-66. 6.
-
Jourdi G, Lordkipanidzé M, Philippe A, Bachelot-Loza C, Gaussem P. Current and Novel Antiplatelet Therapies for the Treatment of Cardiovascular Diseases. Int J Mol Sci. 2021 Dec 3;22(23):13079. .
-
Khan H, Kanny O, Syed MH, Qadura M. Aspirin Resistance in Vascular Disease: A Review Highlighting the Critical Need for Improved Point-of-Care Testing and Personalized Therapy. Int J Mol Sci. 2022 Sep 26;23(19):11317. .
-
Kubisa MJ, Jezewski MP, Gasecka A, Siller-Matula JM, Postuła M. Ticagrelor - toward more efficient platelet inhibition and beyond. Ther Clin Risk Manag. 2018 Jan 17;14:129-140. 9.
-
Lee CH, Franchi F, Angiolillo DJ. Clopidogrel drug interactions: a review of the evidence and clinical implications. Expert Opin Drug Metab Toxicol. 2020 Nov;16(11):1079-1096. .
-
Lukianeţ K, Pcelin I, Şişkin AN, et al. Resistance to Antiplatelet Agents: Mechanisms, Roles of Comorbidity and Other Clinical Factors. Kardiologia v Belarusi. 2021;13:815-826. .
-
Musallam KM, Charafeddine K, Bitar A, Khoury M, Assaad S, Beresian J, Alam S, Taher AT. Resistance to aspirin and clopidogrel therapy. Int J Lab Hematol. 2011 Feb;33(1):1-18. .
-
Parameshwara S, Manjula B, Bhaktha G, et al. Clopidogrel resistance in cardiovascular disease patients and its association with gene polymorphisms: A pilot study. J Clin Prev Cardiol. 2021;10:80-4.
-
Patrono C, Morais J, Baigent C, Collet JP, Fitzgerald D, Halvorsen S, Rocca B, Siegbahn A, Storey RF, Vilahur G. Antiplatelet Agents for the Treatment and Prevention of Coronary Atherothrombosis. J Am Coll Cardiol. 2017 Oct 3;70(14):1760-1776. .
-
Ray S. Clopidogrel resistance: the way forward. Indian Heart J. 2014 Sep-Oct;66(5):530-4. 2.
-
Roh JW, Lee SJ, Kim BK, Hong SJ, Kim HY, Ahn CM, Cho DK, Kim JS, Ko YG, Choi D, Hong MK, Jang Y. Ticagrelor vs. Clopidogrel in Acute Coronary Syndrome Patients With Chronic Kidney Disease After New-Generation Drug-Eluting Stent Implantation. Front Cardiovasc Med. 2022 Jan 10;8:707722. 2.
-
Ross S, Krebs K, Paré G, Milani L. Pharmacogenomics in Stroke and Cardiovascular Disease: State of the Art. Stroke. 2023 Jan;54(1):270-278. 7.
-
Saiz-Rodríguez M, Abad-Santos F. Clopidogrel Pharmacogenetics in Patients Undergoing Percutaneous Neurointervention. J Neurobiol Physiol. 2020; 2(1):1-8.
-
Sheng XY, An HJ, He YY, Ye YF, Zhao JL, Li S. High-Dose Clopidogrel versus Ticagrelor in CYP2C19 intermediate or poor metabolizers after percutaneous coronary intervention: A Meta-Analysis of Randomized Trials. J Clin Pharm Ther. 2022 Aug;47(8):1112-1121. .
-
Shpigelman J, Proshkina A, Daly MJ, Cox D. Personalized Dual Antiplatelet Therapy in Acute Coronary Syndromes: Striking a Balance Between Bleeding and Thrombosis. Curr Cardiol Rep. 2023 Jul;25(7):693-710. .
-
Turgeon RD, Koshman SL, Youngson E, Har B, Wilton SB, James MT, Graham MM. Association of Ticagrelor vs Clopidogrel With Major Adverse Coronary Events in Patients With Acute Coronary Syndrome Undergoing Percutaneous Coronary Intervention. JAMA Intern Med. 2020 Mar 1;180(3):420-428. .
-
van Werkum JW, Heestermans AA, Deneer VH, Hackeng CM, Ten Berg JM. Clopidogrel resistance: fact and fiction. Future Cardiol. 2006 Mar;2(2):215-28. .
-
Virk HUH, Escobar J, Rodriguez M, Bates ER, Khalid U, Jneid H, Birnbaum Y, Levine GN, Smith SC Jr, Krittanawong C. Dual Antiplatelet Therapy: A Concise Review for Clinicians. Life (Basel). 2023 Jul 18;13(7):1580. .
-
Wessler JD, Grip LT, Mendell J, Giugliano RP. The P-glycoprotein transport system and cardiovascular drugs [published correction appears in J Am Coll Cardiol. 2014 May 27;63(20):2176. Dosage error in article text]. J Am Coll Cardiol. 2013;61(25):2495-2502.
-
Wiśniewski A, Filipska K. The Phenomenon of Clopidogrel High On-Treatment Platelet Reactivity in Ischemic Stroke Subjects: A Comprehensive Review. Int J Mol Sci. 2020 Sep 3;21(17):6408. .
-
Wiśniewski A. Multifactorial Background for a Low Biological Response to Antiplatelet Agents Used in Stroke Prevention. Medicina (Kaunas). 2021 Jan 10;57(1):59. .
-
Xu RJ, Kong WM, An XF, Zou JJ, Liu L, Liu XD. Physiologically-Based Pharmacokinetic-Pharmacodynamics Model Characterizing CYP2C19 Polymorphisms to Predict Clopidogrel Pharmacokinetics and Its Anti-Platelet Aggregation Effect Following Oral Administration to Coronary Artery Disease Patients With or Without Diabetes. Front Pharmacol. 2020 Dec 17;11:593982. .
-
Zhang X, Zhang X, Tong F, Cai Y, Zhang Y, Song H, Tian X, Yan C, Han Y. Gut microbiota induces high platelet response in patients with ST segment elevation myocardial infarction after ticagrelor treatment. Elife. 2022 Mar 8;11:e70240. .
-
Ma YT, Gao H, Zhao JZ, Zhao XT. Association between CYP2C19 and ABCB1 polymorphisms and clopidogrel resistance in clopidogrel-treated Chinese patients. Anatol J Cardiol. 2018 Feb;19(2):123-129.
Articole din ediţiile anterioare
Amidonul rezistent şi impactul asupra sindromului metabolic
Până la sfârşitul lui 1980 se credea că amidonul este digerat complet şi absorbit în intestinul subţire uman. Amidonul este cel mai răspândit poliz...
Obezitatea şi sistemul imunitar
Obezitatea este o problemă de sănătate publică, fiind recunoscută la ora actuală ca boală ce cauzează complicaţii grave precum diabetul zaharat, af...
Folosirea judicioasă a antibioticelor şi chimioterapicelor antibacteriene (II)
În alegerea antibioticelor utilizate în tratarea infecţiilor microbiene trebuie să se ţină seama de consideraţii legate de pacient, de microorganis...
Utilizarea raţională a antibioticelor
Antibioticele, în sensul larg la cuvântului, sunt medicamente care prezintă toxicitate selectivă faţă de anumite bacterii. Datorită acestei proprie...